【研究意义】走马胎(Ardisia gigantifolia)又名大叶紫金牛,为紫金牛科(Myrsinaceae)紫金牛属(Ardisia)多年生小灌木植物,其干燥根及根茎是我国传统中药材,药用历史悠久,具有很高的药用价值,是一种药用和观赏价值极高的野生植物,主要分布于广西、广东、江西和福建等地,具有很大的开发潜力[1-2]。走马胎味辛、性温,具有祛风湿、壮筋骨和活血祛痕的功效,广泛应用于跌打损伤、风湿骨痛、产后血痕和痈疽溃疡的治疗[3]。走马胎主要药用化学成分为三萜皂苷类、岩白菜素类、香豆素类、甾醇类和挥发油类等,其中三萜皂苷类和岩白菜素类在抗肿瘤、抗氧化、抗血栓等方面具有重要意义,也是目前研究的热点[4-5]。走马胎也是民间食疗的原材料,保健产品的开发不断扩展[6]。目前,市场上的走马胎主要来源于野生采挖,随着需求量的增大,导致货源紧缺,近年来市场上有用杜鹃花科和马鞭草科植物的根或茎加工混充[7-8]。而且,过度的采挖使野生资源日益缺乏、枯竭,所以急需开展走马胎的人工种植[6]。【前人研究进展】走马胎种群的分布、对光线的响应、合适的种植条件已有研究[6,9-10],但尚未见走马胎茎段繁育的报道,生产上以自然采摘的走马胎种子作为种源,多混杂,极易造成质量不稳定[6]。随着植物组织培养技术的普及,多种名贵中草药种苗已由植物工厂进行快速繁殖,如岗梅[11]、铁皮石斛[12-13]、牛大力[14]等。利用走马胎嫩叶为外植体,诱导出愈伤组织和不定芽分化途径的培养方法已成功[15],但利用茎段繁殖并开展工厂化生产走马胎种苗还未见报道。【本研究切入点】走马胎的种苗是限制其发展的根本原因,本研究对走马胎的茎段组织培养参数,外植体的消毒方法、增殖和生根培养基进行探索和优化,建立走马胎的离体培养与快速繁殖技术体系,为开展工厂化生产提供参,为人工种植提供了种苗基础缓解当前种苗不足的现状。【拟解决的关键问题】组培苗的工厂化生产影响因素主要是外植体的消毒、增殖效率和移栽成活率,获得这3个环节的最佳参数是走马胎组培苗生产的关键。
1 材料与方法
1.1 试验材料
2018年夏季在广东南雄选取生长健壮的野生走马胎植株,在广东省农作物遗传改良重点实验室培养。
1.2 试验方法
1.2.1 培养基与培养条件 (1)丛芽诱导与增殖培养基:在改良MS培养基(在原MS培养基中增加54.8 mg/L FeSO4·7H2O和8 mg/L抗坏血酸)中添加适量的6-BA、KT和IBA。(2)生根培养基:在1/2改良MS培养基中添加适量IBA及NAA。所有培养基附加蔗糖30 g/L、琼脂5.5 g/L,pH值调至5.8(±0.2),经121 ℃高压灭菌20 min。培养条件:温度28(±2)℃,光照度1 900~2 100 lx,光照时间14 h/d。
1.2.2 外植体消毒 选取健康的走马胎植株幼嫩的枝条作为外植体,将枝条切成单芽茎段,先用70%酒精浸泡30 s,用无菌水冲洗3次,每次1~3 min;再用含有吐温的0.1% HgCl2溶液处理5~11 min(设 5、7、9、11 min 4个处理),用无菌水洗涤3~5次,每次5 min。用无菌的滤纸上将茎段上的水吸干,得到消毒外植体备用。切除茎段的两端接触HgCl2溶液的部位,插入诱导培养基(改良MS+ 6-BA 0.5 mg/L +KT 0.5 mg/L +IBA 0.2 mg/L)中,每个消毒处理10个芽,培养15 d后统计污染率和萌芽率。
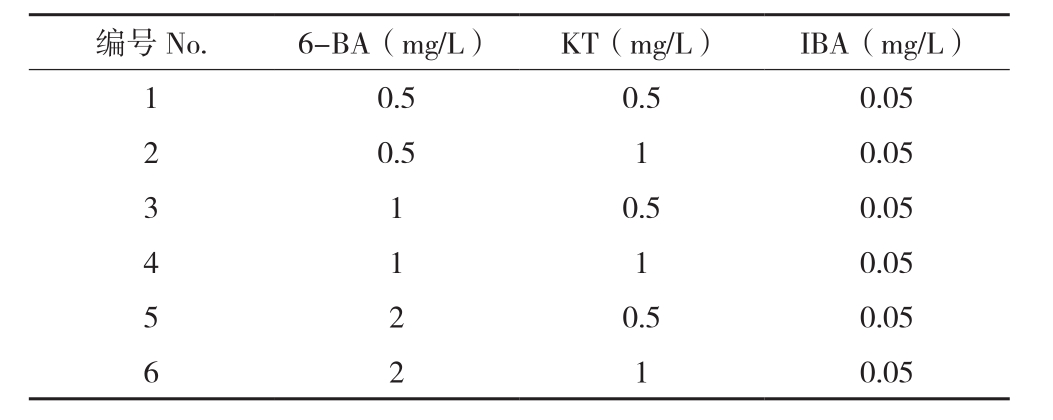
1.2.3 丛芽增殖 将走马胎不定芽从外植体上切下来,接种于含有不同激素浓度和种类的丛芽增殖培养基,用于继代增殖,其激素组合见表1,在继代培养基上培养20~25 d,得到走马胎的无菌丛苗。比较不同激素组合对走马胎丛芽增值的效果,统计10个芽的增殖情况。培养基以改良MS培养基为基础添加6-BA、KT和IBA。
表1 不定芽不同诱导激素组合
Table 1 Different hormones combination for adventitious bud induction
编号No.6-BA(mg/L) KT(mg/L) IBA(mg/L)1 0.5 0.5 0.05 2 0.5 1 0.05 3 1 0.5 0.05 4 0.05 5 2 0.5 0.05 1 1 6 2 1 0.05
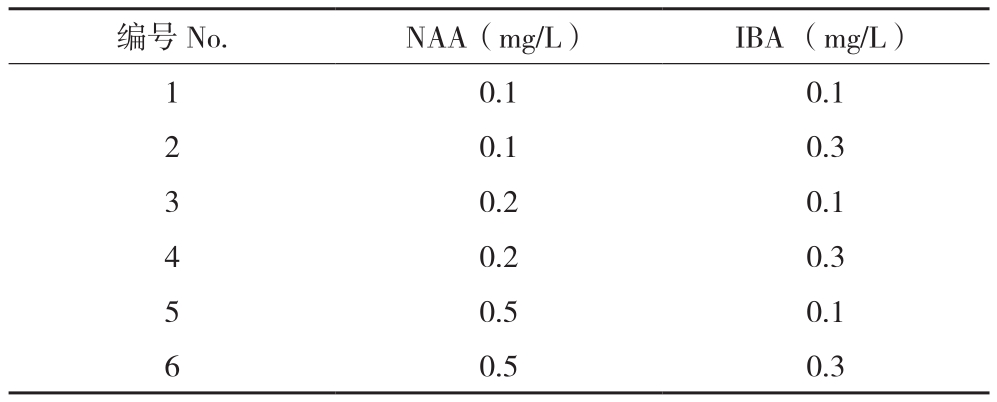
1.2.4 生根诱导 从增殖的丛芽上切下带有2~3个芽的茎段,插入生根培养基中,深度约0.5 cm左右。培养基以1/2改良MS为基础,添加不同浓度的NAA和IBA,浓度组合配制见表2。生根诱导培养40~50 d,统计20株的根数量和长度。
1.2.5 种植 取根长0.5 cm以上、苗高3 cm以上的走马胎再生植株进行炼苗、移栽。在室内炼苗培养3~7 d,再用自来水冲洗干净根部的培养基,0.1%多菌灵溶液中浸泡10 min,最后将苗种在消毒过的泥炭土中,保持环境湿度。
表2 根诱导激素配方
Table 2 Different hormones combinnation for rooting induction
编号 No.NAA(mg/L) IBA (mg/L)1 0.1 0.1 2 0.1 0.3 3 0.2 0.1 4 0.2 0.3 5 0.5 0.1 6 0.5 0.3
2 结果与分析
2.1 不同方法对外植体消毒效果
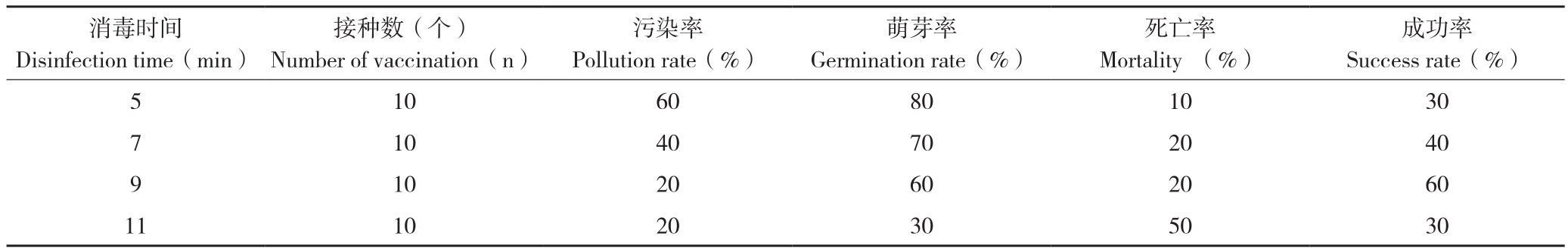
经过消毒处理后的走马胎茎段外植体在诱导培养基上培养7~10 d后,大部分腋芽逐渐开始恢复、出现萌动,少部分出现褐化,长出细菌和真菌,对污染率、萌芽率和死亡率进行统计,结果(表3)表明,走马胎外植体进行消毒处理5~10 min,均能获得无菌的外植体,但成功率有差异。真菌是主要的污染源,其分布在腋芽内而消毒液无法渗入,导致消毒不彻底[1]。随着消毒时间的延长,HgCl2溶液接触外植体的面积越大,消毒也越彻底,污染率略有下降,但其对外植体的伤害却迅速增加,主要表现在外植体中出现真菌的数量越来越少,但萌芽率逐渐降低,萌芽时间滞后,而且褐化、死亡率则不断上升。走马胎外植体污染率在20%~60%之间,其中消毒9和11 min 的污染率较低,为20%;消毒11 min对走马胎的毒害最为严重,萌芽率为30%,比处理10 min低100%;消毒时间7~9 min,获得无菌外植体的成功率可达到40%~60%,满足在生产上的需求。在本研究中处理1~4均能得无菌外植体,结合萌芽率和污染率等综合分析,70%酒精预处理30 s 结合0.1% HgCl2处理7~9 min的消毒方法比较合适走马胎外植体的消毒。
表3 不同方法对外植体消毒的效果
Table 3 Effect of explants disinfection by different methods
消毒时间Disinfection time(min)成功率Success rate(%)5 10 60 80 10 30 7 10 40 70 20 40 9 10 20 60 20 60 11 10 20 30 50 30接种数(个)Number of vaccination(n)污染率Pollution rate(%)萌芽率Germination rate(%)死亡率Mortality (%)
2.2 走马胎丛芽诱导与增殖效果
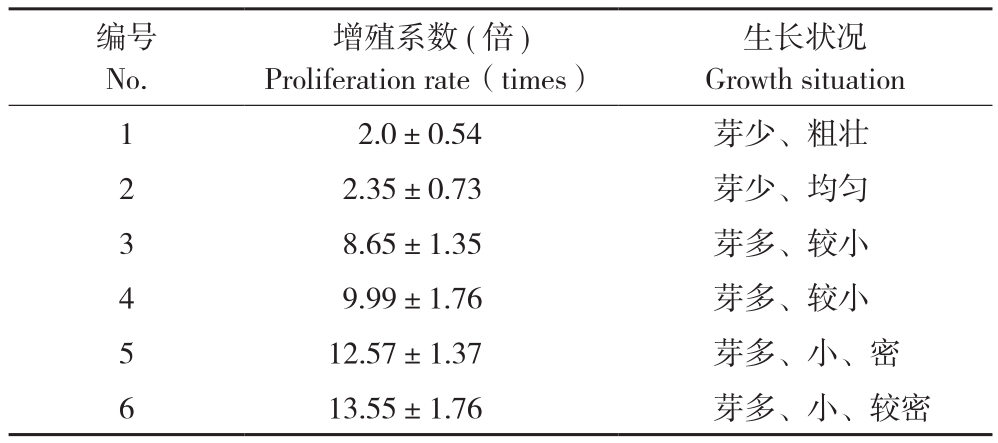
通过对丛生芽继代、增殖培养,能在短期内迅速提高种苗的数量,增值效率的高低决定种苗生产的成本,是进行组培苗工厂化育苗的关键。从表4、图1可以看出,6-BA、KT和IBA的激素组合都能诱导走马胎不定芽增殖,增殖效率与培养基中6-BA浓度正相关,随着浓度的升高,走马胎的增殖效率增加,在6-BA浓度2 mg/L时增殖系数达到12左右。但是此时组培苗的不定芽数目较多,导致过于密集和细弱,质量不高,不适合进行下一代的增殖。加入KT和IBA可以改善苗的均匀性,以1 mg/L NAA、1 mg/L KT和0.05 mg/L IBA的组合较适合走马胎的增殖。
表4 不同激素组合和浓度对不定芽增殖的影响
Table 4 Effect of different hormones combination and concentration on adventitious bud proliferation
编号No.生长状况Growth situation 1 2.0±0.54 芽少、粗壮2 2.35±0.73 芽少、均匀3 8.65±1.35 芽多、较小4 9.99±1.76 芽多、较小5 12.57±1.37 芽多、小、密6 13.55±1.76 芽多、小、较密增殖系数(倍)Proliferation rate(times)

图1 走马胎离体增殖结果
Fig.1 Buds proliferation in vitro of Ardisia gigantifolia
2.3 生根培养效果
将含有2~3个芽的茎段接入生根培养基中,进行组培苗的生根诱导。在培养40 d后,统计生根率和根的长度。结果(表5图2)表明,采用IBA和NAA的激素组合均能诱导走马胎的生根,但是和其他草本植物相比,走马胎的生根较慢,且多为主根,侧根较少。在低浓度的激素水平下,随着激素浓度的增加根的数量也相应增加,根长增长。添加0.2 mg/L NAA和0.3 mg/L IBA的处理能促进根的数量、提高根的质量,但是随着NAA和IBA浓度的增加,走马胎诱导生根的时间也增加。表明NAA浓度增加,根数量也增加,但直径略变小,其中0.5 mg/L NAA处理比0.1 mg/L NAA处理诱导的根数量增加1.25倍,长度增加46.15%,而根直径没有明显的差异。结合出根时间和根的质量,以0.2 mg/L NAA和0.3 mg/L IBA诱导的组培苗根系较好,适合后期的移栽。
表5 不同激素对走马胎根诱导的效果
Table 5 Effect of different hormones on rooting induction of Ardisia gigantifolia
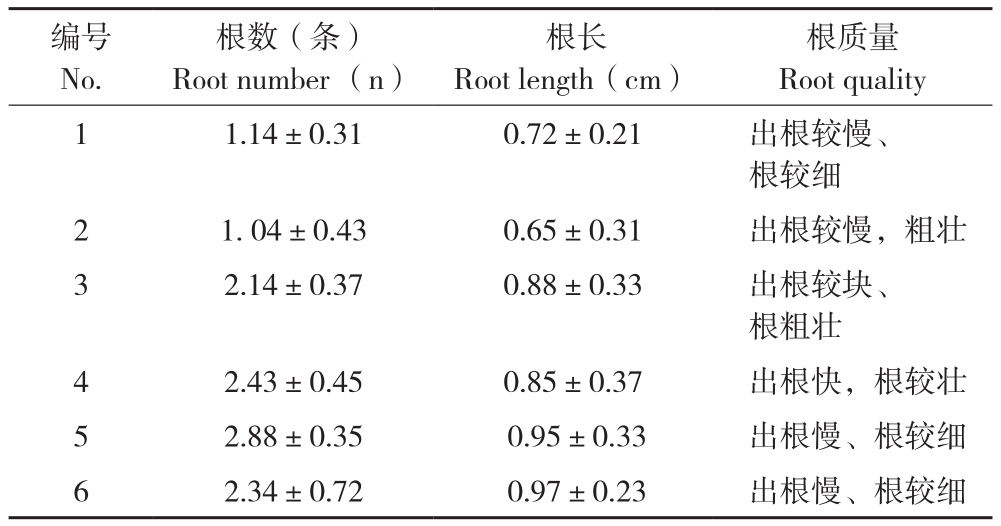
编号No.根数(条)Root number (n)根长Root length(cm)根质量Root quality 1 1.14±0.31 0.72±0.21 出根较慢、根较细2 1.04±0.43 0.65±0.31 出根较慢,粗壮3 2.14±0.37 0.88±0.33 出根较块、根粗壮4 2.43±0.45 0.85±0.37 出根快,根较壮5 2.88±0.35 0.95±0.33 出根慢、根较细6 2.34±0.72 0.97±0.23 出根慢、根较细

图2 走马胎离体诱导生根情况
Fig.2 Rooting in vitro of Ardisia gigantifolia
2.4 炼苗及移栽
生根诱导培养40~60 d,走马胎幼苗的根长0.7 cm、株高3 cm左右。通过练苗,组培苗叶片变厚,质地变硬。在移栽5 d后植株挺拔,成活率在85%以上。
3 讨论
随着人口的增长和社会对中医药事业的重视,中药材的需求日益增加,但是大量的中药材还没有开展人工栽培,大多以自然采挖为主,导致野生资源被掠夺性开发,资源濒临枯竭,同时也很难满足现代中医药产业的需求[2]。近年来,中药农业逐渐兴起,特别是在中草药的人工驯化、选育和标准化种植,不断提升了中草药的质量,缓解中药原料短缺,将产生良好的生态和经济效益[3-4]。走马胎作为一种药用历史悠久中药材,同时兼具观赏价值,但由于其生长缓慢,繁殖系数较低,建立走马胎种苗的人工快速繁殖技术可缩短育苗周期,保障种苗的质量,促进走马胎规模化、标准化种植,彻底市场紧缺的困境[5],同时,也有效保护野生走马胎的种子资源,有助于走马胎资源的稳定。
持续提供大量的种苗是进行规模化种植的基础,在走马胎生产上具有重要的意义[6]。目前植物组织培养快速繁殖在技术上非常成熟,在种苗生产中,种性稳定,保持母本优良性状是进行工厂化生产的前提,器官发生途径的变异要较愈伤组织途径低,因而在生产上大多采用茎段繁殖[7]。在生产中,无菌外植体的获得和高增殖效率是制约组培快繁的两个主要因素[8]。HgCl2在外植体消毒中应用最为广泛,但是受到环境保护的限制,酒精、84消毒液和次氯酸钠等消毒剂的应用频率开始增加[9-11]。在中草药植物的组培中,材料纤维化程度、表面是否有绒毛、蜡质,特别是生理状态等因素都会影响外植体消毒的效果[12-14]。走马胎和其他木本植物植物一样,嫩茎在0.1%HgCl2处理7~9 min进行消毒较适合。6-BA和KT是在增殖过程中常用的细胞分裂素,在生根诱导方面则主要为生长素。不同的植物对激素的敏感性存在较大差异,一般通过梯度设计得到适合的配方[15,16]。本试验结合以往的研究,通过设置6-BA和KT的浓度,得到走马胎的增殖体系。生长素中的NAA和IBA较为稳定,常用与生根诱导,两者的配合使用可以大大改善根的形态,诱导得到健壮的走马胎的根[17]。组织培养快繁技术能提供大量优质的走马胎种苗,满足市场需求,保护野生资源不受破坏,促进其在中医药产业中更好的应用。
4 结论
本研究建立的走马胎组培苗生产技术体系,包括嫩茎经过70%酒精处理30 s结合0.1% HgCl2处理7~9 min的消毒方法,优化了改良MS培养基+ 6-BA 1.0 mg/L+KT1 mg/L +IBA 0.05 mg/L的不定芽的增殖培养基和1/2改良MS培养基+ NAA 0.2 mg/L +IBA 0.3 mg/L的生根培养基配方。通过建立走马胎的离体培养与快速繁殖方法,能够开展工厂组培苗的生产,为人工种植提供充足的种苗,满足生产需求。
[1]谷永杰.走马胎三萜皂苷类化合物的分离及Ag3的生物转化研究[D].张家口:河北北方学院,2014.doi: 10.7666/d.D618739.GU Y J.Study on the isolation of triterpenoid saponins from Ardisia gigantifolia and Ag3 biotransformation[D].Zhangjiakou: HeBei North University, 2014.doi: 10.7666/d.D618739.
[2]魏蓉.环境因子对走马胎生物量及皂苷含量的影响[D].广州:仲恺农业工程学院,2017.WEI R.The influence of environmental factors on contents of biomass and saponins of Ardisia gigantifolia[D].Guangzhou: Zhongkai University of Agriculture and Engineering, 2017.
[3]戴卫波,董鹏鹏,梅全喜,何鉴洪,张远军.走马胎石油醚提取物抗类风湿性关节炎的作用机制[J].中药材,2018, 41(2): 459-463.doi:10.13863/j.issn1001-4454.2018.02.047.DAI W B, DONG P P, MEI Q X, HE J H, ZHANG Y J.Mechanism of Ardisia gigantifolia extracted by petroleum ether on anti-rheumatoid arthritis[J].Journal of Chinese Medicinal Materials, 2018, 41(2):459-463.doi:10.13863/j.issn1001-4454.2018.02.047.
[4]封聚强,黄志雄,穆丽华,赵海霞,刘屏.走马胎化学成分研究[J].中 国 中 药 杂 志,2011, 36(24): 3463-3466.doi: 10.4268/cjcmm20112416.FENG J Q, HUANG Z X, MU L H, ZHAO H X, LIU P.Study on chemical constituents of rhizome of Ardisia gigantifolia[J].China Journal of Chinese Materia Medica, 2011, 36(24): 3463-3466.doi:10.4268/cjcmm20112416.
[5]戴卫波,董鹏鹏,梅全喜.走马胎的化学成分、药理作用研究进展[J].天然产物研究与开发,2018, 30(4): 717-723.doi:10.16333/j.1001-6880.2018.4.029.DAI W B, DONG P P, MEI Q X.Review on chemical constituents of Ardisia gigantifolia and their pharmacological effects[J].Natural Product Research and Development, 2018, 30(4): 717-723.doi:10.16333/j.1001-6880.2018.4.029.
[6]毛世忠,李景剑,蒋小华,丁莉,赵博,邓涛,马虎生.走马胎种质资源遗传多样性的ISSR分析(英文)[J].广西植物,2017, 37(1):33-39.doi: 10.11931/guihaia.gxzw201512016.MAO S Z, LI J J, JIANG X H, DING L, ZHAO B, DENG T, MA H S.Efficiency of ISSR markers in assessing genetic diversity and relationships in Ardisia gigantifolia germplasm[J].Guihaia, 2017,37(1): 33-39.doi: 10.11931/guihaia.gxzw201512016.
[7]杜泽乡.走马胎及其两种混伪品饮片的鉴别[J].中药材,1995(4):183-184.doi: 10.13863/j.issn1001-4454.1995.04.010.DU Z X.Identification of Ardisia gigantifolia and its two mixed fake pieces[J].Journal of Chinese Medicinal Materials, 1995(4): 183-184.doi: 10.13863/j.issn1001-4454.1995.04.010.
[8]戴卫波,董鹏鹏,田素英,梅全喜.走马胎及其混淆品红马胎的生药学对比研究[J].中药材,2018, 41(3): 565-569.doi: 10.13863/j.issn1001-4454.2018.03.013.DAI W B, DONG P P, TIAN S Y, MEI Q X.Comparative study on the pharmacognosy of Ardisia gigantifolia and its confused product red Ardisia gigantifolia[J].Journal of Chinese Medicinal Materials, 2018,41(3): 565-569.doi: 10.13863/j.issn1001-4454.2018.03.013.
[9]毛世忠,赵博,蒋小华,丁莉,莫凌,邓涛,马虎生.林下不同光照条件对走马胎苗木生长及光合特性的影响[J].西北林学院学报,2016, 31(1): 21-24.doi: 10.3969/j.issn.1001-7461.2016.01.04.MAO S Z, ZHAO B, JIANG X H, DING L, MO L, DENG T, MA H S.Influences of illumination on the seedling growth and photosynthetic characteristics of understory Ardisia gigantifolia[J].Journal of Northwest Forestry University, 2016, 31(1): 21-24.doi: 10.3969/j.issn.1001-7461.2016.01.04.
[10]龙杰超,冯军,刘布鸣,何开家,陈明生.种植与野生走马胎的化学成分差异分析[J].广西科学院学报,2016, 32(4): 275-277.doi:10.13657/j.cnki.gxkxyxb.20161201.001.LONG J C, FENG J, LIU B M, HE K J, CHEN M S.Variance analysis of chemical constituents in the cultivated and wild Ardisia gigantifolia Stapf[J].Journal of Guangxi Academy of Sciences, 2016, 32(4):275-277.doi: 10.13657/j.cnki.gxkxyxb.20161201.001.
[11]蔡时可,魏杰,李战超,王继华.独脚金离体培养与快速繁殖[J].亚热带植物科学,2017, 46(4): 375-378.doi:10.3969/j.issn.1009-7791.2017.04.015.CAI S K, WEI J, LI Z C, WANG J H.In vitro culture and rapid propagation of Striga asiatica[J].Subtropical Plant Science, 2017, 46(4): 375-378.doi:10.3969/j.issn.1009-7791.2017.04.015.
[12]杨平飞,吴明开,宋智琴,张金霞,李娟,杨琳.不同激素配比对铁皮石斛组培丛生芽增殖的影响[J].北方园艺,2016(6): 106-108.doi:10.11937/bfyy.201606026.YANG P F, WU M K, SONG Z Q, ZHANG J X, LI J, YANG L.Effect of medium of different hormone on Dendrobium officinale buds proliferation[J].Northern Horticulture, 2016(6): 106-108.doi:10.11937/bfyy.201606026.
[13]刘雪兰,孙长生,朱虹,李利霞,李婷婷,龙祥友.温度对铁皮石斛组培苗质量的影响[J].中国实验方剂学杂志,2015, 21(8): 89-92.doi: 10.13422/j.cnki.syfjx.2015080089.LIU X L, SUN C S, ZHU H, LI L X, LI T T, LONG X Y.Influence of temperature on quality of Dendrobii officinalis caulis tissue culture seedlings[J].Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(8): 89-92.doi: 10.13422/j.cnki.syfjx.2015080089.
[14]张桂琴,黄雪娟.牛大力茎段组织培养污染率控制方法的初步研究[J].北京农业(下旬刊),2015(6): 65.ZHANG G Q, HUANG X J.Preliminary study on the method of controlling tissue culture contamination rate in stem section of Millettia speciosa Champ[J].Beijing Agriculture, 2015(6): 65.
[15]符运柳,徐立,李志英,黄碧兰,李克烈.走马胎离体培养及植株再生[J].北方园艺 , 2017(4): 98-101.doi: 10.11937/bfyy.201704022.FU Y L, XU L, LI Z Y, HUANG B L, LI K L.In vitro culture and plant regeneration of Ardisia gigantifolia Stapf[J].Northern Horticulture,2017(4): 98-101.doi: 10.11937/bfyy.201704022.
[16]莫可元,蔡毅,蒋秋香,王进声.独脚金的显微结构鉴别[J].中药材,2006, 29(6): 542-544.doi: 10.3321/j.issn:1001-4454.2006.06.009.MO K Y, CAI Y, JIANG Q X, WANG J S.Microstructure identification of Striga asiatica[J].Journal of Chinese Medicinal Materials, 2006,29(6): 542-544.doi: 10.3321/j.issn:1001-4454.2006.06.009.
[17]马周华.木里县道地中药材生产现状及发展对策[J].四川农业科技,2014(6): 52-53.MA Z H.Production status and development countermeasures of traditional chinese medicine in Muli county[J].Sichuan Agricultural Science and Technology, 2014(6): 52-53.
[18]王亚立.我国中药材发展问题及解决对策[J].黑龙江农业科学,2019(1): 124-126.doi: 10.11942/j.issn1002-2767.2019.01.0124.WANG Y L.Development problems and solutions of traditional chinese medicine in china[J].Heilongjiang Agricultural Sciences, 2019(1):124-126.doi: 10.11942/j.issn1002-2767.2019.01.0124.
[19]王继东,卢杉.延庆区射干栽培技术[J].农业科技通讯,2019(1):192-193.WANG J D, LU S.Cultivation technology of Belamcanda chinensis in Yanqing district[J].Bulletin of Agricultural Science and Technology,2019(1): 192-193.
[20]熊丙全,廖相建,郑雪莲,邓科君,阳淑,张勇.基于液体培养基的白芨种苗离体快繁技术[J].湖北农业科学,2018, 57(2): 80-82.doi:10.14088/j.cnki.issn0439-8114.2018.02.020.XIONG B Q, LIAO X J, ZHENG X L, DENG K J, YANG S, ZHANG Y.A rapid in vitro propagation technique of Bletilla striata seedling based on liquid culture medium[J].Hubei Agricultural Sciences, 2018, 57(2):80-82.doi:10.14088/j.cnki.issn0439-8114.2018.02.020.
[21]饶宝蓉,谢东奇,陈泳和,周先治,邹荣春,陈敏建,刘忠辉.多花黄精实生苗组培快繁技术研究[J].江西农业学报,2018, 30(2):46-49.doi: 10.19386/j.cnki.jxnyxb.2018.02.11.RAO B R, XIE D Q, CHEN Y H, ZHOU X Z, ZOU R C, CHEN M J,LIU Z H.Study on technology of tissue culture and rapid propagation for polygonatum cyrtonema seedlings[J].Acta Agriculturae Jiangxi,2018, 30(2): 46-49.doi: 10.19386/j.cnki.jxnyxb.2018.02.11.
[22]肖文芳,李佐,尤毅,陈和明,吕复兵.兰属杂交兰绿翡翠组培变异的RAPD 检测与鉴定[J].广东农业科学,2014, 41(21): 135-139.doi: 10.16768/j.issn.1004-874X.2014.21.029.XIAO W F, LI Z, YOU Y, CHEN H M, LV F B.Detection and identification of high-tillering and dwarf mutants from Cymbidium hybrids 'Lv Fei Cui' by RAPD[J].Guangdong Agricultural Sciences,2014, 41(21): 135-139.doi: 10.16768/j.issn.1004-874X.2014.21.029.
[23]徐世强,李宇峰,王继华.观赏水草雪花草的离体培养与快速繁殖[J].黑龙江农业科学,2016(3): 16-19.doi: 10.11942/j.issn1002-2767.2016.03.0016.XU S Q, LI Y F, WANG J H.In vitro culture and rapid propagation of ornamental waterweeds Hottonia in flate[J].Heilongjiang Agricultural Sciences, 2016(3): 16-19.doi: 10.11942/j.issn1002-2767.2016.03.0016.
[24]和琼姬,和加卫,王宇萍,木永青,杨文宏,杨洪涛,黄杏娥,吴永斌,和寿莲,和建平.青刺果研究概述[J].中国农学通报,2016, 32(7):74-78.HE Q J, HE J W, WANG Y P, MU Y Q, YANG W H, YANG H T,HUANG X E, WU Y B, HE S L, HE J P.Overview of Prinsepia utilis Royle[J].Chinese Agricultural Science Bulletin, 2016, 32(7): 74-78.
[25]冯丽娜.灯台树组培快繁技术研究[D].保定:河北农业大学,2008.FENG L N.Study on the micropropagation of Bothrocaryum controversum Hemsl.[D].Baoding: Agricultural University of Hebei ,2008.
[26]谢羽,夏凯,黎敏,伍春莲.不同类被子植物组培快繁及其消毒方式的影响[J].分子植物育种,2017(3): 255-260.doi: 10.13271/j.mpb.015.001029.XIE Y, XIA K, LI M, WU C L.Effects of different angiosperms on callus induction and sterilization methods research[J].Molecular Plant Breeding, 2017(3): 255-260.doi: 10.13271/j.mpb.015.001029.
[27]官锦燕,谭嘉娜,罗剑飘,黄海英,罗青文,杨俊贤,陈月桂.牛樟的组织培养和植株再生[J].南京林业大学学报(自然科学版),2016,40(4): 63-68.doi: 10.3969/j.issn.1000-2006.2016.04.010.GUAN J Y, TAN J N, LUO J P, HUANG H Y, LUO Q W, YANG J X,CHEN Y G.Tissue culture and plant regeneration of Cinnamomum kanehirae Hay[J].Journal of Nanjing Forestry University(Natural Sciences Edition), 2016, 40(4): 63-68.doi: 10.3969/j.issn.1000-2006.2016.04.010.
[28]郭慧慧,蒋元斌,林丛发,周丽英.金线莲研究进展[J].福建农业科技,2016, 47(3): 55-59.doi:10.13651/j.cnki.fjnykj.2016.03.022.GUO H H, JIANG Y B, LIN C F, ZHOU L Y.Research progress in Anoectochilus roxburghii[J].Fujian Agricultural Science and Technology, 2016, 47(3): 55-59.doi:10.13651/j.cnki.fjnykj.2016.03.022.
[29]徐世强,李宇峰,王继华.南美叉柱花的离体培养与快速繁殖[J].现代园艺,2016(11): 18-20.doi: 10.14051/j.cnki.xdyy.2016.11.010.XU S Q, LI Y F, WANG J H.In vitro culture and rapid propagation of Staurogyne concinnula of South American[J].Xiandai Horticulture,2016(11): 18-20.doi: 10.14051/j.cnki.xdyy.2016.11.010.
[30]吴艳歌,毕波,柴明良.细胞分裂素对沟叶结缕草愈伤组织生长及其抗氧化系统的影响[J].核农学报,2016, 30(7): 1288-1295.doi:10.11869/j.issn.100-8551.2016.07.1288.WU Y G, BI B, CHAI M L.Effect of cytokinins on callus growth and antioxidant system in Zoysia matrella(L.)Merr[J].Journal of Nuclear Agricultural Sciences, 2016, 30(7): 1288-1295.doi: 10.11869/j.issn.100-8551.2016.07.1288.
[31]田景,金华,申国安,郭宝林,姜志海,李砾.6-BA及尿素对拟巫山淫羊藿根芽形成的影响[J].中国现代中药,2019, 21(1): 71-75.doi: 10.13313/j.issn.1673-4890.20180813002.TIAN J, JIN H, SHEN G A, GUO B L, JIANG Z H, LI L.Effects of 6-BA and nitrogen on buds formation of Epimedium pseudowushanense[J].Modern Chinese Medicine, 2019, 21(1): 71-75.doi: 10.13313/j.issn.1673-4890.20180813002.
[32]刘玉莲,张学友,邓冰倩,曾永祯,郝艳琪,侯义龙,赵东利.连翘〔Forsythia suspensa(Thunb.)Vahl〕的试管苗快速繁殖[J].北京农学院学报, 2016, 31(3): 12-15.doi: 10.13473/j.cnki.issn.1002-3186.2016.0315.LIU Y L, ZHANG X Y, DENG B Q, ZENG Y Z, HAO Y Q, HOU Y L,ZHAO D L.Rapid propagation of Forsythia suspensa(Thunb.)Vahl in vitro[J].Journal of Beijing University of Agriculture, 2016, 31(3):12-15.doi: 10.13473/j.cnki.issn.1002-3186.2016.0315.