【研究意义】瓜类疫病是由瓜类疫霉(Phytophthora melonis Katsura)引起的毁灭性病害[1],可以侵染黄瓜、冬瓜、节瓜、南瓜等瓜类作物[2]。瓜类疫病在全国各地均有发生,特别是华南地区春、夏季节雨水多、湿度大,易引起疫病的爆发和传播。该病一旦发生,化学药剂难以控制,损失严重,一般年份减产30%,病害流行年份则几乎绝收,对瓜类生产和育种构成严重威胁。目前尚未有有效化学手段防治该病害,发掘瓜类抗性基因资源、培育抗性品种是控制这一病害最有效的策略,因此建立快速鉴定瓜类疫病抗性方法尤为重要。【前人研究进展】早在1981年翁祖信等[3]就提出菌丝块活体接种黄瓜幼苗的方法,1983年又提出用孢子悬浮液接种活体黄瓜幼苗,均可引起植株发病。赖莉玉等[4]采用涂抹浓度为102个孢子/mL的菌液法对135份山东黄瓜品种资源进行抗疫病鉴定,筛选到21份抗性品种材料。王平勇等[5]利用1×106/mL的孢子悬浮液灌根接种166份甜瓜材料,筛选到14份抗疫病甜瓜材料。柴喜荣等[6]利用5×103个孢子/mL浓度的孢子悬浮液灌根接种黄瓜材料,没有筛选到抗性材料,并对其接种后防御相关酶进行研究。周克琴、刘学敏等均对南瓜疫病抗性苗期接种方法进行了研究[7-8]。以上方法能够筛选到一定的抗病材料,但无论是活体接种[9]、灌根、喷雾还是注射接种,都容易将病原菌带到田间引起集中爆发,不利于疫病的防治工作;同时,疫病致死率高,不容易保存中间材料及感病材料,极大影响了抗性基因的相关研究工作[10]。此外,常规鉴定方法对发病条件要求苛刻,需要提供稳定的温度和湿度,一般光照培养箱难以满足大量材料的鉴定。【本研究切入点】基于以上问题,本研究以黄瓜为例,拟建立一个快速、精准、高通量、安全有效的疫病抗性鉴定技术体系。选择两个抗感差异明显的黄瓜材料为研究对象,探讨叶片离体接种方法的条件,并通过与灌根法、喷雾法、浸泡法进行比较,最终建立室内离体快速鉴定瓜类疫病的技术体系;同时利用离体叶片接种法对40份黄瓜资源进行疫病抗病性鉴定,以期为瓜类的抗病育种奠定基础。【拟解决的关键问题】建立离体接种快速鉴定瓜类疫病技术体系。
1 材料与方法
1.1 试验材料
供试黄瓜抗性材料JSH和感病材料B80,以及用于抗性筛选40份黄瓜种质资源材料,均由广东省农业科学院蔬菜研究所林毓娥研究员提供。试验于2018年12月20日至2019年1月15日在广东省农业科学院蔬菜研究所实验室进行。
1.2 试验方法
1.2.1 孢子悬浮液的制备 将10% V8培养液倒入灭菌培养皿(直径9 cm)中,每皿15~20 mL。将新鲜培养的疫霉菌菌丝块(大小约2 mm×2 mm)8~10块移入培养液中,在25 ℃、黑暗条件下培养2~3 d。待菌丝丛形成后,倾去培养液,用15~20 mL灭菌水冲洗悬浮菌丝丛2次,置于25 ℃、黑暗中培养,直至孢子大量产生[11]。用纱布过滤菌丝,用血球计数板测定孢子浓度,并稀释到所需浓度。
1.2.2 接种方法 (1)灌根法:黄瓜待测材料及抗、感对照材料播种于10 cm×10 cm盆钵中,置于光照培养箱(白天28 ℃、晚上26 ℃,湿度均为85%)中培养20 d,瓜类疫霉菌孢子悬浮液调整至102、103、104个孢子/mL,每个盆钵灌根30 mL,置于光照培养箱中温度28 ℃、湿度90%、黑暗培养24 h,之后在白天30 ℃、晚上28 ℃、湿度90%条件下继续培养,3 d后调查发病情况。
(2)喷雾法:将培养20 d的黄瓜材料置于密闭容器内,分别喷雾102、103、104孢子悬浮液,每个浓度处理3次重复,每个重复3 d后观察发病情况。
(3)浸根法:将培养20 d的黄瓜植株根部土壤洗净,分别浸泡在102、103、104孢子悬浮液中,置于光照培养箱(白天28 ℃、晚上26 ℃,湿度均为90%)中,每个浓度处理3次重复,每个重复10株,24 h后观察发病情况。
(4)菌块离体接种法:利用V8、PDA或皮氏培养基(固体)在28 ℃条件下黑暗培养瓜类疫霉菌3~4 d,将黄瓜待测材料及抗、感对照材料播种于盆钵中,置于光照培养箱(白天28 ℃、晚上26 ℃,湿度均为85%)中培养7 d。用打孔器或改造后的移液器枪头切取菌圈周围最新鲜的微菌块(直径约2 mm),取黄瓜子叶,将其背面向上置于培养皿中的湿润滤纸上,将微菌块菌丝向下放置于黄瓜子叶上;将接种疫霉菌后的黄瓜子叶置于28 ℃培养皿中黑暗培养24 h,将黄瓜子叶从培养皿中取出并拍照,利用Photoshop软件[12]准确测量病斑面积,并将其与感病对照进行比较,病斑面积占感病对照病斑面积的0~5%(含5%)为(高抗HR)材料、占5%~20%(含20%)为(抗病R)材料、占20%~40%(含40%)为(感病S)材料、占40%以上为(高感HS)材料
1.2.3 黄瓜抗病种质资源的筛选 用本研究建立的菌块离体接种方法对40份黄瓜资源进行抗性鉴定,同时将其种植于田间常年多发疫病地块,调查自然发病结果,用于比较室内人工接种实验结果。
试验数据采用Excel和方差分析软件进行处理和作图,采用单因素方差分析和两因素随机区组法进行差异显著性比较。
2 结果与分析
2.1 接种方法的筛选
2.1.1 浸根法 将植株根部浸泡在孢子悬浮液中,浸泡24 h即可发病,102个孢子/mL浓度接种处理感病材料B80有6株萎蔫,根部开始出现水烫状、溢缩,全部萎蔫发病率达98%;抗性材料JSH几乎无感病症状,发病率为2.22%。103个孢子/mL浓度接种处理B80根部全部溢缩、萎蔫严重,发病率100%;JSH出现萎蔫症状,5株子叶发黄、根部无变化,发病率17.78%。104个孢子/mL浓度接种处理JSH和B80均全部萎蔫,其中B80根部开始腐烂、发病率100%,JSH根部溢缩、枯萎,发病率100%(图1)。

图1 浸泡法接种黄瓜抗感材料发病率
Fig.1 Incidence rate of infested cucumber cultivars by soaking method
2.1.2 喷雾法 喷雾法接种JSH、B80 材料48 h后,104个孢子/mL浓度接种处理B80全部植株萎蔫,茎呈水烫状,根部腐烂,发病率100%;JSH接种后表现为2/3植株呈水烫萎蔫状,叶片呈黄色病斑发病率91%。103个孢子/mL浓度接种处理JSH的发病率为46%株,B80的发病率为100%。102个孢子/mL浓度接种处理JSH、B80无发病,但在72 h后JSH植株发病率为5.55%,B80植株发病率为97%(图2)。
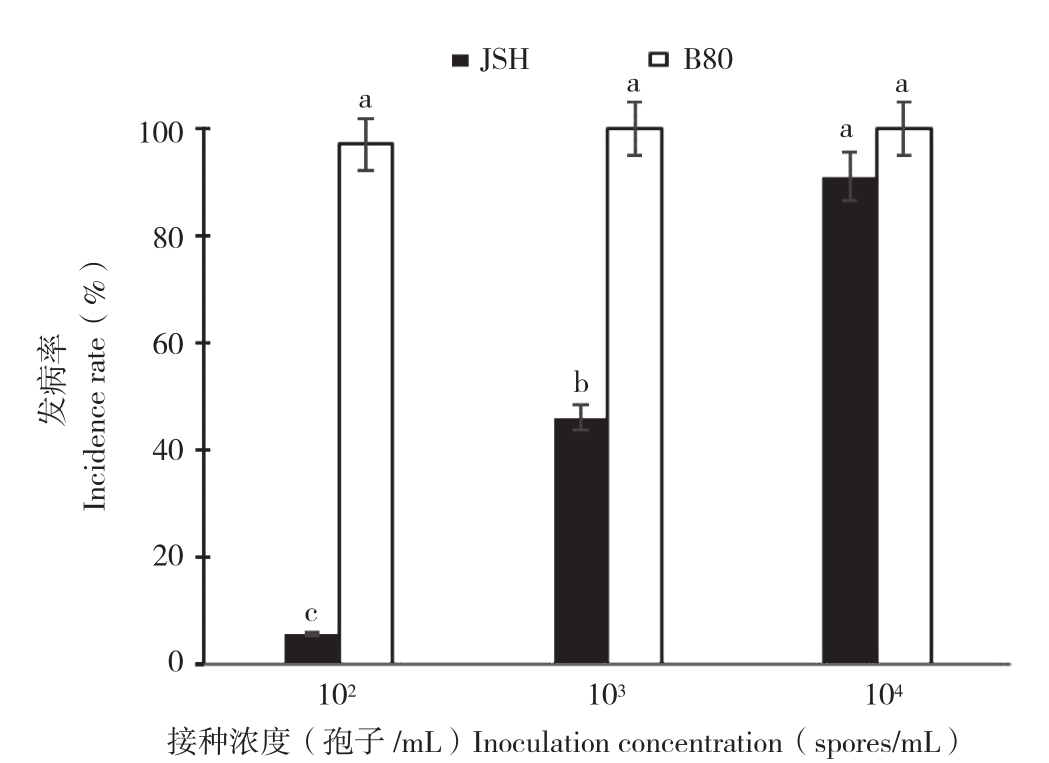
图2 喷雾法接种黄瓜抗感材料发病率
Fig.2 Incidence rate of infested cucumber cultivars by spore-spraying method
2.1.3 灌根法 用孢子悬浮液灌根接种10 d苗龄的JSH、B80,接种后3 d开始出现发病状态。其中,102个孢子/mL浓度接种处理B80发病率为100%,JSH发病率为2%。103个孢子/mL浓度接种处理JSH发病率为19%,B80发病率为100%。104个孢子/mL浓度接种处理JSH发病率67%,B80发病率100%(图3)。

图3 灌根法接种黄瓜抗感材料发病率
Fig.3 Incidence rate of infested cucumber cultivars by root pouring method
2.1.4 菌块离体接种法 将菌块放置于离体子叶进行接种,接种后24 h即可发病,在24~36 h调查结果比较好,这个时间能够明确分辨出抗感差异。抗性材料JSH部分叶片只在菌块覆盖部位出现点状失绿病斑,甚至无病斑,而感病材料B80的叶片1/3~1/2叶片出现失绿病斑,严重时整片叶子开始腐烂(图4)。
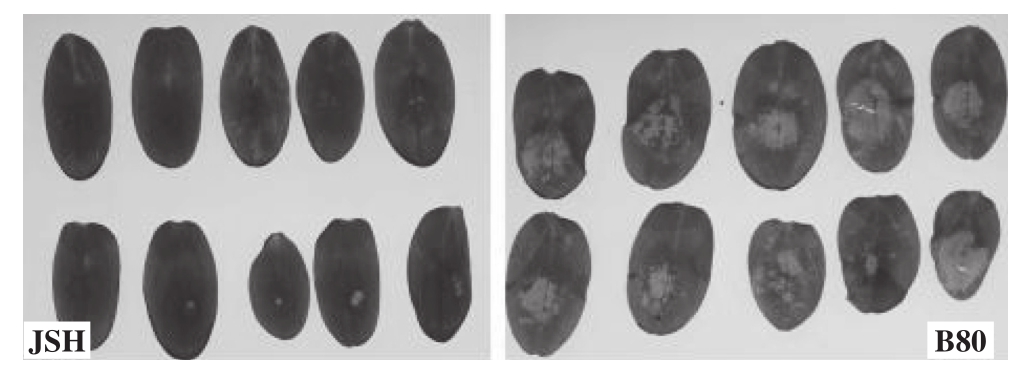
图4 菌块接种法接种JSH和B80 24 h后结果
Fig.4 Result of inoculation of JSH and B80 for 24 hours by mycelial pellet inoculation
2.2 黄瓜抗病种质资源筛选结果
采用菌块离体接种鉴定方法,对40份黄瓜材料进行抗疫病鉴定。结果(表1)发现,根据抗病种质资源病斑面积占感病对照病斑面积比例,PE40、PE119、PE120、PE185为相对抗病品种,占所测品种的10%,其余90%品种均感病或者高感疫病。所测40份黄瓜育种材料中,除抗病对照JSH外,没有高抗疫病的种质资源,该鉴定结果与田间自然发病条件结果相似,这也与以往学者“黄瓜资源抗疫病材料匮乏,华南型吊瓜类型比刺瓜类型较抗疫病”的研究结果相似。
表1 不同黄瓜种质资源抗病性鉴定结果
Table 1 Result of identification of phytophthora blight resistance of different cucumber germplasm resources
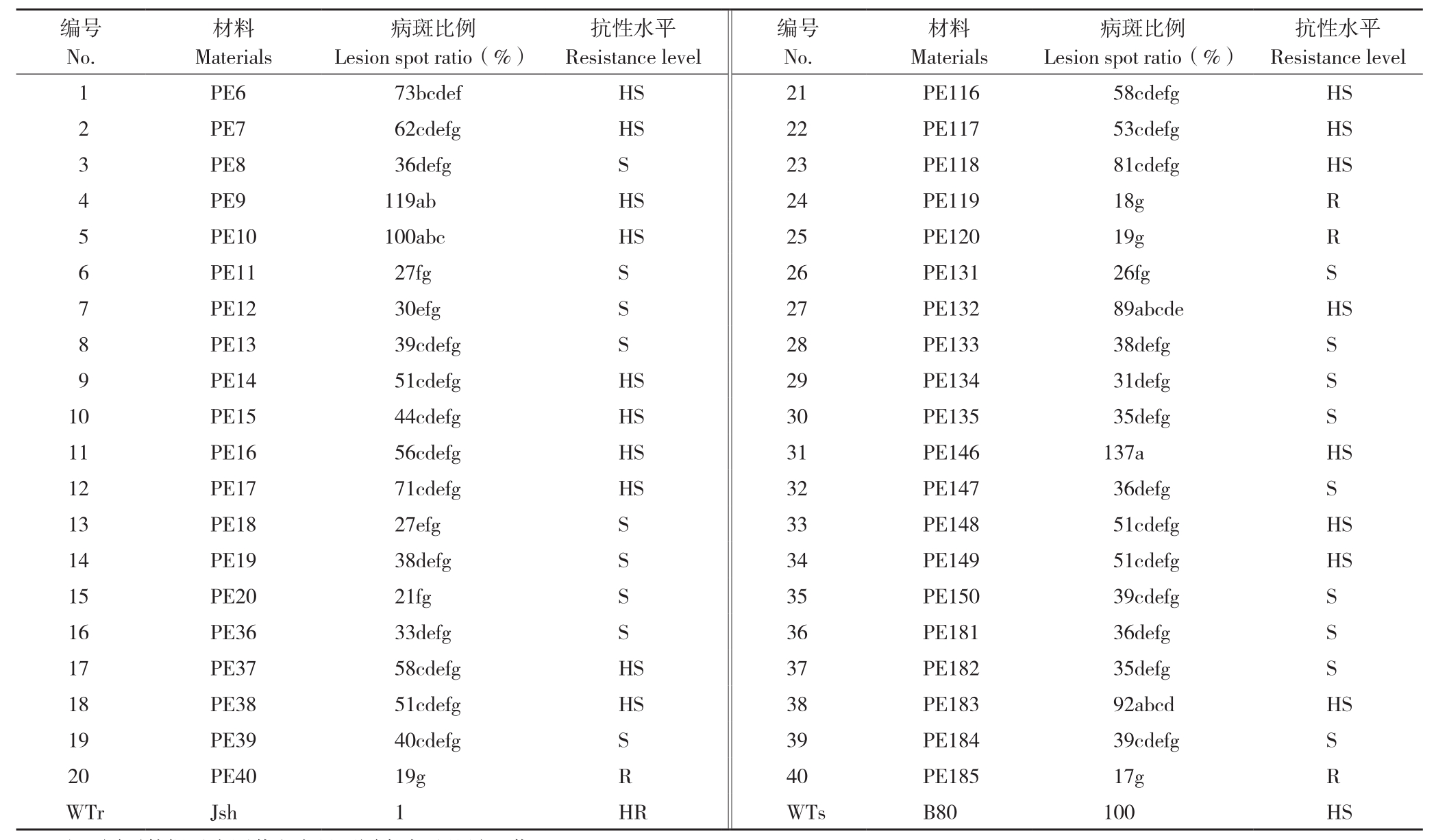
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
抗性水平Resistance level 1 PE6 73bcdef HS 21 PE116 58cdefg HS 2 PE7 62cdefg HS 22 PE117 53cdefg HS 3 PE8 36defg S 23 PE118 81cdefg HS 4 PE9 119ab HS 24 PE119 18g R 5 PE10 100abc HS 25 PE120 19g R 6 PE11 27fg S 26 PE131 26fg S 7 PE12 30efg S 27 PE132 89abcde HS 8 PE13 39cdefg S 28 PE133 38defg S 9 PE14 51cdefg HS 29 PE134 31defg S 10 PE15 44cdefg HS 30 PE135 35defg S 11 PE16 56cdefg HS 31 PE146 137a HS 12 PE17 71cdefg HS 32 PE147 36defg S 13 PE18 27efg S 33 PE148 51cdefg HS 14 PE19 38defg S 34 PE149 51cdefg HS 15 PE20 21fg S 35 PE150 39cdefg S 16 PE36 33defg S 36 PE181 36defg S 17 PE37 58cdefg HS 37 PE182 35defg S 18 PE38 51cdefg HS 38 PE183 92abcd HS 19 PE39 40cdefg S 39 PE184 39cdefg S 20 PE40 19g R 40 PE185 17g R WTr Jsh 1 HR WTs B80 100 HS编号No.材料Materials病斑比例Lesion spot ratio(%)抗性水平Resistance level编号No.材料Materials病斑比例Lesion spot ratio(%)
3 讨论
接种鉴定是抗病育种的一个重要手段,因此建立一套方便、快捷、准确、高效的室内鉴定方法势必能让抗病育种工作事半功倍。对于卵菌引起的病害常用接种鉴定方法已有较多研究[11-14],有报道认为点滴法、灌根法、喷雾法、菌液浸泡法、注射法、涂抹法等均能在一定程度上鉴定出材料的抗感性差异,但均采用活体接种,不能保存感病材料和中间材料,不能满足构建群体的试验要求。其中,常用的灌根法接种接近田间发病状态[15],但是发病不稳定,需要多次重复试验才能得出可靠结果;喷雾法接种发病时间较长、发病较重,而且喷雾不均匀、喷雾量控制要求较严格,否则无法鉴别出抗感品种;浸根法接种植株发病快,但需要洗根,只适合少量材料的接种鉴定工作。以上3种方法及注射法、涂抹法接种都需要诱导大量疫霉菌孢子,而瓜类疫霉菌孢子难以诱发,这增加了孢子培养和孢子悬浮液制备的工作量,浪费人力和物力;同时,以上活体接种不能保存遗传分析过程中的感病材料,这给抗病育种工作造成很多困扰。菌块接种法在南瓜上已有研究[8],但是采用活体接种无法避免材料损害问题。离体接种法在很多病害和作物上已有大量研究[16-17];任莉等[18]比较了离体叶片接种、离体茎段接种(牙签法)、活体茎秆接种(牙签法)、活体叶柄接种(吸头法)4种接种方法,测定5种油菜资源对菌核病的抗病性,结果发现利用移液管介导的叶柄接种是一种便捷可靠的油菜菌核病抗性鉴定方法;齐振宇等[19]采用人工气候箱活体接种和离体叶片圆盘接种两种方法对6个甜瓜白粉病病原菌生理小种鉴别寄主进行白粉病接种试验,发现离体叶片圆盘接种法发病时间短,圆盘周围有伤口容易被杂菌污染,从而影响了甜瓜白粉病病原菌的生长,因此不能准确分辨出材料的抗感差异;刘淼等[10]探讨了离体叶片接种法鉴定野生大豆抗病性的准确性和可靠性,结果表明离体叶片接种法与下胚轴接种法之间的相关呈极显著,且两种方法差异不显著,证明离体叶片接种法接种大豆疫霉根腐抗性准确可行;姚协丰等[20]研究了甜瓜链格孢叶斑病活体和离体接种方法,最后确定离体接种可以有效鉴定甜瓜资源的抗性。可见,离体接种方法在抗性鉴定中应用广泛,根据鉴定材料和病原菌的不同,鉴定效果也有差异。本研究建立的菌块接种法,利用微小菌块放置于离体黄瓜子叶背面,于光照培养箱适宜温度培养,接种培养24 h即可发病。发病速度快,调查时间就显得尤为重要,应该在抗感对照差异明显时及时记录发病数据。另外,由于瓜类疫霉菌孢子诱导程序复杂,菌块接种无需诱孢,而且对菌块需求量少,利用培养基能够快速、大量培养菌块,大大节省了检测过程的病原菌制备时间。
4 结论
本研究利用Photoshop软件计算病斑面积,将感病对照与鉴定材料同时拍照,利用Photoshop软件即能精确计算病斑面积,将病斑大小量化,易于比较。本研究建立的方法将病斑占比作为发病程度标准,综合对照NY/T 1857-2010《黄瓜主要病害抗病性鉴定技术规程》及抗感差异的统计分析,将病情分级标准定为HR(高抗)、R(抗病)、S(感病)、HS(高感)材料4级。如此分级不仅能够有效区分抗感材料,而且能真实反映材料抗感水平。通过本方法鉴定的40份黄瓜材料的抗感情况与田间自然发病条件的抗感水平一致。与其他鉴定方法相比,本鉴定方法具有操作方便,鉴定时间短、能一次性大批量鉴定材料、且可保存重要种子资源等优点。本鉴定方法以黄瓜为例,同时适用冬瓜、节瓜、南瓜等易感疫病的瓜类。
[1]KATSURA K.On Phytophthora melonis n.sp.of cucumber[J].Annals of the Phytopathological Society of Japan, 1968, 34: 167.
[2]王瑞,林毓娥,梁肇均,金庆敏,吴廷全.广东地区黄瓜疫病病原菌的分离与鉴定[J].中国农学通报,2016,32(1): 76-80.WANG R, LIN YE, LILANG Z J, JIN Q M, WU T Q.Isolation and identification of cucumber blight pathogens in Guangdong Area[J].Chinese Agricultural Science Bulletin,2016,32(1): 76-80.
[3]翁祖信,肖小文.黄瓜疫病苗期抗病性鉴定方法的初步研究[J].中国蔬菜,1984(2):30-31.WENG Z X, XIAO X W.Studies on methods for identification of phytophthora blight resistance at seedling stage of cucumber[J].China Vegetables, 1984(2):30-31.
[4]赖莉玉,张世德.山东黄瓜品种资源抗病性鉴定[J].山东农业科学,1992(1): 20-23.LAI L Y, ZHANG S D.Resistance identification of cucumber germplasms in Shandong[J].Shandong Agricultural Sciences, 1992(1):20-23.
[5]王平勇,赵光伟,孔维虎,贺玉花,欧点点,张健,徐永阳,徐志红,刘璐璐.甜瓜种质资源对疫病的抗性鉴定研究[J].中国农学通报,2018, 34(20): 144-150.WANG P Y, ZHAO G W, KONG W H, HE Y H, OU D D, ZHANG J, XU Y Y, XU Z H, LIU L L.Resistance identification of melon germplasms to phytophthora rot[J].Chinese Agricultural Science Bulletin, 2018,34(20): 144-150.
[6]柴喜荣,林洁,杨暹,康云艳.黄瓜品种抗疫病鉴定及其防御相关酶系研究[J].广东农业科学,2018, 45(7): 16-21.doi: 10.16768/j.issn.1004-874X.2018.07.003.CHAI X R, LIN J, YANG X, KANG Y Y.Identification of resistance of cucumber seedlings to Phytophthora melonis and related defense enzyme activity changes[J].Guangdong Agricultural Sciences,2018, 45(7): 16-21.doi: 10.16768/j.issn.1004-874X.2018.07.003.
[7]周克琴,崔崇士,屈淑平.籽用南瓜疫病苗期抗性鉴定方法的研究[J].吉林 农大大学学报,2003,25(2):164-167.doi:10.13327/j.jjlau.2003.02.013.ZHOU K Q, CUI C S, QU S P.Identification of resistance to squash blight at seedling stage[J].Journal of Jilin Agricultural University,2003,25(2):164-167.doi:10.13327/j.jjlau.2003.02.013.
[8]刘学敏,张俊华,贾文香,张明厚,刘昌洲.接种体和接种部位对南瓜疫病接种效果的影响[J].植物保护学报,1999,26(1): 95-96.doi:10.13802/j.cnki.zwbhxb.1999.01.020.LIU X M, ZHANG J H, JIA W X, ZHANG M H, LIU C Z.Influence of inoculum and inoculation site on the inoculation effect of squash blight[J].Acta Phytophylacica Sinica, 1999,26(1): 95-96.doi:10.13802/j.cnki.zwbhxb.1999.01.020.
[9]程亮,温国泉,吴永官,车江旅,付岗,蒋雅琴,黎炎.广西南瓜疫病的病原分离与鉴定[J].西南农业学报,2014,27(6):2398-2401.doi:10.16213/j.cnki.scjas.2014.06.027.CHENG L, WEN G Q, WU Y G, CHE J L, FU G,JIANG Y Q, LI Y.Isolation and identification of causal organism of phytophthora blight of pumpkin in Nanning City of Guangxi[J].Southwest China Joural of Agricultrural Sciences, 2014,27(6):2398-2401.doi:10.16213/j.cnki.scjas.2014.06.027.
[10]刘淼,来永才,李炜,毕影东,刘明,徐鹏飞,李琬,王玲,邸树峰,丁俊男.离体叶片接种法鉴定大豆疫霉根腐病抗病性[J].安徽农业科学,2017,45(11):43-46.doi:10.13989/j.cnki.0517-6611.2017.11.015.LIU M, LAI Y C, LI W, BI Y D, LIU M, XU P F, LI W, WANG L, DI S F,DING J N.Resistance identification of soybean sources to phytophthora root rot by leaf inoculation method[J].Anhui Agricultural Sciences,2017,45(11):43-46.doi:10.13989/j.cnki.0517-6611.2017.11.015.
[11]王颖.瓜类疫病菌的鉴定以及P.melonis和P.sojae 的分子检测[M].南京:南京农业大学,2007.WANG Y.Molecular distinction of Phytophthora melonis and detection of P.melonis and P.soja[M].Nanjing: Nanjing Agricultural University, 2007.
[12]李任辉,赵仲辉,李家湘.基于Photoshop软件测量植物叶面积的白纸背景法[J].湖南林业科技,2016,43(1):138-142.doi: 10.3969/j.issn.1003-5710.2016.01.028.LI R H, ZHAO Z H, LI J X.An Photoshop software based and white paper as background method for measuring leaf area[J].Hunan Forestry Science & Technology, 2016,43(1): 138-142.doi: 10.3969/j.issn.1003-5710.2016.01.028.
[13]赫卫,张慧,王莹.辣椒对疫霉抗性的快速鉴定[J].植物保护,2018,44(2):145-148-13.doi:10.16688/j.zwbh.2017261.HE W, ZHANG H, WANG Y.Rapid identification of resistance to phytophthora capsici in pepper[J].Plant Protection, 2018,44(2):145-148-13.doi:10.16688/j.zwbh.2017261.
[14]王永琦.西瓜疫病抗性苗期鉴定方法及抗病机理研究[D].杨凌:西北农林科技大学,2010.WANGR Y Q.Studies on method for identification of Phytophthora blight and mechanism of the resistance at seedling stage of watermelon[D].Yangling: Northwest A & F University, 2010.
[15]易图永,张宝玺,谢丙炎,高必达,马新卫.辣椒疫病三种接种 方 法 的 比 较[J].中 国 蔬 菜,2003(2): 18-20.doi:10.3969/j.issn.1000-6346.2003.02.006.YI T Y, ZHANG B X, XIE B Y, GAO B D, MA X W.Comparison of three inoculation methods of pepper Phytophthora blight[J].China Vegetables.2003(2): 18-20.doi:10.3969/j.issn.1000-6346.2003.02.006.
[16]梁静,程智慧,孟焕文,柴喜荣,禹坷,李威.大蒜白腐病抗性鉴定方法研究[J].园艺学报,2011, 38(3):587-592.doi:10.16420/j.issn.0513-353X.2011.03.026.LANG J, CHENG Z H, MENG H W, CHAI X R, YU K, LI W.Protocol establishment for evaluation of resistance of garlic to white rot(Sclerotium cepivorum Berk)[J].Acta Horticulturae Sinica, 2011,38(3): 587-592.doi:10.16420/j.issn.0513-353X.2011.03.026.
[17]张正禹,董文汉,包文静,李成云,杨根华.立枯丝核菌AG-1IA对水稻致病力及粗毒素活性的测定方法研究[J].植物病理学报,2017(1): 82-91.doi:10.13926/J.cnki.apps.000082.ZHANG Z Y, DONG W H, BAO W J, LI C Y, YANG G H.Assessment of methods to pathogenicity of Rhizotonia solanj AG-A 1A and bioactivity of the crude toxin on rice[J].Acta Phytopathologica Sinica, 2017(1): 82-91.doi:10.13926/J.cnki.apps.000082.
[18]任莉,陈坤荣,曾令益,刘凡,徐理,方小平.油菜蕾薹期和花期菌核病接种方法比较[J].江西农业大学学报,2016, 38(2):248-254.doi: 10.13836/j.jjau.2016035.REN L, CHEN K R, ZENG L Y, LING F, XU L, FANG X P.Comparison of methods for resistance screening aganist Sclerotinia sclerotiorum in Brassica napus[J].Acta Agriculturae Universitatis Jiang xiensis,2016, 38(2): 248-254.doi: 10.13836/j.jjau.2016035.
[19]齐振宇,孔德栋,胡卫珍,金蓉,董正中,孙晓梅,于宁宁.甜瓜白粉病抗性鉴定方法的比较[J].实验科学与技术,2015, 13(3):23-26.doi: 10.3969/j.issn.1672-4550.2015.03.008.QI Z Y, KONG D D, HU W Z, JIN R, DONG Z Z, SUN X M, YU N N.Comparison of methods for identifying disease resistance to powdery mildew[J].Experiment Science and Technology, 2015, 13(3):23-26.doi: 10.3969/j.issn.1672-4550.2015.03.008.
[20]姚协丰,李苹芳,朱凌丽,徐锦华,张曼,任润生,刘广,侯茜,羊杏平.甜瓜链格孢叶斑病的2种抗性接种鉴定方法比较[J].浙江农业科学,2018, 59(1):34-36.doi: 10.16178/j.issn.0528-9017.20180115.YAO X F, LI P F, ZHU L L, XU J H, ZHANG M, REN R S, LIU G,HOU X, YANG X P.Comparison of two methods for identifying disease resistance to Alternavia alternata(Fr.)Keissler[J].Journal of Zhejiang Agricultural Sciences, 2018, 59(1):34-36.doi: 10.16178/j.issn.0528-9017.20180115.