非洲猪瘟(African Swine Fever,ASF)是由非洲猪瘟病毒(African Swine Fever Viruses,ASFV)引起的高发病率和死亡率的传染病。ASFV是非洲猪瘟相关病毒科的唯一成员,为双链DNA病毒,根据毒株的不同,基因组大小为170~190 kb,有 151~167 个开放性阅读框[1]。目前基于病毒主要衣壳蛋白p72可将ASFV分为24个基因型,基于病毒血凝素CD2样蛋白(CD2V)和C型凝集素将病毒分为8个血清群,但仅有1个血清型[2]。目前我国流行毒株为基因Ⅱ型血清8 群[3]。
ASF潜伏期为4~19 d不等,潜伏期长短主要取决于病毒毒力、宿主状态及感染方式,高毒力毒株的致死率可达100%且各年龄段猪只都易感。世界动物卫生组织(Office International des Epizooties,OIE)将ASF列为法定上报疫病,我国将其列为一类动物疫病。Zhao等[3]用分离的Pig/HLJ/18毒株感染SPF猪,猪只出现发烧(超过41℃),食欲不振,嗜睡,耳缘、尾巴和四肢末端皮肤发红,呼吸困难和呕吐等症状,这与猪瘟、猪繁殖与呼吸综合征、猪丹毒、猪皮炎肾病综合征等疾病的症状相似,难以从临床症状直接判断区分,需借助实验室检测手段来确诊。ASF感染猪只的唾液、泪液、鼻腔分泌物、尿液、粪便等都可含有病毒,尤其血液中含有大量病毒,可采集相关样品进行实验室检测。
ASFV对猪及猪产品、食品安全有重要的社会和经济影响,尤其是在以猪肉制品为主要蛋白质来源的国家。1921年ASF被首次报道,之后主要流行于撒哈拉以南的非洲地区。2007年ASF在格鲁吉亚暴发[4],疫情迅速蔓延至整个高加索和俄罗斯地区。2014年ASF传入东欧大部分国家并初步呈现出扩大流行趋势[5]。我国生猪养殖体量大,自2018年8月初首次报道非洲猪瘟疫情以来,截至2019年7月3日,我国共发生非洲猪瘟疫情143起,扑杀生猪116万余头。ASF在周边的蒙古、越南、柬埔寨、老挝、朝鲜、韩国等地均有发生,防控形势十分严峻。由于病毒本身的复杂性及对毒力因子和相关保护基因的了解不足,暂无有效疫苗用于ASF防控,因此猪场生存需依赖严格的生物安全措施和准确快速的实验室检测。本综述从分子生物学和免疫学两方面介绍了ASF检测技术进展,以期为不同条件下检测方法的选择提供参考。
1 分子生物学检测
分子生物学方法主要是检测病毒核酸,核酸检测是针对病原体本身采取的检测方法,能作为诊断ASFV感染潜伏期、急性期或病程初期的有效手段。在ASFV最急性和急性感染中,猪通常在抗体转为阳性前已死亡,因此抗体检测更适用于亚急性和慢性感染猪只。常见的分子生物学检测方法及其优缺点见表1,检测人员可以根据临床发病情况及实验室检测条件来选择不同的核酸检测方法,如现场快速诊断可采用等温扩增技术,鉴别诊断可采用聚合酶链式反应(Polymerase Chain Reaction, PCR)或荧光定量PCR。
1.1 普通PCR
PCR已成功应用于猪样品(血液、组织、口腔液等)和钝缘软蜱中ASFV基因组的检测,病毒的核酸片段通过PCR指数级扩增获得足以检测的量,从而实现检测。Luo等[6]根据GenBank中所有ASFV毒株的VP72基因序列的高度保守区域设计特异性引物,建立PCR方法,分析检测极限是每反应60个核酸拷贝,同时与猪其他几种重要病原无交叉反应。当检测来自不同区域的4种基因型(Ⅰ、Ⅴ、Ⅷ、Ⅸ)的14株ASFV毒株时,新的PCR方法比两种OIE推荐的PCR方法更灵敏。新的PCR检测从乌干达收集的62份临床血样,与基于超灵敏通用探针库的荧光定量PCR表现出了很高的一致性(59/62)。相比于其他的抗原检测技术,如酶联免疫吸附试验(Enzyme-linked Immunosorbent Assay, ELISA)和直接荧光抗体技术,PCR方法具有更高的敏感性和特异性。
表1 常用分子生物学检测方法比较
Table1 Comparison of frequently-used molecular biology detection technologies

缺点Disadvantages PCR PCR和荧光定量PCR 最常用的检测方法,特异性强、灵敏度高,样品处理简单,操作方便快捷检测类别Types of detection检测技术Technologies优点Advantages对仪器设备依赖高,现场快速诊断较困难,容易受到污染出现假阳性结果等温扩增类Isothermal amplification LAMP RAA RPA CPA PCLSR操作简便、灵敏度高、特异性强,对检测设备要求低,检测速度快,结果判定简单,适用于现场快速诊断容易造成气溶胶污染,同时反应温度单一,易出现假阳性结果;因为酶的制备工艺,现检测成本较荧光PCR高
1.2 荧光定量PCR(RT-PCR)
RT-PCR因其高敏感性和特异性,已开发很多稳定成熟的商业化产品,并在各专业实验室和基层检测实验室得到广泛应用。2019年6月农业农村部公布了第二批非洲猪瘟现场快速检测试剂名单,包括26个单位的34种产品,其中80%以上都为荧光定量PCR类,引物和探针都是根据病毒基因组中高保守区域VP72设计。
ASF和猪瘟及其他高热病仅从临床症状上难以区分,多重荧光定量PCR能实现多种病原同时检测,用于临床疾病的鉴别诊断,缩减检测成本。王建华等[7]根据ASFV CP530R基因、猪瘟病毒5' UTR基因和高致病性蓝耳病NSP2基因,分别设计了3对特异性引物和Taq Man水解探针,建立了多重荧光定量PCR方法,并对其反应条件进行优化。该方法对ASFV的最低检出量为每微升61拷贝。有研究者将悬浮阵列系统、自动电子微阵列分析、GenomeLab基因表达谱(GeXP)分析等方法与荧光PCR技术结合,能一次检测7种猪常见病原,极大提高了检测效率,但检测的敏感性有待提高[8-10]。RT-PCR方法敏感性高,检测过程中需规范操作,否则易出现污染,干扰检测结果。
1.3 数字PCR
微滴数字PCR(ddPCR)是近年兴起的一种新的绝对定量技术,通过极度稀释实现理论上的单分子扩增,然后利用PCR和泊松分布计算出样品的原始浓度,ddPCR是继普通PCR、RT-PCR之后的第三代PCR技术。
邬旭龙等[11]针对ASFV K205R基因设计了1对特异性引物和Taq Man探针,通过反应条件优化,建立了ASFV ddPCR检测方法,该方法最低检测限度可达到0.36拷贝,在20μL反应体系中约为10拷贝/反应,检测灵敏度是RT-PCR的10倍。原霖等[12]建立ddPCR方法的最低检测限可达每微升0.8拷贝,敏感性高于RT-PCR方法。但目前ddPCR检测成本较RT-PCR高。
1.4 等温扩增技术
等温扩增技术无需反复的热循环和精密的仪器,只需要恒温装置(如水浴锅)就能进行快速高效的扩增反应。该技术自出现以来就得到了迅猛发展,有望成为未来检测发展的新趋势。等温扩增技术检测ASFV操作简便,对检测仪器的要求低,反应时间短,有自身特有的优势,但因缺乏热循环过程中变性、退火等程序,检测过程中易出现假阳性,因此仅适用于田间疾病初步筛查,这在一定程度上限制了等温扩增技术的应用。目前相关检测试剂盒中酶的成本较高,单个样品检测费用较普通荧光PCR高。
1.4.1 环介导等温扩增技术(Loop mediated isothermal amplification,LAMP) LAMP是Notomi等[13]于2000年首先提出的一种新型的等温核酸扩增技术,该法使用4条引物(外引物F3/B3、内引物FIP/BIP)来识别6个特异性DNA结合位点,以及链置换功能的Bst DNA聚合酶来实现核酸的扩增检测。田纯见等[14]利用ASFV高度保守的非结构DNA聚合酶G1211R基因制备质粒标准品,建立实时荧光LAMP方法,以ASFV E70株病毒核酸为模板,LAMP检测灵敏度达到21 pg。James等[15]针对ASFV拓扑异构酶Ⅱ基因建立LAMP方法,分析灵敏度能达到330个基因组拷贝,并且能够检测多个ASFV的代表性分离株而不与CSFV交叉反应。检测实验感染ASFV(马拉维分离株)的猪只的血液和组织样品显示,LAMP测定和RT-PCR之间具有良好的一致性。除了使用琼脂糖凝胶或RT-PCR机器检测反应产物外,还可以使用新型侧向流动装置检测生物素和荧光素双标记的ASFV LAMP扩增子。
1.4.2 重组酶介导核酸扩增技术(Recombinaseaid amplification,RAA) RAA利用37℃恒温,将从细菌或真菌中获得的重组酶与引物DNA紧密结合,形成酶和引物的聚合体,当引物在模板DNA上搜索到与之完全互补的序列时,在单链DNA结合蛋白(Single- stranded DNA binding,SSB)的帮助下使模板 DNA解链,并在DNA聚合酶的作用下形成新的DNA互补链,扩增产物以指数级增长[16]。
农业农村部公布的第二批非洲猪瘟现场快速检测试剂盒名单中有两款荧光RAA检测试剂盒,分别来自中国农业科学院兰州兽医研究所和广州悦洋生物技术有限公司。其中前者的RAA检测试剂盒采用冻干工艺,制备RAA酶混合干粉,从DNA快速提取到RAA快速检测可在30 min内完成。若阴性对照无Ct值且无扩增曲线,阳性对照Ct值<30有对数扩增曲线,为有效结果;在结果有效的前提下,待检样品有对数扩增曲线,且Ct值≤35,判定为非洲猪瘟病毒核酸阳性;若Ct值>39或无数值,则判为阴性;若35<Ct值≤39,则为可疑样品,需对样品重新检测,如仍为可疑,则判为阳性,否则为阴性。目前已有RAA法检测塞内卡病毒、沙门菌、疟原虫等的报道。
1.4.3 重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA) RPA是一种新型的等温核酸扩增技术,其与RAA原理基本相似,但前者重组酶来自T4噬菌体,后者来源于细菌或真菌,各种酶共同作用取代普通PCR热循环解链过程,从而大大缩短反应时间。实时荧光RPA法结合一个便携式的等温扩增仪可在15 min内获得检测结果,检测时间和便利性优于传统PCR法。目前已有用RPA法检测A型流感病毒、水泡性口炎等的报道。Miao等[17]利用RPA方法扩增ASFV p72基因,同时结合侧流试纸检测,敏感度为150拷贝/反应,38℃下10 min即可完成检测,对145个田间样品进行检测,结果与RT-PCR检测结果完全吻合。哈登楚日亚等[18]也针对ASFV p72建立了实时荧光RPA方法,可检测10个拷贝的DNA分子,与Miao等的方法相比灵敏度提高了10多倍。
1.4.4 交叉引物扩增法(Cross-priming isothermal amplification,CPA) CPA是针对靶基因区域内设计3对特异引物,引物尾端交叉互换序列,利用链置换DNA聚合酶在恒温条件下即可完成核酸扩增反应。Frączyk等[19]针对P72基因,利用CPA扩增猪血液中的ASFV,单个样品中最低能检测到7.2个拷贝,与官方通用探针文库(UPL)实时PCR相比,具有相同的灵敏度。Gao等[20]建立了一种CPA-诊断试纸联用方法,该研究基于p72基因设计引物及探针,两个探针分别标记生物素和FITC。该方法最低检测限为200拷贝,对45份非洲疫区临床全血DNA样品检测的结果显示,该方法与RT-PCR的符合率为 97.8 %(44/45)。
1.4.5 聚合酶交联螺旋反应(Polymerase crosslinking spiral reaction,PCLSR) PCLSR是一种等温扩增的新技术,将传统PCR或RT-PCR的优势与等温扩增的的优势结合在一起。外部引物的5'-末端互补于α-拉特罗毒素的远端基因,可保护反应的初始步骤。比较LAMP、CPA和PCLSR发现,PCLSR具有更高的诊断特异性。Woźniakowski等[21]利用聚合酶交联螺旋反应,针对p72基因设计3种引物,在65℃下反应产生交联的复杂结构。使用SYBR Green I染料进行凝胶电泳,观察PCLSR的结果,灵敏度达到每微升720拷贝。试验结果需将扩增产物开盖后进行凝胶电泳观察,气溶胶污染的可能性大,因此不适合基层实验室使用。
1.5 其他技术
随着科技进步,出现了很多新的检测方法,如液态芯片技术、生物传感器技术等。Wang等[22]建立了一种液态芯片技术Luminex xMAP,设计针对病原体核酸的特异性探针与引物,将探针与荧光羧化微球偶联,能同时检测包括ASFV在内的10种昆虫传播的病原体,每个反应能检测到10个目标基因拷贝。Biagetti等[23]使用生物传感器检测血液中的ASFV核酸,利用具有锁定核酸核苷酸的单链DNA探针作为p72基因保守区域的互补识别元件,其能检测每微升373~1058拷贝范围内的DNA,在此范围内该生物传感器的检测结果与OIE推荐的RT-PCR检测结果有极好的相关性。
要获得检测的时效性,养殖基地现场检测很重要,因此研究者也在检测仪器设备改进、样品处理调整等方面开展研究,使其更适合于基层检测要求。Liu等[24]开发了一种双重实时PCR检测方法,用于快速检测和分析ASFV和CSFV,该测定在便携式电池供电的PCR热循环仪上进行。张彩虹等[25]根据VP72基因序列建立ASFV的RT-PCR方法,采集的样品无需提取核酸,可在60 min内完成对样品的检测。便携式荧光PCR仪和核酸免提取技术,为野外或现场的非洲猪瘟病毒快速检测提供了一种切实可行的方法。
2 免疫学检测
病毒入侵机体后,机体识别“自身”与“非己”抗原,针对“非己”抗原产生特异性的免疫反应。据报道,ASF的自然感染潜伏期为4~19 d,在临床症状出现2 d前,ASF感染动物开始散播大量病毒,ASFV散播因毒株不同而异。机体感染ASFV后约7~9 d血清转阳,抗体阳性可持续终生,亚急性及慢性感染猪血液中的带毒量随着时间推移会逐渐降低,此时抗体检测显示出意义,猪场新引进的种猪除核酸检测阴性外还需抗体检测阴性。常用的免疫学方法有红细胞吸附反应(Haemadsorption,HA)、酶联免疫吸附试验(Enzyme-linked Immunosorbent Assay,ELISA)、免疫层析试纸条法、免疫印迹试验(Immunoblotting,IB)等,各检测方法的优缺点比较见表2。
表2 ASFV免疫学检测方法比较
Table2 Comparison of ASFV immunology detection technologies
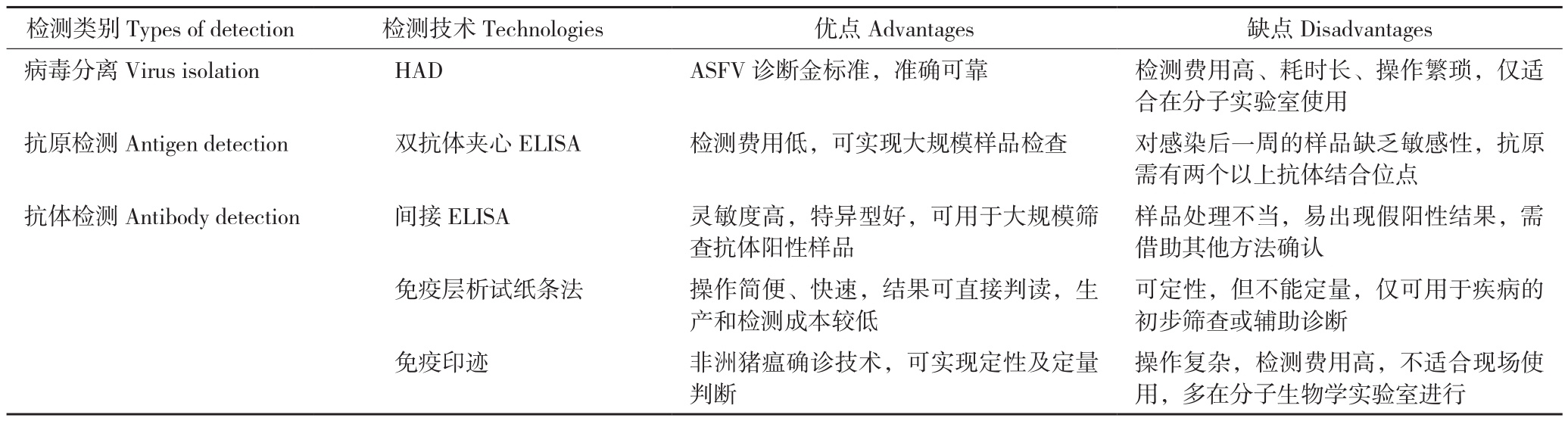
检测类别Types of detection 检测技术Technologies 优点Advantages 缺点Disadvantages病毒分离Virus isolation HAD ASFV诊断金标准,准确可靠 检测费用高、耗时长、操作繁琐,仅适合在分子实验室使用抗原检测Antigen detection 双抗体夹心ELISA 检测费用低,可实现大规模样品检查 对感染后一周的样品缺乏敏感性,抗原需有两个以上抗体结合位点抗体检测Antibody detection 间接ELISA 灵敏度高,特异型好,可用于大规模筛查抗体阳性样品样品处理不当,易出现假阳性结果,需借助其他方法确认免疫层析试纸条法 操作简便、快速,结果可直接判读,生产和检测成本较低可定性,但不能定量,仅可用于疾病的初步筛查或辅助诊断免疫印迹 非洲猪瘟确诊技术,可实现定性及定量判断操作复杂,检测费用高,不适合现场使用,多在分子生物学实验室进行
2.1 HA
HA即在体外培养时受ASFV感染的白细胞周围吸附猪红细胞,形成“玫瑰花环”,该法是ASFV特有的检测技术。Rod rí guez等[26]研究发现,ASFV基因组内一个开放阅读框EP402R编码的多肽(该多肽有402个氨基酸残基,与T细胞粘附受体CD2同源,EP402R的转录发生在病毒复制的后期)直接参与血细胞吸附现象。将EP402R内一段长354 bp的片段破坏后,病毒的体外生长速率不受影响,但血细胞吸附现象消失。由于HA的特异性和敏感性,该法可用来评估疑似暴发,特别是当其他检测为阴性时,应该用HA方法进行确诊。需要注意的是,并非所有ASFV都能产生HA。HA因操作复杂,检测周期长,目前仅在专业实验室内进行。
2.2 ELISA
ELISA是一种敏感、快速、实惠的检测技术,尤其适合于流行病学调查、疫病监测与净化时的自动化血清学检测。因此,ELISA是目前非洲猪瘟大规模血清学研究最适用的方法,其包括抗原检测和抗体检测。
Vidal等[27]利用针对P72的单克隆抗体结合固相夹心ELISA以检测猪样品中的P72蛋白,能检测的最低抗原浓度为0.05μg/mL,低于使用多克隆抗体获得的0.6μg/mL检测限。用该方法检测全病毒颗粒的敏感性为2.3×102 PFU/ mL。Gim é nez-lirola等[28]选定 p30 作为间接 ELISA中使用的重组蛋白,能够检测血清或口腔液样本中的ASFV抗体。实验条件下对猪只接种ASFV,8~12 d后采用优化的ELISA方法可从采集的猪血清和口腔液样品(血清样品以1∶100稀释,口腔液样品以1∶2稀释)中检测到抗p30抗体。对非疫区猪群的血清(n = 200)和口腔液(n = 200)田间样品的测试表明,该方法具有高度特异性。
然而,由于血清成分复杂及缺乏特异性试剂等原因导致ELISA经常出现假阳性或假阴性,尤其当样品处理或保存不当,如溶血样品可能产生高达20%的假阳性结果,故通过ELISA检测为阳性的可疑样品须通过其他血清学替代试验确认,如IB。
2.3 免疫层析试纸条法
免疫层析技术是一种固相免疫标记技术,具有操作简单,反应灵敏迅速,结果判定直观,无需特殊设备和专业人员等优点。较经典的即时检测主要以胶体金作为标记物,以检测线和质控线显色情况及深浅进行定性及半定量检测,不能实现完全定量。吴海涛等[29]利用胶体金标记的ASFV P72蛋白单克隆抗体包被硝酸纤维素膜,以识别两种原核表达的P72蛋白,对两种抗原的最低识别量分别为15、21 ng,经测试该试纸条的特异性、敏感性、稳定性表现良好。张鑫宇等[30]建立ASFV p54抗体的胶体金检测方法,该试纸条的敏感性为200 ng/mL,可在5~10 min内判定试验结果。对141份猪血清样品进行对比检测表明,在ASFV感染早期,胶体金试纸优于OIE推荐的间接ELISA检测方法;以Western Blot检测方法作为参照,该试纸条检测疫区阳性样品的符合率比ELISA高。Sastre等[31]开发了用于抗原检测的侧向流动测定(Lateral flow assay,LFA),将针对VP72蛋白的单克隆抗体与黑色乳胶珠共价结合,可在10 min内判定结果。测定血液中抗体的灵敏度为3 ng,与市售的双抗体夹心ELISA相当。当使用组织培养病毒进行测试时,检测限低至104 PFU/mL。LFA的灵敏度低于RT-PCR,在检测田间样品时假阴性比例高。有研究者利用试纸条法实现多种病原抗体同时检测,Sastre等[32]利用双重侧向流动法,将VP72蛋白和CSFV的E2蛋白与不同颜色乳胶微球耦合,可同时检测血液样品中的ASFV和CSFV抗体。
新型试纸检测技术向着多靶标、高敏感性检测等方向发展,出现用于提高试纸敏感性的新材料,如量子点、磁颗粒、荧光微球等。量子点又称作纳米晶,相对于传统的有机染料,量子点标记材料具有更好的光稳定性、窄且对称的发射光谱、高的发光强度及更长的荧光寿命。林彦星等[33]将ASFV VP73蛋白的抗原性多肽作为试纸条检测线的包被抗原,采用量子点作为标记材料对葡萄球菌蛋白A(SPA)进行标记,以抗SPA的多克隆抗体作为质控线的包被蛋白,制备快速检测ASFV抗体的量子点免疫层析试纸条。结果表明,所制备的试纸条与常见相关猪疫病阳性血清无交叉反应,与进口ELISA试剂盒对临床样品的检测符合率为100%。
试纸条法检测结果容易受到样品质量的影响,如样品来自死亡或者捕杀动物的尸体,或血液样品出现溶血等都会导致结果不准确,因此试纸条法仅适用于检测条件缺乏地区的ASF初步筛查。
2.4 IB
IB技术适用于蛋白质检测和鉴定。该技术快速、灵敏,其原理是抗原抗体的特异性结合,操作相对复杂,适合于专业检测实验室使用。当血清样品疑似保存较差时推荐使用这种方法。ASFV感染动物后会刺激机体产生针对多种病毒蛋白的抗体,可通过IB试验检测到。Kazakova等[34]使用高度纯化的重组p30蛋白开发免疫印迹试验系统(Rec p30-IB),Rec p30-IB测试结果显示,该方法的诊断特异性和灵敏度分别为98.75%和100.00%,可用于免疫系统器官样本及血清中ASFV的特异性抗体检测。
Alcaraz等[35]利用大肠杆菌表达p54蛋白建立了ASFV的IB检测技术,证实ELISA检测ASFV特异性抗体中获得的阳性结果。重组蛋白质印迹试验是高度特异性的,并且对ASFV感染的猪只检测同样敏感,新的蛋白质印迹试验消除了常规技术使用抗原中含细胞化合物产生的假阳性反应的可能性,并且避免了在抗原生产中使用活病毒。
3 讨论
由于ASF尚无可用疫苗,ASFV抗体阳性即表明现在或曾经发生了感染。此外,ASFV抗体在感染早期即可出现并可持续数年。然而,在最急性和急性感染中,猪通常在抗体转为阳性前已死亡。因此,在疫病暴发的早期阶段,建议采集样品检测病毒核酸或抗原。但随着一种疾病在某地的长时间流行,亚急性感染和耐过猪只增多,此时抗体检测显示出意义。
1979—1981年巴西与伊比利半岛有3.5%和0.6%的暴发案例源于ASFV感染后耐过转为血清阳性存活猪只带毒传播造成的[36-37]。近年西非坦桑尼亚3.72%猪只感染ASFV后呈现无症状但血清阳性,并在1年后导致新的暴发[38]。我国非洲猪瘟的疫情史较短,目前流行的主要是强毒株,但非洲猪瘟短期内在我国较难清除,巴西净化非洲猪瘟所用时间最短也耗时7年。随着病毒和宿主的相互适应进化,出现病毒毒力由强到弱也不无可能。在欧洲已有非洲猪瘟基因Ⅱ型病毒株由强毒力转变为中等毒力的报道[39],这一转变表明病毒的致死率降低,临床症状更温和,猪只出现耐受,长时间后血液带毒量低,而抗体能在猪体内留存多年甚至可终生存在,检测时效性更长。未来ASFV疫苗面世后,也可利用抗体监测来反映疫苗免疫效果。
为更好应对非洲猪瘟疫情,农业农村部鼓励各规模化猪场进行自检。目前RT-PCR检测的灵敏度高,在各基层检测实验室应用较多。但由于检测实验室未严格分区,专业检测人员缺乏,容易发生实验室气溶胶污染,导致结果不准或检测中断。ASFV检测在基层的广泛应用依赖于对病原特性进一步研究,寻找特异性好、灵敏度高且更适用于田间检测的技术。ASF作为外来动物疫病,使我国养猪业损失惨重,此次灾难也促进各地猪场生物安全防控的全面升级改造,从控制传染源、切断传播途径、保护易感动物等各方面来控制疫情传播扩散。我们需积极从ASF防控中吸取经验教训,采取系统化措施控制外来疫病,稳定畜牧业生产。
[1]GALINDO I, ALONSO C.African swine fever virus: A review[J].Viruses, 2017(9):103.
[2]QUEMBO C J, JORI F, VOSLOO W, HEATH L.Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype[J].Transboundary and Emerging Diseases, 2018,65(2):420-431.
[3]ZHAO D, LIU R, ZHANG X, LI F, WANG J, ZHANG J, LIU X, WANG L, ZHANG J, WU X, GUAN Y, CHEN W, WANG X, HE X, BU Z.Replication and virulence in pigs of the fi rst African swine fever virus isolated in China[J].Emerging Microbes & Infections, 2019,8:438-447.
[4]ROWLANDS R J, MICHAUD V, HEATH L, HUTCHINGS G, OURA C, VOSLOO W, DWARKA R, ONASHVILI T, ALBINA E, DIXON L K.African swine fever virus isolate, Georgia, 2007[J].Emerging Infectious Diseases, 2008,14(12):1870-1874.doi:10.3201/eid1412.080591.
[5]SANCHEZ-CORDON P J, MONTOYA M, REIS A L, DIXON L K.African swine fever: a re-emerging viral disease threatening the global pig industry[J].Veterinary Journal, 2018,233:41-48.doi:10.1016/j.tvjl.2017.12.025
[6]LUO Y, ATIM S A, SHAO L, AYEBAZIBWE C, SUN Y, LIU Y, JI S,MENG X Y, LI S, LI Y, MASEMBE C, STÅHL K, WIDÉN F, LIU L,QIU H J.Development of an updated PCR assay for detection of African swine fever virus[J].Archives of Virology, 2017,162(1):191-199.doi:10.1007/s00705-016-3069-3.
[7]王建华,陈小金,赵丹,王玉玲,张俊哲,肖妍,董志珍,赵祥平.非洲猪瘟病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒多重TaqMan荧光定量RT-PCR检测方法的建立[J].中国预防兽医学报, 2017,39(11):907-911.doi:10.3969/j.issn.1008-0589.201611038.WANG J H, CHEN X J, ZHAO D, WANG Y L, ZHANG J Z, XIAO Y,DONG Z Z, ZHAO X P.Establishment of multiplex TaqMan-MGB realtime RT-PCR for detection of classical swine fever virus, african swine fever virus, and porcine reproductive and respiratory syndrome virus[J].Chinese Journal of Preventive Veterinary Medicine, 2017,39(11):907-911.doi:10.3969/j.issn.1008-0589.201611038.
[8]XIAO L, WANG Y, KANG R, WU X, LIN H, YE Y, YU J, YE J, XIE J, CAO Y, WEI Y, LIAO D, PAN M, LIN Y, DAI Z, LI X.Development and application of a novel Bio-Plex suspension array system for highthroughput multiplexed nucleic acid detection of seven respiratory and reproductive pathogens in swine[J].Journal of Virological Methods,2018,261:104-111.
[9]ERICKSON A, FISHER M, FURUKAWA-STOFFER T, AMBAGALA A, HODKO D, PASICK J, KING D P, NFON C, ORTEGA P R, LUNG O.A multiplex reverse transcription PCR and automated electronic microarray assay for detection and differentiation of seven viruses affecting swine[J].Transboundary and Emerging Diseases,2018A,65(2):e272-e283.doi:10.1111/tbed.12749.
[10]HU L, LIN X, NIE F, YANG Z X, YAO X, LI G, WU X, REN M,WANG Y.Simultaneous typing of seven porcine pathogens by multiplex PCR with a GeXP analyser[J].Journal of Virological Methods,2016,232:21-28.doi:10.1016/j.jviromet.2015.12.004.
[11]邬旭龙,肖璐,宋勇,林华,陈世界,杨苗,安微,姚学萍,杨泽晓,王印.非洲猪瘟病毒微滴数字PCR(ddPCR)方法的建立及应用[J].微生物学通报,2017,44(12):2839-2846.doi:10.13344/j.microbiol.china.170502.WU X L, XIAO L, SONG Y, LIN H, CHEN S J, YANG M, AN W, YAO X P, YANG Z X, WANG Y.A novel high-sensitivity droplet digital PCR(ddPCR)for detection of African swine fever virus[J].Microbiology China, 2017,44(12):2839-2846.doi:10.13344/j.microbiol.china.170502.
[12]原霖,董浩,倪建强,刘洋,陈亚娜,杨林,宋晓晖,王传彬.非洲猪瘟病毒微滴数字PCR检测方法的建立[J].畜牧与兽医,2019,7:81-84.YUAN L, DONG H, NI J Q, LIU Y, CHEN Y N, YANG L, SONG X H,WANG C B.Development of droplet digital PCR for detecting African swine fever virus[J].Animal Husbandry & Veterinary Medicine,2017,44(12):2839-2846.
[13]NOTOMI T, OKAYAMA H, MASUBUCHI H, YONEKAWA T,WATANABE K, AMINO N, HASE T.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research, 2000,28(12):E63.
[14]田纯见,杨舒展,段喻燕,刘志玲,林志雄,罗琼,陈茹.非洲猪瘟病毒非结构基因实时荧光LAMP检测方法的建立[J].动物医学进展,2017,38(11):1-5.doi:10.16437/j.cnki.1007-5038.2017.11.001.TIAN C J, YANG S Z, DUAN Y Y, LIU Z L, LIN Z X, LUO Q, CHEN R.Establishment of loop-mediated isothermal amplification for detecting non-structural gene of African Swine Fever Virus[J].Progress in Veterinary Medicine, 2017,38(11):1-5.doi:10.16437/j.cnki.1007-5038.2017.11.001.
[15]JAMES H E, EBERT K, MCGONIGLE R, REID S M, BOONHAM N, TOMLINSON J A, HUTCHINGS G H, DENYER M, OURA C A, DUKES J P, KING D P.Detection of African swine fever virus by loop-mediated isothermal amplification[J].Journal of Virological Methods, 2010,164(1-2):68-74.
[16]吕蓓,程海荣,严庆丰,黄震巨,沈桂芳,张志芳,李轶女,邓子新,林敏,程奇.用重组酶介导扩增技术快速扩增核酸[J].中国科学:生命科学,2010,40(10):983- 988.LV B, CHENG H R, YAN Q F, HUANG Z J, SHEN G F, ZHANG Z F,LI Y N, DENG Z X, LIN M, CHENG Q.Rapid and sensitive method for detecting DNA using recombinase- aid amplification[J].Scientia Sinica(Vitae), 2010,40(10):983- 988.
[17]Miao F, Zhang J, Li N, Chen T, Wang L, Zhang F, Mi L, Zhang J,Wang S, Wang Y, Zhou X, Zhang Y, Li M, Zhang S, Hu R.Rapid and sensitive recombinase polymerase amplification combined with lateral flow strip for detecting African Swine Fever Virus[J].Frontiers in Microbiology, 2019,10:1004.doi:10.3389/fmicb.2019.01004.
[18]哈登楚日亚,樊晓旭,赵永刚,王淑娟,张志诚,戈胜强,李林,吴晓东,王志亮.非洲猪瘟病毒实时荧光重组酶聚合酶扩增技术(RPA)检测方法的建立[J].中国畜牧兽医,2017,44(11):3270-3277.doi:10.16431/j.cnki.1671-7236.2017.11.023.HADENG C R Y, FAN X X, ZHAO Y G, WANG S J, ZHANG Z C, GE S Q, LI L, WU X L, WANG Z L.Establishment of a real-time fluorescent recombinase polymerase amplification(RPA)for the detection of African Swine Fever Virus[J].China Animal Husbandry, 2017,44(11):3270-3277.doi:10.16431/j.cnki.1671-7236.2017.11.023.
[19]FRARĄCZYK M, WOŹNIAKOWSKI G, KOWALCZYK A,NIEMCZUK K, PEJSAK Z.Development of cross-priming amplification for direct detection of the African Swine Fever Virus,in pig and wild boar blood and sera samples[J].Letters In Applied Microbiology, 2016,62(5):386-391.doi:10.1111/lam.12569.
[20]GAO Y, MENG X Y, ZHANG H W, LUO Y Z, SUN Y, LI Y F,ABID M, QIU H J.Cross-priming amplification combined with immunochromatographic strip for rapid on-site detection of African swine fever virus[J].Sensors and Actuators B: Chemical, 2018,274:304-309.doi:10.1016/j.snb.2018.07.164.
[21]WOŹNIAKOWSKI G, FRĄCZYK M, KOWALCZYK A, POMORSKAMÓL M, NIEMCZUK K, PEJSAK Z.Polymerase cross-linking spiral reaction(PCLSR)for detection of African swine fever virus(ASFV)[J].Scienti fi c Reports, 2017,7:42903.
[22]WANG H Y, WU S Q, JIANG L, XIAO R H, LI T, MEI L, LV J Z, LIU J J,LIN XMM, HAN X Q.Establishment and optimization of a liquid bead array for the simultaneous detection of ten insect-borne pathogens[J].Parasit Vectors, 2018,11(1):442.
[23]BIAGETTI M, CUCCIOLONI M, BONFILI L, CECARINI V,SEBASTIANI C, CURCIO L, GIAMMARIOLI M, DE M G M,ELEUTERI A M, ANGELETTI M.Chimeric DNA/LNA-based biosensor for the rapid detection of African swine fever virus[J].Talanta, 2018,184:35-41.
[24]LIU L, LUO Y, ACCENSI F, GANGES L, RODRÍGUEZ F, SHAN H, STÅHL K, QIU J, BELÁK S.Pre-clinical evaluation of a realtime pcr assay on a portable instrument as a possible field diagnostic tool: experiences from the testing of clinical samples for African and classical Swine Fever Viruses[J].Transboundary and Emerging Diseases, 2017,64(5):e31-e35.
[25]张彩虹,杨俊兴,林彦星,刘建利,曹琛福,史卫军,花群义.非洲猪瘟病毒免提取核酸荧光定量PCR检测方法的建立[J].中国兽医科学,2019,9:1-7.doi:10.16656/j.issn.1673-4696.2019.0174.ZHANG C H, YANG J X, LIN Y X, LIU J L, CAO C F, SHI W J, HUA Q Y.Development of a direct real-time PCR assay freed from DNA extraction for detection of African swine fever virus[J].Chinese Veterinary Science, 2019,9:1-7.doi:10.16656/j.issn.1673-4696.2019.0174.
[26]RODRÍGUEZ J M, YÁÑEZ R J, ALMAZÁN F, VIÑUELA E,RODRIGUEZ J F.African swine fever virus encodes a CD2 homolog responsible for the adhesion of erythrocytes to infected cell[J].Journal of Virology, 1993, 67(9):5312-5320..
[27]VIDAL M I, STIENE M, HENKEL J, BILITEWSKI U, COSTA J V,OLIVA A G.A solid-phase enzyme linked immunosorbent assay using monoclonal antibodies, for the detection of African swine fever virus antigens and antibodies[J].Journal of Virological Methods, 1997, 66(2):211-218.doi:10.1016/s0166-0934(97)00059-1.
[28]GIMÉNEZ-LIROLA L G, MUR L, RIVERA B, BILITEWSKI U,COSTA J V, OLIVA A G.Detection of African Swine Fever Virus antibodies in serum and oral fluid specimens using a recombinant Protein 30(p30)dual matrix indirect ELISA[J].PLoS One, 2016,11(9):e0161230.
[29]吴海涛,成大荣,吴萌,左伟勇,洪伟鸣.非洲猪瘟病毒胶体金免疫层析试纸条的研制[J].黑龙江畜牧兽医,2018, 17:126-128.WU HT, CHENG DR, WU M, ZUO W Y, HONG W M.Development of immunochromatographic strip for the detection of African swine fever virus[J].Heilongjiang Animal Science and Veterinary Medicine,2018,17:126-128.
[30]张鑫宇,左伟勇,朱善元,朱善元,夏晓莉,孙怀昌.非洲猪瘟病毒p54抗体胶体金试纸检测方法的建立[J].中国预防兽医学报,2014,4:281-285.doi:10.3969/j.issn.1008-0589.2014.04.07.ZHANG X Y, ZUO W Y, ZHU S Y, ZHU S Y, XIA X L, SUN H C.Establish of colloidal gold strip for detecting antibody against African swine fever virus[J].Chinese Journal of Preventive Veterinary Medicine, 2014,4:281-285.doi:10.3969/j.issn.1008-0589.2014.04.07.
[31]SASTRE P, GALLARDO C, MONEDERO A, RUIZ T, ARIAS M,SANZ A, RUEDA P.Development of a novel lateral flow assay for detection of African swine fever in blood[J].BMC Veterinary Research, 2016,12:206.
[32]SASTRE P, PÉREZ T, COSTA S, YANG, RÄBER A, BLOME S,GOLLER K V, GALLARDO C, TAPIA I, GARCÍA J, SANZ A, RUEDA P.Development of a duplex lateral flow assay for simultaneous detection of antibodies against African and Classical swine fever viruses[J].Journal of Veterinary Diagnostic Investigation, 2016,28(5):543-549.
[33]林彦星,曹琛福,张彩虹,孙 洁,杨俊兴,廖立珊,黄超华,刘建利,阮周曦,吕建强,花群义.非洲猪瘟病毒抗体量子点检测试纸条的研制[J].中国兽医科学,2017,10:1214-1220.doi:10.16656/j.issn.1673-4696.2017.10.002.LIN Y X, CAO C F, ZHANG C H, SUN J, YANG J X, LIAO L S,HUANG C H, LIU J L, RUAN Z X, LV J Q, HUA Q Y.Establishment of a quantum dots-based immunochromatographic strip for detection of the antibodies against African swine fever virus[J].Chinese Veterinary Science, 2017,10:1214-1220.doi:10.16656/j.issn.1673-4696.2017.10.002.
[34]KAZAKOVA A S, IMATDINOV I R, DUBROVSKAYA O A,IMATDINOV A R, SIDLIK M V, BALYSHEV V M, KRASOCHKO P A, SEREDA A D.Recombinant protein p30 for serological diagnosis of African Swine Fever by immunoblotting assay[J].Transboundary and Emerging Diseases, 2017,64(5):1479-1492.doi:10.1111/tbed.12539.
[35]ALCARAZ C, RODRIGUEZ F, OVIEDO J M, EIRAS A, DE DIEGO M,ALONSO C, ESCRIBANO J M.Highly specific confirmatory western blot test for African swine fever virus antibody detection using the recombinant virus protein p54[J].Journal of Virological Methods,1995,52(1-2):111-9.doi:10.1016/0166-0934(94)00150-f.
[36]Mebus C A, Dardiri A H.Additional characteristics of disease caused by the African swine fever viruses isolated from Brazil and the Dominican Republic[J].Proceedings Annual Meeting of the United States Animal Health Association.1979(83):227-239.
[37]PÉREZ J, FERNÁNDEZ A I, SIERRA M A, HERRÁEZ P,FERNÁNDEZ A, MARTÍN DE LAS MULAS J.Serological and immunohistochemical study of African swine fever in wild boar in Spain[J].Veterinary Record, 1998,143(5):136-139.
[38]UTTENTHAL Å, BRAAE U C, NGOWI H A, RASMUSSEN T B,NIELSEN J, JOHANSEN M V.ASFV in Tanzania: asymptomatic pigs harbor virus of molecular similarity to Georgia 2007[J].Veterinary Microbiology, 2013,165(1-2):173-176.
[39]GALLARDO C, NURMOJA I, SOLER A, DELICADO V, SIMÓN A,MARTIN E, PEREZ C, NIETO R, ARIAS M.Evolution in Europe of African swine fever genotypeⅡviruses from highly to moderately virulent[J].Veterinary Microbiology, 2018,219:70-79.doi:10.1016/j.vetmic.2018.04.001.