【研究意义】土沉香〔Aquilaria sinensis(Lour.)Spreng.〕,别名莞香、白木香、牙香树、女儿香、栈香、青桂香、崖香、六麻树[1],为瑞香科(Thymelaeaceae)沉香属(Aquilaria Spp.)植物,是分布于热带亚热带的一种常绿乔木[2]。土沉香在受到物理、化学伤害或真菌侵染后产生具有挥发性含树脂的心材,能抑制真菌侵染并加速伤口愈合,这种含树脂的心材即为沉香[3-4],具有通便、镇静、止血与消炎等功效[5-7]。沉香是我国传统中药材,列为十大广药之一,其味辛、苦,性微温,具行气止痛、温中止呕、纳气平喘之功效,主治胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等症,此外,品闻焚烧的沉香还具有安神、镇定和促进睡眠的作用。因此,我国对沉香的需求量日益增大,近年来随着沉香价格的不断攀升,已出现不少不法商人盗挖野生土沉香的事件,从而加剧了对我国土沉香资源的破坏。为了促进对野生土沉香资源的保护,本着宜疏不宜堵的原则,应该大力加强土沉香资源的栽培及利用研究[8]。土沉香在我国自然分布于广东、广西、福建、海南、云南及香港、澳门特别行政区[9-10],在台湾、福建、四川金沙江干热河谷等地区有部分人工栽培[11]。1996年在《中华人民共和国野生植物保护条例》中被列为国家Ⅱ级保护野生植物[12]。
【前人研究进展】在自然条件下结香是一个复杂而漫长的过程,根据相关学者的研究表明,物理化学伤害或真菌侵染能够诱导土沉香产生具有抑菌活性的防御性物质沉香倍半萜和2-(2-苯乙基)色酮类化合物(沉香的主要化学成分)[13-16],这些物质与细胞其他组分复合形成的导管填充物堵塞了次生木质部的导管,从而结香[17-18]。然而由于其低速低效的结香过程,这种自然的结香方法显然不能满足日益增长的市场需求,如何更快更好地促使土沉香结香已成为当前土沉香相关研究中的热点问题,人工结香技术应运而生。人工结香技术主要包括物理伤害结香法(砍伤法、凿洞法、半断干法[19]、断枝法、打钉法[20])、接菌结香法、化学伤害结香法。
光合作用是植物体内一个重要的生理过程,对植物的生长发育至关重要。根据前人研究,植物体受损不仅减少了光合作用的叶面积,使积累的光合产物下降,并诱导产生一系列防御性物质[21-23]。传统的光合速率是通过测量植物在进行光合作用时所消耗的CO2或积累的干物质,而叶绿素荧光分析技术则是通过测量叶绿素荧光量准确获得光合作用量及相关的植物生长潜能数据[24]。目前,国际上对植物体内叶绿素荧光动力学的研究已形成热点,并在强光、高温、低温、干旱等逆境生理研究中得到广泛应用[25-27]。叶绿素荧光动力学技术在测定植物叶片光合作用过程中对光能的吸收、传递、耗散、分配等具有独特作用[28],几乎所有光合作用过程的变化均可通过叶绿素荧光反映出来[29]。
【本研究切入点】在土沉香的实际生产中,在不过度影响土沉香生长的前提下,如何通过人为干扰,促使其产生防御性物质(结香),成为土沉香结香管理的关键。在以前研究中,主要关注缺素、水分胁迫、生长调节剂以及不同光强对于土沉香光合等生理特征的影响[30-34],关于土沉香在结香过程中进行树体损伤处理的相关研究较少。【拟解决的关键问题】本研究采用改进后的物理伤害方法引发土沉香树结香,在此基础上对土沉香的光合等生理特征进行研究,并利用叶绿素荧光技术比较不同损伤处理下土沉香叶绿素荧光参数的变化。研究经过损伤处理土沉香的生长情况,可为土沉香人工结香选择最合适的处理方式提供科学依据。
1 材料与方法
1.1 试验材料
试验在东莞植物园和东莞东华园林沉香基地进行,试验对象为土沉香,均为15年树龄,随机选择土沉香树体进行试验处理。
1.2 试验方法
试验于2018年1月12、13日对土沉香进行开香门及损伤处理,设4种土沉香损伤处理:A,侧根和枝条不进行破坏处理;B,侧根、枝条破坏1/3;C,侧根、枝条破坏2/3;D,截干,将主干上的枝条全部截断,只剩主干。以上损伤处理前,供试土沉香树体均进行了开香门处理,即在主干离地面50、75、100、125 cm处砍出一个楔形缺口,深度为树干粗的1/3~1/2。每个处理随机选3棵土沉香树体,以不做任何处理(不开香门,不截枝断根)作对照。
1.3 测定项目及方法
2018年7月28、29日,对土沉香进行叶片光合参数以及叶绿素荧光参数的测定。
1.3.1 叶片光合参数测定 采用开放式气体交换Li-6400型便携式光合仪(LI-COR Inc,USA),透明叶室,测定光合参数。每天从9:00—16:00,每隔1 h测定1次各处理下标记叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(E)。
1.3.2 叶绿素荧光参数测定 利用PAM-2500(Walz Inc, GER)测定不同处理土沉香叶片的叶绿素荧光参数。在7:00—8:00之间选取植株中下部生长良好的成熟叶,所选叶片的空间取向和角度尽量一致,每株测3片叶。测定前先用暗适应夹对测试叶片进行10~15 min的暗适应,用铅笔在叶片上做好标记,以保证测定时每次都能夹在相同位置,同时确保测定时叶片的自然生长角度不变。叶片测量位置为靠近叶基部位,测量初始荧光量(F0)、最大荧光产量(Fm),再计算可变荧光产量(Fv=Fm-F0)以及PSⅡ最大光化学量子效率(Fv/Fm)、PSⅡ潜在活性(Fv/F0)。
试验数据使用Office2016软件进行处理及绘图,用R 3.4.2软件进行新复极差检验(Duncan法)。
2 结果与分析
2.1 不同损伤处理对土沉香净光合速率日变化的影响
由图1可知,总体上4种损伤处理下土沉香的光合日变化均为“双峰型”曲线,且净光合速率(Pn)峰值大致均出现在10: 00左右,4种处理的净光合速率(Pn)均高于对照,并在11: 00和13: 00时有一定幅度的下降,产生“午休”现象。
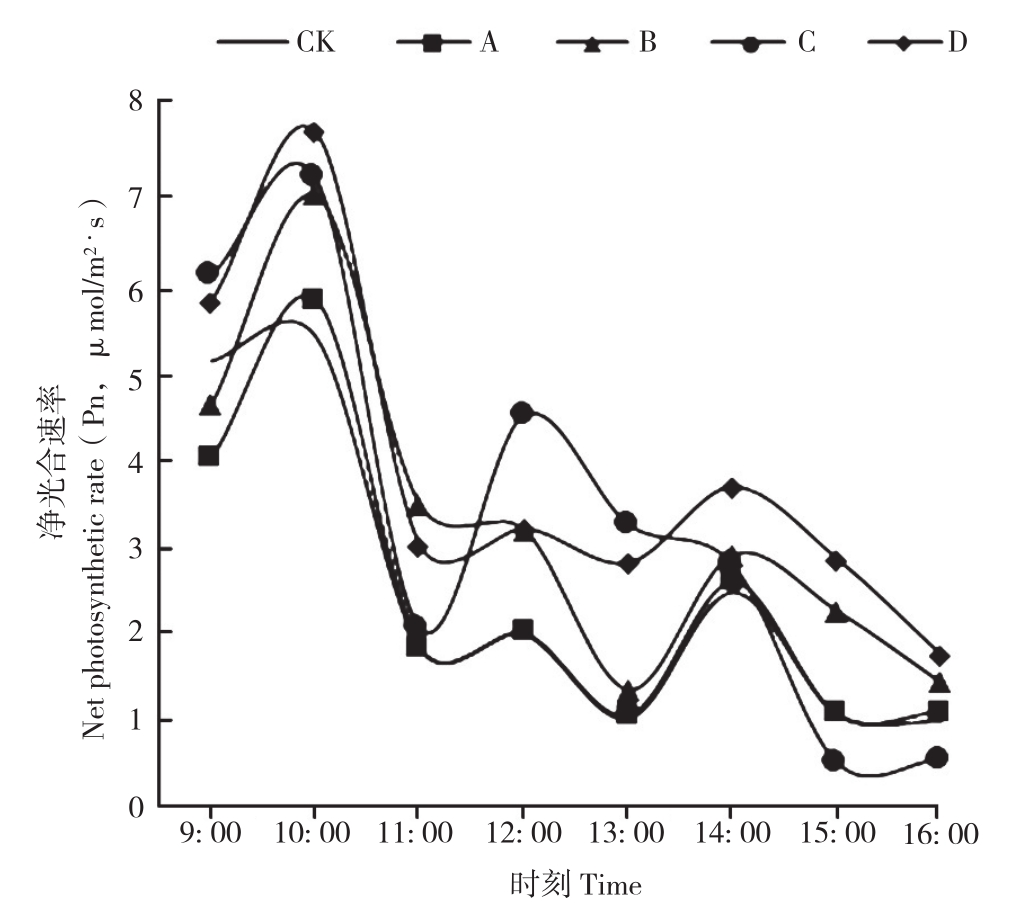
图1 不同损伤处理对土沉香净光合速率日变化的影响
Fig. 1 Effects of different damage treatments on daily variation of photosynthesis rate of Aquilaria sinensis
CK: 对照,A:不去枝去根,B:去枝去根1/3,C:去枝去根2/3,D:截干CK: Control group,A: No cutting,B: 1/3 cutting of lateral branch and lateral root,C: 2/3 cutting of lateral branch and lateral root,D: Stem cutting-off
2.2 不同损伤处理对土沉香叶片光合参数的影响
从表1可以看出,D处理下的净光合速率(Pn)与对照相比具有显著差异,而A、B、C处理与对照相比均无显著差异。其中,A处理的叶片光合参数与对照无显著差异,C处理的胞间CO2浓度(Ci)显著高于对照,B处理的蒸腾速率(E)显著高于对照,D处理显著提高了叶片的Pn、Gs、Ci、E。
表1 不同损伤处理对土沉香叶片光合参数的影响
Table 1 Effects of different damage treatments on photosynthetic characteristics of Aquilaria sinensis
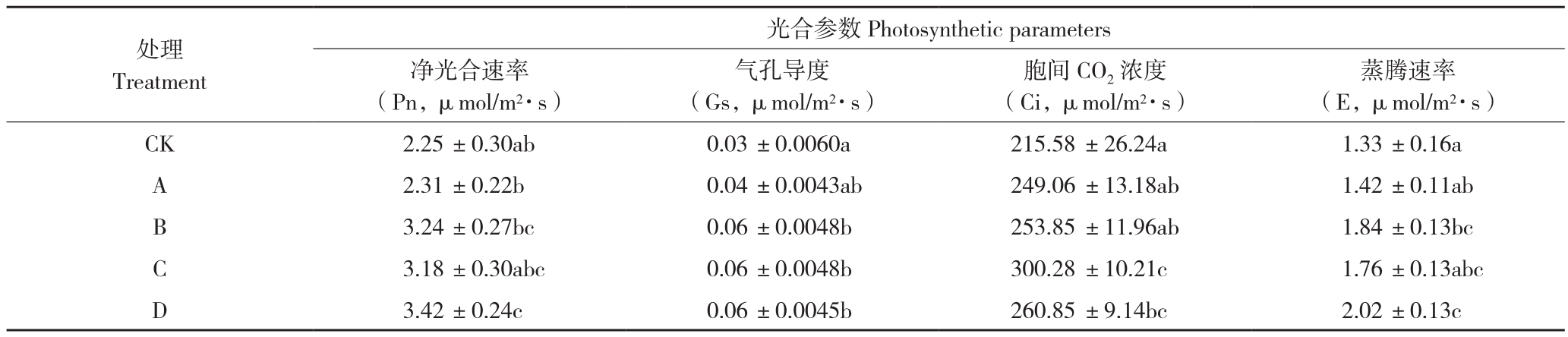
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
处理Treatment光合参数Photosynthetic parameters净光合速率(Pn,μmol/m2·s)胞间CO2浓度(Ci,μmol/m2·s)气孔导度(Gs,μmol/m2·s)蒸腾速率(E,μmol/m2·s)CK 2.25 ±0.30ab 0.03 ±0.0060a 215.58 ±26.24a 1.33 ±0.16a A 2.31 ±0.22b 0.04 ±0.0043ab 249.06 ±13.18ab 1.42 ±0.11ab B 3.24 ±0.27bc 0.06 ±0.0048b 253.85 ±11.96ab 1.84 ±0.13bc C 3.18 ±0.30abc 0.06 ±0.0048b 300.28 ±10.21c 1.76 ±0.13abc D 3.42 ±0.24c 0.06 ±0.0045b 260.85 ±9.14bc 2.02 ±0.13c
2.3 不同损伤处理对土沉香PSⅡ潜在活性(Fv/F0)的影响
由图2可知,与对照相比,A、B、C处理下土沉香叶片的PSⅡ潜在活性均无显著差异,A、B、C处理之间也无显著差异,而D处理的PSⅡ潜在活性显著高于对照。
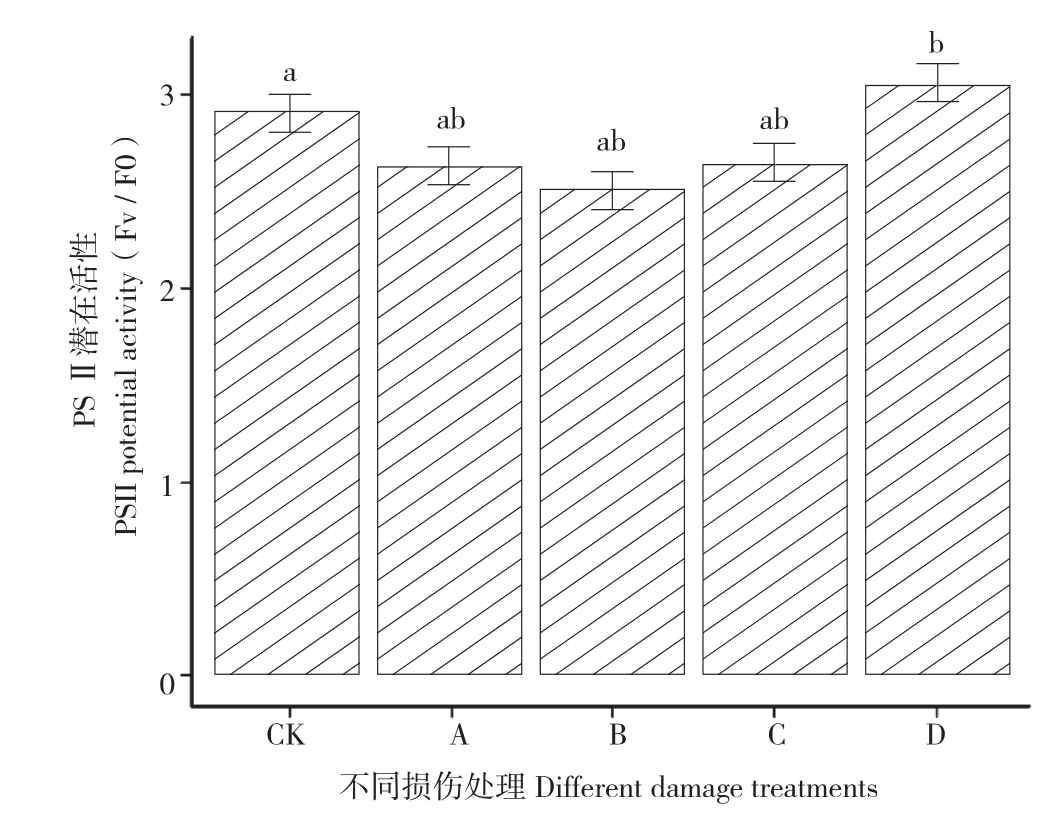
图2 不同损伤处理对土沉香Fv/F0
Fig. 2 Effects of different damage treatments on Fv/ F0 in leaves of Aquilaria sinensis
CK: 对照,A:不去枝去根,B:去枝去根1/3,C:去枝去根2/3,D:截干。CK: Control group,A: No cutting,B: 1/3 cutting of lateral branch and lateral root,C: 2/3 cutting of lateral branch and lateral root,D: Stem cutting-off
2.4 不同损伤处理对土沉香PSⅡ最大光化学效率(Fv/ Fm)的影响
最大光化学效率(Fv/ Fm)代表PSⅡ的原初光能转化效率,是表明光化学反应状况的一个重要参数,可以很好地反映植物体光损伤的程度[35]。由图3可知,与对照相比,A、B、C处理下的土沉香叶片PSⅡ最大光化学效率变化均无显著差异,而D处理下土沉香叶片PSⅡ最大光化学效率显著高于对照。
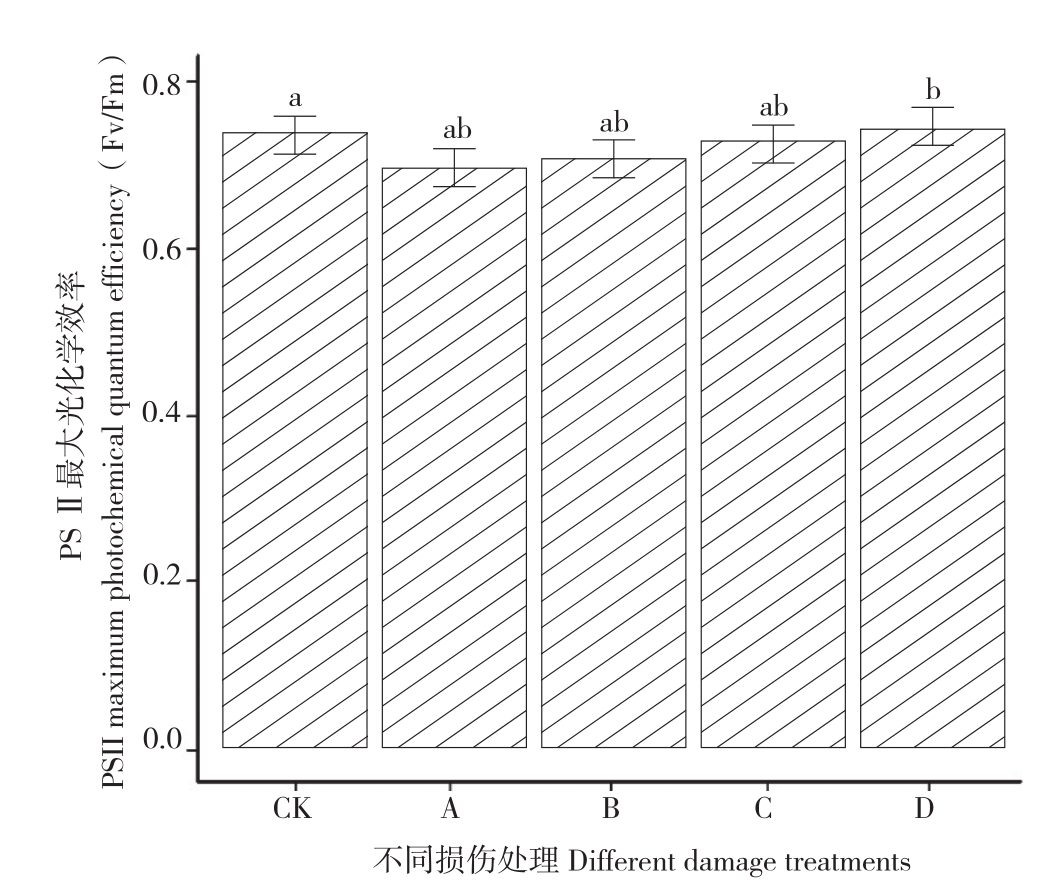
图3 不同损伤处理对土沉香Fv/ Fm的影响
Fig. 3 Effects of different damage treatments on Fv/ Fm in leaves of Aquilaria sinensis
CK: 对照,A:不去枝去根,B:去枝去根1/3,C:去枝去根2/3,D:截干CK: Control group,A: No cutting,B: 1/3 cutting of lateral branch and lateral root,C: 2/3cutting of lateral branch and lateral root,D: Stem cutting-off
3 讨论
本试验4种损伤处理下土沉香叶片的光合日变化均为双峰型,且在11: 00和13: 00均发生“午休”现象。鲁莹莹等[36]在对土沉香光合日变化特性研究时也发现了这一现象,其主要原因是由于环境中的温度及光强超过叶片光合作用的饱和点,产生了胁迫作用。高温和强光通过影响光合酶活性及蒸腾作用,使叶肉细胞失水,导致气孔完全关闭或部分关闭,从而产生了“午休”现象。
净光合速率(Pn)是衡量植物光合能力的重要指标,4种损伤处理下土沉香叶片的Pn在9: 00—10: 00之间迅速升高,在10: 00均达到一天中的峰值,这可能是由于日出后外界温度迅速上升,同时光照及湿度等因素均向着适宜叶片光合作用的状态靠近,从而导致光合速率相应增大,从而在10: 00左右时净光合速率(Pn)达到一天中的最大值;此后中午13: 00左右光辐射达到最强,温度升高,植物的蒸腾作用增强,从而导致植物叶片水汽压亏缺值(Vpdl)减小,气孔关闭,气孔导度(Gs)急速下降,植物则通过此过程减少蒸腾来维持体内水分平衡和光合作用的有效进行[37],因而Pn会逐渐下降。本试验4种处理中,仅D处理下土沉香叶片的净光合速率高于对照,原因可能是严重受损的植物有着更高的光合效率和光合能力,植物体在受到严重的外界损伤后,需要积累更多的有机物储存能量为植物体提供生存[38];A、B、C处理的净光合速率(Pn)与对照相比无显著差异,说明适度的损伤对土沉香的光合作用没有明显的影响,对其生长发育的负面影响也不严重。
本试验中,B、C、D处理下土沉香叶片的光合参数与对照相比均有显著差异,这3种处理下叶片的气孔导度(Gs)与对照相比均有显著提高,而A处理下土沉香叶片的光合参数与对照相比无显著差异,这可能是由于树体损伤后叶肉细胞的光合能力增强所致。D处理下,叶片光合能力的增加与气孔导度、蒸腾速率的增加可能一致,因为CO2的供应速度与同化速度基本保持一致,从而反映胞间CO2浓度(Ci)的变化与对照相比具有显著差异,土沉香的光合特性和荧光参数显著高于对照,增强了土沉香的光合作用。
叶绿素荧光与光合作用效率密切相关,能很好地探测植物的光抑制程度[35]。相关研究发现,任何环境因素对光合作用的影响都能通过叶绿素荧光来反映,Fv / Fm越大,表明PSⅡ的原初光能转换效率越高[39]。本试验中,D处理下Fv / Fm比对照增大,表明D处理下土沉香叶片有着最高的PSⅡ的原初光能转换效率;PSⅡ潜在活性的结果与PSⅡ的原初光能转换效率的结果相似,仅D处理比对照有增高的现象,其他处理与对照相比无显著差异。原因可能是由于D处理下植株受到的伤害更大,给植物体造成更大的生存抗胁迫的压力,需要积累更多的有机物储存能量为植物体提供生存保障,严重的损伤使得植物叶肉细胞的光合能力增强,为植物体的基本生存提供物质基础。
4 结论
本试验4种损伤处理下土沉香的光合特性和荧光参数均受到不同程度的影响,以D处理下效果显著,土沉香叶片的光合能力显著增强。A、B、C处理不会给土沉香植物体造成较大的生存抗胁迫的压力,对土沉香的生长也不会造成很大的负面影响,这说明对土沉香进行适当的伤害处理,不会对植株生长产生较大影响。而至于光合能力强弱及光合产物积累量与结香状况之间存在何种联系还有待进一步探讨。
[1] 林伟强,贺立静,谢正生. 一种值得推广的优良园林树种——白木香[J]. 广东园林,2002(4):38-40.LIN W Q, HE L J, XIE Z S. A kind of fine garden tree species worth popularizing - white wood incense[J]. Guangdong Garden,2002(4):38-40.
[2] 李林海,寿海洋,马清温. 土沉香(瑞香科)的地理分布研究[J]. 安 徽 农 业 科 学,2012, 40(17):9254-9256.doi:10.13989/j.coki.0517-6611.2012.17.101.LI L H, SHOU H Y, MA Q W. Geographical distribution of agarwood(Daphneaceae)[J]. Anhui Agricultural Sciences, 2012, 40(17):9254-9256.doi:10.13989/j.coki.0517-6611.2012.17.101.
[3] NAEF R. The volatile and semi-volatile constituents of agarwood,the infected heartwood of Aquilaria species: a review[J]. Flavour &Fragrance Journal, 2011, 26(2):73-87. doi:10.1002/ffj.2034.
[4] CEESAY M M, MORGAN M W, KAMANDA M O. Prevalence of diabetes in rural and urban populations in southern Sierra Leone: A preliminary survey[J]. Tropical Medicine & International Health,1997, 2(3):272-277. doi:10.1046/j.1365-3156.1997.d01-265.x.
[5] KAKINO M, IZUTA H, ITO T. Agarwood induced laxative effects acetylcholine receptors on loperamide-induced constipation in Mice[J]. Journal of the Agricultural Chemical Society of Japan, 2010,74(8):1550-1555. doi:10.1271/bbb.100122.
[6] TAKEMOTO H, ITO M, SHIRAKI T. Sedative effects of vapor inhalation of agarwood oil and spikenard extract and identification of their active components[J]. Journal of Natural Medicines, 2008, 62(1):41-46. doi:10.1007/s11418-007-0177-0.
[7] ZHOU M, WANG H, SUOLANGJIBA. Antinociceptive and antiinflammatory activities of Aquilaria sinensis(Lour.)Gilg. leavesextract.[J]. Journal of Ethnopharmacology, 2008, 117(2):345-350.doi:10.1016/j.jep.2008.02.005.
[8] BARDEN A, ANAK N A, MULLIKEN T. Heart of the matter: agarwood use and trade and CITES implementation for Aquilaria malaccensis[M].Cambridge, UK: TRAFFIC International,2000:1-60.
[9] YU Q, QI J, YU H X. Qualitative and quantitative analysis of phenolic compounds in the leaves of Aquilaria sinensis using liquid chromatography-mass spectrometry[J]. Phytochemical Analysis,2013, 24(4):349-356.
[10] CHEN H, YANG Y, XUE J. Comparison of compositions and antimicrobial activities of essential oils from chemically stimulated agarwood, wild agarwood and healthy Aquilaria sinensis(Lour.)gilg trees[J]. Molecules, 2011, 16(6):4884-4896. doi:10.3390/molecules16064884.
[11] 寿海洋.土沉香(瑞香科)的分布和生物学特性研究[D]. 北京:北京林业大学,2010.SHOU H Y. Distribution and biological characteristics of agaricaceae[D]. Beijing: Beijing Forestry University, 2010.
[12] 中华人民共和国野生植物保护条例[S].中华人民共和国国务院公报,1996(12):1178-1183.Regulations of the People's Republic of China on the protection of wild plants[S]. Bulletin of the State Council of the People's Republic of China, 1996(12):1178-1183.
[13] CHEN H Q, WEI J H, YANG J S. Chemical constituents of agarwood originating from the endemic genus Aquilaria plants[J]. Cheminform,2012, 43(17):236-250. doi:10.1002/cbdv.201100077.
[14] LI W, CAI C H, DONG W H. 2-(2-phenylethyl)chromone derivatives from Chinese agarwood induced by artificial holing[J]. Fitoterapia,2014, 98:117-123. doi:10.1016/j.fitote.2014.07.011.
[15] LIAO G, MEI W L, DONG W H. 2-(2-Phenylethyl)chromone derivatives in artificial agarwood from Aquilaria sinensis[J].Fitoterapia, 2016, 110:38-43. doi:10.1016/j.phytol.2018.05.008.
[16] CHEN D, XU Z, CHAI X. Nine 2-(2-Phenylethyl)chromone derivatives from the resinous wood of Aquilaria sinensis and their inhibition of LPS-Induced NO production in RAW 264.7 cells[J].European Journal of Organic Chemistry, 2012, 2012(27):5389-5397.doi:10.1002/ejoc.201200725.
[17] 李戈,段立胜,杨春勇,赵俊凌,李学兰. 白木香结香技术研究进展[J]. 安徽农业科学,2009, 37(25):12012-12013. doi:10.13989/j.cnki.0517-6611.2009.25.108.LI G, DUAN L S, YANG C Y,ZHAO J L,LI X L. Progress in research on aloes production technology of white wood[J]. Anhui Agricultural Science, 2009, 37(25):12012-12013. doi: 10.13989/j.cnki.0517-6611.2009.25.108.
[18] 张争,杨云,魏建和,孟慧,隋春,陈怀琼.白木香结香机制研究进展及其防御反应诱导结香假说[J]. 中草药,2010, 41(1):156-159.ZHANG Z, YANG Y, WEI J H,MENG H,SUI C,CHEN H Q. Research progress on the mechanism of aloes formation and the hypothesis of aloes formation induced by defense response[J]. Chinese Herbal Medicine, 2010, 41(1):156-159.
[19] 李锦开,李振纪.中国木本药材与广东特产药材[M]. 北京:中国医药科技出版社,1994.LI J K, LI Z J. Chinese woody herbs and guangdong specialty herbs[M]. Beijing: China Medical Science and Technology Press,1994.
[20] 林峰,梅文莉,吴娇,戴好富. 人工结香法所产沉香挥发性成分的 GC-MS 分析[J]. 中药材,2010, 33(2):222-225. doi:10.13863/j.issn1001-4454.2010.02.025.LIN F, MEI W L, WU J,DAI H F. Analysis of volatile components of aloes produced by artificial aloes production by Gc-Ms[J].Chinese Medicinal Materials, 2010, 33(2):222-225. doi:10.13863/j.issn1001-4454.2010.02.025.
[21] WELTER S C. Impacts of plant diversity on arthropod communities and plant-herbivore network architecture[J]. Ecosphere, 2017, 8(10):e01983. doi:10.1002/ecs2.1983.
[22] NYKÄNEN H, KORICHEVA J. Damage-induced changes in woody plants and their effects on insect herbivore performance: a metaanalysis[J]. Oikos, 2004, 104(2):247-268. doi:10.1111/j.0030-1299.2004.12768.x.
[23] SACK L, HOLBROOK N M. The major veins of mesomorphic leaves revisited: Tests for conductive overload in Acer saccharum(Aceraceae)and Quercus rubra(Fagaceae)[J]. American Journal of Botany,2003, 90(1):32-39. doi: 10.3732/ajb.90.1.32 .doi:10.3732/ajb.90.1.32.
[24] 冯建灿,胡秀丽,毛训甲. 叶绿素荧光动力学在研究植物逆境生理 中 的 应 用[J]. 经 济 林 研 究,2002(4):14-18. doi:10.14067/j.cnki.1003-8981.2002.04.004.FENG J C, HU X L, MAO X J. Application of chlorophyll fluorescence dynamics in studying plant stress physiology[J]. Study on Economic Forest, 2002(4):14-18. doi: 10.14067/j.cnki.1003-8981.2002.04.004.[25] MASSACCI A, LANNELLI M A, PIETRINI F. The effect of growth at low temperature on photosynthetic characteristics and mechanisms of photoprotection of maize leaves[J]. Journal of Experimental Botany,1995, 46(1): 119-127. doi: 10.1093/jxb/46.1.119.
[26] SNEL J F H, KOOTEN O. The use of chlorophyll fluorescence and other non-invasive spectroscopic techniques in plant stress physiology[J]. Photosynthesis Research, 1990, 25(3):147-150. doi: 10.1007/BF00033156.
[27] 韩张雄,李利,徐新文,吕湘芳. NaCl胁迫对3种荒漠植物幼苗叶绿素荧光参数的影响[J]. 西北植物学报,2008, 28(9):1843-1849.HAN Z X, LI L, XU X W,LYU X F. Effects of NaCl stress on chlorophyll fluorescence parameters of three desert plant seedlings[J]. Chinese Journal of Botany, 2008, 28(9):1843-1849.
[28] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学报,1999, 16(4):444-448.ZHANG S R. Significance and discussion of chlorophyll fluorescence kinetic parameters[J]. Acta Botanica Sinica, 1999, 16(4):444-448.
[29] 尤鑫,龚吉蕊. 叶绿素荧光动力学参数的意义及实例辨析[J]. 西 部 林 业 科 学,2012, 41(5):90-94. doi:10.16473/j.cnki.xblykx1972.2012.05.010.YOU X, GONG J R. Significance and case analysis of chlorophyll fluorescence kinetic parameters[J]. Science of Forestry in Western China, 2012, 41(5):90-94. doi:10.16473/j.cnki.xblykx1972.2012.05.010.
[30] 贾晓红,周再知,马华明,梁坤南,黄桂华,余雪标. 缺素对土沉香幼苗根系生长和叶绿素荧光参数的影响[J]. 热带作物学报,2015,36(4):660-664.JIA X H, ZHOU Z Z, MA H M, LIANG K N, HUANG G H, YU X B. Effects of element deficiency on root growth and chlorophyll fluorescence parameters of agarwood seedlings[J]. Acta Tropiae Agronomica Sinica, 2015, 36(4):660-664.
[31] 梁惠萍. 土壤水分对珍贵树种土沉香幼苗生长及生理特性的影响[D]. 南宁:广西大学, 2013.LIANG H P. Effects of soil moisture on growth and physiological characteristics of aloes seedlings of rare tree species[D]. Nanning:Guangxi University,2013.
[32] 原慧芳,田耀华,魏丽萍,陈国云,寸明. 遮光条件下不同种源土沉香幼苗的光合特性与生长速率分析[J]. 植物资源与环境学报,2012, 21(3):20-28.YUAN H F, TIAN Y H, WEI L P,CHEN G Y,CUN M. Analysis of photosynthetic characteristics and growth rate of agarwood seedlings with different provenance under shading conditions[J]. Journal of Plant Resources and Environment, 2012, 21(3):20-28.
[33] 杨振德,徐丽,玉舒中,赵岩岩,刘震. 水分胁迫对土沉香生理生化特性及根系形态的影响[J]. 西部林业科学,2014(1):1-5.doi:10.16473/j.cnki.xblykx.1972.2014.01.014.YANG Z D, XU L, YU S Z,ZHA YY,LIU Z. Effects of water stress on physiological and biochemical characteristics and root morphology of agarwood[J]. Science of Forestry in Western China, 2014(1):1-5.doi:10.16473/j.cnki.xblykx.1972.2014.01.014.
[34] 杨亚慧,孙同高,张亨,黎清,陈红跃. 植物生长调节剂对土沉香苗木光合作用的影响[J]. 现代园艺,2015(15):15-17.doi:10.14051/j.cnki.xdyy.2015.15.007.YANG Y H, SUN T G, ZHANG H,LI Q,CHEN H Y. Effects of plant growth regulator on photosynthesis of agarwood seedlings[J]. Modern Horticulture, 2015(15):15-17.doi:10.14051/j.cnki.xdyy.2015.15.007.
[35] 许大全,张玉忠,张荣铣. 植物光合作用的光抑制[J]. 植物生理学报,1992(4):237-243.doi:10.13592/j.cnki.ppj.1992.04.001.XU D Q, ZHANG Y Z, ZHANG R X. Photoinhibition of plant photosynthesis[J]. Journal of Plant Physiology, 1992(4):237-243.doi:10.13592/j.cnki.ppj.1992.04.001.
[36] 鲁莹莹,谭长强,朱积余,彭玉华,黄志玲,郝海坤. 10个珍贵树种光合日变化特性[J]. 广西林业科学,2015, 44(2):120-125.doi:10.19692/j.cnki.gfs.2015.02.006.LU Y Y, TAN Z Q, ZHU J Y,PENG Y H,HUANG Z L,HAO H K.Diurnal variation characteristics of photosynthesis of 10 rare tree species[J]. Guangxi Forestry Science, 2015, 44(2):120-125.doi:10.19692/j.cnki.gfs.2015.02.006.
[37] 范杰英,郭军战,彭少兵. 10个树种光合和蒸腾性能对水分胁迫的响应[J]. 西北林学院学报,2005, 20(2):36-38.FAN J Y, GUO J Z, PENG S B. Photosynthetic and transpiration responses of 10 tree species to water stress[J]. Journal of Northwest Forestry University, 2005, 20(2):36-38.
[38] THOMSON V P, CUNNINGHAM S A, BALL M C. Compensation for herbivory by Cucumis sativus through increased photosynthetic capacity and efficiency[J]. Oecologia, 2003, 134(2):167-175.
[39] 张云,夏国华,马凯,李根有,代英超,严彩霞. 遮阴对堇叶紫金牛光合特性和叶绿素荧光参数的影响[J]. 应用生态学报,2014, 25(7):1940-1948.doi:10.13287/j.1001-9332.20140425.001.ZHANG Y, XIA G H, MA K. Effects of shading on photosynthetic characteristics and chlorophyll fluorescence parameters of corydalis corydalis[J]. Chinese Journal of Applied Ecology, 2014, 25(7):1940-1948.doi:10.13287/j.1001-9332.20140425.001.