【研究意义】植物微生物燃料电池(Plant-Microbial Fuel Cell,P-MFC)以植物光合作用产生的根系分泌物作为土壤产电微生物的电子供体,将太阳能持续不断地转化为电能,是一种能耗少、无污染、持续性好、具有自我修复能力、可再生的绿色能源。它将植物的光合作用与微生物燃料电池技术相结合,在可再生能源开发、水污染治理、生态环境修复等方面显现出广阔的应用前景,并作为一种有效缓解能源危机和环境压力的新技术受到越来越多国家的关注[1-3]。【前人研究进展】P-MFC研究中采用的植物以湿地植物居多[4],目前已有关于水稻(Oryza sativa)、大米草(Spartina anglica)、野古草(Arundinella anomala)、芦竹(Arundo donax)、短叶茳芏(Cyperus malaccensis var.brevifolius)、美人蕉(Canna indica)、风车草(Cyperus alternifolius)、菖蒲(Acorus calamus)等P-MFC的研究报道[5-8]。然而,已报道的P-MFC产电性能仍相对较弱,其最大输出功率密度仅为222 mW/m2[5]。为适应湿地厌氧环境,湿地植物根系一般具有渗氧的生理特性。根系渗氧能在P-MFC阳极形成微氧环境,氧气可与电极争夺电子,从而影响P-MFC的产电性能[9]。自然状态下,P-MFC阴极会自发形成菌藻膜[10],菌藻膜进行光合作用,吸收水体中的HCO3-释放OH-和O2[11],改变阴极pH和氧化还原条件,也可能会影响阴极的电极反应。另外,环境温度变化影响植物的生长和微生物的代谢活性,从而也会对P-MFC的产电性能产生较大影响[4]。目前,对于以上因素如何影响P-MFC产电性能尚缺乏进一步的了解。【本研究切入点】研究不同植物及环境因素对P-MFC产电性能的影响,对提高P-MFC产电能力、开发利用绿色能源具有重要意义。【拟解决的关键问题】本研究以巴拉草(Brachiaria mutica,禾本科)、短叶茳芏(Cyperus malaccensis var. brevifolius,莎草科)、多枝扁莎(Pycreus polystachyus,莎草科)、双穗雀稗(Paspalum paspaloides,禾本科)4种野外常见且耐水淹能力比较强的湿地植物为材料构建P-MFC,研究了不同P-MFC产电性能的差异及其产电性能与环境因素和植物特性之间的关系,为构建高效P-MFC、P-MFC产电性能机理的研究及相关产品的研发提供参考。
1 材料与方法
1.1 4种湿地植物P-MFC的构建
采用无离子交换膜的单室P-MFC为模型,以顶部直径18 cm、底部直径14.5 cm、高18.5 cm、总容积4 L的黑色塑料桶作为反应器,直径14 cm、厚5 mm石墨碳毡作为阴、阳电极,电极间距5 cm,钛丝连接电路[12]。阳极位于反应器的底部,覆泥土5 cm,栽种植物后将阴极置于土层表面,注满水(图1)。反应器中分别单独栽种巴拉草(B. mutica)、短叶茳芏(C. malaccensis )、多枝扁莎(P. polystachyus)、双穗雀稗(P. paspaloides)4种植物,每种植物3次重复,每个重复中栽种数量相等、健康无病害且生长状况基本一致的植株,以无植物MFC作空白对照。启动所有电池,并置于室外自然条件下预培养30 d,待开路电压稳定后,外接1 kΩ电阻,开始监测数据,每隔10 min检测和记录1次电压值和温度值,连续监测211 d(2016年10月24日至2017年5月28日)。

图1 植物-微生物燃料电池结构示意图
Fig. 1 Schematic diagram of the P-MFC system
1.2 产电性能相关参数测定
1.2.1 电压和电极测定 采用Keithley 2700万用表(美国Keithley仪器公司)实时监测P-MFC输出电压,设置每隔10 min记录一次数据。6 mm银/氯化银参比电极(上海楚兮实业有限公司)测定电池两极电位,SG98多参数测试仪〔梅特勒-托利多(上海)有限公司〕测定阴极附近水体pH和溶解氧浓度。GSP-6型温湿度记录仪(杭州精创电子有限公司)实时记录外界环境温度值。输出功率密度(Output Power Density,mW/m2)按以下公式计算:
输出功率密度=U2/RS
式中,U为外接电阻两端的电压,R为外界电阻1 kΩ,S为阴极表面积(m2)。
每天8:30、13:30、18:00分别测定阴极区pH、溶解氧浓度,连续测定7 d。
1.2.2 根系渗氧量和渗氧率测定 采用柠檬酸钛比色法[13]测定根系渗氧量。选用株高30 cm左右、根长约10 cm的4种植物单株分别置于营养液(0.1%琼脂+10%Hoagland溶液)中,每组设3次重复,培养30 d。取50 mL洁净试管,将连接氮气瓶的导管插入试管底部持续吹氮排空气,保证无氧环境;然后注入30 mL无氧营养液,再将用去离子水洗净的植物根系转入试管中,注入5 mL无氧柠檬酸钛(Ⅲ)溶液,整个操作在持续通氮气条件下进行;最后注入适量石蜡油密封液面,停止通氮气。以无植物组作对照。将所有试样及对照在光照培养箱中培养6 h,UV Power PC型紫外分光光度计(北京莱伯泰科有限公司)测定其在527 nm处的吸光度,同时以浓度1~20 mmol/L的无氧柠檬酸钛(Ⅲ)溶液绘制标准曲线。计算根系渗氧量(ROL)和渗氧率(ROL rate):
ROL(μmol/d·株)=4C×(Y-Z)
ROL rate(μmol/d·g)=4C×(Y-Z)/m
式中,C表示每个试管加入柠檬酸钛(Ⅲ)后的溶液总体积(L),Y表示对照组反应6 h后柠檬酸钛(Ⅲ)浓度(μmol/L),Z表示放入植物的试管反应6 h后柠檬酸钛(Ⅲ)浓度(μmol/L),m表示植物根系干重(g)。
1.2.3 根系孔隙度测定 采用25 mL比重瓶法测定根系孔隙度,计算公式如下:
式中,m1为比重瓶+水的质量(mg),m2为根样鲜质量(mg),m3为研磨前比重瓶+水+根样的质量(mg),m4为研磨后比重瓶+水+根样的质量(mg)[13]。
1.2.4 石蜡切片观测 手工制作根系石蜡切片,利用HM340E型半自动石蜡切片系统(德国Microm公司)切片后用DM2500型正置显微镜(德国Leica仪器有限公司)进行观察和拍照。
1.3 数据处理与分析
试验数据用Microsoft Excel 2007进行统计分析,并结合Origin Pro 8.0软件进行数据处理和绘图,SPSS Statistics 19.0软件对数据进行方差分析,采用LSD法多重比较进行差异显著性测验。
2 结果与分析
2.1 4种植物P-MFC电压及电位变化情况
截取自2016年10月31日至2017年3月21日共142 d电池电压较为稳定的时间段进行数据分析,其中2017年1月24—25日因停电数据缺失,结果(图2,封二)显示,P-MFC及空白对照的电压整体上呈稳定的周期性波动,与温度波动基本一致。10月至次年1月上旬平均气温高,电池平均电压较高;1月中旬至2月上旬平均气温下降,电池平均电压有所下降。双穗雀稗的P-MFC平均电压最高,为0.26(±0.02) V,其次是巴拉草、对照、短叶茳芏、多枝扁莎(表1)。从本研究结果来看,不同植物构建的P-MFC产电性能差异较大,禾本科的两种植物优于莎草科的两种植物,双穗雀稗平均功率密度最大,为4.38(±0.56)mW/m2,多枝扁莎最小,为0.20(±0.08) mW/m2。
表1 4种植物P-MFC平均电压和平均功率密度
Table 1 Average voltage and average power densities of four P-MFCs

注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
平均功率密度Average power densities(mW/m2)对照Control 0.16±0.03 1.74±0.39b巴拉草B. mutica 0.25±0.01 4.25±0.35a短叶茳芏C. malaccensis 0.15±0.02 1.57±0.35b多枝扁莎P. polystachyus 0.05±0.02 0.20±0.08c双穗雀稗P. paspaloides 0.26±0.02 4.38±0.56a处理Treatments平均电压Average voltage(V)
随机选取3个晴朗日测定不同植物P-MFC的两极电位和电压,记录时间为当天5: 00至次日4: 30,每隔30 min测定一次数据。结果(图3、图4)显示,不同植物P-MFC的阴极平均电位差别不大,但阳极平均电位差别明显。阴极日平均电位表现为双穗雀稗(0.48V±0.08 V)>多枝扁莎(0.47V±0.01 V)>短叶茳芏(0.42V±0.02 V)>巴拉草(0.38V±0.01 V)>对照(0.02V±0.07 V),而阳极日平均电位表现为多枝扁莎(0.46V±0.01 V)>双穗雀稗(0.32V±0.11 V)>短叶茳芏(0.30V±0.05 V)>巴拉草(0.12V±0.03 V)>对照(-0.12V±0.04 V)。图5显示,尽管P-MFC阴阳极平均电位均高于对照,但平均电压并不都高于对照,表现为巴拉草(0.26V±0.02 V)>双穗雀稗(0.17V±0.07 V)>对照(0.1V6±0.03 V)>短叶茳芏(0.12V±0.03 V)>多枝扁莎(0.02V±0.02 V)。
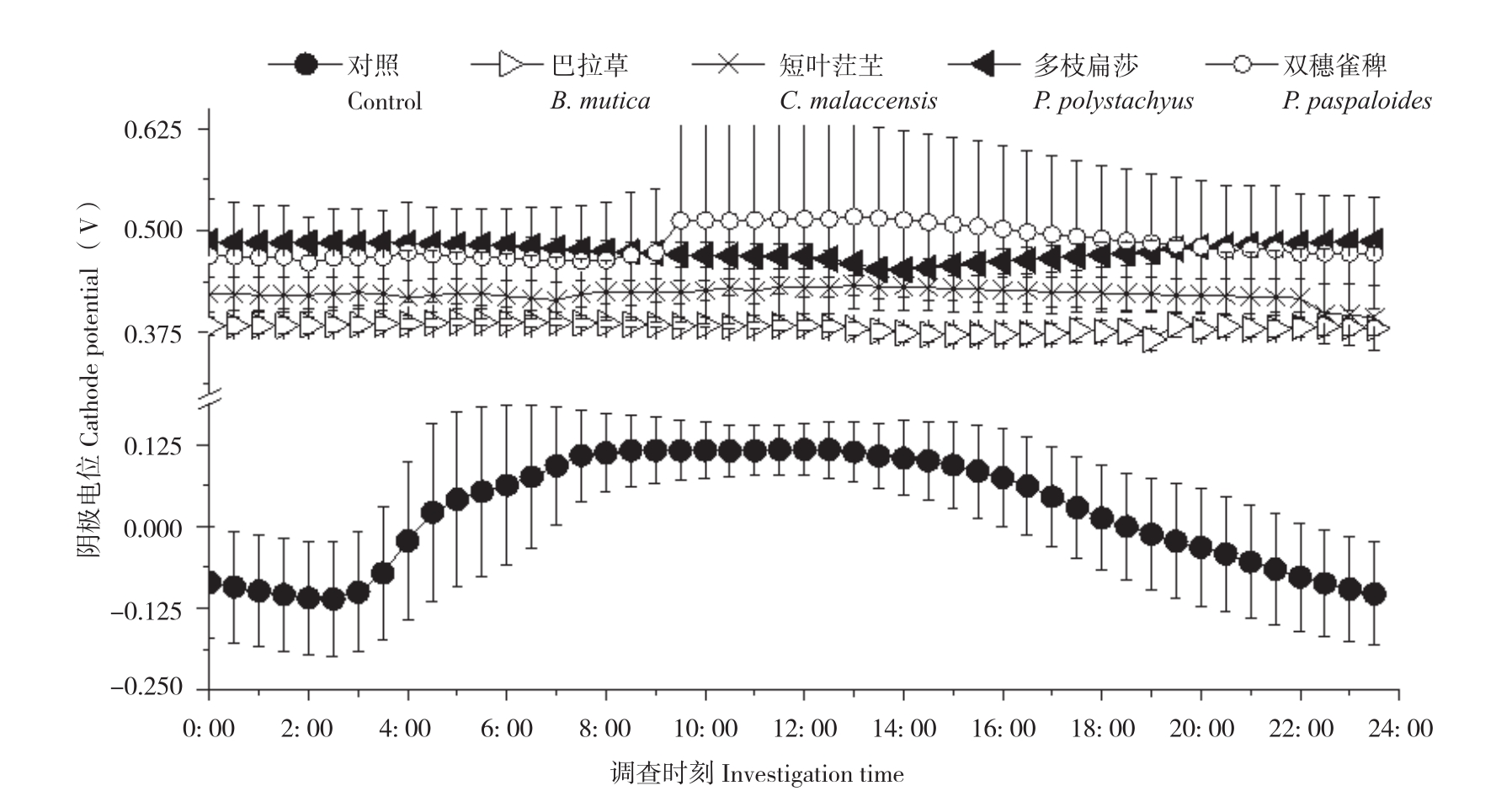
图3 4种植物P-MFC阴极电位日变化
Fig. 3 Daily variation of cathode potential of four P-MFCs
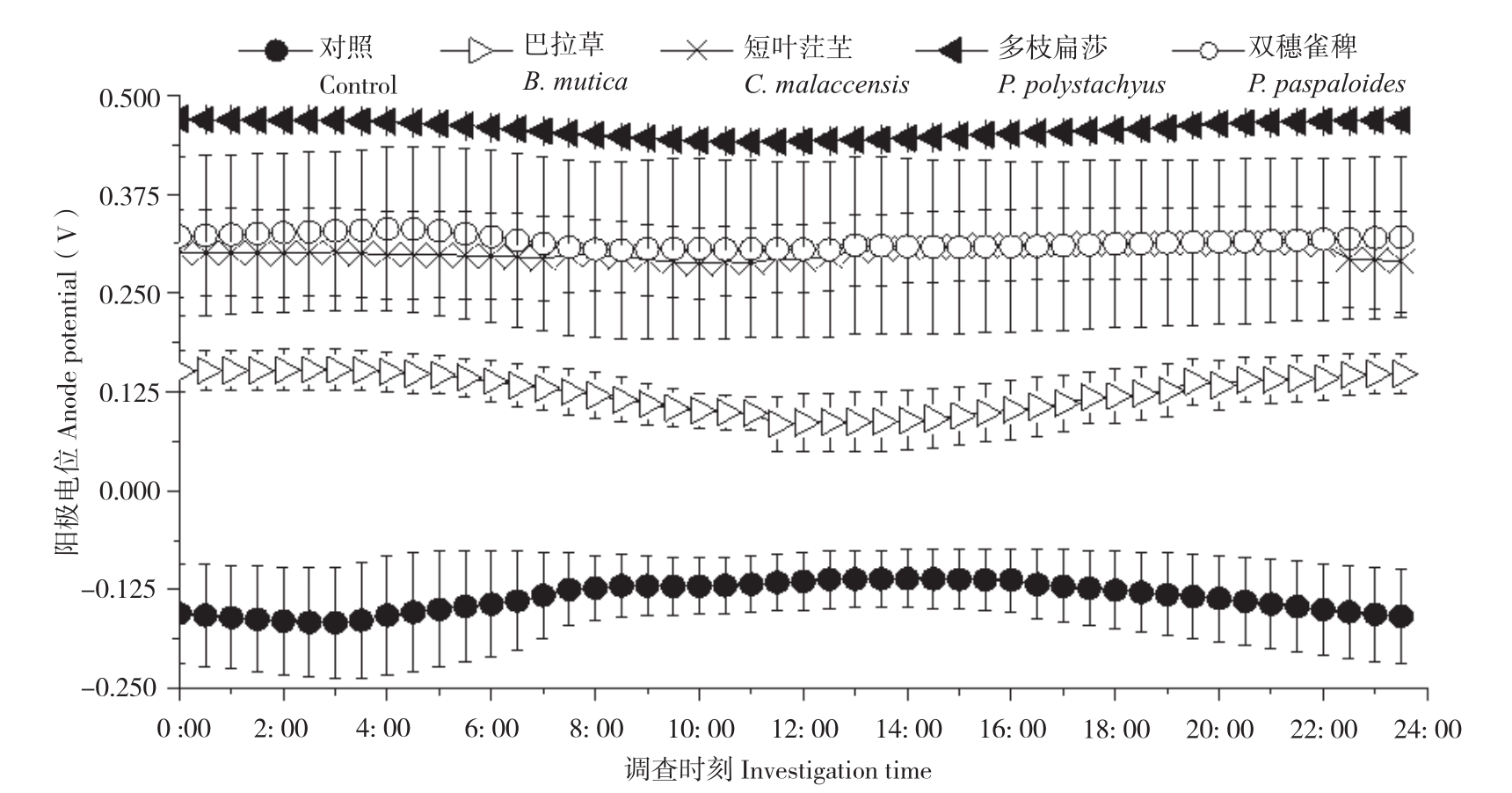
图4 4种植物P-MFC阳极电位日变化
Fig. 4 Daily variation of anodic potential of four P-MFCs
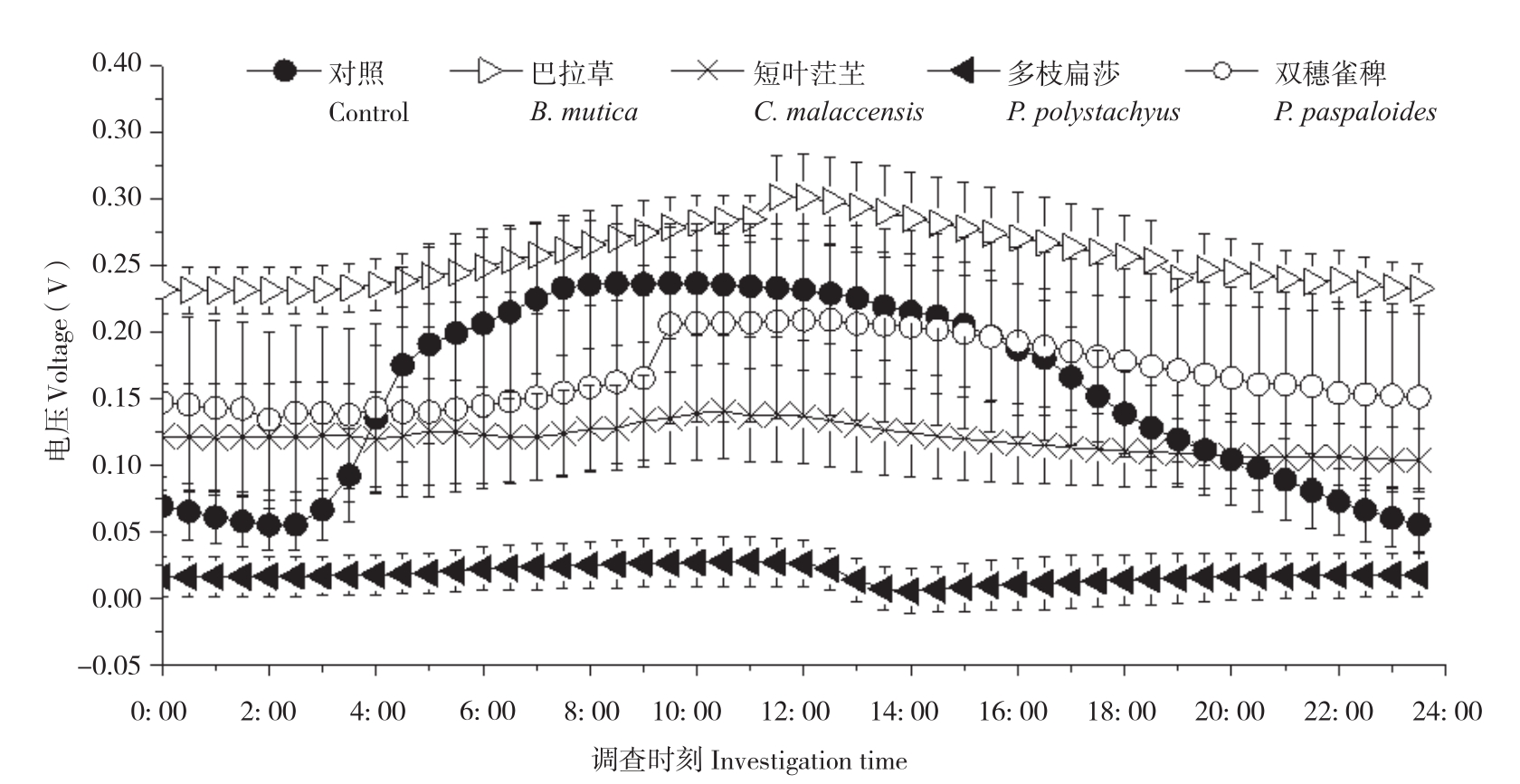
图5 4种植物P-MFC电压日变化
Fig. 5 Daily variation of voltage of four P-MFCs
2.2 4种植物P-MFC阴极区pH值及溶氧浓度
从图6、图7可以看出,P-MFC及对照的阴极区pH值、溶氧浓度变化趋势均呈单峰型,最高值出现在13: 00—14: 00之间。P-MFC阴极区pH(7.2~8.5)、溶氧浓度(4.83~10.81 mg/L)均低于对照(8.6~9.9、6.28~15.88 mg/L),其中pH值变化情况表现为巴拉草7.3-8.5-7.4、短叶茳芏7.3-7.5-7.2、多枝扁莎7.2-8.5-7.3、双穗雀稗7.2-7.2-7.3、对照8.6-9.9-9.4,溶氧浓度变化情况表现为巴拉草5.73 mg/L-10.26 mg/L-6.92 mg/L、短叶茳芏5.21 mg/L-8.11 mg/L-5.65 mg/L、多枝扁莎7.55 mg/L-10.81 mg/L-5.64 mg/L、双穗雀稗5.15 mg/L-5.66 mg/L-4.83 mg/L、对照6.28 mg/L-15.88 mg/L-10.56 mg/L。其中,多枝扁莎P-MFC阴极区pH值、溶氧浓度均值最大,而双穗雀稗则最小。

图6 4种植物P-MFC阴极区pH值变化
Fig. 6 Variation of pH in cathode area of four P-MFCs
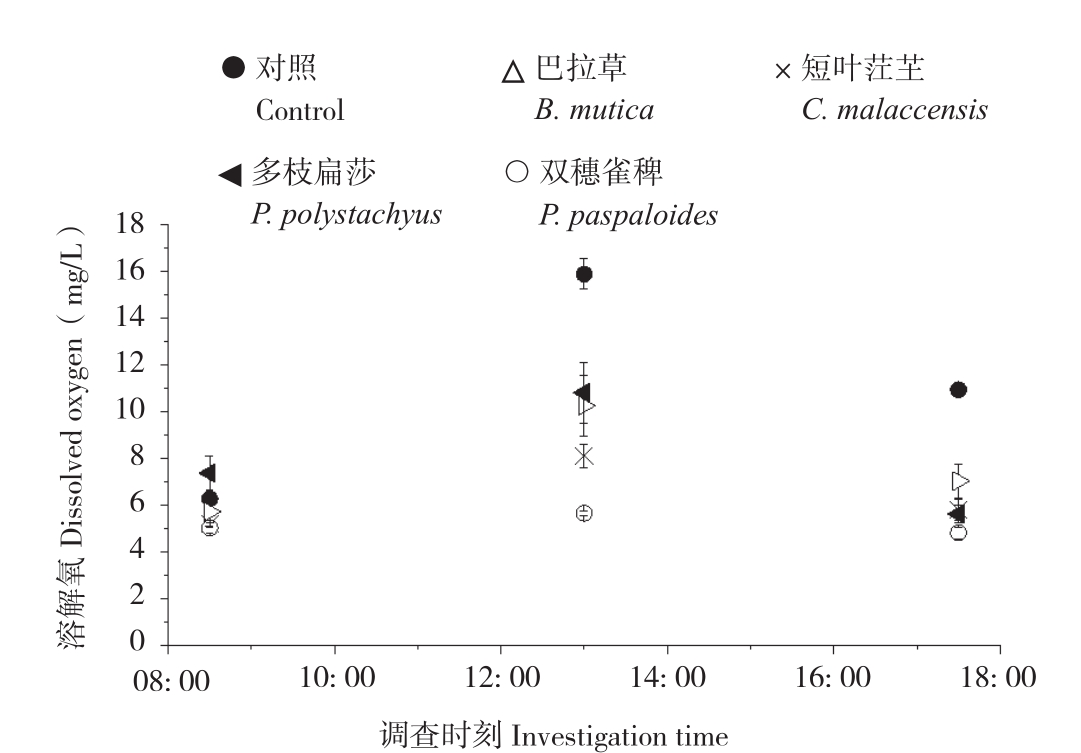
图7 4种植物P-MFC阴极区溶解氧浓度
Fig. 7 Variation of dissolved oxygen concentration in cathode area of four P-MFCs
2.3 4种植物根系结构及渗氧率
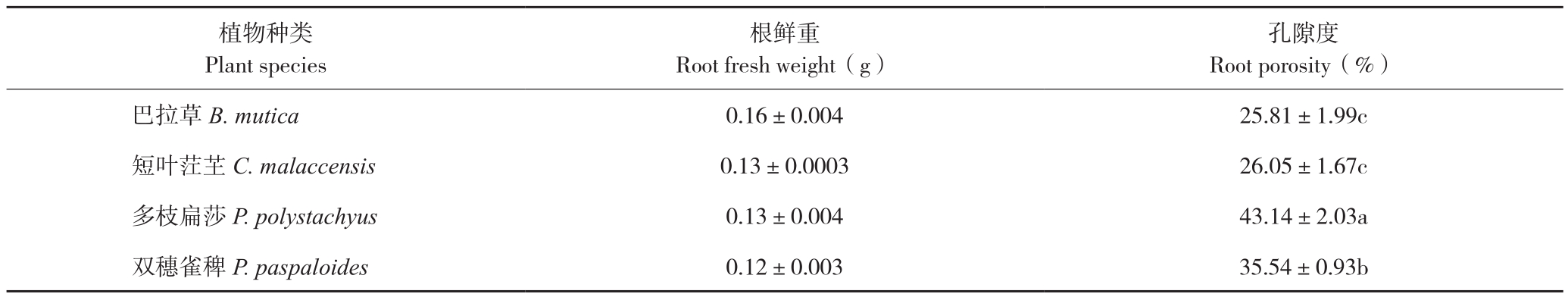
2.3.1 根系结构和孔隙度 通过根系石蜡切片结构观察,发现不同植物根系内均含有气腔,说明根系均具有一定的通气能力(图8),巴拉草、双穗雀稗和多枝扁莎的根系上具有较多细小根毛,而短叶茳芏根系根毛较少。采用比重法测定得到的根系孔隙度由小到大依次为巴拉草、短叶茳芏、双穗雀稗、多枝扁莎(表2)。
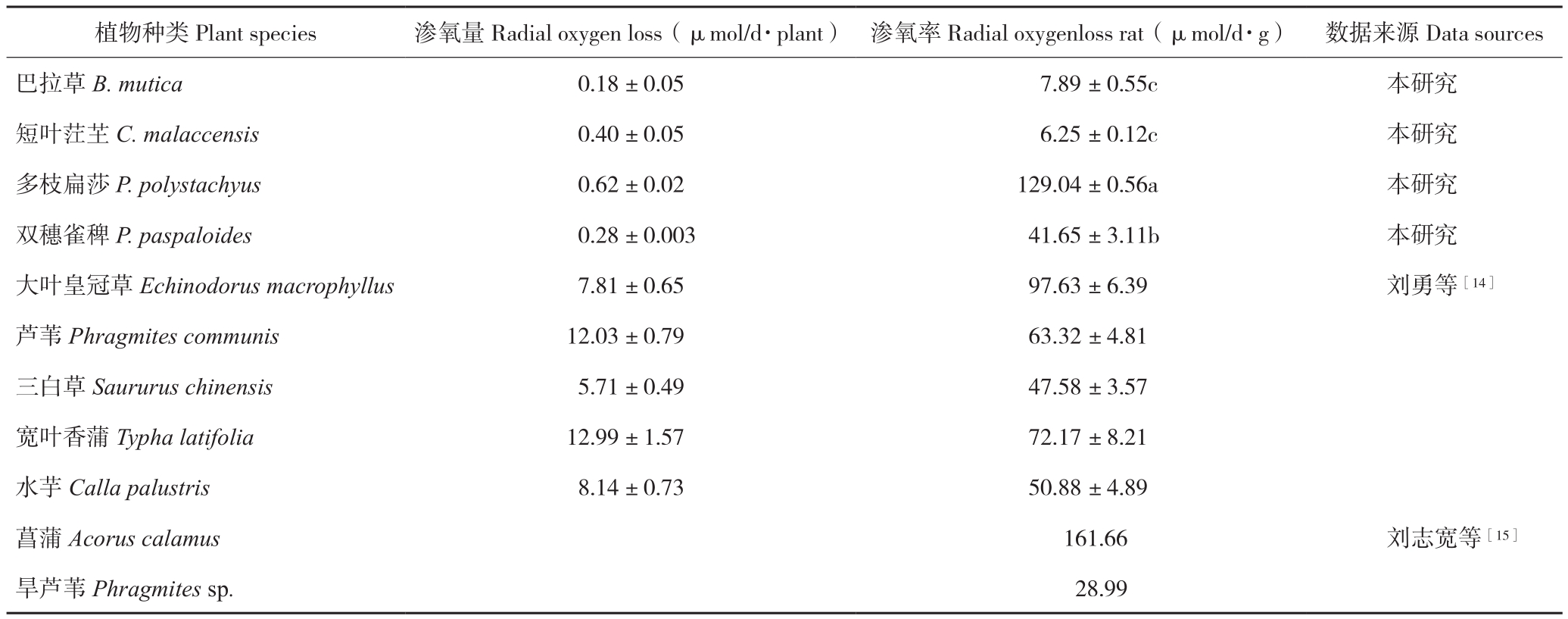
2.3.2 根系渗氧率 由表3可知,不同植物种类的根系渗氧率存在差异。巴拉草和短叶茳芏相比其他植物有着更低的渗氧率,而多枝扁莎的渗氧率较高,仅次于菖蒲。渗氧率大小表现为短叶茳芏<巴拉草<双穗雀稗<多枝扁莎。

图8 4种植物根系形态和解剖结构比较
Fig. 8 Root morphological and anatomic structure of four different plants
表2 4种植物根系孔隙度比较
Table 2 Comparison of root porosity of four different plants
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
孔隙度Root porosity(%)巴拉草B. mutica 0.16±0.004 25.81±1.99c短叶茳芏C. malaccensis 0.13±0.0003 26.05±1.67c多枝扁莎P. polystachyus 0.13±0.004 43.14±2.03a双穗雀稗P. paspaloides 0.12±0.003 35.54±0.93b植物种类Plant species根鲜重Root fresh weight(g)
表3 4种植物根系渗氧率比较
Table 3 Comparison of ROL rate of four different plants
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
植物种类Plant species 渗氧量Radial oxygen loss(μmol/d·plant) 渗氧率Radial oxygenloss rat(μmol/d·g) 数据来源Data sources巴拉草 B. mutica 0.18 ±0.05 7.89 ±0.55c 本研究短叶茳芏C. malaccensis 0.40 ±0.05 6.25 ±0.12c 本研究多枝扁莎P. polystachyus 0.62 ±0.02 129.04 ±0.56a 本研究双穗雀稗P. paspaloides 0.28 ±0.003 41.65 ±3.11b 本研究大叶皇冠草 Echinodorus macrophyllus 7.81 ±0.65 97.63 ±6.39 刘勇等[14]芦苇 Phragmites communis 12.03 ±0.79 63.32 ±4.81三白草 Saururus chinensis 5.71 ±0.49 47.58 ±3.57宽叶香蒲 Typha latifolia 12.99 ±1.57 72.17 ±8.21水芋 Calla palustris 8.14 ±0.73 50.88 ±4.89菖蒲Acorus calamus 161.66 刘志宽等[15]旱芦苇Phragmites sp. 28.99
3 讨论
3.1 不同植物P-MFC产电特性
Helder等[5]以禾本科植物大米草(Spartina anglica)、野古草(Arundinella anomala)和芦竹(Arundo donax)分别构建P-MFC,其产电性能差异明显,大米草和野古草P-MFC的最大功率密度和平均功率密度分别为222 、10 mW/m2和22 、21 mW/m2。吴夏芫等[16]以粉黛万年青(Dief fenbachia)、小白掌(Spathiphyllum kochii Engl. & K. Krause)、金边富贵竹(Dracaena sanderiana)构建了植物-沉积物微生物燃料电池(基质为土壤),最大功率密度分别为8.7、14.0、13.0 mW/m2。可见,在同样条件下,采用不同植物构建的P-MFC产电性能是有差异的。Timmers等[17]报道以大米草构建的含离子交换膜的双室P-MFC(阳极基质为霍格兰溶液)最大平均功率密度为22(±14)mW/m2;而Helder等[5]同样以大米草构建的P-MFC产电性能(222 mW/m2)要远高于Timmers等的研究结果[17],这与二者P-MFC所用的电极材料及阳极体积不同有关[5]。可见,同一种植物采用不同的电极材料和构建P-MFC方法,其产电性能也是有差异的。朱娟平等[8]以风车草(Cyperus alternifolius)和短叶茳芏构建的河涌底泥P-MFC最大功率密度为10.74、10.05 mW/m2。而本研究中4种植物P-MFC平均功率密度均低于上述报道,但不同P-MFC间产电性能差异明显,其中巴拉草和双穗雀稗P-MFC产电性能优于对照,而短叶茳芏和多枝扁莎P-MFC则低于对照。总之,选用合适的植物和优化电池构造有利于提高P-MFC的产电性能。
3.2 植物根系结构和渗氧能力对P-MFC产电性能的影响
湿地植物为适应湿地厌氧环境一般都具有根系渗氧的生理特征[18-19]。湿地植物根系渗氧率与通气组织的发达程度、根部细胞的排列紧密程度有关,一般通气组织越发达,根部细胞排列疏松,根系孔隙度越大,根系渗氧率越大[20-22]。因此,可通过观察根系的解剖结构和测定根系的孔隙度研究植物根系的渗氧能力。本研究中巴拉草和短叶茳芏的根系细胞排列相对紧密、孔隙度小,因而具有较低的渗氧率;而多枝扁莎和双穗雀稗根系细胞排列疏松、孔隙度大,渗氧率高。当数据监测结束后,取出多枝扁莎P-MFC电极,发现植株根系已遍布整个反应器并穿透阳极,在阳极上表面和反应器内壁各形成一层较其他P-MFC更明显的红棕色氧化铁膜,由此也反映出多枝扁莎根系具有更强的渗氧能力。与刘志宽等[15]和刘勇等[14]报道的其他湿地植物的渗氧率比较发现,多枝扁莎的渗氧率也属于高水平。
已有报道表明,植物根际渗氧会为根际非产电微生物氧化降解根系分泌物提供电子受体[9],进而提高P-MFC阳极电位,降低其产电性能[23]。因而,我们推测不同湿地植物P-MFC产电性能的差异可能与根系渗氧能力有关:巴拉草根系渗氧率较低,从而能够维持较低的阳极电位,而多枝扁莎根系渗氧率最高,维持了较高的阳极电位,在二者阴极电位差别不大的情况下,高的阳极电位减弱了输出电压,降低了电池的产电性能。可见,根系渗氧能力对P-MFC的产电性能具有明显影响,可作为植物筛选时的一项重要参考依据。
3.3 阴极区pH和溶氧浓度对P-MFC产电性能的影响
本研究除双穗雀稗阴极pH变化较为平稳外,其他P-MFC阴极pH在白天的变化呈单峰型,这可能主要是因为阴极表面菌藻膜的光合作用消耗了水体中大量HCO3-,释放OH-,造成水体pH随着光照升高[11]。双穗雀稗P-MFC植物覆盖茂密,阴极电极上藻类少,pH相对稳定。另外,阴极O2的还原过程也需要H+参与,白天P-MFC运行效率高,H+被大量消耗、浓度降低,pH增大。夜晚,藻类不再消耗水体中的HCO3-;同时阳极产电微生物代谢产生的H+扩散至阴极,补充了阴极上的损耗,使阴极区H+浓度逐渐升高,pH降低。吴瑾妤等[24]报道通过调节阴阳两极pH可以优化电池的产电性能,阳极碱性(pH 8.5)和阴极酸性(pH5.5)时,沉积物微生物燃料电池(SMFC)输出功率最高。本研究中双穗雀稗P-MFC阴极pH稳定且相对较低,能为阴极O2的还原提供充足的H+,从而使其阴极电位较高,整体输出功率较大。
除双穗雀稗P-MFC外,其他P-MFC阴极以及对照表面均有一层菌藻膜,菌藻膜进行光合作用致使阴极溶解氧白天升高夜晚降低。阴极充足的氧气浓度有利于提高MFC的产电性能[25]。巴拉草和多枝扁莎阴极的溶解氧浓度最高,但是巴拉草的阴极电位反而最低,这可能是因为阴极电位是氧气、pH和微生物活性等共同作用的结果。
3.4 温度对P-MFC产电性能的影响
本研究发现P-MFC的输出电压变化趋势与温度波动趋势基本一致,温度与P-MFC产电性能之间可能存在一定关系。10—11月平均气温高,电池平均输出电压较高,而此时期植物生长旺盛,株高增长明显,根系和产电微生物代谢活跃;12月至次年3月,气温逐渐下降,电池平均输出电压下降,而此时期植物生长缓慢,根系和产电微生物代谢活动较弱,这与Zhou等[7]观察到的现象类似。可见,温度可能通过影响植物和微生物的生理代谢活性间接影响P-MFC的产电性能[4]。若将温度控制在适宜范围内,植物生长良好,根系分泌物丰富,阳极产电微生物代谢活跃,产生的质子和电子量多,将有利于阴极还原反应,从而使电池具备较高的产电性能。温度对产电性能的影响及二者间的相关性,有待进一步研究。
4 结论
不同植物构建的P-MFC产电性能差异明显,种植植物的P-MFC电位高于无植物的对照。巴拉草和双穗雀稗P-MFC产电能力较强,可能与巴拉草根系渗氧速率较低、双穗雀稗阴极pH较低且比较稳定有关。低的根系渗氧能力能够维持低的阳极电位,阴极低pH环境有利于维持较高的阴极电位,从而使得电池整体输出电压较高。在利用湿地植物构建P-MFC时,植物的根系特点尤其是根系渗氧生理是需要重点考虑的因素。
[1] HELDER M, CHEN W S, VAN DER HARST E J, STRIK D P,HAMELERS H V, BUISMAN C J, POTTING J. Electricity production with living plants on a green roof: environmental performance of the plant-microbial fuel cell[J]. Biofuels, Bioproducts and Biorefi ning,2013, 7(1): 52-64. doi: 10.1002/bbb.1373.
[2] STRIK D P, HAMELERS H, SNEL J F, BUISMAN C J. Green electricity production with living plants and bacteria in a fuel cell[J].International Journal of Energy Research, 2008, 32(9): 870-876.doi: 10.1002/er.1397.
[3] STRIK D P, TIMMERS R A, HELDER M, STEINBUSCH K J,HAMELERS H V, BUISMAN C J. Microbial solar cells: applying photosynthetic and electrochemically active organisms[J]. Trends in Biotechnology, 2011, 29(1): 41-49. doi: 10.1016/j.tibtech.2010.10.001.
[4] REGMI R, NITISORAVUT R, KETCHAIMONGKOL J. A decade of plant-assisted microbial fuel cells: looking back and moving forward[J].Biofuels, 2018, 9(5): 605-612. doi: 10.1080/17597269.2018.1432272.
[5] HELDER M, STRIK D, HAMELERS H, KUHN A, BLOK C,BUISMAN C. Concurrent bio-electricity and biomass production in three plant-microbial fuel cells using Spartina anglica, Arundinella anomala and Arundo donax[J]. Bioresource Technology, 2010,101(10): 3541-3547. doi: 10.1016/j.biortech.2009.12.124.
[6] SCHAMPHELAIRE L D, BOSSCHE L V D, DANG H S, HöFTE M, BOON N, RABAEY K, VERSTRAETE W. Microbial fuel cells generating electricity from rhizodeposits of rice plants[J].Environmental Science & Technology, 2008, 42(8): 3053-3058. doi:10.1021/es071938w.
[7] ZHOU Y, XU D, XIAO E, XU D, XU P, ZHANG X, ZHOU Q, HE F, WU Z. Relationship between electrogenic performance and physiological change of four wetland plants in constructed wetland-microbial fuel cells during non-growing seasons[J]. Journal of Environmental Sciences, 2018, 70: 54-62. doi: 10.1016/j.jes.2017.11.008.
[8] 朱娟平,王健,张太平,朱能武,邹定辉. 湿地植物-沉积物微生物燃料电池阳极微生物群落多样性研究[J]. 环境科学学报,2016, 36(11): 4017-4024. doi: 10.13671/j.hjkxxb.2016.0101.ZHU J P, WANG J, ZHANG T P, ZHU N W, ZOU D H. Phylogenetic diversity of bacterial and archaeal communities in anode biofilm of sediment microbial[J]. Acta Scientiae Circumstantiae, 2016, 36(11):4017-4024. doi: 10.13671/j.hjkxxb.2016.0101.
[9] TIMMERS R A, ROTHBALLER M, STRIK D P, ENGEL M, SCHULZ S, SCHLOTER M, HARTMANN A, HAMELERS B, BUISMAN C.Microbial community structure elucidates performance of Glyceria maxima plant microbial fuel cell[J]. Applied Microbiology and Biotechnology, 2012, 94(2): 537-548. doi: 10.1007/s00253-012-3894-6.
[10] WETSER K, SUDIRJO E, BUISMAN C J, STRIK D P. Electricity generation by a plant microbial fuel cell with an integrated oxygen reducing biocathode[J]. Applied Energy, 2015, 137:151-157. doi:10.1016/j.apenergy.2014.10.006.
[11] JOHNSON D B, HALLBERG K B. Acid mine drainage remediation options: a review[J]. Science of the Total Environment, 2005, 338(1-2): 3-14. doi: 10.1016/j.scitotenv.2004.09.002.
[12] HUAN D, YI CHENG W, ZHANG F, HUANG Z C, ZHENG C, HUI J X, FENG Z. Factors affecting the performance of single-chamber soil microbial fuel cells for power generation[J]. Pedosphere, 2014, 24(3):330-338. doi: 10.1016/s1002-0160(14)60019-9.
[13] KLUDZE H, DELAUNE R, PATRICK W. A colorimetric method for assaying dissolved oxygen loss from container-grown rice roots[J].Agronomy Journal, 1994, 86(3): 483-487. doi: 10.2134/agronj1994.00021962008600030005x.
[14] 刘勇,刘永,李纯厚,谭凤仪,叶志鸿,陆琴燕. 不同红树植物和湿地植物根部渗氧特征研究[J]. 广东农业科学,2011, 38(23): 5-9.doi: 10.3969/j.issn.1004-874X.2011.23.002.LIU Y, LIU Y, LI C H, TAN F Y, YE Z H, LU QY. Characteristics of radial oxygen loss from roots of different mangrove and wetland plants[J]. Guangdong Agricultural Sciences, 2011, 38(23): 5-9. doi:10.3969/j.issn.1004-874X.2011.23.002.
[15] 刘志宽, 牛快快, 马青兰, 白晓华, 苏刘选. 8种湿地植物根部泌氧速率的研究[J]. 贵州农业科学, 2010, 38(4): 47-50. doi: 10.3969/j.issn.1001-3601.2010.04.014.LIU Z K, NIU K K, MA Q L, BAI X H, SU L X. Study on rate of roots radial oxygen loss of eight wetland plants[J]. Guizhou Agricultural Sciences, 2010, 38(4): 47-50. doi: 10.3969/j.issn.1001-3601.2010.04.014.
[16] 吴夏芫,宋天顺,朱旭君,周楚新,韦萍. 不同湿地植物构建植物沉积型微生物燃料电池的研究[J]. 可再生能源,2013, 31(9):78-82.WU X Y, SONG T S, ZHU X J, ZHOU C X, WEI P. Research on different wetland plants to construct the Plant-Sediment Microbial Fuel Cell[J]. Renewable Energy Resources, 2013, 31(9): 78-82.
[17] TIMMERS R A, STRIK D P, HAMELERS H V, BUISMAN C J. Longterm performance of a plant microbial fuel cell with Spartina anglica[J]. Applied Microbiology and Biotechnology, 2010, 86(3): 973-981. doi: 10.1007/s00253-010-2440-7.
[18] COLMER T D. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots[J].Plant Cell & Environment, 2003, 26(1): 17-36. doi: 10.1046/j.1365-3040.2003.00846.x.
[19] JACKSON M, ARMSTRONG W. Formation of aerenchyma and the processes of plant ventilation in relation to soil flooding and submergence[J]. Plant Biology, 1999, 1(3): 274-287. doi: 10.1111/j.1438-8677.1999.tb00253.x.
[20] PI N, TAM N, WU Y, WONG M H. Root anatomy and spatial pattern of radial oxygen loss of eight true mangrove species[J]. Aquatic Botany,2009, 90(3): 222-230. doi: 10.1016/j.aquabot.2008.10.002.
[21] 邓泓,叶志鸿,黄铭洪. 湿地植物根系泌氧的特征[J]. 华东师范大学学报(自然科学版),2007(6): 69-76. doi: 10.3969/j.issn.1000-5641.2007.06.009.DENG H, YE Z H, HUANG M H. Characteristics of radial oxygen loss from root of wetland plants[J]. Journal of East China Normal University(Natural Science), 2007(6): 69-76.doi: 10.3969/j.issn.1000-5641.2007.06.009.
[22] 林剑华, 杨扬, 李丽, 麦晓蓓. 8种湿地植物的生长状况及泌氧能力[J]. 湖泊科学 , 2015, 27(6): 1042-1048. doi: 10.18307/2015.0608.LIN J H, YANG Y, LI L, MAI X B. Characteristics of growth and radial oxygen loss of eight wetland plants[J]. Journal of Lake Sciences,2015, 27(6): 1042-1048. doi: 10.18307/2015.0608.
[23] TIMMERS R A, STRIK D P, ARAMPATZOGLOU C, BUISMAN C J, HAMELERS H V. Rhizosphere anode model explains high oxygen levels during operation of a Glyceria maxima PMFC[J]. Bioresource Technology, 2012, 108:60-67. doi: 10.1016/j.biortech.2011.10.088.
[24] 吴瑾妤,赵娟,李秀芬,陈坚. 基于pH值调控的沉积型微生物燃料电池(SMFC)运行特性[J]. 环境化学,2011, 30(6): 1162-1167.WU J Y, ZHAO J, LI X F, CHEN J. pH regulation of sediment microbial fuel cell performance[J]. Environmental Chemistry, 2011, 30(6):1162-1167.
[25] 吴夏芫,宋天顺,支银芳,周楚新,俞俊杰,朱隽瑶. 小球藻生物阴极型微生物燃料电池的基础特性[J]. 过程工程学报,2012, 12(1):131-135.WU X Y, SONG T S, ZHI Y F, ZHOU C X, YU J J, ZHU J Y. Research on basic characteristics of a microbial fuel cell with Chlorella vulgaris biocathode[J]. The Chinese Journal of Process Engineering, 2012,12(1): 131-135.