【研究意义】 彩叶芋(Caladium bicolor)属天南星科,别名花叶芋、五彩芋,原产于南美洲,为多年生草本植物,因其叶片色彩和图案丰富而成为观叶植物中的上品[1-3],具有较高的观赏价值和经济价值。自彩叶芋在亚马逊流域被发现以来,经过长期的引种驯化、世代杂交,至今全世界已培育出370多个专供观赏的彩叶芋品种[4]。比较常见的栽培品种有白雪彩叶芋(Caladium hortulanum‘Candidum’)、银翼彩叶芋(C.hortulanum‘Ciation’)、红艳彩叶芋(C.hortulanum‘Postman Joyner’)、红脉彩叶芋(C.hortulanum‘Jessiethayer’)、粉红彩叶芋(C.hortulanum‘Gen.W.B.Halderman’)、 红点彩叶芋(C.hortulanum‘Marie Moir’)、娇点彩叶芋(C.hortulanum‘Miss Muffet’)、漆斑彩叶芋(C.hortulanum‘Wightii’)、漆翼彩叶芋(C.hortulanum‘Jody’)等[4-6]。彩叶芋适应性较强,在南北方均见栽植,除热带地区可以播种繁殖外,其他地区因为气候环境等条件的限制,难以自然结实,目前主要依靠块茎分株繁殖[7]。但是,由于块茎分株繁殖方式具有繁殖系数低、生长慢、成本高等特点,市场上该花卉价格普遍较高,且生产供不应求[7-8]。组织培养技术是目前植物快繁最有效的方法之一[9],并能使物种保持稳定的性状,满足大规模生产的需要[10-11]。【前人研究进展】 国内外学者早在20世纪80年代就开始研究彩叶芋的组织培养和快速繁殖技术[12],然而近十几年来关于彩叶芋组织培养的研究甚少报道[13]。在彩叶芋离体快繁中,激素的种类与配比是关键因素之一,目前应用的激素主要有NAA、6-BA、KT、IAA、2,4-D等。虽然国内外对彩叶芋不同生长阶段所需的最佳激素配比都进行了一些研究,但研究结果不尽相同[13]。其中,诱导彩叶芋产生愈伤组织的最佳激素配比在MS+6-BA 2~3 mg/L+NAA 0.2~1 mg/L之间。【本研究切入点】 在前人研究基础上,本研究设置更多不同浓度的激素组合,以探索6-BA和NAA的不同组合对彩叶芋愈伤组织诱导和分化增殖的影响,确定最佳的生长调节剂配比,为促进彩叶芋组培快繁技术研究及实现优良品种工厂化生产奠定基础。【拟解决的关键问题】 外植体的消毒灭菌以及组织培养物褐化的预防,是构建高效彩叶芋组织快繁系统的关键。因此,研究过程中不可忽视对外植体、培养基及有机添加物、消毒方法和培养方法等的选择。
1 材料与方法
1.1 试验材料
供试材料为漆斑彩叶芋(C.hortulanum‘Wightii’)和红艳彩叶芋(C.hortulanum ‘Postman Joyner’)两个品种(图1),由浙江农林大学提供。

图1 供试彩叶芋品种
Fig.1 Tested Caladium bicolor cultivars
A:漆斑彩叶芋,B:红艳彩叶芋
A: C.hortulanum‘Wightii’; B: C.hortulanum‘Postman Joyner’
1.2 试验方法
1.2.1 外植体消毒 取刚抽出未展开的幼嫩叶片为外植体,蒸馏水冲洗干净后,在超净工作台上用75%乙醇消毒1 min,再用0.1%升汞(加入2滴吐温-80)浸泡5 min,期间轻轻摇动,然后用无菌水冲洗5次。将幼叶切成0.5 cm×0.8 cm左右的小块,接种到培养基上,接种后15 d按如下公式计算污染率:
1.2.2 愈伤组织诱导培养 选用MS培养基进行愈伤组织诱导:蔗糖3%、琼脂0.7%、活性炭0.1%、附加不同浓度的6-BA(2.0、3.0、4.0 mg/L)、NAA(0.2、0.5、1.0 mg/L),pH 6.0。先暗培养1周,培养温度25(±2)℃,接着光照时间12 h/d、光照强度1 500 lx。接种后定期进行观察并统计启动时间和产愈率,其中启动时间指从外植体接种到60%以上的外植体出现愈伤组织所需的时间,统计时假设污染率为0,产愈率计算公式为:

1.2.3 愈伤组织增殖分化培养 将叶片产生的愈伤组织接种到附加不同浓度6-BA(1.0、2.0 mg/L)和NAA(0.1、0.2、0.5 mg/L)的MS培养基上,添加蔗糖3%、琼脂0.7%、活性炭0.1%,pH 6.0。接种后30 d按如下公式计算愈伤组织分化率和分化系数(统计时均假设污染率为0):

1.2.4 炼苗移栽 把生根良好的彩叶芋试管苗开盖培养7 d,然后洗净根部培养基,种植在经过高温消毒的基质(由泥炭、蛭石、珍珠岩混合)中,搭塑料薄膜棚保湿,并置于人工气候室中,7 d后撤去薄膜,定期浇水,30 d后统计其成活率:
2 结果与分析
2.1 彩叶芋外植体的消毒灭菌
采用刚抽出未展开的幼嫩叶片为外植体,蒸馏水冲洗后先用75%乙醇消毒1 min,再用0.1%升汞(加入2滴吐温-80)浸泡5 min,消毒灭菌效果良好,接种15 d后总污染率仅为5.7%,既保证了较低的污染率,又避免过高浓度的消毒剂以及过长的消毒时间降低愈伤组织的启动时间和产愈率。
2.2 彩叶芋愈伤组织的诱导
由表1可知,6-BA浓度在2.0~4.0 mg/L范围内均能实现愈伤组织的诱导效果,但6-BA、NAA不同浓度组合的诱导效果及愈伤组织的颜色会存在差异,不同组合配比诱导产生漆斑彩叶芋和红艳彩叶芋叶片愈伤组织的时间为35~50 d,产愈率均在60%以上。当NAA浓度恒定、6-BA浓度为2.0~4.0 mg/L时,随着6-BA浓度的增加,愈伤组织产生的时间缩短、产愈率提高,其中以添加有6-BA 4.0 mg/L+NAA 0.5 mg/L的MS培养基效果最好,启动时间短,并且产愈率高。
表1 不同NAA、6-BA配比对两种彩叶芋愈伤组织诱导的影响
Table 1 Effect of NAA and 6-BA with different concentration on callus induction of two Caladium bicolor
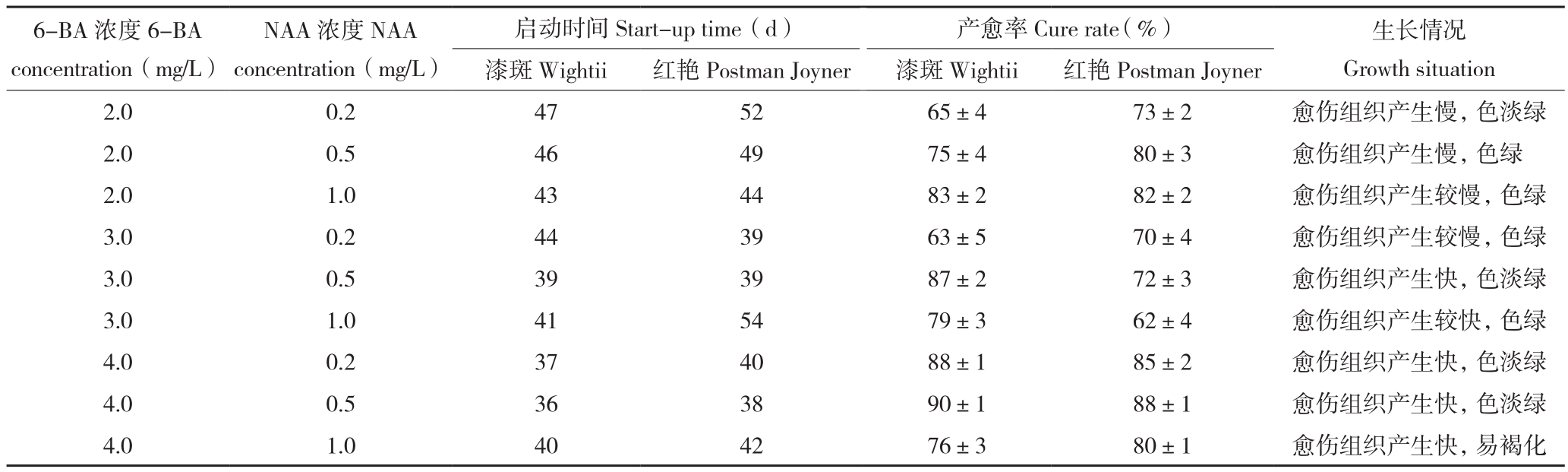
注:漆斑代表漆斑彩叶芋,红艳代表红艳彩叶芋。
Note : Wightii represents C.Hortulanum‘Wightii’, Postman Joyner represents C.Hortulanum‘Postman Joyner’.
6-BA浓度6-BA concentration(mg/L)启动时间Start-up time(d)产愈率Cure rate (%)生长情况Growth situation漆斑Wightii 红艳Postman Joyner 漆斑Wightii 红艳Postman Joyner 2.0 0.2 47 52 65±4 73±2 愈伤组织产生慢,色淡绿2.0 0.5 46 49 75±4 80±3 愈伤组织产生慢,色绿2.0 1.0 43 44 83±2 82±2 愈伤组织产生较慢,色绿3.0 0.2 44 39 63±5 70±4 愈伤组织产生较慢,色绿3.0 0.5 39 39 87±2 72±3 愈伤组织产生快,色淡绿3.0 1.0 41 54 79±3 62±4 愈伤组织产生较快,色绿4.0 0.2 37 40 88±1 85±2 愈伤组织产生快,色淡绿4.0 0.5 36 38 90±1 88±1 愈伤组织产生快,色淡绿4.0 1.0 40 42 76±3 80±1 愈伤组织产生快,易褐化NAA浓度NAA concentration(mg/L)
2.3 彩叶芋愈伤组织的增殖分化
对添加了不同NAA、6-BA配比的培养基愈伤组织分化过程进行观察和统计,结果(表2)表明,当NAA浓度保持不变、6-BA浓度为1.0~2.0 mg/L时,随着6-BA浓度的增加,彩叶芋愈伤组织的分化率有明显提高。其中MS+6-BA 2.0 mg/L+NAA 0.2 mg/L为最佳培养基,愈伤组织分化率最高,分化系数最高,试管苗的生长情况也最好。漆斑彩叶芋组织培养的全流程见图2。
2.4 彩叶芋组培苗的炼苗移栽
对生根良好的彩叶芋组培苗进行驯化移栽,在培养室内开盖培养1周后,小心取出幼苗并洗净根部培养基,移栽至由泥炭、蛭石、珍珠岩混合而成的苗床基质(提前经过高温消毒)中,苗床上方搭建塑料膜棚保湿,而后置于人工气候室中。1周后撤除薄膜,定期浇水培养,保证基质湿润,1个月后漆斑彩叶芋和红艳彩叶芋的成活率均达90%以上,植株长势良好。
表2 不同NAA、6-BA配比对两种彩叶芋愈伤组织增殖分化的影响
Table 2 Effect of NAA and 6-BA with different concentration on callus differentiation of two Caladium bicolor
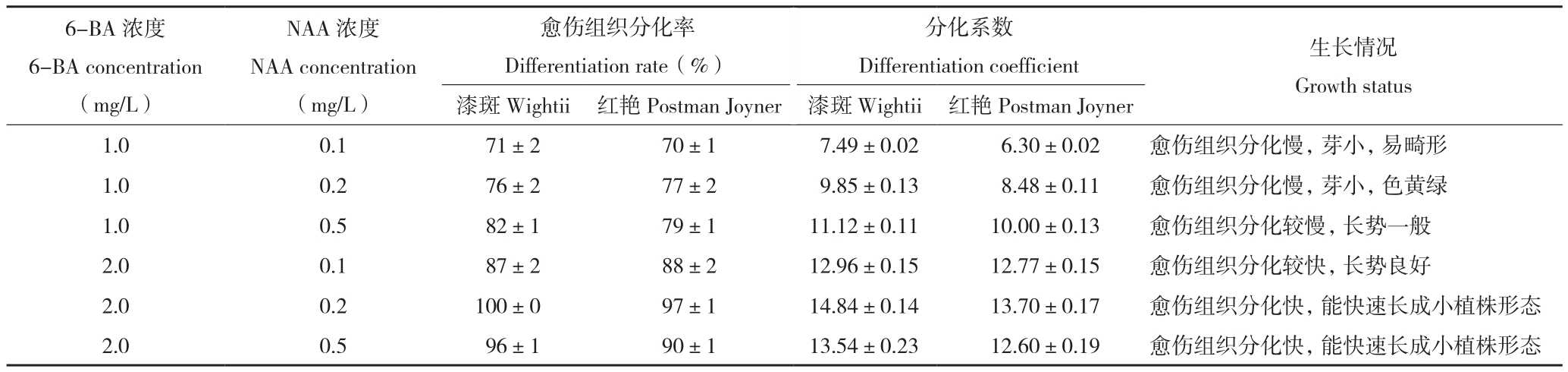
注:漆斑代表漆斑彩叶芋,红艳代表红艳彩叶芋。
Note: Wightii represents C.Hortulanum ‘Wightii’, Postman Joyner represents C.Hortulanum ‘Postman Joyner’.
6-BA浓度6-BA concentration(mg/L)分化系数Differentiation coefficient 生长情况Growth status漆斑Wightii 红艳Postman Joyner 漆斑Wightii 红艳Postman Joyner 1.0 0.1 71±2 70±1 7.49±0.02 6.30±0.02 愈伤组织分化慢,芽小,易畸形1.0 0.2 76±2 77±2 9.85±0.13 8.48±0.11 愈伤组织分化慢,芽小,色黄绿1.0 0.5 82±1 79±1 11.12±0.11 10.00±0.13 愈伤组织分化较慢,长势一般2.0 0.1 87±2 88±2 12.96±0.15 12.77±0.15 愈伤组织分化较快,长势良好2.0 0.2 100±0 97±1 14.84±0.14 13.70±0.17 愈伤组织分化快,能快速长成小植株形态2.0 0.5 96±1 90±1 13.54±0.23 12.60±0.19 愈伤组织分化快,能快速长成小植株形态NAA浓度NAA concentration(mg/L)愈伤组织分化率Differentiation rate(%)

图2 漆斑彩叶芋组织培养
Fig.2 Tissue culture of Caladium hortulanum ‘Wightii’
A:幼嫩叶片的接种;B:叶片边缘处出现膨大的圆粒状愈伤组织;C:愈伤组织分化;D:再生植株
A: Inoculation of young leaves; B: Inflated round granular callus appeared at the edge of leaf blades; C: Callus differentiation; D: Regeneration plant
3 讨论
在植物组织培养中,只有各种植物生长调节剂浓度组合适合的培养基才能很好地诱导细胞分裂的启动、愈伤组织的分化成长以及基本器官的形成[15]。在一定浓度范围内,不同的植物生长调节剂组合对愈伤组织增殖分化影响不同[16-17]。本研究发现,在脱分化培养过程中,彩叶芋在不同浓度组合的植物生长调节剂培养下均能产生愈伤组织并再生出植株[18],可见彩叶芋在组织培养中对植物生长调节剂的适应范围比较广,这与李维强等[19]的研究结论相同。本试验还发现,采用组培出的彩叶芋植株再进行组织培养,产生愈伤组织的时间大大缩短、污染率也减少。
愈伤组织诱导的启动时间、产愈率、愈伤组织分化率以及愈伤组织分化增殖的能力与彩叶芋品种有关,本研究试验材料漆斑彩叶芋和红艳彩叶芋之间的愈伤组织诱导能力存在差异,与李维强等[19]的试验结果不完全一致。在添加了不同配 比 6-BA(2.0、3.0、4.0 mg/L)、NAA(0.2、0.5、1.0 mg/L)的9种MS培养基中,以6-BA 4.0 mg/L+NAA 0.5 mg/L的诱导愈伤组织产生的能力最好;对愈伤组织的增殖分化培养基来说,在6-BA浓度为1.0、2.0 mg/L以及NAA浓度为0.1、0.2、0.5 mg/L范围内,以6-BA 2.0 mg/L+NAA 0.2 mg/L为最佳配比。本试验在前人基础上,进一步细化了6-BA和NAA的浓度范围,所设组合不一,因此得出的最佳植物生长调节剂配比与前人不完全相同。针对不同品种彩叶芋,可以在最佳植物生长调节剂浓度配比上进行优化,设置更加精确的浓度梯度配比试验,以促进彩叶芋组培快繁技术的发展。
褐化是组织培养过程中普遍存在的现象,轻则抑制愈伤组织生长,重则导致外植体迅速死亡。褐变产生的机理主要是植物组织细胞受到伤害,导致其还原性物质被空气中的氧气氧化成醌类物质,后者具有细胞毒性[20-21]。控制褐化比控制污染和玻璃化更加困难。目前通常采用的缓解褐化方法如下:在培养基中适当加入活性炭、抗氧化剂(如抗坏血酸),愈伤组织在短时间内反复转接,适当降低温度和光照,降低激素浓度,降低无机盐浓度,在未培养前选取生长活跃的部位等[22-24]。研究表明,添加活性碳、适时切除褐变部位并及时更换新鲜培养基、使用添加有椰子水的培养基、采用适宜培养温度等,均能较好地防止褐变死亡的发生[25-26]。本试验为解决褐变问题,采用选取刚长出未展开幼叶为外植体、在培养基中添加0.1%活性炭、暗培养7 d、缩短转接时间等方法,效果比较好。
4 结论
本试验结果表明,MS+6-BA 4.0 mg/L+NAA 0.5 mg/L是适合彩叶芋愈伤组织诱导的最佳培养基,愈伤组织产生快,启动时间短,产愈率高,产生的愈伤组织颜色淡绿。漆斑彩叶芋的愈伤组织诱导效果优于红艳彩叶芋,表现为启动时间更短、产愈率更高。MS+6-BA 2.0 mg/L+NAA 0.2 mg/L是适合彩叶芋分化增殖的最佳培养基,愈伤组织分化率最高,愈伤组织分化快,能快速长成小植株形态,试管苗生长情况最好,且无需经过诱导生根即可在已形成的苗基部自然生长出几条浅绿色根。
[1] CAI X D, CAO Z, XU S X, DENG Z N.Induction, regeneration and characterization of tetraploids and variants in‘Tapestry’Caladium[J].Plant Cell Tissue & Organ Culture, 2015, 120(2): 689 -700.
[2] 韩清华.彩叶芋的品种及栽培管理[J].中国花卉园艺,2007(12):34-35.
HAN Q H.Varieties and cultivation management of Caladium bicolor[J].China Flowers & Horticulture, 2007(12): 34-35.
[3] BALDWIN D, MIRANDA G J, WILFRET B K, HARBAUGH.‘Florida White Ruffles’-A white strap-leaved Caladium for small pots, hanging baskets, or sunny landscapes[J].Hort Science, 2002, 5: 838-840.
[4] 周肇基.七彩缤纷彩叶芋[J].花木盆景(花卉园艺),2009(3):16-17.
ZHOU Z J.Colorful Caladium bicolor[J].Flower Plant & Penjing,2009(3): 16-17.
[5] 周肇基.观叶新宠彩叶芋[J].花木盆景(花卉园艺),2000(12):4.
ZHOU Z J.New favorite of foliage Caladium bicolor[J].Flower Plant& Penjing, 2000(12): 4
[6] 周默 .彩叶植物新品[J].中国花卉园艺,2016(6):56.
ZHOU M.Colorful leaf plant[J].China Flowers & Horticulture,2016(6): 56.
[7] 蔡明.花叶芋组培快繁技术[J].内蒙古林业,1999(9):28.
CAI M.Tissue culture and rapid propagation of Caladium bicolor[J].Inner Mongolia Forestry, 1999(9): 28.
[8] 李国义,龚束芳,张丽梅,朱祥春,车代弟.彩色马蹄莲组培快繁技术的研究[J].北方园艺,2004(2):64-65.
LI G Y, GONG S F, ZHANG L M, ZHU X C, CHE D D.Study on tissue culture and rapid propagation of Zantedeschia hybida[J].Northern Horticulture, 2004(2): 64-65.
[9] 张东旭,周增产,卜云龙,张洁,张晓文,张成波,蔡伟健,康静,肖政.植物组织培养技术应用研究进展[J].北方园艺,2011(6):209-213.
ZHANG D X, ZHOU Z C, BU Y L, ZHANG J, ZHANG X W, ZHANG C B, CAI W J, KANG J, XIAO Z.Research progress on plant tissue culture technology[J].Northern Horticulture, 2011(6): 209-213.
[10] PENCE, VALERIE C.Evaluating costs for the in vitro propagation and preservation of endangered plants[J].In Vitro Cellular &Developmental Biology, 2011, 47(1): 176-187.
[11] 黄祖传.绚丽多彩的彩叶芋[J].中国花卉盆景, 1990(11):11.
HUANG Z C.Bright and colourful Caladium bicolor[J].China Flower& Penjing, 1990(11): 11.
[12] 董少鸣.彩叶芋的组织培养及快速繁殖[J].承德民族师专学报,2003,23(2):76.doi:10.16729/j.cnki.jhnun.2003.02.039.
DONG S M.The histocultivating of colored-leaves taros and its rapid reproduction[J].Journal of Chengde Teachers' College for Nationalities, 2003, 23(2): 76.doi:10.16729/j.cnki.jhnun.2003.02.039.
[13] 王颖,陆国权.彩叶芋组织培养研究进展[J].北方园艺,2012(12):196-198.
WANG Y, LU G Q.Research advances of Caladium bicolor[J].Northern Horticulture, 2012(12): 196-198.
[14] 吴蓓,戴修纯,郑岩松,张木清,李光光,陈胜文,刘绍钦.大田苦瓜的离体快繁研究[J].广东农业科学,2017,44(12):27-32.doi:10.16768/j.issn.1004-874X.2017.12.005.
WU B, DAI X C, ZHENG Y S, ZHANG M Q, LI G G, CHEN S W, LIU S Q.In vitro propagation of bitter gourd (Momordica charantia Linn.) for field culti-vation[J].Guangdong Agricultural Sciences, 2017, 44(12):27-32.doi :10.16768/j.issn.1004-874X.2017.12.005.
[15] 高燕会,童再康,黄华宏,郭福起,郁重彦.花叶络石的组织培养[J].浙江农林大学学报,2006,23(6):701-704.
GAO Y H, TONG Z K, HUANG H H, GUO F Q, YU C Y.Tissue culture on Trachelospermum jasminoides `Variegatum'[J].Journal of Zhejiang A & F University, 2006, 23(6): 701-704.
[16] 陈月桂,谭嘉娜,官锦燕,罗剑飘,黄海英,罗青文,杨俊贤,李奇伟.甘蔗新品种粤糖03-373组培快繁试验[J].广东农业科学,2017,44(5):13-18.doi:10.16768/j.issn.1004-874X.2017.05.003.
CHEN Y G, TAN J N, GUAN J Y, LUO J P, HUANG H Y, LUO Q W, YANG J X, LI Q W.Tissue culture and rapid propagation of Yuetang 03-373, a new sugarcane variety[J].Guangdong Agricultural Sciences, 2017,44(5): 13-18.doi:10.16768/j.issn.1004-874X.2017.05.003.
[17] 吴满良,李冬梅,朱根发,刘小飞.紫花山奈的组培快繁研究[J].广东农业科学,2018,45(7):29-33.doi:10.16768/j.issn.1004-874X.2018.07.005.
WU M L, LI D M, ZHU G F, LIU X F.In vitro rapid propagation of Kaempferia elegans[J].Guangdong Agricultural Sciences, 2018,45(7):29-33.doi:10.16768/j.issn.1004-874X.2018.07.005.
[18] 蔡小东,DENG Z N.彩叶芋愈伤组织的诱导、增殖及植株再生[J].江苏农业科学,2016,44(9):75-77.doi:10.15889/j.issn.1002-1302.2016.09.021.
CAI X D, DENG Z N.Callus induction, proliferation and plantlet regeneration of Caladium bicolor[J].Jiangsu Agricultural Sciences,2016, 44(9): 75-77.doi:10.15889/j.issn.1002-1302.2016.09.021.
[19] 李维强,刘静.花叶芋组培快繁的应用研究[J].郑州牧业工程高等专科学校学报,2004(4):260-261.
LI W Q, LIU J.Study on the technology of Caladium bicolor tissue culture and rapid multiplication[J].Journal of Zhengzhou College of Animal Husbandry & Engineering, 2004(4): 260-261.
[20] 祝骥,姚汝华,黄毓文,梁承邺.苦丁茶愈伤组织的诱导与褐变抑制[J].热带亚热带植物学报,2000,8(4):319-323.
ZHU J, YAO R H, HUANG Y W, LIANG C Y.Callus induction and browning inhibition in Ilex kudingcha C.J.TSENG[J].Journal of Tropical and Subtropical Botany, 2000, 8(4): 319-323.
[21] 罗阳春,杨云,李仕伟,方芳,王鹏蒲,全波,郑祖平.组织培养中植物外植体及愈伤组织褐变的研究进展[J].贵州农业科学,2018,46(1): 5-10.
LUO Y C, YANG Y, LI S W, FANG F, WANG P P, QUAN B, ZHENG Z P.Research progress on browning of explant and callus in plant tissue culture[J].Guizhou Agricultural Sciences, 2018, 46(1): 5-10.
[22] BROOME O C, ZIMMERMAN R H.In vitro propagation of blackberry[J].Hortieulture Science, 1978, 13: 151-153.
[23] 肖小君,罗潼,王芳.木本植物组织培养过程中褐变现象及控制措施的研究进展[J].江苏农业科学,2017,45(16):20-24.doi:10.15889/j.issn.1002-1302.2017.16.004.
XIAO X J, LUO T, WANG F.Research process on browning and control measures of woody plants tissue culture[J].Jiangsu Agricultural Sciences, 2017, 45(16): 20-24.doi:10.19415/j.cnki.1673-890x.2015.36.009.
[24] 任辉丽.植物组培技术常见问题及其预防措施[J].南方农业,2015,36(9):20-21.doi:10.19415/j.cnki.1673-890x.2015.36.009.
REN H L.Common problems and preventive measures of plant tissue culture technology[J].South China Agriculture, 2015, 36(9): 20-21.doi:10.19415/j.cnki.1673-890x.2015.36.009.
[25] 姚丽娟,徐晓薇,林绍生,陈中林,陈义增.洋兰组培快繁褐变抑制因子探讨[J].北方园艺,2006(4):162-163.
YAO L J, XU X W, LING S S, CHEN Z L, CHEN Y Z.Inhibitor of browning in tissue culture of orchid[J].Northern Horticulture,2006(4): 162-163.
[26] 贾荟芹,高龙梅,李薇,杨小丽,胡振兴.黄花菜组织培养褐变研究[J].农业开发与装备,2015(8):69.
JIA H Q, GAO L M, LI W, YANG X L, HU Z X.Study on browning in tissue culture of Hemerocallis citrine Baroni[J].Agricultural Development & Equipments, 2015(8): 69.