【研究意义】 索邦(Sorbonne)和西伯利亚(Siberia)百合均属于东方百合杂种系,为百合中的名贵品种群,由于其花色丰富、气味芳香而深受人们喜爱,成为近年国内外市场热销的花卉种类之一,栽培面积也日益增长,在切花生产中的地位也越来越重要。百合主要靠分球繁殖,繁殖系数低,传统的鳞茎球繁殖方法繁殖速度缓慢,而离体培养繁殖速度快,有利于工厂化和规模化生产[1]。利用组织培养技术,既能脱毒、又能加快其生长发育周期,从而更好地利用其经济价值和开发其潜力[2] 。【前人研究进展】 近年来,国内学者对多种百合进行离体培养研究[3-8],随着东方百合在市场上越来越受欢迎,对东方百合的离体研究也逐渐增多[9-12]。龙彬等[13]研究表明,株洲红东方百合的组培苗在-1 ℃条件下冷藏40 d为最佳并有助于炼苗成功。农艳丰等[14]研究了东方百合甜梦品种花器官的组织培养,结果表明花器官中子房最容易诱导愈伤组织,花柱、花药次之,花托为最难诱导愈伤组织。目前东方百合的离体培养研究取得较大进展,如针对索邦,不同研究所报道的适宜培养基配方不同。梁芳等[15]认为,索邦百合最佳增殖培养基是MS+NAA 0.1 mg/L+6-BA 1.0 mg/L,愈伤组织诱导最佳培养基是MS+IBA 0.1 mg/L+6-BA 1.0 mg/L,分化培养最佳培养基是MS+NAA 0.3 mg/L+TDZ 0.1 mg/L+KT 0.2 mg/L;西伯利亚百合在MS+NAA 0.1 mg/L+6-BA 1.0 mg/L培养基中愈伤组织的诱导和增殖最佳,分化培养最佳培养基是MS+IBA 1.0 mg/L+KT 0.5 mg/L;以上两个品种最佳生根培养基均为1/2 MS+NAA 0.1 mg/L+IBA 0.01 mg/L。闫海霞等[16]研究表明,提伯(Tiber)、索邦和西伯利亚等3种东方百合愈伤诱导和分化的适宜培养基为MS,最适增殖培养基为MS+6-BA 0.5 mg/L+NAA 0.5 mg/L,最适生根培养基为MS+IBA 0.1 mg/L。【本研究切入点】 目前东方百合的离体培养研究虽然取得较大进展,但是索邦、西伯利亚两种东方百合遗传转化再生系统研究仍较少[17-18]。【拟解决的关键问题】 确定索邦和西伯利亚百合的离体再生系统适合的诱导培养基、增殖培养基、生根培养基以及最佳转化受体系统,建立稳定、高效的索邦和西伯利亚百合的离体再生体系。
1 材料与方法
1.1 试验材料
供试材料为索邦百合和西伯利亚百合的无菌鳞茎球,购自中国芊卉种苗公司。
1.2 试验方法
1.2.1 外植体灭菌 取百合鳞茎球先经流水冲洗2 h,冲洗干净后把鳞片叶剥下,选取分化能力最强、与鳞茎盘相连的下部柔嫩鳞片叶,剔除菌斑及瑕眦;用75%酒精浸泡30 s、无菌水漂洗后放入0.1% AgCl2(0.02%吐温)中浸泡5~8 min,再用无菌水漂洗5次,滤纸吸干水分,切成3 mm×3 mm小块作外植体,背面朝下接种在培养基上。在人工控制培养室中培养,先暗培养7 d,培养温度 22~26 ℃,光照度 2 000~2 200 Lx,光照12 h/d。
1.2.2 愈伤组织及芽诱导培养基筛选 以MS为培养基,共设置11个不同的激素浓度组合,包括2,4-D(0.5、1.0、1.5、2.0 mg/L)+6-BA 0.2 mg/L、2,4-D(1.0、1.5、2.0 mg/L)、6-BA(2.0、1.5、1.0、0.5 mg/L)+NAA 0.2 mg/L。然后附加蔗糖3%、琼脂0.55%~0.65%,pH调至5.8,培养120 d,观察其生长状况,60 d统计启动率,120 d统计植株出芽频率、有效外植体平均出芽数和出苗平均高度。
1.2.3 继代增殖培养基筛选 接种60~90 d后诱导培养基中已长出大量愈伤组织和芽丛,将愈伤组织和丛芽切割成0.5 cm×0.5 cm小块,接入附加有不同激素配比(包括2,4-D 1.5 mg/L、2,4-D 1.0 mg/L、6-BA 0.5 mg/L+NAA 0.2 mg/L)的MS培养基上,定期观察两个品种在3个继代培养基中的生长状况,并统计芽增殖倍数、芽平均高度和生长势。
1.2.4 根诱导培养基筛选 将苗高3 cm以上且基部鳞茎球达到直径3 mm的无菌苗,移至附加不同激素配比(包括NAA 0.1、0.2、0.3 mg/L,IBA 0.1、0.2 mg/L)的1/2MS培养基中,40 d后统计生根数、根长和生长势。
1.2.5 炼苗移栽 待苗基部鳞茎球发育至直径达3 mm时,即可敞开瓶口在培养室中炼苗。1周后,用流动水清洗干净根系上的培养基,移入喷洒过0.2%达克宁的基质(沙∶花肥∶椰糠为1∶1∶1)中,温度为25 ℃,平均光照2 000 Lx,每天光照12 h,15 d后再移入花盆或大田中生长。
1.2.6 抗生素敏感实验 在获得最适合两种百合诱导增殖生根培养基的基础上,设5个卡那霉素浓度梯度(0、50、75、100、150 mg/L)。30 d后统计褐化率,观察发芽表现,筛选转化植株时卡那霉素的浓度。
2 结果与分析
2.1 不同激素配比对百合愈伤组织诱导的影响
百合鳞片块接入培养基中约15 d左右,鳞片颜色由白色变成绿色,接种20 d时鳞片表面及切口处出现白色及浅绿色突起,即出现了黄绿色愈伤组织,主要集中在不定芽上。每个鳞片上有数个突起,接种40~45 d时突起部位长出绿色芽丛,且鳞片基部出现愈伤组织并逐渐增大,至接种70~80 d时芽丛继续长高,而基部愈伤组织在生长的同时又出现新的芽点及芽丛。继续培养至120 d,可确定培养基各阶段的诱导及伸长芽的效率。
从表1可以看出,接种60 d时,索邦和西伯利亚在H4、H5、H11培养基上的启动率均高于其他培养基,百合在各诱导培养基中的愈伤及芽生长情况见图1。接种120 d 时,在H1~H3等3种培养基中,两种百合的植株出芽频率和有效外植体平均出芽数均相对较低,甚至出芽数为0。在H4培养基中,索邦百合虽然植株出芽频率为100%,但其有效外植体平均出芽数较低。两种百合的植株出芽频率和有效外植体平均出芽数均相对较低,甚至出芽数为0。而H5、H6、H7培养基中百合的有效外植体出芽数均大于5且出芽频率都为100%,表明单独使用2,4-D效果更好。索邦在H5、H6培养基中长出鳞茎球,西伯利亚在H6、H7培养基中也长出鳞茎球。H11培养中,百合的各项测定指标均显著高于H8、H9、H10、H11等4种培养基。综上说明,索邦的最适芽诱导和伸长培养基是MS+2,4-D 1.0~2.0 mg/L、MS+6-BA 0.5 mg/L+NAA 0.2 mg/L,西伯利亚的最适芽诱导和伸长培养基为MS+2,4-D 1.0~1.5 mg/L、MS+6-BA 0.5 mg/L+NAA 0.2 mg/L。
表1 不同激素配比对百合愈伤组织诱导的影响
Table 1 Effects of different hormone ratios on callus induction of Lilium
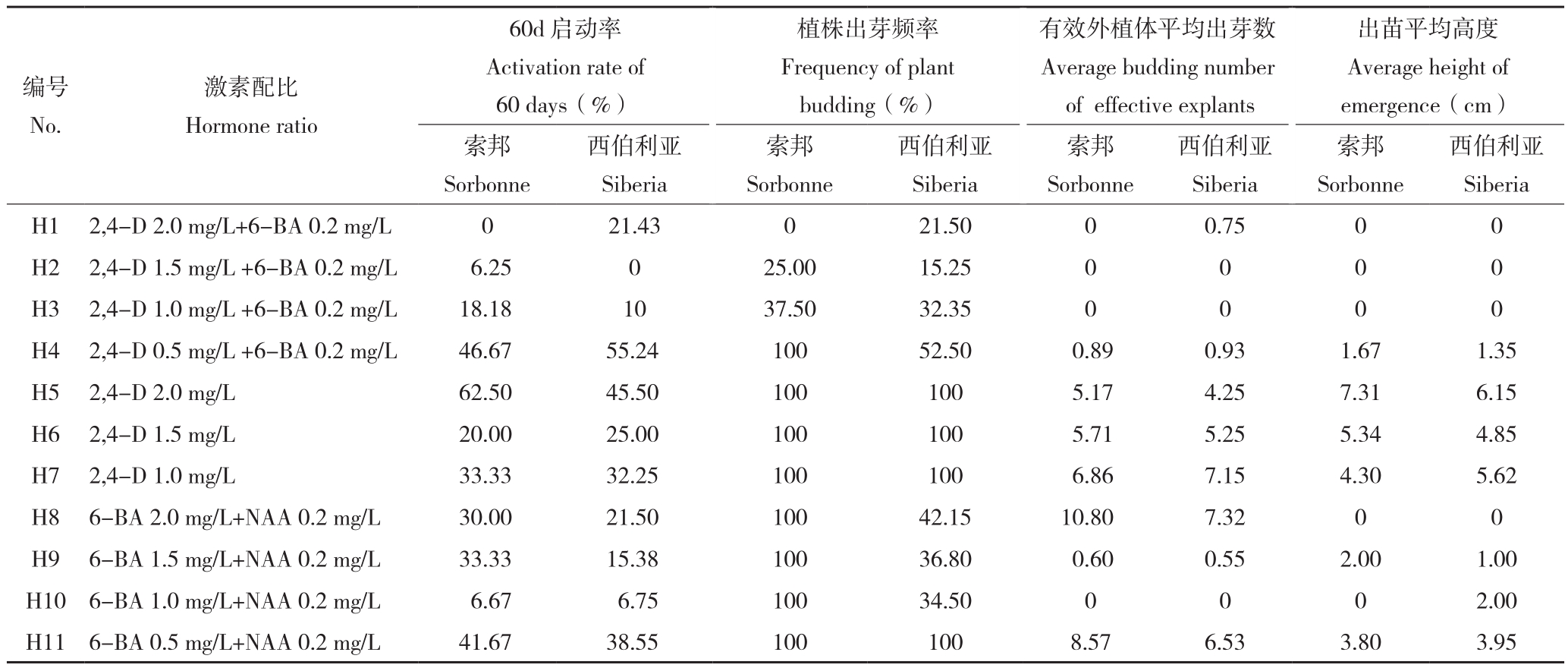
编号No.西伯利亚Siberia H1 2,4-D 2.0 mg/L+6-BA 0.2 mg/L 0 21.43 0 21.50 0 0.75 0 0 H2 2,4-D 1.5 mg/L +6-BA 0.2 mg/L 6.25 0 25.00 15.25 0 0 0 0 H3 2,4-D 1.0 mg/L +6-BA 0.2 mg/L 18.18 10 37.50 32.35 0 0 0 0 H4 2,4-D 0.5 mg/L +6-BA 0.2 mg/L 46.67 55.24 100 52.50 0.89 0.93 1.67 1.35 H5 2,4-D 2.0 mg/L 62.50 45.50 100 100 5.17 4.25 7.31 6.15 H6 2,4-D 1.5 mg/L 20.00 25.00 100 100 5.71 5.25 5.34 4.85 H7 2,4-D 1.0 mg/L 33.33 32.25 100 100 6.86 7.15 4.30 5.62 H8 6-BA 2.0 mg/L+NAA 0.2 mg/L 30.00 21.50 100 42.15 10.80 7.32 0 0 H9 6-BA 1.5 mg/L+NAA 0.2 mg/L 33.33 15.38 100 36.80 0.60 0.55 2.00 1.00 H10 6-BA 1.0 mg/L+NAA 0.2 mg/L 6.67 6.75 100 34.50 0 0 0 2.00 H11 6-BA 0.5 mg/L+NAA 0.2 mg/L 41.67 38.55 100 100 8.57 6.53 3.80 3.95激素配比Hormone ratio出苗平均高度Average height of emergence(cm)60d启动率Activation rate of 60 days(%)索邦 西伯利亚Sorbonne植株出芽频率Frequency of plant budding(%)有效外植体平均出芽数Average budding number of effective explants Siberia索邦Sorbonne西伯利亚Siberia索邦Sorbonne西伯利亚Siberia索邦Sorbonne

图1 索邦和西伯利亚百合在不同诱导培养基中的愈伤组织及芽生长情况
Fig.1 Callus and bud growth of Sorbonne and Siberia in different induction medium
A:索邦在MS+ 6-BA 0.5 mg/L+NAA 0.2 mg/L培养基中;B:索邦在MS+2,4-D 2.0 mg/L培养基中;
C:索邦在MS+2,4-D 0.5 mg/L +6-BA 0.2 mg/L培养基中;D:西伯利亚在MS+2,4-D 2.0 mg/L+6-BA 0.2 mg/L培养基中
A:Sorbonne in MS+6-BA 0.5 mg/L+NAA 0.2 mg/L medium; B:Sorbonne in MS+2,4-D 2.0 mg/L medium
C:Sorbonne in MS+2,4-D 0.5 mg/L +6-BA 0.2 mg/L medium;D:Siberia in MS+2,4-D 2.0 mg/L+6-BA 0.2 mg/L medium
2.2 不同激素配比对百合丛芽继代增殖的影响
由表2可知,在MS+2,4-D 1.5 mg/L培养基中,索邦和西伯利亚百合的增殖倍数最高、分别为2.76和4.51,且芽平均高度也最高、分别为5.03和5.17,但两种百合的长势均比MS+6-BA 0.5 mg/L +NAA 0.2 mg/L培养基中植株差。西伯利亚百合在MS+2,4-D 1.5 mg/L培养基中虽然分化出大量愈伤组织,但芽有畸形现象。而在MS+6-BA 0.5 mg/L +NAA 0.2 mg/L培养基中,百合苗较壮且没有畸形,芽与愈伤组织的密度也较合适。试验中还发现,两种百合培养一个周期后,西伯利亚百合在仅含有2,4-D的培养基中丛芽发生玻璃化现象,说明2,4-D对西伯利亚百合的抑制分化作用更明显。综合生长状况,我们认为在MS+6-BA 0.5 mg/L+NAA 0.2 mg/L中,两种百合繁殖出的愈伤组织和丛芽更健壮、密度也更合适。
表2 不同激素配比对百合丛芽继代增殖的影响
Table 2 Effects of different hormone ratio on subculture proliferation of Lilium cluster buds
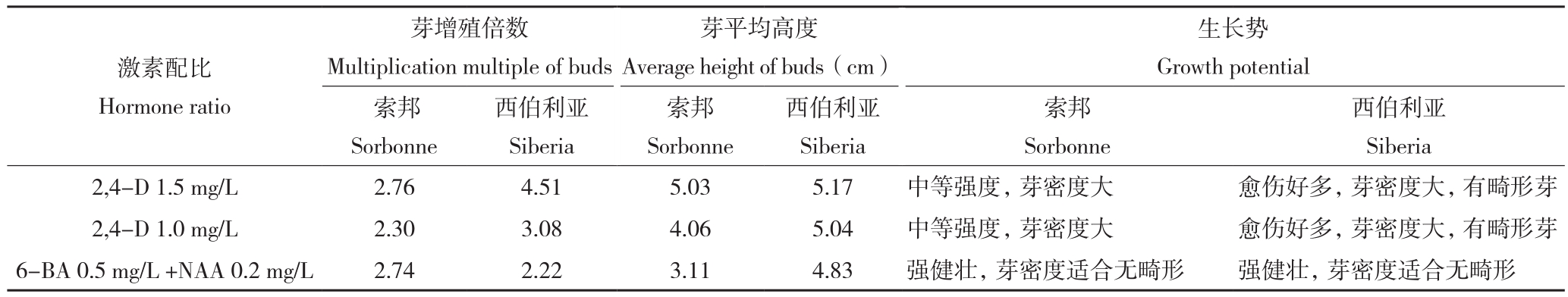
西伯利亚Siberia 2,4-D 1.5 mg/L 2.76 4.51 5.03 5.17 中等强度,芽密度大 愈伤好多,芽密度大,有畸形芽2,4-D 1.0 mg/L 2.30 3.08 4.06 5.04 中等强度,芽密度大 愈伤好多,芽密度大,有畸形芽6-BA 0.5 mg/L +NAA 0.2 mg/L 2.74 2.22 3.11 4.83 强健壮,芽密度适合无畸形 强健壮,芽密度适合无畸形激素配比Hormone ratio芽增殖倍数Multiplication multiple of buds生长势Growth potential索邦Sorbonne芽平均高度Average height of buds(cm)西伯利亚Siberia索邦Sorbonne西伯利亚Siberia索邦Sorbonne
2.3 不同激素配比对百合根诱导及移栽的影响
由表3可知,索邦和西伯利亚的根诱导培养基试验结果比较一致,在添加NAA 0.1~0.3 mg/L的MS培养基中,MS+NAA 0.2 mg/L中百合的平均根长度显著高于其他两种培养基,索邦和西伯利亚分别为1.13、3.70,平均生根数次于MS+NAA 0.3 mg/L培养基,且植株生长势好、根系粗壮。虽然MS+NAA 0.3 mg/L培养基中百合平均生根数最高,但是植株生长势相对于其他两种培养基较为弱。MS+IBA 0.1 mg/L培养基中百合的各项指标均显著高于MS+IBA 0.2 mg/L,且植株生长势好、根系粗壮。综合生根数、平均根长度和植株生长势,效果较好的生根培养基为1/2MS+NAA 0.2 mg/L、1/2MS+IBA 0.2 mg/L,IBA和NAA对促进百合生根效果相仿。
表3 不同激素配比对百合根诱导及移栽的影响
Table 3 Effects of different hormone ratios on the rooting induction and transplanting of Lilium
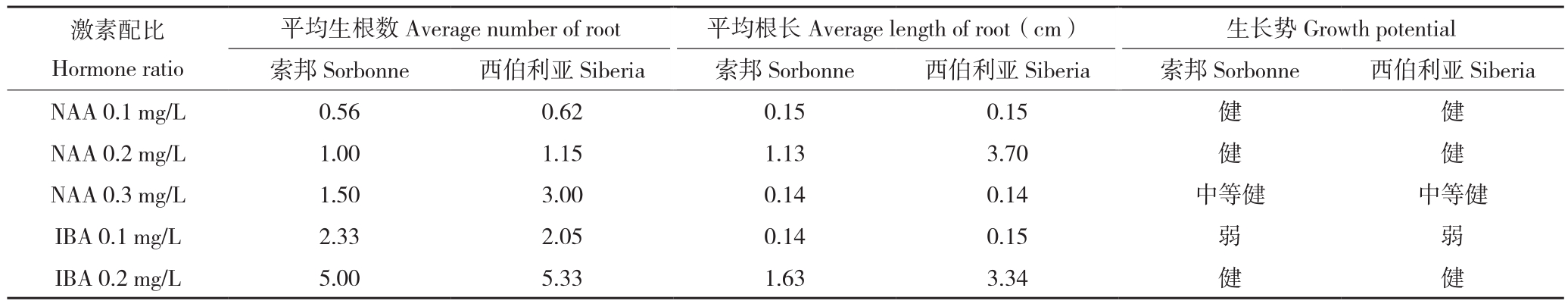
平均生根数Average number of root 平均根长Average length of root(cm) 生长势Growth potential索邦Sorbonne 西伯利亚Siberia 索邦Sorbonne 西伯利亚Siberia 索邦Sorbonne 西伯利亚Siberia NAA 0.1 mg/L0.560.620.150.15健健NAA 0.2 mg/L1.001.151.133.70健健NAA 0.3 mg/L 1.50 3.00 0.14 0.14 中等健 中等健IBA 0.1 mg/L2.332.050.140.15弱弱IBA 0.2 mg/L5.005.331.633.34健健激素配比Hormone ratio
2.4 卡那霉素抗性筛选
从表4可以看出,随着卡那霉素质量浓度的升高,两种百合褐化率上升、发芽数减少,外植体的生长和分化受到不同程度的影响。当卡那霉素质量浓度较低时,两种百合发芽正常,当卡那霉素质量浓度为150 mg/L时,两种百合褐化率分别高达100%和98%,无芽发生且芽呈黑褐色。可见,卡那霉素质量浓度越高,两种百合均表现为发芽减少并呈萎缩趋势,150 mg/L浓度能起到抑制未转化细胞的效果。
表4 百合鳞片对卡那霉素的抗性
Table 4 Resistance of Lilium scales to Kanamycin
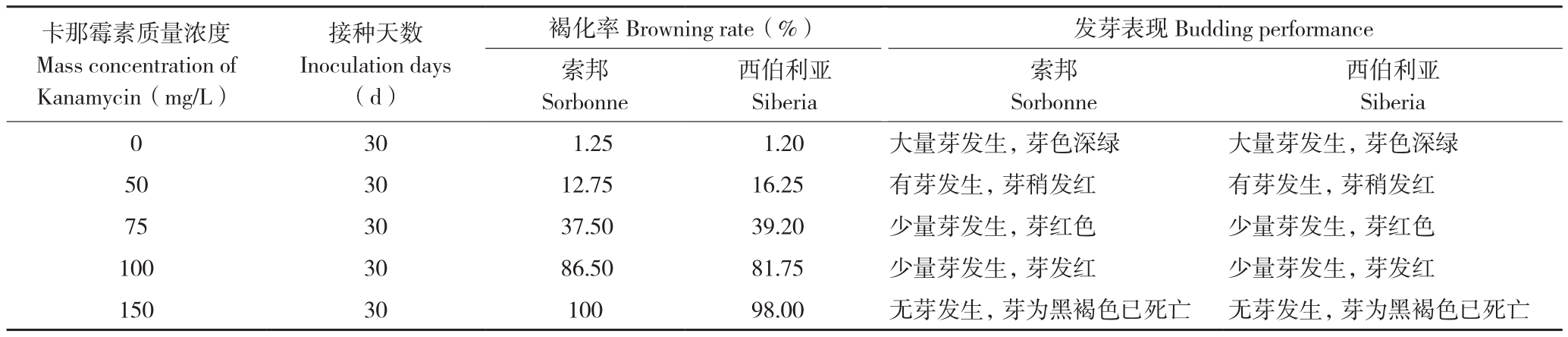
卡那霉素质量浓度Mass concentration of Kanamycin(mg/L)西伯利亚Siberia 0 30 1.25 1.20 大量芽发生,芽色深绿 大量芽发生,芽色深绿50 30 12.75 16.25 有芽发生,芽稍发红 有芽发生,芽稍发红75 30 37.50 39.20 少量芽发生,芽红色 少量芽发生,芽红色100 30 86.50 81.75 少量芽发生,芽发红 少量芽发生,芽发红150 30 100 98.00 无芽发生,芽为黑褐色已死亡 无芽发生,芽为黑褐色已死亡接种天数Inoculation days(d)褐化率Browning rate(%) 发芽表现Budding performance索邦Sorbonne西伯利亚Siberia索邦Sorbonne
3 讨论
3.1 不同激素配比对百合丛芽的影响
通过对索邦和西伯利亚百合离体快繁结果表明,在促进愈伤组织的诱导、继代增殖、生根培养中,生长调节剂的选择及其浓度都会影响芽的生长。同时发现索邦和西伯利亚在添加2,4-D的MS培养基中出芽效果更好,说明在适宜浓度下单独使用2,4-D比组合使用6-BA 0.5 mg/L+NAA 0.2 mg/L对百合丛芽持续生长的效果更明显,但其综合生长状况却不及组合激素发挥稳定。因此,单独使用2,4-D对百合分化芽的生长状况比再加入6-BA强,这与前人试验结果[19]相一致。在组合激素培养基中百合幼苗更加健壮,不易发生玻璃化现象。此外,本试验还观察到的6-BA在愈伤组织分裂中的作用,6-BA浓度过高(2.0 mg/L)会导致百合出苗长势变差,相对适宜的6-BA浓度为0.5 mg/L。我们认为,6-BA和NAA在百合增殖和生根中的作用是协同的,任意一种浓度过高或过低后会导致植株生长不良,两者比例合适时才能发挥最大效果。
3.2 百合转基因研究、抗生素对百合的敏感影响
目前,采用农杆菌介导法进行百合转基因研究中,大多采用的是在室外生长的鳞片叶进行消毒,然后与农杆菌共同培养[20],此法的最大缺点是污染率高,表面消毒对供试材料具有一定伤害,从而造成褐化,最终导致转化率降低。而本研究采用组织培养的方式,将鳞片叶直接作为基因转化受体材料,建立直接分化再生系统,此法的优势在于取材不受季节和气候的影响,且没有外植体污染问题,从而提升了转化效率。
唐东芹等[21]认为,在基因转化过程中百合外植体不能连续被分割,且在筛选培养基时抗生素会使有切口的外植体褐化并导致死亡,因此要保证外植体的完整性。说明百合再生能力强且适合离体培养,若以鳞片为外植体,其直接分化率高、分化周期短且分化能力强,是外植体稳定来源之一卡纳霉素的使用能有效抑制非转化细胞或细菌的生长,并且不影响转化细胞的生长效果,但转化筛选时必须保证外植体的完整性,防止伤口恶化。鳞片叶再生过程中,NAA和6-BA组合对鳞片叶再生效果好,且分化率高,可作为良好的受体。
4 结论
本研究以百合鳞茎片为外植体,比较了不同诱导培养基、增殖培养基、生根培养基的诱导、继代增殖、生根效果。结果表明,索邦百合的最佳诱导培养基是MS+2,4-D 1.5~2.0 mg/L,西伯利亚百合是2,4-D 1.0~1.5 mg/L;两种百合的最佳继代培养基均为MS+6-BA 0.5 mg/L+NAA 0.2 mg/L,最佳生根培养基均为1/2MS+NAA 0.2 mg/L、1/2MS+IBA 0.2 mg/L。以百合鳞茎片为受体系统而筛选转化植物时,卡那霉素最佳质量浓度为150 mg/L。本研究确定了两种百合的离体再生体系的技术参数,诱导培养开始7 d为暗培养,诱导培养基中培养60~90 d后,分割芽丛或新形成的小鳞茎片后接入继代培养基中继代45 d,再生根培养40~50 d,当芽苗高度达3 cm且新形成鳞茎球直径达3 mm时,炼苗7 d,然后移至基质(沙∶花肥∶椰糠为1∶1∶1)生长15 d后移入花盆或大田中生长。本研究结果可为东方百合品种种球工厂化生产及遗传转化再生体系提供充实理论依据。
[1] 黄惠英.东方百合的离体培养[J].甘肃农业大学学报,2000(4):450-453,464.doi:10.13432/j.cnki.jgsau.2000.4.016.
HUANG H Y.Culture of lily in vitro[J].Journal of Gansu Agricultural University,2000(4):450-453,464.doi:10.13432/j.cnki.jgsau.2000.4.016.
[2] 周春华,尤超,陈凝华.百合组织培养研究进展[J].北方园艺,2013(14):193-195.
ZHOU C H,YOU C,CHEN N H.Research advances on tissue culture of Lilium brownie[J].Northern Horticulture.2013(14):193-195.
[3] 宛淑艳,柳美红.铁炮百合快速繁殖技术研究[J].广东农业科学,2013,40(23):31-34.doi: 10.3969/j.issn.1004-874X.2013.23.009.
WAN S Y,LIU M H.Study on the rapid propagation of Lilium formolongi [J].Guangdong Agricultural Sciences,2013,40(23):31-34.doi: 10.3969/j.issn.1004-874X.2013.23.009.
[4] 常琳,杜方,王丽婷,李兴桃,张鲜艳,樊俊苗.金石和伯爵百合鳞茎诱导及膨大研究[J].山西农业科学,2018,46(8):1279-1281,1370.
CHANG L,DU F,WANG L T,LI X T,ZHANG X Y,FAN J M.Study on bulblet induction and enlargement of Golden Stone and Album Lily [J].Journal of Shanxi Agricultural Sciences,2018,46(8):1279-1281,1370.
[5] 李彪,莫鸿伟,卜顺法,汤桂钧,黄雪龙.百合优质种球的无性繁殖技术研究[J].上海农业科技,2018(5):93-94.
LI B,MO X W,BU S F,TANG G J,HUANG X L.Study on asexual propagation technology of Lily high quality germ balls[J].Shanghai Agricultural Science and Technology,2018(5):93-94.
[6] 王丽婷.百合组培苗鳞茎诱导及膨大研究[D].太原:山西农业大学,2017.
WAGN L T.Study on bulb induction and expansion of Lily by tissue culture[D].Taiyuan: Shanxi Agricultural University,2017.
[7] 仇硕,唐凤鸾,夏科,李秀娟,赵志国,蒋庆鸿,赵健.龙牙百合增殖培养及鳞茎生长发育研究[J].广东农业科学,2017,44(4):61-66.doi: 10.16768/j.issn.1004-874X.2017.04.010.
CHOU S,TANG F L,XIA K,LI X J,ZHAO Z G,JIANG Q H,ZHAO J.Propagation culture and bulbs development of Lilium brownii var.viridulum[J].Guangdong Agricultural Sciences,2017,44(4):61-66.doi: 10.16768/j.issn.1004-874X.2017.04.010.
[8] 王雅楠,薛莉,雷家军.新疆百合鳞片离体培养研究[J].东北农业大学学报,2017,48(4):30-35.doi:10.19720/j.cnki.issn.1005-9369.2017.04.005
WANG Y L,XUE L,LEI J J.Study on culture in vitro of scales in Lilium martagon var.pilosiusculum[J].Journal of North-east Agricultural University,2017, 48(4): 30-35.doi:10.19720/j.cnki.issn.1005-9369.2017.04.005.
[9] 吴昀.基于离体模式体系的百合小鳞茎发生发育机制研究[D].杭州:浙江大学,2016.
WU Y.The mechanisms of Lily bulblet initiation and development based on the in vitro model system[D].Hangzhou: Zhejiang University,2016.
[10] 于雪,张铭芳,封紫,袁晓娜,贾桂霞.6个东方百合品种的染色体核型分析[J].广东农业科学,2012,39(10):137-140,144.doi:10.3969/j.issn.1004-874X.2012.10.041.
YU X,ZHANG M F,FENG Z,YUAN X N,JIA G X.Karyotype analysis on 6 cultivars of Oriental Lilies[J].Guangdong Agricultural Sciences,2012,39(10):137-140,144.doi: 10.3969/j.issn.1004-874X.2012.10.041.
[11] 郑洁,王有国,崔光芬,王祥宁,蒋亚莲,马璐琳,段青,杜文文,贾文杰.东方百合可育品种及其不育突变体花药形成的细胞学观察[J].西南农业学报,2015,28(3):1246-1250.doi: 10.16213/j.cnki.scjas.2015.03.061.
ZHENG J,WANG Y G,CUI G F,WANG X N,JIANG T L,MA L L,DUAN Q,DU W W,JIA W J.Cytological observation of anther formation of Lilium‘Oriental Hybrids’ normal line and male sterile mutant line[J].Southwest China Journal of Agricultural Sciences,2015,28(3):1246-1250.doi: 10.16213/j.cnki.scjas.2015.03.061
[12] 朱庆松,徐函兵,刘秀青.东方百合索邦高效再生体系的建立[J].现代园艺,2018(15):7-10.doi: 10.14051/j.cnki.xdyy.2018.15.003.
ZHU Q S,XU H B,LIU X Q.Establishment of Sorbonne regeneration system of Oriental Lily[J].Xiandai Horticulture,2018(15):7-10.doi:10.14051/j.cnki.xdyy.2018.15.003.
[13] 龙彬,廖晓珊,郑思乡,龚建华,邓雅文.株洲红东方百合种球繁育技术[J].湖南农业科学,2018(7):5-7.doi: 10.16498/j.cnki.hnnykx.2018.07.002.
LONG B,LIAO X S,ZHENG S X,GONG J H,DENG Y W.Breeding technology of Oriental Lily of Zhuzhou Red[J].Hunan Agricultural Sciences,2018(7):5-7.doi:10.16498/j.cnki.hnnykx.2018.07.002.
[14] 农艳丰,杨美纯,宁云芬,周珊.东方百合“甜梦”花器官组织培养再生植株研究[J].农业研究与应用,2016(1):1-6.
NOGN Y F,YANG M C,NIGN Y F,ZHOU S.Study on tissue culture and regeneration of floral organ of Oriental Lilium“Sweet dreams”[J].Agricultural Research and Application,2016(1):1-6.
[15] 梁芳,蒋素华,崔波,李霞.两种东方系百合组织培养快繁技术[J].河南科学,2017,35(2):209-213.
LIANG F,JIANG S H,CUI B,LI X.Tissue culture and rapid propagation of two Lilium Orential Hybird[J].Henan Science,2017,35(2):209-213.
[16] 闫海霞,蒋月喜,邓杰玲,黄昌艳,王晓国,何荆洲,卜朝阳.3种东方百合离体培养[J].南方农业学报,2016,47(6):889-894.doi:10.3969/j.issn.2095-1191.2016.06.889.
YAN H X,JIANG Y X,DENG J L,HUANG C Y,WANG X G,HE J Z,PU Z Y.In vitro culture for 3 varieties of Oriental Lily[J].Journal of Southern Agriculture,2016,47(6):889-894.doi: 10.3969/j.issn.2095-1191.2016.06.889.
[17] 辛轶.东方百合‘贝尼尼’体细胞胚的诱导及蓝色基因遗传转化的研究[D].杨凌:西北农林科技大学,2012.
XIN T.Studies on somatic embryogenesis and genetic transformation with blue gene of oriental Lily 'BERNINI' [D].Yangling: Northwest A& F University,2012.
[18] 崔祺.花青素合成调节基因Bi/Cl转化东方百合‘索邦’的研究[D].北京:北京林业大学,2014.
CUI Q.Transformation of Lilium Oriental Hybrid ‘Sorbonne' with anthocyanin regulatory gene Bi/Cl[D].Beijing: Beijing Forestry University,2014.
[19] 马惠,郭扶兴,周俊彦,罗新谈.百合叶片愈伤组织的诱导和植株再生[J].植物生理学报,1992(4):284.
MA H,GUO F X, ZHOU J Y,LUO X T.Callus induction and plant regeneration in young leaves of Lilium concolor[J].Plant Physiology Communications,1992(4):284.
[20] 余桂红,马鸿翔,周淼平,黄益洪,陆维忠.百合农杆菌介导的遗传转化受体系统的建立[J].江西农业学报,2004(2):15-19.doi:10.19386/j.cnki.jxnyxb.2004.02.004.
YU G H,MA H X,ZHOU M P,HUANG Y H,LU W Z.Establishment of acceptor system of agrobacterium-mediated transformation of Lily[J].Acta Agriculturae Jiangxi,2004(2):15-19.doi:10.19386/j.cnki.jxnyxb.2004.02.004.
[21] 唐东芹,钱虹妹,黄丹枫,唐克轩.百合基因转化直接分化受体系统的建立[J].江苏农业科学,2003(3):48-51.doi:10.15889/j.issn.1002-1302.2003.03.019.
TANG D Q,QIAN H M,HUANG D F,TANG K X.Establishment of direct differentiation receptor system for Lily gene transformation[J].Jiangsu Agricultural Sciences,2003(3):48-51.doi:10.15889/j.issn.1002-1302.2003.03.019.