【研究意义】 斜带石斑鱼(Epinephelus coiodes)为鲈形目(Perciformes)鮨科(Serranidae)石斑鱼属(Epinephelus)鱼类,分布于热带、亚热带海域,是我国南方沿海(海南、广东、广西、福建等)重要的海水经济养殖鱼类[1-2]。斜带石斑鱼雌雄同体,属于先雌后雄的鱼类,目前对调控斜带石斑鱼性逆转的机制尚未清楚。
【前人研究进展】 具有保守DM结构域的转录因子(Double-sex and mab-3 relatated transcription factor,Dmrt)基因是指与果蝇 Dsx 基因和线虫Mab-3 基因同源的基因家族,Dmrt 基因家族由其DNA结合(DM)结构域分类,包括一组非经典的锌指,高度保守的DM结构域的特征在于其稳定两个锌离子的能力,每个锌离子位于由3个半胱氨酸和组氨酸配位的疏水核心内[3-6]。Dmrt 基因家族编码具有保守DNA结合域的转录因子,其在鱼、爬行动物、鸟类和哺乳动物的性腺中高度表达[7]。Dmrt 家族有多种功能,其生理作用涉及性别决定、胚胎发育、体节发育、组织器官形成以及调控肌肉发育等多个方面[8]。Dmrt 基因家族在不同的脊椎动物中数目不同,目前在小鼠中发现了 Dmrt1 ~ Dmrt8,在鸡中发现了 Dmrt1 ~ Dmrt3,在鸟类中发现了 4个家庭成员,在鱼类中发现了 Dmrt1 ~ Dmrt5[9]。Dmrt1 在鱼类中主要参与雄性调控,其沉默或基因突变会使青鳉鱼(Oryzias latipes)雄性逆转。青鳉鱼Dmrt1 Y 的第3个外显子包含1个氨基酸突变,会导致DMY的翻译提前终止,不能表达完整的DMY蛋白,失去DMY蛋白功能导致鱼发生了性别反转[10-11]。有研究基因敲除半滑舌鳎Dmrt1,证明 Dmrt1 是半滑舌鳎雄性性别决定基因。Dmrt2是鱼类发育研究中的一个重要基因,主要参与胚胎发育和配子的形成;通过对 Dmrt2表达谱研究发现,其参与青鳉和斑马鱼的性别发育,参与鸡与小鼠的性别胚胎发育[12]。Dmrt3 在发育中的小鼠前脑和脊髓中某些中间神经元中被检测到,在马和小鼠中起到运动协调器的作用;人类 Dmrt3 的顺式调节元件缺失可能导致前脑发育受损和步态异常[13];Dmrt3 在河豚(Takifugu rubripes)的器官发育以及斑马鱼神经系统中表达,也在性腺中表达[14]。Dmrt4 在生物上普遍存在选择性剪接现象及对雌性发育起重要作用,目前在奥利亚罗非鱼(Oreochromis aureus)、稀有鮈鲫(Grobiocypris rarus)等生物中发现了其不同剪接体[15-16]。Dmrt5 有助于调节细胞周期进程和神经元分化之间的微调,且Dmrt5通过调控 Cxxc4表达,从而抑制Wnt/β-catenin信号来影响早期胚胎头部的发育[17];Dmrt5 在斑马鱼中缺失会导致皮质显著减少,同时神经元数量减少。
【本研究切入点】 鉴于Dmrt 基因在斜带石斑鱼胚胎发育过程中的表达情况目前尚未清楚,本研究以Ecdmrt1、Ecdmrt2、Ecdmrt3基因为试验对象,研究这3个基因在斜带石斑鱼胚胎发育不同阶段的表达,为今后进一步研究斜带石斑鱼性逆转奠定基础。【拟解决的关键问题】 以斜带石斑鱼为研究对象,了解其胚胎发育过程及性腺不同时期 Dmrt 基因家族的表达模式,以期掌握Dmrt 基因家族在雌雄同体雌性先熟鱼类中的变化趋势,有助于我们深入研究 Dmrt 基因家族在胚胎发育中的调控作用,进一步确定 Dmrt 家族参与发育的相关基因,为揭示该类基因的表达规律及在鱼类胚胎发育中的功能,为探索斜带石斑鱼性逆转机制提供参考。
1 材料与方法
1.1 试验材料
供试的斜带石斑鱼来源于广东省海洋渔业试验中心。受精卵于室内以自然产卵方式取得,倒入提前备好的 1 L 烧杯中,在室内恒温(24±0.5℃)、静水中孵化。用显微镜观察胚胎的发育,分别取分裂期、囊胚期、原肠期、神经胚期、器官形成期、初孵仔鱼期的胚胎保存于RNAlater中,每组 5 个平行,作为提取 RNA 样品,4 ℃过夜,-20℃ 低温保存备用。
1.2 试验方法
1.2.1 引物设计 根据 NCBI 中的斜带石斑鱼Dmrt1 基因序列和斜带石斑鱼基因组基因库(与华大基因合作)中的斜带石斑鱼 Dmrt2/2b/3 基因序列,利用 Primer Premier5.0 软件设计特异性引物(表1)。
表1 荧光定量引物的设计
Table 1 Sequences of the primers for fluorescence quantification
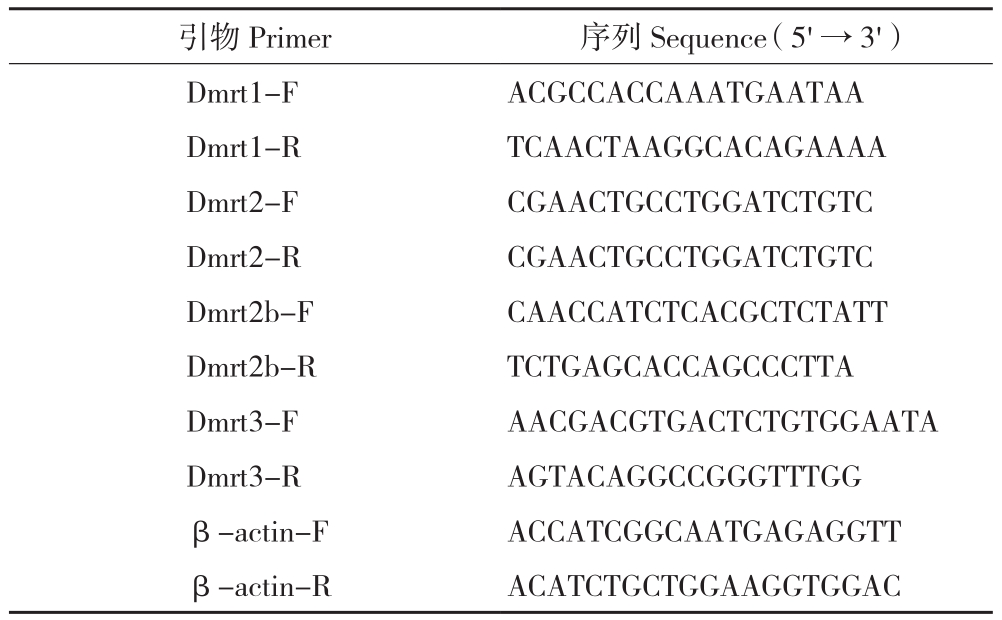
引物 Primer序列 Sequence (5'→3')Dmrt1-F ACGCCACCAAATGAATAA Dmrt1-R TCAACTAAGGCACAGAAAA Dmrt2-F CGAACTGCCTGGATCTGTC Dmrt2-R CGAACTGCCTGGATCTGTC Dmrt2b-F CAACCATCTCACGCTCTATT Dmrt2b-R TCTGAGCACCAGCCCTTA Dmrt3-F AACGACGTGACTCTGTGGAATA Dmrt3-R AGTACAGGCCGGGTTTGG β-actin-F ACCATCGGCAATGAGAGGTT β-actin-R ACATCTGCTGGAAGGTGGAC
1.2.2 RNA 提取及 cDNA 模版的制备 总 RNA的提取按照 Trizol® reagent(Invitrogen, USA)说明书进行操作,再反转录成 cDNA 模板,用于荧光定量 PCR。
1.2.3 荧光定量 PCR 及数据分析 以 cDNA 为 荧光定量PCR 模板,选取 β-actin 作为内参基因。选用 SYBR Green Real time PCR Master Mix plus kit(TOYOBO,Japan)试剂盒进行荧光定量PCR 试验。反应程序为:95 ℃ 预变性 4 min;95 ℃ 变性 15 s、55 ℃ 退火 15 s、72 ℃ 延伸 20 s,共 40 个循环;84℃下收集荧光。分析溶解曲线,确定荧光定量PCR 的质量,根据Ct值利用2-ΔΔCt法初步处理数据,再利用 Graphpad Prism5.0 软件对数据进行处理和分析,当P<0.05 时认为差异显著。
1.2.4 构建系统进化树 使用 Clustal X和MEGA 5.0 软件(http://smart.embl-heidelberg.de/)将不同种类动物的 Dmrt 基因家族编码的氨基酸序列进行分析比对,并构建 Neighbour-joining 系统进化树。
2 结果与分析
2.1 斜带石斑鱼胚胎发育过程
斜带石斑鱼受精卵(图1-1)直径780~880μm,在(24±0.5)℃ 、盐度 31.0 的海水中培育,历时约 29 h 50 min 完成整个胚胎发育过程,进入胚后发育阶段。
2.1.1 卵裂期 斜带石斑鱼的卵裂方式属于盘状卵裂。受精后约30 min,受精卵动物极开始形成胚盘(图1-2)。受精后约 45 min,胚盘出现第1次分裂,将胚盘分裂为两个大小相等的椭圆形细胞(图1-3)。受精后约55 min,胚盘开始第2 次分裂,将上一次分裂的每个细胞平均分为两个细胞(图1-4),进入 4 细胞期。受精后1 h 20 min,开始第3次卵裂,进入 8 细胞期(图1-5)。
受精后约 1 h 40 min,胚盘第4次分裂,进入 16细胞期(图1-6)。受精后约 2 h,胚盘第5次分裂,进入 32 细胞期,此时细胞直接界限不清晰,失去规则(图1-7)。受精后约 2 h 30 min,胚盘第 6 次分裂,进入 64 细胞期,此时细胞排列不规则且大小性状不同(图1-8)。受精后约 3 h,细胞渐渐变小且重叠在一起,其性状为方形轮廓,此时进入多期(图1-9)。受精后约 3 h 30 min,细胞变得更小、界限更难以分辨,形成许多小球状的细胞排列成一团,近似圆形,此时胚胎进入桑葚期(图1-10)。
2.1.2 囊胚期 受精后约 4 h 30 min,细胞继续分裂,细胞数目和层次不断增多,使得胚盘与卵黄间直接形成囊胚腔,囊胚中部向上隆起,出现帽状性状,此时进入高囊胚期(图1-11)。此后囊胚隆起的部分不断变低,受精后约 5 h 55 min,囊胚隆起部变得更低,胚盘细胞向周围发展,呈扁平帽状于卵黄上,此时胚胎进入低囊胚期(图1-12)。
2.1.3 原肠胚期 低囊胚期后,囊胚边缘细胞逐渐增加且胚层细胞从动物极向植物极方向迁移和下包,受精后约 7 h 30 min,卵黄被胚层包围 1/4(图1-13),此时胚胎进入原肠早期。此后可见到胚层一端形成一个胚盾,胚层下包约卵黄 1/2(图1-14),此时胚胎已经进入原肠中期。受精后约11 h 15 min,胚层下包大部分卵黄(约 3/4),胚盾逐渐变得细长(图1-15),此时胚胎进入原肠晚期。
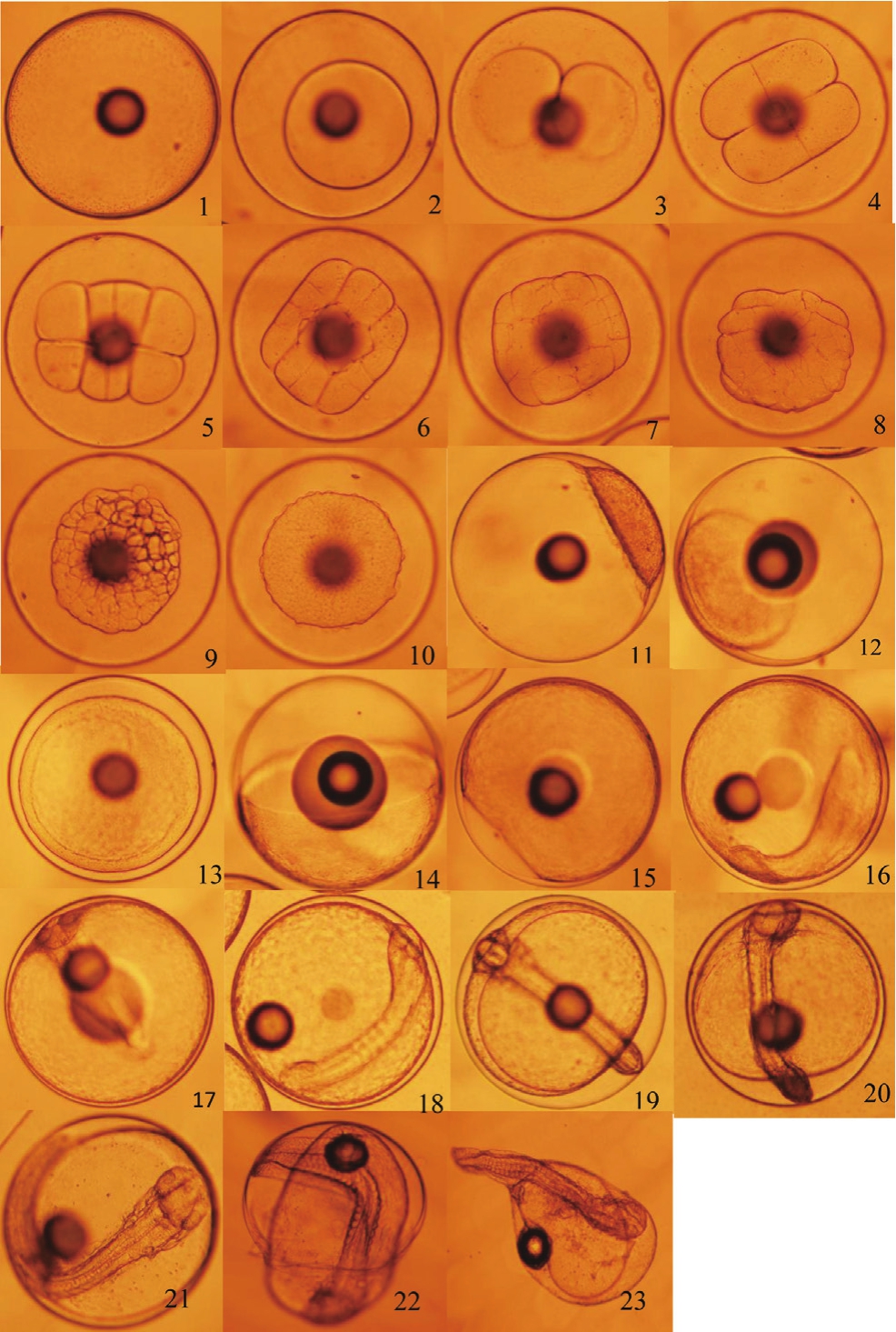
图1 斜带石斑鱼胚胎发育过程
Fig.1 Embryonic development process of Epinephelus coioides
1:受精卵;2:胚盘隆起;3:2细胞期;4:4细胞期;5:8细胞期;6:16细胞期;7: 32细胞期;8:64细胞期;9:多细胞期;10:桑椹胚;11:高囊胚期;12:低囊胚期;13:原肠早期;14:原肠中期;15:原肠末期;16:胚体形成期;17:视囊形成期;18:肌节形成期;19:脑泡形成期;20:心脏形成期;21:将孵期;22:孵化期;23:初孵仔鱼
1: Fertilized egg; 2: Blastodisc formation; 3: 2-cell stage; 4: 4-cell stage; 5:8-cell stage; 6: 16-cell stage; 7: 32-cell stage; 8: 64-cell stage; 9: Multi -cell stage; 10: Morula; 11: High blastula; 12: Low blastula; 13: Early gastrula: 14:Middle gastrula; 15: Late gastrula; 16: Embryo formation stage; 17: Optic capsule stage; 18: Muscle burl stage; 19: Brain vesicle stage; 20: Heart stage;21: Pre-hatching stage; 22: Hatching stage; 23: Newly hatched larvae
2.1.4 神经胚期 受精后约 12 h 40 min,胚盾延伸到植物极,胚体背面增厚,神经板形成,视野可见到 1条圆柱形脊索(图1-16),胚胎发育进入神经胚期。
2.1.5 器官形成期 受精后约 14 h 30 min,在脊索头部两端出现 1 对视囊(图1-17)。受精后约16 h,胚体出现明显的肌节(图1-18)。受精后约 18 h 20 min,肌节达到 10 对以上,且胚体视囊中还出现椭圆形脑泡(图1-19)。受精后约 23 h 40 min,在显微镜下可看到胚胎心跳,脊索神经管明显(图1-20)。受精后约28 h,在显微镜下可看到胚胎内胚体抽动(图1-21)。受精后约29 h 20 min,部分胚胎内的小鱼开始孵化,小鱼头部先伸出,然后尾部用力不断抖动脱去卵膜(图1-22)。受精后约 29 h 50 min,大部分胚胎孵出仔鱼,其仔鱼悬浮于水体表层,没有运动能力,且腹部膨大(图1-23)。
2.2 胚胎发育过程中 Dmrt 基因的表达
定量 PCR 分析结果表明,斜带石斑鱼 Dmrt基因(Ecdmrt1)在胚胎发育过程中均从卵裂期开始表达。Ecdmrt1 基因囊胚期表达水平达到峰值,卵裂期和初孵仔鱼期表达量较低(图2A),Ecdmrt1 基因在囊胚期表达是分裂期的 5.4 倍。Ecdmrt2 基因在胚胎初期相对表达量比较平稳,神经胚期表达量显著上升,是分裂期的 9.2 倍;Ecdmrt2 基因在初孵仔鱼中表达水平最高(图2B),是分裂期的 17.6 倍。Ecdmrt2b 基因在胚胎发育过程中表达量逐渐增加,在器官形成期表达量达到峰值(P<0.05)(图2C),在初孵仔鱼中表达水平又下降。Ecdmrt3 基因在胚胎发育初期表达量相对较低,在器官形成期时表达量显著上升,是分裂期 7.1 倍,在初孵仔鱼中表达量达到峰值(图2D)。
2.3 Dmrt家族系统进化树
对 GenBank 数据库上能搜索到的不同脊椎动物 Dmrt 家族成员氨基酸序列及由Ecdmrt1、Ecdmrt2、Ecdmrt2b、Ecdmrt3推测出来的氨基酸序列进行比对。采用MEGA6 软件,利用NeNeighbor Joining 法构建系统进化树,结果(图3)表明,Ecdmrt1与鲫鱼Dmrt3、Ecdmrt2与黄鳝 Dmrt2b、Ecdmrt2b 与斑马鱼 Dmrt2b、Ecdmrt3与小家鼠 Dmrt1最为接近。Ecdmrt2 与Ecdmrt2b聚为一族,再与 Ecdmrt3 聚为一族。可以看出,Ecdmrt2与 Ecdmrt2b 在进化上很接近,与 Ecdmrt1亲缘关系较远。
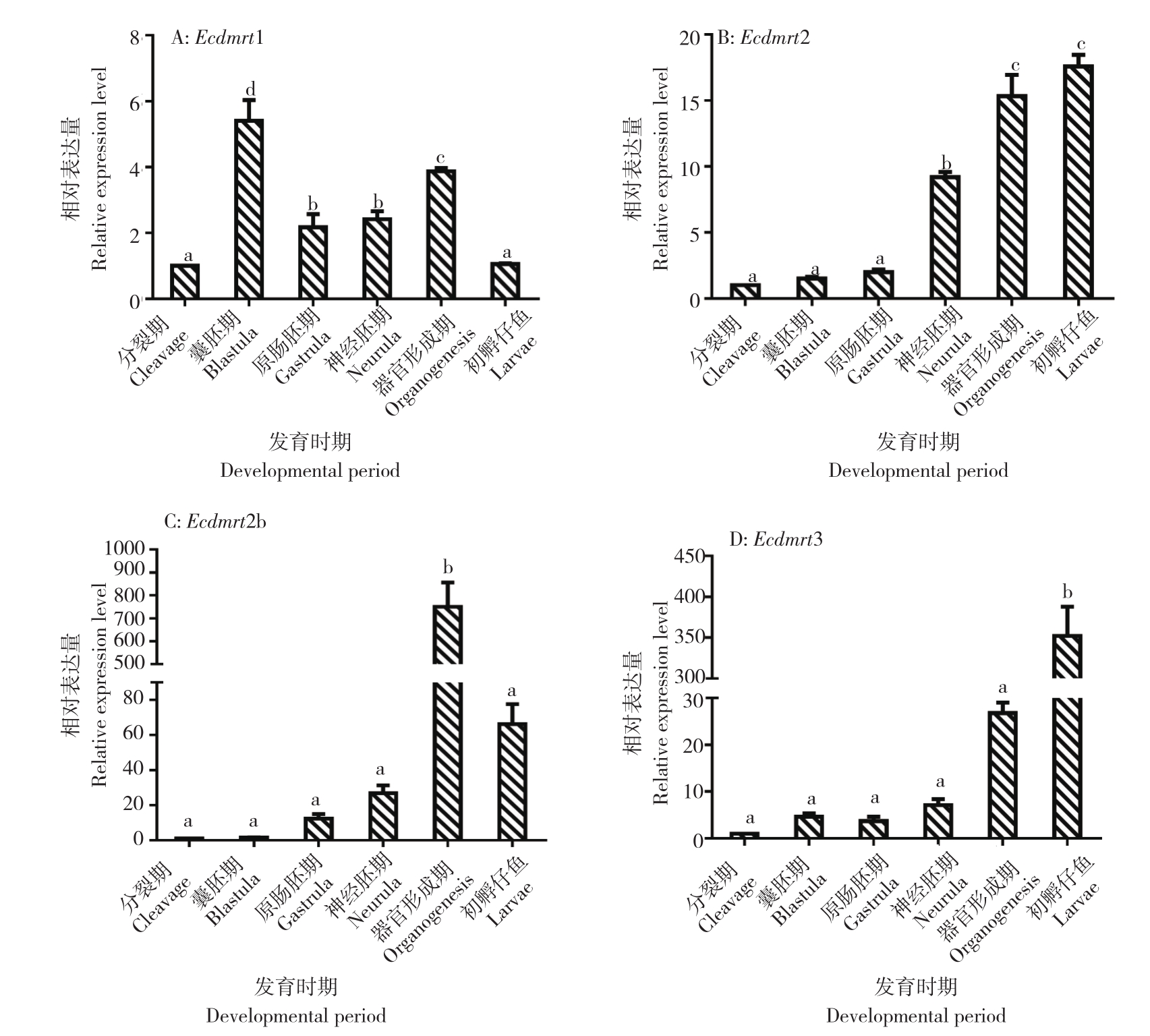
图2 Dmrt 基因在斜带石斑鱼不同胚胎发育时期的表达水平
Fig.2 The expression level of Dmrt in different embryonic development stages of Epinephelus coioides
同一图中小写字母不同者表示差异显著Different lowercase letters in the same chart represent significant difference.

图3 采用 Neighbor Joining 方法构建的不同物种 Dmrt家族系统进化树
Fig.3 Phylogenetic tree of Dmrt family generated with Neighbor Joining method
3 讨论
3.1 斜带石斑鱼的胚胎发育
本研究结合斜带石斑鱼胚胎发育的结果,且参照石斑鱼发育阶段的划分[18],可将斜带石斑鱼胚胎发育过程划分为卵裂期、囊胚期、原肠胚期、神经胚期和器官形成期。其胚胎发育符合硬骨鱼类胚胎发生的普遍规律,但胚胎发育过程中器官发育的先后顺序不同,但其他方面与常见石斑鱼的胚胎发育过程一般规律相似[19-20]。
3.2 Dmrt1基因在胚胎发育不同时期的表达
Dmrt1基因在河川沙塘鳢(Odontobutis potamophila)不同胚胎时期均有表达,但其表达量随着河川沙塘鳢的不断发育呈先上升后下降的趋势,尤其在原肠胚时期达到最高值,显著高于其他发育阶段[21]。Dmrt1 基因在黄河鲤 (Cyprinus carpio)胚胎发育各个时期都有表达,表达量呈先上升后下降,在原肠胚期表达量最高[22]。Dmrt1基因在香鱼(Plecoglossus altivelis)胚胎发育过程中均有检测,但其在原肠期表达量达到最大值[23]。同样Ecdmrt1基因在胚胎发育过程均有表达,其表达与河川沙塘鳢、黄河鲤等情况一样,先上升后下降,但其在囊胚期表达量最高,其次是器官形成期。根据以上结果,Ecdmrt1 参与整个胚胎发育过程,推测该基因在斜带石斑鱼胚胎发育过程中也扮演着重要角色。Ecdmrt1在囊胚期表达量最高,而在硬骨鱼中,原始生殖细胞 (PGCs)最早发现于原肠胚时期,且原肠期与原始生殖细胞的产生有关[23-24],因此,Ecdmrt1 在囊胚期可能为形成生殖细胞做好准备。其次 Ecdmrt1 在器官形成期表达量较高,推测 Ecdmrt1 基因可能参与器官的形成。
Dmrt2a在斑马鱼(Danio rerio)以及青鳉(Oryzias latipes)中主要于体节形成前和正在发育的体节中表达。Dmrt2a在金鱼(Carassius auratus)胚胎发育体节形成中表达量比其他时期显著[25]。Dmrt2b在金鱼受精后 12 h 表达,其表达过程与斑马鱼相似,但斑马鱼 Dmrt2b在受精后 6 h 开始表达,且从受精后 16~48 h 出膜时表达水平相对稳定,并通过 Hedgehog 信号通路参与体节发育过程[26],而 Dmrt2b在金鱼出膜后仔鱼表达量显著增加。Ecdmrt2基因在斜带石斑鱼胚胎初期相对表达量比较平稳,且在初孵仔鱼中表达水平最大,与 Dmrt2b在金鱼中的表达相似[25]。Ecdmrt2b基因在胚胎发育过程中表达量逐渐增加,在器官形成期表达量达到峰值,在初孵仔鱼中表达水平又下降。根据以上结果推测,Ecdmrt2b基因可能参与器官形成,而 Ecdmrt2基因可能参与仔鱼生长发育。
Dmrt3基因在鲫鱼(Carassius auratus)的尾芽期开始有微量表达,在 15 体节期表达量有所增加[27]。Dmrt3 基因在爪蟾(Xenopus tropicali)胚胎早期发育的各个时期均有表达,主要在嗅觉原基、端脑、侧线原基、神经管等部位特异性表达[28]。而 Ecdmrt3基因在石斑鱼的胚胎发育初期表达量相对较低,在器官形成期表达量显著上升,在初孵仔鱼中表达量达到峰值。根据以上结果推测,Dmrt3的功能可能发生了歧化,在不同物种中有不同的功能,Ecdmrt3基因在石斑鱼中可能参与生长发育。
4 结论
斜带石斑鱼的胚胎发育符合硬骨鱼类胚胎发育规律,划分为卵裂期、囊胚期、原肠胚期、神经胚期和器官形成期。Ecdmrt基因家族都是从卵裂期开始表达,Ecdmrt1在囊胚期表达量最高,而原始生殖细胞(PGCs)与原肠胚时期有关,推测与形成生殖细胞有关;Ecdmrt1在器官形成期表达量较高,推测 Ecdmrt1基因可能参与器官的形成。Ecdmrt2基因在初孵仔鱼期表达水平最高,而 Ecdmrt2b在器官形成期表达量达到峰值,推测Ecdmrt2b基因可能参与器官形成,而 Ecdmrt2基因可能参与仔鱼生长发育。Ecdmrt3基因在初孵仔鱼表达量达到峰值,推测 Ecdmrt3基因可能参与石斑鱼仔鱼的生长发育。Ecdmrt 基因家族在进化过程中,功能出现了歧化。Ecdmrt 基因家族在斜带石斑鱼的胚胎发育过程中,可能参与器官的形成以及仔鱼的发育。
[1] 陈华谱,洪广,邓思平,朱春华,李广丽,陈燕,黄海,李水生.斜带石斑鱼 Frizzled 4 基因的克隆及表达分析[J].海南大学学报(自然科学版),2016,34(2):177-183.
CHEN H P, HONG G, DENG S P, ZHU C H, LI G L, HUANG H, LI S S.Molecular cloning and expression analysis of Frizzled 4 in Orangespotted Grouper, Epinephelus coioides[J].Natural Scienece Journal of Hainan University, 2016, 34(2): 177 -183.
[2] 姚占娟,张其中,崔淼.斜带石斑鱼 IgZ 重链基因的表达纯化和抗体制备[J].广东农业科学,2013,40(5):149-152.
YAO Z J, ZHANG Q Z, CUI M.Prokaryotic expression, purification of orange-spotted grouper(Epinephelus coioides) IgZ heavy-chain protein and preparation of polyclonal antibody against IgZ[J].Guangdong Agricultural Sciences, 2013, 40(5): 149-152.
[3] ZARKOWER D.Establishing sexual dimorphism: conservation amidst diversity?[J].Nature Reviews Genetics, 2001, 2(3): 175-185.doi:10.1038/35056032.
[4] BURTI K C, BAKER B S.Drosophila double sex gene controls somatic sexual differentiation by producing alternatively spliced mRNAs encoding related sex-specific polypeptides[J].Cell, 1989, 56(6): 997-1010.
[5] CHANDLER J C, FITZGIBBON Q P, SMITH G, ELIZUR A, VENTUR T .Y-linked iDmrt1 paralogue (iDMY) in the Eastern spiny lobster,Sagmariasus verreauxi: The first invertebrate sex-linked Dmrt[J].Developmental Biology, 2017, 430(2): 337-345.doi: 10.1016/j.ydbio.
[6] 李法君,付春鹏,罗永巨.Dmrt 基因在水生生物中的研究进展[J].水生生物学报,2016,40(5):1968-1977.
LI F J, FU C P, LUO Y J.Research progress of Dmrt gene in aquatic organisms[J].Acta Hydrobiologica Sinica, 2016, 40(5): 1968-1977.
[7] GE C, YE J, ZHANG H, ZHANG Y, SUN W, SANG Y, CAPEL B,QIAN G.Dmrt1 induces the male pathway in a turtle species with temperature-dependent sex deter mination[J].Development, 2017,144(12), 2222-2233.doi: 10.1242/dev.152033.
[8] MA W J ,RODRIGUES N, SERMIER R, BRELSFORD A, PERRIN N.Dmrt1 polymorphism covaries with sex deter mination patterns in Rana temporaria[J].Ecology and Evolution, 2016, 6(15): 5107-5117.doi:10.1002/ece3.2209.
[9] 曹谨玲,陈剑杰,甘西,罗永巨.鱼类 DMRT 基因的研究进展[J].广东海洋大学学报,2011,31(1):96-98.
CAO J L, CHEN J J, GAN X, LUO Y J.Advances in research on fish DMRT gene[J].Journal of Zhanjiang Ocean University, 2011, 31(1):96-98.
[10] 杨莹莹,王浩栋,张艺元,刘培源,严汉池.性别决定相关因子的研究进展[J].现代生物医学进展 .2018,18(1):168-174.
YANG Y Y, WANG H D, ZHANG Y Y, LIU P Y, YAN H C.The research progress of sex deter mination mechanisms[J].Progress in Modern Biomedicine, 2018, 18(1): 168-174.
[11] CUI Z K, LIU Y, WANG W W, WANG Q, ZHANG N, LIN F,WANG N,SHAO CW, DONG Z D, LI Y Z, YANG Y M, HU M Z, LI H L, GAO F T, WEI Z F, MENG L, LIU Y, WEI M, ZHU Y, GUO H, CHENG C H K,SCHARTL M, CHEN S L.Genome editing reveals Dmrt as nessenialt malesex-deter mining gene in chinese tonguesole(Cynoglossus semilaevis)[J].Scientific Reports, 2017, 7: 42213.doi: 10.1038/srep42213.
[12] 杜力.日本鳗鲡 Dmrt2 基因cDNA的克隆与表达分析[D].上海:上海海洋大学,2017.
DU L.Molecular cloning,sequence identification and gene expression analysis of Japanese eel Dmrt2 gene[D].Shanghai: Shanghai Ocean University, 2017.
[13] KUBOTA N, YOKOYAMA T, HOSHI N, SUYAMA M.Identification of a candidate enhancer for DMRT3 involved in spastic cerebral palsy pathogenesis[J].Biochemical and Biophysical Research Communications, 2018, 496(1): 133-139.doi: 10.1016/j.bbrc.
[14] LI Q, ZHOU X, GUO Y, SHANG X, CHEN H, LU H,CHENG H,ZHOU R.Nuclear localization, DNA binding and restricted expression in neural and germ cells of zebrafish Dmrt3[J].Biology of the Cell,2008, 100(8): 453-463.doi: 10.1042/BC20070114.
[15] CAO J L, CHEN J J, WU T T, GAN X, LUO Y J.Molecular cloning and sexually dimorphic expression of Dmrt4 gene in Oreochromis aureus[J].Molecular Biology Reports, 2010, 37(6): 2781-2788.doi: 10.1007/s11033-009-9820-z.
[16] 张小艳,孙立伟,查金苗,王子健.稀有鮈鲫 Dmrt基因家族 13 个成员的克隆与序列分析[J].生态毒理学报,2007,2(1):88-93.
ZHANG X Y, SUN L W, CHAN J M, WANG Z J.Clone and sequence analysis of thirteen members of Dmrt genes in rare minnow[J].Asian Journal of Ecotoxicology, 2007, 2(1): 88-93.
[17] YOUNGA F I, KERUZORE M, NAN X S, GENNET N, BELLEFROID E J,LI M.The doublesex-related Dmrta2 safeguards neural progenitor maintenance involving transcriptional regulation of Hes1[J].Pnas,2017, 114(28): E5599-E5607.doi: 10.1073/pnas.
[18] 张海发,刘晓春,刘付永忠,王云新,林蠡,黄国光,舒琥,罗国武,林浩然.斜带石斑鱼胚胎及仔稚幼鱼形态发育[J].中国水产科学,2006,13(5):689-690.
ZHANG H F, LIU X C, LIU F Y Z, WANG Y X, LIN L, HUANG G G,SHU H,LUO G W, LIN H R.Embryonic development, morphological development of larva, juvenile and young fish of Epinephelus coioides[J].Journal of Fishery Sciences of China, 2006,13(5): 689-690.
[19] 刘付永忠,王云新,黄国光,刘晓春,林浩然.自然产卵的赤点石斑鱼胚胎及仔鱼形态发育研究[J].中山大学学报:自然科学版,2001,40(10):81-84.
LIU F Y Z, WANG Y X, HUANG G G, LIU X C, LIN H R.Embyronic and larval development of red-spotted grouper[J].Acta Scientiarum Naturalium Universitatis Sunyatseni, 2001, 40(10): 81-84.
[20] 周立斌,邓妹芳,张海发,刘付永忠.斜带石斑鱼亲鱼培育和胚胎发育的研究[J].惠州学院学报,2006,26(6):36-41.
ZHOU L B, DENG M F, ZHANG H F, LIU F Y Z.Study on brood stock culture and embryonic development of Epinephelus coioides[J].Journal of Huizhou University, 2006, 26(6): 36-41.
[21] 张红燕,朱文旭,赵诚,张宏叶,王涛,陈树桥,尹绍武,贾永义.河川沙塘鳢 Dmrt1 基因的克隆及其表达分析[J].海洋渔业,2018,40(5):576-580.
ZHANG H Y, ZHU W X, ZHAO C, ZHANG H Y, WANG T, CHEN S Q,YIN S W, JIA Y Y.Cloning and expression analysis of DMRT1 gene in Odontobutis potamophila[J].Marine Fisheries, 2018, 40(5): 576-580.
[22] 王黎芳.黄河鲤 CcDMRT1基因的克隆、表达及相关家族成员的功能解析[D].新乡:河南师范大学,2015.
WANG L F.Cloning and expression of CcDMRT1 gene in Yellow River carp and functional analysis of related family members[D].Xinxiang:Henan Normal University, 2015.
[23] 王金华.性别相关候选 Dmrt 基因在香鱼(Plecoglossus altivelis)不同发育阶段和组织中的表达[D].宁波:宁波大学,2014.
WANG J H.Gender-related candidate Dmrt gene expression in different developmental stages and tissues of sweetfish (Plecoglossus altivelis)[D].Ningbo: Ningbo University, 2014.
[24] 殷海成,吕海英.黑尾近红鲌胚胎发育和原始生殖细胞的迁移研究[J].水产科学,2010,29(5):265-269.
YIN H C, LYU H Y.Embryonic development and primordial germ cell migration in culter Ancherythroculter nigrocauda[J].Fisheries Science, 2010, 29(5): 265-269.
[25] 江山,陈晓武,施志仪,李倩.金鱼Dmrt2 基因表达分析[J].上海海洋大学学报,2012,21(5):701-708.
JIANG S, CHEN X W, SHI Z Y, LI Q.Expression of Dmrt2 gene in Carassius auratus[J].Journal of Shanghai Ocean University, 2012,21(5): 701-708.
[26] LIU S, LI Z, GUI J F.Fish-specific duplicated Dmrt2b contributes to a divergent function through Hedgehog pathway and maintains left-right asymmetry establishment function[J].Plos One, 2009, 4(9): 1-12.doi:10.1371/journal.pone.0007261.
[27] 王佳,罗琛.鲫鱼Dmrt3基因的克隆和表达分析[J].水生生物学报,2014,38(3):548-555.
WANG J, LUO S.Molecular cloning and expression analysis of Dmrt3 in goldfish,Carassius auratus[J].Acta Hydrobiologica Sinica, 2014,38(3): 548-555.
[28] 陆怡,李政,朱晓龙,章骥,黄晓.热带爪蟾Dmrt3基因的克隆及在早期胚胎发育中的表达[J].浙江大学学报,2012,39(5):565-570.
LU Y, LI Z, ZHU X L, ZHANG Y, HUANG X.Molecular cloning and characterization of Dmrt3 during Xenopus tropicalis embryogenesis[J].Joural of Zhejing University(Science Edition), 2012, 39(5): 564 - 570.