【研究意义】 补硒对动物机体功能的发挥和预防部分疾病具有重要意义[1],通过摄入适量的硒营养剂,可以有效预防缺硒疾病[2]。价廉易得的亚硒酸钠是目前被广泛使用的饲用硒营养剂。但亚硒酸钠的营养剂量与毒性剂量间范围较窄[3],过量摄入易引起中毒[4]。同时,由于亚硒酸钠稳定性欠佳,在一定条件下能与饲料中的营养物质反应[5],导致硒元素流失,影响饲料品质及其营养价值。此外,在动物吸收亚硒酸钠的过程中,硒元素主要经由肠道吸收,而胃部几乎不吸收[6]。但在胃酸环境中,亚硒酸钠氧化性有所增强[7],能与胃部还原性物质如维生素C(Vc)作用,导致Vc失效,而且影响肠道对硒元素的吸收[8],产物随粪便排出,对环境造成潜在污染。因此需要通过技术手段提高亚硒酸钠在环境中的稳定性,并使亚硒酸钠营养剂兼具胃肠道响应性能,这对控制亚硒酸钠在饲料中的用量、提高亚硒酸钠的生物利用率、促进饲料中其他营养物质吸收乃至促进维持禽畜机体健康均有意义。
【前人研究进展】 目前研究者主要通过改善亚硒酸钠的稳定性来提高亚硒酸钠的生物利用率。Grilli等[9]通过喷雾冷却法对亚硒酸钠进行微胶囊化,亚硒酸钠微胶囊化后硒元素转移到牛奶中的效率高于直接使用亚硒酸钠。但该法仅就亚硒酸钠微胶囊化的生物利用率展开讨论,且工序繁琐。而响应性微胶囊兼具改善物质稳定性和特异性响应的特点,可作为提高亚硒酸钠生物利用率的新途径。响应性微胶囊已在智能控释、靶向给药、病虫防治等领域[10-12]得到广泛应用。响应性微胶囊的响应性主要受控于其溶胀行为[13-14],而微胶囊的溶胀行为与其成囊壁材特性和环境因素密切相关。其中,海藻酸钠是一种具有“酸沉碱溶”特性的微胶囊壁材,可作为肠溶性响应微胶囊的壁材。Chang等[15]制备了具有pH响应的海藻酸钠微胶囊,但该法所用的高碘酸等试剂存在一定的安全隐患,且制备过程复杂。同时,微胶囊的溶胀行为可借助溶胀动力学模型对其进行分析。前人通过探究溶胀数据的关系,提出了不同的溶胀动力学模型[16-21]。Zhao等[22]对浒苔水凝胶的整个溶胀行为进行了Schott溶胀动力学模拟,Schott动力学模型能有效描述浒苔水凝胶的溶胀过程。【本研究切入点】 内源乳化法海藻酸钠微胶囊具有操作简便、设备简单的特点,易于对药物进行包埋。而药物微胶囊响应性释放药物的能力与微胶囊的溶胀性能密切相关[23]。我们在前期研究了亚硒酸钠/海藻酸钠微胶囊(SSSAMC)的制备工艺,并对其进行傅里叶红外和X射线衍射等分析[24]的基础上进一步深入研究,着重研究微胶囊的溶胀性能,以明确亚硒酸钠/海藻酸钠微胶囊的溶胀动力学,这将对其响应特性及其肠道给药具有指导意义。
【拟解决的关键问题】 为提高亚硒酸钠在饲料中的生物利用率,促进维持禽畜机体健康,降低亚硒酸钠过量使用对环境造成的污染,本研究采用内源乳化法制备 SSSAMC。通过初步探讨SSSAMC在不同环境条件下的溶胀动力学,分析亚硒酸钠/微胶囊的响应性,为后续实现微胶囊的肠胃响应及动物试验提供依据。
1 材料与方法
1.1 试验材料
海藻酸钠(Sodium alginate,SA,化学纯),购自上海阿拉丁生化科技股份有限公司;98%亚硒酸钠,购自西亚化学试剂厂;纳米碳酸钙(Nano-CaCO3,化学纯),≤19 μm,购自佛山市源磊粉体有限公司;Span 80(化学纯),购自天津市福晨化学试剂厂;冰醋酸(分析纯),购自国药集团化学试剂有限公司;液体石蜡(化学纯)、无水乙醇(分析纯),购自天津富宇精细化工有限公司;硫代硫酸钠、碘化钾(分析纯),购自广州光华化学试剂厂。
主要试验仪器有S4800型扫描电子显微镜(SEM,日本Hitachi Limited公司)、TGA2型热重分析仪(TGA,瑞士Mettler Toledo公司)。
1.2 SSSAMC的制备
称取1.8 g SA与0.9 g Nano-CaCO3于烧杯中,加入100 mL去离子水,搅拌过夜,作为水相备用。量取150 mL液体石蜡于烧杯中,向液体石蜡中加入2 %(W/W) Span 80与0.6 g Na2SeO3,乳化30 min,作为油相。取50 mL水相滴加到油相中,持续搅拌90 min,形成W/O型乳液。然后缓慢加入2 mL冰醋酸,持续搅拌40 min。凝胶化、过滤后用无水乙醇洗涤至试样表面不出现油层,75 ℃干燥12 h,常温真空干燥24 h。空白微胶囊(SAMC),除不加Na2SeO3外,其他步骤依照SSSAMC制备方法。
1.3 SSSAMC的结构表征
采用热重分析仪,分别对Na2SeO3、SAMC和SSSAMC进行热重分析,升温范围40~950 ℃,升温速率10 ℃/min,N2流量50 mL/min;采用扫描电子显微镜分别对Na2SeO3、SAMC和SSSAMC进行形貌观察,电压3.0 kV。同时,对SAMC和SSSAMC进行能谱扫描(EDS),分析微胶囊中的C、Ca、O、Se含量。
1.4 SSSAMC的溶胀性能分析
1.4.1 pH对SSSAMC溶胀性能的影响 准确称取0.5 g SSSAMC置于滤纸袋中,分别置于30 ℃蒸馏水中,用HCl或NaOH调节pH值为1、7、13,每隔一段时间取出滤纸袋,用滤纸迅速吸干样品表面水分,称重,3次重复。
1.4.2 温度对SSSAMC溶胀性能的影响 准确称取0.5 g SSSAMC置于滤纸袋中,分别置于pH为7的蒸馏水中,调节蒸馏水温为30、50 ℃,保持取出样品时间点与1.4.1相同,用滤纸迅速吸干样品表面水分,称重,3次重复。
1.4.3 离子强度对SSSAMC溶胀性能的影响 准确称取0.5 g SSSAMC置于滤纸袋中,分别置于pH 7、温度30 ℃的蒸馏水中,用NaCl调节溶液浓度为0、0.3、0.5 mol/L,保持取出样品时间点与1.4.1相同,用滤纸迅速吸干样品表面水分,称重,3次重复。
绘制SSSAMC溶胀率SR(Swelling Ratio)与时间的关系曲线,作为SSSAMC的溶胀动力学曲线。SR按下式计算:
式中,mt为t时刻时微胶囊的质量(g),m0为初始时刻微胶囊的质量(g)。
1.5 SSSAMC的溶胀动力学研究
溶胀动力学探究微胶囊/凝胶的溶胀随时间变化的关系,是微胶囊智能化的重要特征。本研究制备的SSSAMC为三维立体凝胶网络结构,为了更合理地描述微胶囊溶胀过程,采用Schott模型研究其溶胀动力学。Schott动力学模型表达式如下:
将上述方程重新整理得到Schott的另一种形式:
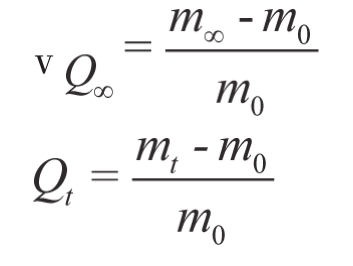
式中,m0为干燥的SSSAMC质量(g),mt为t时刻SSSAMC的质量(g),Qt为t时刻SSSAMC的溶胀度(g/g),Q∞为SSSAMC的理论溶胀度(g/g),Kis为SSSAMC初始溶胀速率常数〔g/(g·min)〕。
将t/Qt对t作图可得到一条斜率为1/Q∞、截距为1/KisQ∞2的直线。
2 结果与分析
2.1 SSSAMC的热稳定性分析
从Na2SeO3、SAMC和SSSAMC的热稳定性(TG)结果(图1)可知,SAMC在40~200 ℃间SAMC失重约16.2%,由SAMC失去游离水、内部结合水以及部分分子内部糖苷键断裂分解所致。在200~400 ℃间SAMC失重61.6%,此过程中SAMC内SA分子内糖苷键继续断裂分解,相邻的羟基以水分子形式脱除,羧基产生CO2脱除。在600~800℃间SAMC失重11.2%,最终产物为CaO。Na2SeO3在460~540 ℃间失重2.8%,在700~950 ℃失重10.5%,残余84.8%。对比三者的DTG(TG的一次微分曲线)可知,Na2SeO3在460 ℃以下具有良好的热稳定性。而SAMC和SSSAMC在测试温度范围内失重特性相似,说明包埋Na2SeO3未改变SA结构。由于SSSAMC中含有Na2SeO3,致使SAMC和SSSAMC最终失重率出现差异,两者最终失重率分别为93.8和86.8%,SSSAMC较SAMC失重率减少7%。
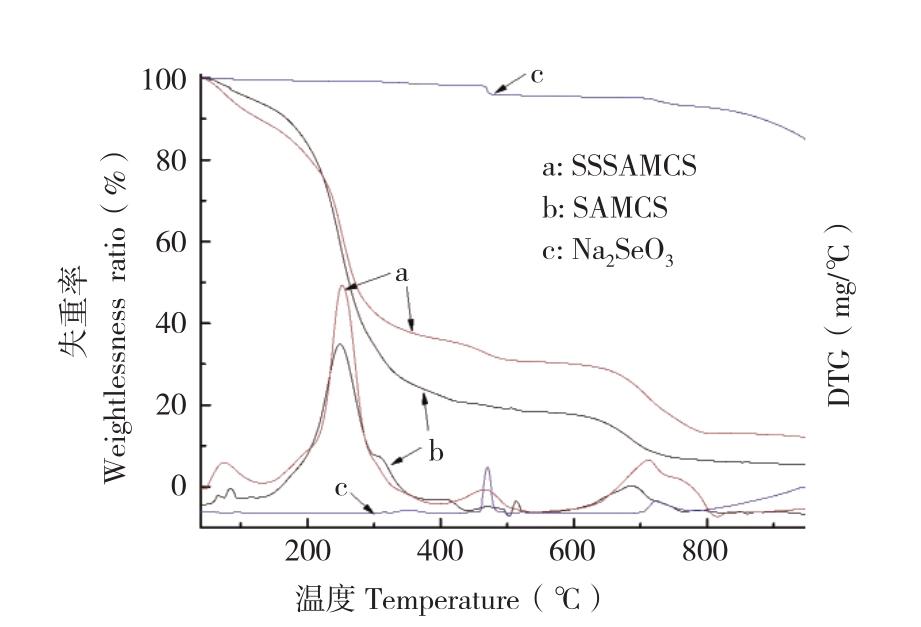
图1 Na2SeO3、SAMC和SSSAMC的热稳定性结果
Fig.1 Thermostability spectra of Na2SeO3,SAMC and SSSAMC
2.2 SSAMC的扫描电镜及能谱分析
Na2SeO3、SAMC和SSSAMC的扫描电镜(SEM)结果如图2所示。由图2A可知,Na2SeO3粒径为50~120 μm,形貌为规则长方体颗粒,表面光滑。结合我们前期工作的XRD分析结果[24]可知,此为Na2SeO3晶体。由图2B可知,SAMC粒径为5~40 μm,形貌规则,为球型,表面大部分区域光滑,有少量凹陷出现。由图2C可知,SSSAMC粒径为10~35 μm,整体为规则球状,球状表面有不连续凸起的颗粒,且有少量凹陷和气孔出现,且SSSAMC表面为无规则的长方体颗粒。对比SAMC的形貌以及结合FTIR分析可知,SSSAMC表面不连续凸起的颗粒是Na2SeO3,成因可能是Na2SeO3与SA液滴接触后溶解,少部分SeO32-在渗透压的推动下渗透至SA液滴内部。SA液滴与Ca2+交联固化后,在微胶囊干燥过程中残留在微胶囊表面的Na+或Ca2+与SeO32-重新形成Na2SeO3或CaSeO3。该结果与SSSAMC样品在XRD分析中强衍射峰消失现象结果相符合。
从SAMC和SSSAMC的能谱(EDS)分析结果(图2)可知,SAMC表面含有C、O和Ca 3种元素,其含量分别为48.183%、46.767%和5.050%(图2D)。SSSAMC表面含有C、O、Ca和Se 4种元素,其含量分别为35.612%、50.116%、18.259%和5.151%(图2E),表明Na2SeO3已成功包埋至SSSAMC中。
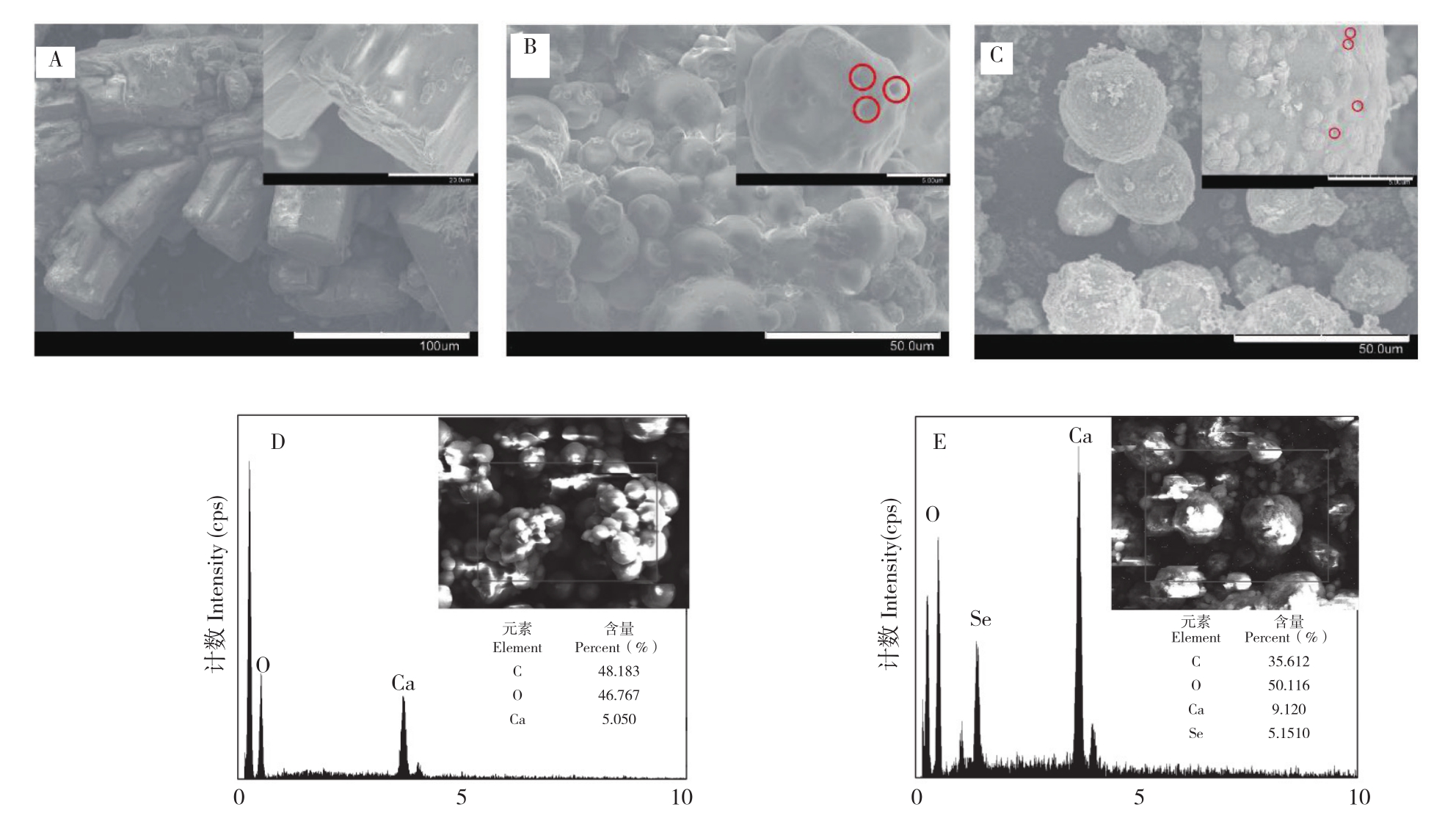
图2 Na2SeO3、SAMC和SSSAMC的扫描电镜(SEM)和能谱(EDS)分析结果
Fig.2 Scanning electron microsope (SEM) photos and energy spectrum(EDS) of Na2SeO3, SAMC and SSSAMC
A:Na2SeO3的SEM图;B:SAMC的SEM图 ;C:SSSAMC的SEM图;D:SAMC的EDS图 ;E:SSAMC的EDS图
A: SEM photo of Na2SeO3 ; B:SEM photo of SAMC; C: SEM photo of SSSAMC; D: EDS photo of SAMC; E: EDS photo of SSSAMC
2.3 SSSAMC的响应特性及溶胀动力学
2.3.1 pH对SSSAMC溶胀动力学的影响 图3A是SSSAMC分别在pH为1、7、13时的溶胀曲线。由图3A可知,SSSAMC的平衡溶胀率随溶液pH的增大而增大,说明SSSAMC的溶胀具有pH响应性。SSSAMC在pH 13时,其平衡溶胀率由在pH 1时的45.0%提高到86.4%。SSSAMC的pH响应性能受-COOH的离子化程度控制,在酸性或中性溶液中,羧基仅有少量-COOH离子化,SA分子链未能在溶液中自由舒展,SSSAMC的吸水空间受到限制,其溶胀行为受酸性和中性溶液pH值的影响有限;在碱性溶液中,羧基离子化程度大大提高,增大SA分子间的静电斥力;同时Na+通过离子移变作用置换了部分已络合的Ca2+,造成SSSAMC网络结构松弛,使得SSSAMC的孔隙增大,可增强其吸水能力、提高其平衡溶胀率。
SSSAMC在不同pH下的溶胀动力学拟合情况如图3B和表1所示。动力学拟合相关系数R2为0.99以上,变量t与t/Qt呈线性相关,说明SSSAMC在不同pH下的溶胀行为符合Schott模型。SSSAMC的初始溶胀速率常数Kis随溶液pH增大由 0.398 g/(g· min)降至 0.049 g/(g·min),而理论平衡溶胀度Q∞随pH增大由0.456 g/g增至0.904 g/g。SSSAMC在酸性环境中,H+促进SA中的-COOH质子化,促使微胶囊内部形成分子内和分子间氢键,引起微胶囊中SA分子收缩,而降低SSSAMC溶胀度。同时,由于酸的加入,提升了溶液的渗透压,提高了SSSAMC中的溶胀速率。而SSSAMC于碱性环境中,-OH抑制SA中的-COOH质子化,SA分子间静电斥力作用下,扩展了SSSAMC中三维网络孔径,使SSSAMC更具吸水性,而增加SSSAMC的溶胀度。同时,碱性环境中的Na+进入微胶囊内部,提高微胶囊内部渗透压,导致SSSAMC在碱性环境中溶胀速率下降。
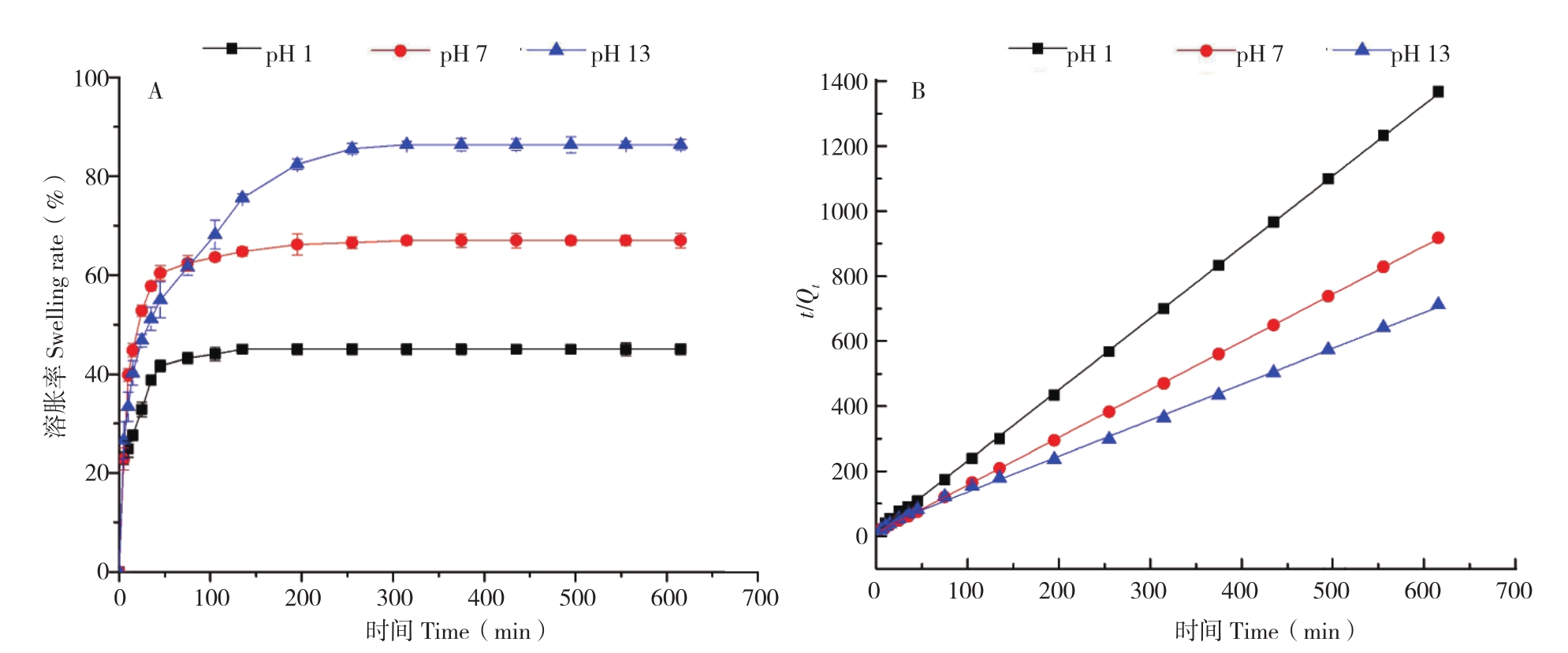
图3 pH对SSSAMC溶胀性能的影响(A)及溶胀动力学t/Qt-t曲线(B)
Fig.3 Effect of different pH on the swelling properties of SSSAMC(A)and the swelling kinetics t/Qt-t curves(B)
表1 不同pH溶液中SSSAMC溶胀动力学方程和动力学参数
Table 1 Swelling kinetic equations and kinetic parameters of SSSAMC in solution with different pH
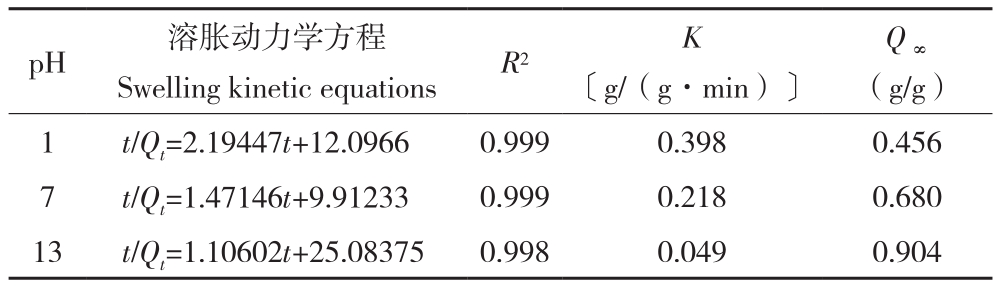
pH 溶胀动力学方程(g/g)1 t/Qt=2.19447t+12.0966 0.999 0.398 0.456 7 t/Qt=1.47146t+9.91233 0.999 0.218 0.680 13 t/Qt=1.10602t+25.08375 0.998 0.049 0.904 Swelling kinetic equations R2 K〔g/(g· min)〕Q∞
2.3.2 温度对SSSAMC溶胀动力学的影响 图4A是SSSAMC分别在温度为30、50 ℃时的溶胀曲线。由图4A可知,SSSAMC的溶胀速率随溶液温度增大,平衡溶胀率随之增大,说明SSSAMC的溶胀具有温度响应性。SSSAMC在溶液温度为50 ℃时,其平衡溶胀率由30 ℃时的67.0%提高到91.0%。升高溶液温度,一方面减弱了SSSAMC分子链间和SA分子与水间的氢键作用,降低了SSSAMC结构的紧密程度,使SA的分子链可充分舒展;另一方面可使SSSAMC和水分子的动能增大,水分子更易进入SSSAMC内部。因而SSSAMC在溶胀过程中具有温度响应性。
SSSAMC在不同温度下的溶胀动力学拟合情况如图4B和表2所示。动力学拟合相关系数R2为0.99以上,变量t与t/Qt呈线性相关,说明SSSAMC在不同温度下的溶胀行为符合Schott模型。SSSAMC的初始溶胀速率常数Kis随溶液pH增大由 0.218 g/(g·min)降至 0.087 g/(g·min),而理论平衡溶胀度Q∞随pH增大由0.677 g/g增至0.904 g/g。理论平衡溶胀度与实验平衡溶胀度相近。
表2 不同温度溶液中SSSAMC溶胀动力学方程和动力学参数
Table 2 Swelling kinetic equations and kinetic parameters of SSSAMC in solution with different temperature

温度TemperatureR2 ∞(℃)Swelling kinetic equations 〔g/(g·min)〕 (g/g)30 t/Qt=1.47146t+9.91233 0.999 0.218 0.680 50 t/Qt=1.07071t+13.2455 0.999 0.087 0.934 K 溶胀动力学方程Q
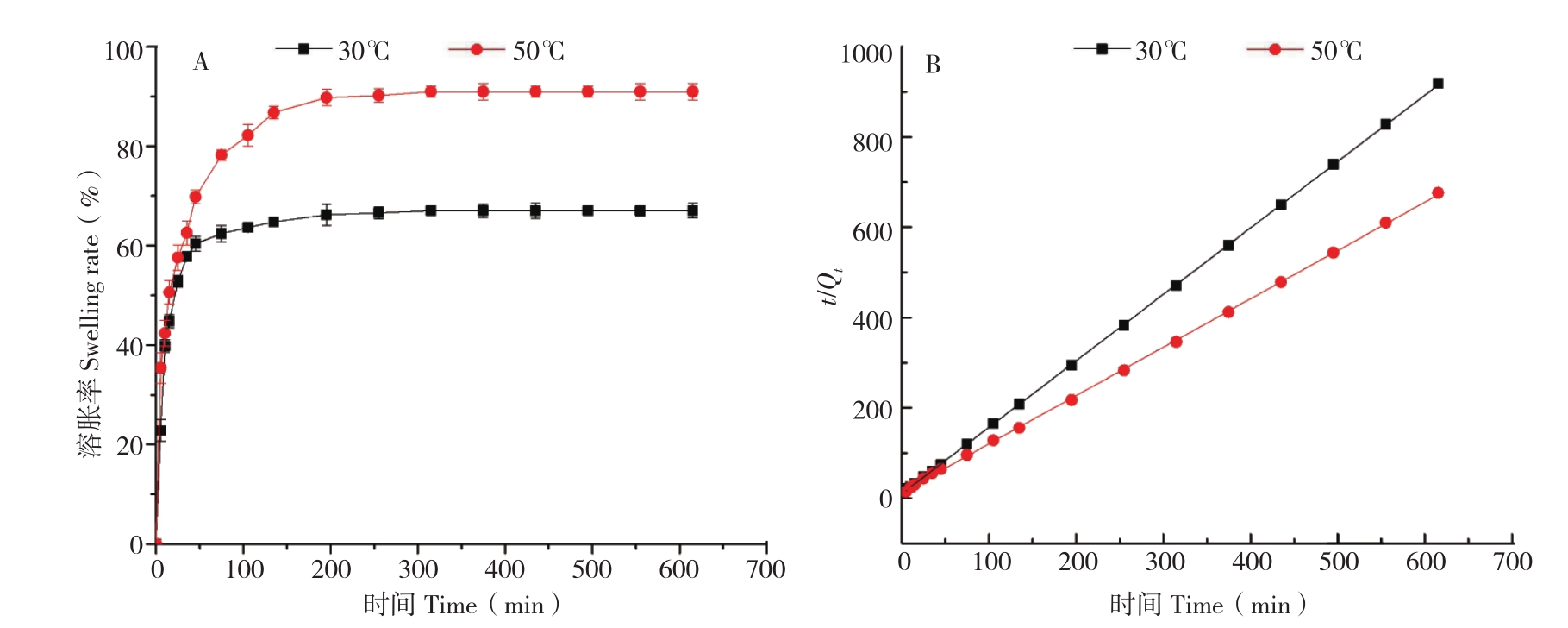
图4 温度对SSSAMC溶胀性能的影响(A)及溶胀动力学t/Qt-t曲线(B)
Fig.4 Effect of different temperature on the swelling properties of SSSAMC(A)and the swelling kinetics t/Qt-t curves(B)
2.3.3 离子强度对SSSAMC溶胀动力学的影响 图5A是SSSAMC分别在NaCl浓度为0、0.3、0.5 mol/L时的溶胀曲线。由图5A可知,SSSAMC的溶胀速率随NaCl浓度增大而增大,平衡溶胀率随浓度增大而降低,说明SSSAMC的溶胀具有离子强度响应性。SSSAMC的离子强度响应性主要受Na+对其结构破坏程度与电荷屏蔽作用控制。当NaCl浓度较低时,Na+对其结构破坏程度是SSSAMC离子浓度响应的主导因素,Na+渗透至微胶囊内部与海藻酸钙中的Ca2+发生交换,破坏微胶囊的“蛋盒”(egg-box)结构,微胶囊结构变得疏松,有利于水分子进入微胶囊内部[25]。然而,随着盐溶液NaCl浓度的增加,Na+对-COO-的电荷屏蔽作用增加,在SSSAMC离子响应中逐渐占主导地位。高浓度的NaCl溶液增强了Na+对-COO-的电荷屏蔽作用,导致SAMC分子链间的静电斥力减少,从而抑制了海藻酸钠中分子链的舒展[26]。对比实验数据可知,Na+对-COO-的电荷屏蔽作用是导致SSSAMC在高盐浓度下溶胀度下降的主导因素。
SSSAMC在不同离子浓度下的溶胀动力学拟合情况如图5B和表3所示。动力学拟合相关系数R2为0.99以上,变量t与t/Qt呈线性相关,说明SSSAMC在不同离子浓度下的溶胀行为符合Schott模型。SSSAMC的初始膨胀率受凝胶网络结构和溶胀介质与SSSAMC间的渗透压影响[27]。随着溶液盐浓度增大,盐溶液与SSSAMC间的渗透压增大,在高渗透压推动下,提高水分子和Na+进出SSSAMC的速率。然而,大量Na+进入SSSAMC后加剧了Na+对-COO-的电荷屏蔽作用,抑制了SSSAMC中SA分子链的舒展。同时,由于盐溶液与SSSAMC间存在渗透压,为达到渗透平衡,部分进入SSSAMC的水分重新回到盐溶液中,因而降低了SSSAMC的溶胀度。
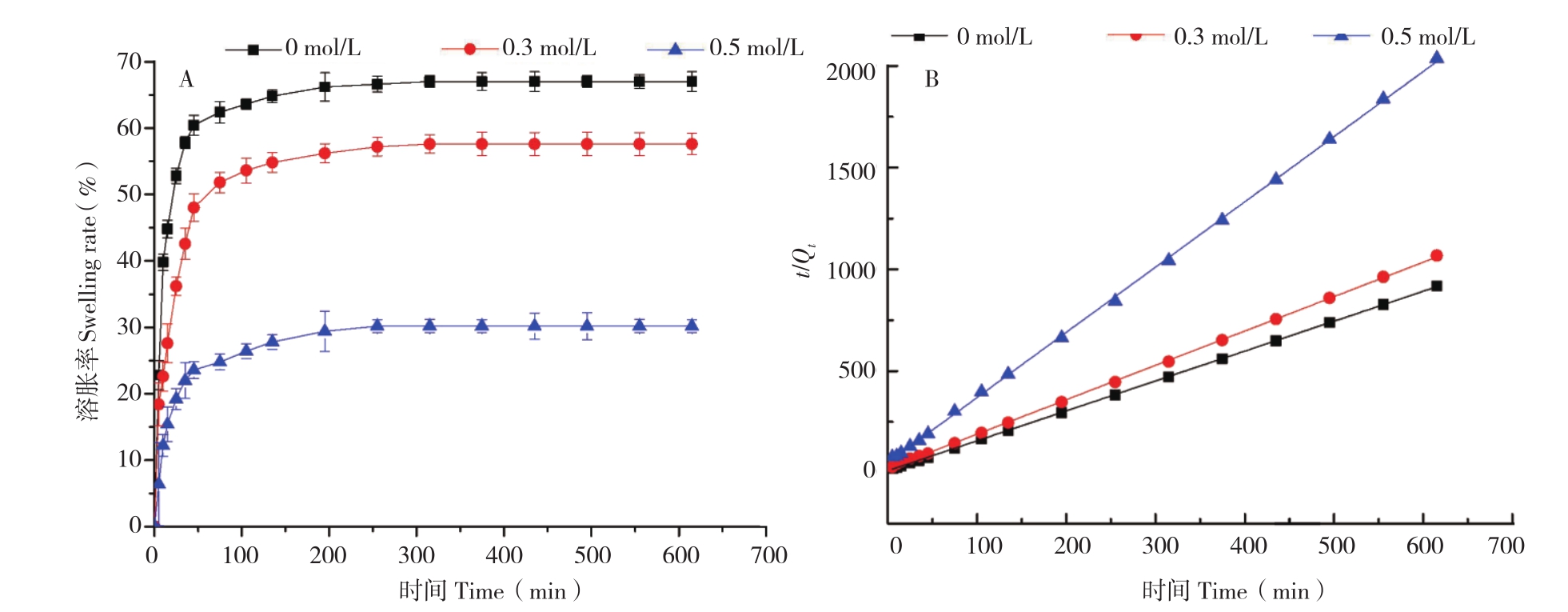
图5 离子强度对SSSAMC溶胀性能的影响(A)及溶胀动力学t/Qt-t曲线(B)
Fig.5 Effect of different ion concentration on the swelling properties of SSSAMC(A)and the swelling kinetics t/Qt-t curves(B)
表3 不同离子强度溶液中SSSAMC溶胀动力学方程和动力学参数
Table 3 Swelling kinetic equations and kinetic parameters of SSSAMC in solution with differention concentration
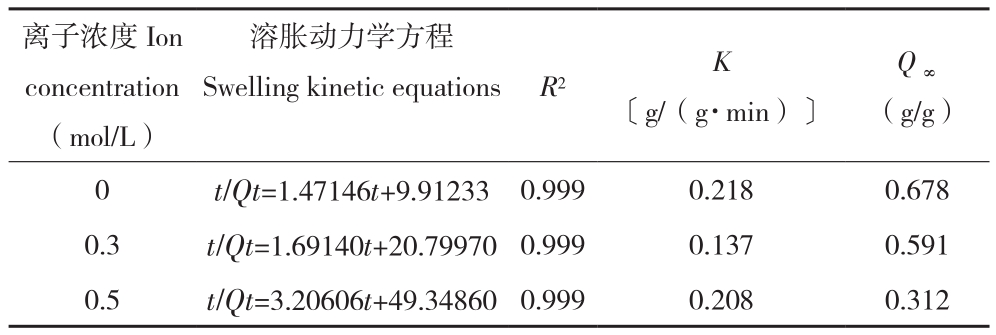
离子浓度Ion concentration(mol/L)(g/g)0 t/Qt=1.47146t+9.91233 0.999 0.218 0.678 0.3 t/Qt=1.69140t+20.799700.999 0.137 0.591 0.5 t/Qt=3.20606t+49.348600.999 0.208 0.312溶胀动力学方程Swelling kinetic equations R2 K〔g/(g·min)〕Q∞
3 讨论
本研究针对Na2SeO3作为饲用硒营养剂使用时存在稳定性欠佳的问题,采用内源乳化法制备了SSSAMC,其中Na2SeO3为芯材、SA为壁材。对SSSAMC进行了热稳定性、结构表征、能谱及其环境响应性分析。SSSAMC具有较好的热稳定性,且形貌规整,其中硒元素含量约为5%。SSSAMC的溶胀能力是其环境响应性的重要考察对象。Gasmi等[23]以酮基布洛芬(Ketoprofen)为模型药物,PLGA〔Poly(D, L lactic-co-glycolic acid)〕为壁材,制备了PLGA微粒,考察PLGA微粒溶胀与药物缓释间的关系。结果表明,PLGA微粒溶胀在药物释放控制中起决定性作用。因而,通过探讨SSSAMC在不同的pH、温度以及离子浓度下的溶胀性能,考察SSSAMC的环境响应能力,对实现长效保护和肠道释放Na2SeO3具有指导意义。而SSSAMC的溶胀性能及其环境响应能力与SA的性质和结构密切关系。SA作为本研究制备微胶囊使用的壁材,其具有能在碱性环境中溶解却不溶于酸性条件的特点,可以作为一种口服肠道给药载体。由样品的SEM分析可知,SSSAMC表面分布着不同直径的孔隙,这种结构促进了其溶胀过程中的物质交换。Lin等[28]研究中也有类似讨论,他们认为水凝胶的响应性溶胀不仅受水凝胶基质性质的影响,同时受到水凝胶的结构影响。此外,溶胀介质的分子动能、渗透压和电荷屏蔽作用等外部因素均会对SSSAMC的溶胀能力产生不同程度的影响。溶液介质中分子动能增大能促进SSSAMC的溶胀,而溶胀介质的渗透压和电荷屏蔽作用增大,对SSSAMC的溶胀起到抑制作用。SSSAMC在本试验pH下的平衡溶胀率为45.0%~86.4%,在本试验温度下的平衡溶胀率为67.0%~91.0%,在本试验离子浓度下的平衡溶胀率为31.2%~67.8%。可见,SSSAMC兼具pH、温度和离子强度响应性,有望作为一种长效保护和肠道释放亚硒酸钠的饲用硒营养剂。对SSSAMC的溶胀数据进行数学模拟,能更便捷地描述SSSAMC的溶胀过程及响应性能。王飞镝等[29]将大豆蛋白(SPI)经预热处理、EDTAD酰化和戊二醛交联,制备出改性大豆蛋白凝胶,并探究了化学改性大豆蛋白改性凝胶溶胀规律,对该凝胶溶胀过程进行Fick模型拟合,得到了较好的线性相关系数,但该溶胀模型使用范围仅在0<Mt/M∞≤0.6间(Mt为t时刻凝胶所吸收水分的质量;M∞为溶胀平衡时凝胶中吸收水分的质量),其未能完整描述凝胶的整个溶胀过程。Ibrahim等[30]通过自由基聚合制备了丙烯酸、丙烯酰胺和N, N-二甲基丙烯酰胺水凝胶,采用Schott模型对水凝胶的整个溶胀过程进行了拟合,得到了较满意的拟合结果。Schott模型可视为一种用于探究三维水凝胶溶胀过程的动力学模型。SSAMC的整个溶胀过程经Schott模型拟合,其线性相关系数均达0.99以上。同时,各条件下的理论溶胀度与实验测得的微胶囊溶胀度接近,表明Schott模型能有效描述SSSAMC的溶胀过程及环境响应性。
4 结论
本研究分别以Na2SeO3、SA和Nona-CaCO3作为芯材、壁材和交联剂,采用内源乳化法制备了SSSAMC。通过分析SSSAMC的热稳定性、形貌与表面元素含量以及在不同pH、温度和离子浓度下的溶胀能力,考察其结构特征与环境响应特性。结果表明,SSSAMC具有较好的热稳定性,且形貌规整,其表面硒元素含量约为5%。在SSSAMC制备过程中,微胶囊表面形成孔隙有利于SSSAMC进行物质交换,而Na2SeO3则以无定型的形式包埋与海藻酸钠微胶囊内。同时,SSSAMC兼具pH、温度和离子浓度响应性,其溶胀行为符合Schott模型,其相关系数达到0.99以上。SSSAMC具备作为肠道响应释放亚硒酸钠的应用潜力。
[1] LOSCALZEO J.Keshan disease, selenium deficiency, and the selenoproteome[J].New England Journal of Medicine, 2014,370(18):1756-1760.doi: 10.1056/NEJMcibr1402199.
[2] AJAREM J, BASHER G, EBAID H.Neurobehavioral changes in mice offspring induced by prenatal exposure to acute toxicity of sodium selenite[J].Biologia, 2011,66(2):357-364.doi: 10.2478/s11756-011-0025-2.
[3] BRODIN O, EKSBORG S, WALLENBER M, ASKERHAGELBERG C, LARSEN E H, MOHLKERT D, LENNEBYHELLEDAY C, JACOBSSON, LINDER S, MIKAEL S, BJORNSTEDT M.Pharmacokinetics and toxicity of sodium selenite in the treatment of patients with carcinoma in a phase I clinical trial: The secar study[J].Nutrients, 2015,7(6):4978.doi: 10.3390/nu7064978.
[4] ASHTON K, HOOPER L, HARVEY L J, HURST R, CASGRAIN A,FAIRWEATHER-TAIT S J.Methods of assessment of selenium status in humans: a systematic review[J].American Journal of Clinical Nutrition, 2009,89(6):2025S-2039S.doi: 10.3945/ajcn.2009.27230G.
[5] LINANG L P, YANG W J, GUAN X H, LI J L, XU Z J, WU J, HUANG Y Y, ZHANG X Z.Kinetics and mechanisms of pH-dependent selenite removal by zero valent iron[J].Water Research, 2013,47(15):5846-5855.doi: 10.1016/j.watres.2013.07.011.
[6] LOESCHER K, HADRUP N, HANSEN M, PEREIRA S A,GAMMELGAARD B, MΦLLER L H, MORTENSEN A, LAM H R, LARSEN.Absorption, distribution, metabolism and excretion of selenium following oral administration of elemental selenium nanoparticles or selenite in rats[J].Metallomics, 2014,6(2):330-337.doi: 10.1039/C3MT00309D.
[7] HUANG Y, MARDEN J P, JULIEN C, BAYOURTHE C.Redox potential: An intrinsic parameter of the rumen environment[J].Journal of Animal Physiology and Animal Nutrition, 2018, 102(2):393-402.doi: 10.1111/jpn.12855.
[8] SINGER P, MANZANARES W, BERGER M M.What’s new in trace elements?[J].Intensive Care Medicine, 2018,44(5):643-645.doi:10.1007/s00134-017-4955-1.
[9] GRILLI E, GALLO A, FUSTINI M, FABTINATI P, PIVA A.Microencapsulated sodium selenite supplementation in dairy cows:effects on selenium status[J].Animal, 2013, 7(12): 1944-1949.
[10] XIAO W, ZENG X, LIN H, HAN K JIA H ZHANG X Z.Dual stimuliresponsive multi-drug delivery system for the individually controlled release of anti-cancer drugs[J].Chemical Communications,2015,51(8):1475-1478.doi: 10.1039/C4CC08831J.
[11] WEI J, JU X J, ZOU X Y, XIE R, WANG W, LIU Y M, CHU L Y.Multi-stimuli-responsive microcapsules for adjustable controlledrelease[J].Advanced Functional Materials, 2014,24(22):3312-3323.doi: 10.1002/adfm.201303844.
[12] HUANG J, LIU Y, LIN Y H, BELLES X, LEE H.Practical use of RNA interference: oral delivery of double-stranded RNA in liposome carriers for cockroaches[J].Journal of Visualized Experiments: JoVE,2018(135).doi: 10.3791/57385.
[13] FRANKLIN D S, GUHANATHAN S.Performance of silanecoupling agent-treated hydroxyapatite/diethylene glycol-based pH-sensitive biocomposite hydrogels[J].Iranian Polymer Journal,2014,23(10):809-817.doi: 10.1007/s13726-014-0278-z.
[14] QIU Y, PARK K.Environment-sensitive hydrogels for drug delivery[J].Advanced Drug Delivery Reviews, 2001,53(3):321-339.doi: 10.1016/j.addr.2012.09.024.
[15] CHANG D, LEI J, CUI H R, LU N, SUN Y J, ZHANG X H, GAO C, ZHENG H, YIN Y H.Disulfide cross-linked nanospheres from sodium alginate derivative for inflammatory bowel disease: Preparation,characterization, and in vitro drug release behavior[J].Carbohydrate Polymers, 2012,88(2):663-669.doi: 10.1016/j.carbpol.2012.01.020.
[16] SATO MATSUO E, TANAKA T.Kinetics of discontinuous volumephase transition of gels[J].The Journal of Chemical Physics, 1988,89(3): 1695-1703.doi: 10.1063/1.455115.
[17] LI Y, TANAKA T.Kinetics of swelling and shrinking of gels[J].The Journal of Chemical Physics, 1990, 92(2): 1365-1371.doi:10.1063/1.458148
[18] WANG C, LI Y, HU Z.Swelling kinetics of polymer gels[J].Macromolecules, 1997, 30(16): 4727-4732.doi: 10.1021/ma9613648.
[19] CRANK J.The Mathematics of Diffusion[M].Oxford:Oxford University Press, 1979.
[20] ALFREY Jr T, GURNEE E F, LLOYD W G.Diffusion in glassy polymers[J].Journal of Polymer Science Part C: Polymer Symposia.1966, 12(1): 249-261.doi: 10.1002/polc.5070120119.
[21] SCHOTT H.Swelling kinetics of polymers[J].Journal of Macromolecular Science, Part B: Physics, 1992,31(1):1-9.doi: org/10.1080/00222349208215453.
[22] ZHAO L W, LI Q, XU X, KONG W K, LI X D, SU Y, YUE Q Y, GAO B Y.A novel enteromorpha based hydrogel optimized with Box-Behnken response surface method: synthesis, characterization and swelling behaviors[J].Chemical Engineering Journal, 2016, 287: 537-544.
[23] GASMI H , DANEDE F , SIEPMANN J, SIEPMANN F.Does PLGA microparticle swelling control drug release? New insight based on single particle swelling studies[J].Journal of Controlled Release, 2015, 213:120-127.doi: 10.1016/j.jconrel.2015.06.039.
[24] 杨安源,胡恩烨,周红军,周新华,舒绪刚.亚硒酸钠/海藻酸钠微胶囊的制备及表征[J].广东农业科学,2018,48(12):118-124.doi: 10.16768/J.ISSN.1004-874X.2018.12.020.
YANG A Y, HU E Y, ZHOU H J, ZHOU X H,SHU X G.Preparation and characterization of sodium selenite/sodium alginate microcapsules[J].Guangdong Agricultural Sciences, 2018,48(12):118-124.doi: 10.16768/J.ISSN.1004-874X.2018.12.020.
[25] 罗璋.海藻酸钠/羽毛蛋白缓释微球的制备及性能研究[D].广州:仲恺农业工程学院,2014.
LUO Z.Preparation and properties of sodium alginate/feather keratin sustained-release microsphere[D].Guangzhou: Zhongkai University of Agriculture and Engineering,2014.
[26] SHI X, WANG W, WANG A.pH-responsive sodium alginate-based superporous hydrogel generated by an anionic surfactant micelle templating[J].Carbohydrate Polymers, 2013,94(1):449-455.doi:10.1016/j.carbpol.2013.01.019.
[27] ZHAO Y, SU H J, FANG L, TAN T W.Superabsorbent hydrogels from poly (aspartic acid) with salt, temperature and pH responsiveness properties[J].Polymer, 2005,46(14):5368-5376.doi: 10.1016/j.polymer.2005.04.015.
[28] LIN H, LIN J K, ZHANG K, FAN Y J, ZHANG X D.Dynamic mechanical and swelling properties of maleated hyaluronic acid hydrogels[J].Carbohydrate Polymers, 2015, 123: 381-389.doi:10.1016/j.carbpol.2015.01.047.
[29] 王飞镝,柯晴瑾,王凌伟,奚红霞,崔英德.化学改性大豆蛋白凝胶溶胀过程规律的研究[J].高分子学报,2010(9):1116-1121.doi:10.3724/SP.J.1105.2010.09383.
WANG F D, KE Q J, WANG L, XI H X, CUI Y D.Swelling behavior of chemical modified soy protein gels[J]Acta Polymerica Sinica,2010(9):1116-1121.doi: 10.3724/SP.J.1105.2010.09383.
[30] IBRAHIM A G, HAI F A, WAHAB H A, MAHMOUD H.Synthesis,characterization, swelling studies and dye removal of chemically crosslinked acrylic acid/acrylamide/N, N-dimethyl acrylamide hydrogels[J].American Journal of Applied Chemistry, 2016, 4: 221-234.doi: 10.11648/j.ajac.20160406.12.