【研究意义】随着2015年马铃薯主食化战略的提出,马铃薯在我国的种植面积不断增长[1],与其他粮食作物相比,马铃薯更加耐寒、耐旱、耐瘠薄、适应性广[2]。然而,受限于现代农业具有复种指数高、作物种类单一的特点,马铃薯连作现象普遍,长期连作导致其即使在正常栽培管理下也会出现品性退化、品质下降、产量降低等情况,即连作障碍[3]。连作障碍的形成是由植物-土壤系统多种因素综合作用的结果[4],其中由于化感物质引起的化感现象是引起连作障碍的重要原因,酚酸类物质是已经被证实的众多化感物质之一[5]。酚酸常用的测定方法有酶法、分光光度法、气相色谱法、离子色谱法、高效液相色谱法及毛细管电泳法,其中高效液相色谱法是目前较精确、较常用的仪器分析法,而色谱条件直接影响了高效液相色谱法的测定效果,测定不同有机酸其条件也有很大差异[6]。【前人研究进展】江和源等[7]建立了利用高效液相色谱法同时测定茶叶中5种酚酸类化合物的方法,并认为使用不同提取液制备样品,测定结果差异较大;运用反相高效液相色谱法可以同时测定马铃薯块茎中的4种酚酸,但流动相对测定效果有很大影响[8];吴丹等[9]利用高效液相色谱法测定了太子参根际土壤中的酚酸,发现种植太子参后土壤中的酚酸类自毒物质含量升高。香草酸、对羟基苯甲酸、阿魏酸是与马铃薯连作障碍的关系密切的酚酸类化合物[10-11],分别浇灌这3种酚酸的溶液及其混合液,对马铃薯植株的株高、茎粗、地上分茎数、匍匐茎数、根长和生物量均有显著抑制作用[12],因此如何快速修复连作障碍的最根本条件是降低土壤中自毒物质的数量和活性。目前,轮作换茬是当前防治连作障碍最经济、最有效、应用最广的方法,而在不同栽培方法下土壤理化性质会发生相应改变,酚酸类物质的含量与种类也会有所不同,多年连作的西洋参轮作后发现总酚含量显著下降,与未种植过西洋参的土地接近,并且病害减少[13];杨树人工轮作与连作土壤中酚酸有很大差异,轮作中酚酸降解菌总丰度都有增加[14]。【本研究切入点】对色谱条件中测定波长、流动相体系、柱温等参数进行了优化,考察以上条件对分离测定效果的影响,并对马铃薯进行3种方式连作(普通连作、玉薯轮作、强化连作)试验,采用优化后的色谱条件,通过高效液相色谱法测定土壤的酚酸含量。【拟解决的关键问题】建立一种快速、准确利用高效液相色谱法测定土壤中3种酚酸的方法,并分析不同连作方式对马铃薯土壤中3种酚酸的影响。
1 材料与方法
1.1 试验材料
仪器:安捷伦-1200高效液相色谱仪、高纯水制备仪、台式pH计、超声波震荡仪、高速离心机。
试剂:酚酸标准品为Sigma公司生产的香草酸、对羟基苯甲酸、阿魏酸。乙腈、甲醇、冰醋酸为色谱级,液相色谱采用的水为超纯水,盐酸、氢氧化钠为分析纯。
1.2 试验方法
1.2.1 试验设计 试验于2014—2017年在四川农业大学试验田进行,设马铃薯连作、马铃薯/玉米轮作、马铃薯强化连作3个处理,以保持土壤未栽培状态作对照(CK),供试马铃薯品种为川芋117(表1)。
表1 试验处理
Table 1 Experimental treatment

处理Treatment 2014 2015 2016 2017对照(CK) 闲置 闲置 闲置 闲置普通连作Common continuous cropping马铃薯 马铃薯 马铃薯 马铃薯玉-薯轮作Cornpotato rotation玉米 马铃薯 玉米 马铃薯强化连作Intensified continuous cropping春薯-秋薯 春薯-秋薯 春薯-秋薯 春薯-秋薯
1.2.2 土样采集 于马铃薯连续种植第4年(2017年)春季的前期、花期、块茎膨大期、成熟期共4个时期分别采集土样,采用抖土法收集各处理马铃薯根际土壤,室内风干后过0.425 mm筛,用塑封袋装后于4℃保存待用。
1.2.3 土壤酚酸提取 土壤酚酸的提取参考田给林等[15]的方法并有所改动。分别称取各处理土样10 g置于离心管中,加入1 mol/L NaOH溶液各20 mL,超声震30 min后静置24 h,于210 r/min摇床上震荡30 min,8 000 g离心力下离心20 min,分离上清液后用12 mol/L盐酸调整溶液pH至2.5沉淀出胡敏酸,超声震荡10 min后静置2 h,8 000 g离心力下离心10 min,分离上清液4℃保存待分析。
1.3 测定方法
1.3.1 标准溶液配制 准确称取香草酸、对羟基苯甲酸、阿魏酸各20.0 mg分别置于3个100 mL容量瓶中,并准确称取香草酸、对羟基苯甲酸、阿魏酸各20.0 mg置于同一容量瓶中,滴加几滴甲醇溶解后用超纯水定容至刻度线,作为单一标样以及混合标样的母液,于4℃中保存,使用时稀释100倍作为工作液。所有样品进样前经0.22 μm滤膜过滤。
1.3.2 色谱条件 分离柱采用安捷伦XDB-C18柱(250 mm×4.6 mm,5 μm),检测波长为λ=280 nm,柱温为35℃,进样量为20 μL,采用A、B双泵系统,其中流动相组分A为乙腈,B为用色谱纯的冰醋酸调节pH 2.60的高纯水,体积比为A∶B=25∶75,双泵体积流量SI=0.8 mL/min,调整两泵的流速来分离3种酚酸。
试验数据使用Excel、Origin数据处理软件进行处理和分析。
2 结果与分析
2.1 色谱条件的选择
2.1.1 测定波长 在确定色谱柱的前提下,液相色谱的条件主要有流速和柱温、紫外检测波长、流动相的选择,测定酚酸的最佳波长有260、280、320 nm[8],结合测定目标,为保证测定的灵敏度,将280 nm设为本试验紫外检测波长。
2.1.2 流动相 甲醇-醋酸与乙腈-醋酸都是常用的流动相体系,而乙腈吸光度小、柱压低,测试后选择乙腈-醋酸水溶液作流动相。酚酸为酸性物质,因此,醋酸水溶液pH对峰型和保留时间影响较大。经测试,当醋酸水溶液pH=2.60时,峰型较好、无拖尾现象;而随着乙腈在流动相中所占体积比的增大,各酚酸的保留时间缩短、分离度随之下降,经测试乙腈∶醋酸水溶液=20∶80、25∶75、30∶70、35∶75、40∶60的效果,同时综合分离效果与分离时间,选择乙腈∶醋酸水溶液=25∶75。
2.1.3 柱温 色谱柱温度能影响其柱效、分离选择性、检测灵敏度和稳定性。一般来说,提高柱温可以缩短各酚酸的保留时间,因此分离度也会下降,但柱温过高会影响色谱柱本身。由图1可知,当其他色谱条件确定时,柱温分别为25、30、35℃的测定效果表明,柱温为35℃时测定时间短且保证了分离度。
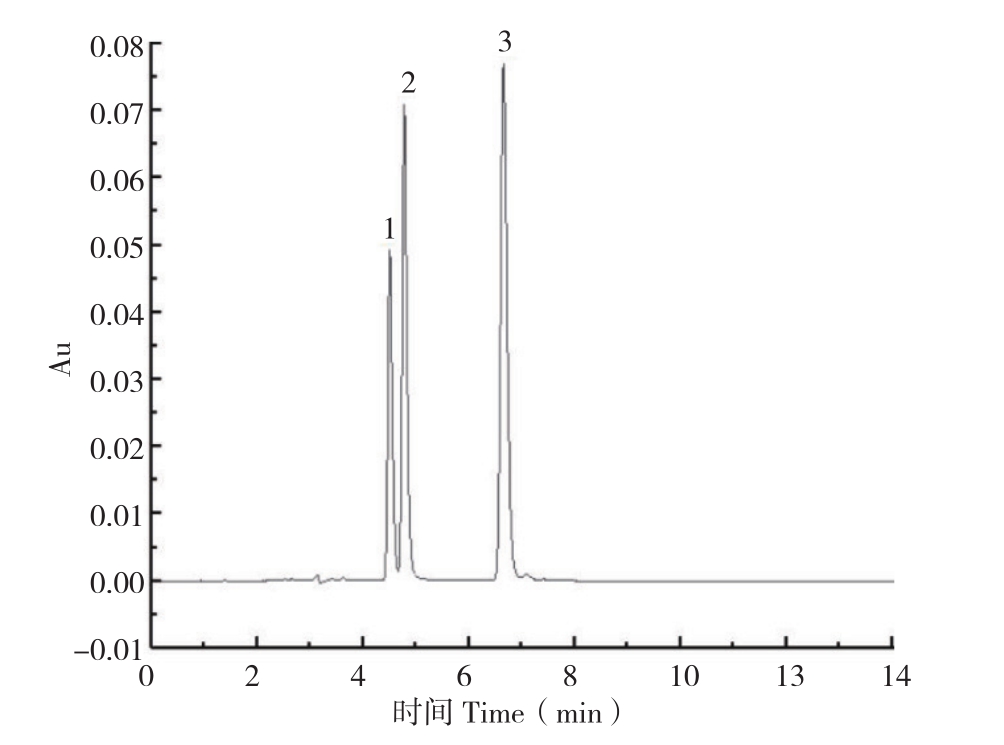
图1 3种酚酸混合标准样品的色谱图
Fig. 1 Chromatograms of standard sample of mixture of 3 phenolic acids
1:对羟基苯甲酸;2:香草酸;3:阿魏酸
1:ρ-hydrobenzoic acid; 2: Vanllic acid; 3: Frulic acid
2.2 色谱条件的分析考察
2.2.1 线性关系 将制备的不同浓度标准样品按照2.1条件依次进样,计算回归方程与相关系数,并以3倍信噪比确定检出限,结果(表2)表明在该条件下,各酚酸的紫外吸收值与浓度间的线性关系良好。
2.2.2 重现性 将3种酚酸的混合样品按照上述建立的液相色谱条件进行重复进样6次,比较色谱峰相对保留时间,结果见表3,表3表明在该条件下5次平行试验中各酚酸保留时间变化较小,具有良好的稳定性,其RSD值在0.05%~0.18%。
表2 3种酚酸组分的回归方程、相关系数、线性范围和检出限
Table 2 Regression equations, correlation coefficients, linear ranges and detection limits of 3 phenolic acids
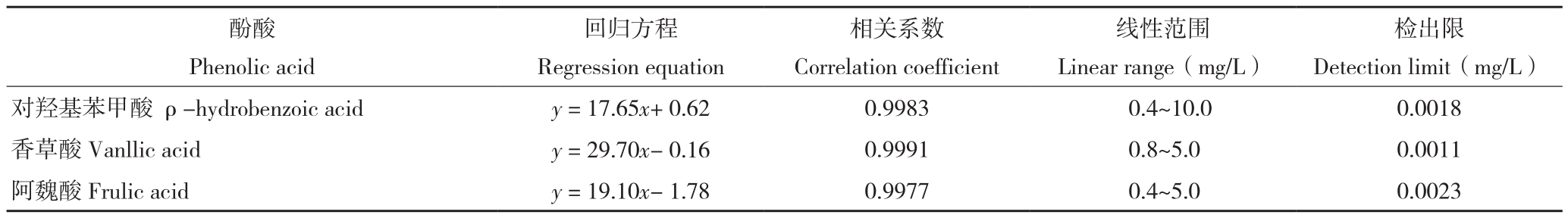
检出限Detection limit(mg/L)对羟基苯甲酸ρ-hydrobenzoic acid y = 17.65x+ 0.62 0.9983 0.4~10.0 0.0018香草酸Vanllic acid y = 29.70x- 0.16 0.9991 0.8~5.0 0.0011阿魏酸Frulic acid y = 19.10x- 1.78 0.9977 0.4~5.0 0.0023酚酸Phenolic acid回归方程Regression equation相关系数Correlation coefficient线性范围Linear range(mg/L)
表3 3种酚酸的保留时间和相对标准偏差
Table 3 Retention time and relative standard deviation of 3 phenolic acids

相对标准偏差RSD对羟基苯甲酸ρ-hydrobenzoic acid酚酸Phenolic acid保留时间Retention time(min)4.461±0.081 0.18香草酸Vanllic acid 4.714±0.029 0.06阿魏酸Frulic acid 6.525±0.030 0.05
2.2.3 回收率 将混合标准样品稀释10倍后,与待测土壤提取液等体积混合,按照上述条件进样,重复6次,测定回收率,结果见表4,在本试验条件下各酚酸回收率较高,相对标准偏差均低于2%,能达到定量分析要求。
表4 3种酚酸的回收率和相对标准偏差
Table 4 Recovery rate and relative standard deviation of 3 phenolic acids

相对标准偏差RSD对羟基苯甲酸ρ-hydrobenzoic acid酚酸Phenolic acid回收率Recovery rate (%)100.46±8.29 1.86香草酸Vanllic acid 95.03±7.48 1.04阿魏酸Frulic acid 94.37±5.22 0.59
2.3 不同连作方式对土壤酚酸含量的影响
不同连作方式条件下成熟期马铃薯土壤酚酸含量的色谱图见图2,对不同连作方式中同类酚酸进行多重比较分析结果见表5。结果表明,3种酚酸均能在不同连作方式和对照土壤中检测出,但是含量与变化都有所差异。在马铃薯整个生育期,未栽培(CK)、轮作、普通连作土壤中3种酚酸含量整体上均表现为先增后减,而强化连作土壤3种酚酸含量一直呈下降趋势,但均在花期达到最大值;成熟期与前期相较,未栽培(CK)土壤中对羟基苯甲酸、香草酸、阿魏酸变化分别为3.28%、-7.83%、-6.27%,3种酚酸前后变化较小且差异不显著,轮作土壤分别下降19.65%、17.98%、39.88%,普通连作土壤分别下降5.36%、16.85%、16.31%,强化连作土壤分别下降45.13%、59.52%、49.15%。3种种植方法中的3种酚酸整体均呈下降且达到显著差异,说明马铃薯在整个生育期中对土壤酚酸含量产生了影响,且不同栽培方式对不同种类的酚酸影响不同。在前期,强化连作土壤3种酚酸均高于其他处理且差异显著,这3种酚酸含量分别比其他连作方式高出48.26%~56.17%、71.26%~149.60%、29.64%~58.90%,其中玉薯轮作均为最低;至成熟期时,玉薯轮作土壤中3种酚酸含量均为最低,未栽培(CK)土壤的3种酚酸含量均为最高。
3 讨论
3.1 HPLC同时测定马铃薯土壤中3种酚酸的方法
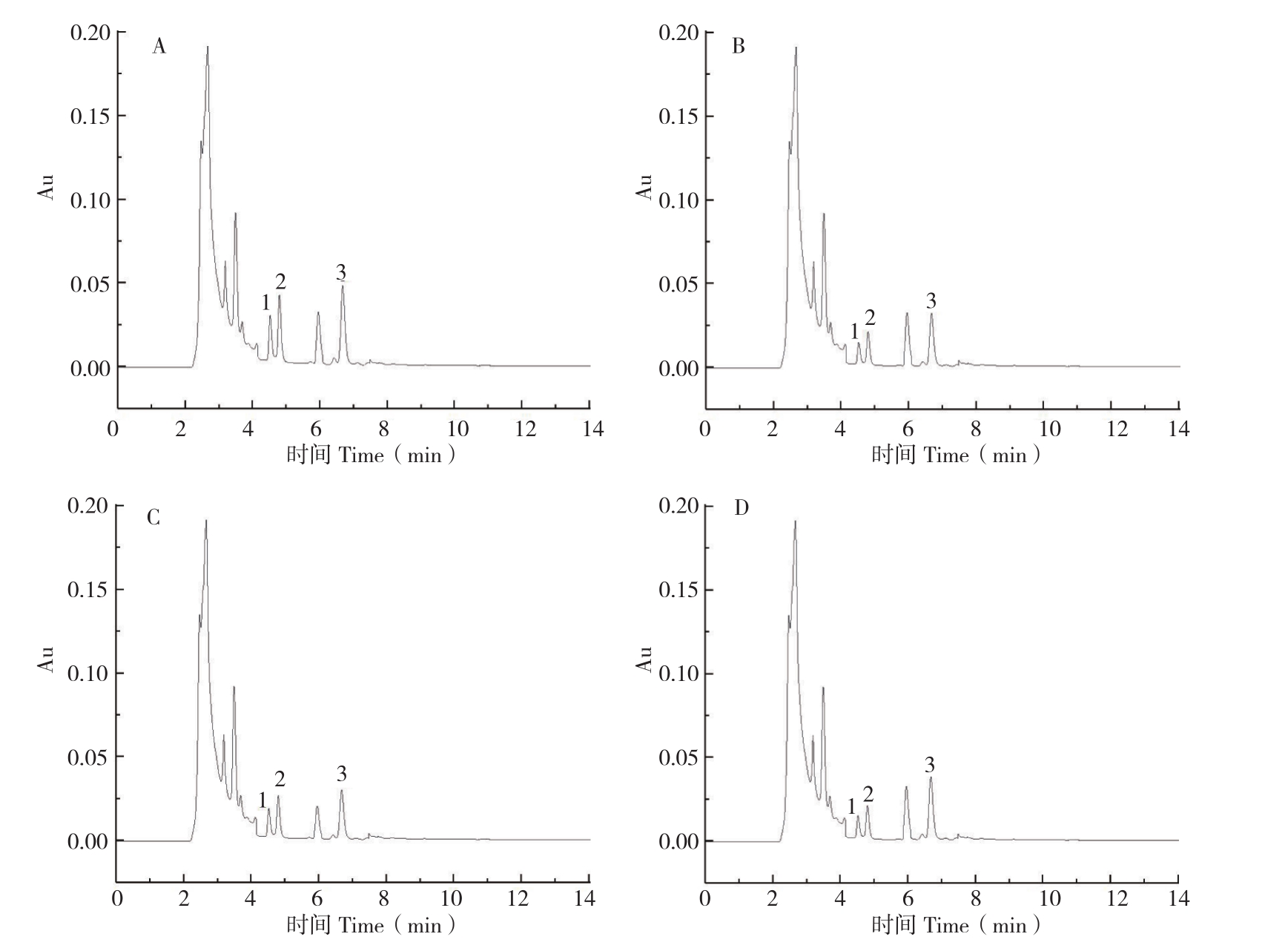
图2 成熟期不同连作方式与对照土壤提取液中酚酸色谱图
Fig. 2 Chromatogram of phenolic acids in soil extracts from different continuous cropping patterns and CK at mature stage
A:对照;B:玉薯轮作;C:普通连作;D:强化连作
A: CK; B:: Corn and potato rotation C: Continuous Cropping D: Intensified continuous cropping 1:对羟基苯甲酸;2:香草酸;3:阿魏酸1:ρ-hydrobenzoic acid;2:Vanllic acid;3:Frulic acid
表5 不同连作方式下各生育期土壤酚酸含量(μg/g)
Table 5 Content of soil phenolic acids in different growth stages under different continuous cropping patterns

注:同类酚酸同列数据后小写英文字母不同者表示差异显著。
Note: The same phenolic acids marked with different lowercase letters represent significant differences.
生育时期 Growth period前期Earlier stage 花期 Flowering 块茎膨大期Tuber swelling 成熟期 Maturation stage对羟基苯甲酸ρ-hydrobenzoic acid酚酸Phenolic acid连作方式Continuous cropping pattern CK 10.67±0.40ef 13.15±0.52bc 13.81±0.35b 11.02±0.87def玉薯轮作 10.33±0.27fg 12.74±0.14bcd 11.57±0.32def 8.34±0.08h普通连作 10.83±0.51ef 12.68±0.33bcd 11.62±0.52def 10.25±0.22ef强化连作 15.82±0.43a 13.96±0.58bc 12.29±0.31cde 8.68±0.09gh香草酸Vanllic acid CK 16.72±0.12f 24.95±0.75b 25.28±0.21b 15.41±0.57fg玉薯轮作 12.07±0.58i 26.17±0.21b 19.05±0.11de 9.92±0.23i普通连作 17.57±0.48ef 21.65±0.38c 20.41±0.29cd 14.61±0.25gh强化连作 30.09±0.78a 24.64±0.34b 13.61±0.41h 12.18±0.21i阿魏酸Frulic acid CK 10.68±0.16fg 16.51±0.33b 16.15±0.21ab 10.01±0.32gh玉薯轮作 10.09±0.22c 12.63±0.28ef 9.92±0.49h 7.87±0.22i普通连作 11.71±0.11de 12.76±0.22cd 11.33±0.25ef 9.80±0.40h强化连作 16.97±0.13a 13.09±0.21c 10.41±0.50ef 8.63±0.28i
利用高效液相色谱法测定酚酸类自毒化感物质是目前运用最广泛、最便捷的方法之一[16]。在使用高效液相色谱法测定时,色谱条件直接影响测定结果,测定不同化合物所需的溶剂各不相同,主要与目标化合物的溶解性与解离度相关,测定酚酸常用的有机溶剂有甲醇、乙腈、石油醚等[17],流动体系对分离度的影响较大,通过调整有机相与水相的比例可以有效分离多种酚酸,改变柱温可以影响出峰时间,对分离度也有一定影响。本研究在前人基础上,同时对色谱溶剂、流动体系、柱温和波长进行了试验,筛选出能够快速分离测定马铃薯土壤中3种酚酸(对羟基苯甲酸、香草酸、阿魏酸)含量的方法,且该方法重复性高、精确度较好、检出限低,各酚酸均有显著的线性关系。
3.2 不同种植方式对马铃薯土壤中3种酚酸含量的影响
改变种植制度、合理更换栽培方式被认为是有效克服连作障碍的方法之一。符建国等[18]通过分离与鉴定烟田根际土壤酸性有机组分,发现轮作与连作土壤中的酸性成分发生了种类与数量上的变化,说明更改种植制度可以有效影响土壤中酚酸成分的组成。本试验中,各个时期的土壤中均能检测出对羟基苯甲酸、香草酸、阿魏酸。马铃薯属于块茎类作物,在前期主要为地上部分生长发育,而后期则相反,这可能是土壤酚酸出现先增后减的原因,整体来看,各种植方式中3种酚酸含量均逐渐下降,且随着生育期推进与未栽培土壤(CK)差异逐渐不显著,这与叶发茂等[19]研究结果相似。植株残体会产生自毒物质[20],作物残体的腐解与降解[21]会导致土壤中酚酸积累,强化连作距离上一茬较近,导致在前期强化连作3种酚酸含量均为最高;而玉薯轮作丰富了作物与土壤交换模式,改善了土壤理化环境,使得马铃薯不需要分泌自毒物质来抑制其他植物生长发育[22],并且马铃薯与玉米对土壤养分需求有一定差异[23],这可能导致玉薯轮作中前期与成熟期3种酚酸含量均为最低,证明玉薯轮作可以减少土壤中3种酚酸含量,但土壤中的酚酸并不是单一作用的,不同酚酸之间存在协同作用和拮抗作用,对作物的影响程度也有一定差异[24],不能仅以含量来评估其对连作障碍的影响,因此酚酸对连作障碍的作用机理还有待进一步探究。
4 结论
在安捷伦XDB-C18柱(250 mm×4.6 mm,5 μm),检测波长为λ=280 nm,柱温为35℃,进样量20 μL,采用等度洗脱,流动相为75%A液(以冰醋酸调节pH=2.60)∶25%B液(乙腈),双泵体积流量SI=0.8 mL/min的色谱条件下,能够准确、快速地同时测定土壤中香草酸、对羟基苯甲酸、阿魏酸等3种酚酸。测定结果显示,空白对照土壤中3种酚酸在前后差异较小,3种酚酸在不同连作方式下成熟期均低于前期,其中玉薯轮作土壤中3种酚酸均为最低,表明通过玉薯轮作可以降低土壤中酚酸含量,缓解连作障碍。
[1] 谷悦.马铃薯主粮化为国家粮食安全战略重要一步——农业部公开解答关于马铃薯主粮化的问题[J]. 中国食品,2015(3):36-39.GU Y. Potato staple food conversion is an important step in the national food security strategy - the Ministry of Agriculture openly answers questions about potato staple food conversion[J]. China Food, 2015(3): 36-39.
[2] 冯华.为何要让马铃薯成第四大主粮[J].湖南农业,2015(3):31.FENG H. Why make potatoes the fourth staple food[J]. Hunan Agriculture, 2015(3): 31.
[3] 何天久,吴巧玉,曾宪浩,唐健波,雷尊国.马铃薯连作障碍形成机制与调控措施研究进展[J].江苏农业科学,2016,44(4):1-4.doi: 10.15889/j.issn.1002-1302.2016.04.001.HE T C, WU Q Y, ZENG X H, TANG J B, LEI Z G. Research progress on formation mechanism and control measures of continuous cropping obstacles in potatoes[J]. Jiangsu Agricultural Sciences, 2016, 44 (4):1-4. doi:10.15889/j.issn.1002-1302.2016.04.001.
[4] 田给林,毕艳孟,孙振钧,张潞生.酚酸类物质在作物连作障碍中的化感效应及其调控研究进展[J].中国科技论文,2016,11(6):699-705. doi: 10.3969/j.issn.2095-2783.2016.06.022.TIAN Z L, BI Y M, SUN Z J, ZHANG L S. Advances in allelopathic effects and regulation of phenolic acids in crop continuous cropping obstacles[J].Chinese Science and Technology Papers, 2016, 11 (6):699-705. doi: 10.3969/j.issn.2095-2783.2016.06.022.
[5] 李孝刚,张桃林,王兴祥.花生连作土壤障碍机制研究进展[J].土壤,2015,47(2):266-271.LI X G, ZHANG T L, WANG X X. Advances in soil barrier mechanism of peanut continuous cropping[J].Soil, 2015, 47(2): 266-271.
[6] 暴凤伟,刘玉强,胡丽萍,张振秋,侯学智,谢剑琳.HPLC波长切换法同时测定丹参酚酸提取物中5种成分[J].中成药,2012,34(12):2368-2372. doi: 10.3969/j.issn.1001-1528.2012.12.026.BAO F W, LIU Y Q, HU L P, ZHANG Z Q, HOU X Z, XIE J L.Simultaneous determination of five constituents in salvianolic acid extract by wavelength switching method of high performance liquid chromatography[J]. Chinese Patent Medicine, 2012, 34 (12):2368-2372.doi:10.3969/j.issn.1001-1528.2012.12.026.
[7] 江和源,蒋迎.茶叶中5种酚酸类化合物的HPLC测定方法[J].食品工业科技,2004(12):50. doi:10.3969/j.issn.1002-0306.2004.12.053.JIANG H Y, JIANG Y. Determination of five phenolic acids in tea by high performance liquid chromatography[J].Food Industry Science and Technology, 2004 (12): 50. doi:10.3969/j.issn.1002-0306.2004.12.053.
[8] 骆成尧,印遇龙,阮征,欧阳崇学,文红艳,周笑犁.反相高效液相色谱法同时测定马铃薯块茎中酚酸类物质[J].食品科学,2011,32(18):300-303.LUO C Y, YING Y L, RUAN Z, OUYANG C X, WEN H Y, ZHOU X L.Simultaneous determination of phenolic acids in potato tubers by RPHPLC[J]. Food Science, 2011, 32 (18): 300-303.
[9] 吴丹,赵立,庞文生,周美兰,胡娟.太子参根际土壤酚酸类自毒物质的分析测定[J].中国民族民间医药,2017,26(24):32-34.WU D, ZHAO L, PANG W S, ZHOU M L, HU J. Analysis and determination of phenolic acid autotoxic substances in rhizosphere soil of Radix pseudostellariae[J]. Chinese Folk Medicine, 2017, 26 (24): 32-34.
[10] 沈宝云.甘肃黄河灌区马铃薯不同品种对连作逆境的响应机理研究[D].兰州:甘肃农业大学,2013.SHEN B Y. Response mechanism of different potato varieties to continuous cropping stress in Yellow River irrigation area of Gansu [D].Lanzhou: Gansu Agricultural University, 2013.
[11] 沈宝云,李朝周,余斌,张俊莲,王蒂,白江平.甘肃沿黄灌区连作马铃薯根区土壤有机物GC-MS分析[J].干旱地区农业研究,2016,34(3):1-7. doi: 10.7606/j.issn.1000-7601.2016.03.01.SHEN B Y, LI C Z, Yu Bin, ZHANG J L, WANG D, BAI J P. GCMS analysis of soil organic matter in potato root zone of continuous cropping along the Yellow River irrigation area in Gansu[J].Agricultural Research in Arid Areas, 2016, 34 (3): 1-7. doi: 10.7606/j.issn.1000-7601.2016.03.01.
[12] 李自龙,回振龙,张俊莲,沈宝云,李朝周.外源酚酸类物质对马铃薯植株生长发育的影响及机制研究[J].华北农学报,2013,28(6):147-152. doi: 10.7668/hbnxb.2013.06.026 LI Z L, HUI Z L, ZHANG J L, SHEN B Y, LI Z C. Effects of exogenous phenolic acids on the growth and development of potato plants and their mechanisms[J]. Journal of North China Agriculture, 2013, 28 (6):147-152. doi: 10.7668/hbnxb.2013.06.026.
[13] 张雪松.轮作对西洋参连作障碍消减作用的研究[D].北京:北京协和医学院,2013.ZHANG X S. Study on the reducing effect of rotation on continuous cropping obstacles of panax quinquefolium[D]. Beijing: Peking Union Medical College, 2013.
[14] 王文波,马雪松,董玉峰,王华田,王延平,伊文慧.杨树人工林连作与轮作土壤酚酸降解细菌群落特征及酚酸降解代谢规律[J]. 应用与环境生物学报,2016,22(5):815-822. doi:10.3724/SP.J.1145.2015.10020.WANG W B, MA X S, DONG Y F, WANG H T, WANG Y P, YI W H. Poplar plantation continuous cropping and rotation phenolic acid degradation bacteria community characteristics and phenolic acid degradation metabolism analysis[J].Journal of Applied and Environmental Biology,2016,22(5): 815-822. doi:10.3724/SP.J.1145.2015.10020.
[15] 田给林,严婷婷,毕艳孟,孙振钧,张潞生.草莓连作土壤灭菌与施用有机肥对根际土壤酚酸及土壤酶活性的影响[J].园艺学报,2015,42(10):2039-2048. doi: 10.16420/j.issn.0513-353x.2015-0192.TIAN Z L, YAN T T, BI Y M, SUN Z J, ZHANG L S. Effects of sterilization and application of organic fertilizer on phenolic acids and soil enzyme activities in rhizosphere soil of strawberry continuous cropping[J]. Journal of Horticulture, 2015, 42 (10): 2039-2048. doi:10.16420/j.issn.0513-353x.2015-0192.
[16] 陈娥,张等宏,王丹丹,金辉,李秀壮,何小凤.三种酚酸类化合物对莴苣幼苗的化感作用及机理初探[J].农药学学报,2016,18(3):317-322. doi: 10.16801/j.issn.1008-7303.2016.0043.CHEN E, ZHANG D H., WANG D D, JIN H, LI X Z, HE X F.Preliminary study on allelopathy and mechanism of three phenolic acids on lettuce seedlings[J]. Journal of Pesticides, 2016, 18 (3): 317-322.doi: 10.16801/j.issn.1008-7303.2016.0043.
[17] 谢越,俞浩,汪建飞,张祖亮,陈世勇,肖新.高效液相色谱法同时测定滁菊样品中的 9种酚酸[J].分析化学,2013,41(3):383-388. doi: 10.3724/SP.J.1096.2013.20820.XIE Y, YU H, WANG J F, ZHANG Z L, CHEN S Y, XIAO X.Simultaneous determination of nine phenolic acids in Chuju samples by high performance liquid chromatography[J]. Analytical Chemistry,2013, 41(3): 383-388. doi: 10.3724/SP.J.1096.2013.20820.
[18] 符建国.轮作与连作烟田根际土壤酸性有机组分的初步分离与鉴定[J].中国烟草科学,2011,32(6):67-71. doi: 10.3969/j.issn.1007-5119.2011.06.015.FU J G. Preliminary isolation and identification of acidic organic components in rhizosphere soil of rotation and continuous cropping tobacco fields[J]. Tobacco Science of China, 2011, 32(6): 67-71. doi:10.3969/j.issn.1007-5119.2011.06.015.
[19] 林开敏,叶发茂,林艳,李卿叁.酚类物质对土壤和植物的作用机制研究进展[J].中国生态农业学报,2010,18(5):1130-1137. doi:10.3724/SP.J.1011.2010.01130.LIN K M, YE H M, LIN Y, LI Q S. Progress in the mechanism of phenolic substances on soil and plants[J]. Chinese Journal of Eco-Agriculture,2010, 18(5): 1130-1137. doi: 10.3724/SP.J.1011.2010.01130.
[20] 万年鑫,袁继超,何卫,龙文靖,张琴,周少猛.马铃薯不同器官浸提液的自毒作用[J].浙江大学学报(农业与生命科学版),2016,42(4):411-418. doi:10.3785/j.issn.1008-9209.2015.09.231.WAN N X, YUAN J C, HE W, LONG W J, ZHANG Q, ZHOU S M.Autotoxicity of different organs of potato extracts[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2016 (4): 411-418.doi:10.3785/j.issn.1008-9209.2015.09.231.
[21] 张璐,杨瑞秀,王莹,姚远,延涵,高增贵. 甜瓜连作土壤中酚酸类物质测定及降解研究[J]. 北方园艺,2017(9):18-23. doi:10.11937/bfyy.201709004.ZHANG L, YANG R X, WANG Y, YAO Y,YAN H, GAO Z G.Determination and degradation of phenolic acids in continuous cropping soil of melon[J]. Northern Horticulture, 2017 (9): 18-23. doi:10.11937/bfyy.201709004.
[22] 张重义,尹文佳,李娟,林文雄,杨艳会,杜家方.地黄连作的生理生态特性[J].植物生态学报,2010,34(5):547-554. doi: 10.3773/j.issn.1005-264x.2010.05.008.ZHANG C Y, YIN W J, LI J, LIN W X,YANG Y H, DU J F.Physiological and ecological characteristics of Rehmannia glutinosa continuous cropping[J]. Journal of Plant Ecology, 2010, 34 (5): 547-554. doi: 10.3773/j.issn.1005-264x.2010.05.008.
[23] 刘飞,张民,诸葛玉平,李倩,刘东雪,王建.马铃薯玉米套作下控释肥对土壤养分垂直分布及养分利用率的影响[J].植物营养与肥料学报,2011,17(6):1351-1358. doi: 10.11674/zwyf.2011.1019.LIU F, ZHANG M, ZHUGE Y P, LI Q, LIU D X, WANG J. Effects of controlled-release fertilizer under potato-maize intercropping on soil nutrient vertical distribution and nutrient utilization[J]. Journal of Plant Nutrition and Fertilizer, 2011, 17(6): 1351-1358. doi: 10.11674/zwyf.2011.1019.
[24] 杨家学,高微微.酚酸类化感物质对两种西洋参病原真菌的作用[J].中国农学通报,2009,25(9):207-211.YANG J X, GAO W W. Effects of phenolic acid allelochemicals on two kinds of pathogenic fungi of Panax quinquefolium[J]. China Agricultural Bulletin, 2009, 25 (9): 207-211.