【研究意义】辣木(Moringa oleifera Lam.)属辣木科(Moringaceae) 辣木属(Moringa Adans.),是多年生常绿或落叶小乔木,具有速生、丰产、抗逆性强、营养成分丰富及药用价值高等特点,已成为工业、医药及动物饲料等领域重要的新型资源树种[1]。作为速生树种,辣木生长期需大量养分,生产上需进行多次施肥,但化肥的过量施入又常带来严重的环境污染问题[2-3]。【前人研究进展】近年来,前人通过筛选与鉴定出具有溶磷作用的微生物来制作高效溶磷菌菌肥,这已成为目前微生物学、农林学、土壤学领域的研究热点之一。研究表明,植物对土壤中的大部分无机磷和有机磷不能直接利用,植物吸收磷量与其产量和生物量存在显著的正相关性,而大部分磷肥都作为无效态在土壤中积累[4]。土壤中有效磷含量高低是制约树木生长的重要原因,土壤中含磷量虽高,但有效磷仅占土壤全磷含量的2%~3%,华南地区酸性土壤中严重缺磷,土壤中有效磷浓度远远低于10 mg/kg,已成为限制该地区经济林木生产力的主要因素[5-6]。溶磷菌通过分泌的磷酸酶和有机酸起溶磷作用从而促进植物对磷的吸收[7]。土壤中的溶磷微生物不仅是通过自身分泌产物促进植物生长,还有些溶磷微生物互相作用对其他病原菌产生拮抗作用,并且溶磷微生物菌剂和化学肥料结合施用还有助于提高微生物种群密度,改善土壤微生态环境[8]。施用溶磷菌可将难溶性磷转化为可溶性磷,进而促进植物的生长发育,提高化肥的利用效率[9]。因此,筛选和鉴定溶磷菌对未来使用绿色菌肥以提高植物生产力具有重大的意义。目前,国内外对溶磷菌的筛选和研究主要集中在农作物和蔬菜上,如油菜、辣椒、大葱、水稻和大豆等,辣木溶磷菌菌株资源非常缺乏[10-12]。【本研究切入点】以辣木根际土壤为研究对象,通过透明溶磷圈法筛选和钼锑抗比色法测定,并结合菌落形态特征及16S rDNA高通量测序鉴定优势溶磷菌。【拟解决的关键问题】从辣木根际土壤中分离、筛选和鉴定溶磷细菌,为开发和应用高效溶磷菌菌肥、改善辣木林地土壤微生态环境以提高辣木生产力,提供优质的菌株资源。
1 材料与方法
1.1 试验材料
2017年4月,在华南农业大学辣木基地采集4年生健康辣木植株根际土壤。辣木分别引种自尼日尼亚(NY)、越南(YN)、印度(PM)、老挝(GY)、中国云南(M)5个地区。每个种源随机选取8株辣木植株,样品采集时先去除表层土,小心挖取0~20 cm土层的植株根系,离根表1 cm内的土为根际土壤,五点法随机采集辣木的根际土。新鲜土壤样品过孔径0.100 mm筛后放置于4 ℃冰箱保存备用。
分离培养基:固体培养基为蒙金娜无机磷固体培养基、蒙金娜有机磷固体培养基、牛肉膏蛋白胨培养基和 LB 培养基,液体培养基为蒙金娜无机磷培养基和蒙金娜有机磷培养基。
1.2 试验方法
1.2.1 溶磷菌的分离 称取新鲜土壤样品10 g,放入装有90 mL无菌水和含有小玻璃珠的250 mL三角瓶中,置于170 r/min摇床上振荡30 min,静置 20~30 s后,以上清液分别稀释成10-1、10-2、10-3、10-4、10-5、10-6菌液。采用稀释平板涂抹法分离溶磷菌,倒置于28 ℃恒温培养箱中培养3~7 d,观察菌落生长情况,每个样品3个重复。
1.2.2 溶磷菌的筛选 对分离的溶磷菌进行平板初筛,挑取培养基上出现明显溶磷圈或透明圈的菌落,接种在对应的蒙金娜有机和无机固体培养基上,于28 ℃恒温培养3~12 d,得到单株具解磷能力的菌株。用十字交叉法测量溶磷圈直径(D)和菌落直径(d),重复3次,计算透明圈与菌落直径比。观察记录菌落的形状、大小、边缘结构、光泽、透明度、颜色等形态学指标。
1.2.3 溶磷能力测定 通过形态特征观察及溶磷圈的比较,初步判断各菌株的溶磷能力,进一步用钼锑抗比色法测定其磷含量[13],并用酸度计(上海三信仪器表厂,PHB-3型笔式pH计)测定其pH值。
1.2.4 分子生物学鉴定 用牛肉膏蛋白胨液体培养基活化初筛的溶磷菌菌株,采用细菌基因组DNA提取试剂盒(天根)提取 总DNA。 以16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′, 1541R:5′-AAGGAGGTGATCCAGCCGCA-3′) 对 优 势 菌株进行PCR扩增,0.8%琼脂糖凝胶电泳检测后,按PCR产物纯化试剂盒(天根)的操作对PCR产物进行纯化,并送至上海生工生物工程公司进行双向测序。分析测序峰图,对获得的有效序列进行拼接,得到对应菌株的序列。同时,提取所有分离到的溶磷菌株DNA,等量混合后用引物Nobar_341F(5′-CCTACGGGNGGCWGCAG-3′)和 Nobar_805R(5′-GACTACHVGGGTATCTAATCC-3′)扩增 16S rDNA V3-V4区,并送至上海生工生物工程公司利用Illumina公司Miseq 2×250 bp平台进行高通量测序,鉴定辣木根际土壤溶磷菌的种类和丰度。对高通量测序数据进行质检、比对和拼接。在NCBI网站上用Blast工具对所得序列与GenBank等数据库中的序列进行同源性比对分析,并用MEGA 5.0软件包构建系统发育树,鉴定溶磷菌菌株,并参考《伯杰细菌鉴定手册》对其进行描述。
试验数据采用Excel和SPSS 22.0软件进行统计分析。
2 结果与分析
2.1 溶磷菌平板初筛结果
辣木根际土壤中分别获得19株解有机磷菌株和10株解无机磷菌株,透明圈与菌落直径之比分别为1.2~2.5、1.3~1.9(图1)。其中,有机菌株GY5的透明圈最大,与菌落直径之比达到2.5,且溶磷圈随着培养时间的延长而逐步增大。无机菌株PM5和GY7的透明圈最大,与菌落直径之比达到1.9。从整体的情况来看,不同种源辣木土壤样本筛选的溶磷菌数量和解磷能力各不相同,其中种源地为中国云南的辣木根际土壤分离出来的有机溶磷菌株最多且溶磷能力普遍较强,这可能是该品种引种驯化时间较长,其根际土壤溶磷细菌溶磷能力增加,以适应华南地区普遍缺磷的立地条件。尼日尼亚种源地中分离出来的无机溶磷菌株最多,但无机培养基中分离到的溶磷菌不同种源间无显著差异。
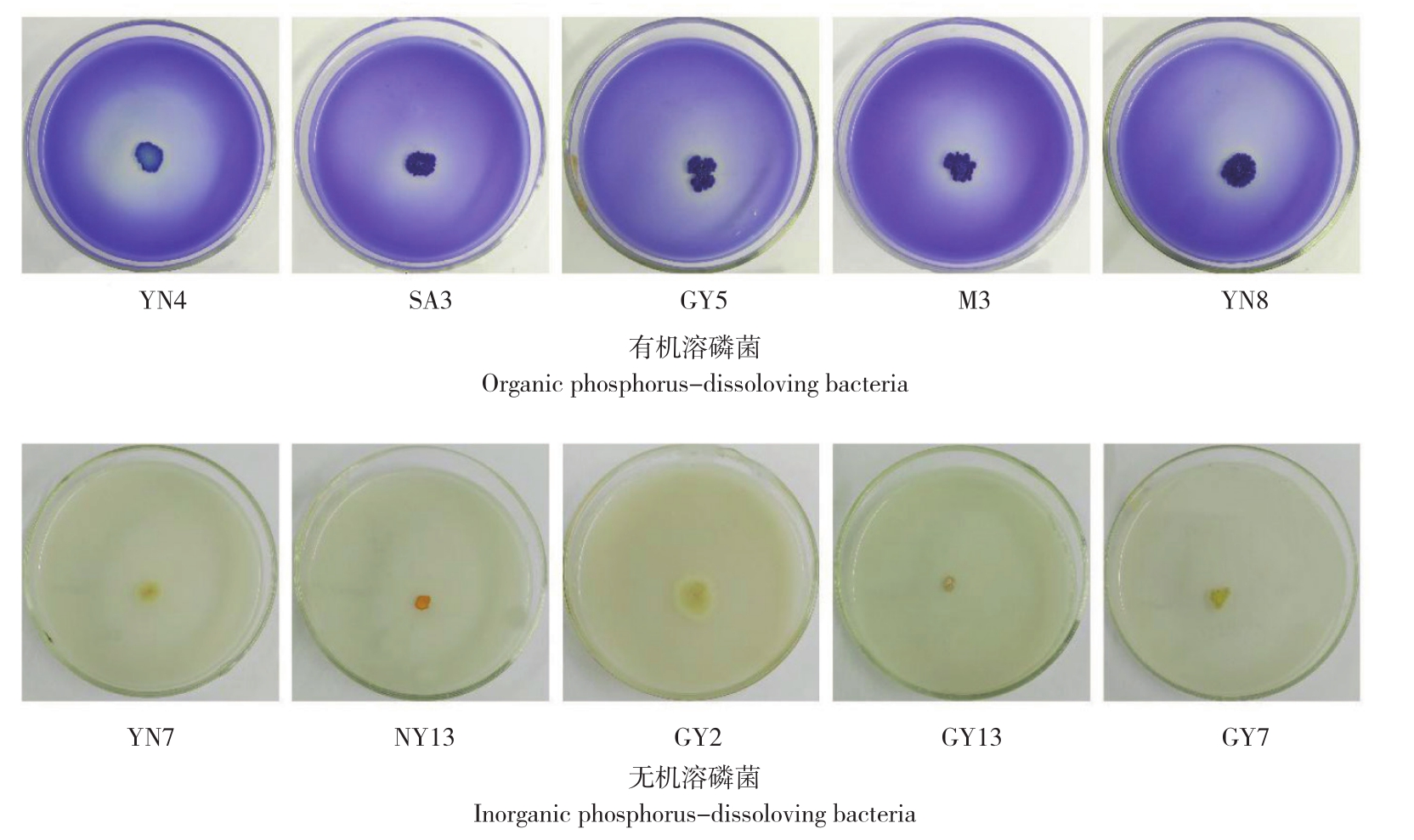
图1 辣木根际土壤部分有机、无机溶磷菌培育12 d的形态特征
Fig. 1 Morphological characteristics of partial organic and inorganic phosphorus-dissolving bacteria from rhizosphere soil of Moringa oleifera Lam. cultured for 12 days on Monkina medium
2.2 溶磷菌的菌落特征
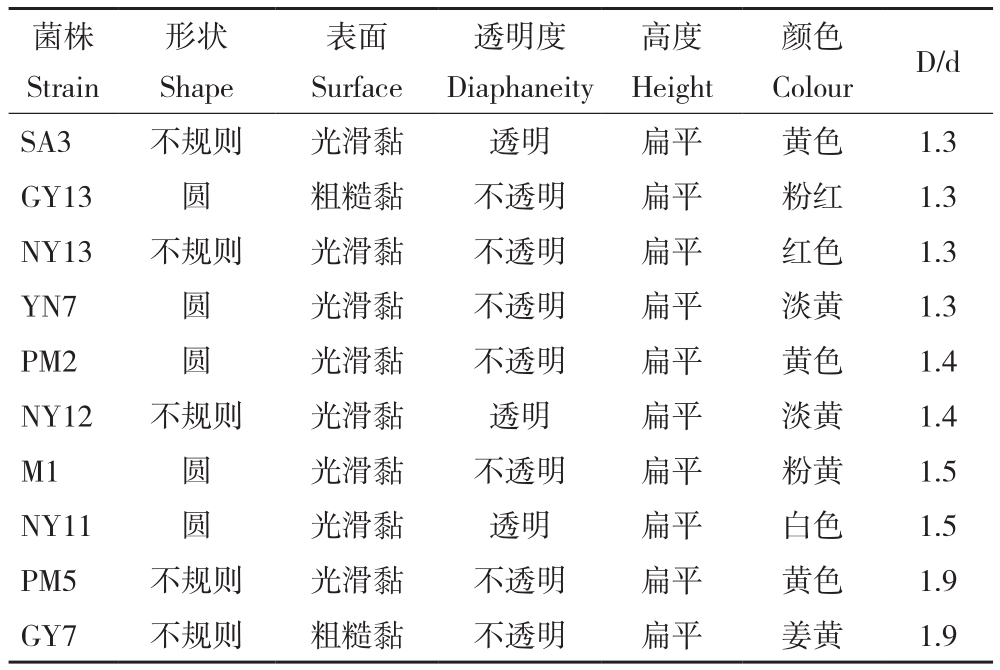
对辣木根际土壤中所分离纯化的29株溶磷菌菌落形态进行观察,结果(表1、表2)显示,溶磷能力较强的19株有机磷细菌中,大部分细菌菌落呈蓝色、形状不规则、光滑粘稠、不透明、扁平;溶磷能力较强的10株无机磷细菌中,大部分细菌菌落呈黄色、形状不规则、光滑粘稠、不透明、扁平。
表1 有机溶磷菌培养12 d的菌落特征
Table 1 Colony characteristics of organic phosphorusdissolving bacteria cultured for 12 days

注:D为透明圈直径;d为菌落直径。
Note: D represents the diameter of the transparent circle; d represents the diameter of the colony.
菌株Strain形状Shape表面Surface透明度Diaphaneity高度Height颜色Colour D/d GY7 不规则 光滑黏 不透明 扁平 深蓝 1.2 YN4 圆 光滑黏 半透明 扁平 蓝色 1.2 GY6 不规则 粗糙黏 不透明 扁平 深蓝 1.2 NY6 圆 冻状黏 不透明 凸起 淡蓝 1.3 PM1 不规则 光滑黏 不透明 扁平 蓝色 1.3 M4 圆 光滑黏 不透明 扁平 蓝黑色 1.4 NY4 不规则 粗糙黏 不透明 扁平 淡蓝 1.5 SA1 不规则 光滑黏 透明 扁平 淡蓝 1.5 GY10 圆 光滑黏 不透明 扁平 红色 1.5 M6 圆 粗糙黏 不透明 扁平 深蓝 1.6 M3 不规则 光滑黏 不透明 扁平 深蓝 1.7 M8 圆 光滑黏 透明 扁平 蓝色 1.7 SA3 不规则 光滑黏 不透明 扁平 深蓝 1.9 M2 不规则 光滑黏 不透明 扁平 深蓝 1.9 GY11 不规则 光滑黏 半透明 扁平 蓝色 1.9 M5 不规则 光滑黏 不透明 扁平 深蓝 2.0 SA2 不规则 光滑黏 不透明 扁平 深蓝 2.1 GY5 不规则 光滑黏 不透明 扁平 深蓝 2.5 YN8 不规则 光滑黏 不透明 扁平 深蓝 2.5
表2 无机溶磷菌培养12 d的菌落特征
Table 2 Colony characteristics of inorganic phosphorusdissolving bacteria cultured for 12 days
注:D为透明圈直径;d为菌落直径。
Note: D represents the diameter of the transparent circle; d represents the diameter of the colony.
菌株Strain形状Shape表面Surface透明度Diaphaneity高度Height颜色Colour D/d SA3 不规则 光滑黏 透明 扁平 黄色 1.3 GY13 圆 粗糙黏 不透明 扁平 粉红 1.3 NY13 不规则 光滑黏 不透明 扁平 红色 1.3 YN7 圆 光滑黏 不透明 扁平 淡黄 1.3 PM2 圆 光滑黏 不透明 扁平 黄色 1.4 NY12 不规则 光滑黏 透明 扁平 淡黄 1.4 M1 圆 光滑黏 不透明 扁平 粉黄 1.5 NY11 圆 光滑黏 透明 扁平 白色 1.5 PM5 不规则 光滑黏 不透明 扁平 黄色 1.9 GY7 不规则 粗糙黏 不透明 扁平 姜黄 1.9
2.3 溶磷菌的溶磷能力
2.3.1 溶解有机磷的能力 利用钼锑抗比色法对初筛溶磷菌株的溶磷能力进行测定,结果(图2A)显示,19个有机磷菌株都具有分解有机磷的能力,不同菌株间溶磷量差异较大,溶磷量为6.99~26.95 mg/L,M8菌株溶磷量最高,其溶磷量是溶磷能力最低菌株NY4的3.9倍。此外,各溶磷菌偏酸性,pH值为4.00~5. 83。
2.3.2 溶解无机磷的能力 试验结果(图2B)表明,10株无机溶磷菌均具有一定分解无机磷的能力, pH值为4.07~5.23,溶磷量为3.47~13.48 mg/L。与对照相比,接种溶磷菌后,各菌株培养液的pH均有不同程度的下降。此外,有机、无机溶磷菌培养液的溶磷量与pH之间基本表现为负相关关系,但相关性不显著。
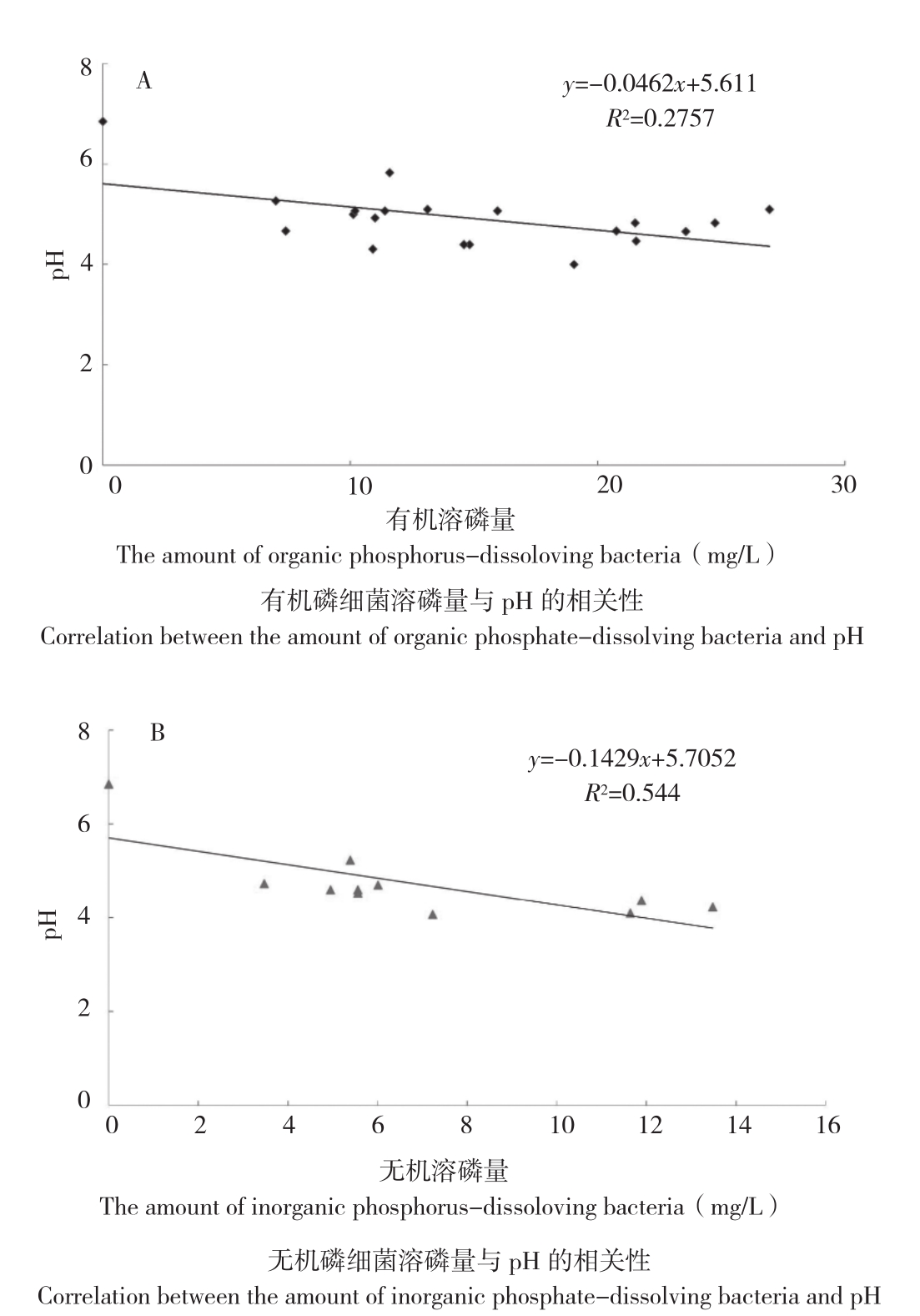
图2 有机(A)、无机溶磷菌溶磷量(B)与 pH的相关性
Fig. 2 Correlation between the amount of organic(A) and inorganic phosphorus-dissolving bacteria(B) and pH
2.4 16S rDNA高通量测序鉴定溶磷菌
利用高通量16S rDNA高通量测序鉴定所分离到的辣木根际土壤溶磷菌,分离到的溶磷菌有类芽孢杆菌属(Paenibacillus)、贪铜菌属(Cupriavidus)、杆菌属(Bacillus)、细杆菌属(Microbacterium)、根瘤菌属 (Mesorhizobium)、根瘤菌(Bradurhizobium)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和硝化杆菌属(Bosea)等,其中类芽孢杆菌属丰度最高、占50.51%,其次为贪铜菌属和杆菌属,分别占25.72%和18.19%。
结合形态学和分子生物学方法对溶磷能力较强的4株优势菌株进行鉴定,结果(图3)表明,有机磷菌株NY6、SA2分别为蜡样芽孢杆菌和枯草芽孢杆菌,无机磷菌株YN7、M1分别为为巨大芽孢杆菌和假单胞菌,同源性均达到100%。

图3 辣木根际土壤4株优势溶磷菌菌株序列鉴定
Fig. 3 Identification of four dominant strains of phosphorus-solubilizing bacteria in rhizosphere soil of Moringa oleifera Lam. through sequencing
3 讨论
不同植物根际土壤分离到的溶磷菌种类及溶磷能力均有差异[14]。本研究从辣木根际土壤中分离到的代表性无机磷溶磷细菌NY13和SA3的溶磷量分别为13.48、11.64 mg/L,低于杉木和玉米根际土壤中分离出溶磷菌的溶磷量,有机磷菌株M8的溶磷量为26.95 mg/L,高于玉米根际土壤中分离的代表性有机磷溶磷菌RYJ1-6菌株的溶磷量[15-16]。总体来看,从辣木根际分离得到无机溶磷细菌的溶磷能力普遍低于玉米等其他植物,而根际有机溶磷细菌的溶磷能力高于玉米等植物,这可能与辣木的根系特性相关。
pH会影响溶磷菌的溶磷量,这可能与不同菌株的溶磷机制相关。溶磷菌的溶磷机理比较复杂,有的溶磷菌是通过释放质子,降低土壤pH来起作用,有的是通过分泌有机酸起作用,有的则是通过分泌磷酸酶来溶磷,还有些溶磷菌是多种机制并存综合作用[17-18]。Illmer等[19]研究表明培养基的pH与溶磷量并没有相关性,这种差异可能与溶磷菌本身的特性有关。本研究中辣木根际土壤无机溶磷菌的溶磷量与其培养基pH之间呈一定的负相关,但相关性不显著,而有机溶磷菌的溶磷量与其培养基pH之间无相关性。
辣木根际土壤筛选鉴定的优势无机溶磷菌巨大芽孢杆菌和假单胞菌目前在植物上应用比较广泛。其中巨大芽孢杆菌YN7菌株和蜡样芽孢杆菌NY6菌株的pH值分别为4.07和4.83,这与这两类菌能产生有机酸的结果吻合,其溶磷机制可能是通过分泌有机酸和磷酸酶来溶磷,碱性磷酸酶是有机磷溶解的主要机制,而酸类物质促进了难溶性含磷物的溶解,是磷的主要溶解机制[20-21]。目前,优势溶磷菌枯草芽孢杆菌SA2菌株和假单胞菌M1菌株在食品及饲料方面研究众多,枯草芽孢杆菌易溶解磷矿粉,促进植物生长,而假单胞菌具有溶解磷酸三钙的能力,受氮源影响较大。目前,对类芽孢杆菌属的溶磷机理相关研究很少,但对其进行蛋白质组学研究时,发现其溶磷过程有磷酸基团进入菌体参与糖酵解、磷酸戊糖途径、三羧酸循环以及电子传递和氧化磷酸化等过程,具有一定借鉴作用[22]。在细菌拮抗与菌肥应用试验中,枯草芽孢杆菌、巨大芽孢杆菌、胶质芽孢杆菌相互间不存在拮抗现象,这几种菌均有相对较显著的解磷作用,较适合应用于菌肥生产[23]。
4 结论
本研究共分离到辣木根际土壤溶磷菌29株菌株,主要为类芽孢杆菌属、贪铜菌属、杆菌属、细杆菌属、根瘤菌属和根瘤菌等,各菌株溶磷能力与其培养基pH之间有一定相关性,但相关性不显著。优势磷菌株NY6、SA2、YN7、M1分别为巨大芽孢杆菌、蜡样芽孢杆菌,枯草芽孢杆菌及假单胞菌,可作为栽培辣木溶磷菌肥的候选菌株资源。
[1] LEONE A, SPADA A, BATTEZZATI A, SCHIRALDI A, ARISTIL J,BERTOLI S . cultivation, genetic, ethnopharmacology, phytochemistry and pharmacology of Moringa oleifera Leaves: An Overview[J].International Journal of Molecular Sciences, 2015, 16(6):12791-12835.
[2] FAGBENRO J A, OSHUNSANYA S O, OYELEYE B A. Effects of gliricidia biochar and inorganic fertilizer on Moringa plant grown in an oxisol[J].Communications in Soil Science and Plant Analysis, 2015,46(5):619-626.
[3] 刘华. 过量施用化肥对环境的污染及其防治措施探讨[J]. 甘肃农业,2005(11):35-35.doi: 10.3969/j.issn.LIU H. Discussion on environmental pollution caused by excessive application of chemical fertilizer and its control measures[J]. Gansu Agriculture, 2005(11):35-35. doi: 10.3969/j.issn.
[4] 张淑云.土壤解磷微生物研究进展[J]. 内蒙古林业科技,2015,41(1):39-41. doi: 10.3969/j.issn.1007-7731.2009.09.029.ZHANG S Y. Research progress of phosphate solubilizing microbes in soil[J].Journal of Inner Mongolia Forestry Science and Technology,2015, 41(1):39-41. doi: 10.3969/j.issn.1007-7731.2009.09.029.
[5] 吴鹏飞,张冬明,郝丽虹,漆智平. 解磷微生物研究现状及展望[J]. 中国农业科技导报,2008,10(3):40-46.doi: 10.3969/j.issn.1008-0864.2008.03.007.WU P F, ZHANG D M, HAO L H, QI Z P. Status quo and prospects of phosphate-soluble microorganisms[J]. Journal of Agricultural Science and Technology, 2008, 10(3):40-46. doi: 10.3969/j.issn.1008-0864.2008.03.007.
[6] AI P,SUN S,ZHAO J,FAN X,XIN W,GUO Q,YU L,SHEN Q,WU P,MILLER A,XU G. Two rice phosphate transporters, OsPht1;2 and OsPht1;6, have different functions and kinetic properties in uptake and translocation[J]. The Plant Journal, 2008, 57(5):798-809.
[7] 管国强,李倩,季蓉蓉,陈菊,钱静亚,黄达明. 1株溶磷细菌 P0417的溶磷机制[J]. 江苏农业科学,2015,43(10):432-435. doi:10.15889/j.issn.1002-1302.2015.10.134.GUAN G Q, LI Q, JI R R, CHEN J, QIAN J Y, HUANG D M.Phosphorus solubilization mechanism of a phosphorus soluble bacteria P0417[J]. Journal of Agricultural Science and Technology, 2015,43(10):432-435. doi: 10.15889/j.issn.1002-1302.2015.10.134.
[8] 孙合美,王春红,卢冬雪,刘晶晶,岳胜天. 土壤溶磷微生物及其对植物促生作用研究进展[J]. 河南农业科学,2016,45(5).doi:10.15933/j.cnki.1004-3268.2016.05.001.SUN H M, WANG C H, LU D X, LIU J J, YUE S T. Research progress of phosphorus dissolving microorganisms and their promotion effect on plant growth[J]. Journal of Henan Agricultural Sciences, 2016, 45(5).doi: 10.15933/j.cnki.1004-3268.2016.05.001.
[9] Alori E T, Glick B R, Babalola O O. Microbial phosphorus solubilization and its potential for use in sustainable agriculture[J]. Frontiers in Microbiology, 2017, 8:971-985.
[10] 李海云,孔维宝,达文燕,牛世全. 土壤溶磷微生物研究进展[J].生物学通报,2013,48(7):1-5.doi: 10.3969/j.issn.0006-3193.2013.07.001.LI H Y, KONG W B, DA W Y, NIU S Q. Research progress on soil phosphorus-dissolving microorganisms[J]. Bulletin of Biology, 2013,48(7):1-5. doi: 10.3969/j.issn.0006-3193.2013.07.001.
[11] 刘泽平,王志刚,徐伟慧,陈文晶,吕智航,王春龙,史一然. 水稻根际促生菌的筛选鉴定及促生能力分析[J]. 农业资源与环境学报,2017,35(2):119-125.doi: 10.13254/j.jare.2017.0251.LIU Z P, WANG Z G, XU W H, CHEN W J, LV Z H, WANG C L, SHI Y R. Screen, identification and analysis on the growth-promoting ability for the rice growth-promoting rhizobacteria[J]. Journal of Agricultural Resources and Environment, 2017, 35(2):119-125. doi:10.13254/j.jare.2017.0251.
[12] 武志海,刘晶晶,付丽,卢冬雪,岳胜天,杨美英. 溶磷菌对大豆根际土壤酶活性及微生物群落的影响[J].中国农业大学学报,2017,22(11):58-67. doi: 10.11841/j.issn.1007-4333.2017.11.06.WU Z H, LIU J J, FU L, LU D X, YUE S T, YANG M Y. Effects of phosphate-solubilizing bacteria on the soil enzyme activities and microecology of soybean rhizosphere[J]. Journal of China Agricultural University, 2017,22(11):58-67. doi: 10.11841/j.issn.1007-4333.2017.11.06.
[13 赵小蓉,林启美,李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志,2003,23(3):5-7.doi: 10.3969/j.issn.1005-7021.2003.03.002.ZHAO X R, LIN Q M, LI B G. Relationship between microbial dissolved phosphate rock powder capacity and pH and secretion of organic acids[J]. Journal of Microbiology, 2003, 23(3):5-7. doi: 10.3969/j.issn.1005-7021.2003.03.002.
[14] KOBUS J. The distribution of microorganisms mobilizing phosphorus in different soils[J]. Acta Microbiologica Polonica, 1962, 11:255-267.
[15] 白文娟,胡蓉蓉,章家恩, 冯丽芳,徐华勤. 玉米根际溶磷细菌的分离、筛选及溶磷能力研究[J]. 华南农业大学学报,2013,34(2):167-176.doi: 10.7671/j.issn.1001-411X.2013.02.009.BAI W J, HU R R, ZHANG J E, FENG L F, XU H Q. A study on the isoation , screening and phosphate solubilizing capacity of phosphate solubilizing bacteria in the rhizosphere of corn[J]. Journal of South China Agricultural University, 2013, 34(2):167-176. doi: 10.7671/j.issn.1001-411X.2013.02.009.
[16] 李蓉,周德明,吴毅,周国英,黄鹏飞,邓小军. 杉木根际溶磷菌筛选及其部分特性的初步研究[J]. 中南林业科技大学学报,2012,32(4):95-99.doi: 10.3969/j.issn.1673-923X.2012.04.020.LI R, ZHOU D M, WU Y, ZHOU G Y, HUANG P F, DENG X J.Selection and characteristics of phosphate-solubilizing bacteria in rhizosphere of Cunninghaimia lanceolate[J]. Journal of Central South University of Forestry & Technology, 2012, 32(4):95-99. doi: 10.3969/j.issn.1673-923X.2012.04.020.
[17] 吴海燕,金荣德,范作伟,胡会军,孙甜田,赵兰坡. 解磷巨大芽孢杆菌(Bacillus megaterium)的溶磷机理探讨[J]. 吉林农业大学学报,2014(2):171-175.doi: 10.13327/j.jjlau.2014.1713.WU H Y, JIN R D, FAN Z W, HU H J, SUN T T, ZHAO L P. Mechanism of solubilizing phosphate by Bacillus megaterium[J]. Journal of Jilin Agricultural University, 2014(2):171-175. doi: 10.13327/j.jjlau.2014.1713.
[18] 詹杨,韩旭,萧龙珍,崔俊涛,王呈玉. 溶磷放线菌研究进展[J]. 广州化工,2016,44(08):8-9.doi: 10.3969/j.issn.1001-9677.2016.08.003.ZHAN Y, HAN X, XIAO L Z, CUI J T, WANG C Y. Research progress on phosphate-solubilizing actinomycetes [J].Guangzhou Chemical Industry, 2016,44(08):8-9. doi: 10.3969/j.issn.1001-9677.2016.08.003.
[19] Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J]. Soil Biology&Biochemistry, 1992, 24(4):389-395. doi: 10.1016/0038-0717(92)90199-8.
[20] 卫星,徐鲁荣,张丹,支月娥,周培. 一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J]. 环境科学学报,2015,35(7):2052-2058.doi:10.13671/j.hjkxxb.2014.0976.WEI X, XU LR, ZHANG D, ZHI Y E, ZHOU P. Phosphate solubilizing characteristics of a nitrate-tolerating bacterium, Bacillus megaterium[J]. Acta Scientiae Circumstantiae, 2015, 35(7):2052-2058. doi:10.13671/j.hjkxxb.2014.0976.
[21] 刘诚,张钲,佘梦林,唐梦君,倪红. 多功能菌株假单胞菌的溶磷和解磷效果及其应用[J]. 湖北大学学报(自然科学版),2018,40(05):457-461.doi: 10:3969/j.issn.1000-2375.2018.05.004.LIU C, ZHANG Z, SHE M L, TANG M J, NI H. Multifunctional pseudomonas with degrading organophosphorusand phosphatesolubilizing and its application[J]. Journal of Hubei University(Natural Science), 2018,40(05):457-461. doi: 10:3969/j.issn.1000-2375.2018.05.004.
[22] 常文智. 胶质类芽孢杆菌溶磷分子机理探索及其对土壤生态效应的影响[D].泰安:山东农业大学,2013:54-75.doi: 10.7666/d.Y2303668.CHANG W Z, Exploration of molecular mechanism of phosphatesolubilizing on paenibacillus mucilaginosus and its effects on soil ecological effect[D].Taian Shandong Agricultural University, 2013:54-75. doi: 10.7666/d.Y2303668.
[23] 宋凤鸣,刘建华,史正军,江亚雄,叶宇轩,许建新. 解磷解钾根际促生菌的分离鉴定和筛选应用[J]. 广东农业科学,2017,44(3):94-100.doi: 10.16768/j.issn.1004-874X.2017.03.014.SONG F M, LIU J H, SHI Z J, JIANG Y X, YE Y X, XU J X.Identification and screening of plant growth-promoting rhizobacteria(PGPR)with ability of phosphate-solubilizing or potassiumsolubilizing[J]. Guangdong Agricultural Sciences, 2017, 44(3):94-100. doi: 10.16768/j.issn.1004-874X.2017.03.014.