甘蔗属C4作物,是1年生宿根热带和亚热带草本植物。目前巴西是全球甘蔗种植面积最大的国家,其次是印度,中国居第3位。中国甘蔗种植区主要分布在广西、云南、广东、海南等省(自治区)。广西由于其地理优势和适宜的气候条件已成为我国主要的蔗糖原材料生产基地,甘蔗种植面积和蔗糖产量居全国首位[1]。
甘蔗黑穗病(Sugarcane smut)是一种世界重要的甘蔗病害。该病害的发生与危害,给甘蔗产业造成了严重经济损失。甘蔗黑穗病最明显特征是病蔗梢头具一条向下内卷的黑色鞭状物。黑穗鞭中央是由寄主组织构成的心柱,外围包着一层厚垣孢子。染病蔗种萌芽早,茎细小,叶细长、淡绿,分蘖增多,分蘖后长出黑穗鞭[2]。黑穗鞭散落的冬孢子在甘蔗芽、甘蔗宿根和土壤中越冬,成为次年发病的初次侵染源。宿根蔗比新植蔗发病重[3]。该病于1877年在南非纳塔尔首次被发现[4],1940年以前仅限于东半球甘蔗产区发生危害,后来该病害蔓延至西半球蔗区[3]。我国则在1932年报道广州发生甘蔗黑穗病,随后广西、云南、福建、台湾等地相继报道该病害的发生[3,5]。曾经一度认为澳大利亚是唯一免受甘蔗黑穗病侵扰的国家,但1998年在澳大利亚的Ord River irrigation Area(ORIA)蔗区发生了甘蔗黑穗病,该病通过对感病的主栽品种N:Co310和Q117的侵染迅速在澳大利亚蔓延[6]。迄今,甘蔗黑穗病已成为甘蔗生产上一种普遍发生的甘蔗病害。本文综述了甘蔗黑穗病病原、遗传多样性、病原菌致病机理和病害防治技术等方面的研究进展,为今后甘蔗黑穗病的深入研究和防治提供参考。
1 甘蔗黑穗病病原和生物学特性
1.1 甘蔗黑穗病病原
甘蔗黑穗病病原为Sporisorium scitamineum(原学名为Ustilago. scitaminea)[2],属担子菌亚门两型真菌,具有其他黑粉菌相似的生活史,即冬孢子萌发产生单倍体孢子,单倍体通过芽殖繁殖,菌落呈酵母状,孢子成雪茄状,不具致病性;不同遗传交配型的单倍体细胞通过有性配合形成双核菌丝体,菌丝在培养基上不能进一步扩展,侵染寄主植物,在寄主体内形成冬孢子完成其生活史[7]。
1.2 病原生物学特性
该菌冬孢子萌发的温度范围为15~40℃,菌丝生长适温15~35℃,冬孢子萌发和菌丝生长的最适温为25~30℃;冬孢子的致死温度为49~50℃,62 ℃可使其立即失活,而在冰上至少可以存活3 d;冬孢子在蔗芽、土壤、蔗叶和蔗根提取液中萌发的时间分别为3.5、6.1、4.0、4.5 h,其中蔗芽提取液最适合冬孢子萌发,培养6 h后20.16%的冬孢子萌发;可利用多种碳源和氮源,1.5%葡萄糖溶液和蔗糖溶液最适合冬孢子萌发;菌体可在PDA,V-8 juice agar,malt extract agar以及glucose peptone agar 培养基上生长较好[8-9]。Bhuiyan等[10]对甘蔗鞭黑粉菌生物学特性进行比较系统研究,认为冬孢子的菌龄、侵染环境、温湿度及时间等是影响孢子萌发和侵染的因素。一条黑穗鞭只有60%冬孢子能存活,而且靠近黑穗鞭基部的冬孢子仅30%能萌发;冬孢子接种在水琼脂培养基上分别置于20、23、25、30、36℃的温度培养下均可萌发,2 h开始萌发,7 h后萌发率达到最大。甘蔗种苗浸泡在31℃冬孢子悬浮液中10 min比浸泡在环境温度13℃条件下发病率高。
2 甘蔗鞭黑粉菌的生理小种和多样性分析
2.1 甘蔗鞭黑粉菌生理小种
甘蔗鞭黑粉菌生理小种是其致病力分化的结果,同时也是甘蔗抗黑穗病育种的前提和基础。据报道美国夏威夷存在A、B 2个生理小种,巴基斯坦存在5个生理小种,巴西至少有2个生理小种,而中国台湾存在3个生理小种[11-12]。甘蔗鞭黑粉菌生理小种的鉴定主要通过寄主鉴别法,不同的国家或地区所采用的鉴别寄主不同。中国大陆主要参照台湾的鉴别寄主体系,即NCo310(感小种1,抗小种2),F134 (感小种2,抗小种1),NCo376(免疫),F273 (高感)。20世纪90年代中期中国大陆地区利用该体系鉴别了2个生理小种,分别为小种1和小种2,优势生理小种为小种2[13-14]。沈万宽等[15]在分析甘蔗对黑穗病抗性中推测广东湛江蔗区可能存在第3个生理小种,且新小种可能为优势小种。刘睿等[16]对来自广西的甘蔗鞭黑粉菌菌株进行致病力分析,认为生理小种2 仍然是广西蔗区的优势小种,并发现了一些具有新致病力的菌株。
2.2 甘蔗鞭黑粉菌多样性
遗传多样性(Genetic diversity)狭义上指种内不同种群之间或是一个种群内不同个体间的遗传多态性程度。分子遗传标记技术已普遍应用于植物病原真菌遗传多样性的研究,甘蔗鞭黑粉菌的分子标记研究起步较晚,ITS、RAPD、AFLP、ISSR、SSR等分子标记先后用于甘蔗鞭黑粉菌的遗传多样性分析中。由于地域差异以及采取分析方法的不同,各地区的甘蔗鞭黑粉菌多样性存在不同程度的丰富度(表1)。
表1 甘蔗鞭黑粉菌多样性
Table 1 Genetic diversity of Sporiscrium scitamineum
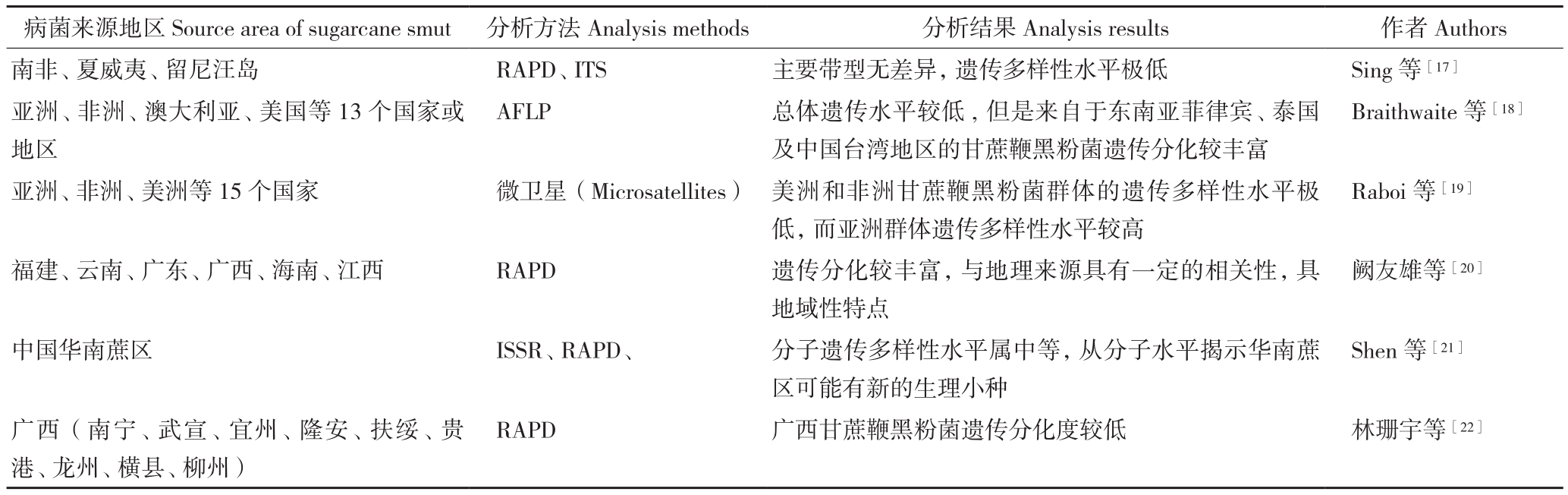
病菌来源地区 Source area of sugarcane smut 分析方法 Analysis methods 分析结果 Analysis results 作者Authors南非、夏威夷、留尼汪岛 RAPD、ITS 主要带型无差异,遗传多样性水平极低 Sing等[17]亚洲、非洲、澳大利亚、美国等13个国家或地区AFLP 总体遗传水平较低, 但是来自于东南亚菲律宾、泰国及中国台湾地区的甘蔗鞭黑粉菌遗传分化较丰富Braithwaite 等[18]亚洲、非洲、美洲等15个国家 微卫星(Microsatellites) 美洲和非洲甘蔗鞭黑粉菌群体的遗传多样性水平极低, 而亚洲群体遗传多样性水平较高福建、云南、广东、广西、海南、江西 RAPD 遗传分化较丰富,与地理来源具有一定的相关性,具地域性特点中国华南蔗区 ISSR、RAPD、 分子遗传多样性水平属中等,从分子水平揭示华南蔗区可能有新的生理小种Raboi等[19]阙友雄等[20]Shen 等[21]广西(南宁、武宣、宜州、隆安、扶绥、贵港、龙州、横县、柳州)RAPD 广西甘蔗鞭黑粉菌遗传分化度较低 林珊宇等[22]
3 甘蔗鞭黑粉菌致病机理
3.1 甘蔗鞭黑粉菌基因组和转录组分析
甘蔗鞭黑粉菌全基因组序列的测定使人们对甘蔗鞭黑粉菌有了新认识。基因组大小约19.8 Mb, 包含约6 636 个基因,平均每个基因长度为2.98 kb。192个基因跟致病性相关,其中31个在病菌各发育阶段均能表达,主要编码能量代谢和短链化合物氧化还原的酶类;68个属于分泌效应蛋白的候选基因;另有32个基因在病菌侵染寄主不同时期表达,可能跟诱导寄主产生防卫反应相关。同时作者还分析了MAT-1 的交配型基因 a locus 和 b locus,发现 b locus 与 U. hordei、U.maydis 和 S. reilianum 的基因结构和方向相同[23]。Taniguti 等[24]也获得类似结果。甘蔗鞭黑粉菌侵染早期和侵染后期(黑穗鞭的形成)两个时间点的转录组分析结果表明:13.5%基因的表达水平因侵染阶段的不同而存在差异,这些表达差异基因包含有细胞壁降解酶类、蛋白酶类、脂肪酶、几丁质修饰和木质素降解酶类、蔗糖转运酶和转录因子,作者认为甘蔗鞭黑粉菌在与寄主互作过程中可能会通过调控某些基因表达来逃避寄主产生的活性氧和有毒代谢物所形成的抗性[24]。
3.2 甘蔗鞭黑粉菌有性配合和致病机理
甘蔗鞭黑粉菌遗传转化体系的成功构建促进了甘蔗鞭黑粉菌分子生物学研究[25]。Yan等[26]分离和鉴定了该病菌两个不同性系交配型MAT-1和MAT-2菌株,通过绿色荧光蛋白和红色荧光蛋白分别标记MAT-1和MAT-2菌株,监视和跟踪其有性配合过程、冬孢子形成、冬孢子萌发及冬孢子萌发形成小孢子的减数分裂现象。另外通过同源克隆获得了甘蔗鞭黑粉菌MAT-1和MAT-2交配型b位点基因,并验证了b位点基因与有性配合和致病性相关。同时把病菌 b位点基因转入模式真菌U. maydis中,发现该基因能在U.maydis中起相似功能[2]。此外,还对b位点基因缺失突变体和野生型进行转录组分析,验证了淀粉/蔗糖代谢和Hog1 MAPK信号途径对有性配合的调控的关系[27]。Lu 等[28]用 a locus 的 Mfa2作为目标基因,利用CRISPR/Cas9技术对该基因进行了精准敲除和敲入,建立了该菌 CRISPR/Cas9基因编辑技术体系。最近,Deng等[29]证实MAP Kinase SsKpp2与甘蔗鞭黑粉菌的有性配合和菌丝形成相关。另外,Chang等[30]的研究揭示了cAMP/PKA 信号在甘蔗鞭黑粉菌中通过调高细胞内的ROS水平,促使“+”“-”两性单倍体细胞进行有性配合形成具有侵染力的菌丝体侵染寄主。
4 甘蔗抗病育种
4.1 常规抗病育种体系的建立
抗病育种是最有效的防治植物病害的措施。据报道在1974年之前,甘蔗的抗病育种主要是自然筛选,即在黑穗病发生严重的蔗区种植甘蔗品种或者品系,让其自然发病,经多次抗性鉴定,淘汰感病品种和品系最终筛选抗病品种[31]。然而由于该抗病育种体系存在耗时长、筛选量少、试验地需求大、效率低等缺陷,因此有必要建立新的抗病育种体系以加快抗病育种进程[31]。
抗性鉴定及评价标准的建立是甘蔗抗病育种体系的关键。抗性鉴定分为自然接种和人工接种鉴定,关于甘蔗黑穗病人工接种方法有多种,如孢子液涂芽法[32-33]、针刺涂抹法[32-33]、孢子悬浮液浸泡法[32-33]、“+”“-”孢子混合注射法[34]等。试验证明针刺涂抹法可以对高感和高抗品种和品系进行快速鉴定,然而由于发病过于严重可能会忽略掉具有物理抗性的品种或品系,而孢子悬浮液浸泡法则认为更接近于甘蔗鞭黑粉菌自然侵染的状态[32],因此该方法被普遍采纳。
关于甘蔗抗黑穗病的抗性等级各国之间存在差异,各国根据当地的情况,确定甘蔗黑穗病的抗性筛选压力。如南非、印度、台湾等采用0~9级分类法, 菲律宾、澳大利亚、新西兰等采用1~9级分类法,而我国在“九五” 实施后统一采用1~9级分类法, 将其抗性等级大致分为HR (高抗)、R (抗 )、M(中抗 )、S (感 ) 和 HS (高感 ) 等 5 种类型[13]。通常将发病率在10%~12%以下划分为R(抗病)等级[32,35-36]。1974年之后各国相继建立比较规范的甘蔗常规育种体系[32,35-36]。
4.2 抗病机理及应用
抗性机理的研究可为甘蔗抗病育种提供科学依据,甘蔗的抗性可分为外部抗性和内部抗性两部分,Marques等[37]发现甘蔗的外部抗性与芽鳞紧、厚以及毛的浓厚等结构有关,抗病品种芽的毛较感病品种的浓和厚;抗病品种芽在受到甘蔗鞭黑粉菌的侵染时,与感病品种相比较,会分泌更多的苯丙烷、糖蛋白、酚类等化学物质抵抗病原菌的入侵,这样抗病品种在芽的外部形成第一层保护层。而当病原菌成功侵入寄主后,经过转录组和蛋白组分析,甘蔗鞭黑粉菌侵染寄主48 h后,寄主的反应最为活跃。与感病品种相比,抗病品种在侵染点附近产生过敏性坏死,分泌木质素(lignin)、糖蛋白(glycoprotein)、植保素(phytoalexins)和 多胺(polyamines)等化学物质以及诱导 R基因表达,形成第二层保护,以抵抗病菌的进一步侵染[37-38]。
根据抗性与病原菌在寄主中的定殖和生理生化有关,有研究者通过检测病菌侵入早期在寄主中的定殖情况以及寄主分泌的抗性物质进行甘蔗抗病品种鉴定,提高抗病育种效率。Su等[39]采用定量RT-PCR测试甘蔗鞭黑粉菌在寄主中的定殖,发现品种的抗性与病原菌在甘蔗中的定殖能力有一定的相关性。而通过检测寄主受甘蔗鞭黑粉菌胁迫时的生理生化反应,发现甘蔗品种的抗性与过氧化物酶(POD)、葡聚糖酶(b-1,3-glucanase)、抗坏血酸过氧化物酶(APX)等成正相关。Khan等[40]采用基于RAPD的 SCAR分子标记找到与黑穗病抗性相关的基因片段,并进行了验证。分子标记等技术应用于甘蔗的抗病育种,将会大大提高甘蔗的抗病育种效率,甘蔗抗病育种将会进入分子辅助育种的阶段。
5 甘蔗黑穗病防治措施
甘蔗黑穗病的防治遵守“预防为主,综合防治”的植保方针策略,而选育和种植抗病品种是最为经济有效的防控途径,此外,强化栽培管理、合理施肥和轮作也是综合防治的基础。
5.1 抗病品种的利用
目前国内外都在选育抗黑穗病品种,印度选育出F134、2000A241、NCo310、98A163、81A99、Co7805、93A165等 7个中抗品种[41]。我国主要的抗性品种有选三、闽70-611、云蔗71-388、云蔗81-173等[3],目前各地都在加大抗病育种力度,加强抗性材料筛选和抗病品种鉴定[36,42]。
5.2 农业综合防治
甘蔗生产中尽量选用无病蔗株留种,生产和种植无病蔗苗,及时清除田间的病残体和病宿根,以减少田间甘蔗鞭黑粉菌菌源。带病蔗种经52℃处理3~4 h或54℃处理2~4 h,对甘蔗黑穗病能起到一定的防治作用,结合杀菌剂使用,其效果更好[43]。加强栽培管理,合理施肥,有条件的可实行水旱轮作或者与水稻、玉米、甘薯、花生、黄豆、苜蓿等作物进行轮作以避免病菌长期侵染危害甘蔗[3]。
5.3 生物防治
使用化学农药防治甘蔗黑穗病的效果并不佳,且过度使用易造成农药残留和污染环境等问题,而生物防治具有无农残、环保、可持续性等优点,是很有前景的一种防治方法。Sinha等[44]在甘蔗黑穗病发病植株上找到一种串珠镰刀菌Fusarum. moniliforme [Gibberella fujikuroi],该菌株能分泌毒素抑制甘蔗鞭黑粉菌的冬孢子萌发。廖咏梅等[45]从甘蔗根际土壤及甘蔗不同组织内分离获得多个对甘蔗鞭黑粉菌有拮抗作用的细菌菌株,主要是荧光菌和非荧光菌中的白色菌群。Jayakumar等[46]从甘蔗节间、芽、根等组织分离筛选到对甘蔗鞭黑粉菌菌丝有抑制作用的内生细菌菌株,大田小区试验证实其中2个内生细菌菌株ESR 7和ESR 21防效最好,且可促进甘蔗生长。Liu等[47]从土壤中分离,获得一株能够阻断甘蔗鞭黑粉菌有性配合的细菌菌株ST4。测试分析表明,葡萄糖存在的情况下可促使菌株ST4产生拮抗化学物质,而蔗糖、麦芽糖和果糖等均不能支持菌株ST4分泌拮抗化学物质。温室试验与上述结果一致,温室试验表明细菌接种时添加2%葡萄糖后,菌株ST4的生防作用明显增强,防治效果比无糖接种的处理高77%。新近报道海洋微生物中如放线菌[48]、海黄瓜共附生细菌[49]、海绵共栖细菌[50]等对甘蔗鞭黑粉菌均有抑制作用。另外生物表面活性剂鼠李糖脂亦可抑制甘蔗鞭黑粉菌的冬孢子萌发、小孢子的生长[51];而霉酚酸(Mycophenolic Acid)除了可抑制冬孢子萌发及小孢子生长外,还可抑制甘蔗鞭黑粉菌的有性配合[52]。以上微生物或化学物质具有开发成为生物农药的潜力。
6 展望
因甘蔗黑穗病对我国乃至世界甘蔗产业的严重影响,国内外学者已在致病机理、抗病育种、病原-寄主互作机制研究和防控措施等方面投入了大量精力,取得一定的成果。作者认为应加强以下几个方面的研究:(1)我国在抗病育种方面还比较落后,需加强抗病育种材料(野生资源)的收集、抗性评价和利用工作。全面开展主栽品种以及杂交亲本材料的黑穗病抗性评价。此外,开展抗病连锁分子标记研究,将常规育种和生物技术育种相结合,缩短育种周期。(2)在甘蔗鞭黑粉菌致病机理方面的研究已经获得突破,如遗传转化体系的建立及致病基因的鉴定等;然而在致病机理方面的研究还处于起始阶段,对甘蔗鞭黑粉菌有性配合和致病机制的解析和致病基因的挖掘仍有很大空间。另外,在抗病机理方面也已开展了大量研究,也取得了一些成果,但研究的深度仍然不够。基于组学研究和功能分析,揭示病原-寄主互作机理,挖掘关键基因是一项重要工作。(3)虽然我国在甘蔗鞭黑粉菌遗传多样性方面进行了大量的研究工作,但在生理小种的类型和分布仍然不明确。因此,需加强甘蔗鞭黑粉菌生理小种的鉴别研究,明确其类型,为抗病育种提供科学依据。(4)开展生物防治研究,可针对甘蔗鞭黑粉菌生活史的3个靶向,即冬孢子萌发、单倍体孢子生长、“+”“-”孢子有性配合3个阶段进行生防菌的筛选,可开发出多个靶向、多类型的生物农药。
[1] 覃泽林,孔令孜,李小红,韦昌联. 广西蔗糖产业技术研究进展[J].广东农业科学,2014,41(12):195-199.doi:10.16768/j.issn.1004-874X.2014.12.017.QIN Z L , KONG L Z, LI X H,WEI C L. Research advances in technology of sugarcane industry in Guangxi[J]. Guangdong Agricultural Sciences, 2014, 41(12):195-199. doi: 10.16768/j.issn.1004-874X.2014.12.017.
[2] YAN M, ZHU G, LIN S, XIAN X, CHANG C, XI P, SHEN W, HUANG W, CAI E, JIANG Z, DENG Y, ZHANG L. The mating-type locus b of the sugarcane smut Sporisorium scitamineum is essential for mating,filamentous growth and pathogenicity[J]. Fungal Genetics & Biology,2015, 86: 1-8. doi: 10.1016/j.fgb.2015.11.005.
[3] 卢文洁,李文风,黄应昆. 甘蔗黑粉病发生及防治研究进展[J]. 中国糖料,2008(3):64-66.LU W J, LI W F, HUANG Y K. Research advances on sugar cane Smut disease occurrence and control[J]. Sugar Crops of China, 2008(3):64-66.
[4] MC MARTIN A. Sugarcane smut: reappearance in Natal[J]. South African Sugar Journal, 1945, 29: 55-57.
[5] 韦金菊,邓展云,黄诚华,黄伟华,颜梅新,刘海斌,唐红琴. 广西甘蔗主要真菌病害调查初报[J]. 南方农业学报,2012,43(9):1316-1319. doi: 10.3969/j:issn.2095-1191.2012.09.1316.WEI J J, DENG Z Y, HUANG C H, HUANG W H, YAN M X, LIU H B, TANG H Q. Preliminary report on investigating major sugarcane fungal diseases in Guangxi[J]. Journal of Southern Agriculture, 2012,43(9):1316-1319.. doi: 10.3969/j:issn.2095-1191.2012.09.1316.
[6] CROFT B J, MAGAREY R C, ALLSOPP P G, COX M C, WILLCOX T G, MILFORD B J, WALLIS E S. Sugarcane smut in Queensland: arrival and emergency response[J]. Australasian Plant Pathology, 2008, 37:26-34. doi: 10.1071/ap07083.
[7] ALBERT H H and SCHENCK S. PCR amplification from a homolog of the bE mating-type gene as a sensitive assay for the presence of U. scitaminea DNA[J]. Plant Disease, 1996, 80: 1189-1192. doi:10.1094/PD-80-1189.
[8] SINGH K , BUDHRAJA T R. Culture studies on U. scitaminea Syd[J]. Indian Jour Sugar Res & Dev, 1962, 7: 41-42.
[9] 吴伟怀,谢祖健,贺春萍,郑肖兰,李锐, 郑服丛. 甘蔗黑粉病菌冬孢子生物学特性及杀菌剂对其萌发的影响. 热带作物学报,2009,30(11):1674-1678. doi:10.3969/j.issn.1000-2561.2009.11.024.WU W H, XIE Z J, HE C P, ZHENG X L, LI R, ZHENG F C. Biological characteristics of teliospores of Ustilago scitaminea andvirulence of 2 fungicides against them Indoor[J]. Chinese Journal of Tropical Crops,2009, 30(11): 1674-1678.doi:10.3969/j.issn.1000-2561.2009.11.024.
[10] BHUIYAN S A, CROFT BARRY J. Some biological parameters of the sugarcane smut fungus, Ustilago scitaminea[J]. Sugar Cane International, 2010, 28 (1): 22-26,38.
[11] LEU L S,TENG W S. Culmicolous smut of sugarcane in Taiwan (V) two pathogenic strains U. scitaminea Sydow[J]. Plant Pathology, 1998,45: 275-279.
[12] GRISHAM M P, HOGARTH D M. An international project on genetic variability within sugarcane smut// International Society of Sugar Cane Technologists[C]. Proceedings of the XXIV Congress, Brisbane,Australia, 2001:1024-1027.doi:10.1016/j.domaniend.2009.05.004.
[13] 许莉萍,陈如凯.甘蔗黑穗病及其抗病育种的现状与展望[J].福建农业学报,2000,26(2):26-31. doi:10.3969/j.issn.1008-0384.2000.02.006.XU L P, CHEN R K. Current status and prospects of smut and smut resistance breeding in sugarcane[J]. Fujian J ournal of Agricultural Sciences, 2000, 26(2):26-31. doi:10.3969/j.issn.1008-0384.2000.02.006.
[14] 熊国如,赵更峰,伍苏然,沈林波,冯翠莲,王俊刚,蔡文伟,王文治,张树珍. 海南蔗区甘蔗黑穗病菌生理小种鉴定[J]. 热带作物学报,2013,34(7):1328-1334. doi:10.3969/j.issn.1000-2561.2013.07.024.XIONG G R, ZHAO G F, WU S R, SHEN L B, FENG C L, WANG J G, CAI W W, WANG W Z, ZHANG S Z. Identification of physiological races of Sporisorium scitaminea Syd. in Hainan province[J]. Chinese Journal of Tropical Crops, 2013, 34(7): 1328-1334. doi:10.3969/j.issn.1000-2561.2013.07.024.
[15] 沈万宽,邓海华.引进甘蔗品种黑穗病抗性鉴定及结果分析[J].中国农学通报,2011,27(19):234-238.SHEN W K, DENG H H. Analysis of results from smut resistant identification in sugarcane varieties introduced[J]. Chinese Agricultural Science Bulletin, 2011, 27(19): 234-238.
[16] 刘睿,杨湛端,沈万宽,樊丽娜, 吴嘉云, 李奇伟, 陈健文. 广西甘蔗黑穗病病菌致病力分析[J]. 中国植保导刊,2018, 38(11): 16-20.doi:CNKI:SUN:ZBJS.0.2018-11-004.LIU R, YANG Z D, SHEN W K, FAN L N, WU J Y, LI Q W, CHEN J W.Pathogenicity of Sporisorium scitamineum in Guangxi[J]. China Plant Protection, 2018, 38(11): 16-20. doi:CNKI:SUN:ZBJS.0.2018-11-004.
[17] SINGH N, SOMAI B M, PILLAY D, PILLAY D. Molecular profiling demonstrates limited diversity amongst geographically separate strains of U. scitaminea[J]. FEMS Microbiology Letters, 2005, 247: 7-15. doi:10.1016/j.femsle.2005.04.022.
[18] BRAITHWAITE K, BAKKEREN G, CROFT B, BRUMBLEY S M.Genetic variation in a worldwide collection of the sugarcane smut fungus Ustilago scitamineae[J].Proceedings Australian Society of Sugarcane Technologists, 2004, 26: 1-9.
[19] KALYNA BEZCHLIBNYKBUTLER M D W. Evidence for the dispersal of a unique lineage from Asia to America and Africa in the sugarcane fungal pathogen Ustilago scitaminea[J]. Fungal Genetics and Biology,2007, 44(1):64-76.doi:10.1016/j.fgb.2006.07.004.
[20] 阙友雄,许莉萍,邹添堂,陈如凯. 甘蔗黑粉病(U. scitaminea Syd.)分子多样性初步分析[J]. 农业生物技术学报,2004,12(6): 685-689. doi:10.3969/j.issn.1674-7968.2004.06.015.QUE Y X, XU L P, ZOU T T, CHEN R K. Primary analysis of molecular diversity in populations of the fungus Ustilago scitaminea Syd[J].Journal of Agricultural Biotechnology, 2004, 12(6): 685-689.doi:10.3969/j.issn.1674-7968.2004.06.015.
[21] SHEN W K, XI P G, LI M H, LIU R, SUN L, JIANG Z, ZHANG L. Genetic diversity of Ustilago scitaminea Syd. In Southern China revealed by combined ISSR and RAPD analysis[J]. African Journal of Biotechnology, 2012, 11(54): 11693-11703.
[22] 林珊宇,贤小勇,颜梅新,朱桂宁. 广西甘蔗鞭黑粉菌遗传多样性分析[J]. 南方农业学报,2016,47(9):1506-1511. doi:10.3969/jissn.2095-1191.2016.09.1506.LIN S Y, XIAN X Y, YAN M X, ZHU G N. Genetic diversity of Sporisorium scitamineum in Guangxi[J]. Journal of Southern Agriculture,2016, 47(9): 1506-1511. doi: 10.3969/jissn.2095-1191.2016.09.1506.
[23] QUE Y X, XU L P, WU Q B, LIU Y F, LING H, LIU Y H, ZHANG Y Y, GUO J L, SU Y C, CHEN J B, WANG S S, ZHANG C G. Genome sequencing of Sporisorium scitamineum provides insights into the pathogenic mechanisms of sugarcane smut[J]. BMC Genomics, 2014,15: 1184-1186. doi: 10.1186/s12864-015-1336-4.
[24] TANIGUTI L M, SCHAKER P D, BENEVENUTO J, PETERS L P,CARVALHO G, PALHARES A, QUECINE M C, NUNES F R, KMIT M C, WAI A, HAUSNER G, AITKEN K S, BERKMAN P J, FRASER J A, MOOLHUIJZEN P M, COUTINHO L L, CRESTE S, VIEERA M L, KITAJIMA J P, MONTEIRO-VITORELLO C B. Complete genome sequence of sporisorium scitamineum and biotrophic interaction transcriptome with sugarcane[J]. Plos One, 2015, 10(6):e0129318.doi: 10.1371/journal.pone.0129318. eCollection 2015.
[25] SUN L, YAN M, DING Z, LIU Y, DU M, XI P, LIAO J, JI L, JIANG Z. Improved dominant selection markers and co-culturing conditions for efficient Agrobacterium tumefaciens-mediated transformation of Ustilago scitaminea[J]. Biotechnology Letters, 2014, 36(6): 1309-1314. doi: 10.1007/s10529-014-1486-5.
[26] YAN M, CAI E, ZHOU J, CHANG C, XI P, SHEN W, LI L, JIANG Z, DENG Y, ZHANG L. A Dual-Color Imaging System for Sugarcane Smut Fungus Sporisorium scitamineum[J]. Plant Disease, 2016,100:2357-2362. doi: 10.1094/PDIS-02-16-0257-SR.
[27] YAN M, DAI W, CAI E, DENG Y, CHANG C, JIANG Z, ZHANG L.Transcriptome analysis of Sporisorium scitamineumreveals critical environmental signals for fungal sexual mating and filamentous growth[J]. BMC Genomics, 2016, 17(1): 1-11. doi:10.1186/s12864-016-2691-5.
[28] LU S, SHEN X, CHEN B. Development of an efficient vector system for gene knock-out and near in- cis gene complementation in the sugarcane smut fungus[J]. Scientific Reports, 2017, 7(1): 1-8. doi:10.1038/s41598-017-03233-7.
[29] DENG Y, ZHANG B, CHANG C, WANG Y, LU S, SUN S, ZHANG X,CHEN B, JIANG Z. The MAP Kinase SsKpp2 is required for mating/filamentation in Sporisorium scitamineum[J]. Front. Microbiol, 2018,9:2555. doi: 10.3389/fmicb.2018.02555.
[30] CHANG C, CAI E, DENG Y, MEI D, QIU S, CHEN B, ZHANG L,JIANG Z. cAMP/PKA signaling pathway regulates Redox homeostasis essential for Sporisorium scitamineum mating/filamentation and virulence[J]. Environmental Microbiology, 2018, https://doi.org/10.1111/1462-2920.14496.
[31] BAILEY R A, BECHET G R. Progress in screening for resistance to sugarcane disease in South Africa// Congress-south African Sugar Technologists Association[C]. 1982: 143-149.
[32] LADD S L, HEINZ D J, MEYER H K. Control of sugarcane (Saccharum sp.) smut disease (Ustilago scitaminea) through breeding and selection of resistant clones// Congress[C]. 1974: 36-45.
[33] CO O , NGUGI K , NZIOKI H , GITHIRI S. Evaluation of smut inoculation techniques in sugarcane seedlings[J]. Sugar Tech, 2008,10(4):341-345. doi: 10.1007/s12355-008-0060-7.
[34] 沈万宽,姜子德,杨湛端,刘睿,陈健文,邓海华. 甘蔗抗黑穗病的鉴定新方法及其品种抗性评价[J]. 华中农业大学学报,2014,33(2):51-56. doi:10.13300/j.cnki.hnlkxb.2014.02.005.SHEN W K, JIANG Z D, YANG Z D, LIU R, CHEN J W, DENG H H. New resistance identification method and resistance evaluation of sugarcane varieties to smut disease[J]. Journal of Huazhong Agricultural University, 2014, 33(2): 51-56.doi:10.13300/j.cnki.hnlkxb.2014.02.005.
[35] KHANDAGALE P P, KESKAR M M, GHODAKE S K. Screening sugarcane genotypes for resistance against smut and Yellow Leaf disease[J]. Contemporary Research in India, 2017, 7(4): 196-199.
[36] 陈双,曾泽鉴,沈万宽,徐刚红,吴夏明. 甘蔗亲本黑穗病抗性鉴定与评价[J]. 华北农学报,2016(31):438-443. doi: 10.7668 /hbnxb.2016.S1. 073.CHEN S, ZENG Z J, SHEN W K, XU G H, WU X M. Identification and evaluation on sugarcane parents against smut[J]. Acta Agriculturae Boreali-Sinica, 2016(31): 438-443.doi: 10.7668 /hbnxb.2016.S1. 073.
[37] MARQUES J P R, HOY J W, APPEZZATO-DA-GLORIA BEATRIZ,VIVEROS ANDRES F G, VIEIRA M L C, NIRANJANB. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum[J]. Frontiers in Plant Science, 2018, 9:698. doi: 10.3389/fpls.2018.00698.
[38] MCNEIL M D, BHUIYAN S A, BERKMAN P J, CROFT B J, AITKEN K S, VITALY, C. Analysis of the resistance mechanisms in sugarcane during Sporisorium scitamineum infection using RNA-seq and microscopy[J]. Plos One, 2018, 13(5) : e0197840. doi: 10.1371/journal.pone.0197840.
[39] SU Y, WANG Z, XU L, PENG Q, LIU F, LI Z, QUE Y. Early selection for smut resistance in sugarcane using pathogen proliferation and changes in physiological and biochemical indices[J]. Frontiers in Plant Science, 2016, 7: 1133. doi:10.3389/fpls.2016.01133.
[40] KHAN M , PAN Y B, IQBAL J. Development of an RAPD-based SCAR marker for smut disease resistance in commercial sugarcane cultivars of Pakistan[J]. Crop Protection, 2017, 94:166-172. doi: 10.1016/j.cropro.2016.12.024.
[41] RAO G V N, PATRO T S S K. Screening of sugarcane clones against smut, U. scitaminea[J]. Indian Journal of Plant Protection, 2006,34(1): 143-144.
[42] 杨荣仲,周会,谭芳,周忠凤,宋修鹏. 甘蔗家系抗病性评价分析[J]. 南方农业学报,2017,48(10):90-96. doi:10.3969/j.issn.2095-1191.2017.10.13.YANG R Z, ZHOU H, TAN F, ZHOU Z F, SONG X P. Evaluation on disease resistance of sugarcane family[J]. Journal of Southern Agriculture, 2017, 48(10): 90-96. doi: 10.3969/j.issn.2095-1191.2017.10.13.
[43] 沈万宽,姜子德,邓海华,刘睿. 甘蔗黑穗病及其病原菌研究进展[J]. 热带作物学报,2013,34(10):2063-2068. doi:10.3969/j.issn.1000-2561.2013.10.036.SHEN W K, JIANG Z D, DENG H H, LIU R. Research progress on sugarcane smut disease and Sporisorium scitaminea[J]. Chinese Journal of Tropical Crops, 2013, 34(10): 2063-2068.doi: 10.3969/j.issn.1000-2561.2013.10.036.
[44] SINHA O K, SINGH K. Antagonistic activity of Fusarium moniliforme var. subglutinans against sugarcane smut[J]. Indian Phytopathology,1983, 36(1): 92-94.
[45] 廖咏梅,张桂英,黄定安, 覃蔓萍, 姚普远. 甘蔗黑粉病菌拮抗细菌的筛选及鉴定[J]. 广西农业生物科学,2004,23(3):197-201.LIAO Y M, ZHANG G Y, HUANG D A, QIN M P, YAO P Y. Screening and identif ication of antagonistic bacteria of Ustilago scitaminea[J].Journal of Guangxi Agric. and Biol. Science, 2004, 23(3): 197-201.
[46] JAYAKUMAR V, SUNDAR A R, VISWANATHAN R. Biological suppression of sugarcane smut with endophytic bacteria[J]. Sugar Tech, 2018(3): 1-8. doi: 10.1007/s12355-018-0684-1.
[47] LIU S, LIN N, CHEN Y, LIANG Z, LIAO L, LV M, CHEN Y, TANG Y, HE F, CHEN S, ZHOU J, ZHANG L. Biocontrol of sugarcane smut disease by interference of fungal sexual mating and hyphal growth using a bacterial isolate[J]. Frontiers in Microbiology, 2017, 8: 778.doi: 10.3389/fmicb.2017.00778.
[48] 李小群,于清武,易湘茜,郝二伟,马亮,颜栋美,高程海. 广西北仑河口红树林底泥放线菌多样性及其抑制甘蔗鞭黑粉菌活性 分 析[J]. 南 方 农 业 学 报,2018, 9(4): 708-713. doi: 10.3969/j.issn.2095-1191.2018.04.14.LI X Q, YU Q W, YI X Q, HAO E W, MA L, YAN D M, GAO C H.Diversity of actinomycetes isolated from bottom mud of mangrove forest in Beilun Estuary of Guangxi and its antibacterial activity against Sporisorium scitamineum[J]. Journal of Southern Agriculture,2018,9(4): 708-713. doi: 10.3969/j.issn.2095-1191.2018.04.14.
[49] 江蕾,李菲,李智,易湘茜, 邓家刚, 周桂, 高程海. 海黄瓜共附生细菌多样性及其对甘蔗鞭黑粉菌的抑制作用[J]. 南方农业学报,2018,49(3):488-494. doi: 10.3969/j.issn.2095-1191.2018.03.12.JIANG L, LI F, LI Z, YI X Q, DENG J G, ZHOU G, GAO C H.Diversity of symbiotic bacteria isolated from Pseudocnus echinatus and its antifungal activity against Sporisorium scitamineum[J].Journal of Southern Agriculture, 2018, 49(3): 488-494. doi:10.3969/j.issn.2095-1191.2018.03.12.
[50] 李菲,黄庶识,王伟,江蕾,米顺利,余炼. 海绵Pseudoceratina sp.共栖细菌多样性及其抑制甘薦鞭黑粉菌活性研究[J]. 广西科学,2018,25(1):87-93, 99. doi:10.13656/j.cnki.gxkx.20180115.001.LI F, HUANG S S, WANG W, JIANG L, MI S L, YU L. Diversity of sponge-derived bacteria isolated from Pseudoceratina sp.Against Sporisorium scitamineum vitro[J]. Guangxi Sciences, 2018, 25(1): 87-93,99. doi:10.13656/j.cnki.gxkx.20180115.001.
[51] 王蕾,毛玉玲,许汉亮,李继虎, 林明江, 胡玉伟, 毛永凯, 管楚雄. 生物表面活性剂鼠李糖脂对甘蔗黑穗病菌的体外抗菌活性[J/OL]. 微生物学通报. 2018. https://doi.org/10.13344/j.microbiol.china.180499.WANG L, MAO Y L, XU H L, LI J H, LIN M J, HU Y W, MAO Y K, GUAN C X. In vitro antifungal activity of biosurfactant rhamnolipidsagainst sugarcane smut caused by Sporisorium scitamineum[J]. Microbiology China, 2018.https://doi.org/10.13344/j.microbiol.china.180499.
[52] ZHONG Y, YAN M, JIANG J, ZHANG Z, HUANG J, ZHANG L, DENG Y, ZHOU X, HE F. Mycophenolic acid as a promising fungal dimorphism inhibitor to control sugarcane disease caused by Sporisorium scitamineum[J]. Journal of Agricultur and Food Chemistry, 2019, 67, 112-119. doi: 10.1021/acs.jafc.8b04893.