【研究意义】β-葡聚糖(β-glucan)有多种生物学活性,具有免疫调节和潜在的免疫治疗、抗氧化、抗感染、促进益生菌增殖、降低血脂等作用[1-2]。β-葡聚糖可以从海藻、小麦、燕麦、产碱杆菌、酵母等多种天然来源的植物和微生物中获得[3]。植物来源的β-葡聚糖主要由葡萄糖以1, 3糖苷键和1, 4糖苷键连接构成,而微生物来源的β-葡聚糖通常以1,3糖苷键连接构成。作为一种新型、绿色的天然免疫增强剂,β-葡聚糖在水产养殖中已经得到广泛应用,其饲料添加剂相关功能在家禽和水产养殖业中越来越受到重视[4]。饲料中适量添加β-葡聚糖对鱼类和多种水生动物的生长发育、免疫功能以及抗氧化水平都有促进作用[5-7]。
【前人研究进展】大量研究表明,在饵料中添加β-葡聚糖可以调节水生动物的非特异性免疫和抗氧化水平[8-11]。β-葡聚糖在促进鱼类、虾类生长,提高饲料转化率上有一定作用。但也有部分研究表明,β-葡聚糖对鱼类的促生长作用不太明显,可能与剂量和效应时间有关,这有待作进一步研究[12-13]。作为免疫刺激剂的β-葡聚糖,其分子结构、剂量和添加方式对水生动物和其他动物的免疫反应有重要影响[14]。以往β-葡聚糖对水生动物免疫功能影响的研究,大多数针对鱼类和虾类进行,有部分则针对中华鳖(Pelodiscus sinensis)进行[15-24],而对地方种黄沙鳖(Truogx sinensis)免疫和抗氧化功能影响的相关研究鲜见有报道。【本研究切入点】黄沙鳖是中华鳖的地方种,原产于广西境内的左江、右江、郁江、邕江、西江流域,现分布于广西、广东的西江流域地区,是西江水系特有的鳖种,是经济价值较高的优质淡水水产品之一。绿色生态养殖模式是当前水产养殖业中十分重要的养殖模式之一,对水产养殖行业实现可持续发展和为人们提供更优质的水产品发挥越来越重要的作用[16]。绿色生态养殖模式的目标是实现水产品在生产过程中达到“无抗”“无激素”,不用药或者少用药,因此,制定科学合理防控水产品病害的综合措施尤为关键。优化基础饵料、使用绿色免疫增强剂是综合防控病害的常用手段。选择安全有效的免疫增强剂符合绿色生态养殖要求和特点。
【拟解决的关键问题】本试验在黄沙鳖的基础饲料中添加β-葡聚糖,研究β-葡聚糖在绿色生态养殖条件下对黄沙鳖生长性能和溶菌酶(LZM)活性、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)含量等免疫指标,过氧化氢酶(CAT)、超氧化物歧化酶(T-SOD)活性及丙二醛(MDA)含量等抗氧化指标的影响,以期为β-葡聚糖应用于黄沙鳖绿色生态养殖提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试黄沙鳖幼鳖和养殖条件 试验于2018年6—10月在广东省肇庆市某黄沙鳖绿色生态养殖场的室外饲养池中进行。供试黄沙鳖幼鳖平均体质量200(±10)g,饲养期间饲养池水温为25(±5)℃,池水中溶氧保持在3 mg/L 以上,氨氮浓度保持在0.02 mg/L以下,光照为室外自然光照条件。基础饲料以贝、螺、小鱼、小虾等鲜活饵料为主,占总投饵量的70%,再配30%佛山市顺德区海皇实业有限公司生产的803系列成鳖用饲料,投喂量约为鳖体质量的2%,每天9:00和18:00各投喂1次。由于幼鳖外观上难以区分雌雄,因此,本试验不区分试验动物的性别。
1.1.2 供试β-葡聚糖 供试β-葡聚糖免疫增强剂为广东省某公司生产的免疫多糖(酵母细胞壁),该产品主成分为β-葡聚糖(≥20.0%)。
1.2 试验方法
选取9个条件相同的饲养池(10 m2长方形饲养池,2 m×5 m)作为试验池,将180只健康的黄沙鳖幼鳖随机分成3组,每组3次重复,每个重复20只,分别投喂基础饲料(对照)和添加200、1 000 mg/kgβ-葡聚糖的试验饲料,对照组所用饲料中除没有添加β-葡聚糖之外,其他营养成分均没有改变。每天喂食前 4 h配制饵料,添加β-葡聚糖后饵料存放在阴凉处。连续投喂120 d。
1.3 测定指标及方法
1.3.1 生产性能指标 饲养120 d后空腹24 h,清池点数黄沙鳖,逐只称重,分别计算增重量、体重与内脏比和内脏与肝脏比。
1.3.2 免疫和抗氧化指标 连续投喂120 d后2 d,从每个重复中选3只体重相近的鳖,空腹活体采血(于颈静脉处),将每只鳖的血液分为2份,其中1份以肝素抗凝制备抗凝血供测定CAT活力;1份于室温下倾斜自然凝固后以3 000 r/min 离心15 min,取血清分装于1.5 mL EP管中,-80 ℃保存,用以测定LZM、T-SOD活力和ACP、AKP、MDA含量,取血后48 h内完成检测。检测所用试剂盒均购自南京建成生物工程研究所,各试验步骤按照试剂盒说明书进行。
试验数据采用SPSS10.0软件进行统计分析,差异显著性检验采用独立样本t 检验和单因子方差分析(Oneway ANOVA, LSD)。
2 结果与分析
2.1 β-葡聚糖对黄沙鳖幼鳖生长性能的影响
由表1可知,试验期间对照和β-葡聚糖200 mg/kg、1 000 mg/kg处理的黄沙鳖幼鳖增重量、体重与内脏比和内脏与肝脏比均无显著差异。此外,肉眼观察各处理黄沙鳖幼鳖的体形、内脏形态与颜色均未出现明显差别,表明本试验添加200、1000 mg/kg两种剂量的β-葡聚糖对黄沙鳖幼鳖的机体生长和各组织器官的正常生理机能没有明显不良影响。
表1 各处理黄沙鳖幼鳖增重量与体指测量结果
Table 1 Tested result of the increased weight and morphological indexes of three groups of Truogx sinensis
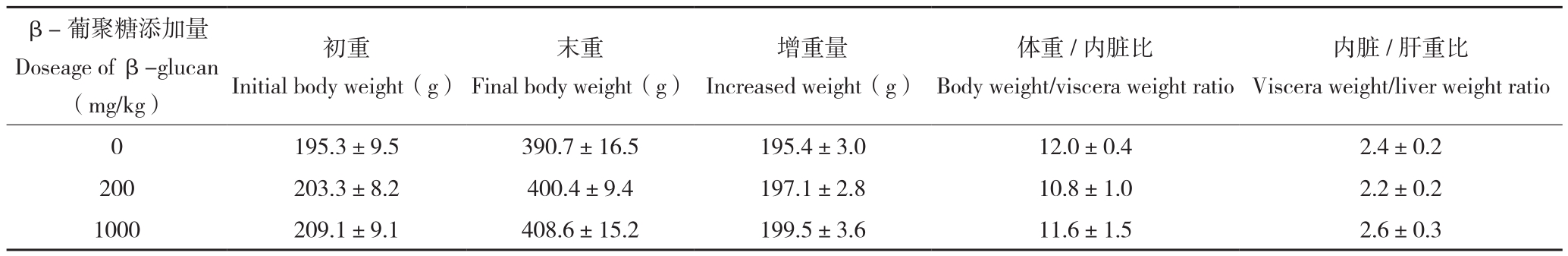
β-葡聚糖添加量Doseage of β-glucan(mg/kg)内脏/肝重比Viscera weight/liver weight ratio 0 195.3±9.5 390.7±16.5 195.4±3.0 12.0±0.4 2.4±0.2 200 203.3±8.2 400.4±9.4 197.1±2.8 10.8±1.0 2.2±0.2 1000 209.1±9.1 408.6±15.2 199.5±3.6 11.6±1.5 2.6±0.3初重Initial body weight(g)末重Final body weight(g)增重量Increased weight(g)体重/内脏比Body weight/viscera weight ratio
2.2 β-葡聚糖对黄沙鳖幼鳖部分免疫和抗氧化指标的影响
由表2可知,LZM活性最高的是β-葡聚糖1 000 mg/kg处理的黄沙鳖幼鳖;β-葡聚糖1 000 mg/kg处理与对照之间、β-葡聚糖1 000 mg/kg处理组与200 mg/kg处理之间均存在显著差异。AKP、ACP含量β-葡聚糖处理均高于对照,但差异不显著。T-SOD活性β-葡聚糖处理高于对照,而且β-葡聚糖200 mg处理和对照之间差异显著。CAT活力和MDA含量各处理之间均没有显著差异。
3 讨论
饵料是影响鱼类消化道菌群的因素之一,鱼类摄食不同饵料对肠道菌群有一定影响[17]。在鱼类生长发育早期,肠道经历了不同菌群的定植与演替,消化道、免疫系统的发育尚未完善,特别是肠道微生态平衡很容易受到干扰,可通过饵料中添加适量免疫增强剂优化饵料的品质,从而调节鱼类的免疫水平[18]。目前已有研究证实, β-葡聚糖可以通过激活鱼体内的非特异性免疫反应以及体液防御系统来增强鱼体的抗感染能力,β-葡聚糖对鱼类非特异性免疫机能的影响表现在可提高鱼类血清中相关酶的活性,如LZM、ACP和KP;提高鱼类体内吞噬细胞活性,提高细胞因子水平等[19]。黄沙鳖生长早期可能与鱼类生长发育早期的情况相似,因此β-葡聚糖显示出提高幼鳖非特异性免疫水平的作用。
溶菌酶是动物自身的非特异性免疫因子,是动物机体体液免疫的主要参与者,参与多重免疫反应机制,在抵抗外来病原菌入侵中发挥重要作用[20]。动物体内许多组织和体液中都含有溶菌酶, 抗原性物质或者免疫刺激剂可以使血清中的溶菌酶活力上升[21]。碱性磷酸酶普遍存在于动物体内,在碱性条件下可使磷酸单脂水解生成乙醇和磷酸,与某些营养物质的消化有关。酸性磷酸酶是巨噬细胞溶酶体的标志酶,巨噬细胞吞噬异物时,与异物颗粒形成吞噬体后用包括酸性磷酸酶在内的溶解酶消化异物颗粒,因此酸性磷酸酶的活性代表吞噬细胞清除异物的能力,也就是非特异性免疫能力。碱性磷酸酶和酸性磷酸酶均参与动物体内的免疫活动[22],这两种酶和溶菌酶都是重要的非特异性免疫酶,在水生动物体液免疫和抗病过程中起重要作用。这些酶活力的高低也常被用作评价水生动物免疫机能状态的重要指标,这3种酶的活性可以反映黄沙鳖非特异性体液免疫状态,在一定程度上反映黄沙鳖非特异性免疫功能的高低[23]。本研究结果表明,在基础饵料中添加β-葡聚糖1 000 mg/kg可以显著提高黄沙鳖幼鳖血清溶菌酶活性,这与汪成竹等[24]研究免疫多糖(酵母细胞壁)对中华鳖非特异性免疫功能影响的结果基本一致。碱性磷酸酶含量β-葡聚糖处理组显著升高,表明基础饵料添加β-葡聚糖有助于提高黄沙鳖幼鳖的非特异性免疫水平;酸性磷酸酶含量β-葡聚糖处理组均高于对照组,但没有表现出显著差异,其原因有待进一步研究。
表2 各处理黄沙鳖幼鳖非特异性免疫指标和抗氧化水平测定结果
Table 2 Tested result of non-specific immunity index and antioxidant level of three groups of Truogx sinensis

注:同列数据后小写英文字母不同者表示差异显著。
Note: The different lowercase letters in the same column represent significant differences
β-葡聚糖添加量Doseage of β-glucan(mg/kg)LZM(U/mL)AKP(king’s unit/100mL)ACP(king’s unit/100mL)T-SOD(U/mL)CAT(U/mL)MDA (U/mL)421.93±62.03a 4.03±2.28a 11.11±5.02 47.29±2.35a 3.16±1.76 2.27±0.45 200 326.77±53.76a 7.59±2.63b 14.61±4.62 49.37±1.19b 3.65±0.76 2.04±0.22 1000 557.31±89.72b 6.36±1.49b 12.88±3.42 48.46±1.73ab 2.69±0.64 1.99±0.42 0
动物机体是通过酶系统与非酶系统产生氧自由基的,这种自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成脂质过氧化物如醛基、酮基、羰基、羟基、氢过氧基以及新的氧自由基等。氧自由基通过生物膜中多不饱和脂肪酸的过氧化作用引起细胞损伤,还通过脂氢过氧化物的分解产物引起细胞损伤。T-SOD和CAT是动物非特异性免疫系统中主要的免疫抗氧化酶,对机体的氧化与抗氧化平衡具有至关重要的作用,能清除超氧阴离子自由基(O2-·),保护细胞免受损伤。因此,测定CAT 、T-SOD活力和MDA含量可以分析机体的抗氧化水平。MDA的测定常常与T-SOD的测定相互配合,SOD活力的高低间接反映了机体清除氧自由基的能力,而MDA含量的高低又间接反映了机体细胞受自由基攻击的严重程度。本研究显示,添加β-葡聚糖能提高T-SOD活力,而添加β-葡聚糖并没有改变MDA含量,表明基础饵料添加β-葡聚糖也有助于加强黄沙鳖幼鳖机体的抗氧化能力。
4 结论
绿色生态养殖环境下在基础饵料基础上添加1 000 mg/kgβ-葡聚糖有助于增强黄沙鳖幼鳖的非特异性免疫功能,而且不影响黄沙鳖的生长和体型。1 000 mg/kg 的添加量可以作为下一步优化β-葡聚糖添加量的参考值。在绿色生态养殖环境下使用适量β-葡聚糖添加剂来提高黄沙鳖的免疫水平是可行的。
[1] 曹俊明,赵红霞,黄燕华,王国霞,胡俊茹,陈冰,吴春玉.β-葡聚糖及其在水生动物中的应用研究[J].饲料工业,2013,34(18):1-6.doi: 10.3969/j.issn.1001-991X.2013.18.001.CAO J M, ZHAO H X, HUANG Y H, WANG G X, HU J R, CHEN B, WU C Y. β-glucan and its application in aquatic animals[J].Feed Industry,2013, 34(18):1-6. doi: 10.3969/j.issn.1001-991X.2013.18.001.
[2] 李万坤,闫鸿斌,才学鹏,郭福存. β-葡聚糖的免疫增强作用机理的研究进展[J]. 中国畜牧兽医,2007,34(5):151-155.LI W S, YAN H B, CAI X P, GUO F C. Mechanism study of β-glucans for enhanced immune competence[J]. China Animal Husbandry &Veterinary Medicine, 2007, 34(5):151-155.
[3] KUPETZ M, PROCOPIOL S, SACHER B, BECKER T. Critical review of the methods of β-glucan analysis and its significance in the beer filtration process[J]. Eur Food Res Technol, 2015, 241(6): 725-736.doi:10.1007/s00217-015-2498-7.
[4] 金毅明,李平利,赵雅萍,王凤山. β-葡聚糖研究进展及其在健康产业中的开发潜能[J]. 食品与药品,2018,20(5):377-381. doi:10.3969/j.issn.1672-979X.2018.05.016.JIN Y M, LI P L, ZHAO Y P, WANG F S. Research progress on β-glucan and its development potential in health industry[J].Food and Drug,2018, 20(5):377-381. doi: 10.3969/j.issn.1672-979X.2018.05.016.
[5] 张华,方热军. β-葡聚糖对动物的免疫增强和促生长作用及其机制[J]. 湖南饲料,2009(4):29-31.ZHANG H, FANG R J. Enhanced immune competence and growth promotion mechanism of β-glucans for animals[J]. Hunan Feed,2009 (4):29-31.
[6] 李永娟,曹俊明,赵红霞,黄燕华,王国霞,吴春玉,刘小玲,马永萍. β-葡聚糖在水产动物营养生理中的作用研究进展[J]. 广东农业科学,2014,41(21):128-134. doi: 10.16768/j.issn.1004-874X.2014.21.036.LI Y J, CAO J M, ZHAO H X, HUANG Y H, WANG G X, WU C Y,LIU X L, MA Y P. Advances in nutritional and physiological effects of β-glucan on aquatic animals[J]. Guangdong Agricultural Sciences,2014, 41(21):128-134. doi: 10.16768/j.issn.1004-874X.2014.21.036.
[7] 易建华,杨凡,聂琴,戴晋军,胡骏鹏. 酵母细胞壁中β-葡聚糖在水产养殖中研究进展[J]. 中国饲料,2016,(14):41-44. doi:10.15906/j.cnki.cn11-2975/s.20161410.YI J H, YANG F, NIE Q, DAI J J, HU J P. Research advance of the application of the β-glucan in yeast cell wall in aquaculture[J].China Feed,2016, (14):41-44. doi: 10.15906/j.cnki.cn11-2975/s.20161410.
[8] 王永宏,杨小玉,郭正龙,张玉晴,张鸿业,陈立侨,周忠良.β-葡聚糖对暗纹东方鲀幼鱼非特异性免疫及生长性能的影响[J]. 中 国 水 产 科 学,2013,20(6):1247-1256. doi: 10.3724/SP.J.1118.2013.01247.WANG Y H, YANG X Y, GUO Z L, ZHANG Y Q, ZHANG H Y, CHEN L Q, ZHOU Z L. Effect of β-glucan on the non-specific immunity and growth of Takifugu obscurus[J]. Journal of Fishery Sciences of China,2013, 20(6):1247-1256. doi: 10.3724/SP.J.1118.2013.01247.
[9] 曹俊明,吴春玉,黄燕华,王国霞,赵红霞,莫文艳,齐飞,伏枥龙. β-葡聚糖对花鲈免疫和抗氧化指标的影响[J]. 水产科学,2015,34(1):1-7. doi: 10.16378/j.cnki.1003-1111.2015.01.001.CAO J M, WU C Y, HUANG Y H, WANG G X, ZHAO H X, MO W Y, QI F, FU L L. Effects of dietary β-glucan on immunity and antioxidation indices in Japanese Seabass Lateolabrax japonicas[J]. Fisheries Science,2015, 34(1):1-7. doi: 10.16378/j.cnki.1003-1111.2015.01.001.
[10] 李永娟. β-葡聚糖对黄颡鱼生长性能和免疫功能的影响[D]. 武汉:华中农业大学,2016.LI Y J. Effects of β-glucan on growth performance and immunity function of yellow catfish ,Pelteobagrus fulvidraco[D]. Wuhan:Huazhong Agricultrural University, 2016.
[11] 曹俊明,王安利,黄燕华,蓝汉冰,李国立,刘穗华. 饲料中长期添加β-1,3 -葡聚糖对凡纳滨对虾生长性能 、体成分和生化指标的影响[J]. 动物营养学报,2010,22(5):1464-1470. doi: 1006-267X (2010) 05-1464-07.CAO J M, WANG A L, HUANG Y H, LAN H B, LI G L, LIU S H.Effects of long-term dietary supplementation of β-1,3-glucan on growth performance, body compositio and biochemical indices of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition,2010,22(5):1464-1470. doi: 1006-267X (2010) 05-1464-07.
[12] 王艺,纪利芹,孙国祥,刘鹰,王顺奎. 饲料中添加β-葡聚糖对虹鳟部分生长指标和血液生理指标的影响[J]. 渔业科学进展,2018,39(3):65-71. doi: 10.19663/j.issn2095-9869.20170712003.WANG Y, JI L Q, SUN G X, LIU Y, WANG S K. Effects of dietary β-glucan on some growth and blood physiological indices of rainbow trout(Oncorhynchus mykiss)[J]. Progress in Fishery Sciences, 2018,39(3): 65-71. doi: 10.19663/j.issn2095-9869.20170712003.
[13] LU D L, LIMBU S M, LV H B, MA Q, CHEN L Q, ZHANG M L,DU Z Y. The comparisons in protective mechanisms and efficiencies among dietary α-lipoic acid, β-glucan and L-carnitine on Nile tilapia infected by Aeromonas hydrophila[J]. Fish and Shellfish Immunology,2019,86:785-793. doi: :10.1016/j.fsi.2018.12.023.
[14] DE OLIVERA CARLOS A F, VETVICKA V, ZANUZZO F S.β-Glucan successfully stimulated the immune system in different jawed vertebrate species[J]. Comparative Immunology, Microbiology and Infectious Diseases,2019,62:1-6. doi:10.1016/j.cimid.2018.11.006.
[15] 季高华,刘至治,冷向军. 饲料中添加β-葡聚糖和低聚果糖对中华鳖幼鳖生长和血清 SOD 、溶菌酶活力的影响[J]. 上海水产大学学报,2004,13(1):36-40.JI G H, LIU Z Z, LENG X J. Effects of dietary betaglucan and fructooligosaccharides on the growth and activities of superoxide dismutase and lysozyme of Trionyx sinensis[J]. Journal of Shanghai Ocean University, 2004,13(1):36-40.
[16] 钱光芸. 绿色生态养殖技术在淡水养殖中的应用 [J]. 南方农业 ,2018,12(21):143-145. doi: 10.19415/j.cnki.1673-890X.2018.21.076.QIAN G Y. Application of green ecological farming technology in freshwater aquaculture[J]. South China Agriculture, 2018,12(21):143-145. doi: 10.19415/j.cnki.1673-890X.2018.21.076.
[17] 陈孝煊,吴志新,周文豪. 鱼类消化道菌群的作用与影响因素研究进展[J]. 养殖与饲料,2006(3):37-40. doi:10.13300/j.cnki.cn42-1648/s .2006.03.010.CHEN X X, WU Z X, ZHOU W H. Study on the Effects and influencing factors of microflora in the digestive tract of fish[J]. Animals Breeding and Feed, 2006(3) : 37-40. doi: 10.13300/j.cnki.cn42 -1648/s.2006.03.010..
[18] BIDHAN C D, MEENA D K, BEHERA B K, PRONOBDAS,DASMOHAPATRA P K, SHARMA A P.Probiotics in fish and shellfish culture: Immunomodulatory and ecophysiological responses[J].Fish Physiol Biochem,2014,40( 3) : 921-971.
[19] 刘露,李代宗,肖勤. β-葡聚糖对鱼类相关免疫功能的影响[J]. 饲 料 研 究,2017(1),13-18. doi: 10.13557/j.cnki.issn1002-2813.2017.01.003.LIU L, LI D Z, XIAO Q. Effects of dietary β-glucan on relevant immunity functions of fish[J]. Feed Research, 2017(1),13-18. doi:10.13557/j.cnki.issn1002-2813.2017.01.003.
[20] 魏世娜,秦启伟. 鱼类溶菌酶和组织蛋白酶研究进展[J]. 广西科学 2018,25(1),32-35. doi:10.13656/j.cnki.gxkx.20180206.002.WEI S N, QIN Q W. Advance on lysozyme and cathepsin of fish[J]. Guangxi Sciences,2018,25(1),32-35 doi:10.13656/j.cnki.gxkx.20180206.002.
[21] KAWAKAMI H, SHINOHARA N, SAKAI M. The nonspecefic immunostimulation and adjuvant effects of Vibrio anguillarum bacterin,M-glucan, chitin and Freund′ s complete adjuvant against Pasteurella piscicida infection in yellowtail[J].Fish Path, 1998, 33(3):283-292.
[22] 程逍妹,黄启成,王方海,李广宏. 蝇蛆蛋白对中华鳖血清生化指标及非特异性免疫功能的影响[J]. 水产科学,2017,36(06),768-772. doi:10.16378/j.cnki.1003-1111.2017.06.013.CHENG X M, HUANG Q C, WANG F H, LI G H. Effects of dietary housefly maggot protein on serum biochemical indices and nonspecific immunity in soft shelled turtle Trionyx sinensis[J]. Fisheries Science,2017,36(6),768-772.doi:10.16378/j.cnki.1003-1111.2017.06.013.
[23] 陈忠法,王伟,徐洁皓,尹尚军,钱国英. 中华鳖不同群体非特异性免疫差异分析[J]. 浙江万里学院学报,2018,31(1),80-82,92.doi: 10.13777/j.cnki.issn1671-2250.2018.01.016.CHEN Z F, WANG W, XU J H, YIN S J, QIAN G Y. Studies on nonspecific immunity of Chinese soft-shell turtles (Pelodiscus sinensis)in different populations and seasons[J]. Journal of Zhejiang Wanli University, 2018,31(1),80-82, 92. doi:10.13777/j.cnki.issn1671-2250.2018.01.016.
[24] 汪成竹,姚鹃,吴凡,谭斌,熊传喜,陈昌福. 免疫多糖(酵母细胞壁)对中华鳖非特异性免疫功能的影响[J]. 华中农业大学学报,2006,25(4):421-425. doi: 10.13300/j.cnki.hnlkxb.2006.04.020.WANG C Z, YAO J, WU F, TAN B, XIONG C X, CHEN C F. Effect of immunopolysaccharide (yeast cell wall) on non-specific immune function in juvenile soft-shelled turtles (Pelodiscus sinensis) by oral administration[J]. Journal of Huazhong Agricultural University,2006,25(4) : 421-425. doi: 10.13300/j.cnki.hnlkxb.2006.04.020.