【研究意义】千年桐(Aleurites montana)是大戟科油桐属落叶乔木,主要分布于福建、广西、广东、江西等地,特点是生长速度快,可作为短轮伐期的工业原料林树种;种仁含油率高,是炼制生物质柴油的优质原料。此外,由于千年桐凋落量大,还可以作为生态公益林的补植树种,与针叶树种混交可改良地力[1]。【前人研究进展】关于千年桐在繁育技术、幼苗生长特性和营林技术上已取得相关研究[2],如比较播种密度、播种时间、扦插培育、不同嫁接方式等对苗木生长的影响[3],千年桐在幼苗阶段采取相关促进生长发育措施的研究[4],纯林与混交林的相关生理生态指标分析等[5]。而在与内生真菌有关的研究相对较少。【本研究切入点】植物内生真菌是寄生在植物体内与其共同生长、相互作用并相互影响的一类真菌,一般不会使寄主植物产生不良影响[6]。现有研究表明,内生真菌能提高植物对养分的利用[7],对许多植物具有促生作用;也能提高植物体内的酶活性[8],降低有害次生代谢物质含量[9],提高植物抗逆性[10]。同时,很多报道指出,植物内生真菌还具有明显的抑菌作用,如核桃内生真菌对苹果腐烂病原菌(Valsa ceratosperma)、核桃炭疽病原菌(Gloeosporium fructigenum)、辣椒疫霉病原菌(Phytophthora capsici)和小麦赤霉病原菌(Fusarium graminearum)均有抑制作用[11]。【拟解决的关键问题】千年桐作为兼用林树种,近年来其栽植与利用受到诸多关注。但是,由于闽北丘陵山地的地形限制,千年桐常栽植于人工管理不易、土壤瘠薄的陡坡。通过内生真菌作用,提高千年桐的养分利用率和抗逆性,对减少肥料投入、降低生产成本、提高桐果产量和质量均具有重要意义。本研究通过对千年桐内生真菌的分离和鉴定,比较千年桐不同器官中内生真菌分布和种类的差异;同时,磷作为植物生长重要元素之一,土壤中高于95%磷元素却未被有效利用,针对这一问题最直接快速的方法是施用磷肥,但是南方红壤的磷肥利用率较低、磷素固化严重,急需发展新的替代品来替代或一定程度缓解这一状况[12]。筛选出具有较高溶磷效果的优势菌株,以期为闽北地区千年桐的优质栽培以及林木内生真菌的应用提供一些理论基础。
1 材料与方法
1.1 试验材料
供试千年桐材料于2014年采自福建省南平市建阳区外墩采育场、湖桥工区和书坊林场,包括长势良好、无病虫害的千年桐散生木,毛竹、杉木和千年桐混交林中的千年桐成熟木,以及千年桐纯林中的成熟木,共29株,树龄为10~15年。每株分别采集根、茎、叶器官样本,叶片选择健康的定长叶片,根和茎样品长度约10 cm。采集后的材料放在密封袋中编号,并用浸湿滤纸覆盖叶片和根系,用浸湿棉花包裹根茎两端,带回实验室进行内生真菌的分离。
1.2 试验方法
1.2.1 千年桐内生真菌的分离纯化 将千年桐各器官表面冲洗30 min后转移至超净工作台,用75%酒精和15%次氯酸钠依次漂洗。每次漂洗后用无菌水冲洗3~4次,并用无菌纸吸干水分。将表面消毒过的新鲜千年桐根段、茎段和叶片置于无菌玻璃片上,切割成5 mm×5 mm的组织块。每个培养皿放入6~8个组织块,置于改良马丁培养基(鱼蛋白胨5.0 g、葡萄糖20.0 g、酵母浸出粉2.0 g、磷酸氢二钾1.0 g、硫酸镁0.5 g、蒸馏水1 000 mL、pH 6.4(±0.2)上。密封培养皿,于28 ℃恒温箱中避光培养7 d。
培养期间,当组织块周围有菌落出现时,根据菌落生长速度、颜色的差异,用无菌接种针从组织块周围选取单一的菌落,并挑取其菌丝体接种至马丁培养基平板上,于28 ℃恒温培养7 d待菌丝长满,重复纯化培养3次后接种到斜面培养基〔马铃薯葡萄糖琼脂(PDA)40.1 g、蒸馏水1 000 mL、pH 7.0〕,并于4 ℃保存。
1.2.2 千年桐内生真菌的鉴定 纯化培养后,根据菌落形态挑取适量菌丝制成玻片,于光学显微镜下观察菌落大小、颜色和纹路等特征,根据其显微结构,参照魏景超[13]的方法进行菌株初步分类鉴定。为了进一步验证鉴定结果的准确性,将样品送至上海迈浦生物科技有限公司通过18S rDNA进行分子鉴定。
1.2.3 千年桐内生真菌的筛选 综合千年桐各个器官中生长较快、长势较好菌株出现的频率,筛选出优势菌株。筛选方法为以3处采样地的千年桐根、茎、叶3个器官中内生真菌出现频率为基数进行统计,即有9个出现位置,如某一菌株出现于3处样地的千年桐根系中,则其出现频率为1/3。菌株生长速度则以培养至7 d时菌落直径的大小来表示。经筛选得到的优势菌株采用三点接种法[14]分别接种在NBRIP无机磷培养基(葡萄糖10 g、磷矿粉5 g、氯化镁5 g、硫酸镁0.25 g、氯化钾0.2 g、硫酸铵0.1 g、蒸馏水1 000 mL、pH 7.0)[15]上,每个菌株3次重复,于25 ℃培养7 d,将具有明显可见透明圈的菌落视为具有较高溶磷效果,记录溶磷圈直径(D)和菌落直径(d),以进一步筛选具有较强溶磷能力的菌株。
2 结果与分析
2.1 千年桐不同器官的消毒
本试验使用75%酒精和15%次氯酸钠对千年桐不同器官表面进行消毒。根据多次试验结果,各器官消毒的适宜时间为:使用75%酒精对千年桐根、茎、叶消毒30 s,无菌水冲洗后,用15%次氯酸钠分别消毒根部7 min、茎部5 min、叶片7 min。将表面消毒后的千年桐根、茎和叶放入改良马丁培养基于28 ℃恒温箱中避光放置3 d,培养基内无微生物长出,确认器官表面彻底灭菌。
2.2 千年桐内生真菌的分离结果
从千年桐根、茎、叶各器官中分离得到的内生真菌情况(表1)可知,千年桐不同器官分离出的内生真菌数量存在一定差异。从器官角度分析,茎中分离出的内生真菌数量最多,从3个采样地的样品茎部共分离出60株内生真菌,占总数的38.71%;而根部分离出的内生真菌较少,占总数的29.03%。从采样地来看,湖桥样地和书坊样地的样品中分离出内生真菌的数量较多,分别占总数的49.68%和41.94%,外墩样地样品中分离出的内生真菌仅有13株,占总数的8.39%。
表1 千年桐各器官内生真菌分离结果
Table1 The number of endophytic fungi isolated from different organs of Aleurites montana
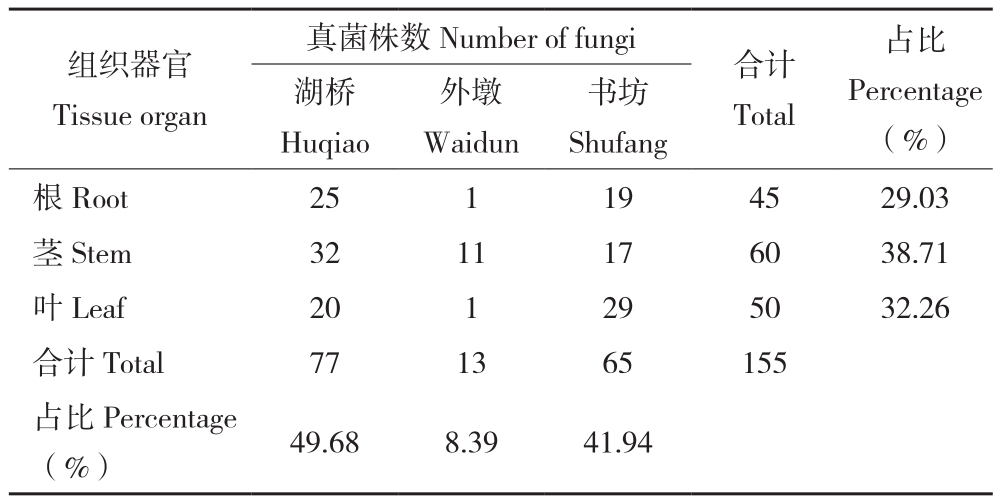
images/BZ_54_1284_1080_2267_1135.png书坊Shufang根Root 25 1 19 45 29.03茎Stem 32 11 17 60 38.71叶Leaf 20 1 29 50 32.26合计Total 77 13 65 155占比Percentage(%) 49.68 8.39 41.94组织器官Tissue organ 湖桥Huqiao合计Total 外墩Waidun Percentage(%)
2.3 千年桐内生真菌的鉴定结果
根据对菌落的形态学观测和18S rDNA分子鉴定的结果,千年桐不同器官分离出的155株内生真菌分别隶属于以下14个属:青霉属(Penicillium sp.)、 毛 霉 菌 属(Mucor sp.)、嗜热真菌属(Thermomyces sp.)、拟盘多毛孢属(Pestalotia sp.)、木霉属(Trichoderma sp.)、盾壳霉属(Coniothyrium sp.)、茎点霉属(Phoma sp.)、镰刀菌属(Fusarium sp.)、生赤壳属(Bionectria sp.)、赤霉属(Gibberella sp.)、链格孢属(Alternaria sp.)、漆斑菌属(Myrothecium sp.)、五隔盘单毛孢属(Seiridium sp.)、尼泊尔盘孢属(Seimatoantlerium sp.)。
2.4 千年桐内生真菌的筛选结果
根据菌株生长速度和出现频率的差异,从155株内生真菌中筛选出25株优势菌株,经鉴定分别隶属于毛霉菌属、青霉属、拟盘多毛孢属、生赤壳属、木霉属、嗜热真菌属、链格孢属、盾壳霉属、镰刀菌属等9个属。通过记录菌株在NBRIP无机磷培养基中的溶磷圈直径(D)与菌落直径(d),计算其比值,结果见表2。表2显示,在优势菌株中筛选出具有较好溶磷效果的菌株4株。其中青霉属菌株R1的菌落直径和溶磷圈直径最大,分别为2 cm和2.7 cm,青霉属菌株R3的D/d值最大,为1.667。溶磷圈直径与菌落直径比值大小排列顺序为R3>R1>R2>R4,初步判断R3菌株具有相对较强的溶磷能力。
表2 千年桐溶磷菌的筛选结果
Table2 The phosphprus-solubilizing endophytic fungi in Aleurites montana
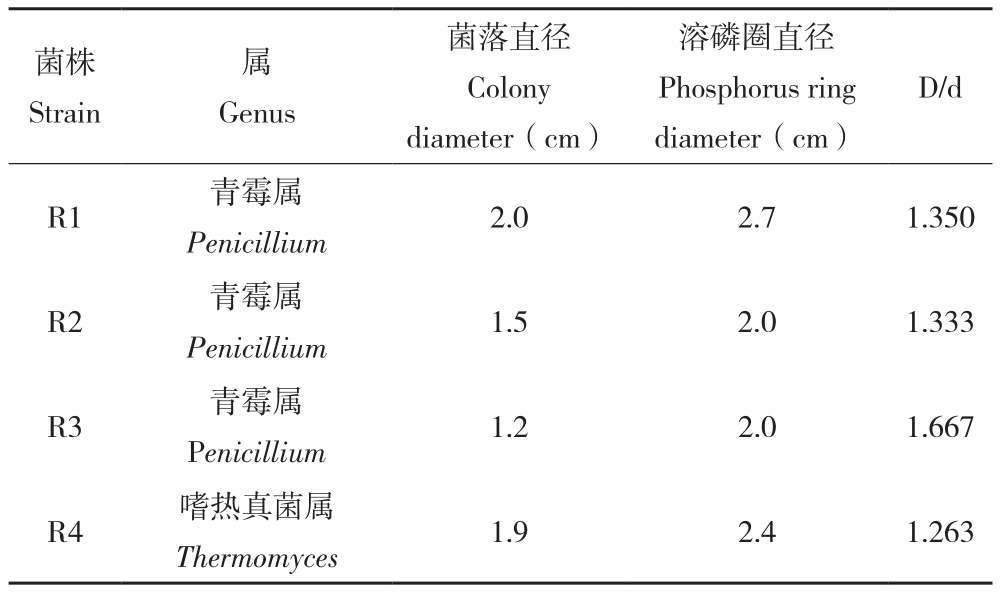
菌株Strain属Genus菌落直径Colony diameter(cm)溶磷圈直径Phosphorus ring diameter(cm)D/d R1 青霉属Penicillium 2.0 2.7 1.350 R2 青霉属Penicillium 1.5 2.0 1.333 R3 青霉属Penicillium 1.2 2.0 1.667 R4 嗜热真菌属Thermomyces 1.9 2.4 1.263
3 讨论
前人研究发现,在无菌、盆栽和大田3种栽培条件下,后两者分离出的内生真菌数量较前者明显增加[16]。也有报道指出,内生真菌生物量的高低受培养环境的影响[17]。本研究结果也表明,从湖桥、外墩、书坊样地的千年桐中分离出的内生真菌数目存在差异,说明一定条件下环境因子可作用于宿主植株进而对其内生真菌产生影响。同时,内生真菌在千年桐不同器官间的分布也存在差异,表现为茎部最多(38.71%)、叶片居中(32.26%)、根部最少(29.03%)的特征,这与陈志为等[18]对台湾相思内生真菌的研究结果一致。一方面,土壤微生物可以侵染根部进而随着千年桐的生长向上扩展到茎部;另一方面,千年桐叶片表面积较大,空气中的微生物有更多机会侵染,且叶片中的微生物也有机会扩展到茎部[19]。此外,闽北地区的气候和土壤条件也会对微生物结构组成产生影响[20]。但相关报道也发现,桑树内生真菌在根部数量最多[21],马尾松叶片中的内生真菌数量高于根部和茎部[22],而雷公藤内生真菌呈现在枝条中分布数量最高的趋势[23],说明内生真菌在植物各器官间的分布也因植物种类而异。
对3个采样地千年桐内生真菌的鉴定结果显示其分别隶属于14个属,而进一步筛选出的25株优势菌株隶属于9个属,分别为毛霉菌属、青霉属、拟盘多毛孢属、生赤壳属、木霉属、嗜热真菌属、链格孢属、盾壳霉属、镰刀菌属,初步明确了3个采样地千年桐内生真菌的组成。这与戴传超等[24]在同为大戟科的泽漆(Euphorbia helioscopia L.)、乌桕〔 Sapium sebiferum(L.)Roxb.〕、大戟(Euphorbia pekinensis Rupr.)、重阳木(Bischo fi a polycarpa)等4种植物中分离得到的内生真菌表现有共同的菌属,分别为拟盘多毛孢属、镰刀菌属和青霉属。在植物内生真菌的种类差异上,有研究表明,内生真菌的繁殖扩散会受其宿主基因型和环境因子(如温度和海拔等)影响,且在环境条件和宿主基因型共同作用下,宿主针对易感内生真菌的特性在自然环境下会发生改变,从而影响宿主内生真菌的种类[25-26]。同时,在宿主植株对环境的适应性生长过程中,植物内生真菌与土壤微生物之间的互作也导致植株内生真菌种类的差异[27-28]。
根据前人研究,绝大多数溶磷菌株是从植物根际土壤中分离得到的,而青霉属是其中最重要的一类溶磷菌[29-31]。本研究从千年桐植株中也提取出具有较高溶磷效果的青霉属和嗜热真菌属内生真菌菌株,扩大了溶磷微生物资源。内生真菌作为微生物资源,可以促进宿主生长、增强宿主对外界条件的抵抗能力、促进宿主合成化学物质[32-33],这对提高千年桐生态公益林、短轮伐期工业原料林以及经济林的高优栽培具有重大意义。
4 结论
本研究结果表明,千年桐内生真菌数量在不同地点以及不同器官间分布有不同,表现为湖桥样品分离内生真菌的数量最多、外墩样品最少,茎部最多(38.71%)、叶片居中(32.26%)、根部最少(29.03%)的特征。初步确定千年桐内生真菌菌属组成,即毛霉菌属、青霉属、拟盘多毛孢属、生赤壳属、木霉属、嗜热真菌属、链格孢属、盾壳霉属、镰刀菌属,其中青霉属和嗜热真菌属内生真菌菌株具有较高的溶磷效果。
[1] 樊月,陈志为,潘云龙,洪滔,苏少川,吴承祯,林晗. 林龄和坡位对杉桐混交林化学计量特征的影响[J]. 应用与环境生物学报,2019,25(2):246-253. doi: 10.19675/j.cnki.1006-687X.2018.05029.FAN Y, CHEN Z W, PAN Y L, HONG T, SU S C, WU C Z, LIN H. Effects of stand age and slope position on the stoichiometric characteristics of the Cunninghamia lanceolata-Aleurites montana mixed forest[J].Chinese Journal of Applied and Environmental Biology, 2019, 25(2):246-253. doi: 10.19675/j.cnki.1006-687X.2018.05029.
[2] 田蜜,杨小丽,郭霞,杨丽薇.木油树研究进展及展望[J].绿色科技,2018(23):82-83. doi: 10.16663/j.cnki.lskj.2018.23.038.TIAN M, YANG X L, GUO X, YANG L W. Research history and prospect of Aleurites montana Lour[J]. Journal of Green Science and Technology, 2018(23):82-83. doi: 10.16663/j.cnki.lskj.2018.23.038.
[3] 肖应忠,陈建忠,刘剑斌,张水生,毛慧英,暨雪枝.千年桐播种密度、播种时间与苗木生长关系的研究[J].福建林业科技,2011,38(4):104-106,110. doi:10.3969/j.issn.1002-7351.2011.04.26.XIAO Y Z, CHEN J Z, LIU J B, ZHANG S S, MAO H Y, JI X Z.Study on the relationship among seeding density, time and seedling growth of Aleurites montana[J]. Journal of Fujian Forestry Science and Technology,2011,38(4):104-106,110. doi:10.3969/j.issn.1002-7351.2011.04.26.
[4] 肖应忠 .千年桐苗木生长规律研究[J].防护林科技,2014(4):23-24,27. doi: 10.13601/j.issn.1005-5215.2014.04.010.XIAO Y Z. Growth law of Aleurites montana seedlings[J] .Protection Forest Science and Technology, 2014(4): 23-24,27. doi: 10.13601/j.issn.1005-5215.2014.04.010.
[5] 潘云龙,林国伟,陈志为,樊月,陈欣凡,吴承祯,洪滔.杉木纯林及杉桐混交林土壤酶活性研究[J].热带作物学报,2018,39(5):846-851. doi: 10.3969/j.issn.1000-2561.2018.05.003.PAN Y L, LIN G W, CHEN Z W, FAN Y, CHEN X F, WU C Z, HONG T.Effect of Cunninghamia-lanceolata-Aleurites montana mixed forests on soil enzyme activity[J]. Chinese Journal of Tropical Crops, 2018,39(5): 846-851. doi: 10.3969/j.issn.1000-2561.2018.05.003.
[6] STONE J K, BACON C W, WHITE J F J. An overview of endophytic microbes: Endophytism defined[M]//BACON C W, WHITE J F J.Microbial Endophytes. New York: Marcel Dekker, Inc., 2000: 3-29.
[7] 刘桂青,杨栋,倪其军,李廷强,郝虎林,陈宝,杨卫东,杨肖娥. 内生菌对柳树生长及氮磷吸收的强化作用[J]. 浙江大学学报(农业与生命科学版), 2016,42(2):256-264. doi:10.3785/j.issn.1008-9209.2015.04.132.LIU G Q, YANG D, NI Q J, LI T Q, HAO H L, CHEN B, YANG W D,YANG X E. Bioaugmentation effects of endophytic bacteria on growth and nitrogen and phosphorus accumulation of willow[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2016, 42(2): 256-264. doi:10.3785/j.issn.1008-9209.2015.04.132.
[8] 杨鑫,杜全能,齐文武,张旭,谭玲玲,廉欣,兰时乐,李林. 花生内生菌的分离及促生长作用初步研究[J].花生学报,2018,47(3):19-25. doi:10.14001/j.issn.1002-4093.2018.03.004.YANG X, DU Q N, QI W W, ZHANG X, TAN L L, LIAN X, LAN S L,Studies on the isolation and growth-promotion of endophyte in peanut[J]. Journal of Peanut Science, 2018, 47(3): 19-25. doi:10.14001/j.issn.1002-4093.2018.03.004.
[9] 张鹏,李盼盼,高林,杜咏梅,刘新民,张忠锋,申国明. 烟草内生真菌多样性及其功能研究进展[J]. 中国烟草科学,2017,38(2):93-99. doi:10.13496/j.issn.1007-5119.2017.02.016.ZHANG P, LI P P, GAO L, DU Y M, LIU X M, ZHANG Z F, SHEN G M.Research advances on biodiversity and functions of tobacco endophytic fungi[J]. Chinese Tobacco Science, 2017, 38(2): 93-99. doi:10.13496/j.issn.1007-5119.2017.02.016.
[10] 牛燕芬,李扬苹,罗富成,陈泽斌,彭声静,陈武荣,字泰平. 植物内生真菌对寄主生长及抗逆性的增效机理研究进展[J]. 草原与草坪,2015,35(2):91-96. doi:10.13817/j.cnki.cyycp.2015.02.019.NIU Y F, LI Y P, LUO F C, CHEN Z B, PEN S J, CHEN W R, ZI T P. Promotion mechanisms on endophyte of plant to growth and stress tolerance of hosts plant[J]. Grassland and Turf, 2015, 35(2): 91-96.doi:10.13817/j.cnki.cyycp.2015.02.019.
[11] 阿依佳玛丽·依玛尔. 核桃内生真菌多样性及高活性菌株代谢产物抑菌活性研究[D].杨凌:西北农林科技大学,2017.YIMA’ER A. Diversity and antimicrobial activity of metabolites of endophytic fungi isolated from Juglans regial[D]. Yangling:Northwest A & F University,2017.
[12] 银婷婷,王敬敬,柳影,梁亚杰,王兴彪,韩一凡,王夏,程美娟,黄志勇. 高效解磷菌的筛选及其促生机制的初步研究[J]. 生物技 术 通 报,2015,31(12):234-242. doi: 10.13560/j.cnki.biotech.bull.1985.2015.12.034.YIN T T, WANG J J, LIU Y, LIANG Y J, WANG X B, HAN Y F, WANG X, CHENG M J, HUANG Z Y. The screening of efficient phosphorussolubilizing bacteria and the primary study on its mechanism of plantgrowth-prooting[J]. Biotechnology Bulletin, 2015, 31(12): 234-242.doi: 10.13560/j.cnki.biotech.bull.1985.2015.12.034.
[13] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1982.WEI J C. Fungal Identification Manual[M]. Shanghai: Shanghai Science and Technology Press, 1982.
[14] 周德庆.微生物学实验教程[M].北京:高等教育出版社,2006:13-15.ZHOU D Q. Microbiology Experiment Tutorial[M]. Beijing: Higher Education Press, 2006: 13-15.
[15] 胡晓峰. 溶磷菌的筛选、溶磷条件优化及对玉米的促生作用研究[D]. 南京:南京农业大学,2010.HU X F. Screening of phosphate solubilizing bacteria, optimization of phosphate dissolving conditions and its promotion to maize growth[D].Nanjing: Agricultural University, 2010.
[16] 马同锁,田苗珍,袁红楼,赵士豪,薛胜平. 不同生长环境对2种蔬菜内生菌分布的影响[J].安徽农业科学,2009,37(17):7812-7813,7815. doi: 10.13989/j.cnki.0517-6611.2009.17.048.MA T S, TIAN M Z, YUAN H L, ZAHO S H, XUE S P. Effect of the different growth environmental conditions on the distribution of endophytes in two species of vegetables[J]. Journal of Anhui Agricultural Sciences, 2009, 37(17): 7812-7813,7815. doi: 10.13989/j.cnki.0517-6611.2009.17.048.
[17] 戴传超,余伯阳,徐增莱,袁生. 环境因子对乌桕内生真菌生长及脂肪酸的影响[J]. 应用生态学报,2003(9):1525-1528. doi:10.13287/j.1001-9332.2003.0336.DAI C C, YU B Y, XU Z L, YUAN S. Effect of environmental factors on the growth and fatty acid composition of five endophytic fungi from Sapium sebiferum[J]. Chinese Journal of Applied Ecology, 2003(9):1525-1528. doi:10.13287/j.1001-9332.2003.033.
[18] 陈志为,周艳芬,樊月,潘云龙,林晗,洪滔,吴承祯. 台湾相思内生真菌的分离筛选及其对幼苗生长的影响[J]. 东北林业大学学报,2019(1):61-64,75. doi:10.13759/j.cnki.dlxb.2019.01.012.CHEN Z W, ZHOU Y F, FAN Y, PAN Y L, LIN H, HONG T, WU C Z. Isolation and screening of Endophytic fungi from Acacia confuse and their effects on seedling growth[J]. Journal of Northeast Forestry University, 2019(1): 61-64,75. doi:10.13759/j.cnki.dlxb.2019.01.012.
[19] 刘济明,柳嘉佳,颜强,熊雪,李丽霞,骆畅. 小蓬竹植物内生真菌多样性[J]. 东北林业大学学报,2016,44(12):71-75,90. doi:10.13759/j.cnki.dlxb.2016.12.015.LIU J M, LIU J J, YAN Q, XIONG X, LI L X, LUO S. Diversity of endophytic fungal from Drepanostachyum luodianense[J]. Journal of Northeast Forestry University, 2016, 44(12): 71-75, 90. doi: 10.13759/j.cnki.dlxb.2016.12.015.
[20] 周赛,梁玉婷,孙波. 红壤微生物群落结构及其演变影响因素的研究进展[J]. 土壤,2015,47(2):272-277. doi: 10.13758/j.cnki.tr.2015.02.012.ZHOU S, LIANG Y T, SUN B. Research advances in environmental and human factors affecting microbial community structure and evolution in red soils[J]. Soils, 2015, 47(2): 272-277. doi: 10.13758/j.cnki.tr.2015.02.012.
[21] 梁嘉俊. 陕西省桑树内生菌和紫花苜蓿病原菌分离鉴定[D]. 杨凌:西北农林科技大学,2018.LIANG J J. Isolation and identification of endophytes of mulberry and pathogen of alfalfa in Shanxi province[D]. Xian: Northwest A & F University, 2018.
[22] 邓慧华,洪伟,吴承祯,谢安强,潘伟彬,段萍. 马尾松内生真菌产油脂菌株的分离、筛选和鉴定[J]. 植物资源与环境学报,2014,23(2):27-33. doi: 10.3969/j. issn.1674-7895.2014.02.04.DENG H H, HONG W, WU C Z, XIE A Q, PAN W B, DUAN P.Separation, selection and identification on producing lipid strains of endophytic fungi from Pinus massoniana[J]. Journal of Plant Resources and Environment, 2014, 23(2): 27-33. doi: 10.3969/j.issn.1674-7895.2014.02.04.
[23] 宋萍,洪伟,吴承祯,封磊. 雷公藤内生真菌的分离及抗肿瘤活性研究[J]. 北华大学学报 (自然科学版),2009,10(4):310-313.SONG P, HONG W, WU C Z, FEN L. Isolation and bioactivity studies of endophytic fungi from Tripterygium wilfordii Hook.f[J]. Journal of Beihua University (Natural Science), 2009, 10(4): 310-313.
[24] 戴传超,余伯阳,赵玉婷,蒋继宏,杨启银. 大戟科4种植物内生真菌分离与抑菌研究[J].南京林业大学学报(自然科学版),2006(1):79-83.DAI C C, YU B Y, ZHAO Y T, JIANG J H, YANG Q Y. The screening and identification of endophytic fungi from four species of family euphorbiaceae and the strains, antibacterial activity[J]. Journal of Nanjing Forestry University (Natural Sciences), 2006(1): 79-83.
[25] AHLHOLM J, HELANDER M, HENRIKSSON J, METZLER M,SAIKKONEN K. Environ-mental conditions and host genotype direct geneticdiversity of Ventuha ditricha, a fungal endophyte of birch trees[J]. Evolution, 2002, 56: 566-1573. doi: 10.1023/A:1019680111363.
[26] AHLHOLM J, HELANDER M, ELAMO P, SALONIEMI I,NEUVONEN S, HANHIMÄKI S, SAIKKONEN K. Micro-fungi and invertebrate herbivores on birch trees: Fungal mediated plant- herbivore interactions or responses to host quality?[J]. Ecology Letters, 2002, 5:648-655. doi: 10.1046/j.1461-0248.2002.00368.x.
[27] 朱琳,黄建,陈天阳,周永斌. 文冠果人工林根际土壤真菌和根系内生真菌群落多样性[J].东北林业大学学报,2015,43(5):105-111. doi: 10.13759/j.cnki.dlxb.20150522.007.ZHU L, HUANG J, CHEN TY, ZHOU Y B. Root-associated and endophytic fungal community diversity in Xanthoceras sorbifolia Bunge plantation[J]. Journal of Northeast Forestry University, 2015,43(5): 105-111. doi:10.13759/j.cnki.dlxb.20150522.007.
[28] 巫婷玉,杨丽,许明敏,余文娟,詹寿发,樊有赋,陈晔. 槲蕨根际真菌与内生真菌的多样性及相关性分析[J]. 广东农业科学,2012,39(17):157-159. doi: 10.16768/j.issn.1004-874X.2012.17.057.WU T Y, YANG L, XU M M, YU W J, ZHAN S F, FAN Y B, CHEN Y. Diversity and correlation of endophytic fungi and rhizosphere fungi isolated from Drynaria roosii[J]. Guangdong Agricultural Sciences,2012, 39(17): 157-159. doi: 10.16768/ j.issn.1004-874X.2012.17.057.
[29] 江红梅,殷中伟,史发超,刘彩月,程明芳,范丙全. 一株耐盐溶磷真菌的筛选、鉴定及其生物肥料的应用效果[J]. 植物营养与肥料学报,2018,24(3):728-742. doi: 10.11674/zwyf.17468.JIANG H M, YIN Z W, SHI F C, LIU C Y, CHEN M F, FAN B Q.Isolation and functional evaluation of phosphate - solubilizing fungi with salt - tolerant characteristics[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(3): 728-742. doi: 10.11674/zwyf.17468.
[30] MURUMKAR D, BORKAR D, CHIMOTE V. Diversity in phosphate solubilizing fungi (Aspergillus awamori and Penicillium digitatum)present in soils of Maharashtra[J]. Research Journal of Biotechnology,2014, 9(8): 20-26.
[31] MENDES G, FREITAS A, PEREIRA O, SILVA I, VASSILEV N,COSTA M. Mechanisms of phosphate solubilization by fungal isolates when exposed to different Psources [J]. Annals of Microbiology, 2014,64(1): 239-249. doi: 10.1007/s13213-013-0656-3.
[32] 姚领爱,胡之璧,王莉莉,周吉燕,黎万奎. 植物内生菌与宿主关系研究进展[J]. 生态环境学报,2010,19(7):1750-1754. doi:10.16258/j.cnki.1674-5906.2010.07.021.YAO A L, HU Z B, WANG L L, ZHOU J Y, LI W K. Research development of the relationship between plant endophyte and host[J].Ecology and Environmental Sciences, 2010, 19(7): 1750-1754. doi:10.16258/j.cnki.1674-5906.2010.07.021.
[33] 任爱梅,张丽珂,孟宪刚.植物内生真菌研究进展与存在问题[J].广东农业科学,2010,37(2):103-106. doi:10.16768/j.issn.1004-874X.2010.02.011.REN A M, ZHANG L K, MENG X G. Research progress and existing problems of Endophytic[J]. Guangdong Agricultural Sciences, 2010,37(2): 103-106. doi: 10.16768/j.issn.1004-874X.2010.02.011.