【研究意义】砷、锑、镉是毒性极强的3种重金属,且其矿山在中国分布广泛,长期开采与冶炼对矿山周边土壤、运输线路周边农田与河流造成严重的重金属污染,导致农作物难以生长,受影响生物、植物进入食物链后甚至会对人体健康造成不可逆作用甚至是死亡[1-8]。目前常用超富集植物对受污染土壤进行植物提取修复,利用超富集植物能超量富集重金属并将其转移至地上部的特点,收割地上部以达到去除土壤重金属污染的目的[9]。蜈蚣草是一种成熟的修复土壤砷污染的超富集植物,廖晓勇等[10]在田间试验中发现蜈蚣草对砷污染土壤的修复率最高可达7.84%,且修复率与收割次数成正比关系,而陈同斌等[11]将蜈蚣草投入工程性土壤重金属修复,并成功修复湖南郴州砷污染土壤。对蜈蚣草富集锑、镉的特性在近年也有报道,研究发现其可富集锑386.7 mg/kg、镉 952.26 mg/kg[12-13]。了解蜈蚣草体内重金属的赋存形态以及在多金属共胁迫下对其赋存形态的影响对进一步探究蜈蚣草耐受重金属毒性的机理有重要意义。【前人研究进展】重金属在植物体内分为多种形态,各种形态对植物造成的毒性不尽相同,存在差异性,这就导致了重金属毒性同总量不一定成正比关系。对于植物的有效态目前主要分为许嘉琳等[14]提出的醋酸提取态、去离子水提取态、氯化钠提取态、醋酸提取态、盐酸提取态与吴慧梅等[15]提出的两步连续提取法提取的盐酸提取态、乙醇提取态等。乙醇提取态被认为是植物体内生物活性最强的形态、易迁移,而且对植物锑的毒性效应最为显著[14],但对水培植物体内重金属形态的研究鲜有报道。【本研究切入点】本研究选用耐受多种重金属的蜈蚣草为载体,进行As、Sb、Cd单一胁迫及交互胁迫试验,并利用两步连续提取法提取As、Sb、Cd的乙醇提取态与盐酸提取态进行分析。【拟解决的关键问题】探索As、Sb、Cd单一胁迫及交互作用下蜈蚣草的富集特性及形态分布,并进一步阐述重金属在高耐性植物体内的赋存形态规律,以期为植物修复技术提供更多元化的支撑数据。
1 材料与方法
1.1 试验材料
蜈蚣草采自贵州大学校园,筛选采摘平均茎长10~15 cm的蜈蚣草,采摘时连根同采,采回后立即用小股清水缓慢清洗,保证其根部完整性。
改良霍格兰营养液:四水硝酸钙945 mg/L、硝酸钾506 mg/L、硝酸铵80 mg/L、磷酸二氢钾136 mg/L、硫酸镁493 mg/L、铁盐溶液2.5 mL/L、微量元素液5 mL/L;铁盐溶液:七水硫酸亚铁5.56 g/L、乙二胺四乙酸二钠7.46 g/L;微量元素液:碘化钾0.83 mg/L、硼酸6.2 mg/L、硫酸锰22.3 mg/L、硫酸锌8.6 mg/L、钼酸钠0.25 mg/L、硫酸铜0.025 mg/L、氯化钴0.025 mg/L;酒石酸锑钾、亚砷酸钠、氯化镉、氯化铵,均为分析纯。
1.2 试验方法
1.2.1 蜈蚣草培养 将采回的蜈蚣草置于改良霍格兰营养液中预培养7 d,使其适应水培环境后,立即进行试验处理。所有培养过程在人工气候箱中进行,白天温度设置为23℃,夜晚温度设定为10℃,所有植株长势正常,无明显枯萎、叶片变色等情况。
1.2.2 试验设计 试验设置重金属单一胁迫及交互胁迫7个处理,分别为砷、锑、镉、砷-镉、砷-锑、锑-镉、砷-锑-镉胁迫,每个处理均设7个重金属胁迫梯度,分别为1、5、10、30、50、70、90 mg/L(多金属交互胁迫处理浓度均为设定浓度),探究各浓度梯度下重金属在蜈蚣草体内的富集特征。每个处理3次重复,以营养液水培作空白对照。胁迫时长统一设置为7 d,与Tisarum等[16]设定的蜈蚣草水培时间相同。
1.2.3 取样方法 蜈蚣草水培7 d后,取其根、茎、叶,晾干后于烘箱中95℃杀青30 min,再于65℃烘干,磨成粉,过0.150 mm筛装入密封袋保存待测。
1.3 分析方法
重金属在植物中主要以乙醇提取态与盐酸提取态毒性最强,重金属锑形态分析分为乙醇提取态(简称为“乙醇态”)、盐酸提取态(简称为“盐酸态”)和残渣态,分析方法参考两步连续提取法测定植物中重金属的形态[15]。
1.3.1 乙醇提取态 取0.1~0.3 g样品粉末加入50 mL聚四氟乙烯离心管中,加入10 mL体积分数为80%的乙醇溶液,室温振荡20 h,10 000 r/min离心10 min,收集离心液,残渣中再次加入10 mL乙醇溶液,室温振荡2 h,离心分离,重复2次,将3次离心液全部集中在50 mL三角瓶中,置于140℃电热板上加热浓缩后,加2 mL浓硝酸加盖回流2 h,蒸至近干,重复回流一次。
1.3.2 盐酸提取态 于乙醇提取态残渣中加入10 mL盐酸提取剂(0.6 mol/L),室温振荡20 h,10 000 r/min离心10 min,收集离心液,残渣中再次加入10 mL盐酸提取剂,室温振荡2 h,离心分离,重复2次,将3次离心液全部集中在50 mL三角瓶中,置于140℃电热板上加热浓缩后,加2 mL浓硝酸加盖回流2 h,蒸至近干,重复回流一次。
1.3.3 植物残渣态 将盐酸提取态残渣移入高压密闭消解罐中,加入5 mL HNO3+2 mL H2O2+2 mL HF,预消解过夜后,180℃高压密闭消解12 h,取出冷却至室温,置于160℃电热板上蒸至呈黄豆大小液滴后,转移至50 mL容量瓶中,并逐级稀释100倍后待测。
1.3.4 测定方法 上述所有提取液和消解液均用2% HNO3定容,使用原子荧光测定,测定前1 h各样品加入1 mL硫脲和抗坏血酸将所有锑还原为三价。
试验数据使用Origin进行整理并制作图表,采用SPSS 24.0进行方差分析,应用ANOVA进行差异显著性检验。
2 结果与分析
2.1 蜈蚣草对As、Sb、Cd的富集特征分析
2.1.1 蜈蚣草地下部对As、Sb、Cd的富集特征 由于蜈蚣草是一种能将As、Sb等重金属快速转运至地上部的蕨类植物[17],因此本试验将蜈蚣草分为地上部与地下部进行分析。由图1可知,As、Sb、Cd单一胁迫下,蜈蚣草地下部对As、Sb、Cd的富集浓度与其胁迫浓度呈正比关系,且均在70 mg/L胁迫浓度时达到最大值,分别为 337.56、7 020.90、2 742.58 mg/kg,其中蜈蚣草地下部对砷的富集浓度相对较低,且总体趋势随胁迫浓度变化不明显,这可能是由于其属于砷的超富集植物,能快速将地下部砷转移至地上部所致。当胁迫浓度高于70 mg/L,单一胁迫处理均出现地下部富集浓度下降的情况,其中胁迫浓度为90 mg/L时,As、Sb、Cd富集浓度降幅分别为10.9%、40.2%、23.9%。
在重金属互作胁迫下,蜈蚣草地下部对As、Sb、Cd的富集能力均产生了较大变化,从图1A可以看出,在As胁迫分别添加Sb、Cd、Sb+Cd后,蜈蚣草地下部对As的富集浓度均有增加,其中胁迫浓度50 mg/L时,As+Cd胁迫与单As胁迫相比,As浓度增幅达到最大值1279%,出现较大反常;而As+Sb胁迫虽然对As的富集浓度有所增加,但总体变化趋势趋于平稳。与单As胁迫组相似,可能是由于As、Sb两种重金属结构与化学性质的相似性,Sb的加入并没有对蜈蚣草吸收As的通道造成损坏或功能紊乱,相似规律在图1B中也有体现,蜈蚣草地下部对Sb的富集趋势同样没有因为As的加入产生较大变化,且由于As的加入,Sb的富集量在50 mg/L开始趋于稳定。
蜈蚣草富集重金属的能力可能随生长时间、生物量、地域等因素产生变化,目前对蜈蚣草的定位有许多不同意见,除作为砷的超富集植物是学界统一定论外,其是否能作为Sb超富集植物,结论不一[17]。本试验发现,水培蜈蚣草对Sb的富集浓度远超As、Cd(图1),地下部Sb浓度随胁迫浓度的增加呈现逐渐升高趋势(图1B),至胁迫浓度达到50 mg/L后,富集浓度趋势开始出现反常,或突然降低或趋于平稳;与As相似,多金属互作胁迫同样能提高蜈蚣草地下部对Sb的富集能力,增幅最大点同样出现在加入Cd的50 mg/L Sb+Cd胁迫,增幅达到200.8%,Sb富集浓度为11 087.10 mg/kg。

图1 各胁迫条件下蜈蚣草地下部对As(A)、Sb(B)、Cd(C)的富集浓度
Fig.1 The enrichment concentration of As (A), Sb (B) and Cd (C) in the underground part of the Pteris vittata under different stress conditions
由图1C可知,当As+Cd胁迫浓度高于50 mg/L、Cd胁迫与Sb+Cd胁迫浓度高于70 mg/L,蜈蚣草地下部对Cd的富集浓度均开始逐渐下降或趋于平稳,而As+Sb+Cd胁迫出现反常,As、Sb的共同加入可能导致了蜈蚣草对Cd的吸收通路变化,促使根系能够大量吸收Cd。
2.1.2 蜈蚣草地上部对As、Sb、Cd的富集特征植物茎部与叶部的重金属是由根系吸收后经过木质部运输或蒸腾作用等方式转移至地上部[18-19],因此对地上部富集浓度的分析即是对蜈蚣草转运能力的分析。绝大多数植物吸收的重金属大部分储存在根部,难以向茎、叶部转运,以此作为防御重金属毒害的一种手段。蜈蚣草是砷的超富集植物,对As有较强的转运能力,可能对同主族的Sb具有相似的转运能力。而多金属的互作胁迫作用,可能会对蜈蚣草体内As的转运能力产生影响,如图2A所示,Sb、Cd的加入提高了蜈蚣草对As的转运量,且胁迫浓度为50 mg/L时地上部As的富集浓度达到一个高点,之后出现一个下降趋势,至70 mg/L后又出现回升趋势,说明水培条件下,50~70 mg/L的胁迫浓度可能是蜈蚣草体内As转移的一个临界点或极限点。蜈蚣草地上部富集As浓度的最大值出现在90 mg/L As+Cd胁迫,达到1 390.40 mg/kg;Sb的加入也能够提升蜈蚣草地上部对As的富集能力,最大值达到1 139.10 mg/kg,相对提升98.1%,且不改变其对As的富集规律,而As对Sb也表现出相似规律,能提高蜈蚣草地上部对Sb的富集能力,且不改变Sb的富集规律。
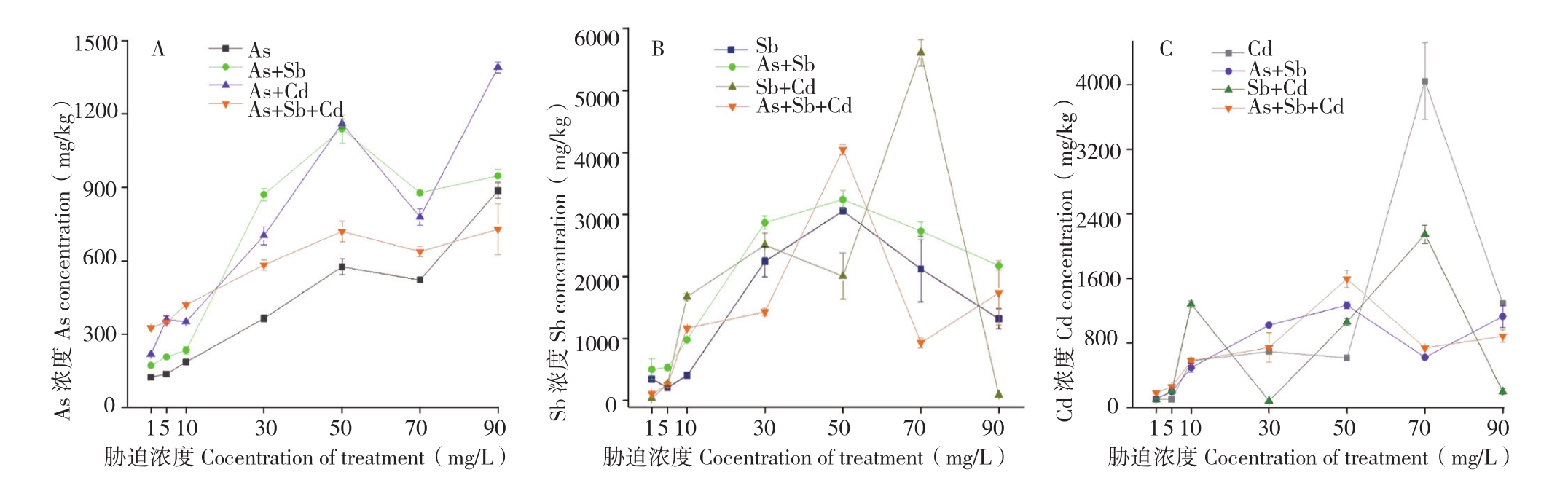
图2 各胁迫条件蜈蚣草地上部对As(A)、Sb(B)、Cd(C)的富集浓度
Fig.2 The enrichment concentration of As (A), Sb (B) and Cd (C) in shoot of the Pteris vittata under different stress concentrations
Cd的加入对蜈蚣草转运Sb的能力也有较大影响,如图2B所示,蜈蚣草地上部Sb浓度最大值出现在70 mg/L Sb+Cd胁迫、达到5 613.30 mg/kg,而在之后的90 mg/L Sb+Cd胁迫却急剧下降、降至90.90 mg/kg,降幅达到6175.2%,说明Cd的加入可能对蜈蚣草转运Sb的能力影响较大,而从总体趋势分析,除As+Sb+Cd胁迫外,蜈蚣草对Sb的转运能力在胁迫浓度50~70 mg/L之后均呈现逐渐降低的趋势。
2.2 重金属单一及互作胁迫下蜈蚣草转移系数的变化分析
1977年,Brooks等[20]首次提出超富集植物的概念,其定义是能够超量富集重金属并将其转运到地上部的植物。通常,超富集植物可以考虑以下两个主要因素:一是植物叶片或地上部(干重)含Cd量达到100 mg/kg,含Co、Cu等达到1 000 mg/kg;二是植物地上部的重金属含量高于根部(即转移系数>1)的植物称为超富集植物,至今世界上共发现400多种超富集植物。而目前发现的重金属耐性植物有许多,其能够高富集重金属在根部,但大都难以向地上部转移,因此,转移系数是识别高富集植物与超富集植物的分界线。
蜈蚣草可以耐受许多重金属,但是仅对砷有稳定的转运能力。对比分析蜈蚣草在As、Sb、Cd单一胁迫与互作胁迫下蜈蚣草体内对其转移系数的变化情况(表1),在单一重金属胁迫下,胁迫浓度达到30 mg/L后蜈蚣草对As的转移系数稳定>1,这一稳定规律在Sb、Cd中均没有出现,说明蜈蚣草对Sb、Cd仅为高富集,而非超富集。
2.3 多金属互作对蜈蚣草体内重金属形态变化的影响
表1 不同胁迫浓度下蜈蚣草体内As、Sb、Cd转移系数
Table1 The transfer coefficient of As, Sb and Cd in Pteris vittata under different stress concentrations
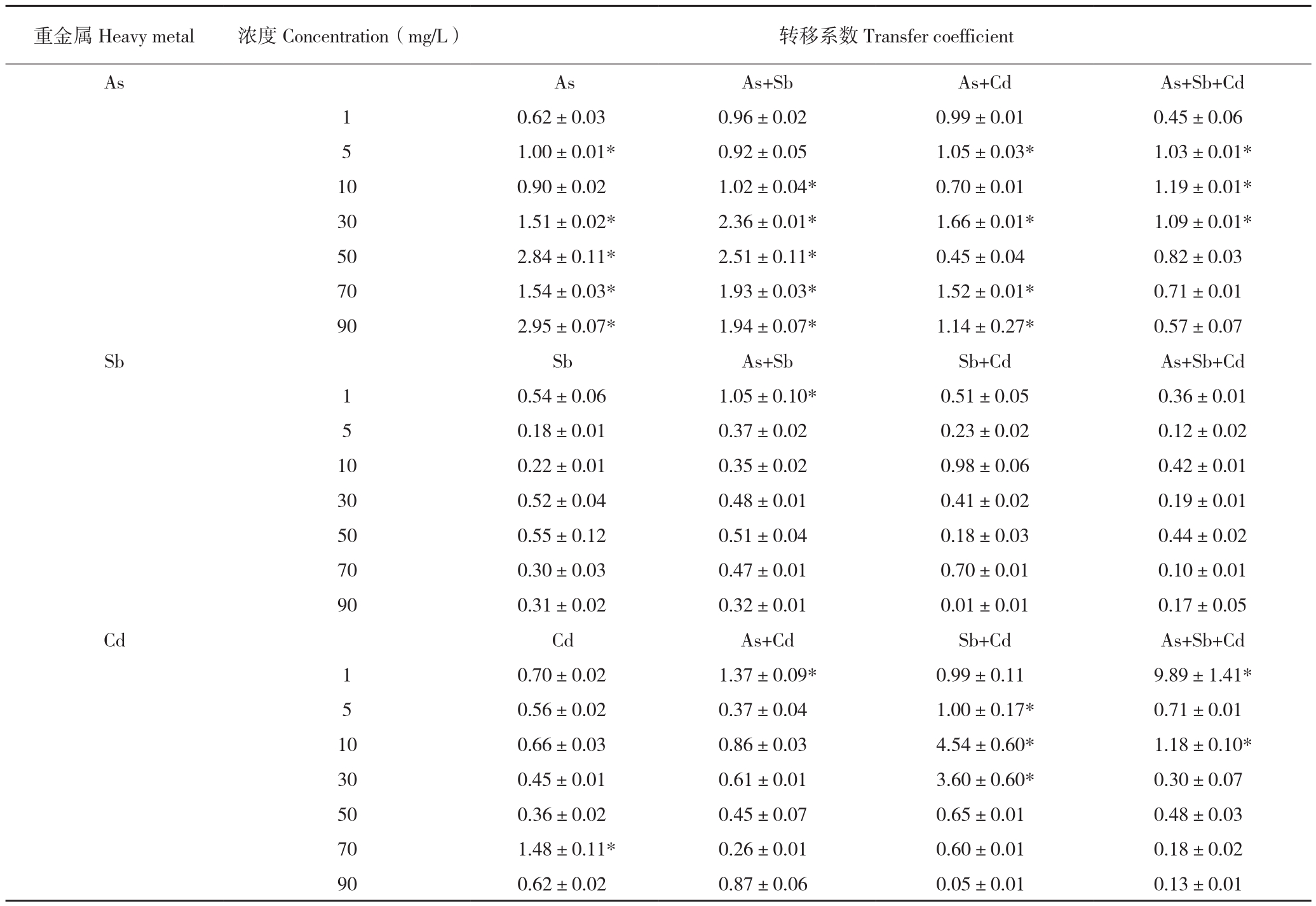
注:*为转移系数>1的胁迫处理。
Note: * represents the treatment group with the transfer coefficient > 1.
重金属Heavy metal 浓度Concentration(mg/L) 转移系数Transfer coefficient As As As+Sb As+Cd As+Sb+Cd 1 0.62±0.03 0.96±0.02 0.99±0.01 0.45±0.06 5 1.00±0.01* 0.92±0.05 1.05±0.03* 1.03±0.01*10 0.90±0.02 1.02±0.04* 0.70±0.01 1.19±0.01*30 1.51±0.02* 2.36±0.01* 1.66±0.01* 1.09±0.01*50 2.84±0.11* 2.51±0.11* 0.45±0.04 0.82±0.03 70 1.54±0.03* 1.93±0.03* 1.52±0.01* 0.71±0.01 90 2.95±0.07* 1.94±0.07* 1.14±0.27* 0.57±0.07 Sb Sb As+Sb Sb+Cd As+Sb+Cd 1 0.54±0.06 1.05±0.10* 0.51±0.05 0.36±0.01 5 0.18±0.01 0.37±0.02 0.23±0.02 0.12±0.02 10 0.22±0.01 0.35±0.02 0.98±0.06 0.42±0.01 30 0.52±0.04 0.48±0.01 0.41±0.02 0.19±0.01 50 0.55±0.12 0.51±0.04 0.18±0.03 0.44±0.02 70 0.30±0.03 0.47±0.01 0.70±0.01 0.10±0.01 90 0.31±0.02 0.32±0.01 0.01±0.01 0.17±0.05 Cd Cd As+Cd Sb+Cd As+Sb+Cd 1 0.70±0.02 1.37±0.09* 0.99±0.11 9.89±1.41*5 0.56±0.02 0.37±0.04 1.00±0.17* 0.71±0.01 10 0.66±0.03 0.86±0.03 4.54±0.60* 1.18±0.10*30 0.45±0.01 0.61±0.01 3.60±0.60* 0.30±0.07 50 0.36±0.02 0.45±0.07 0.65±0.01 0.48±0.03 70 1.48±0.11* 0.26±0.01 0.60±0.01 0.18±0.02 90 0.62±0.02 0.87±0.06 0.05±0.01 0.13±0.01
重金属的乙醇态被认为是在植物体内生物活性最强的形态,毒性效应也最显著,其提取的重金属乙醇态是以硝酸盐、氯化物为主的无机盐及氨基盐等,而重金属的盐酸提取态是以草酸盐为主[14,21],残渣态为除以上两种形态外剩余的重金属提取态,各提取态中所含重金属被提取部分见表2。根据前述试验发现,重金属胁迫浓度在50~70 mg/L时,蜈蚣草对重金属的富集量达到峰值,综合考虑选用50 mg/L作为研究重金属形态变化的重金属胁迫浓度,通过施加不同重金属共胁迫分析蜈蚣草根、茎、叶中蜈蚣草重金属提取态的变化情况。
表2 重金属化学提取态与可被提取部分之间的关系[14,21]
Table2 Relationship between chemical extraction states of Heavy metals and the extractable parts

重金属可被提取部分Extracted parts for heavy metals乙醇态Ethanol stata化学提取态Chemical extraction state以硝酸盐、氯化物为主的无机盐及氨基盐等盐酸态Hydrochloric acid state提取草酸盐等残渣态Residue state以重金属的磷酸盐、果胶酸盐与蛋白质结合态呈吸附态、有机酸盐等
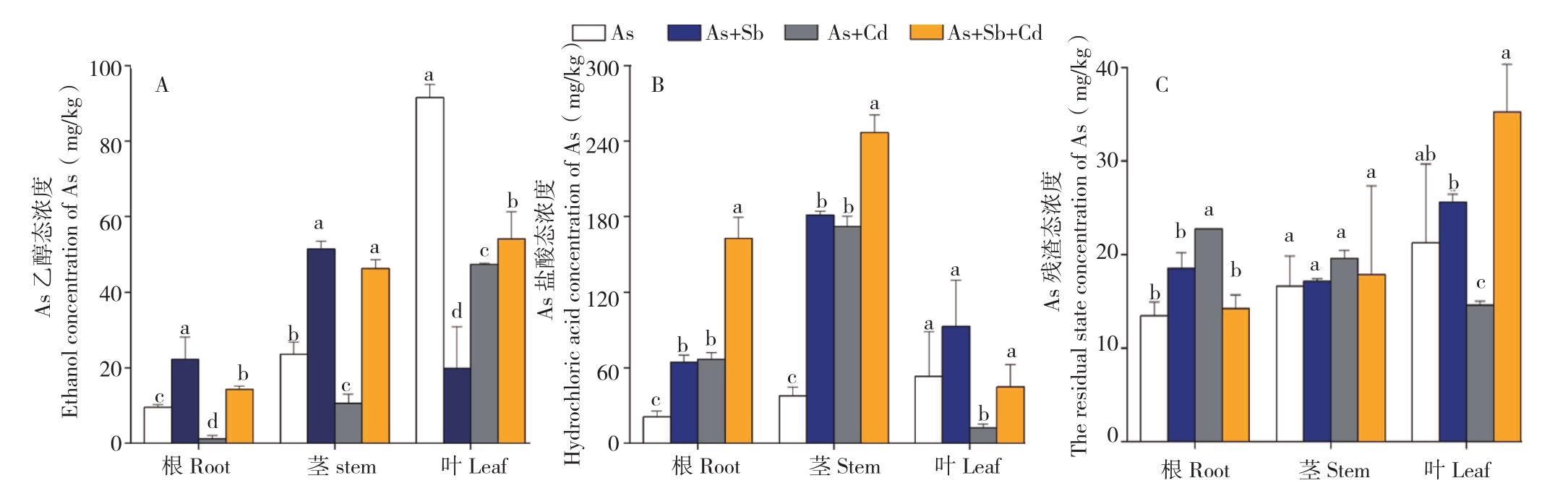
图3 多金属胁迫下蜈蚣草体内As乙醇态浓度(A)、As盐酸态浓度(B)与As残渣态浓度(C)
Fig.3 Ethanol concentration of As(A), hydrochloric acid concentration of As(B) and the residue concentration of As(C) in various parts of Pteris vittata with different metal treatments
2.3.1 多金属胁迫对蜈蚣草体内As形态的影响对As的提取态分析(图3)发现,单一As胁迫下,蜈蚣草体内各部位As的乙醇态、盐酸态与残渣态浓度均表现为叶>茎>根,说明蜈蚣草对砷的各种形态均有较好且稳定的向上转移能力;在加入其他金属胁迫后,这一规律发生不同程度的变化,从As形态分析,随着Cd的加入,根部As乙醇态浓度急剧降低,降幅达到87.1%,茎部及叶部也出现同样趋势,而根部盐酸态与残渣态浓度均有所上升,升幅分别达到316.3%、168.9%,说明Cd的加入可能是通过改变As在蜈蚣草体内的赋存形态,从而影响蜈蚣草根部对As的富集能力与向上的转运能力;Sb的加入对As的吸收有促进作用,且对蜈蚣草对As形态的转化能力没有太大影响,除叶部As的乙醇态低于单As胁迫外,其余均呈现不同程度的升高趋势。从图3可以看出,蜈蚣草在不同胁迫条件下,其根、茎、叶的As形态均以乙醇态与盐酸态两种重金属有效态为主,占比在69.49%以上,最高达94.25%。
2.3.2 多金属胁迫对蜈蚣草体内Sb形态的影响 对As的超富集植物蜈蚣草中Sb的富集形态分析结果(图4)表明,单Sb胁迫下,蜈蚣草根、茎、叶中Sb的残渣态浓度分别达到852.2、770.8、643.3 mg/kg,占比分别为51.7%、47.5%、52.3%,说明残渣态为蜈蚣草体内Sb的主要赋存形态。从图4A可以看出,加入As、Cd胁迫后,蜈蚣草根、茎、叶中Sb的乙醇态浓度大幅降低,由最高322.0 mg/kg降至19.9 mg/kg,且比较图4B与图4C发现,残渣态仍为Sb的主要赋存形态,表明As、Cd的加入会导致蜈蚣草体内的Sb难以向乙醇态转化,从而降低了Sb对蜈蚣草的毒性作用,As、Cd对Sb毒性可能具有拮抗作用。
从蜈蚣草根部Sb形态分析,单Sb胁迫下,蜈蚣草根部Sb乙醇态、盐酸态与残渣态浓度分 别 为 285.0、512.5、852.2 mg/kg, 在 As+Sb、Sb+Cd、As+Sb+Cd胁迫下,Sb乙醇态浓度分别下降至35.6、77.3、37.9 mg/kg,Sb盐酸态浓度分别提高至788.9、791.9、712.8 mg/kg,Sb残渣态浓度分别提高至999.2、1 015.3、957.0 mg/kg,说明多金属胁迫可以促进蜈蚣草根部Sb形态向盐酸态与残渣态转化,抑制Sb向乙醇态转化,重金属的乙醇态属于植物中的易迁移形态,因此As、Cd胁迫对蜈蚣草Sb转移系数的抑制作用(表1)可能是由于体内乙醇态浓度的降低导致的。
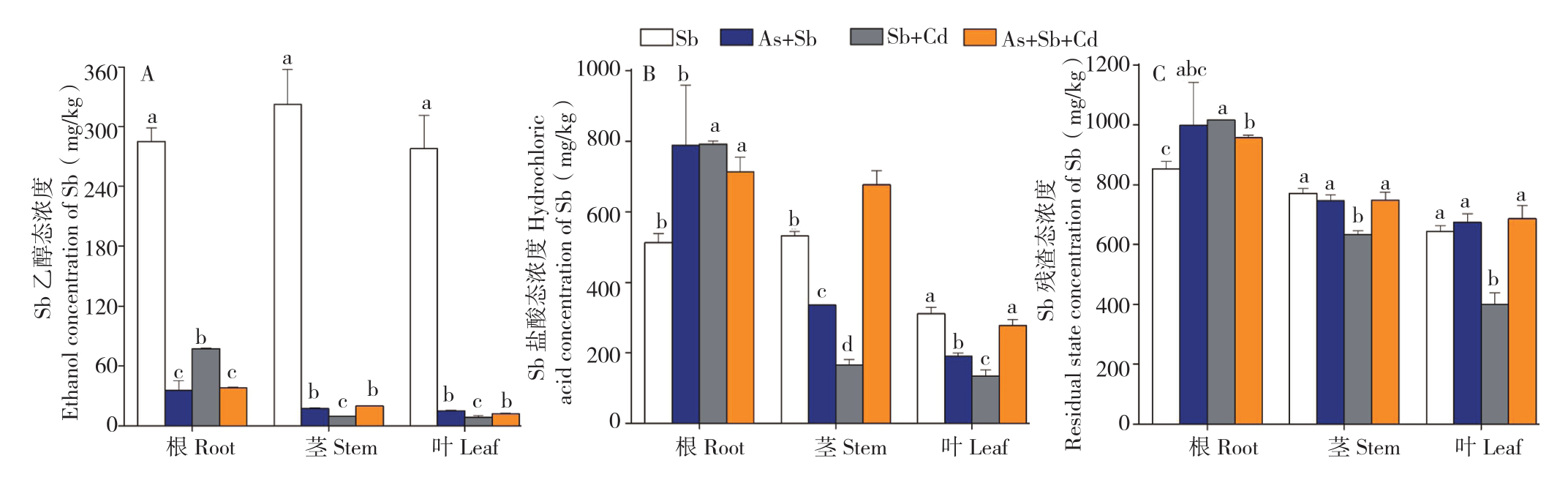
图4 多金属胁迫下蜈蚣草体内Sb提取态浓度
Fig.4 Extraction concentration of Sb in Pteris vittata with different metal treatments
2.3.3 多金属胁迫对蜈蚣草体内Cd形态的影响由图5可知,Cd单一胁迫下,Cd的乙醇态浓度最大值出现在茎部、为27.5 mg/kg,表现为茎>根>叶;Cd的盐酸态浓度最大值出现在叶部、为1 571.6 mg/kg,表现为叶>根>茎;Cd的残渣态最大值出现在根部、为13.6 mg/kg,表现为根>叶>茎,总体规律表现为根、茎、叶Cd形态均以盐酸态为主,占各部位Cd形态的90%以上,说明Cd在蜈蚣草体内以硝酸镉或氯化镉为主(结合表2分析),而Cd胁迫使用的药品为溶解后的氯化镉,代表蜈蚣草吸收Cd后可能难以改变Cd的形态,也从另一方面证明了蜈蚣草对Cd的迁移、转化能力较弱。
从蜈蚣草中Cd的主要赋存形态盐酸态分析,图5B显示,Sb+Cd、As+Cd与As+Sb+Cd胁迫下,蜈蚣草根、茎、叶中Cd的盐酸态呈递增趋势,最大富集浓度出现在As+Sb+Cd胁迫的根部,达到1 968.3 mg/kg,且相比于单Cd胁迫的增幅达到306.5%,说明As、Sb、Cd共胁迫能大幅促进蜈蚣草根部富集的Cd向盐酸态转变。
2.3.4 多金属胁迫下蜈蚣草As、Sb、Cd的残渣态转化率 由于水培试验中加入的As、Sb、Cd(C8H4K2O12Sb2、NaAsO2、CdCl3)均为可溶态,即可溶于乙醇与盐酸,其被蜈蚣草吸收后在体内进行形态转化,则考虑其向残渣态的转化率也可近似地作为蜈蚣草对重金属耐受性的表征因子。由表3可知,蜈蚣草体内As的残渣态转化率均维持在10%以上,Sb、Cd共胁迫时会出现一定的浮动变化,总体上蜈蚣草As残渣态转化率维持在10%~20%,蜈蚣草对Sb的残渣态转化率较高,最高可达78.36%,整体稳定在50%~65%,这也证明了蜈蚣草对Sb的响应作用极为明显,可以在高Sb环境下生长,而Cd的残渣态转化率最高仅为2%,整体水平上处于1%以下。
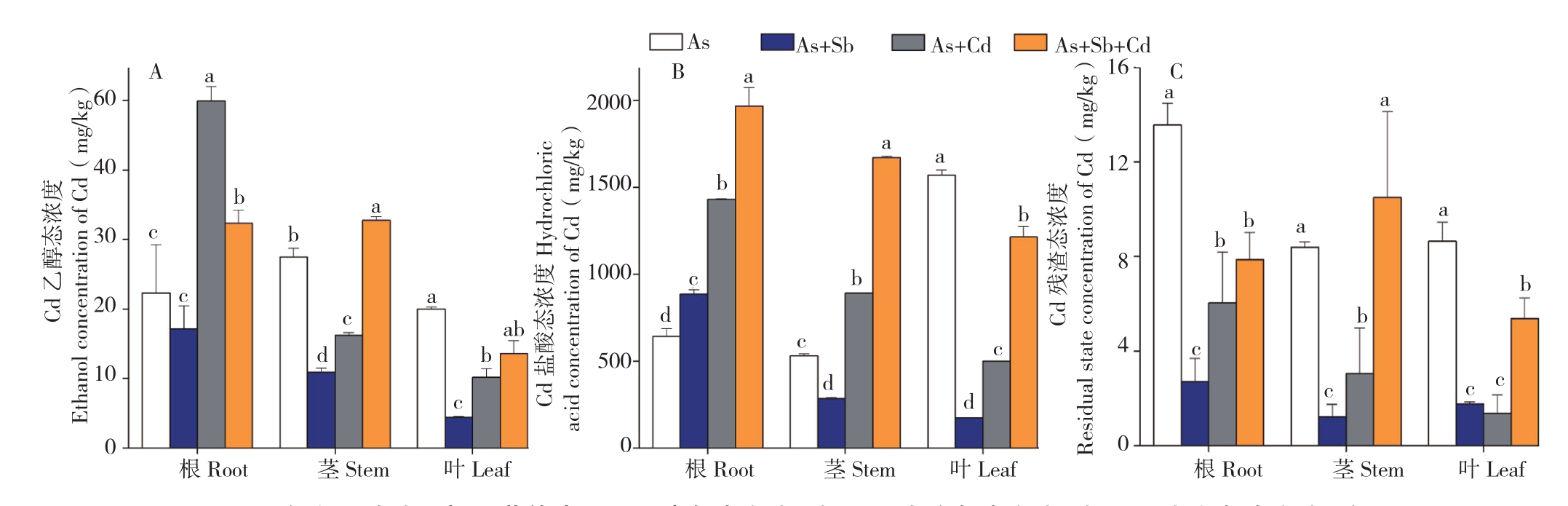
图5 多金属胁迫下蜈蚣草体内Cd乙醇态浓度(A)、Cd盐酸态浓度(B)、Cd残渣态浓度(C)
Fig.5 Ethanol concentration of Cd(A), hydrochloric acid concentration of Cd(B) and the residue concentration of Cd(C) in various parts of Pteris vittata with different metal treatments
表3 蜈蚣草各部位的As、Sb、Cd残渣态转化率
Table3 Conversion rate of As, Sb, Cd residue state of various parts in Pteris vittata
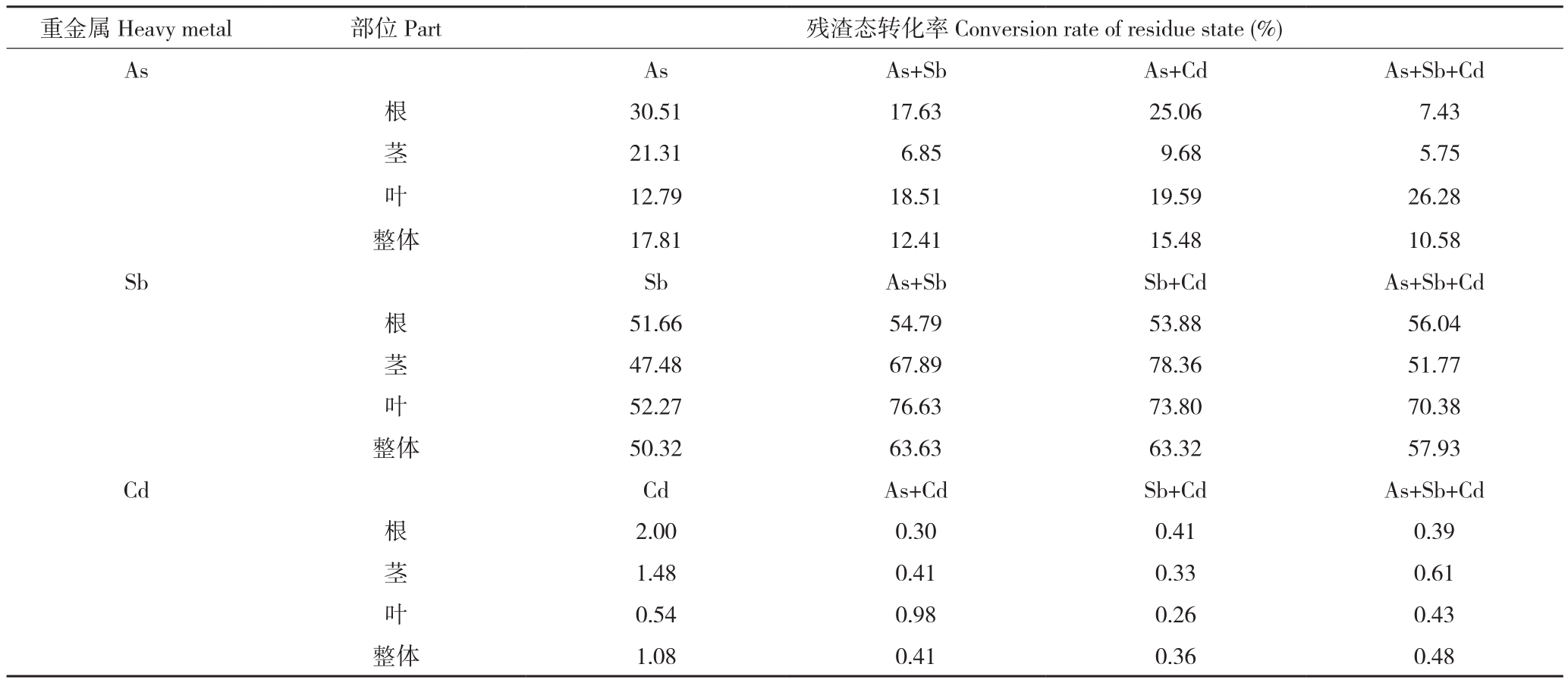
images/BZ_81_213_429_2263_484.pngAs As As+Sb As+Cd As+Sb+Cd根30.51 17.63 25.06 7.43茎21.31 6.85 9.68 5.75叶12.79 18.51 19.59 26.28整体 17.81 12.41 15.48 10.58 Sb Sb As+Sb Sb+Cd As+Sb+Cd根51.66 54.79 53.88 56.04茎47.48 67.89 78.36 51.77叶52.27 76.63 73.80 70.38整体 50.32 63.63 63.32 57.93 Cd Cd As+Cd Sb+Cd As+Sb+Cd根2.00 0.30 0.41 0.39茎1.48 0.41 0.33 0.61叶0.54 0.98 0.26 0.43整体 1.08 0.41 0.36 0.48
从整体上看,蜈蚣草As残渣态转化率加入Sb、Cd胁迫后,下降了2.33~7.23个百分点,说明多金属共胁迫下降低了蜈蚣草将As向残渣态转化的能力,这一规律与Cd残渣态转化率变化相似,而与Sb残渣态转化率呈现相反趋势;在加入As、Cd胁迫后,转化率提升了7.61~13.31个百分点,说明在蜈蚣草体内As、Sb两种同主族重金属元素赋存形态的差异性。
3 讨论
蜈蚣草是一种公认的As超富集植物,但是其是否为Sb、Cd的超富集植物目前学界争议较大[17]。蜈蚣草对As、Sb、Cd富集浓度的最大值分别出现在胁迫浓度为90、70、70 mg/L时,富集浓度分别达到1 187.5、9 142.4、6 788.3 mg/kg,均表现出对3种重金属的高富集能力,但是仅对As表现出稳定的转运能力,转移系数稳定>1。部分研究中在矿区采样发现蜈蚣草对Sb转移系数>1[17],可能是由于矿山伴生矿导致的多金属胁迫所致,如1 mg/L As+Sb胁迫,蜈蚣草对Sb的转移系数>1。相似情况也出现在Sb+Cd胁迫中,蜈蚣草对Cd的转移系数在胁迫浓度为5~10 mg/L时发生突变、高达4.54,在As+Sb+Cd胁迫中也有出现,说明多金属胁迫下蜈蚣草对Sb、Cd的转移能力会受到影响。As、Sb共胁迫下,蜈蚣草可以提高对As的转运能力,而Cd的介入则会降低其对As的转运能力,其原因可能与Sb、As结构的相似性有关。但是Sb、Cd无论在单一胁迫还是多金属共胁迫下,仅少数胁迫处理表现出转移系数>1的情景,从整体上看,蜈蚣草并不具备良好的转移Sb、Cd的能力,不是Sb、Cd超富集植物。
在单一金属胁迫下,胁迫浓度大于70 mg/L后,As、Sb、Cd地下部富集浓度均开始下降,这可能与蜈蚣草的耐受极限有关,即通过流出作用[16]排出重金属,降低其对自身的毒性。由于本试验是在水培条件下进行,重金属胁迫形态均为溶解态,利于植物吸收,其富集浓度与国内外土培试验结果[22-24]差距较大。
多金属胁迫时,蜈蚣草地下部对As、Sb的富集浓度最大值均出现在外加Cd的胁迫中,说明Cd可能对蜈蚣草根部吸收As、Sb的通道产生影响,从而极大地提高了蜈蚣草地下部对As 的富集能力。章金鸿等[25]发现植物中的Cd70%分布在细胞质中,陈同斌等[26]发现As在蜈蚣草体内90%以上被贮存在液泡内,两者的亚细胞分布场所不同却又相连,之间可能存在某种相互平衡的关系,导致Cd的加入能够提高蜈蚣草根部对As与As的同族元素Sb的吸收。蜈蚣草地上部As浓度在Cd加入后同样出现增加情况,但是转移系数在不同程度上出现下降,说明Cd的加入是诱导蜈蚣草根部富集As的量增加,从而导致地上部的As富集浓度增加,并没有对蜈蚣草的As转运能力起到促进作用。Cd改变蜈蚣草对As、Sb富集特征的原因也有可能与蜈蚣草自身的特性有关,有研究认为植物根系和叶片中,Cd的亚细胞分布情况为细胞壁>细胞器,转移系数随根系细胞壁和细胞器的分配比例增加而递减[27]。而Sb的加入也提高了蜈蚣草地上部对As的富集浓度,但并没有影响其对As的转运规律,As的加入同样提高了蜈蚣草对Sb的转运能力,但并没有影响其对Sb的转运规律,说明As、Sb之间可能存在相互促进的作用,与Wan等[28]、王晓丽等[29]研究发现的蜈蚣草中As、Sb共胁迫会增加As、Sb的富集浓度结论相似。
植物体内重金属的赋存形态决定了其对植物的毒性效应,植物从土壤中吸取的均为生物可利用态,但是最终检测出的形态却各有差异,重金属形态在植物体内的转变也表征了植物对其的耐受性。之前研究一直认为重金属以迁移能力最强的乙醇态、盐酸态毒性效应最大[15],但在本研究中发现蜈蚣草体内对As、Sb、Cd的主要赋存形态均有所差异,说明重金属各形态间关系复杂,虽然在植物体内乙醇态、盐酸态易溶于植物自身分泌的酸性物质,易于被植物利用,但是其对植物造成的毒性效应不一定最强。如蜈蚣草体内As的乙醇态、盐酸态浓度占比超过70%,但是蜈蚣草却是一种As的超富集植物,As在蜈蚣草体内主要以硝酸砷、氯化砷以及草酸砷等形式存在,是其较易于向上迁移的原因之一。蜈蚣草体内Sb形态同其他植物有所差异,锑矿区植物包括玉米、桃、芦苇、板栗等体内Sb主要以盐酸态为主,乙醇态占比极小[30-31],而蜈蚣草中的Sb主要以残渣态为主,这可能是由于蜈蚣草通过转变Sb形态来降低其对自身的毒性,是一种耐性机制。而Cd的形态在芦苇中是以氯化钠提取态(主要提取Cd果胶酸盐与蛋白质结合态或呈吸着态的重金属等)为主[32],属于本研究中的残渣态,但在蜈蚣草体内却几乎不存在Cd的残渣态(<2%),其同一般植物体内Sb形态存在差异性,说明重金属在蜈蚣草体内的赋存形态与蜈蚣草本身能够大量富集多种重金属且同时维持正常生长有关。Cd在蜈蚣草中主要以易迁移的盐酸态为主,但是却难以向地上部转运,可能是由于根部吸收Cd后主要附着在细胞壁上[33],而蜈蚣草细胞壁对重金属有极强的“吸持作用”[26],从而减低了Cd向地上部转运的能力。
从残渣态转化率中分析发现蜈蚣草对Cd残渣态的转化率远低于As、Sb,说明蜈蚣草对Cd的耐性机制同As、Sb不同,且蜈蚣草对As、Sb两种结构相似的重金属确实有相似的耐性机制,即通过转变重金属形态来降低其在植物体内的毒性效果。
由于试验使用的是两步连续提取法,仅测定重金属乙醇提取态、盐酸提取态与残渣态,残渣态中可能还包括了重金属的果胶酸盐与蛋白质结合态或呈吸着态和水溶性有机态的重金属等,存在一定的局限性,且受蜈蚣草生物量、根长等影响,具有不确定性,有待在进一步研究中完善。
4 结论
蜈蚣草对As在各种情况下均具备超富集通,而对Sb、Cd仅为高富集。Cd的加入可以促进蜈蚣草根部对As、Sb的富集能力。
重金属在植物体内的主要赋存形态表示了其对植物的毒害效应,蜈蚣草体内对As、Sb的赋存形态同Cd有较大差异,As在植物体内以乙醇态与盐酸态为主,两者占比达到70%以上,Sb以残渣态为主,占比达到50%以上,Cd以盐酸态为主,占比达到90%以上,残渣态占比极低,仅为1%左右。多金属共胁迫实验中发现,Sb的加入可以促进蜈蚣草对As的富集能力,而Cd的加入会降低蜈蚣草中As乙醇态的浓度,可能是促使其向盐酸态转化。而As、Cd的加入会大幅降低蜈蚣草体内Sb乙醇态的浓度,As、Cd对Sb毒性可能具有拮抗作用且会抑制蜈蚣草对Sb的转运能力。As、Sb对蜈蚣草根部Cd的主要赋存形态盐酸态也有极大影响,在As、Sb、Cd共胁迫下,同Cd单一胁迫相比,根部Cd盐酸态增幅达到400%。重金属间的互作作用虽不会改变蜈蚣草体内对其的主要赋存规律,但是对各形态均会有显著性影响,继续进一步探究超富集植物体内重金属形态的赋存规律对理解超富集重金属机制、解毒机制等会有较大帮助。
[1] 莫昌琍,吴丰昌,符志友,朱静,冉靓. 湖南锡矿山锑矿区农用土壤锑、砷及汞的污染状况初探[J]. 矿物学报,2013,33(3):344-350. doi: 10.16461/j.cnki.1000-4734.2013.03.005.MO C L, WU F C, FU Z Y, ZHU J, RAN L. Antimony, arsenic and mercury polluton in agricultural soil of antimony mine area in Xikuangshan, Hunan[J]. Acta Mieralogica Sinica, 2013, 33(3): 344-350. doi: 10.16461/j.cnki.1000-4734.2013.03.005.
[2] 谢李娜,周建伟,郝春明,刘慧林,NYIRENDA M T,鲁槚银,李立刚,朱越. 湘中锡矿山北矿区地下水化学特征及污染成因[J]. 地质科技情报,2016,35(2):197-202.XIE L N, ZHOU J W, HAO C M, LIU H L, NYIRENDA M T, LU J Y, LI L G, ZHU Y. Hydrochemical characteristics and contaminative causes of groundwater in the north area of Xikuangshan Antimany Mine,Hunan Province[J]. Geological Science and Technology Information,2016, 35(2): 197-202.
[3] MEHARG A A. Trace elements in soils and plants[J]. Experimental Agriculture, 2011, 47(4): 739. doi: 10.1201/b10158. doi: 10.1201/b10158.
[4] MCLAREN R G, NAIDU R, SMITH J. Fractionation and distribution of arsenic in soils contaminated by cattle dip[J].Journal of Environment Quality, 1998, 27(2): 348. doi: 10.2134/jeq1998.00472425002700020015x.
[5] NEWBIGGING M A, PALIWODA E R, CHRIS L X. Rice: Reducing arsenic content by controlling water irrigation[J]. Journal of Environmental Sciences, 2015, 30(4): 131-133. doi: 10.1016/j.jes.2015.03.001.
[6] 袁敏,铁柏清,唐美珍. 土壤重金属污染的植物修复及其组合技术的应用[J]. 中南林学院学报,2005(1):81-85. doi: 10.3969/j.issn.1673-923X.2005.01.019.YUAN M, TIE B Q, TANG M Z. Application of phyto-remediation and its combination technologyto remediating heavy-metal contaminated soil[J]. Journal of Central South Forestry University, 2005(1): 81-85.doi: 10.3969/j.issn.1673-923X.2005.01.019.
[7] 宋勇进,张新英,韦业川,熊丹. 基于文献数据的广西不同功能区土壤镉含量特征研究[J]. 广西师范学院学报(自然科学版),2018(4): 1-6.SONG Y J, ZHANG X Y, WEI Y C, XIONG D. Characteristics of cadmium content in soils of different functional areas in Guangxi based on literature data[J]. Journal of Guangxi Teachers Education University:Natural Science Edition, 2018 (4): 1-6.
[8] 郭勇,童艳君. 我国农业土壤重金属污染现状及防治对策[J]. 现代农业科技,2012(18):222-223. doi: 10.3969/j.issn.1007-5739.2012.18.145.GUO Y, TONG Y J. Current situation of heavy metal pollution in agricultural soil in China and its countermeasures[J]. Modern Agricultural Technology, 2012(18): 222-223. doi: 10.3969/j.issn.1007-5739.2012.18.145.
[9] 戴树桂,董亮,王臻. 表面活性剂在土壤颗粒物上的吸附行为[J]. 中国环境科学, 1999(5):392-396. doi: 10.3321/j.issn:1000-6923.1999.05.003.DAI S G, DONG L, WANG Z. Adsorption behavior of surfactant on soil particles[J]. China Environmental Science, 1999(5): 392-396. doi:10.3321/j.issn:1000-6923.1999.05.003.
[10] 廖晓勇,陈同斌,阎秀兰,谢华,肖细元,翟丽梅. 不同磷肥对砷超富集植物蜈蚣草修复砷污染土壤的影响[J]. 环境科学,2008(10):2906-2911. doi: 10.3321/j.issn:0250-3301.2008.10.038.LIAO X Y, CHEN T B, YAN X N, XIE H, XIAO X Y, ZHAI L M. Effects of different phosphate fertilizers on the repair of arsenic-contaminated soil by the arsenic-rich plant centipede[J]. Environmental Science, 2008(10): 2906-2911. doi: 10.3321/j.issn:0250-3301.2008.10.038.
[11] 陈同斌,李海翔,雷梅,武斌,宋波,张学洪. 植物修复过程中蜈蚣草对土壤养分的吸收动态:5年田间定位试验[J]. 环境科学学报,2010(2):402-408.CHEN T B, LI H X, LEI M, WU B, SONG B, ZHANG X H. Dynamics of soil nutrient uptake by centipedes during phytoremediation: 5 years field experiment[J]. Journal of Environmental Science, 2010(2): 402-408.
[12] 李影,刘鹏. Cd胁迫对3种蕨类植物生理代谢及镉累积特性的影响[J]. 水土保持学报,2016(3):128-133. doi: 10.13870/j.cnki.stbcxb.2016.03.023.LI Y, LIU P. Effects of Cd stress on physiological metabolism and cadmium accumulation of three ferns[J]. Journal of Soil and Water Conservation, 2016 (3): 128-133. doi: 10.13870/j.cnki.stbcxb.2016.03.023.
[13] 冯人伟. 植物对砷、硒、锑的富集及抗性机理研究[D]. 武汉:华中农业大学,2009. doi: 10.7666/d.Y1598625.FENG R W. Enrichment and resistance mechanism of arsenic, selenium and antimony in plants[D]. Wuhan: Huazhong Agricultural University,2009. doi: 10.7666/d.Y1598625.
[14] 许嘉琳,鲍子平,杨居荣,刘虹,宋文昌. 农作物体内铅、镉、铜的化学形态研究[J]. 应用生态学报,1991(3):244-248.XU J L, BAO Z P, YANG J R, LIU H, SONG W C. Study on chemical morphology of lead, cadmium and copper in crops[J]. Journal of Applied Ecology, 1991 (3): 244-248.
[15] 吴慧梅,李非里,牟华倩,张慧. 两步连续提取法测定植物中重金属的形态[J]. 环境科学与技术,2012(7):133-137. doi: 10.3969/j.issn.1003-6504.2012.07.030.WU H M, LI F L, MU H Q, ZHANG H. The morphology of heavy metals in plants was determined by two-step continuous extraction method[J]. Environmental Science and Technology, 2012(7): 133-137. doi:10.3969/j.issn.1003-6504.2012.07.030.
[16] TISARUM R, LESSL JT, DONG X. Antimony uptake, efflux and speciation in arsenic hyperaccumulator Pteris Vittata[J].Environmental Pollution, 2014, 186(1): 110-114. doi: 10.1016/j.envpol.2013.11.033.
[17] WAN X,LEI M,YANG J. Two potential multi-metal hyperaccumulators found in four mining sites in Hunan Province, China[J]. Catena, 2017,148(1): 67-73. doi: 10.1016/j.catena.2016.02.005.
[18] 敖明,柴冠群,刘桂华,秦松,范成五. 水稻对镉的吸收与转运规律研究进展[J]. 南方农业,2018,12(24):127-128,131. doi:10.19415/j.cnki.1673-890x.2018.24.068.AO M, CHAI G Q, LIU G H, QIN S, FAN C W. Research progress on cadmium uptake and transport in rice[J]. Southern Agriculture, 2018,12(24): 127-128,131. doi: 10.19415/j.cnki.1673-890x.2018.24.068.
[19] MIHUCZ V G, TATÁR E, KMETHY B. Investigation of the transported heavy metal ions in xylem sap of cucumber plants by size exclusion chromatography and atomic absorption spectrometry[J]. Journal of Inorganic Biochemistry, 2000, 81(1): 81-87. doi: 10.1016/S0162-0134(00)00091-X.
[20] BROOKS R, LEE J, REEVES R. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants[J]. Journal of Geochemical Exploration, 1977, 7(1): 49-57. doi: 10.1016/0375-6742(77)90074-7.
[21] 侯晓龙. 铅超富集植物金丝草对Pb胁迫的响应机制研究[D]. 福州:福建农林大学,2013.HOU X L. Study on response mechanism of Pb stress in hyperlead- enriched auricularia auriculata[D]. Fuzhou: Fujian University of Agriculture and Forestry, 2013.
[22] 杨树深,杨军,杨俊兴,万小铭,雷梅,陈同斌,刘树庆. 土壤添加剂对蜈蚣草吸收转运铅、镉的影响[J]. 生态学杂志,2017,11(6):1650-1657. doi: 10.13292/j.1000-4890.201706.022.YANG S S,YANG J, YANG J X, WAN X M, LEI M, CHEN T B, LIU S S. Effects of soil additives on the uptake and transport of lead and cadmium in centipede grass[J]. Journal of Ecology, 2017, 11(6):1650-1657. doi: 10.13292/j.1000-4890.201706.022.
[23] 韦朝阳,陈同斌,黄泽春,张学青. 大叶井口边草——一种新发现的富集砷的植物[J]. 生态学报,2002,8(5):777-778. doi: 10.3321/j.issn:1000-0933.2002.05.022.WEI C Y, CHEN T B, HUANG Z C, ZHANG X Q. A newly discovered arsenic-rich plant, Esparto macrophylla[J]. Acta Ecologica Sinica,2002, 8(5): 777-778. doi: 10.3321/j.issn:1000-0933.2002.05.022.
[24] 安志装,陈同斌,雷梅,肖细元,廖晓勇. 蜈蚣草耐铅、铜、锌毒性和修复能力的研究[J]. 生态学报,2003,9(12):2594-2598. doi:10.3321/j.issn:1000-0933.2003.12.013.AN Z Z, CHEN T B, LEI M, XIAO X Y, LIAO X Y. Study on the toxicity and repair ability of centipede grass to lead, copper and zinc[J]. Acta Ecologica Sinica, 2003, 9(12): 2594-2598. doi: 10.3321/j.issn:1000-0933.2003.12.013.
[25] 章金鸿,李玫. 植物对金属镉的吸收、分配及其影响因素[J]. 广州环境科学,1999,5(3):28-32.ZHANG J H, LI M. Absorption, distribution and influencing factors of cadmium in plants[J]. Guangzhou Environmental Science, 1999, 5(3): 28-32.
[26] 陈同斌,阎秀兰,廖晓勇,肖细元,黄泽春,谢华,翟丽梅. 蜈蚣草中砷的亚细胞分布与区隔化作用[J]. 科学通报,2005,11(24):2739-2744. doi: 10.3321/j.issn:0023-074X.2005.24.010.CHEN T B, YAN X L, LIAO X Y, XIAO X Y, HUANG Z C, XIE H,ZHAI L M. Subcellular distribution and compartmentalization of arsenic in centipede grass[J]. Chinese Science Bulletin, 2005, 11(24):2739-2744. doi: 10.3321/j.issn:0023-074X.2005.24.010.
[27] 陈亚慧,刘晓宇,王明新,王静,严新美. 蓖麻对镉的耐性、积累及与镉亚细胞分布的关系[J]. 环境科学学报,2014,34(9):265-271. doi: 10.13671/j.hjkxxb.2014.0545.CHEN Y H, LIU X Y, WANG M X, WANG J, YAN X M. The relationship between tolerance, accumulation and distribution of cadmium subcells in castor bean[J]. Journal of Environmental Science, 2014, 34(9): 265-271. doi: 10.13671/j.hjkxxb.2014.0545.
[28] WAN X M, LEI M, CHEN T B. Interaction of As and Sb in the hyperaccumulator Pteris vittata L.: Changes in As and Sb speciation by XANES[J]. Springer Berlin Heidelberg, 2016, 23(19): 19173-19181.doi: 10.1007/s11356-016-7043-0.
[29] 王晓丽. 植物中锑的积累过程及锑与砷的复合作用研究[D]. 武汉:华中农业大学,2012. doi: 10.7666/d.Y2161997.WANG X L. Studies on the accumulation of antimony in plants and the complex action of antimony and arsenic[D]. Wuhan: Huazhong Agricultural University, 2012. doi: 10.7666/d.Y2161997.
[30] 陈秋平,胥思勤,陈洁薇,吴贞术. 晴隆锑矿区植物砷、锑形态分析[J].环境科学与技术,2014,37(8):71-75, 98.CHEN Q P, XU S Q, CHEN J W, WU Z S. Morphological analysis of plant arsenic and antimony in qinglong antimony deposit area[J].Environmental Science and Technology, 2014, 37(8): 71-75, 98.
[31] 陈秋平,胥思勤,陈洁薇,吴贞术. 锑矿区土壤重金属污染及植 物 累 积 特 征[J]. 环 境 科 技,2014(2):1-4. doi: 10.3969/j.issn.1674-4829.2014.02.001.CHEN Q P, XU S Q, CHEN J W, WU Z S. Soil heavy metal pollution and plant accumulation in antimony deposit area[J].Environmental Science and Technology, 2014(2): 1-4. doi: 10.3969/j.issn.1674-4829.2014.02.001.
[32] 丁振华,苏芳莉,孙权. Cd胁迫下芦苇体内氯化钠提取态镉及谷氨酰半胱氨酸合成酶活性研究[J]. 生态与农村环境学报,2018,34(12):1139-1144. doi: 10.11934/j.issn.1673-4831.2018.12.011.DING Z H, SU F L, SUN Q. Study on the activities of cadmium and glutamyl cysteine synthase extracted from reed under the stress of Cd by sodium chloride[J]. Journal of Ecology and Rural Environment,2018, 34(12): 1139-1144. doi: 10.11934/j.issn.1673-4831.2018.12.011.
[33] NISHIZONO H, ICHIKAWA H, SUZIKI S, ISHII F. The role of the root cell wall in the heavy metal tolerance of Athyrium yokoscense[J]. Martinus Nijhoff Publishers, 1987, 101(1): 15-20. doi: 10.1007/bf02371025.