【研究意义】玉米穗粒腐病是世界上普遍发生、危害严重的真菌性病害,严重影响玉米的产量和品质,已逐步上升为玉米生产上的主要病害[1],也是广西最常见的玉米真菌病害之一[2]。玉米穗粒腐病一般品种发病率为5%~10%,感病品种发病率可高达50%左右[3-4]。玉米穗粒腐病致病菌有20多种,在我国主要是由拟轮枝镰孢菌(串珠镰孢菌)[5]和禾谷镰孢菌引起的[6]。选育和种植抗穗腐病玉米品种是最为经济有效的防治方法[1]。近年来,由于异常气候的影响,玉米种植区穗腐病有不断加重趋势。穗粒腐病的抗性已成为玉米品种审定中的一个重要指标,广大育种者应高度重视选育抗穗腐病的玉米品种。因此,深入研究玉米穗腐病的病因、病原菌种类、抗病机制、抗性基因等对创制抗病新材料及培育新品种具有重要意义。
【前人研究进展】近年来,对于玉米穗粒腐病的研究,国内外研究者多侧重于其抗性遗传规律方面。以经典遗传学研究为基础,分子生物学手段的运用为穗粒腐病抗性遗传规律的研究带来了极大的便利。Pérez-Brito等选用来自墨西哥高原的两个抗病自交系分别与同一个感病自交系杂交,构建了分别包含238、206个F2:3家系的2个作图群体,采用针刺法接种鉴定各家系的穗粒腐病抗性,在两个群体中分别找到7个和9个籽粒抗性的QTL,这些QTL中包括两个群体中共有的QTL位点3个(其中1个在第3染色体上,另外2个在第6染色体上),分别可以解释4%~10%的表型变异[7]。Robertson-Hoyt等利用来自美国种质资源的2份抗病材料GE440 和NC300,分别与感病材料FR1064和B104构建了2个作图群体,在抗病自交系GE440和NC300中分别找到7个和5个抗病QTL,分别在第2、4、5染色体上检测到共同的抗病QTL,表型变异贡献率介于4.4%~5.8%之间 [8-9]。张帆等利用抗病材料R15进行穗粒腐病抗性遗传研究,通过多年多点试验,在雅安和绵阳两个点检测到2个共同的抗病QTL(分别位于第6和第9染色体上),分别可以解释 18.7%~26.4% 的表型遗传变异[10]。Ding等检测到位于第3染色体着丝点附近多年多环境间稳定遗传的抗病QTL[11]。Li等利用抗病自交系BT-1和感病自交系N6构建的250个RIL群体进行玉米抗镰孢菌穗粒腐病的QTL定位,发现了分别位于第3、4、5、6染色体上的4个QTL,分别能解释2.5%~10.2%的表型变异[12]。Chen等用抗病自交系BT-1和感病自交系Xi502组配的包含210个家系的F2:3群体对玉米镰孢菌穗粒腐病抗性进行QTL定位,检测到3个QTL,分别位于第4、5、10染色体上,其中位于第4染色体上的QTL能解释17.95%的表型变异。在第4染色体4.05/4.06bin区段,以感病亲本Xi502为轮回亲本获得 的NIL群体中,杂合植株的抗病率比纯合植株提高 33.7%~35.2% [13]。Chen等通过 GWAS方法在3个不同环境下对818份玉米热带材料的穗腐病抗性进行分析,鉴定出与镰孢穗腐病抗性显著相关的SNP位点45个,这些SNP位点对穗粒腐病抗性的效应均表现为较小的加性效应,单个SNP位点的表型变异贡献率分别为1%~4%。整合GWAS分析结果和穗粒腐病抗性QTL分析结果,检测到位于第2、3、4、5、9、10染色体上的8个共同位点(第4、5染色体上分别有2个,其余4条染色体上均为1个),其中第2、9染色体上的位点为新发现位点[14]。Maschietto等用抗性亲本CO441和感病亲本CO354构建的188个F2:3家系对玉米轮枝镰孢菌穗粒腐病的QTL定位和候选基因分析,共检测到15个穗粒腐病抗性QTL,并筛选出24个抗病候选基因[15]。此外,一些研究者也已开展了穗粒腐抗性基因发掘及抗病机制相关的研究。Liu等通过对两个近等基因系转录组的分析,发现了乙烯合成、病程相关蛋白、信号途径基因等与抗病相关的基因[16]。Wang等则通过对侵染拟轮枝镰孢菌的抗感玉米材料进行转录组研究,发现一些中间产物参与了由拟轮枝镰孢菌诱发的穗腐病抗病分子机制,如小分子热激蛋白、次级代谢物、脱落酸、茉莉酸等,为研究穗粒腐病的抗病机制提供了方向[17]。
【本研究切入点】目前广西等南方一年两熟玉米种植区尚未有正式的玉米穗粒腐病抗性QTL定位的相关文献报道。相对一年一熟的玉米种植区,广西等一年两熟玉米种植地区连作程度高[18],且感病敏感期具备适宜发病的温度湿度条件[3],更利于穗粒腐病的发生,且越来越严重,因而对这些区域玉米安全生产的危害更严重。【拟解决的关键问题】在这些地区开展玉米穗粒腐病抗性QTL定位研究,揭示玉米穗粒腐病抗性遗传变异的规律,为这些区域的玉米穗粒腐病抗性育种提供一定的理论依据。
1 材料与方法
1.1 试验材料
以感病自交系掖478(Ye478)为母本、抗病自交系 CML171为父本构建包含215个家系的F2∶3群体为试验材料。掖478和CML171均为本研究室种植观察多年的自交系。掖478是国内穗粒腐病抗性鉴定的感病对照,自然发病相当严重[6,19];CML171则较抗穗粒腐病,接种也感病较轻。
1.2 试验设计
2017年早造在明阳基地试验地种植掖478和CML171,杂交后获得 F1代植株和F2 代种子;同年晚造种植F2,F2群体单株套袋自交获得F2∶3 群体。掖478、CML171和杂交后获得F1代苗期取样提取DNA用于SSR引物的筛选,F2群体苗期取样提取DNA用于多态性SSR引物多态性检测。2017 年晚造在明阳基地试验田种植F2种子,对F2单株进行严格套袋自交获得包含215个家系的F2:3群体进行性状测定并完成QTL定位。2018年早造种植2个亲本,F1及F2:3家系,田间人工接种轮枝镰孢菌,观察记载各家系内各单株的病级。试验采用随机区组设计,2次重复,行长3 m,行宽70 cm,株距25 cm。田间管理标准与普通大田生产相同。
1.3 性状测定
在吐丝后10 d采用针刺法人工接种拟轮枝镰孢菌(Fusarium verticillioides,本所植保研究室杜青分离培养后提供),接种后45 d进行田间抗病性鉴定。抗病性按玉米穗粒腐病抗性全国统一记载标准分单株记载家系内各单株病级。根据病级计算各个家系的病情指数, 抗病指数=1-病情指数。
1.4 SSR分析和QTL分析
苗期分别取两个亲本及其F1、F2各单株幼嫰叶片,参照CTAB法[20]提取叶片DNA;在前人玉米抗穗粒腐病QTL定位研究的基础上,在MaizeGDB网站(http://www.maizegdb.org)的IBM2005图谱中选择均匀覆盖玉米全基因组的452对已发表的SSR分子标记,利用抗、感病亲本筛选多态性好的标记,最终筛选出覆盖全基因组、多态性好的分子标记148对[21],用这些多态性标记对作图群体内各单株进行基因型分析,用于构建遗传连锁图谱;将F2 群体各单株在各多态性标记间的基因型数据按要求整理好,运行Mapmaker 3.0软件,构建遗传连锁图谱[22],根据Mapmaker 3.0的最终结果,用Mapchart 2.3软件绘制连锁图谱[23]。
根据抗病指数计算公式将群体内各家系内各单株的病级转化为各家系的抗病指数,结合构建的遗传连锁图谱,利用winQTLCart 2.5[24]软件中的复合区间作图法进行抗病指数的QTL定位。定位过程中,抗病指数在α= 0.05显著水平下进行500次排列检验,确定其QTL的LOD阈值,软件各主要参数设置如下:窗口大小=10 cM;步长=1 cM;背景控制:正向-反向逐步回归法;背景标记个数:5。计算得到抗病指数QTL的LOD阈值为2.2,从而选择LOD值≥2.2来判断是否存在QTL,并计算各QTL的表型变异贡献率。QTL作用方式依据Stuber等[25]提出的显性度判别标准来确定。
2 结果与分析
2.1 表型数据分析
田间接种鉴定调查结果(表1)表明,抗病亲本CML171抗病指数为0.75,表现为抗;而感病亲本掖478抗病指数为0.33,表现为感;两亲本的抗病性存在明显差异。运用DPS软件V16.05[26]对抗病指数进行统计分析。方差分析结果显示,两重复间差异不显著;215个F2:3家系间差异极显著。对215个F2:3家系抗病指数进行正态分布检验, 发现 F2:3 群体抗病指数正态曲线χ2值不显著,符合正态分布,可用于QTL定位研究。
表1 抗病指数方差分析结果
Table 1 Result of disease resistance index variance analysis

注: **表示差异极显著。
Note: ** represents extremely significant difference.
变异来源Source of variance 平方和SS 自由度DF 均方MS F P基因型Genotype 6.285 214 0.0294 3.382** 0.0001区组间 Block 0.0083 1 0.0083 0.951 0.3306误差 Error 1.8585 214 0.0087总变异Total variance 8.1518 429
2.2 分离群体连锁图谱构建
共筛选出148对抗感亲本间多态性良好的SSR标记,进行 F2分离群体单株基因型分析,最终构建出整合了这148对多态性SSR位点的遗传连锁图谱(图 1)。本研究中所构建的遗传连锁图谱全长1 396.3 cM,标记间的平均间距为9.43 cM。148个标记在10条染色体上的分布并不均匀,以第1染色体标记数目最多(21个)、长度最长(211 cM),第4染色体标记数目则最少(9个)、长度也最短(94.6 cM)。10条染色体上标记间平均间距在6.71 ~12.36 cM之间。标记间平均间距第9染色体上最小(6.71 cM),第7染色体上最大(12.36 cM)。该连锁图谱存在2个间距较大的区间(大于30 cM),分别是第3染色体的umc1489~umc2081间和第5染色体的bnlg1700~phi109188间。各标记在各染色体上的顺序与IBM2005图谱基本一致。

图1 F2分离群体遗传连锁图谱
Fig.1 Genetic linkage map of F2 population
2.3 抗病指数QTL定位结果及效应分析
采用复合区间作图法对F2:3群体各家系抗病指数进行QTL检测和基因效应分析,共检测到分别位于第2、3、10染色体上的抗病QTL3个(图2,表2),其标记区间分别为phi96100~umc1555、umc1399~umc1489和umc1380~phi083。单个QTL的表型贡献率为4.6%~6.6%。基因作用方式分别为超显性、超显性和部分显性。各QTL的加性效应值有正有负,说明抗感亲本中均含有微效抗病基因。
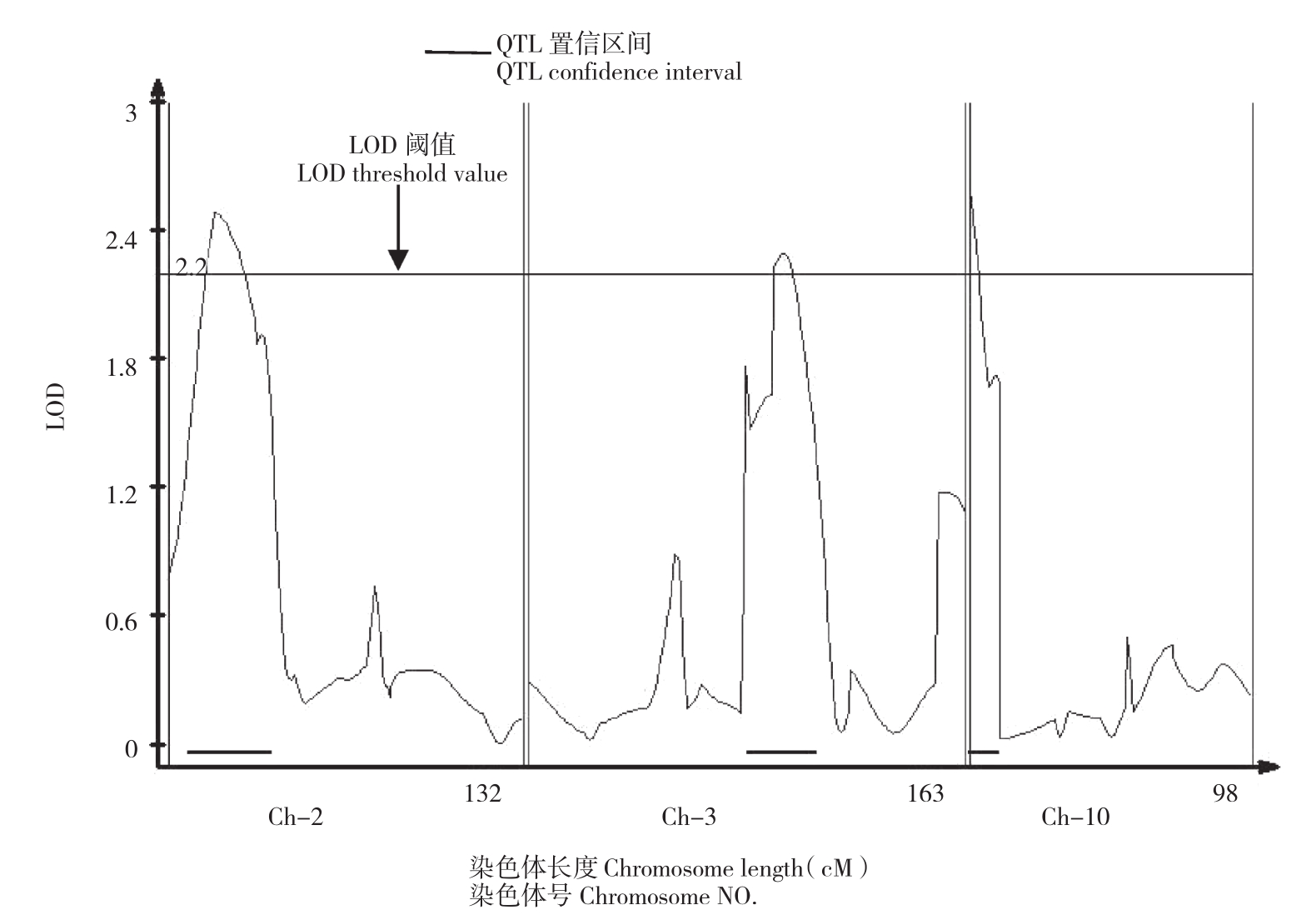
图2 抗病指数QTL在染色体上的分布情况
Fig.2 Distribution of disease resistance index QTL on chromosomes
表2 抗病指数QTL分析
Table 2 QTL analysis of disease resistance index
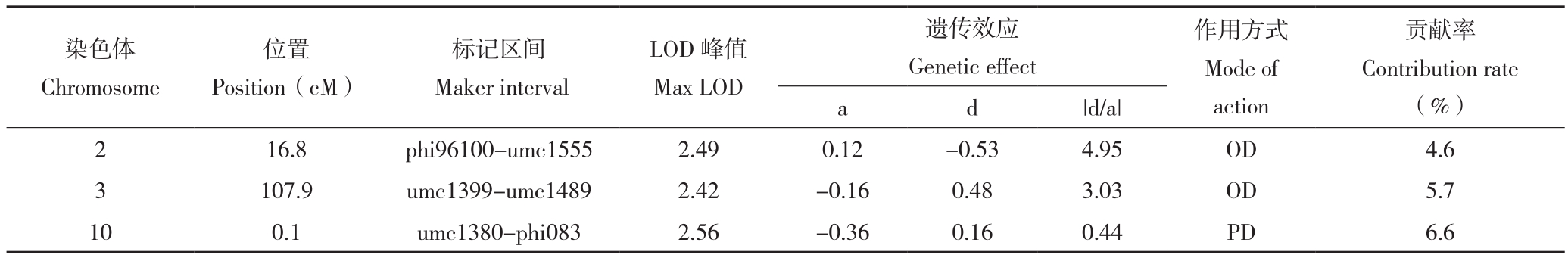
注:a 为加性效应值,d为显性效应值,|d/a|为显性势; A:加性(显性势=0~ 0.2);PD:部分显性(显性势=0.21~0.80);D:显性(显性势=0.81~1.20);OD:超显性(显性势>1.2)。
Note: a:additive effect value, d:dominant effect, |d/a|: dominant degree; A:additive(dominant degree =0-0.20);PD: partial dominance(dominant degree=0.21-0.80);D: dominance(dominant degree =0.81-1.20);OD: over-dominance(dominant degree>1.20).
染色体Chromosome位置Position(cM)标记区间Maker interval LOD峰值Max LOD遗传效应Genetic effect作用方式Mode of action贡献率Contribution rate(%)a d |d/a|2 16.8 phi96100-umc1555 2.49 0.12 -0.53 4.95 OD 4.6 3 107.9 umc1399-umc1489 2.42 -0.16 0.48 3.03 OD 5.7 10 0.1 umc1380-phi083 2.56 -0.36 0.16 0.44 PD 6.6
3 讨论
3.1 玉米抗穗粒腐病遗传连锁图谱的构建
对比前人抗穗粒腐病QTL定位研究发现,连锁图谱的构建大多以经典的F2分离群体为主[7-10,14-15],也有用RIL群体等稳定群体的报道[11-12]。本研究连锁图谱的构建采用F2分离群体。相对其他稳定的群体,F2群体具有构建方法简单、构建周期短等优势,是进行初级定位的首选。但其定位的精度较低,不适合精细定位等研究。前人的抗穗粒腐病QTL定位研究以SSR标记为主,也有AFLP、RFLP或SNP标记等与SSR标记相结合的报道[10,15],本研究选用SSR标记构建连锁图谱。SSR标记在玉米染色体组上的分布较广,数量较多,检测方式相对简单,成本较低,是QTL定位研究的理想标记。但其也存在一些缺点,如其基因型检测自动化程度不高、在染色体组上分布不均,有些区域存在较大的间隔(大于30 cM),大大降低了QTL的检出效率和检出机率。近年来,测序技术和基因芯片技术日趋成熟,为SNP标记的开发和自动化检测提供了技术保障。与SSR标记相比,SNP标记在玉米染色体组上的分布更广,数量更多且分布率极高,检测自动化程度高,检测成本也越来越低[27],必将在QTL定位研究中逐渐取代SSR标记。前人类似的研究结果显示,虽然研究者所用标记的类型和数量各不相同,所构建的遗传连锁图谱的总长度也不相同,但标记间的平均图距大多为10 cM左右[10-11,13]。本研究构建的连锁图谱标记数目、图谱全长与Chen等[13]的研究相当,平均图距9.43 cM,满足初级QTL定位的基本条件。
3.2 玉米抗穗粒腐病QTL分析
前人的QTL定位结果表明,在不同的环境条件下,不同群体玉米抗穗粒腐病QTL在玉米10条染色体上均有分布,相同染色体上不同研究所定位到的QTL位置也不尽相同,各QTL对表型的贡献率也不尽相同[7-15]。由此可见,玉米穗粒腐病抗性是一个极其复杂的、受微效多基因控制的数量性状。相对于同类研究,本研究中仅仅定位到3个效应较小的QTL,还有很多QTL没有定位到,其主要原因可能在于:染色体的某个区段虽存在穗粒腐病抗性的QTL,但亲本CML171和掖478在该QTL的等位基因差异不显著;或者两亲本在该QTL的等位基因存在显著差异,但其遗传效应较小,易受环境影响而无法检测到,亦或是该QTL位点未与所检测到的多态性分子标记连锁。另外,表型鉴定的误差也会对QTL的检出有较大的影响。
前人的研究还表明,玉米穗粒腐病抗性QTL易受群体和环境条件影响。要检测到稳定的QTL位点,可采用不同群体在相同环境条件下进行QTL分析,尽量减小环境条件的误差,以不同群体定位到的共同QTL作为最终的QTL位点;也可以采用相同的群体在不同的环境条件下进行QTL分析,以减小群体对定位结果的影响,以不同环境条件下的共同QTL作为最终的定位结果。因此,在类似的QTL定位研究中,我们必须进行多年多点的表型鉴定,以便能检测到稳定QTL位点。
4 结论
本研究以抗病自交系CML171和感病自交系掖478构建的F2群体为作图群体,构建了全长1 396.3 cM的遗传连锁图谱,标记间平均遗传距离为9.43 cM。结合F2:3家系的抗病指数数据,共检测到位于第2、3、10染色体上的穗粒腐病抗病指数QTL3个,分别可以解释4.6%、5.7%和6.6%的表型变异。基因作用方式分别为超显性、超显性和部分显性。单个QTL的表型贡献率均较小,为微效QTL。未检测到主效QTL。
[1] 李辉,向葵,张志明,袁广胜,潘光堂.玉米穗腐病抗性机制及抗病育种研究进展[EB/J].http://kns.cnki.net/kcms/ detail/22.1201.S.20180702.1704.012.html.LI H ,XIANG K, ZHANG Z M, YUAN G S, PAN G T.Research progress on ear rot resistant mechanism and resistant breeding of maize[EB/J].http://kns.cnki.net/kcms/ detail/22.1201.S.20180702.1704.012.html.
[2] 杜青,唐照磊,李石初,上官玲玲,李华娇,段灿星.广西玉米穗腐病致病镰孢种群构成与产毒基因型分析[J].中国农业科学,2019,52(11):1885-1907.doi:10.3864/j.issn.0578-1752.2019.11.005.DU Q,TANG Z L,LI SC,SHANGGUAN L L, LI H J,DUAN C X.Composition of Fusarium species causing maize ear rot and analysis of toxigenic genotype in Guangxi[J].Scientia Agricultura Sinica,2019,52(11):1885-1907.doi:10.3864/j.issn.0578-1752.2019.11.005.
[3] 张艳,谭静.玉米穗粒腐病的研究进展[J].现代农业科技,2014(21):121-122,125.ZHANG Y, TAN J.Research progress on ear rot in maize[J].Modern Agricultural Science &Technology,2014(21):121-122, 125.
[4] 段灿星,王晓鸣,宋凤景,孙素丽,周丹妮,朱振东.玉米抗穗腐病研究进展[J].中国农业科学,2015,48(11):2152-2164.doi: 10.3864/j.issn.0578-1752.2015.11.007.DUAN C X, WANG X M, SONG F J, SUN S L, ZHOU D N, ZHU Z D.Advances in research on maize resistance to ear rot[J].Scientia Agricultura Sinica,2015,48(11):2152-2164 doi: 10.3864/j.issn.0578-1752.2015.11.007.
[5] PAMPHILE J A, AZEVEDO J A.Molecular characterization of endophytic strains of Fusarium verticillioides(=Fusarium monoliforme)from maize (Zea mays.L)[J].Word Journal of Microbiology&Biotechnology,2002,18:391-396.doi:10.1023/A:1015507008786.
[6] 邹成佳,崔丽娜,章振羽,张小飞,李荣进,陈耕,李晓.玉米自交系对轮枝镰孢菌穗腐病的抗性评价[J].西南农业学报,2017,30(6): 1346-1349.doi:10.16213 /j.cnki.scjas.2017.6.019.ZOU C J, CUI L N,ZHANG Z Y,ZHANG X F,LI R J,CHEN G,LI X.Evaluation of maize inbred lines for resistance to Fusarium verticillioides ear rot[J].Southwest China Journal of Agricultural Sciences,2017,30(6):1346-1349.doi: 10.16213 /j.cnki.scjas.2017.6.019.
[7] PEREZ-BRITO D, JEFFERS D, GONZALEZ-DE-LEON D,KHAIRRALLAH M, CORTES-CRUZ, VELAZQUEZ-CARDELAS G, AZPIROZ-RIVERO S, GANESAN SRINIVASAN.QTL mapping of Fusarium moniliforme ear rot resistance in highland maize, Mexico[J].Agrociencia, 2001, 35(2):181-196.
[8] ROBERTSON-HOYT L A, JINES M P, BALINT-KURTI P J,KLEINSCHMIDT C E,WHITE D G, PAYNE G A, MARAGOS C M,MOLNAR T L, HOLLAND J B.QTL mapping for Fusarium ear rot and fumonisin contamination resistance in two maize populations[J].Crop Science, 2006, 46: 1734-1743.
[9] ROBERTSON-HOYT L A, KLEINSCHMIDT C E,WHITE D G,PAYNE G A, MARAGOS C M, MOLNAR T L, HOLLAND J B.Relationships of resistance to Fusarium ear rot and fumonisin contamination with agronomic performance of maize[J].Crop Science,2007, 47: 1770-1778.
[10] 张帆,万雪琴,潘光堂.玉米抗穗粒腐病QTL定位[J].作物学报,2007,33(3): 491-496.ZHANG F,WAN X Q,PAN G T.Molecular mapping of QTL for resistance to maize ear rot caused by Fusarium moniliforme[J].Acat Agronimica Sinica,2007,33(3): 491-496.
[11] DING J Q, WANG X M, CHANDER S, YAN J B, LI J S.QTL mapping of resistance to Fusarium ear rot using a RIL population in maize[J].Mol Breeding, 2008, 22: 395-403.doi:10.1007/s11032-008-9184-4.
[12] LI Z M, DING J Q, WANG R X, CHEN J F, SUN X D, CHEN W, SONG W B,DONG H F, DAI X D, XIA Z L, WU J Y.A new QTL for resistance to Fusarium ear rot in maize[J].Journal of Applied Genetics, 2011,52(4):403-406.doi:10.1007/s13353-011-0054-0.
[13] CHEN J F, DING J Q, LI H M, SUN X D, LI J J, WANG R X, DAI X D, DONG H F, SONG W B, CHEN W, XIA Z L,WU J Y.Detection and verification of quantitative trait loci for resistance to Fusarium ear rot in maize[J].Mol Breeding,2012,30:1649-1656.doi: 10.1007/ s11032-012-9748-1.
[14] CHEN J F, SHRESTHA R, DING J Q, ZHENG H J, MU C H, WU J Y,MAHUKU G.Genome-wide association study and QTL mapping reveal genomic loci associated with Fusarium ear rot resistance in tropical maize germplasm[J].G3: Genes, Genomes, Genetics, 2016, 6: 3803-3815.doi: 10.1534/g3.116.034561.
[15] MASCHIETTO V,COLOMBI C, PIRONA R, PEA G, STROZZI F, MAROCCO A, ROSSINI L, LANUBILE A.QTL mapping and candidate genes for resistance to Fusarium ear rot and fumonisin contamination in maize[J].BMC Plant Biology, 2017, 17 :20-40.doi:10.1186/s12870-017-0970-1.
[16] LIU Y J, GUO Y L, MA C Y, ZHANG D F, WANG C, YANG Q.Transcriptome analysis of maize resistance to Fusarium graminearum[J].BMC Genomics, 2016, 17: 477-489.doi: 10.1186/s12864-016-2780-5.
[17] WANG Y, ZHOU Z, GAO J, WU Y, XIA Z, ZHANG H, WU J.The mechanisms of maize resistance to Fusarium verticillioides by comprehensive analysis of RNA-seq data[J].Frontiers in Plant Science, 2016, 7:1654.doi: 10.3389/fpls.2016.01654.
[18] 耿贵,杨瑞瑞,於丽华,吕春华,李任任,王宇光.作物连作障碍研究进展[J].中国农学通报,2019,35(10):36-42.GENG G,YANG R R,YU L H,LV C H,LI R R,WANG Y G.Crop Continuous Cropping Obstacles: Research Progress[J].Chinese Agricultural Science Bulletin,2019,35(10):36-42.
[19] 郭成,郭满库,魏宏玉,郭建国.玉米种质资源抗穗腐病鉴定[J].江西农业学报,2015,27( 1) : 50-52.doi:10.19386/j.cnki.jxnyxb.2015.01.014.GUO C,GUO MK,WEI HY,GUO JG.Identification of resistance of maize germplasm resources to ear rot[J].Acta Agriculturae Jiangxi,2015, 27(1) : 50-52.doi:10.19386/j.cnki.jxnyxb.2015.01.014.
[20] 楚海娇.玉米基因组DNA不同提取方法及提取部位的比较研究[J].农业与技术,2016,36(23):30-32.CHU H J.Comparison of different genomic DNA extraction methods to different tissues in maize[J].Agriculture and technology, 2016,36(23):30-32.
[21] LIU Y,GUO J,ZHANG DM,ZHAO Y,ZHU L,HUANG Y,CHEN J.Genetic diversity and linkage disequilibrium estimation among the maize breeding germplasm for association mapping[J].International Journal of Agriculture and Biology,2014,16(5):851-861.
[22] 邢光南,赵团结,盖钧益.关于Mapmaker遗传作图中标记分群和排序操作技术的讨论[J].作物学报,2008,34(2):217-223.doi:10.3724/SP.J.1006.2008.00217.XING G N, ZHAO T J, GAI J Y.Application technique of marker grouping and ordering in genetic linkage map construction using mapmaker[J].Acta Agronomica Sinica,2008, 34(2): 217-223.doi:10.3724/SP.J.1006.2008.00217.
[23] VOORRIPS R E.MapChart: Software for the graphical presentation of linkage maps and QTLs[J].The Journal of Heredity,2002,93 (1): 77-78.doi:10.1093/jhered/93.1.77.
[24] WANG S, BASTEN C J, ZENG Z B.Windows QTL Cartographer 2.5 Department of Statistics.Raleigh: North Carolina State University, 2006[EB/OL].http://statgen.ncsu.edu/ qtlcart/WQTLCart.htm.
[25] STUBER C W,EDWARDS M D,WENDEL J F.Molecular marker-facilitated investigations of quantitative trait loci in maize:Factors influencing yield and its component traits[J].Crop Science,1987,27:639-648.
[26] TANG Q Y, ZHANG C X.Data processing system (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research[J].Insect Science,2012,20(2):254-260.doi:10.1111/j.1744-7917.2012.01519.x.
[27] 宁洽,刘文国,杨伟光,路明.SNP标记在玉米研究上的应用进展[J].玉米科学,2017,25(1):57-61.doi: 10.13597/j.cnki.maize.science.20170110.NING Q, LIU WG, YANG W G, LU M.Progress and application of SNP markers in maize[J].Journal of Maize Sciences,2017,25(1):57-61.doi: 10.13597/j.cnki.maize.science.20170110.