【研究意义】双生病毒科(Geminiviridae)拥有400多种植物病毒,主要分布在热带和亚热带地区,能够侵染木瓜、棉花、豆类和蔬菜等经济作物,导致巨大的经济损失。Geminiviridae病毒为单链DNA病毒,有单组份和双组份两种,主要有菜豆金色花叶病毒属(Begomovirus)、玉米线条病毒属(Mastrevirus)、甜菜曲顶病毒属(Becurtovirus)、曲顶病毒属(Curtovirus)、番茄伪曲顶病毒属(Topocuvirus)、芜菁曲顶病毒属(Turncurtovirus)、画眉草线条病毒属(Eragrovirus)、冠状病毒属(Capulavirus)和葡萄藤红斑病毒属(Grablovirus)等9个属,主要通过烟粉虱、叶蝉、树虱和蚜虫等昆虫传播[1]。桑花叶型萎缩病相关病毒(Mulberry Mosaic Dwarf associated Virus,MMDaV)和橘褪绿矮缩相关病毒(Citrus Chlorotic Dwarf associated Virus,CCDaV)是两种木本双生病毒,具有独特的基因组结构,但因未明确其媒介昆虫和病毒粒子形态,所以将它们归为未定属[2]。桑花叶型萎缩病相关病毒(MMDaV)是在皱缩和花叶状的桑叶中发现,并未确定该病毒与桑花叶型萎缩病具有相关性[3]。桑花叶型萎缩病主要导致桑树植株矮化,叶片皱缩畸形并存在褪绿斑等症状,在我国各蚕区普遍发生且危害严重[4]。但是由于柯赫氏法则验证困难,至今还未能确定MMDaV与桑花叶型萎缩病之间的关系。【前人研究进展】对于双生病毒CCDaV,已有实时荧光定量PCR[5]和环介导等温核酸扩增技术(LAMP)[6]两种检测方法检测CCDaV,可对CCDaV进行快速定量和可视化的检测。而针对MMDaV,虽然已建立了PCR[7]以及核酸斑点杂交(nucleic acid spot hybridization,NASH)检测技术[8]检测MMDaV,但这些方法无法对MMDaV进行快速定量检测。【本研究切入点】与PCR 相比,实时荧光定量PCR具有特异性强、灵敏度高、可定量和快速等特点,在植物病害检测上具有广泛的应用[9]。本研究以MMDaV保守的外壳蛋白基因序列为引物设计靶点,构建有效的MMDaV实时荧光定量PCR检测方法,并以广东、广西、海南、重庆、陕西和江西采集的桑病叶样品为检测对象,验证MMDaV实时荧光定量PCR检测方法的有效性。【拟解决的关键问题】快速定量的检测桑树中的MMDaV,能进一步用于桑树、MMDaV和昆虫三者间互作关系的研究。
1 材料与方法
1.1 试验材料
带有皱缩和花叶状的桑病叶材料(图1)采集于广东、广西、海南、重庆、陕西和江西等地,样品信息见表1。桑叶污叶病病原真菌桑球针壳(Phyllactinia moricola)和桑叶常见真菌疣孢青霉(Penicillium verruculosum),桑椹菌核病病原真菌肉阜状杯盘菌(Ciboria carunculoides),桑树青枯病病原细菌茄科劳尔式菌(Ralstonia solanacearum),桑树青枯病病原细菌假单胞菌(Pseudomonadaceae spp.)和阴沟肠杆菌(Enterobacter cloacae sp.),家蚕微粒子病病原家蚕微孢子(Nosema bombycis)和家蚕白僵病病原真菌白僵菌(Beauveriabassiana)保存于华南农业大学亚太地区蚕桑培训中心微生物实验室。

图1 桑花叶型萎缩病症状
Fig.1 Symptom of mulberry mosaic dwarf disease
A:患桑花叶型萎缩病的桑树,矮小簇生;
B:皱缩状桑叶,边缘存在褪绿斑
A:Mulberry tree with short clusters suffering from mulberry mosaic dwarf disease;
B:Crinkled mulberry leaf with chlorotic spots on the edge
1.2 CTAB法抽提植物基因组DNA
在CTAB法提取植物DNA[10]的基础上,为提高DNA的纯度,在加入600 mL异丙醇后,将全部液体吸入核酸纯化吸附柱套件中,12 000 r/min离心30 s过滤,弃滤液;加入70%乙醇500 μL洗涤,12 000 r/min离心30 s,弃滤液,洗涤2次,最后空离1次;将吸附柱放置于新的1.5 mL EP管中,加50 μL ddH2O,12 000 r/min离心30 s获得桑叶总DNA。
1.3 引物的设计与合成
NCBI上获得桑花叶型萎缩病相关病毒的全基因组序列(KP303687.1)为靶序列,筛选扩增外壳蛋白基因序列引物MCP581F/MCP1464R,并以保守外壳蛋白基因为靶序列,设计特异实时荧光定量PCR检测引物MCP981F/MCP1148R。MMDaV外壳蛋白基因的PCR检测引物MCP746F/MCP1148R[7]用于对照,以上引物序列信息见表2。
表1 各地桑病叶样品信息
Table 1 Information of diseased mulberry leaf sample

采集时间Collection time 采集地点Collection site 代号Code 2017-07-10 广东省英德市大站镇英德蚕种场 GDYD 2017-07-17 广西区宾阳县宾阳县古辣镇 GXBY 2017-07-18 广西区柳城县冲脉镇 GXLC 2017-07-19 广西区柳城县凤山镇 GXFS 2017-08-03 海南省琼中黎族苗族自治县红毛镇 HNQZ 2017-08-05 海南省白沙黎族自治县打安镇 HNZZ 2017-08-06 海南省昌江黎族自治县石碌镇 HNCJ 2017-08-12 广东省连南瑶族自治县三排镇 GDLN 2017-08-15 广东省化州市那务镇 GDHZ 2017-04-18 广东省广州市天河区华南农业大学桑园 GDTH 2017-10-27 重庆市埑江县沙坪镇 CQDJ 2017-10-29 重庆市北培区西南大学 CQXN 2018-09-13 陕西省安康市汉滨区安康学院 SXAK 2018-09-13 江西省南昌县黄马乡蚕桑茶研究所 JXNC
表2 引物信息
Table 2 Primer information
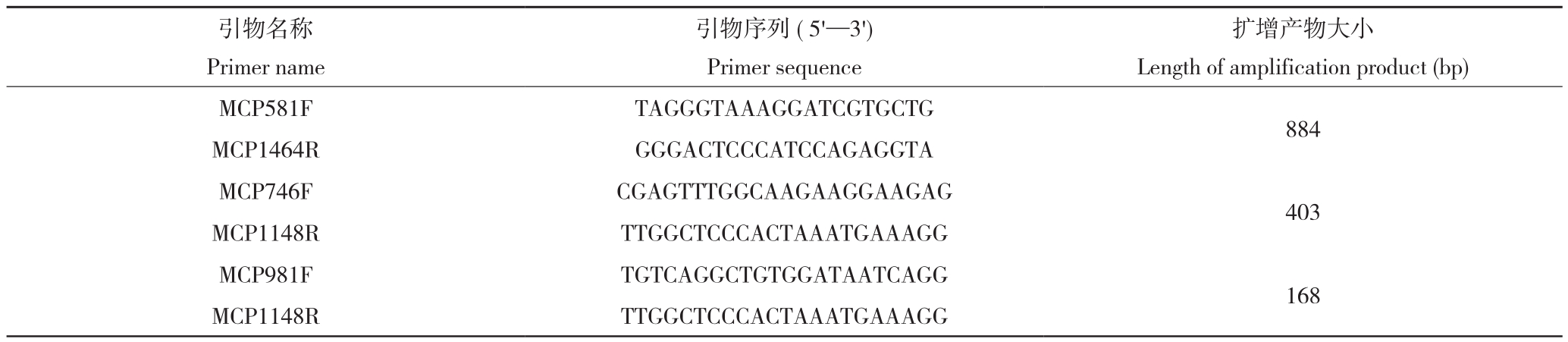
引物名称Primer name引物序列( 5'—3')Primer sequence扩增产物大小Length of amplification product (bp)MCP581F TAGGGTAAAGGATCGTGCTG 884 MCP1464R GGGACTCCCATCCAGAGGTA MCP746F CGAGTTTGGCAAGAAGGAAGAG 403 MCP1148R TTGGCTCCCACTAAATGAAAGG MCP981F TGTCAGGCTGTGGATAATCAGG 168 MCP1148R TTGGCTCCCACTAAATGAAAGG
1.4 构建阳性质粒
以皱缩和花叶状的桑病叶总DNA为模板,使用引物MCP581F/MCP1464R扩增包含病毒外壳蛋白基因序列。反应体系(20 μL):北京擎科生物科技有限公司金牌PCR Mix(TSE101) 10 μL,ddH2O 7 μL,桑病叶总DNA模板2 μL,上下游引物各0.5 μL,PCR条件为98 ℃预变性30 s,98 ℃变性 8 s,58 ℃退火 30 s,72 ℃延伸 20 s,35个循环,最后72℃延伸10 min。扩增目的条带使用TaKaRa胶回收试剂盒(MiniBEST Agarose Gel DNA Extraction Kit)纯化,纯化的片段使用北京全式金生物有限公司克隆试剂盒pEASYBlunt Cloning Kit(CB101)构建阳性质粒,使用生工SanPrep柱式质粒DNA小量抽提试剂盒(B518191-0050)提取质粒,质粒浓度使用分光光度计检测。将质粒浓度计算成拷贝数计数,计数公式:拷贝数=(6.02×1023×质粒质量)/(碱基数×660)。本实验以1.93×109 copies/μL为初始浓度进行10倍梯度稀释。
1.5 实时荧光定量PCR引物检测
PCR特异性检测以皱缩和花叶状的桑病叶、桑球针壳(P.moricola)、肉阜状杯盘菌(C.carunculoides)、白僵菌(B.bassiana)、疣孢青霉(P.verruculosum)、茄科劳尔式菌(R.solanacearum)、假单胞菌(P.spp.)、阴沟肠杆菌(E.cloacae sp.)、家蚕微孢子(N.bombycis)和健康桑叶总DNA为模板对引物的特异性进行验证。PCR灵敏度检测将质粒浓度从1.93×106copies/μL到1.93×101copies/μL以10倍稀释作为模板进行检测。检测引物反应体系(20 μL):2×Taq Master Mix(Microanalysis Inc)10 μL,ddH2O 7 μL,DNA 模板 2 μL,上下游引物各0.5 μL,PCR条件:95 ℃预变性5 min,95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸10 s,35个循环,最后72 ℃延伸10 min。扩增的片段经1.2%琼脂糖凝胶电泳检测。
实时荧光定量PCR特异性检测的DNA模板参照PCR检测模板,其灵敏度检测将阳性质粒从1.93×105 copies/μL 到 1.93×101 copies/μL 浓 度以10倍梯度稀释制成标准参照液,每个浓度重复检测3次。反应体系(20 μL),SYBR Green Realtime PCR Master Mix(QPK-201,东 洋 纺 生物有限公司)10 μL,ddH2O 7 μL,DNA模板2 μL,上下游引物各0.5 μL,实时荧光定量PCR条件:95℃预变性5 min,95℃变性10 s,60 ℃退火15 s,72 ℃延伸10 s,35个循环。仪器为MYGOmini荧光定量PCR仪(3OY-XT4-7NN,IT-IS Life Science Ltd)。
2 结果与分析
2.1 构建MMDaV阳性质粒
扩增获得包含MMDaV外壳蛋白基因的序列,成功构建MMDaV外壳蛋白基因克隆质粒MCP14-pEASY-Blunt,质粒中包含外壳蛋白基因长度为884bp,NCBI上blast仅对比到桑花叶型萎缩病相关病毒(KR131749.1),最大相似率为97.96%。
2.2 检测引物PCR的特异性及灵敏性检测
检测引物MCP981F/MCP1148R的PCR特异性及灵敏度(图2)。特异性检测结果除了花叶皱缩状的桑病叶总DNA及阳性质粒存在大小为168 bp左右的目的条带,其他参照样品和阴性对照均无目的条带,说明该引物的PCR特异性良好。灵敏度检测结果质粒浓度从1.93×106 copies/μL到1.93×103 copies/μL存在明显条带,其余泳道无条带,说明该引物的PCR最低检测限为1.93×103 copies/μL。

图2 引物特异性及灵敏性PCR检测
Fig.2 PCR detection for specificity and sensitivity of primers
M:500bp Marker,1:华南农业大学桑园病桑样品,2:桑球针壳,3:肉阜状杯盘菌,4:白僵菌,5:疣孢青霉,6:茄科劳尔式菌,7:假单胞菌,8:阴沟肠杆菌,9:家蚕微孢子,10:健康桑叶,11:质粒(阳性对照),12:水(空白对照),13:1.93×106copies/μL,14:1.93×105copies/μL,15:1.93×104copies/μL,16:1.93×103copies/μL,17:1.93×102copies/μL,18:1.93×101copies/μL,19:水(空白对照)
M:500bp Marker,1:diseased mulberry leaf samples from South China Agricultural University,2:P.Moricola,3:C.carunculoides,4:B.bassiana,5:P.verruculosum,6:R.solanacearum,7:Pseudomonadaceae,8:E.cloacae,9:N.bombyci,10:Health mulberry leaf,11:Plasmid(positive control),12:Water(blank control),13:1.93×106copies/μL,14:1.93×105copies/μL,15:1.93×104copies/μL,16:1.93×103copies/μL,17:1.93×102copies/μL,18:1.93×101copies/μL,19:water(blank control)
2.3 实时荧光定量PCR标准曲线
成功构建阳性质粒标准曲线,从荧光曲线(图3)可以看出,不同浓度之间存在明显的梯度,且重复性良好。以质粒浓度为横坐标,3次Cq平均值为纵坐标制作标准曲线(图4),结果浓度与Cq值之间线性关系良好,标准曲线为y = -3.3739x + 33.083,其 中 R2 = 0.9992,斜 率为 -3.3739,扩增效率(E=10^(-1/标准曲线斜率)-1)为97.88%。以Cq值≤30的作为检测敏感区间,检测的最低有效质粒浓度为8 copies/μL。
2.4 实时荧光定量PCR特异性检测
对该引物的实时荧光定量PCR检测的特异性进行验证,结果(图5)除了对阳性质粒和花叶皱缩状的桑病叶检测出现曲线,其他样品均未出现曲线,说明该引物在实时荧光定量PCR检测上的特异性良好。
2.5 实时荧光定量PCR检测各地样品
使用构建的实时荧光定量PCR检测方法对采集于广东、广西、海南、重庆、陕西和江西等6个省区花叶皱缩状的桑病叶样品进行检测。对比引物MCP746F/MCP1148R的PCR检测与实时荧光定量PCR检测,结果(图6)PCR对各地桑病叶样品检测均有条带,条带强弱不一,实时荧光定量PCR对各地桑病叶样品检测 均有相应的曲线(图7),检测的Cq值在9.69~26.17之间。并且实时荧光定量PCR与普通PCR电泳条带强弱程度存在对应的Cq值,普通PCR条带亮度强的,其实时荧光定量PCR检测的Cq值越小,反之越大。说明实时荧光定量PCR对各地桑病叶样品均具检测结果,且检测结果稳定可靠且可量化。

图3 不同浓度质粒的实时荧光定量PCR
Fig.3 The real-time fluorescence quantitative PCR for plasmids with different concentrations
1~16为质粒浓度 1.93×105copies/μL到 1.93×101copies/μL以 10倍稀释梯度,每个梯度3次重复的Cq曲线,分别为1~3:1.93×105copies/μL,4~6 :1.93×104copies/μL,7~9:1.93×103copies/μL,10~12:1.93×102copies/μL,13~15:1.93×101copies/μL,16:水(空白对照)
1-16:The Cq curves of plasmid concentration from 1.93×105copies/μL to 1.93×101copies/μL with 10 time-fold dilution gradient and three repeats,1-3:1.93×105copies/μL,4-6:1.93×104copies/μL,7-9:1.93×103copies/μL,10-12:1.93×102copies/μL,13-15:1.93×101copies/μL,16:water(blank control)
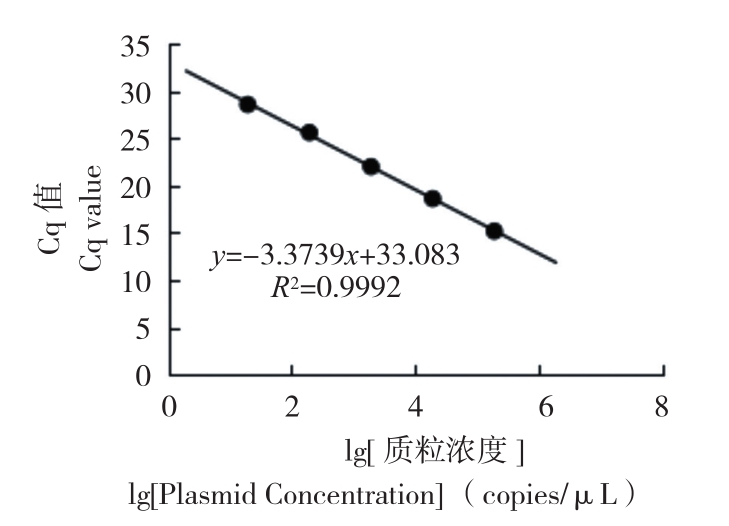
图4 标准曲线
Fig.4 Standard curve

图5 引物实时荧光定量PCR特异性验证
Fig.5 Real-time fluorescence quantitative PCR for primer-specific detection
1~6、9~14为不同DNA模板的检测曲线,1:华南农业大学桑园病桑样品,2:桑球针壳,3:肉阜状杯盘菌,4:白僵菌,5:疣孢青霉,6:茄科劳尔式菌,9:假单胞菌,10:阴沟肠杆菌,11:家蚕微孢子,12:健康桑叶,13:质粒(阳性对照),14:水(空白对照)
1-6,9-14 The detection curves for different DNA templates,1:Diseased mulberry leaf samples from South China Agricultural University,2:P.Moricola,3:C.carunculoides,4:B.bassiana,5:P.verruculosum,6:R.solanacearum,9:Pseudomonadaceae,10:E.cloacae,11:N.bombyci,12:Healthy mulberry leaf,13:plasmid(positive control),14:water(blank control)
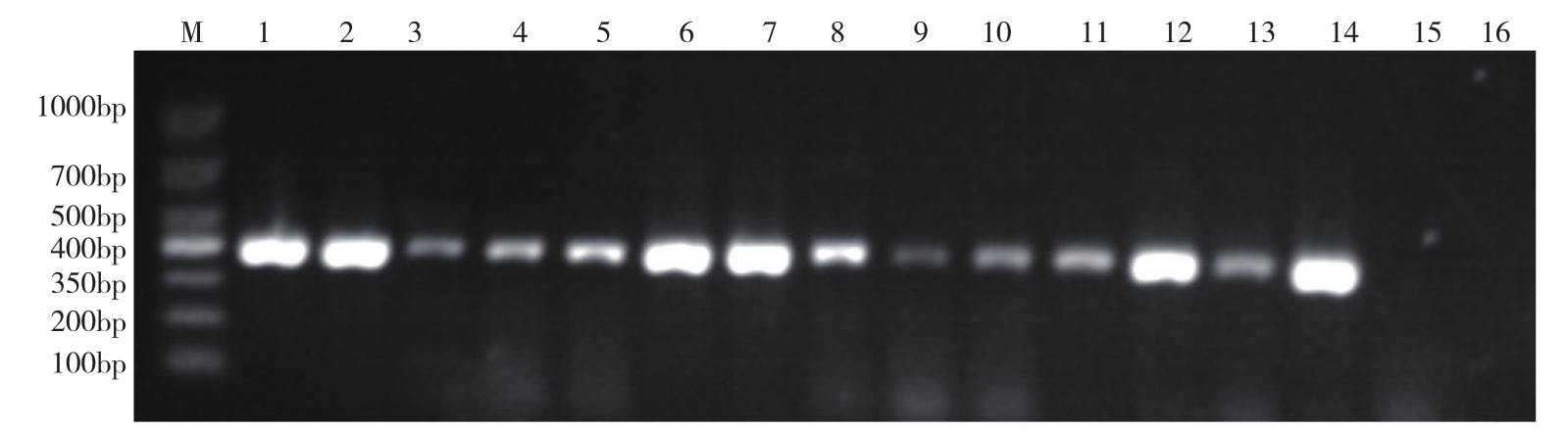
图6 各地样品PCR检测电泳结果
Fig.6 PCR detection results of samples from different provinces
M:TaKaRa DL500 Marker,1~16为不同 DNA 模板的电泳泳道,1:GQDJ,2:CQXN,3:GDYD,4:GDHZ,5:GDLN,6:GXBY,7:GXLC,8:GXFS,9:HNZZ,10:HNCJ,11:HNQZ,12:SXAK,13:JXNC,14:质粒(阳性对照),15:表现健康桑叶,16:水(空白对照)
M:TaKaRa DL500 Marker,1-16:Electrophoresis lanes of different DNA templates,1:GQDJ,2:CQXN,3:GDYD,4:GDHZ,5:GDLN,6:GXBY,7:GXLC,8:GXFS,9:HNZZ,10:HNCJ,11:HNQZ,12:SXAK,13:JXNC,14:Plasmid(positive control),15:Healthy mulberry leaf,16:Water(blank control)
3 讨论
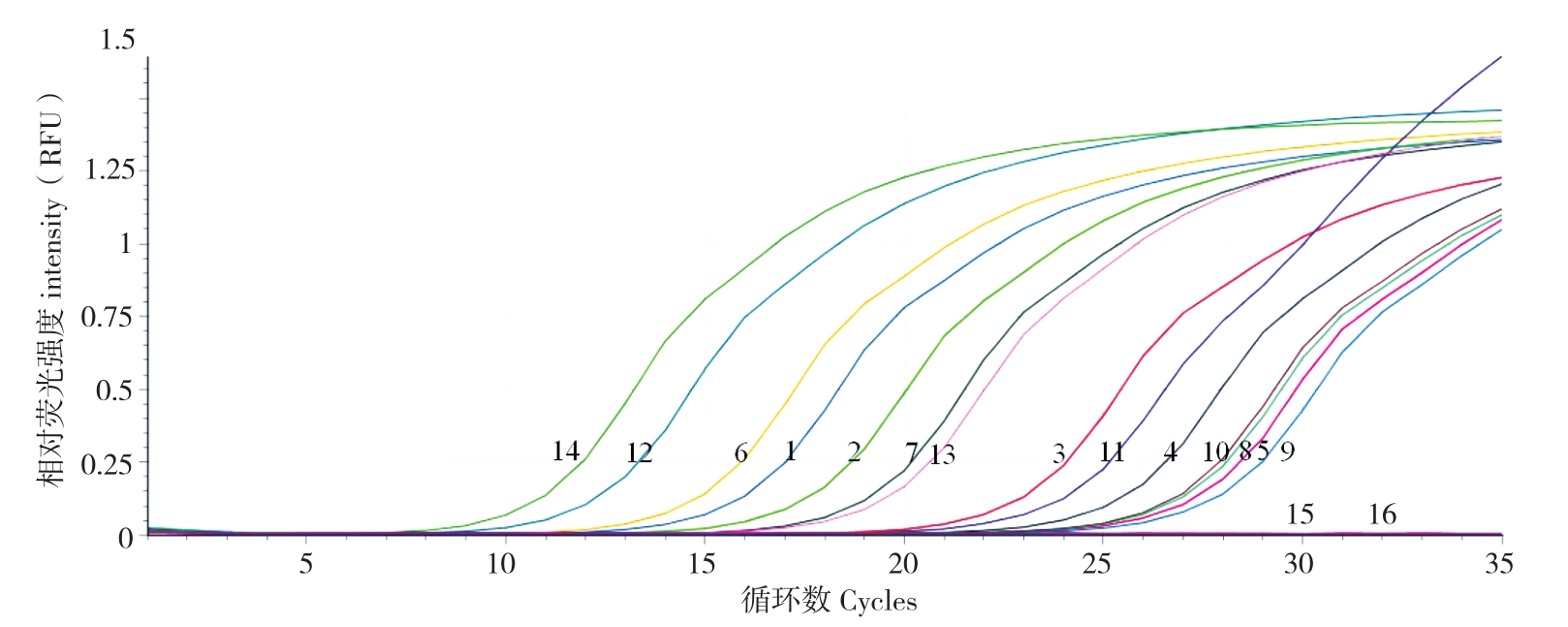
图7 各地样品的实时荧光定量PCR检测
Fig.7 Real-time fluorescence quantitative PCR detection of samples from different provinces
1~16 为不同 DNA 模板的检测曲线,1:GQDJ,2:CQXN,3:GDYD,4:GDHZ,5:GDLN,6:GXBY,7:GXLC,8:GXFS,9:HNZZ,10:HNCJ,11:HNQZ,12:SXAK,13:JXNC,14:质粒(阳性对照),15:健康桑叶,16:水(空白对照)
1-16 :The detection curves of different DNA templates,1:GQDJ,2:CQXN,3:GDYD,4:SGDHZ,5:GDLN,6:GXBY,7:GXLC,8:GXFS,9:HNZZ,10:HNCJ,11:HNQZ,12:SXAK,13:JXNC,14:Plasmid(positive control),15:Healthy mulberry leaf,16:Water(blank control)
实时荧光定量PCR比普通PCR和LAMP检测技术的灵敏度高[11],该技术可生产成诊断试剂盒[12]。在植物病毒检测上,实时荧光定量PCR被广泛应用于我国产量最高的苹果、梨、柑橘、葡萄和香蕉等5种果树中病毒的检测,其中病毒外壳蛋白基因为最常用的检测靶标[13]。本研究采用应用最广的非特性性染料SYBR Green I构建MMDaV的实时荧光定量PCR,以MMDaV外壳蛋白基因序列为靶序列。在验证植物病毒检测引物的特异性时,大多数研究者使用以相同植物上的不同病毒作为参照[12-13]。目前已报道过多种桑树病毒,但都未能明确与桑树之间的关系,也不能稳定的检出,因此无法获得其他桑树病毒作为参照。因为桑树主要用来养蚕、采桑叶和采桑椹,所以本实验以桑叶、桑椹和家蚕常见病原微生物作为对照检测特异性也具有一定的实践意义。
可重复性方面,建立的标准曲线扩增效率为97.88%,在90%~105%之间且接近1,说明重复性好。标准曲线R2=0.9992,接近1,说明该检测方法可靠性高。实时荧光定量PCR可用于检测不同时期带病植株和昆虫体内的病毒量[14-15],本研究建立的MMDaV实时荧光定量PCR能够定量的检测MMDaV,该检测方法最低有效质粒检测浓度为8 copie/μL,与凌薇等[14]构建的樱桃叶斑驳病毒实时荧光定量PCR检测方法有效质粒检测浓度为23 copies/μL均具有较高灵敏度,并且其灵敏度是MMDaV常规PCR的24倍[7]。
虽然桑花叶型萎缩病在全国各大蚕区均有发生,但至今仅在江苏镇江[8]和陕西安康学院[16]两地有MMDaV的报道,此次在广东、广西、海南、陕西、重庆和江西等地皱缩和花叶的桑病叶中均检测到MMDaV,MMDaV的检出地点增加。
4 结论
本研究建立的MMDaV实时荧光定量PCR检测方法具有特异性强、灵敏度高、可重复性和可定量等特点,可应用于广东、广西、海南、陕西、重庆和江西等多个地方桑病叶MMDaV的定量检测。
[1] ZERBINI F M,BRIDDON R W,IDRIS A,MARTIN D P,MORIONES E,NAVAS CASTILLO J,RIVERA BUSTAMANTE R,ROUMAGNAC P,VARSANI A.ICTV Virus Taxonomy Profile:Geminiviridae[J].The Journal of general virology,2017,98(2):131-133.doi:10.1099/jgv.0.000738.
[2] VARSANI A,ROUMAGNAC P,FUCHS M,NAVAS CASTILLO J,MORIONES E,IDRIS A,BRIDDON R E,RIVERA BUSTAMANTE R,MURILO ZERBINI F,MARTIN D P.Capulavirus and Grablovirus:two new genera in the family Geminiviridae[J].Archives of Virology,2017,162(6):1819-1831.doi:10.1007/s00705-017-3268-6.
[3] MA Y X,NAVARRO B,ZHANG Z,LU M,ZHOU X,CHI S,DI SERIO F,LI S.Identification and molecular characterization of a novel monopartite geminivirus associated with mulberry mosaic dwarf disease[J].Journal of General Virology,2015,96(8):2421-2434.doi:10.1099/vir.0.000175.
[4] 夏志松,卢全有.桑花叶型萎缩病夏季嫁接的传染性试验 [J].中国蚕业,2004(2):29.doi:10.16839/j.cnki.zgcy.2004.02.008.XIA Z S,LU Q Y.Infectious test of summer grafting in mulberry mosaic dwarf disease[J].China Sericulture,2004(2):29.doi:10.16839/j.cnki.zgcy.2004.02.008.
[5] LOCONSOLE G,SALDARELLI P,DODDAPANENI H,SAVINO V,MARTELLI G P,SAPONARI M.Identification of a single-stranded DNA virus associated with citrus chlorotic dwarf disease,a new member in the family Geminiviridae[J].Virology,2012,432(1):162-172.doi:10.1016/j.virol.2012.06.005.
[6] 刘科宏,陈洪明,周彦,宋震,李中安.柑橘褪绿矮化相关病毒LAMP 检测体系的建立[J].园艺学报,2017,44(5):999-1004.doi:10.16420/j.issn.0513-353X.2016-0535.LIU K H,CHEN H M,ZHOU Y,SONG Z,LI Z A.Establishment of LAMP Assay for Detection of Citrus chlorotic dwarf-associated virus(CCDaV)[J].Acta Horticulturae Sinica,2017,44(5):999-1004.doi:10.16420/j.issn.0513-353X.2016-0535.
[7] 孙勋勋,杨宏宇,刘吉平.桑花叶型萎缩病相关病毒的初步检测//中国蚕学会第九届青年学术研讨会论文集[C].重庆:中国蚕学会,2017.SUN X X,YANG H Y,LIU J P.Preliminary detection of mulberry mosaic dwarf associated virus//The 9th youth academic conference of Chinese Society of Sericultural Science[C].Chongqing :Chinese Society of Sericultural Science,2017.
[8] 孙鑫,张健,杨磊,卢全有.桑树皱叶病毒NASH检测方法的建立及应用[J].蚕业学报,2018,44(6):828-833.doi:10.13441/j.cnki.cykx.2018.06.002.SUN X,ZHANG J,YANG L,LU Q Y.Establishment and application of nucleic acid spot hybridization method used for detection of mulberry crinkle leaf virus[J].Science of Sericulture,2018,44(6):828-833.doi:10.13441/j.cnki.cykx.2018.06.002.
[9] 陈旭,齐凤坤,康立功,李景富.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155.doi:148-155.10.19720/j.cnki.issn.1005-9369.2010.08.029.CHEN X,QI F K,KANG L G,LI J F.Advance and application of real-time fluorescent quantitative PCR[J].Journal of Northeast Agricultural University,2010,41(8):148-155.doi:148-155.10.19720/j.cnki.issn.1005-9369.2010.08.029.
[10] 曲士松,刘宪华,黄宝勇,王淑芬,徐培文.CTAB法提取大蒜、白菜基因组DNA[J].山东农业大学学报(自然科学版),2000(4):427-429.QU S S,LIU X H,HUANG B Y,WANG S F,XU P W,Isolation of genome DNA in garlic and chinese cabbage by CTAB method[J].Journal of Shandong Agricultural University(Natural Science Edition),2000(4):427-429.
[11] 程保平,赵弘巍,彭埃天,陈霞,宋晓兵,凌金锋.以omp基因为靶标的3种检测方法对柑橘黄龙病菌检测效果比较 [J].广东农业科学,2014,41(5):141-145.doi:10.16768/j.issn.1004-874X.2014.05.016.CHENG B P,ZHAO H W,PENG A T,CHEN X,SONG X B,LING J F.Comparative study on citrus huanglongbing molecular detection methods with the omp target gene[J].Guangdong Agricultural Sciences,2014,41(5):141-145.doi:10.16768/j.issn.1004-874X.2014.05.016.
[12] 余波,罗永成,徐景峨,周思旋,杨莉,马永兵.大鲵柱状黄杆菌SYBR GreenⅠ荧光定量PCR诊断试剂盒的研制[J].广东农业科学,2014,41(21):144-148.doi:10.16768/j.issn.1004-874X.2014.21.037.YU B,LUO Y C,XU J E,ZHOU S X,YANG L,MA Y B.A SYBR GreenⅠ Real-time Quantitative PCR kit for detection of Flavobacterium columnar of giant salamander[J].Guangdong Agricultural Sciences,2014,41(21):144-148.doi:10.16768/j.issn.1004-874X.2014.21.037.
[13] 任芳,张尊平,范旭东,胡国君,李正男,董雅凤.主要果树病毒实时荧光定量PCR检测技术研究进展[J].园艺学报,2018,45(9):1688-1700.doi:10.16420/j.issn.0513-353X.2017-0595.REN F,ZHANG Z P,FAN X D,HU N J,LI Z G,DONG Y F.Progress on real-time fluorescent quantitative PCR detection technology for major fruit tree viruses[J].Acta Horticulturae Sinica,2018,45(9):1688-1700.doi:10.16420/j.issn.0513-353X.2017-0595.
[14] 王艳娇,崔甜甜,黄爱军,陈洪明,李中安,周常勇,宋震.柑橘脉突病毒实时荧光定量RT-PCR检测体系的建立与应用[J].园艺学报,2016,43(8):1613-1620.doi:10.16420/j.issn.0513-353X.2016-0150.WANG Y J,CUI T T,HUANG A J,CHEN H M,LI Z A,ZHOU C Y,SONG Z.Development and application of a quantitative RTPCR approach for quantification of citrus vein enation virus[J].Acta Horticulturae Sinica,2016,43(8):1613-1620.doi:10.16420/j.issn.0513-353X.2016-0150.
[15] 孙洁,王婉,周翎,阮小蕾,饶雪琴,李华平.黄瓜花叶病毒荧光定量PCR检测方法的建立[J].华南农业大学学报,2014,35(2):53-56.doi:10.7671/j.issn.1001-411X.2014.02.010.SUN J,WANG W,ZHOU L,RUAN X L,RAO X Q,LI H P.Realtime PCR for quantification of cucumber mosaic virus in banana[J].Journal of South China Agricultural University,2014,35(2):53-56.doi:10.7671/j.issn.1001-411X.2014.02.010.
[16] 林铭,胡鸿,杜永臣,高建昌,王孝宣,国艳梅.番茄黄化曲叶病毒的实时荧光定量PCR检测[J].中国蔬菜,2013(2):20-26.LI M,HU H,DU Y C,GAO J C,WANG X X,GUO Y M.Real-time PCR for quantification of tomato yellow leaf curl virus in tomato plants[J].China Vegetables,2013(2):20-26.
[17] 赵蕊,吕利华,陈婷,何自福,何余容.木尔坦棉花曲叶病毒SYBR Green Ⅰ实时荧光定量PCR检测方法[J].华南农业大学学报,2015,36(6):87-90.doi:10.7671/j.issn.1001-411X.2015.06.014.ZHAO R,LYU L H,CHEN T,HE Z F,HE Y R.A SYBR green Ⅰreal-time fluorescence quantitative PCR detection method for cotton leaf curl virus[J].Journal of South China Agricultural University,2015,36(6):87-90.doi:10.7671/j.issn.1001-411X.2015.06.014.
[18] 马宇欣.桑花叶型萎缩病病原的鉴定[D].北京:中国农业科学院,2015.MA Y X.Identification of mulberry mosaic dwarf disease[D].Beijing:Chinese Academy of Agricultural Sciences,2015.