【研究意义】马鼻肺炎是描述马属动物呼吸道病、流产、新生驹肺炎或脑脊髓炎等几种疾病的总称,在全世界分布广泛。世界动物卫生组织(OIE)将其列为法定报告动物疫病[1],我国农业部也将马鼻肺炎列为二类动物传染病,国家质量监督检验检疫局与其他国家签订的检疫条款也将其列为出入境马属动物检验检疫的疫病之一[2]。马疱疹病毒1型(Equine herpesvirus,EHV1)和马疱疹病毒4型(Equine herpesvirus,EHV4)是引起马鼻肺炎的主要病原。EHV1是马呼吸道疾病、病毒性流产的主要病因[3],EHV4主要引起急性呼吸道感染[4],从致病性来看,区分EHV1与EHV4意义重大。【前人研究进展】马鼻肺炎的诊断一般采用病毒分离培养、血清学检测、核酸检测[5]。由于EHV1与EHV4之间存在严重的血清交叉反应,目前我国还没有从血清学角度区分EHV1与EHV4的标准方法[6],以PCR与荧光定量PCR为代表的核酸检测,对样品有较好的生物安全性,适合于早期检测[7]。ELISA检测方法灵敏度高,但操作复杂,不适合快速筛查。【本研究切入点】相对于上述几种检测方法,实时荧光PCR(real-time PCR)检测速度快、灵敏度高、特异性强[8],与传统PCR相比具有省时、高效、成本低等优势,且结果易于观察。【拟解决的关键问题】通过设计特异性引物和探针、优化反应条件等手段,建立一种灵敏、特异、快速的双重real-time PCR检测方法,对EHV1与EHV4进行快速检测和分型确认。
1 材料与方法
1.1 试验材料
1.1.1 毒株和标本 选择EHV1和EHV4阳性标本各5份,马流感病毒(EIV)、马动脉炎病毒(EAV)、马日本脑炎病毒(EVJ)和马传染性贫血病毒(EIAV)阳性标本各5份,临床采集马鼻咽喉拭子共64份。由于试验所用的病毒株涉及保存条件要求和样本信息保密性,故病毒株测试实验和临床样本测试实验主要在广东省动植物与食品进出口技术措施研究重点实验室完成。
1.1.2 主要试剂及仪器 病毒核酸提取试剂购自凯杰生物工程(深圳)有限公司(QIAGEN),荧光PCR试剂购自美国VitaNavi Technology 公司,pMD-18-T载体购自宝生物工程(大连)有限公司,探针引物由宝生物工程(大连)有限公司合成,7500型荧光定量PCR仪购自美国应用生物系统(ABI)公司。
1.2 试验方法
1.2.1 引物设计和筛选 分别下载GenBank报道的不同国家和地区的EHV1和EHV4基因序列,进行核苷酸序列同源性比对,根据比对结果将比较保守的糖蛋白B区(gB)基因作为扩增序列,根据荧光定量PCR引物和探针设计原则,使用primer5.0软件分别对EHV1和EHV4设计多套引物和探针,并对设计出的引物进行序列比对分析和特殊结构分析,再根据试验结果对几套引物探针和扩增程序进行筛选,最终选择1套最佳引物探针,并确定引物探针间的最佳比例。引物探针序列信息见表1。
表1 引物探针序列信息
Table 1 Sequence of primers and proke

引物探针 Primer and probe 序列(5’-3’)Sequence(5’-3’)EHV1-F CGTTTCCATCGACGGAATGAT EHV1-R CGGGAACCTGAGGAACGGTTA Probe-1 ACGCTTGCGCGTTAAGACCCCG-BHQ1 EHV4-F CATGTTTCCATGAACGGACAAAT EHV4-R TCTGGTGTAACCTGGGGAACTAGTA Probe-2 ACCACGCGTACATGTCAAGACGCCT-BHQ2
1.2.2 阳性质粒制备 通过比对EHV1和EHV4参考毒株,扩增含有gB序列的基因片段,PCR产物回收后与 Peasy-T3载体连接构建成重组质粒,转化DH5a感受态细胞,通过氨苄蓝白斑筛选转化成功的菌株[9],测序鉴定目的片段,提取质粒制备阳性对照。
1.2.3 病毒核酸提取 EHV1和EHV4 DNA提取选择QIAGEN公司的DNA提取试剂盒,EIV、EAV、EVJ和EIAV RNA提取选择QIAGEN公司的RNA提取试剂盒,病毒核酸提取按照试剂盒说明书进行操作。对EIV、EAV、EVJ和EIAV标准毒株的RNA进行反转录获得cDNA,所有核酸-20℃保存备用。
1.2.4 real-time PCR反应体系的建立和优化 根据Vitanavi Technology公司PCR试剂盒设定real-time PCR的基本反应体系25 μL。设定基本反应条件为:50 ℃ 15 min;95℃ 15 min,95 ℃ 10 s,55 ℃ 40 s,45个循环;40 ℃ 20 s;退火时采集荧光信号。摸索各组分对EHV1和EHV4标准毒株扩增的影响,设置了Mg2+浓度(2、3、4、5、6mmol/L)、dNTP浓度(0.2、0.3、0.4、0.5 mmol/L)、引物和探针的比例(1∶1、1.5∶1、2∶1)和退火温度(52、55、60 ℃),分别以EHV1和EHV4标准毒株的混合核酸为模板,根据试验结果选择最佳反应体系和扩增条件。
1.2.5 敏感性试验 分别对EHV1和EHV4阳性对照进行10倍稀释,共稀释10个梯度,每个梯度5次重复,进行real-time PCR检测,确定EHV1和EHV4检测浓度的最低限以及分析方法的灵敏性。
1.2.6 特异性试验 用建立的real-time PCR方法分别对5份EHV1、5份EHV4标准毒株和逆转录后的EIV、EAV、EVJ和EIAV标准毒株(各5份)的cDNA进行检测,验证该方法的特异性。
1.2.7 稳定性试验 分别以1.47×105 copies/μL的EHV1和EHV4阳性对照为模板,3次重复,记录Ct值,计算标准差(S)和变异系数(CV),验证该方法的稳定性。将上述3管样本保存于-20℃保存4 d和7 d后重复检测,记录Ct值,计算标准差(S)和变异系数(CV)以验证该阳性对照的稳定性和重复性。
1.2.8 临床样本检测 对已有的64份临床样本分别用本研究建立的EHV1/EHV4 real-time PCR、常规PCR和病毒分离方法同时进行检测,比较3种方法结果的符合率。
2 结果与分析
2.1 gB基因扩增及标准品制备
应用设计的EHV引物进行常规PCR扩增,结果(图1)显示,从EHV中扩增到850 bp的gB基因特异性片段。产物回收后构建成重组质粒并转化至DH5a感受态细胞,细菌培养后提取重组质粒进行核苷酸序列测定,测序结果与原始序列片段的同源性为99.8%,表明构建重组质粒成功。抽提质粒DNA,经超微核酸蛋白浓度仪测定,OD260/OD280=1.92,质粒浓度为 1.373 μg/μL,根据公式换算的拷贝数为1.47×109 copies/μL。
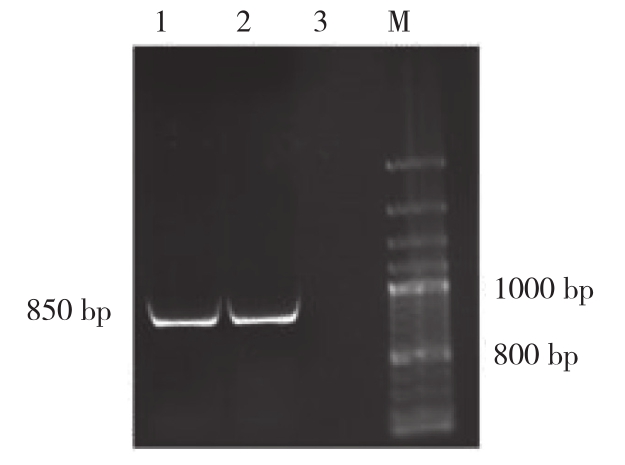
图 1 gB基因扩增结果
Fig.1 Amplification result of gB gene
M:DNA 分子质量标准;1、2:gB基因片段3:阴性对照;M: DNA Marker;1, 2: gB gene fragment; 3: Negative control
2.2 Real-time PCR方法的建立
2.2.1 Real-time PCR反应体系的建立和优化 通过对Mg2+浓度、dNTP浓度、引物和探针的比例进行优化,结果表明,Mg2+浓度为4 mmol/L,dNTP浓度为0.4 mmol/L,引物探针比例为2∶1,退火温度为55℃时,扩增效果最佳,重复性好。最佳体系扩增效果见图2。
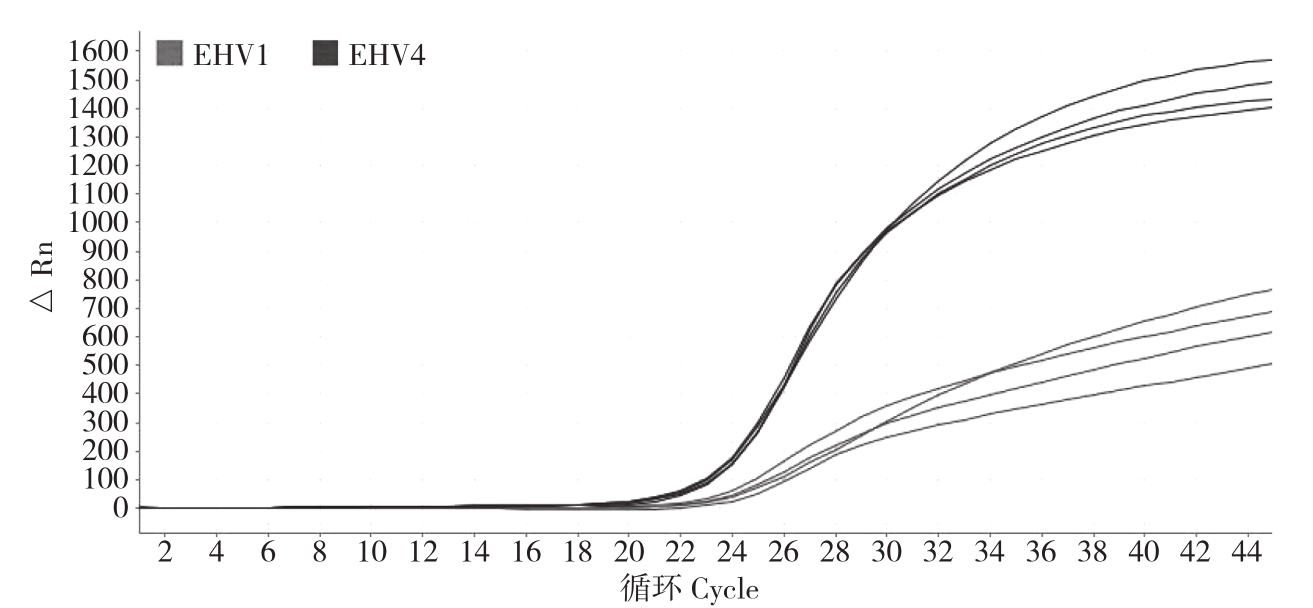
图2 EHV1、EHV4实时荧光PCR检测结果
Fig.2 Results of duplex real-time PCR of EHV1 and EHV4
2.2.2 敏感性试验 对阳性对照进行10个浓度梯度稀释,图3所示蓝色为EHV1扩增曲线,红色为EHV4扩增曲线,均出现7个稀释梯度扩增曲线;质粒拷贝数为1.47×102 copies/μL时,均能检测到特异性扩增;当质粒拷贝数为1.47×101 copies/μL时,则不能检测到特异性扩增,阴性对照也不能检测到扩增曲线。因此样本的最小检测浓度为1.47×102 copies/μL。扩增线性方程为:Ct=20.907-3.214 LogC,扩增效率E为104.687%,相关系数 r2=1,证实扩增指标正常。
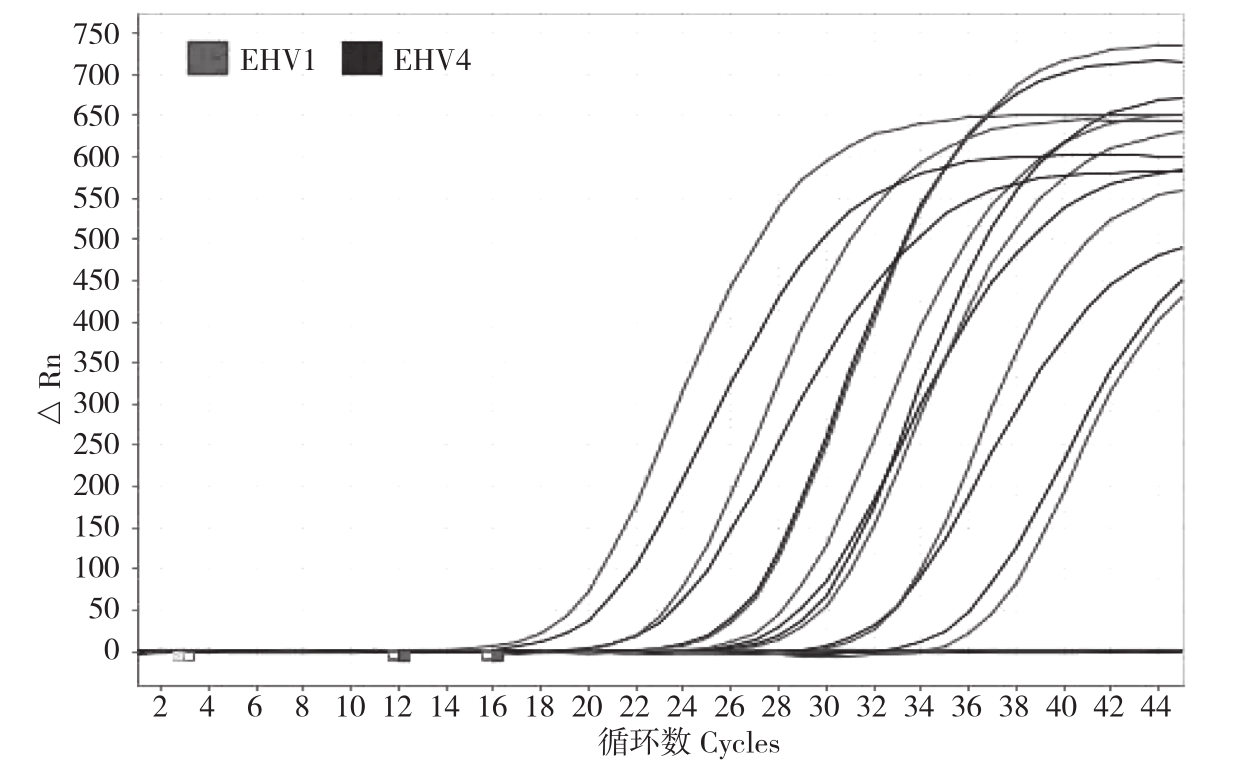
图3 EHV1、EHV4 双重实时荧光 PCR敏感性检测结果
Fig.3 Sensitivity detection of EHV1 and EHV 4 by using duplex real-time PCR
2.2.3 特异性实验 采用本研究建立的EHV1、EHV4 real-time PCR方法分别对EHV1、EHV4、EIV、EAV、EVJ和EIAV各5份标准毒株进行检测,结果(图4)只有EHV1、EHV4出现特异性扩增,其他病毒未出现扩增。
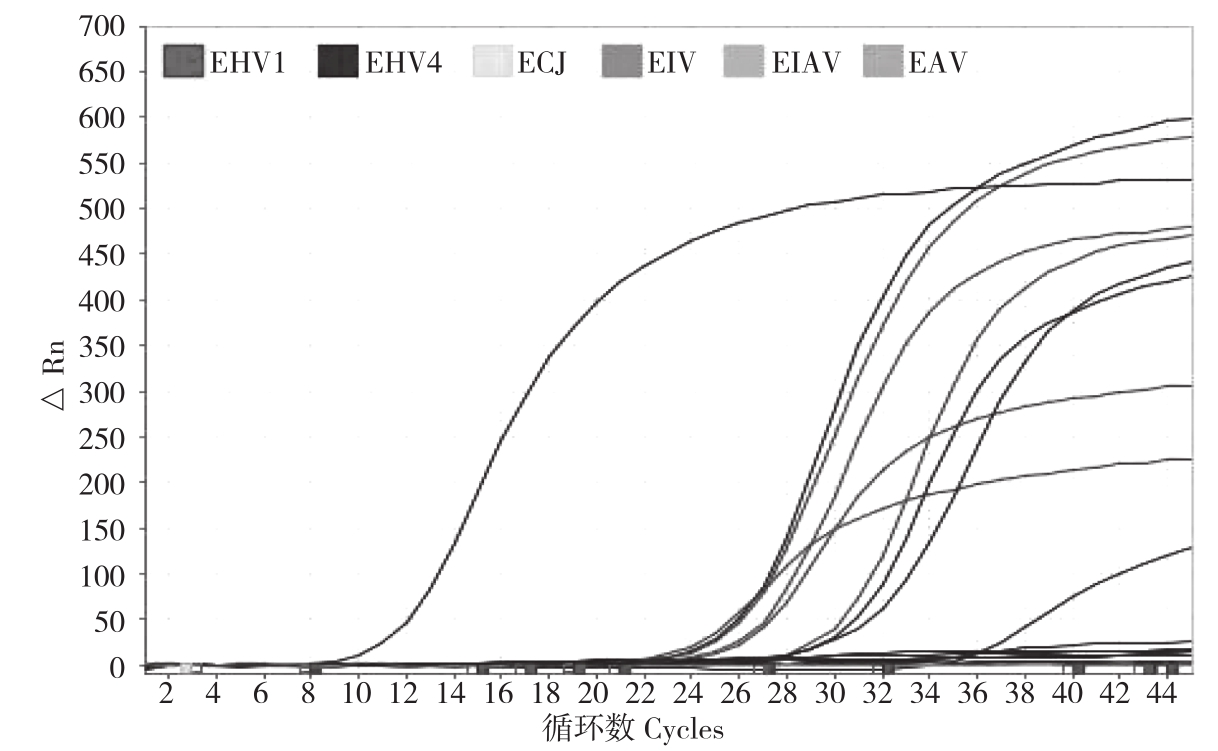
图4 EHV1、EHV4 双重实时荧光PCR特异性检测结果
Fig.4 Specific detection of EHV1 and EHV 4 by using duplex real-time PCR
2.2.4 稳定性试验 批内重复性试验中,相同浓度样本,检测结果见表2,EHV1批内变异系数为1.68%,EHV4批内变异数为2.04%。批间重复性试验中,相同模板不同检测时间结果见表3,EHV1批间变异系数为2.10%,EHV4批间变异数为2.08%。批间和批内重复性试验中Ct值变异系数均小于3%,表明该方法重复性良好,能够满足实际检测的要求。
表2 批内重复性试验结果
Table 2 Result of Intra-assay repetitive experiment
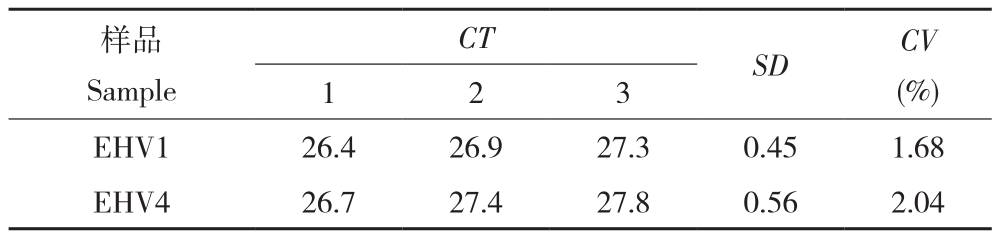
样品Sample CT SD CV(%)1 2 3 EHV1 26.4 26.9 27.3 0.45 1.68 EHV4 26.7 27.4 27.8 0.56 2.04
表3 批间重复性试验结果
Table 3 Result of Inter-assay repetitive experiment

样品Sample CT SD CV(%)0 d 4 d 7 d EHV1 26.4 27.2 27.5 0.57 2.10 EHV4 26.7 27.5 27.8 0.57 2.08
2.2.5 临床样本检测 本研究建立的real-time PCR方法以Ct值<35并且扩增曲线呈“S”型为阳性判定标准。若Ct值<35且扩增曲线良好可直接判定为阳性;Ct值在35~38之间需重复试验,2次试验均能得到良好“S”型扩增曲线方可判定为阳性;Ct值>38判定为阴性。对临床样本进行常规PCR、real-time PCR和病毒分离,结果显示,64份临床样本中,常规PCR检出率为9.38%(6/64)、real-time PCR检出率为14.06%(9/64)、病毒分离阳性率为14.06%(9/64)。证实realtime PCR比常规PCR检测灵敏度更高。
3 讨论
EHV1和EHV4引起的马鼻肺炎可导致妊娠马流产、胎儿死亡等传染性疾病,是影响我国养马业健康发展的巨大威胁,建立快速、准确的检测方法对 EHV1、EHV4 的鉴别诊断和流行病学调查具有重要意义[10]。SYBR Green染料的荧光定量 PCR 方法是目前采用的快速检测方法之一,鉴于SYBR Green 荧光染料的特异性欠佳,该方法对引物的设计要求很高:引物设计中不可出现反向重复序列和发夹结构,引物避免形成二聚体,更不能与模板发生错配扩增等[11]。特异性筛选实验既要保证引物的特异性,又要保证引物的各项参数符合荧光定量PCR 反应的要求[12]。因此,设计常规引物,建立成熟的SYBR Green 染料的荧光定量 PCR 方法有一定的挑战性。
为避免因常规引物特异性差造成检测结果假阳性等不利因素[13],本研究设计了具有强特异性的引物和探针,并建立了检测EHV1、EHV4的双重荧光定量 PCR 方法。该方法可在1 h内分别检测EHV1与EHV4,从而达到在同一反应体系内对EHV进行分型的要求。在设计引物过程中,我们选取gB基因中GC含量较高的区域,提高引物Tm值,从而有效防止引物二聚体的产生,并高概率地减少了非特异性扩增。
4 结论
本研究建立的双重荧光定量PCR的检测方法对EHV1与EHV4有特异性检出,且与其他几种马属动物易感病毒 (EIV、EAV、EIAV及EVJ)无交叉反应。该方法最低检出限为1.47×102 copies/μL,可用于检测目的基因拷贝数较低的样品,实际应用前景广阔。
[1] 朱来华,陈军,刘文波,郑小龙,凌宗帅,方邵庆,姜迪来,姜帆.新版OIE《陆生动物卫生法典》的新变化[J].检验检疫科学,2007,4(9): 70-74.doi: 10.3969/j.issn.1674-5354.2007.04.021.ZHU L H,CHEN J,LIU W B,ZHENG X L,LING Z S,FANG S Q,JIANG D L,JIANG F.The notable changes of new issue of OIE Terrestrial Animal Health Code[J].Inspection And Quarantine Science, 2007,4(9): 70-74.doi: 10.3969/j.issn.1674-5354.2007.04.021.
[2] 朱来华,陆承平,梁成珠.马鼻肺炎的检疫[J].中国动物检疫,2005,22(3):46-48.doi: 10.3969/j.issn.1005-944X.2005.03.031.ZHU L H, LU C P, LIANG C Z.The quarantine of equine rhinopneumonitis[J].Chinese Journal Of Animal Quarantine, 2005,25(3):46-48.doi: 10.3969/j.issn.1005-944X.2005.03.031.
[3] GOODMAN L B, WAGNER B, FLAMINIO M J, SUSSMAN K H,METZGER S M, HOLLAND R, OSTERRIEDER N.Comparison of the efficacy of inactivated combination and modified-live virus vaccines against challenge infection with neuropathogenic equine herpesvirus type 1 (EHV-1)[J].Vaccine, 2006,24 ( 17) : 3636-3645.doi: 10.1016/j.vaccine.2016.01.062.
[4] Ostlund E N.The equine herpesviruses C [J].Vet Clin North Am Equine Pract, 1993, 9(2):283-294.doi: 10.1007/978-1-4684-7012-35.
[5] 杨永龙,刘建华,宋焕堂,李 静,卢亚宾,胡 月,范斌,况玲,冉多良.新疆伊犁地区马疱疹病毒1型的分离与鉴定[J].中国预防兽医学报,2016,38(7):550-553.doi: 10.3969/j.issn.1008-0425.2016.07.09.YANG Y L, LIU J H, SONG H T, LI J, LU Y B, HU Y, FAN B, KUANG L, RAN D L, Isolation and identification of equine herpesvirus 1 in Xinjiang[J].Chinese Journal of Preventive Veterinary Medicine,2016, 38(7):550-553.doi: 10.3969/j.issn.1008-0425.2016.07.09.
[6] 袁贝,李海,马陈,赵亚南,马玉辉,朱义忠,苏艳.新疆伊犁地区马鼻肺炎、马腺疫、马流产沙门菌病的血清学调查[J].中国预防兽医学报,2017,39(7): 540-543.doi: 10.3969/j.issn.1008-0425.2017.07.06.YUAN B, LI H, MA C, ZHAO Y N, MA Y H, ZHU Y Z, SU Y.Serum epidemiology investigation of Equine rhinopneumonitis, Strangles,Salmonella abortus equi in Yili of Xinjiang[J].Chinese Journal of Preventive Veterinary Medicine, 2017, 39(7): 540-543.doi: 10.3969/j.issn.1008-0425.2017.07.06.
[7] 朱来华,陆承平,梁成珠,王丽,吴华,黄丛平,王树峰,高宏伟,岳志芹,邓明俊.应用多重PCR检测和区分3个型的马疱疹病毒[J].中国兽医科技,2005(8): 595-599.doi: 10.3969/j.issn.1673-4696.2005.08.003.ZHU L H, LU C P, LIANG C Z, WANG L, WU H, HUANG C P, WANG S F, GAO H W, YUE Z Q, DENG M J.Detection and differentiation of three types of equine herpesviruses by multiplex PCR[J].Chinese Journal of Veterinary Science and Technology, 2005(8): 595-599.doi:10.3969/j.issn.1673-4596.2005.08.003.
[8] Quinlivan M, Cullinane A, Nelly M, VAN M K, HELDENS J, ARKINS S.Comparison of sensitivities of virus isolation, antigen detection, and nucleic acid amplification for detection of equine influenza virus[J].Journal of Clinical Microbiology, 2004, 42(2): 7563- 7567.doi: 10.1128/JCM.42.2.759-763.2004.
[9] 易新萍,单文鲁,冉多良,王宁,岳城,恩特马克.应用一步PCR法检测并鉴定马疱疹病毒1型和4型[J].病毒学报,2001(2):158-160.YI X P, SHAN W L, RAN D L, WANG N, YUE C, ENTE-MaKe.Detection and identification of equine herpesvirus-1 and -4 by onestep polymerase chain reaction[J].Chinese Journal Of Virology,2001(2): 158-160.
[10] 鱼海琼,张树,林志雄,罗长保,赵吟,田纯见,李守军.马鼻肺炎诊断方法研究进展[J].中国动物检疫,2014, 31(2): 49-52.doi: 10.3969/j.issn.1005-944X.2014.02.016.YU H Q, ZHANG S, LIN Z X, LUO C B, ZHAO Y, TIAN C J, LI S J.Research advance of equine rhinopneumonitis diagnosis method[J].Chinese Journal of Animal Quarantine, 2014, 31(2): 49-52.doi: 10.3969/j.issn.1005-944X.2014.02.016.
[11] 王征,郭巍,姬媛媛,曲娟娟,赵立平,李红梅,相文华.马疱疹病毒1型SYBR GreenⅠ荧光定量PCR检测方法的建立[J].中国预防兽医学报,2012, 34(2): 116-119.doi: 10.3969/j.issn.1008-0589.2012.02.09.WANG Z,GUO W,JI Y Y,QU J J,ZHAO L P,LI HM ,XIANG W H.Establishment of the SYBR GreenⅠreal-time PCR for detection of equine herpesvirus type 1[J].Chinese Journal of Preventive Veterinary Medicine, 2012, 34(2): 116-119.doi: 10.3969/j.issn.1008-0589.2012.02.09.
[12] 朱来华,陆承平,黄纪徽,梁成珠,郑小龙,魏乃林,马丰忠,于红光,孙敏, 李强.应用三重PCR快速同步检测和区分3种马疱疹病毒[J].中国兽医杂志,2007(2): 15-17.doi: 10.3969/j.issn.0529-6005.2007.02.005.ZHU L H, LU C P, HUANG J W,LIANG C Z,ZHENG X L, WEI N L,MA F Z,YU H G, SUN M,LI Q.Rapid detection and differentiation of three types of equine herpesviruses by Triple PCR[J].Chinese Journal of V eterinary Medicine, 2007(2): 15-17.doi: 10.3969/j.issn.0529-6005.2007.02.005.
[13] 杨夷平,刘建华,冉多良,许全圆,李娜,加尔肯.马疱疹病毒1型LAMP检测方法的建立[J].中国畜牧兽医.2014, 41(9): 35-40.YANG Y P,LIU J H,RAN D L,XU Q Y,LI N,JIA -ErKen.Establishment of loop-mediated Isothermal amplification assay detection method of equine herpesvirus type 1[J].Chinese pasturage veterinary medicine, 2014, 41(9): 35-40.