【研究意义】眼斑双锯鱼(Amphiprion ocellaris),俗称公子小丑,是养殖及市场流通最广泛的小丑鱼品种,分类学上隶属于雀鲷科双锯鱼属,其在热带海水观赏鱼中具有重要地位,受众多养殖爱好者的喜爱[1]。然而,随着观赏鱼行业的兴起,备受关注的野生小丑鱼也逐渐面临不同威胁[2]。一是渔民在野外捕鱼时通常会采用氰化物,药物的使用会对周边小丑鱼的机体尤其是肝脏及性腺产生致命影响;二是由于小丑鱼的知名度和养殖热度越来越高,出于利益驱使,造成对野生资源的过度捕捞;三是环境的变化使珊瑚礁生态系统受损,从而减少了小丑鱼赖以生存的栖息场所,致使小丑鱼自然种群资源日益稀少。鉴于对小丑鱼关注度日益提升,也加速了其人工养殖的相关研究,目前主要包括小丑鱼人工繁育胚胎发育、病害学及营养学等方面[3-7]。小丑鱼作为一种海洋鱼类,其赖以生存的介质为海水,其养殖及消费区域集中在沿海地区,受地区限制极为严重。因此,寻找能替代自然海水成功养殖小丑鱼的方法,是小丑鱼养殖业及消费市场向内地拓展及兴起的一种有效途径。【前人研究进展】人工海水是根据自然海水中各种物质组分及含量,用化学物质进行人工配制并溶解在水中以满足一些海洋生物正常生存的海水。有关人工海水配方研制及其养殖方面的研究工作可以追溯到20世纪30—40年代,并取得了一定进展。我国著名海洋生态学家朱树屏致力于海洋学、水产学及湖沼学研究,尤其在人工海水配方研究方面,其于1942—1946年间突破人工海水配制难题,研制出“朱氏人工海水”,是人工海水研究史上的里程碑[8]。此后国际范围内有关人工海水的配置及养殖技术工作逐渐兴起[9-10],尤其在虾、蟹等甲壳动物的养殖工作方面成果丰硕[11-16]。而近几年随着循环水养殖新模式的兴起,有关循环水的人工海水研制及养殖科研工作受到了广泛关注[17-18]。【本研究切入点】有关海水养殖对眼斑双锯鱼可行性的分析有待研究,而酶活性变化直接反映了个体在不同环境下的应激反应,抗氧化酶活性的变化与机体环境应激后组织自由基的形成有关,起着保护机体组织免受氧化损伤的作用[19],而消化酶活性变化则与环境变化下个体代谢消耗能量差异有关,起着能量收支平衡的作用[20]。从不同海水养殖对眼斑双锯鱼不同组织消化酶及抗氧化酶活性影响着手,探讨不同海水养殖条件下的机体反应,为人工海水养殖深化开展提供理论基础。【拟解决的关键问题】通过对比分析自然海水及人工海水养殖条件下,眼斑双锯鱼不同组织消化酶及抗氧化酶的活性差异,揭示眼斑双锯鱼在人工海水环境下的生理反应,分析其人工海水养殖的可行性,为养殖生产眼斑双锯鱼提供参考依据。
1 材料与方法
1.1 试验材料
供试眼斑双锯鱼幼鱼为中国水产科学研究院南海水产研究所热带水产研究开发中心人工繁育,繁育时间为2019年3月17日,以2月龄幼鱼为研究对象,于原地开展不同海水养殖试验研究。幼鱼用水族箱在自然海水自然光照条件下养殖,养殖水质参数为:溶解氧>6.5 mg/L、盐度32(±2)°、水温 28(±1)℃、pH 8.0~8.2、亚硝酸盐含量<0.03 mg/L、氨氮含量<0.01 mg/L。
1.2 养殖处理
预试验,取5尾健康幼鱼放于由海水精(广州市海神水产科技有限公司)配置的人工海水中,饲养48 h,期间投喂丰年虫(Artemia salina)幼体,每天换水1次,换水量50%。观察发现,幼鱼刚被放入时容易出现撞壁现象,约45 min后恢复正常,推测是捕捞转移时受到惊吓或是新环境对其产生了一定的胁迫;饲养48 h后无死亡且摄食活性正常。
试验时,挑选体色正常、活力好的幼鱼72尾,体长4.14(±0.43)cm、体质量5.56(±1.08) g停食24 h后将幼鱼以每组12尾分成6组,分别放入3个加有15 L过滤自然海水和3个加有15 L用海水精配制的人工海水(盐度及各水质参数与自然海水相同)的水族箱(规格25 L)中。幼鱼每天换水1次,换水量50%,每天9: 00和15: 00分别投喂初孵丰年虫1次,投喂密度为20~30/mL。
1.3 样品采集与处理
将幼鱼放入不同养殖海水中后,分别于6、24、48、96 h从每个水族箱中随机取出3尾幼鱼,放置在低温环境下进行解剖,取其鳃、肠、胃、脾、肝脏、肾和肌肉组织。称取适量组织,用生理盐水按所需比例进行稀释研磨,将研磨液于4℃温度下以6 000 r/min离心10 min,取上清液,-80℃保存待测。肠用于测定肠淀粉酶活性,胃用于测定胃蛋白酶活性,肾、脾、肝脏、鳃和肌肉组织用于测定SOD、POD、CAT及GSH-PX活性(南京建成生物工程研究所),淀粉酶活性单位以U/g表示,其他酶活性单位以U/mg表示。
试验数据采用SPSS19.0 进行统计分析,并进行独立样本T检验,分析各组间相关参数差异显著性。
2 结果与分析
2.1 自然海水与人工海水养殖环境对眼斑双锯鱼幼鱼消化酶活性的影响
不同养殖处理下,眼斑双锯鱼幼鱼消化酶活性变化规律如图1所示。不同海水养殖条件对幼鱼胃蛋白酶差异显著,而淀粉酶活性差异不显著。在各取样点,人工海水养殖处理幼鱼胃蛋白酶活性仅于6 h低于自然海水处理,其他各时间点高于自然海水处理;淀粉酶活性大小正好相反,即仅于6 h高于自然海水处理。
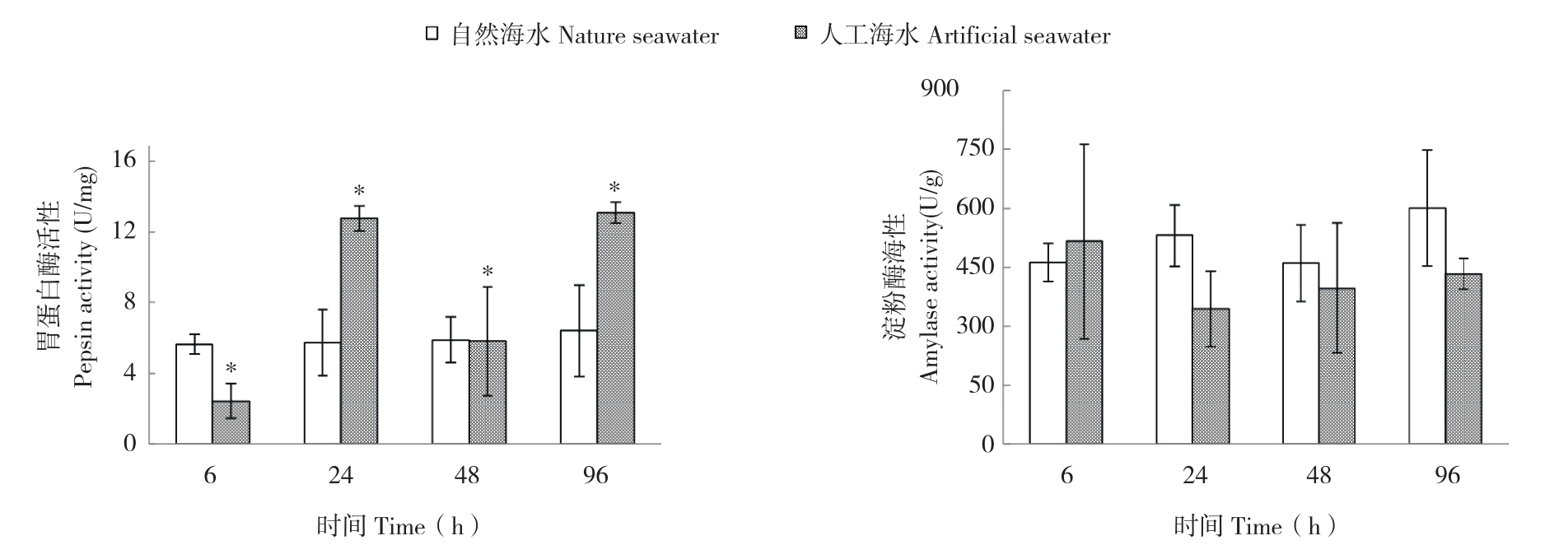
图1 自然海水和人工海水养殖条件下眼斑双锯鱼幼鱼的消化酶活性
Fig.1 Digestive enzyme activity of juvenile Amphiprion ocellaris cultured in nature seawater and artificial seawater
*表示不同养殖处理间差异显著
* represents significant difference between different treatments
2.2 自然海水与人工海水养殖环境对眼斑双锯鱼幼鱼抗氧化酶活性的影响
2.2.1 SOD活性 不同养殖环境下,眼斑双锯鱼幼鱼SOD活性变化规律如图2所示。SOD酶活性在不同组织间有所差异。肾脏、肝及鳃部SOD活性仅在48 h差异不显著,而脾SOD活性仅在48 h差异显著,肌肉48、96 h差异均显著;随着处理时间推移,人工海水处理组幼鱼组织SOD活性变化无明显规律,活性大小呈波动趋势。不同组织SOD活性数量级于肾、脾、鳃及肌肉各组织相似,显著高于肝脏组织,SOD活性最大值(36.70±3.55 U/mgprot)来源于人工海水养殖48 h后取样的肌肉组织。
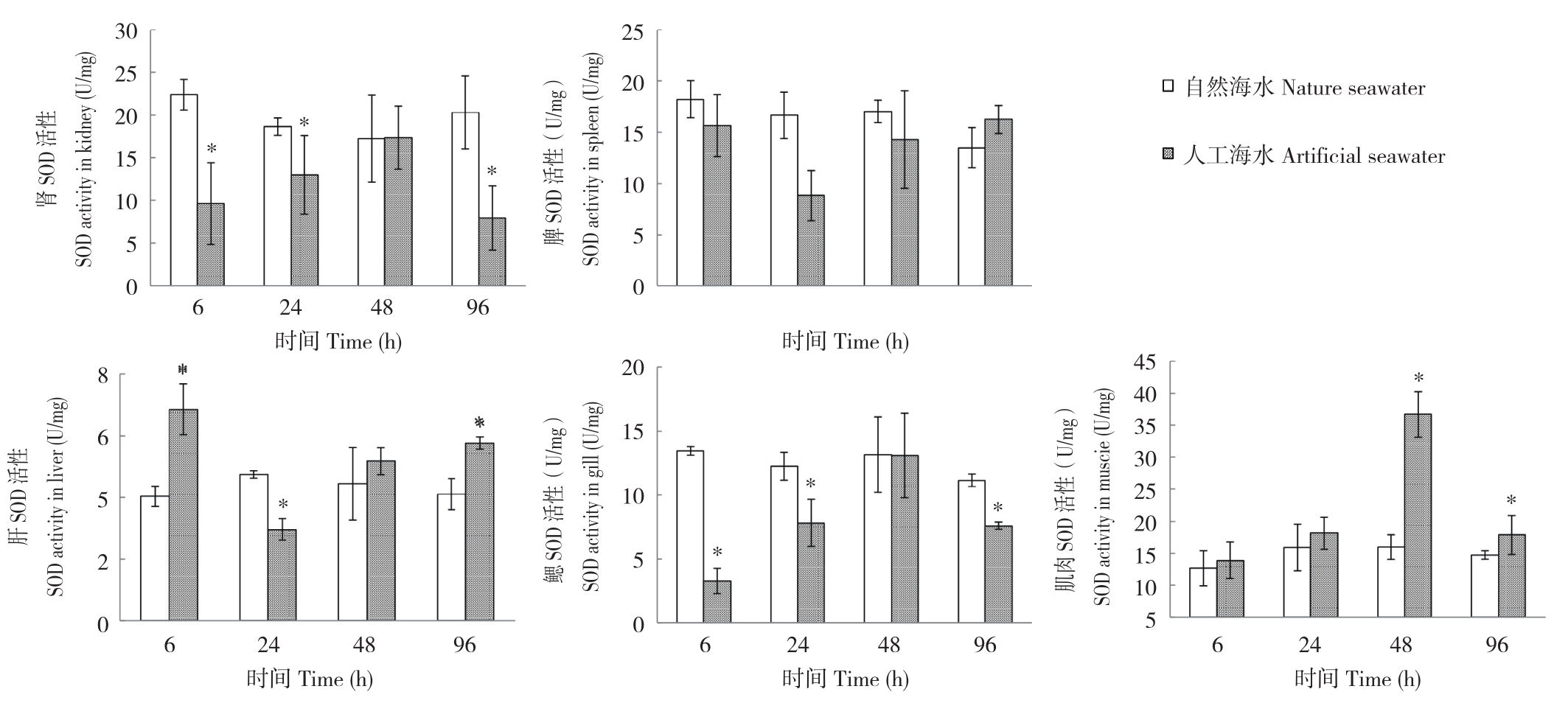
图2 自然海水和人工海水养殖条件下眼斑双锯鱼幼鱼的SOD活性
Fig.2 SOD activity of juvenile Amphiprion ocellaris cultured in nature seawater and artificial seawater
*表示不同养殖处理间差异显著
*represents significant difference between different treatments
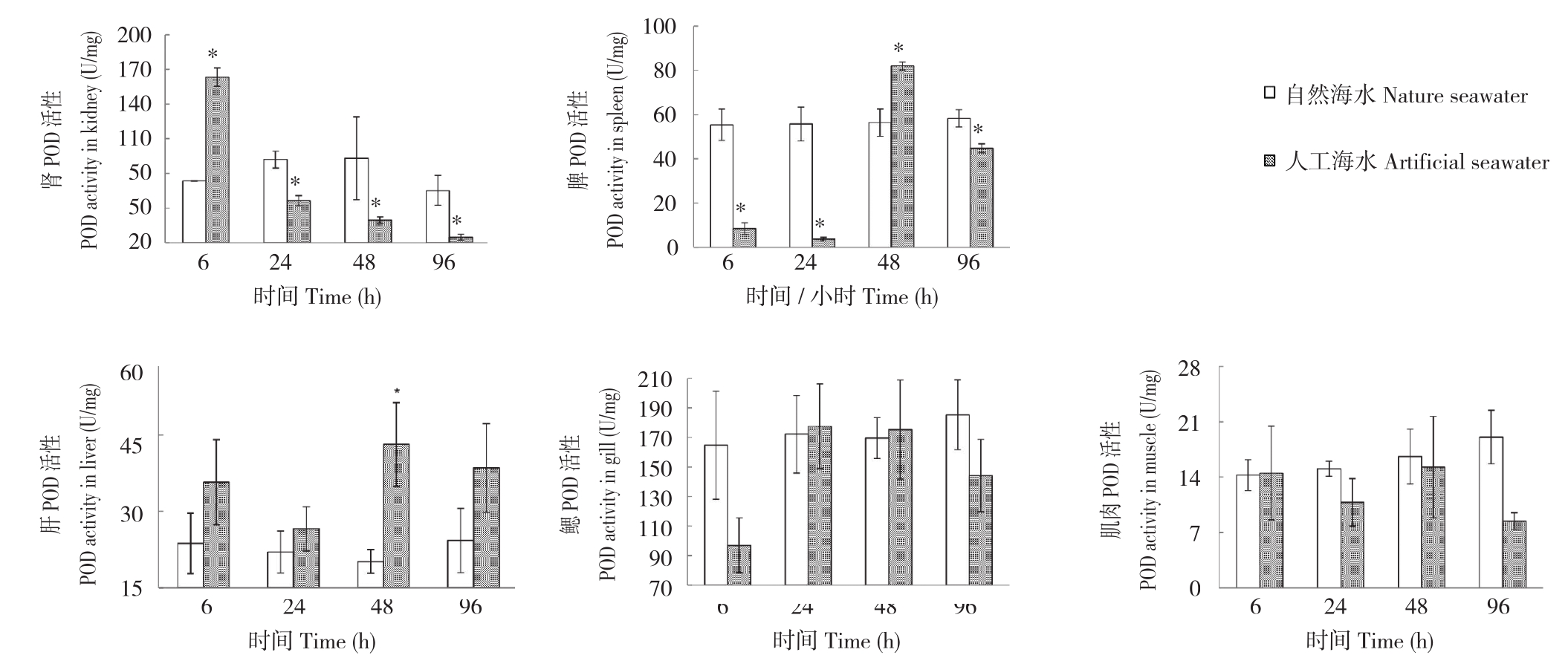
图3 自然海水和人工海水养殖条件下眼斑双锯鱼幼鱼的POD活性
Fig.3 POD activity of juvenile Amphiprion ocellaris cultured in nature seawater and artificial seawater
*表示不同养殖处理间差异显著
* represents significant difference between different treatments
2.2.2 POD活性 不同养殖环境下,眼斑双锯鱼幼鱼POD活性变化规律如图3所示。POD活性在不同组织间存在差异。各取样时间的肾脏、脾及肌肉POD活性差异均显著,而各取样时间的鳃POD活性差异均不显著,肝POD活性仅在48 h差异显著。随着处理时间推移,人工海水养殖处理个体组织POD活性变化差异无明显规律,活性大小呈波动趋势。从酶活性水平来看,除肌肉POD活性最大值为自然海水养殖处理(96 h取样),其他各组织POD活性最大值均出现在人工海水养殖处理。
2.2.3 CAT活性 不同养殖处理下,眼斑双锯鱼幼鱼CAT活性变化规律如图4所示。CAT活性在不同组织间存在差异。各取样时间的脾和肾脏CAT活性差异均显著,肝脏CAT活性于24、48 h差异均显著,而鳃CAT活性于24、48 h差异均不显著,肌肉CAT活性仅在96 h差异不显著。随着处理时间推移,人工海水处理个体组织CAT活性变化差异无明显规律,活性大小呈波动趋势。从酶活性水平来看,除脾组织外,其他各组织CAT活性最大值均出现在人工海水养殖处理。
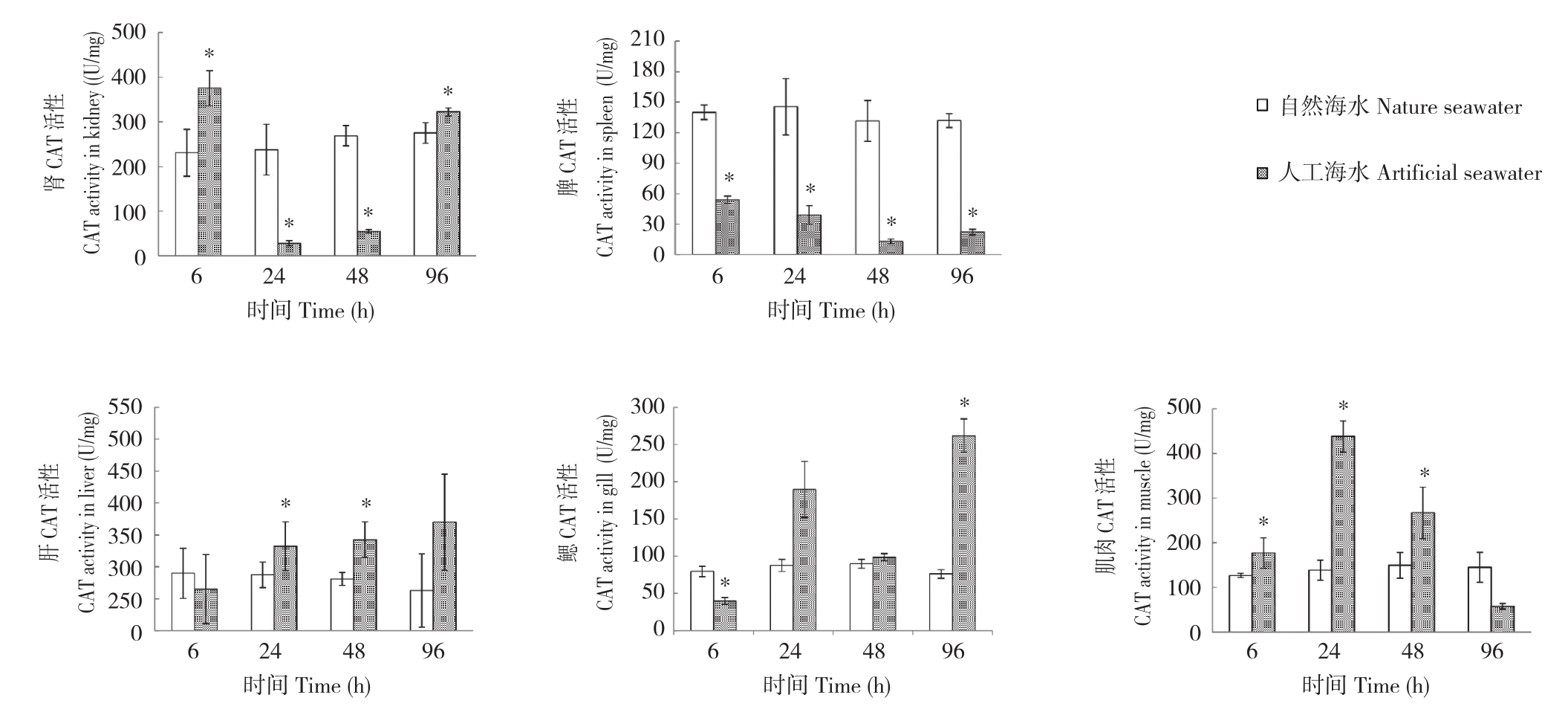
图4 自然海水和人工海水养殖条件下眼斑双锯鱼幼鱼的CAT活性
Fig.4 CAT activity of juvenile Amphiprion ocellaris cultured in nature seawater and artificial seawater
*表示不同养殖处理间差异显著
* represents significant difference between different treatments
2.2.4 GSH活性 不同养殖环境下,眼斑双锯鱼幼鱼GSH活性变化规律如图5所示。GSH活性在不同组织间存在差异。不同取样时间脾和肝脏GSH活性均仅于6 h差异不显著,而肾和鳃部GSH活性分别仅于24、96 h差异均不显著,肌肉GSH活性于24、96 h差异均不显著。随着处理时间推移,人工海水处理个体组织GSH活性变化差异无明显规律,活性大小呈波动趋势。从酶活性水平来看,肾、肝和肌肉组织CAT活性最大值均出现在人工海水养殖处理,而脾和鳃组织CAT活性最大值均出现在自然海水养殖处理。
3 讨论
本试验过程中,眼斑双锯鱼幼鱼在自然海水和人工海水养殖条件下养殖,均无出现死亡现象,相比于自然海水下的幼鱼,人工海水中的幼鱼摄食活力恢复时间更长。推测除了捕捞过程中对幼鱼造成一定的应激外,人工海水环境也对幼鱼的恢复造成了一定刺激,其影响机制可由该试验中各种酶活性的变化差异进行阐述。
3.1 自然海水与人工海水养殖对眼斑双锯鱼幼鱼消化酶活性的影响
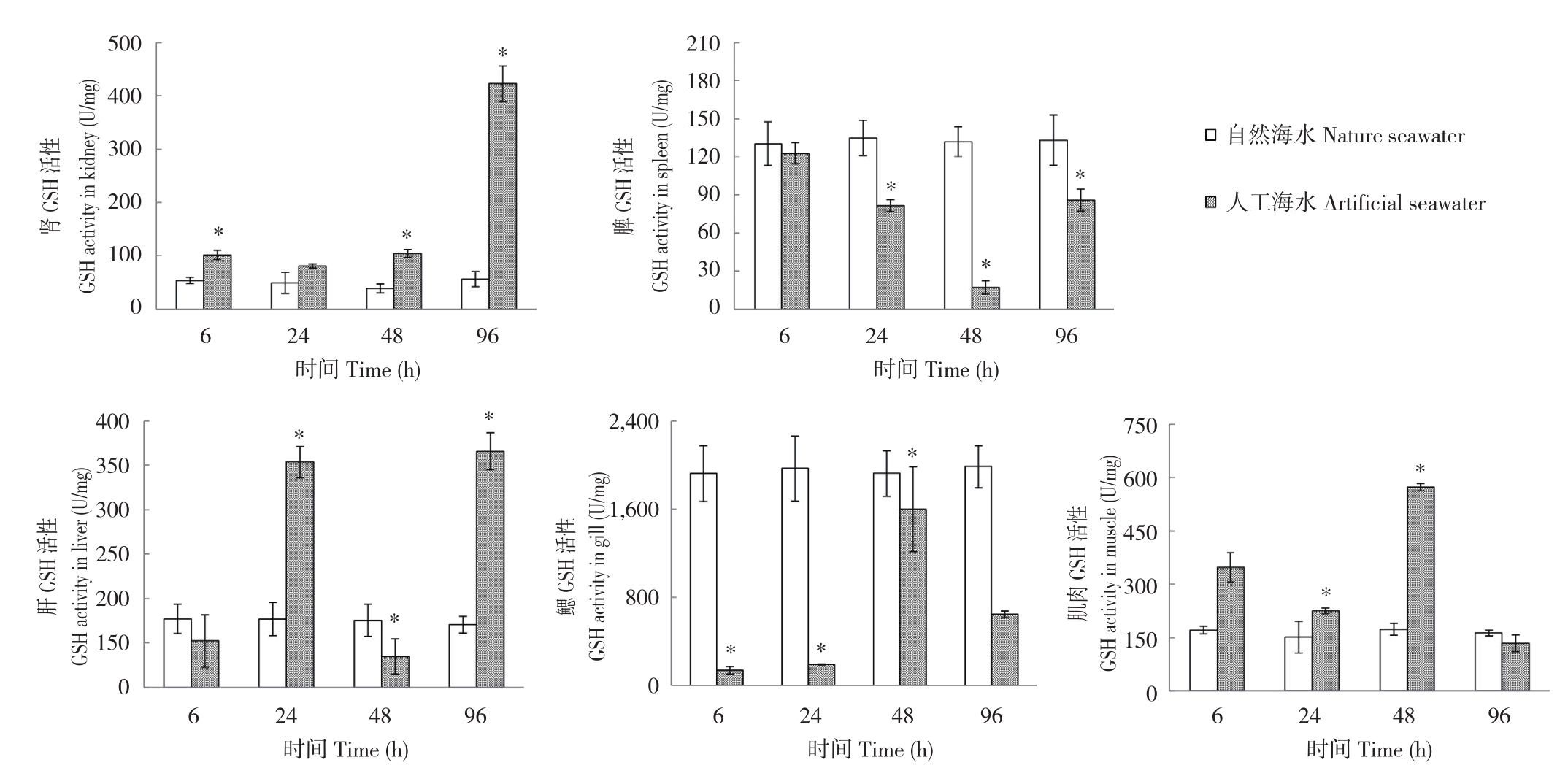
图5 自然海水和人工海水养殖条件下眼斑双锯鱼幼鱼的GSH活性
Fig.5 GSH activity of juvenile Amphiprion ocellaris cultured in nature seawater and artificial seawater
*表示不同养殖处理间差异显著
* represents significant difference between different treatments
消化酶活性不仅反映了个体对营养物质的消化吸收情况,更是反映个体生理活性的指标之一[21]。水生生物包括鱼类的消化酶活性受多种因素影响,包括环境因子,如水温、溶氧和盐度等[22-24],同时也受自身因素影响,如所处发育阶段等[20]。在本试验中,不同海水来源造成了眼斑双锯鱼幼鱼消化酶活性差异,推测主要由部分常量或微量元素的差异所造成[25]。王嫣等[26-27]研究了不同海水养殖条件下,文昌鱼耗氧率及生长发育的差异,结果证明人工海水对文昌鱼的代谢水平及个体生长存在一定负面影响;胡利华等[28]研究了自然海水与人工海水对凡纳滨对虾生长及代谢相关基因表达的影响,结果表明人工海水养殖的凡纳滨对虾在生长性能上显著差于自然海水,且其关键代谢供能基因丙酮酸激酶(PK)、己糖激酶(HK)、异柠檬酸脱氢酶(IDH)和肉毒碱棕榈酰基转移酶(CPTⅠ)的表达受显著抑制。在本研究中,人工海水养殖下眼斑双锯鱼幼鱼蛋白酶活性受养殖处理应激反应显著,而淀粉酶变化差异不显著,由于蛋白质功能的特殊性,即除了提供生命所需能量,更是生命活动的主要承担者,如组织修复等[29]。因此,推测在应激条件下,眼斑双锯鱼个体选择性的调节蛋白酶活性以获取更多能量或免疫物质来应对应激,而其应激来源及其深层次的调节机理有待进一步研究。
3.2 自然海水与人工海水养殖对眼斑双锯鱼幼鱼抗氧化酶活性的影响
大量研究表明,环境因子会对鱼类的免疫机能及抗氧化系统产生消极影响,而在应对环境应激时,各种抗氧化酶,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及谷胱甘肽过氧化物酶(GSH)等在免疫调节过程中起主要作用[19,30]。在本研究中,个体不同组织抗氧化酶活性受养殖处理影响差异显著,且存在组织差异性,针对不同海水养殖条件下的眼斑双锯鱼幼鱼的抗氧化酶进行活性测定分析,结果表明,不同养殖处理、不同养殖时间均对各组织抗氧化酶活性存在显著影响。抗氧化酶活性的变化暗示着某种或多种环境因子对机体产生应激效果[31],分析人工海水与自然海水的差异,主要体现在无机盐、微生物含量以及pH、亚硝酸盐、氨氮及溶解氧等的差异[12,28,32-33],而本试验周期短且试验过程中对水质进行严格把控,因此推测无机盐含量为应激主导因子。正如PILLARD等[15]研究表明,无机盐离子过多或过少均存在一定毒性,因此掌握人工海水配方中无机盐离子的合适含量仍是提高眼斑双锯鱼养殖效益的关键所在。
近年来,随着经济发展,休闲渔业占渔业产业比例逐渐增加,全国各地各类水族馆相继建立,其中海水水族馆尤其受欢迎。然而,由于近海海水受污染严重、品质不稳定,且运输成本较高等因素,通常使用人工配制的海水进行水生动、植物养殖管理。人工海水因无菌、无污染及成分确定等优势而被广泛运用[14-15,18,33-34]。但人工配制海水与自然海水存在本质区别,如无机盐成分偏高或偏低,藻多糖、有益微生物、浮游生物及维生素等活性物质缺乏[28]。根据现有研究发现,人工海水抑制水生生物的生长并非个例[12,26,28],适当增加 Ca2+浓度将有利于个体的生长与发育[13-14,35]。由此可见,摸清人工海水对水生生物生长发育影响机制并揭示其关键因素所在,对指导人工海水养殖具有重大意义,根据研究结果对人工海水配方及合成工艺进行改良,将有望解决人工海水对眼斑双锯鱼的环境应激问题,从而促进其生长发育。
本研究认为,不同组织在应对环境变化过程中,不同的抗氧化酶活性变化趋势不同,即所起到的调节功能不同,虽然相关机理有待深入研究,但根据相关分析结果可推断:同一生化过程可能是多种不同组织协同调节的结果,且该过程中各组织及各组织抗氧化酶活性变化对调节功能的实现所占权重不同,这与许友卿等[36]、马光明等[37]及常藕琴等[38]研究结果一致。试验结果暗示,在对机体生化功能及其内部机制探索过程中,应选取不同部位或组织进行分析研究,以得到更综合、更完善的结论。同样,在对机体生化功能的调节过程进行研究时,不同生化指标的选取也十分必要,不同生化指标间的相关性也为研究的全面性、准确性起到至关重要的作用[39-40]。而本研究由于样本数量、大小等客观原因,仅以消化酶及抗氧化酶活性作为研究参数,相关生化指标的测定分析有待进一步开展。
4 结论
本研究对自然海水和人工海水养殖条件下,眼斑双锯鱼不同组织消化酶及抗氧化酶活性进行了测定分析,初步断定了人工海水存在不足之处,但基于其存活率及摄食活性,也能判定人工海水养殖眼斑双锯鱼的可行性。今后可对其影响机制开展深入研究,如开展较长周期的养殖试验,测定人工海水水质、无机盐含量及微生物含量等条件,研究机体各生长发育指数、代谢指数及相关基因表达等,深入探索其影响程度及机制,为加强人为调控提供理论依据。
[1] WABNITZ C, TAYLOR M, GREEN E.From ocean to aquarium[M].UK: Cambridge, 2003.
[2] 鞠晨曦.公子小丑鱼(Amphiprion ocellaris)胚胎发育的形态学观察及盐度对幼鱼生长的影响[D].上海:上海海洋大学,2013.JU C X.Morphological observation of embryonic development and effects of salinity on growth of False clownfish Amphiprion ocellaris[D].Shanghai: Shanghai Ocean University, 2013.
[3] 杨晨,钟鸿干,李洪武.珊瑚礁鱼类公子小丑鱼人工繁殖和育苗技术[J].水产养殖,2012(5): 39-41.doi: 10.3969/j.issn.1004-2091.2012.05.019.YANG C, ZHONG H G, LI H W.Artificial breeding and seedling techniques of Amphiprion ocellaris in coral reefs[J].Journal of Aquaculture, 2012(5):39-41.doi: 10.3969/j.issn.1004-2091.2012.05.019.
[4] 鞠晨曦,李云,刘红,蔡生力.眼斑双锯鱼胚胎发育的形态学观察[J].海洋渔业,2014, 36(1): 8-15.doi: 10.13233/j.cnki.mar.fish.2014.01.004.JU C X, LI Y, LIU H, CAI S L.Morphological observation on embryonic development of Amphiprion ocellaris[J].Marine Fisheries, 2014,36(1): 8-15.doi: 10.13233/j.cnki.mar.fish.2014.01.004.
[5] 赵旺,牛津,胡静,吴开畅,王雨,杨蕊,叶乐.饲料糖水平对眼斑双锯鱼幼鱼生长性能和体成分的影响[J].南方水产科学,2017,13(3): 66-72.doi: 10.3969 / j.issn.2095-0780.2017.03.009.ZHAO W, NIU J, HU J, WU K C, WANG Y,YANG R,YE L.Effect of dietary carbohydrate level on growth performance and body composition of juvenile Amphiprion ocellaris[J].South China Fisheries Science,2017,13(3): 66-72.doi: 10.3969 / j.issn.2095-0780.2017.03.009.
[6] OLIVOTTO I, DI STEFANO M, ROSETTI S, COSSIGNANI L,PUGNALONI A, GIANTOMASSI F, CARNEVALI O.Live prey enrichment, with particular emphasis on HUFAs, as limiting factor in false percula clownfish (Amphiprion ocellaris, Pomacentridae)larval development and metamorphosis: Molecular and biochemical implications[J].Comparative Biochemistry and Physiology-A Molecular and Integrative Physiology, 2011, 159(3): 207-218.doi:10.1016/j.cbpa.2011.02.004.
[7] PIRARAT N, PRATAKPIRIYA W, JONGNIMITPAIBOON K,SAJJAWIRIYAKUL K, RODKHUM C, CHANSUE N.Lymphocystis disease in cultured false clown anemonefish (Amphiprion ocellaris)[J].Aquaculture, 2011, 315(3-4): 414-416.doi:10.1016/j.aquaculture.2011.01.014.
[8] 朱树屏.朱树屏文集[M].北京:海洋出版社,2007.CHU S P.Collected of works of S.P.CHU[M].Beijing: China Ocean Press, 2007.
[9] 靳志玲,李树生,朱国梁,吕怀鉴.海水观赏鱼人工海水的研制[J].海湖盐与化工,2003, 32(6): 16-17,20.doi: 10.3969/j.issn.1673-6850.2003.06.006.JIN Z L, LI S S, ZHU G L, LÜ H J.Research of artificial sea-water for ornamental fish[J].Sea Lake Salt and Chemical Industry, 2003,32(6): 16-17,20.doi: 10.3969/j.issn.1673-6850.2003.06.006.
[10] KESTER D R, DUEDALL I W, CONNORS D N, PYTKOWICZ R M.Preparation of artificial seawater[J].Limnology and Oceanography,1967,12(1): 176-179.doi: 10.4319/lo.1967.12.1.0176.
[11] 何望,桑明强,杨品红,曾艳君,张晓洪.河蟹人工海水育苗水质的监测与调控[J].内陆水产,1999(10): 2-4.HE W, SANG M Q, YANG P H, ZENG Y J, ZHANG X H.Monitoring and control of water quality of artificial seawater breeding in Chinese mitten Crab[J].Island Fisheries, 1999, (10): 2-4.
[12] 屈锐,江敏,李世凯.凡纳滨对虾人工海水育苗池水质研究[J].广东农业科学,2012(1): 120-123.doi: 10.16768/j.issn.1004-874X.2012.01.076.QU R, JIANG M, LI S K.Research on artificial seawater quality in the Penaeus vannamei larval breeding ponds[J].Guangdong Agricultural Sciences, 2012(1): 120-123.doi: 10.16768/j.issn.1004-874X.2012.01.076.
[13] 黄光华,马华威,黎建斌,杨彦豪,黄立斌,冯鹏霏,吕敏,卢小花,杨学明.人工海水对罗氏沼虾幼体生长发育及能量收支影响初探[J].水生态学杂志,2017, 38(2):76-81.doi: 10.15928 / j.1674-3075.2017.02.012.HUANG G H, MA H W, LI J B, YANG Y H, HUANG L B, FENG P F, LV M, LU X H, YANG X M.Effects of artificial seawater on the growth and energy budget of Macrobrachium rosenbergii Larvae[J].Journal of Hydroecology, 2017, 38(2):76-81.doi: 10.15928/j.1674-3075.2017.02.012.
[14] 黄光华,马华威,杨彦豪,黄立斌,冯鹏霏,吕敏,卢小花,童桂香.人工海水培育罗氏沼虾幼体试验[J].水产科学,2016,35(6) : 727-730.doi: 10.16378/j.cnki.1003-1111.2016.06.022.HUANG G H, MA H W, YANG Y H, HUANG L B, FENG P F, LV M,LU X H, TONG G X.Larva rearing of malaysian prawn Macrobrachium rosenbergii in artificial sea water[J].Fisheries Science, 2016, 35(6):727-730.doi: 10.16378/j.cnki.1003-1111.2016.06.022.
[15] PILLARD D A, DUFRESNE D L, TIETGE J E, EVANS J M.Response of mysid shrimp (Mysidopsis bahia), sheepshead minnow (Cyprinodon variegatus), and inland silverside minnow (Menidia beryllina) to changes in artificial seawater salinity[J].Environmental Toxicology and Chemistry, 1999, 18(3) :430-435.doi: 10.1002/etc.5620180310.
[16] OKU T SU T, CH A N T H A S ON E P, PHOM M ACH A N P,KOUNTHONGBANG A, LASASIMMA O, HAMADA K, MORIOKA S, ITO S.Use of artificial seawater in the rearing of the fluvial prawn Macrobrachium yui larvae[J].Aquaculture International, 2018,26(1): 325-335.doi:10.1007/s10499-017-0218-y.
[17] MACMILLAN R J, CAWTHORN R J, WHYTE S K, LYON P R.Design and maintenance of a closed artificial seawater system for long-term holding of bivalve shellfish[J].Aquacultural Engineering, 1994,13(4): 241-250.doi: 0144-8609/94/$7.110.
[18] ORELLANA J, WALLER U, WECKER B.Culture of yellowtail kingfish (Seriola lalandi) in a marine recirculating aquaculture system (RAS) with artificial seawater[J].Aquacultural Engineering,2014,58:20-28.doi:10.1016/j.aquaeng.2013.09.004.
[19] MARTINEZ-ÁLVAREZ RM, MORALES AE, SANZ A.Antioxidant defenses in fish: biotic and abiotic factors[J].Reviews in Fish Biology Fisheries, 2005, 15(1/2): 75-88.doi: 10.1007/s11160-005-7846-4.
[20] MA Z, GUO H, ZHENG P, WANG L, JIANG SHI, QIN J, ZHANG D.Ontogenetic development of the digestive functionality in golden pompano, Trachinotus ovatus(Linnaeus 1758)[J].Fish Physiology and Biochemistry, 2014, 40(4):1157-1167.doi: 10.1007/s10695-014-9912-0.
[21] MA Z, QIN J G, NIE Z.Morphological change of marine fish larvae and their nutrition need.In: Pourali K, Raad V N(eds) larvae: Morphology,biology and life cycle[M].New York:Nova Science Publishers Inc,2012:1-20.
[22] 于娜,李加儿,区又君,范春燕,张建生.盐度胁迫及昼夜变化对鲻鱼幼鱼消化酶活力的影响[J].南方水产科学,2011, 7(6): 52-57.doi:10.3969/ j.issn.2095 - 0780.2011.06.009.YU N, LI J E, OU Y J, FAN C Y, ZHANG J S.Effects of salinity stress and diurnal variation on digestive enzyme activity of juvenile grey mullet (Mugil cephalus)[J].South China Fisheries Science, 2011,7(6): 52-57.doi: 10.3969/j.issn.2095 - 0780.2011.06.009
[23] MIEGEL R P, PAIN S J, VAN WETTERE W H E J, HOWARTH G S,STONE D A J.Effect of water temperature on gut transit time, digestive enzyme activity and nutrient digestibility in yellowtail kingfish (Seriola lalandi)[J].Aquaculture, 2010, 308(3): 145-151.doi: 10.1016/j.aquaculture.2010.01.036.
[24] BOWYER J N, BOOTH M A, QIN J G, D'ANTIGNANA T, THOMSON M J S, STONE D A J.Temperature and dissolved oxygen influence growth and digestive enzyme activities of yellowtail kingfish Seriola lalandi (Valenciennes, 1833)[J].Aquaculture Research, 2014,45(12): 2010-2020.doi: 10.1111/are.12146.
[25] LI J S, LI J L, WU T T.The effects of copper, iron and zinc on digestive enzyme activity in the hybrid tilapia Oreochromis niloticus(L.) ×Oreochromis aureus (Steindachner)[J].Journal of Fish Biology, 2007, 71(6): 1788-1798.https://doi.org/10.1111/j.1095-8649.2007.01643.x.
[26] 王嫣,赵平孙,王珺.以人工海水和天然海水饲养的文昌鱼生长发育的比较[J].海南大学学报自然科学版, 2002, 20(1): 62-66.doi:10.15886/j.cnki.hdxbzkb.2002.01.016.WANG Y, ZHAO P S, WANG J.The comparison of the growth and development of the lancelets Branchiostoma belcheri tsingtaunese reared with natural and artificial seawater[J].Natural Science Journal of Hainan University, 2002, 20(1): 62-66.doi: 10.15886/j.cnki.hdxbzkb.2002.01.016.
[27] 王嫣,朱锦天.不同环境条件下文昌鱼耗氧的比较[J].海洋科学,2002, 26(6): 18-19,67.doi: 10.3969/j.issn.1000-3096.2002.06.006.WANG Y, ZHU J T.The Comparison of the oxygen consumption of lancelets Branchiostoma belcheri tsingtaunese cultured under different conditions[J].Marine Science, 2002, 26(6): 18-19,67.doi: 10.3969/j.issn.1000-3096.2002.06.006.
[28] 胡利华,查珊洁,刘广绪,张敏,王瑶华,肖国强,闫茂仓,黄贤克.天然海水与人工海水对凡纳滨对虾生长及代谢基因表达的影响[J].渔业研究,2017,39(6): 437-443.doi: 10.14012/j.cnki.fjsc.2017.06.003.HU L H, ZHA S J, LIU G X, ZHANG M, WANG Y H, XIAO G Q, YAN M C, HUANG X K.Impacts of natural seawater and artificial seawater on the growth performance and expression of metabolic genes of Pacific white shrimp[J].Journal of Fisheries Research, 2017, 39(6): 437-443.doi: 10.14012/j.cnki.fjsc.2017.06.003.
[29] FENG S C, ZHOU L, HUANG C H, XIE K, NICE E C.Interactomics: toward protein function and regulation[J].Expert Review of Proteomics, 2015, 12(1): 37-60.doi:10.1586/14789450.2015.1000870.
[30] 张克烽,张子平,陈芸,林鹏,王艺磊.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志,2007,42(2): 153-160.doi:10.3969/j.issn.0250-3263.2007.02.031.ZHANG K F, ZHANG Z P, CHEN Y, LIN P, WANG Y L.Antioxidant defense system in anilans[J].Chinese Journal of Zoology, 2007,42(2): 153-160.doi: 10.3969/j.issn.0250-3263.2007.02.031.
[31] 徐涛.环境因子对条纹锯鮨Centropristis striata能量代谢、渗透调节和抗氧化酶活力的影响[D].青岛:中国海洋大学,2007.doi:10.7666/d.y1112025.XU T.The effect of enviormental factors on energy Budget,osmoregulation and the activities of antioxidant enzymes of Centropristis striata[D].Qingdao: Ocean University of China, 2007.doi: 10.7666/d.y1112025.
[32] NISHIDA T, ISHIBASHI Y.Effects of seawater elements on growth, survival rate, and whole-body mineral concentration of the ocellate puffer (Takifugu rubripes) larvae and Juveniles[J].Aquaculture Science, 2011, 59(1): 59-64.doi: 10.1590/S0100-67622008000400015.
[33] PATIN N V, PRATTE Z A, REGENSBURGER M, HALL E,GILDE K, DOVE A D M, STEWART F J.Microbiome dynamics in a large artificial seawater aquarium[J].Applied and Environmental Microbiology, 2018, 84(10): 1-17.doi: 10.1128/AEM.00179-18.
[34] WANG T, CHENG Y Z, LIU Z P, YAN S H, LONG X H.Effects of light intensity on growth, immune response, plasma cortisol and fatty acid composition of juvenile Epinephelus coioides reared in artificial seawater[J].Aquaculture, 2013, 414-415: 135-139.doi:10.1016/j.aquaculture.2013.08.004.
[35] 邓潜,江林源,黄光华.调整人工海水配方中钙镁钾离子浓度对罗氏沼虾蚤状幼体的影响研究[J].农业与技术,2012, 32(7): 105-106.doi: 10.3969/j.issn.1671-962X.2012.07.079.DENG G Q, JIANG L Y, HAUNG G H.Effects of calcium, magnesium and potassium concentrations in the artificial seawater formula on the juveniles of macrobrachium rosenbergii[J].Agriculture and Technology, 2012, 32(7): 105-106.doi: 10.3969/j.issn.1671-962X.2012.07.079.
[36] 许友卿,屈浩林,丁兆坤.铅对水生动物抗氧化酶的影响、机理和防治[J].广东农业科学, 2012(18): 180-183.doi:10.16768/j.issn.1004-874X.2012.18.016.XU Y Q, QU H L, DING Z K.Effect of lead on antioxidant enzymes in aquatic animals and its prevention[J].Guangdong Agricultural Sciences, 2012(18): 180-183.doi:10.16768/j.issn.1004-874X.2012.18.016.
[37] 马光明,顾党恩,朱赟杰,牟希东,罗建仁,胡隐昌.灭非灵对尼罗罗非鱼乙酰胆碱酯酶和抗氧化酶活性的影响[J].广东农业科学,2015,42(8): 95-100.doi:10.16768/j.issn.1004-874X.2015.08.026.MA G M, GU D E, ZHU Y J, MU X D, LUO J R.Effects of Miefeiling on acetyl cholinesterase and antioxidant enzymes activities in Nile tilapia(Oreochromis niloticus)[J].Guangdong Agricultural Sciences,2015.42(8): 95-100.doi:10.16768/j.issn.1004-874X.2015.08.026
[38] 常藕琴,石存斌,吴淑勤.硫酸铜中毒对剑尾鱼肝脏和鳃损伤的病理学研究[J].广东农业科学,2012(21): 136-138.doi:10.16768/j.issn.1004-874X.2012.21.068.CHANG O Q, SHI C B, WU S Q.Pathological studies on liver and gill of swordtail fish with copper sulfate[J].Guangdong Agricultural Sciences, 2012(21): 136-138.doi:10.16768/j.issn.1004-874X.2012.21.068.
[39] 梁志凌,马艳平,冯国清,郝乐,马江耀,柯浩,刘振兴.β- 葡聚糖对黄沙鳖生长性能、免疫及抗氧化指标的影响[J].广东农业科学2019, 46(4): 95-100.doi:10.16768/j.issn.1004-874X.2019.04.014.LIANG Z L, MA Y P, FENG G Q, HAO L, MA J Y, KE H, LIU Z X.Effects of β-glucan on growth performance, immunity and antioxidant Indexes of Truogx sinensis[J].Guangdong Agricultural Sciences,2019, 46(4): 95-100.doi:10.16768/j.issn.1004-874X.2019.04.014.
[40] 周萌,吴灶和,梁日深,顾娜.急性降温对凡纳滨对虾血液生化指标及细胞免疫指标的影响[J].广东农业科学, 2015,42(24): 134-139.doi:10.16768/j.issn.1004-874X.2015.24.068.ZHOU M, WU Z H, LIANG R S, GU N.Biochemical and cellular immunological responses of Pacific white shrimp, Litopenaeus vannamei to cold shock[J].Guangdong Agricultural Sciences, 2015,42(24):134-139.doi:10.16768/j.issn.1004-874X.2015.24.068.