【研究意义】 干旱作为一种主要的非生物胁迫因子,严重影响到作物的产量和品质。研究作物抗旱性、了解作物在遭受干旱胁迫时的生理机制、缓解作物对水分的胁迫、提高作物的抗旱性,是国内外研究的热点之一[1-4]。全球有1/3以上的土地处于干旱和半干旱状态,其他地区在作物生长季节也发生不同程度的干旱[5-6],即使在我国南方非干旱区域也常会发生季节性、阶段性干旱。辣椒(Capsicum annuum L.)是一种重要的蔬菜作物,具有较高的营养价值,在我国蔬菜生产中占有举足轻重的地位。但辣椒属于浅根系植物,养分吸收能力较弱,既不耐旱也不耐涝,如果水分胁迫严重,容易造成根系生长不良,植株生长缓慢,造成辣椒减产和品质下降[7-10]。【前人研究进展】 吡咯喹啉醌(Pyrroloquinoline Quinine,PQQ)是一种不同于烟酰胺核苷酸(NAD+和NADP+)和黄素核苷酸(FAD和FMN)的新有机辅酶[11]。国内外研究表明,PQQ能够通过上调抗氧化酶的活力增强微生物对极端环境的适应能力[12-13];刘卫群等[14]研究发现,在冷胁迫条件下,PQQ可以通过提高SOD、APX活性和抑制GSH含量下降,减轻低温胁迫对黄瓜幼苗的伤害;朱云集等[15]研究发现在冬小麦生理代谢旺盛和小花退化高峰的孕穗期,喷洒PQQ能提高叶片中叶绿素含量,进而提高叶片光合速率、减少穗部小花败育。【本研究切入点】 近年来,PQQ的合成和提取技术取得新进展,在提高动物免疫力和品质改善方面成为研究热点[16-17],但在植物上尤其在辣椒抗旱方面尚未有报道和研究。因此,开展PQQ对辣椒抗旱性研究及提高辣椒抗旱性有重要意义。【拟解决的关键问题】 本研究以兴蔬215辣椒品种为试材,以盆栽试验形式研究干旱胁迫条件下辣椒对喷施PQQ的生理响应,探讨干旱胁迫下喷施PQQ后对辣椒植株生理生化指标的影响,为PQQ提高辣椒抗旱的生理机理提供理论依据,为其在农业生产中的应用奠定基础。
1 材料与方法
1.1 试验材料
本试验所用试材为辣椒品种兴蔬215,由湖南省蔬菜研究所提供;PQQ由上海医学生命科学研究中心有限公司提供。
1.2 试验方法
1.2.1 试验设计 2018年4月15日在湖南省蔬菜研究所播种催芽,温室育苗。6片真叶时定植于花盆中,每盆1株,每盆装土5 kg,盆规格为上口径25 cm、高30 cm、下口径20 cm。试验用土选自湖南省蔬菜研究所大棚内菜地0~20 cm土层,pH为6.8,属黏性土。试验用水均为自来水,水分处理采用称量法测定,根据试验用土壤的田间持水量设置为正常处理(70%~75%)和干旱处理(20%~30%)2个梯度,分别用L1和L2表示;喷 施 PQQ 设 0、50、100、200、500、1 000 nmol/L 6个浓度,分别用W1、W2、W3、W4、W5和W6表示,共组成12个处理,每个处理6次重复。试验在湖南省蔬菜研究所基地大棚内开展,于定植10 d缓苗后进行处理,正常处理L1保持土壤相对含水量在(70%~75%),干旱处理L2保持土壤相对含水量在(20%~30%),并每隔5 d向辣椒叶片上喷施不同浓度PQQ溶液,连续喷施3次,第3次喷施5 d后采集相同叶龄的辣椒叶片及果实进行相关生理指标测定。其他管理同常规。
1.2.2 测定项目及方法 喷施处理5 d后,对兴蔬215辣椒植株形态指标进行测量。形态指标包括株高、茎粗、叶面积,每个处理选取3株进行测量。利用卷尺测量株高,从植株地表处起测。茎粗,第1~2节之间,用记号笔做标记,用游标卡尺测量。叶面积,选取辣椒植株自上到下第五片功能叶,用ADC公司生产的AM200型便携式平板叶面积仪进行测量。
测定叶绿素含量采用紫外-可见分光光度计测量法[18]测定;可溶性蛋白含量采用考马斯亮蓝法[19]测定;丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[20]测定;可溶性糖含量采用蒽酮比色法[21]测定;脯氨酸含量采用茚三酮比色法[22]测定,超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)活性采用南京建成生物工程研究所生产的SOD、POD和CAT试剂盒测定,按其所示步骤进行操作。采用SPAD-520型叶绿素仪测定辣椒植株叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Ts)[23]。
试验数据采用Microsoft Excel2007软件进行处理,采用SPSS20.0软件进行差异显著性分析。
2 结果与分析
2.1 PQQ对干旱胁迫下辣椒生长的影响
PQQ对干旱胁迫下辣椒生长的影响如表1所示。W1~W4处理辣椒株高、茎粗和叶面积均随着PQQ浓度的上升而增加,但W5和W6处理各指标均呈现下降趋势,表明增施吡咯喹啉醌有助于辣椒植株生长,但是超过一定范围辣椒植株生长受到抑制,最适浓度W4处理较W1和W6处理总体上达到显著差异;干旱胁迫则导致辣椒株高和叶面积显著下降,但施用适宜浓度PQQ可显著提高辣椒的株高和叶面积。总体上看,L1W4处理最有利于辣椒生长,株高较L1W1处理提高23.56%,适宜浓度PQQ能够降低干旱胁迫对辣椒生长的不利影响。
2.2 PQQ对干旱胁迫下辣椒渗透调节的影响
2.2.1 PQQ对干旱胁迫下辣椒脯氨酸含量的影响 植物在缺水环境中为了更好生长,其体内渗透调节物质会积极响应降低细胞渗透势,以利于植物从外界吸收水分。由图1可知,干旱胁迫条件下辣椒脯氨酸含量均较正常生长条件下相同浓度PQQ处理高,脯氨酸含量随着PQQ浓度的增加呈先降低后升高的趋势。喷施PQQ各处理脯氨酸含量均低于W1处理,其中以W4处理最低,较W1处理降低30.77%、42.11%,差异显著;W5处理脯氨酸含量逐渐升高,但都低于W1处理。总体而言,L1W4处理脯氨酸含量最低。

图1 PQQ对干旱胁迫下辣椒脯氨酸含量的影响
Fig.1 Effect of PQQ on proline content of peper under drought stress
小写英文字母不同者表示差异显著
Different lowercase letters represent significant differences
表1 PQQ对干旱胁迫下辣椒生长指标的影响
Table 1 Effect of PQQ on the growth indexes of peper under drought stress
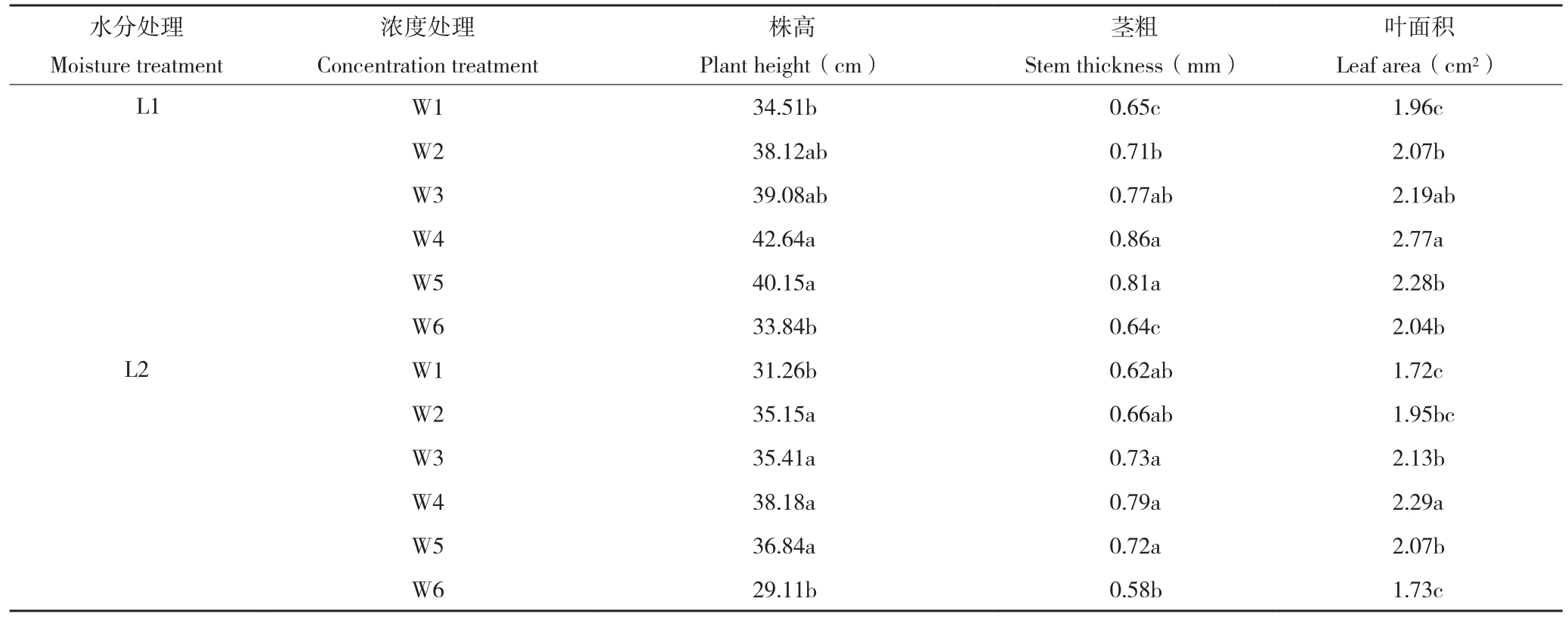
注:同列数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same column represent significant differences.
水分处理Moisture treatment叶面积Leaf area(cm2)L1 W1 34.51b 0.65c 1.96c W2 38.12ab 0.71b 2.07b W3 39.08ab 0.77ab 2.19ab W4 42.64a 0.86a 2.77a W5 40.15a 0.81a 2.28b W6 33.84b 0.64c 2.04b L2 W1 31.26b 0.62ab 1.72c W2 35.15a 0.66ab 1.95bc W3 35.41a 0.73a 2.13b W4 38.18a 0.79a 2.29a W5 36.84a 0.72a 2.07b W6 29.11b 0.58b 1.73c浓度处理Concentration treatment株高Plant height(cm)茎粗Stem thickness(mm)
2.2.2 PQQ对干旱胁迫下辣椒可溶性糖含量的影响 在水分胁迫等逆境下,植物为了适应环境,减少逆境胁迫对植物自身的伤害,植物体内积累大量可溶性糖,既可作为能量储备,又可以提高植物细胞溶质浓度含量,利于从外界环境中吸收水分[24]。由图2可知,随着PQQ浓度不断增加,辣椒叶片可溶性糖含量呈先增加后降低趋势,W4处理可溶性糖含量达到最大,在正常生长和干旱胁迫条件下可溶性糖含量表现趋势相同;在同一PQQ浓度时,干旱胁迫条件下可溶性糖含量高于正常生长处理。总体而言,L2W4处理可溶性糖含量最高。
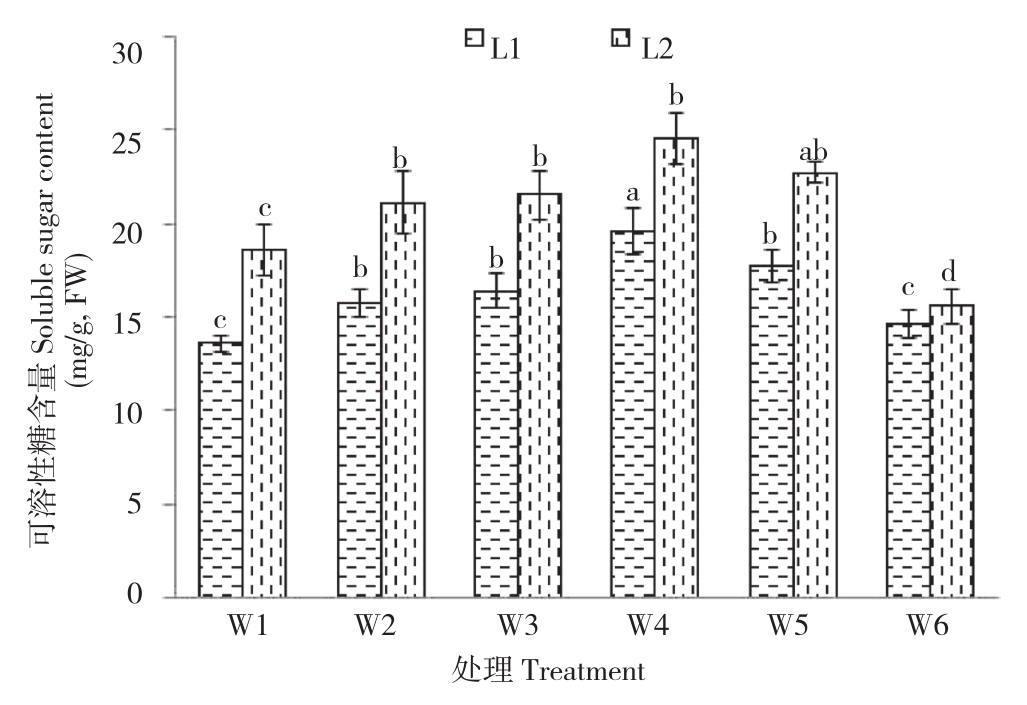
图2 PQQ对干旱胁迫下辣椒可溶性糖含量的影响
Fig.2 Effect of PQQ on soluble sugar content of peper under drought stress
小写英文字母不同者表示差异显著
Different lowercase letters represent significant differences between different treatments in at 0.05 level
2.3 PQQ对干旱胁迫下辣椒叶绿素含量的影响
由图3可知,在干旱胁迫条件下,辣椒叶片叶绿素含量较正常生长处理都有一定程度下降,说明干旱胁迫可以降低辣椒叶片叶绿素含量,但喷施适宜浓度的PQQ可以提高叶片叶绿素含量,两种水分处理条件下均以W4处理叶绿素含量达到最大,随着浓度增加,叶绿素含量逐渐降低;在正常生长条件下,除W6处理,W1与其他处理均有差异,且与W3和W4处理差异显著;干旱胁迫条件下各处理辣椒叶片叶绿素含量变化大,W1与其他处理存在显著差异。
2.4 PQQ对干旱胁迫下辣椒光合特性的影响
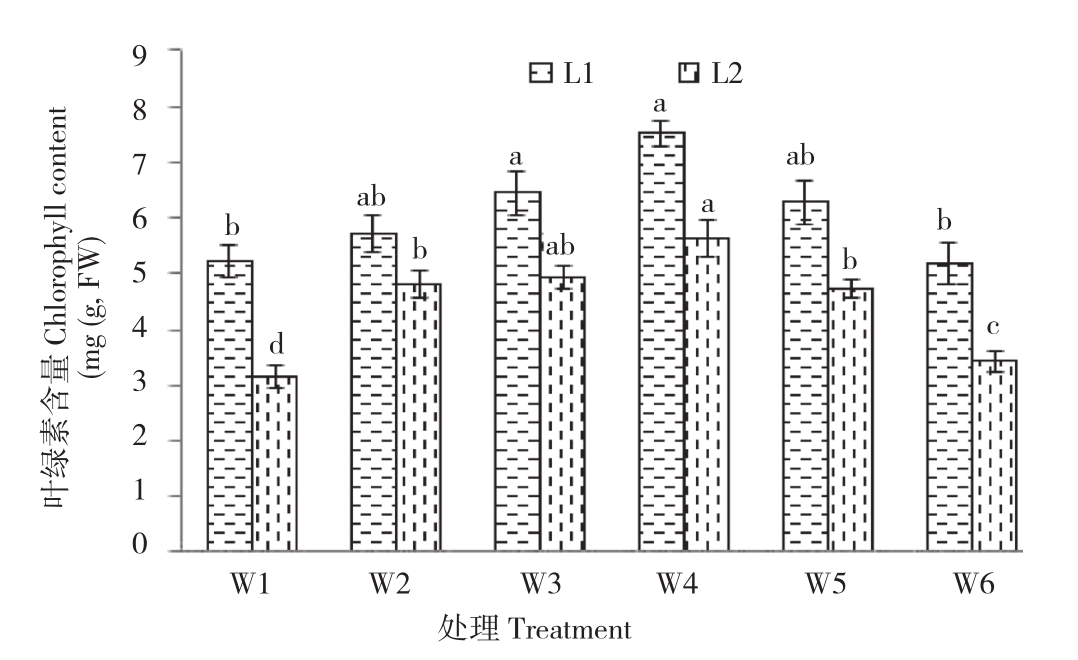
图3 PQQ对干旱胁迫下辣椒植株叶绿素含量的影响
Fig.3 Effect of PQQ on chlorophyll content of peper under drought stress
小写英文字母不同者表示差异显著
Different lowercase letters represent significant differences between different treatments in at 0.05 level
由表2可知,在正常生长和干旱胁迫两种条件下,随着施用PQQ浓度增加,辣椒叶片净光合速率、气孔导度和蒸腾速率均呈先增加后降低的趋势,W4处理净光合速率、气孔导度和蒸腾速率达到最大,后逐渐降低,正常生长条件下喷施PQQ的W3~W5各处理净光合速率、气孔导度和蒸腾速率差异不显著;干旱胁迫条件下适量浓度PQQ能显著增加辣椒叶片净光合速率、气孔导度和蒸腾速率,其中W4较W1处理提高130.89%、33.97%、14.81%,差异显著。喷施200 nmol/ L PQQ可以有效提高水分胁迫下辣椒的净光合速率、气孔导度和蒸腾速率。
2.5 PQQ对干旱胁迫下辣椒酶活性的影响
由表3可知,相同浓度PQQ对辣椒酶活性影响趋同,适宜浓度PQQ可以提高辣椒叶片SOD、POD活性,降低CAT活性、MDA含量,增加辣椒植株的抗氧化能力。随着PQQ浓度的增加,除正常生长处理的CAT活性无规律性变化外,辣椒叶片SOD、POD及CAT活性均呈先增加后降低趋势,L1W5处理CAT活性达到最大,其他处理均在W4达到最大,但与W1相比差异不显著;正常生长条件下,W6处理MDA含量最少,与其他处理差异显著,其他处理间无显著差异;干旱胁迫条件下,MDA含量表现为W6>W1>W2>W3>W4>W5,且各处理与W1均呈显著差异。
2.6 PQQ对干旱胁迫下辣椒果实品质的影响
由表4可知,干旱胁迫条件下,相同浓度PQQ溶液的辣椒果实Vc、可溶性糖及可溶性蛋白含量均低于正常生长处理,W1~W6各处理对辣椒Vc和可溶性蛋白含量无差异,可溶性糖含量随着PQQ浓度增加呈先增加后降低的趋势,在W4处理可溶性糖含量最高,较W1处理提高了21.49%,差异显著;总体而言,L1W4处理的可溶性糖含量最高,L1W6处理的Vc含量和可溶性蛋白含量最高。相同浓度时,正常生长处理的果实品质指标含量高于干旱胁迫处理,但干旱胁迫条件下浓度500 nmol/ L 以下可以改善辣椒果实品质。
表2 PQQ对干旱胁迫下辣椒光合特性的影响
Table 1 Effects of PQQ on photosynthetic characteristics of peper under drought stress
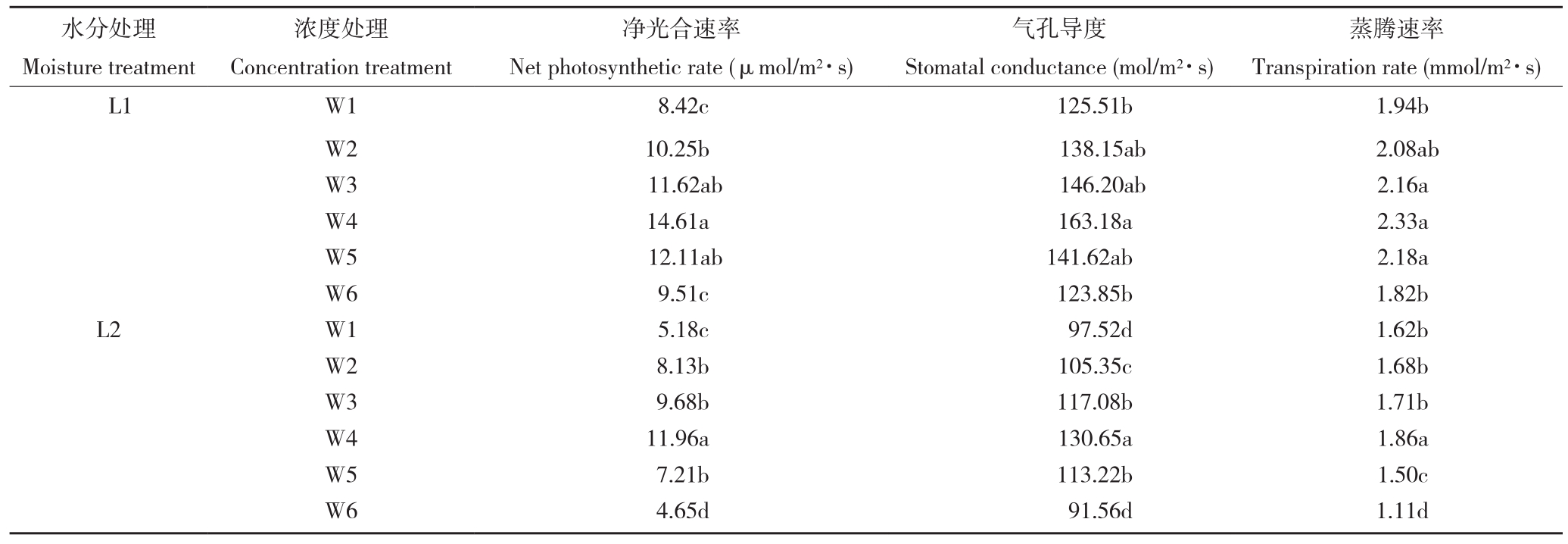
注:同列数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same column represent significant differences.
水分处理Moisture treatment蒸腾速率Transpiration rate (mmol/m2·s)L1 W1 8.42c 125.51b 1.94b W2 10.25b 138.15ab 2.08ab W3 11.62ab 146.20ab 2.16a W4 14.61a 163.18a 2.33a W5 12.11ab 141.62ab 2.18a W6 9.51c 123.85b 1.82b L2 W1 5.18c 97.52d 1.62b W2 8.13b 105.35c 1.68b W3 9.68b 117.08b 1.71b W4 11.96a 130.65a 1.86a W5 7.21b 113.22b 1.50c W6 4.65d 91.56d 1.11d浓度处理Concentration treatment净光合速率Net photosynthetic rate (μmol/m2·s)气孔导度Stomatal conductance (mol/m2·s)
表3 PQQ对干旱胁迫下辣椒酶活性及MDA含量的影响
Table 3 Effect of PQQ on enzyme activity and MDA content of peper under drought stress
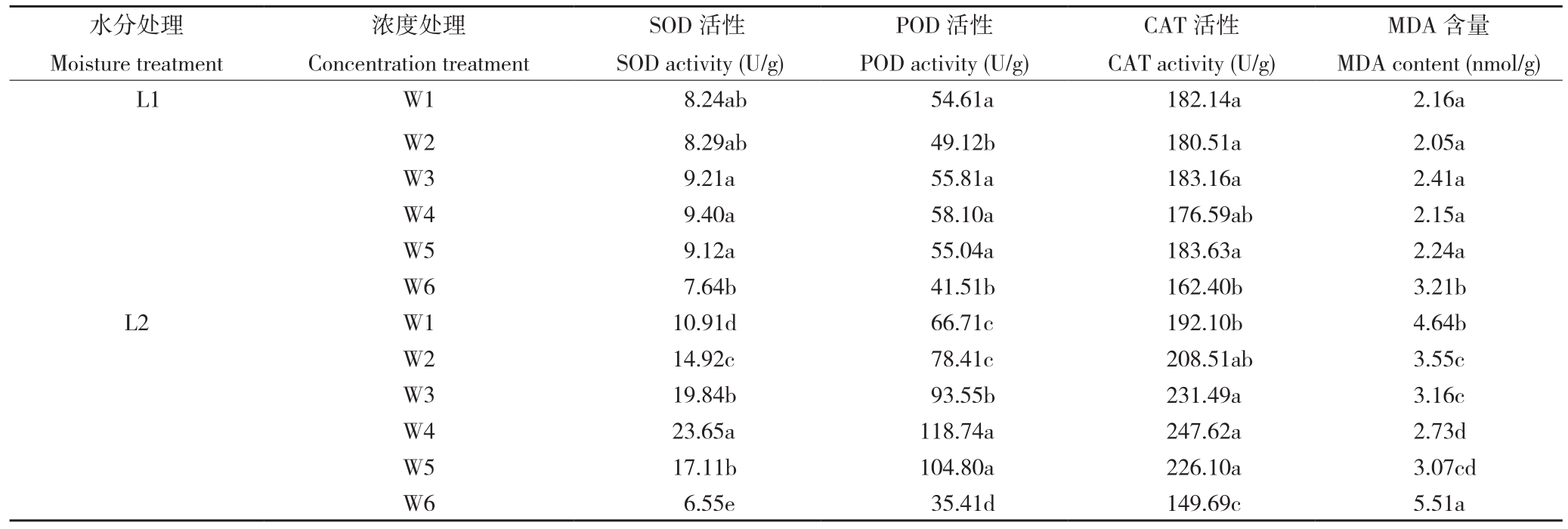
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
水分处理Moisture treatment MDA含量MDA content (nmol/g)L1 W1 8.24ab 54.61a 182.14a 2.16a W2 8.29ab 49.12b 180.51a 2.05a W3 9.21a 55.81a 183.16a 2.41a W4 9.40a 58.10a 176.59ab 2.15a W5 9.12a 55.04a 183.63a 2.24a W6 7.64b 41.51b 162.40b 3.21b L2 W1 10.91d 66.71c 192.10b 4.64b W2 14.92c 78.41c 208.51ab 3.55c W3 19.84b 93.55b 231.49a 3.16c W4 23.65a 118.74a 247.62a 2.73d W5 17.11b 104.80a 226.10a 3.07cd W6 6.55e 35.41d 149.69c 5.51a浓度处理Concentration treatment SOD活性SOD activity (U/g)POD活性POD activity (U/g)CAT活性CAT activity (U/g)
表4 PQQ对干旱胁迫下辣椒果实的品质影响
Table 4 Effect of PQQ on fruit quality of peper under drought stress

注:同列数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same column represent significant differences.
水分处理Moisture treatment可溶性蛋白含量Soluble protein content (mg/g)L1 W1 1.38a 27.6c 12.6a W2 1.34a 30.5b 13.5a W3 1.36a 31.8b 13.4a W4 1.27a 33.7a 12.3a W5 1.30a 34.9a 12.8a W6 1.42a 32.7ab 13.6a L2 W1 1.11a 22.8b 10.7a W2 1.15a 24.9ab 11.3a W3 1.05a 26.1a 10.8a W4 1.13a 27.7a 11.5a W5 1.19a 26.5a 11.6a W6 1.08a 24.4ab 10.4a浓度处理Concentration treatment Vc含量Vc content (mg/g)可溶性糖含量Soluble sugar content (mg/g)
3 讨论
作物受干旱胁迫后,植株体内会产生不同的代谢反应抵御胁迫,减少水分胁迫带来的伤害。通过外源物质强化植株体内代谢活动,减缓植株所受的伤害,进而提高作物抵御逆境能力,实现恢复生长,是作物受干旱胁迫后一种有效的修复途径[25-26]。由于作物存在多种抵御干旱胁迫逆境的途径或生理机制,本试验研究了干旱胁迫下喷施不同浓度PQQ对辣椒植株农艺性状差异、脯氨酸含量、可溶性糖含量、叶绿素含量、酶活、光合特性及品质的差异影响。研究发现,施用PQQ可以促进辣椒生长,与刘卫群等[14,27]研究结果相似,可能与增加叶片中DNA和RNA含量提高有关,另外施用适宜浓度PQQ能够降低干旱胁迫对辣椒生长的不利影响。植物的生长和果实发育依赖于光合产物的充足供应,干旱胁迫抑制了作物光合作用的进行,从而导致作物生长受抑制[28]。干旱胁迫下施用PQQ可以提高叶片中可溶性糖和叶绿素含量,降低脯氨酸含量,提高光合速率,增强活性,减轻干旱胁迫对辣椒的伤害,与朱云集等[15]研究结果类似,可能与PQQ直接参与逆境造成的DNA链断裂修复和植株体本身的抗氧化作用存在联系,间接提高了植物对逆境的耐受能力。同时我们的研究也表明在正常生长条件下,PQQ提高了辣椒的净光合速率、气孔导度和蒸腾速率,200 nmol/L浓度PQQ可以显著提高辣椒叶片SOD和POD活性,降低CAT活性、MDA含量,辣椒植株的抗氧化能力达到最优。由此可见,PQQ对辣椒光合作用与酶活性有一定促进作用,这可能是PQQ有效减轻干旱胁迫对辣椒光合作用抑制的主要原因。
4 结论
本研究结果表明,施用PQQ可以显著促进辣椒的生长,提高辣椒对水分胁迫的抗逆性,尤其在200 nmol/L浓度时的促生长及抗干旱胁迫效果最佳。本试验可以为辣椒阶段性干旱修复提供一定的理论依据,完善辣椒及其他植物的抗旱栽培技术提供新思路。然而仍存在不足之处,如施用PQQ对辣椒果实中Vc 含量和蛋白质含量无显著性影响,对辣椒果实的品质只能在可溶性糖含量方面有所改善,这可能是由于外源PQQ的施用量、施用方式及施用时间存在研究空白,同时PQQ抗旱分子机理还有待进一步研究。
[1]夏菁,张静美,施蕊,赵一鹤.多油辣木幼苗在干旱胁迫下的生理生化响应[J].西北林业科学,2019,48(1):106-113.doi:10.16473/j.cnki.xblykx1972.2019.01.018.
XIA J,ZHANG J M,SHI R,LI Q,ZHAO Y H.Physiological and biochemical responses of moringa oleifera seedling under the drought stress[J].Journal of West China Forestry Science,2019,48(1):106-113.doi:10.16473/j.cnki.xblykx1972.2019.01.018.
[2]薛吉全,马国胜,路海东,任建宏.作物抗旱性与作物生产[J].西安联合大学学报,2001,2:22-26.
XUE J Q,MA G S,LU H D,REN J H.Crops’Drought-resistance and production[J].Journal of Xi'an United University,2001,2: 22-26.
[3]陈珂,焦娟玉,尹英春.植物对水分胁迫的形态及生理响应[J].湖北农业科学,2009,48(4):992-995.
CHEN K,JIAO J Y,YIN Y C.The morphological and physiological responses of plants to water stress[J].Hubei Agricultural Sciences,2009,48(4): 992-995.
[4]吴智明.辣椒花蕾内源激素与基因表达差异分析及细胞质雄性不育基因分子标记的研究[D].广州:华南农业大学,2008.
WU Z M.Differential analysis of endogenous hormone and gene expression in pepper bud and molecular marker of cytoplasmic male sterility gene[D].Guangzhou:South China Agricultural University,2008.
[5]卢育华.蔬菜栽培学各论(北方本)[M].北京:中国农业出版社,2000.
LU Y H.On vegetable cultivation studies (North) [M].Beijing: China Agricultural Press,2000,85-88.
[6]陈善福,舒庆尧.植物耐干旱胁迫的生物学机理及其基因工程研究进展[J].植物学通报,1999,16(5):555-556.
CHEN S F,SHU Q Y.The biological mechanism of plant resistance to drought stress and its advances in genetic engineering[J].Chinese Bulletin of Batany,1999,16(5): 555-556.
[7]Boyer J S.Plant productivity and environment[J].Science,1982,218:443-448.doi:10.1126/science.218.4571.443.
[8]UMEZAWA T,FUJITA M,FUJITAM Y,YAMAGUCHI S K,SHINOZAKI K.Engineering drought tolerance in plants: discovering and tailoring genes to unlock the future[J].Current Opinion in Biotechnology,2006,17:113-122.doi:10.1016/j.copbio.2006.02.002.
[9]DING Z,LI S,AN X,LIU X,QIN H J,WANG D W.Transgenic expression of MYB15 confers enhanced sensitivity to abscisic acid and improved drought tolerance in Arabidopsis thaliana[J].Journal of Genetics and Genomics,2009,36:17-29.doi:10.1016/S1673-8527(09)60003-5.
[10]OH S J,KIM Y S,KWON C W,PARK H K,JEONG J S,KIM J K.Overexpression of the transcription factor AP37 in rice improves grain yield under drought conditions[J].Plant Physiology,2009,150:1368-1379.doi:10.1104/pp.109.137554.
[11]匡炜,刘洋,李强,张玉烛,朱国奇.PQQ对水稻产量及主要农艺性状的影响[J].湖南农业科学,2017(12):40-42.doi:10.16498/j.cnki.hnnykx.2017.012.006.
KUANG W,LIU Y,LI Q,ZHANG Y Z,ZHU G Q.Effects of PQQ on yield composition and main agronomic characters of rice[J].Hunan Agricultural Sciences,2017(12):40-42.doi:10.16498/j.cnki.hnnykx.2017.012.006.
[12]张鹏,孙慧玲,孙静娴,杜阳,李淑英.吡咯喹啉醌(PQQ)营养作用研究进展[J].现代生物医学进展,2014,14(10):1987-1990.
ZHANG P,SUN H L,SUN J X,DU Y,LI S Y.Research progress on nutritional effects of pyrylquinolinquinone (PQQ)[J].Progress in Modern Biomedicine,2014,14(10):1987-1990.
[13]KHAIRNAR N P,MISRA H S,APTE S K.Pyrroloquinoline-quinone synthesized in Escherichia coli by pyrroloquinoline-quinone synthase of Deinococcus radiourans plays a role beyond mineral phosphate solubilization[J].Biochemical Biophysical Research Communications,2003,312(2):303-308.doi:10.1016/j.bbrc.2003.10.121.
[14]刘卫群,朱云集,王永华,赵永芳.低温胁迫下PQQ对黄瓜幼苗子叶防御系统的影响[J].武汉大学学报(自然科学版),1998,44(4):485-488.
LIU W Q,ZHU Y J,WANG Y H,ZHAO Y F.Effect of PQQ on protrctive system in cocomber cotyledons under low temperature stress[J].Journal of Wuhan University (Natural Science Edition),1998,44(4):485-488.
[15]朱云集,王永华,郭天财,刘卫群,赵永芳.吡咯喹啉醌对冬小麦某些生理特性和穗部性状的影响[J].植物生理学通讯,2000,36(4):330-332.
ZHU Y J,WANG Y H,GUO T C,LIU W Q,ZHAO Y F.Effects of pyrroquinolinone on some physiological characteristics and ear properties in wheat[J].Plant Physiology Newsletter,2000,36(4):330-332.
[16]KASAHARA T,KATO T.Nutritional biochemistry: A new redoxconfactor vitamin for mammals[J].Nature,2003,422(6934):832.doi:10.1038/422832a.
[17]STITES T,STORMS D,BAUERLY K,MAH J,HARRIS C,FASCETTI A,ROGERS Q,TCHAPARIAN E,SATRE M,RUCKER R.Pyrroloquinoline quinine modulates mitochondrial quantity and function I mice[J].The Journal of Nutrition,2006,136(2):390-396.doi:10.1093/jn/136.2.390.
[18]潘玲玲,徐晓洁,谭晶晶,张海艳,乔英哲,张晔晖.分光光度法快速测定玉米叶片中的叶绿素[J].分析化学,2007,35(3):413-415.
PAN L L,XU X J,TAN J J,ZHANG H Y,QIAO Y Z,ZHANG Y H.Spectrophotometric determination of chlorophyll concentrations in maize leaves[J].Chinese Journal of Analytical Chemistry,2007,35(3):413-415.
[19]李关荣,李天俊,冯建成.生物化学实验教程[M].第1版.北京:中国农业大学出版社,2011.
LI G R,LI T J,FENG J C.Biochemistry experiment course[M].Beijing: China Agricultural University Press,2011.
[20]李子芳,吴锡冬.植物丙二醛含量测定试验设计方案[J].天津农业科学,2016,22(9):49-51.doi:10.3969/j.issn.1006-6500.2016.09.011.
LI Z F,WU X D.Experimental design scheme for the effect of drought stress on content of malondialdehyde of indoor ornamental plants[J].Tianjin Agricultural Science,2016,22(9):49-51.doi:10.3969/j.issn.1006-6500.2016.09.011.
[21]林炎坤.常用的几种蒽酮比色定糖法的比较和改进[J].植物生理学通讯,1989(4):53-55.
LIN Y K.Comparison and improvement of several common anthronecolorimetric methods for sugar content in plant[J].Plant Physiology Communications,1989(4):53-55.
[22]张永芳.茚三酮呈色法测定谷子种子中的游离氨基酸含量[J].种子,2014,33(1):111-113.
ZHANG Y F.Determination of free amino acids content in millet seeds by Ninhydrine coloration method[J].Seed,2014,33(1):111-113.
[23]程艳,吴春燕,张晓旭,王娜,孙凯,于娅,王飞,张晓明,宫国辉.蕹菜叶片SPAD值与叶绿素含量的相关性分析[J].东北农业科学,2018(4):44-47.doi:10.16423/j.cnki.1003-8701.2018.04.011.
CHEN Y,WU C Y,ZHANG X X,WANG N,SUN K,YU Y,WANG F,ZHANG X M,GONG G H.Analysis of correlation between SPAD value and chlorophyll content in water spinach leaves[J].Journal of Northeast Agricultural Scissors,2018(4):44-47.doi:10.16423/j.cnki.1003-8701.2018.04.011.
[24]刘冰,周新国,李彩霞,甄博,李会贞,李中阳.叶面喷施外源多胺提高夏玉米灌浆前期抗涝性[J].农业工程学报,2016,32(12):122-128.doi:10.11975/j.issn.1002-6819.2016.12.018.
LIU B,ZHOU X G,LI C X,ZHEN B,LI H ZH,LI Z Y.Foliar spraying polyamine inproving waterlogging resistance of summer maize in early grain filling stage[J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(12):122-128.doi:10.11975/j.issn.1002-6819.2016.12.018.
[25]金鹰,王传宽,周正虎.木本植物木质部栓塞修复机制:研究进展与问题[J].植物生态学报,2016,40(8):834-846.doi:10.17521/cjpe.2016.0118.
JIN Y,WANG C K,ZHOU Z H.Mechanism of xylem embolism repair in Woody plants: research progress and questions[J].Chinese Journal of Plant Ecology,2016,40(8): 834-846.doi:10.17521/cjpe.2016.0118.
[26]韩文娇,白林利,李昌晓,崔振,燕江伟,秦红.前期水淹对牛鞭草后期干旱胁迫光合生理响应的影响[J].生态学报,2016,36(18):5712-5724.doi:10.5846/stxb201507181513.
HAN W J,BAI L L,LI C X,CUI Z,YAN J W,QIN H.Effects of flooding on the photosynthetic response of Hemarthria altissina to drought[J].Acta Ecologica Sinica,2016,36(18):5712-5724.doi:10.5846/stxb201507181513.
[27]刘卫群,杨铁钊,李文.吡咯喹啉醌对烟叶幼苗中IAA和玉米素加玉米素核苷及核酸含量的影响[J].植物生理学通讯,1998,34(4):259-260.
LIU W Q,YANG T Z,LI W.Effects of pyrroquinolinone quion on the contents of IAA,Z+ZR and nucleic acid in tobacco seedling[J].Plant Physiology Newsletter,1998,34(4):259-260.
[28]MCLAUGHLIN J E,BOYER J S.Sugar-responsive gene expression,invertase activity and senescence in aborting maize ovaries at low water potentials[J].Annals of Botany,2004,94:675-689.doi:10.1093/aob/mch193.