【研究意义】 目前我国对水冶过程中产生的废弃物通常采用集中堆放在具备防渗漏措施的尾矿库中的方式[1-2]。尾矿库采取了一系列的保障措施来保障其安全[3],即便如此,尾矿中的放射性核素仍会通过各种化学途径具备溶解性,缓慢的向周边的自然环境中释放,给周边生态环境和人类健康带来潜在的危害[4],因此监测及评估铀尾矿周边土壤的质量具有非常重要的意义[5]。【前人研究进展】 土壤微生物作为土壤分解系统的主要组成部分,在生态系统循环中有着不可替代的重要地位[6]。土壤微生物生物量是土壤有机质中最活跃、最敏感的部分,同时微生物生物量在维持土壤中大量酶过程和保护能量、营养方面起到关键作用[7]。基于土壤微生物及其参与的生化过程对污染物表现出的敏感性,可以采用微生物学指标来预测土壤生态系统的变化特征[8]。将微生物的变化特征作为监测土壤质量变化、表征土壤生态系统群落结构稳定性的重要指标,被人们在生态学、土壤生态学等领域广泛接受和应用[9-11]。另外,研究重金属污染对土壤微生物多样性的影响,一直以来都受到研究人员的青睐。通过研究重金属胁迫对微生物群落结构和功能的变化,以及微生物对重金属的解毒机制,建立重金属剂量与生物反应的关系,为制定土壤重金属污染阈值和修复指标提供依据[12]。
【本研究切入点】 目前,国内虽然已有关于铀尾矿安全监测方面的研究,但是大多数集中在铀尾矿中核素迁移规律及迁移机理等方面的研究[13-15],有关放射性污染对土壤微生物活性及多样性的研究报道甚少。为此,本研究以我国某典型铀尾矿库中所取土壤为研究对象,使用微生物活性测定方法和Biolog-Eco技术对土壤微生物活性及群落功能多样性进行分析。【拟解决的关键问题】 探讨放射性污染剂量与微生物活性及群落功能多样性的内在联系,从而为放射性污染土壤生物修复及构建微生物土壤环境质量评价体系提供参考。
1 材料与方法
1.1 试验材料
试验土样于2013年初采集于我国某典型尾矿库地区。前期查阅大量环评资料及前期的研究基础材料,按照放射性核素U的含量高低设置6个取样区域。使用土样采集器沿“S”型路线按0~15 cm土层深度取样,土样置于聚乙烯保鲜袋,24 h内置于4℃冰箱保存。在实验室内,将土样分为两部分,分别测定微生物活性、土壤基本理化性质、放射性核素含量等相关指标(表1、表2)。选取远离铀尾矿初期坝的上游土壤作为对照,设为1号。
1.2 试验方法
1.2.1 土壤微生物活性指标测定 微生物基础呼吸、土壤微生物量碳、氮含量测试方法参照文献[16]。
1.2.2 土壤微生物群落功能多样性测定 采用有96个孔、31种碳源、其中一组为对照的生态板(Biolog-ECO)分析微生物群落功能多样性特征。ECO板接种液的制备参照李芳兰等[17]的方法。先将待测土样于25 ℃下预培养24 h,取等同于干重10 g土样与90 mL 0.85 mol/L NaC1溶液混匀,250 r/min震荡培养30 min,将上清液用NaC1溶液稀释1 000倍。ECO板中各孔加样量为150 uL,设置3个平行,25 ℃下恒温培养8 d,分别在培养24、48、72、96、120、144、168、192 h, 波 长为590 nm下读数,ECO板使用前需预热0.5 h。
表1 供试土壤基本理化性质
Table1 Physical and chemical properties of soil samples
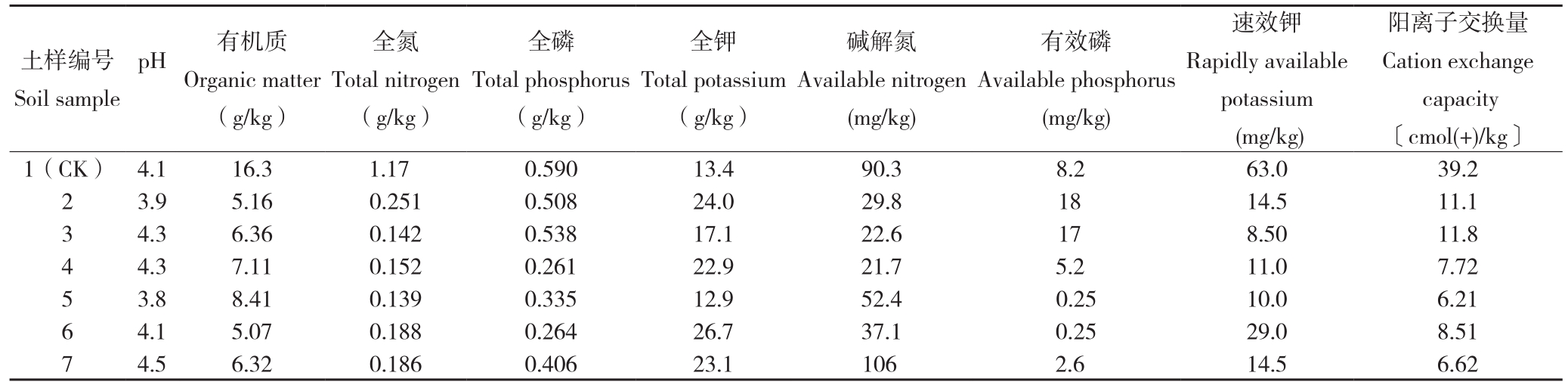
土样编号Soil sample阳离子交换量Cation exchange capacity〔cmol(+)/kg〕1(CK) 4.1 16.3 1.17 0.590 13.4 90.3 8.2 63.0 39.2 2 3.9 5.16 0.251 0.508 24.0 29.8 18 14.5 11.1 3 4.3 6.36 0.142 0.538 17.1 22.6 17 8.50 11.8 4 4.3 7.11 0.152 0.261 22.9 21.7 5.2 11.0 7.72 5 3.8 8.41 0.139 0.335 12.9 52.4 0.25 10.0 6.21 6 4.1 5.07 0.188 0.264 26.7 37.1 0.25 29.0 8.51 7 4.5 6.32 0.186 0.406 23.1 106 2.6 14.5 6.62 pH 有机质Organic matter(g/kg)全氮Total nitrogen(g/kg)全磷Total phosphorus(g/kg)全钾Total potassium(g/kg)碱解氮Available nitrogen(mg/kg)有效磷Available phosphorus(mg/kg)速效钾Rapidly available potassium(mg/kg)
表2 土壤中放射性核素的含量
Table2 Content of radioactive nuclides in soils
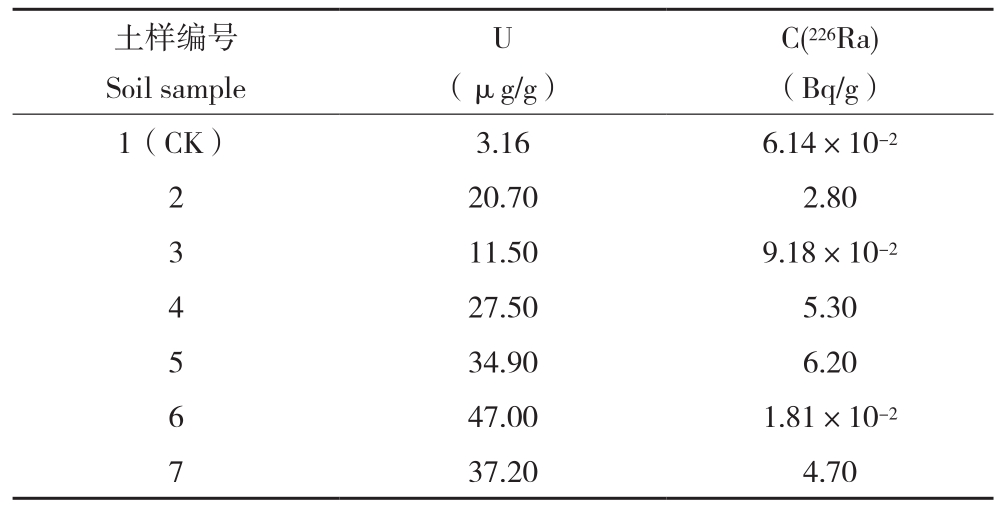
土样编号Soil sample C(226Ra)(Bq/g)1(CK) 3.16 6.14×10-2 2 20.70 2.80 3 11.50 9.18×10-2 4 27.50 5.30 5 34.90 6.20 6 47.00 1.81×10-2 7 37.20 4.70 U(μg/g)

丰富度指数(S)指每孔中(Ci-R)的值大于0.25的孔数[8],其中Ci为每个有培养基孔的光密度值;R为对照孔的光密度值;n为培养基碳源种类,本研究中为31;Pi为(Ci -R) 的值大于0.25的孔数与整板总差的比值。
试验数据采用Origin7.5、SPSS20.0软件进行处理及作图和统计分析[18-20]。
2 结果与分析
2.1 不同放射性污染土壤微生物活性变化 大量研究通过土壤微生物量、基础呼吸、代谢熵以及微生物熵来解释土壤污染程度,本试验的土壤微生物活性分析结果(表3)显示,各指标随污染程度的变化存在一定程度上的差异。其中,微生物量碳(MBC)并不是简单随着污染程度的增加而逐渐降低,相反3、5、6号土样的微生物量碳(MBC)竟高于对照;各土样的微生物量氮(MBN)相比对照下降了16.09%~32.90%,除3号土样外,其他各取样点的基础呼吸和代谢熵相比对照分别下降16.49%~32.90%、2.01%~69.12%;各取样点的微生物熵分别是对照的2.50~3.75倍。相关性分析结果(表4)表明,U、Ra与各指标均呈负相关,但未达到显著水平。土壤微生物活性指标差异研究结果表明,2号取样点MBC与其余各点差异显著,1号取样点MBN和微生物熵均表现出与其余各点差异显著;对于微生物基础呼吸来说,除4号与6号取样点间差异不显著外,其余各点均表现为差异显著;5号和3号取样点微生物代谢熵与其余各点间差异显著。
表3 土壤微生物活性指标
Table 3 Soil microbial activity indicators
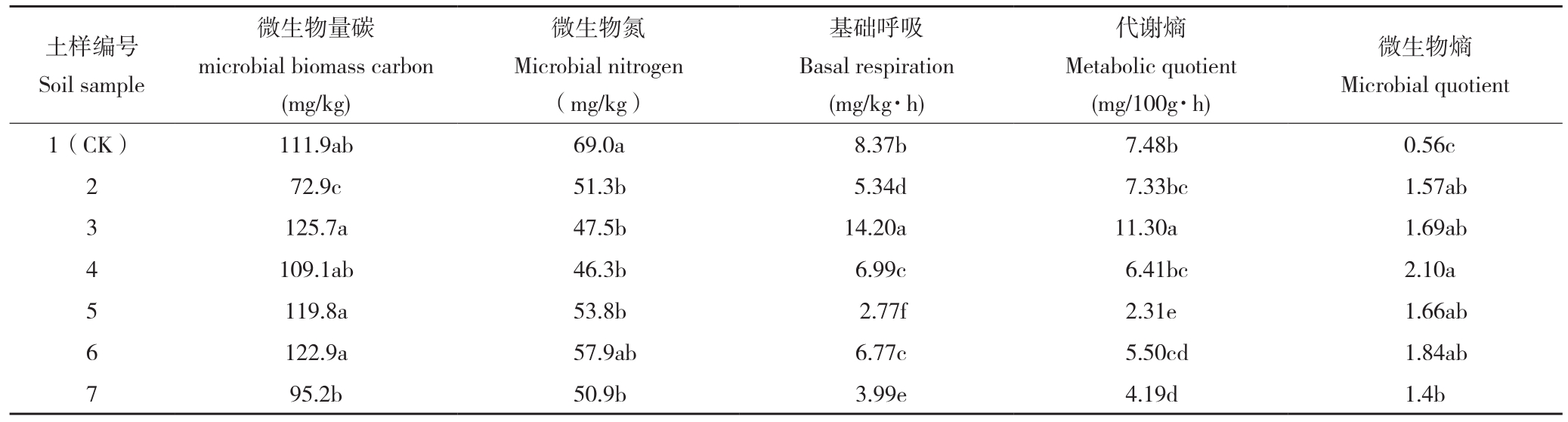
土样编号Soil sample微生物熵Microbial quotient 1(CK) 111.9ab 69.0a 8.37b 7.48b 0.56c 2 72.9c 51.3b 5.34d 7.33bc 1.57ab 3 125.7a 47.5b 14.20a 11.30a 1.69ab 4 109.1ab 46.3b 6.99c 6.41bc 2.10a 5 119.8a 53.8b 2.77f 2.31e 1.66ab 6 122.9a 57.9ab 6.77c 5.50cd 1.84ab 7 95.2b 50.9b 3.99e 4.19d 1.4b微生物量碳microbial biomass carbon(mg/kg)微生物氮Microbial nitrogen(mg/kg)基础呼吸Basal respiration(mg/kg·h)代谢熵Metabolic quotient(mg/100g·h)
表4 放射性核素与微生物参数的相关性
Table 4 Correlation between radioactive nuclides and microbial parameters
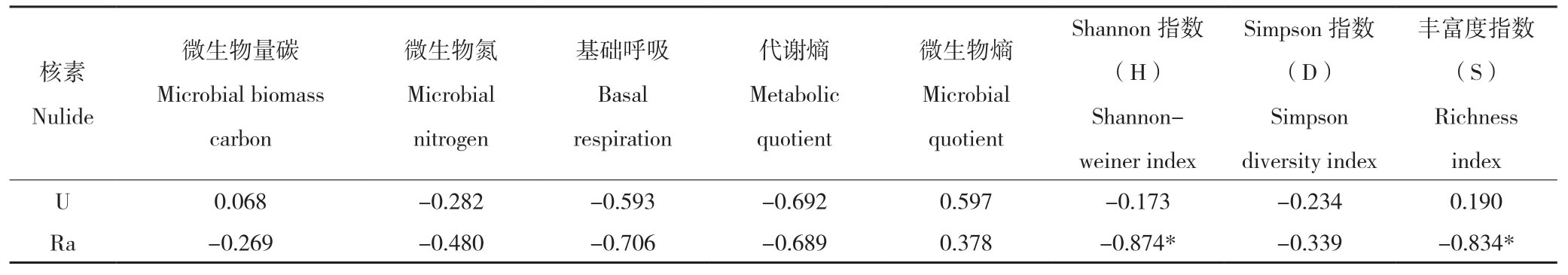
注:*表示显著相关,**表示极显著相关。
Note: *represents significant correlation,**represents extremely significant correlation.
丰富度Shannon指数Simpson指数核素Nulide指数(S)Richness index微生物量碳Microbial biomass carbon微生物氮Microbial nitrogen基础呼吸Basal respiration代谢熵Metabolic quotient微生物熵Microbial quotient(H)Shannonweiner index(D)Simpson diversity index U 0.068 -0.282 -0.593 -0.692 0.597 -0.173 -0.234 0.190 Ra -0.269 -0.480 -0.706 -0.689 0.378 -0.874* -0.339 -0.834*
2.2 不同放射性污染土壤中微生物群落功能多样性的变化
2.2.1 微生物群落代谢剖面AWCD的变化 AWCD反映土壤微生物代谢活性,是测定土壤微生物碳源利用能力的重要指标[18]。从图1可以看出,随着培养时间的增加,AWCD值也呈现不同程度的增加。第一个转折点发生在培养48 h,1、6号土样的AWCD呈明显升高的趋势;第二个转折点发生在培养72 h,2、3、4号土样AWCD持续升高直到培养144 h,这种变化趋于平稳直到试验结束,除6号样品外,其他各点的AWCD值变化速度(斜率)和最终AWCD值比对照均有不同程度的下降。总体来看,当AWCD值开始增加时,各样品的AWCD值增加趋势不同,对照和6号土样的变化速率相对较快,其余各点在整个培养阶段活性都处于一个较低的水平。表明6号土样AWCD最大值及变化速度在整个培养过程中都显著高于对照1号土样,其原因可能是低浓度的Ra造成的逆境,刺激微生物代谢增加的原因。
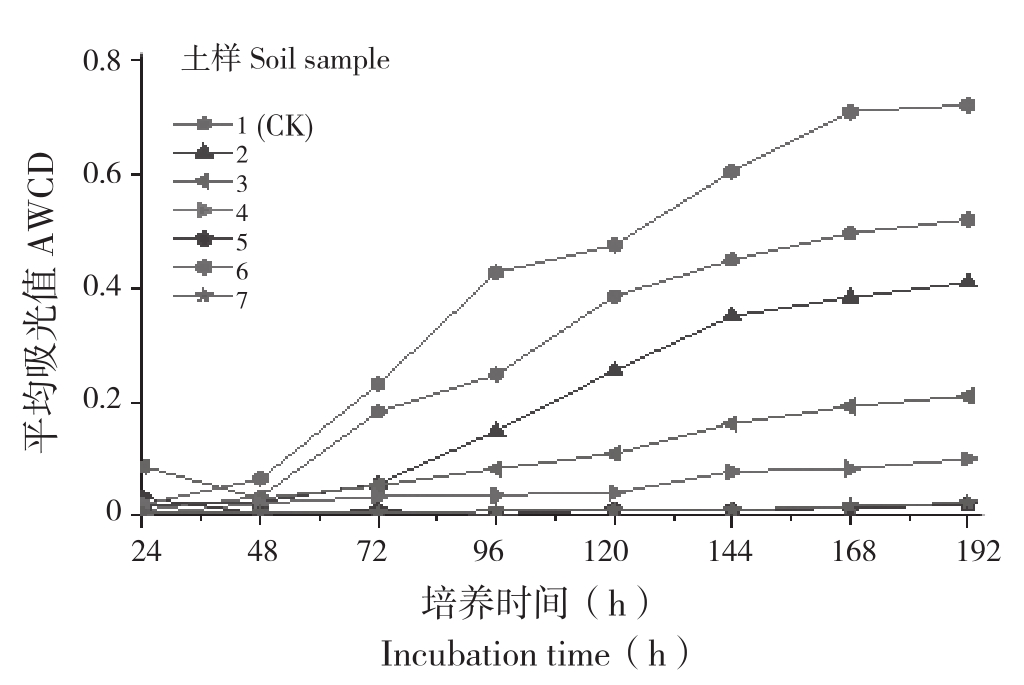
图1 土壤微生物平均吸光值变化
Fig.1 Changes in average well color development(AWCD) values of soil microbes
2.2.2 微生物对不同碳源的利用特征 根据化学基团的性质把生态板上的31种碳源分为6类,即酚酸类、碳水化合物类、羧酸类、氨基酸类、碳水化合物类胺类[21]。可以采用土壤微生物在生态板上培养168 h的数值进行主成分分析,进而比较土壤微生物对不同碳源的利用特征。31种因子中提取的5个主成分因子,累计贡献率达99.290%,分别可以解释所有变量方差的27.472%和25.901%、23.673%、12.860%、9.385%。不同程度污染土壤主成分分析结果(图2)表明,各取样点与对照点微生物群落有明显的差别,说明放射性污染使土壤微生物生理代谢产生了明显的变化。从表5可以看出,PC1载荷表现较高的碳源共有9种,其中3种氨基酸,3种碳水化合物,2种羧酸类,1种胺类;PC2载荷表现较高的碳源共有9种,其中3种氨基酸,碳水化合物和羧酸类各2种,多聚物和酚酸类各1种;PC3载荷表现较高的碳源共有6种,其中3种碳水化合物,酚酸类、胺类、多聚物各1种,表明碳水化合物和氨基酸在PC1和PC2上的权重较大,在PC3上碳水化合物的权重较大。由此可见,各取样点微生物群落代谢利用碳源差异主要表现在为碳水化合物类,其次是氨基酸类以及其他碳源类型。
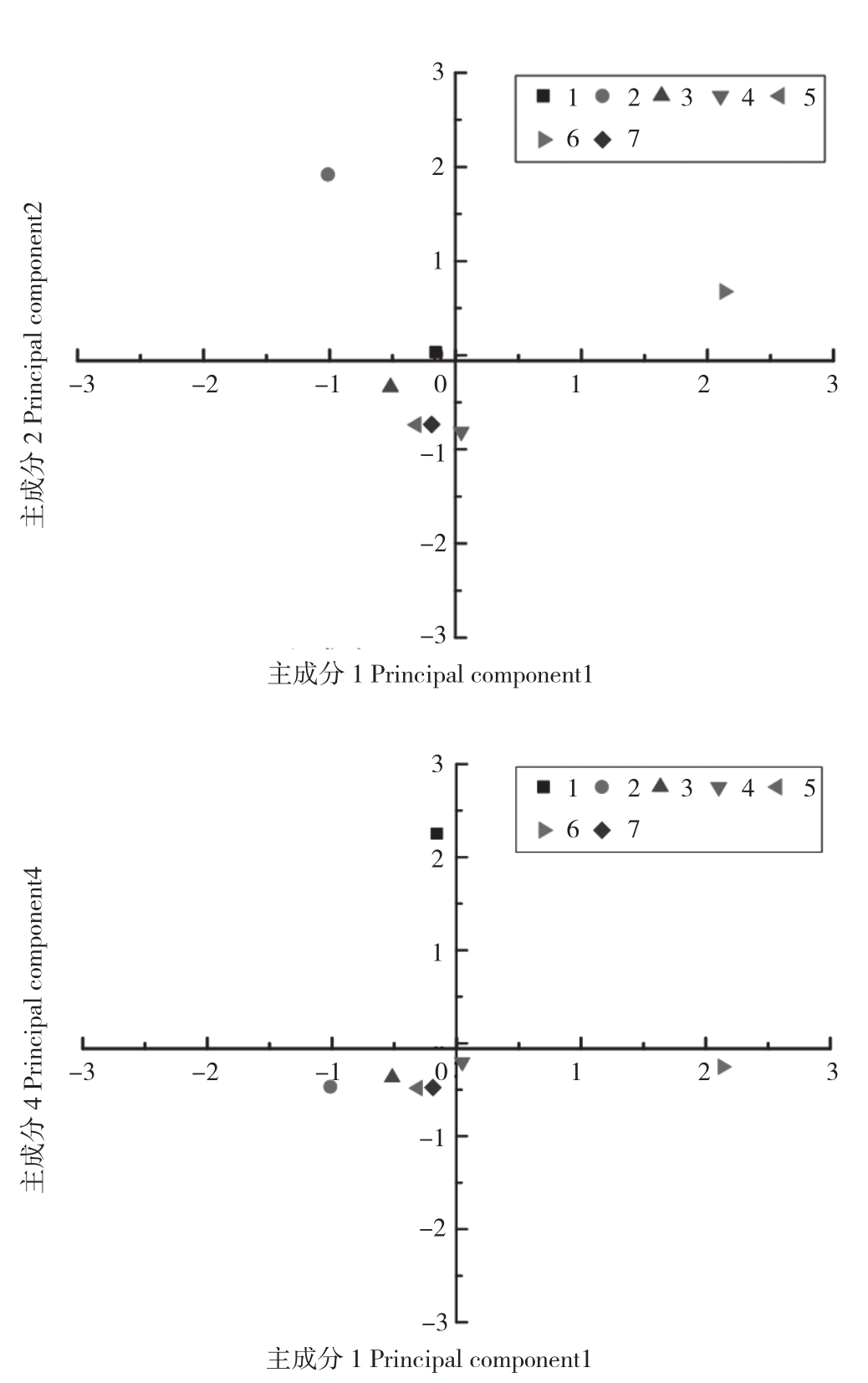
图 2 土壤微生物碳源利用类型的主成分分析
Fig.2 Principal components analysis of carbon utilization by soil microbes
2.2.3 微生物多样性指数分析 采用培养168 h的测定数据计算土壤微生物群落功能多样性指数,其中,Shannon多样性指数表示在颜色变化率一致的情况下,整个生态系统土壤微生物群落利用碳源类型的多与少[22]。从表6可以看出,除6号土样的各指标较对照稍大,其他各点的Shannon指数(H)、Simpson 指数(D)、丰富度指数(S)与对照相比分别下降5.26%~30.53%、28.73%~90.55%、57.14%~100%,值得注意的是5号土样,因其(C-R)<0.25,故将其丰富度记作0。从相关性分析(表4)可以看出,放射性核素U与各功能指数的相关性不明显,而Ra与Shannon指数(H)、丰富度指数(S)呈显著负相关,以上结论可以从一定程度上说明放射性核素对微生物多样性产生了一定的影响。
表5 土壤微生物碳源利用主成分1、2、3载荷较高的碳源
Table 5 Variable loading characteristics of high principal components for carbon source utilization by soil microbes
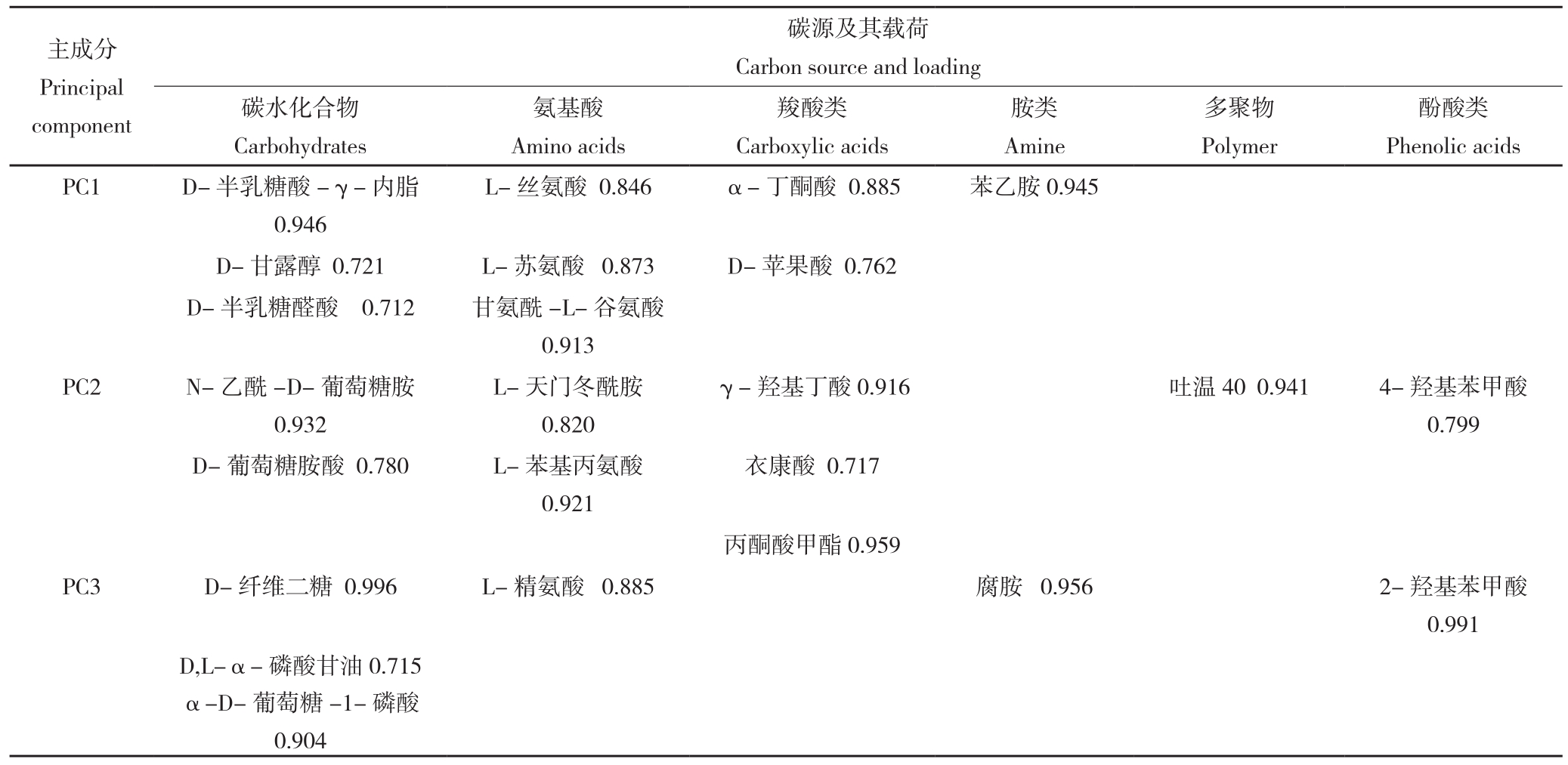
主成分Principal component酚酸类Phenolic acids PC1 D-半乳糖酸-γ-内脂0.946碳源及其载荷Carbon source and loading碳水化合物Carbohydrates氨基酸Amino acids羧酸类Carboxylic acids胺类Amine多聚物Polymer L-丝氨酸 0.846 α-丁酮酸 0.885 苯乙胺 0.945 D-甘露醇 0.721 L-苏氨酸 0.873 D-苹果酸 0.762 D-半乳糖醛酸 0.712 甘氨酰-L-谷氨酸0.913 PC2 N-乙酰-D-葡萄糖胺0.932 γ-羟基丁酸 0.916 吐温40 0.941 4-羟基苯甲酸0.799 D-葡萄糖胺酸 0.780 L-苯基丙氨酸0.921 L-天门冬酰胺0.820衣康酸 0.717丙酮酸甲酯 0.959 PC3 D-纤维二糖 0.996 L-精氨酸 0.885 腐胺 0.956 2-羟基苯甲酸0.991 D,L-α-磷酸甘油 0.715 α-D-葡萄糖-1-磷酸0.904
表6 土壤微生物功能多样性指数
Table 6 Functional diversity indicators of soil microbes
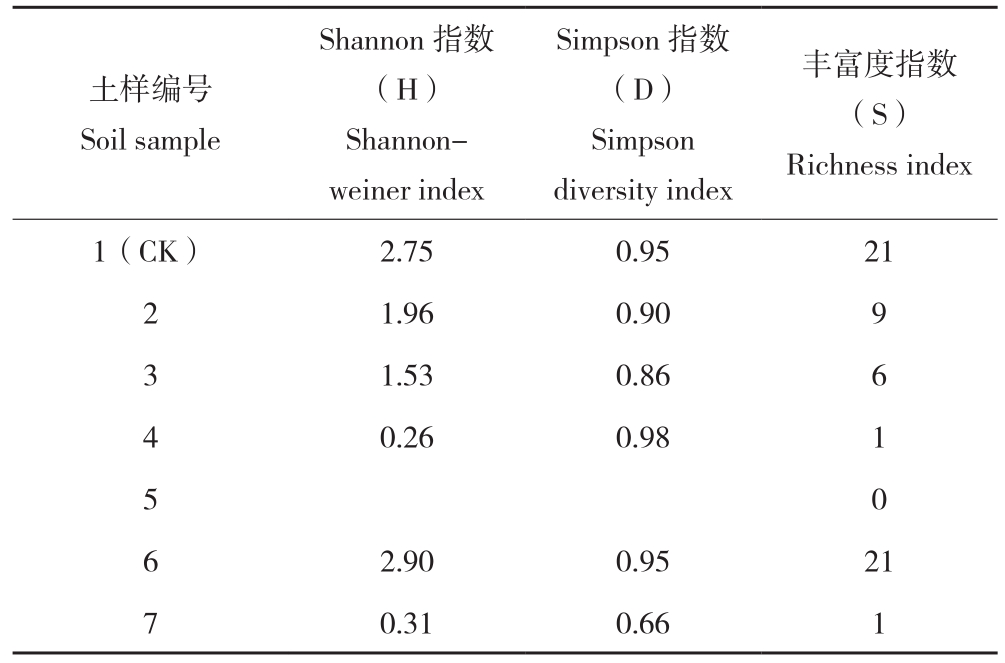
土样编号Soil sample Shannon指数(H)Shannonweiner index Simpson指数(D)Simpson diversity index丰富度指数(S)Richness index 1(CK) 2.75 0.95 21 2 1.96 0.90 9 3 1.53 0.86 6 4 0.26 0.98 1 5 0 6 2.90 0.95 21 7 0.31 0.66 1
3 讨论
土壤微生物生物量、基础呼吸、代谢熵、微生物熵等微生物生理生态参数是近年来用的较多的评估土壤环境质量的指标。一般来说,土壤微生物量与土壤污染元素呈显著负相关,张涪平等[23]研究了藏中矿区重金属对土壤微生物量的影响,结果表明土壤的微生物生物量受到重金属污染的严重影响,随着土壤重金属含量的增加,土壤微生物量碳氮逐渐下降;也有研究称矿区周边的中低浓度的区域微生物量也明显减少[24]。本试验结果显示土壤微生物量与放射性核素的相关性不明显,而且5号取样点的土壤微生物量碳比对照高,可是Biolog结果显示其活性较低,这一结果也明反映土壤放射性核素污染对土壤微生物活性的影响是复杂的,研究结果差异较大,有时甚至相互矛盾[25],其具体原因有待进一步探讨。土壤基础呼吸代表土壤碳素的周转的速率及微生物的总体活性,与土壤环境质量有着密切的关系;代谢熵把微生物生物量和微生物活性结合起来。本研究中供试土壤的基础呼吸、代谢熵以及微生物熵都高于对照,可能是由于微生物可以保持极低的基质利用率。相关性分析表明放射性核素与微生物熵呈正相关关系,在一定程度上说明放射性核素对环境造成了胁迫效应,使微生物活性发生了变化,从而改变了土壤的肥力和质量,这与JÚLIA等[26]的研究结果相似。
土壤微生物群落功能多样性是反应矿区生态环境稳定性的重要指示因子之一,污染程度不同的土壤微生物群落碳源利用的能力是不同,土壤微生物群落利用碳源类型的多与少可以用各种的多样性指数表示[27]。有研究指出,尾矿区土壤微生物群落代谢剖面( AWCD) 及群落丰富度、多样性指数均显著低于非矿区土壤[28],本试验的研究结果与其基本相似,6号土样在整个培养过程中的AWCD值以及多样性各指数都高于对照,可能是由于含水量以及微生物组成区系不同,也有可能是放射性核素长期污染下,该环境更有利于微生物的更替,产生了抗胁迫能力较强的微生物种类,具体原因还有待研究。值得指出的是本试验的各活性指标以及多样性指数均与U的相关性不强,可以说明U在一定程度上未对土壤微生物造成影响或很少,而Ra与Shannon指数(H)、丰富度指数(S)呈显著负相关,表明这2个多样性指数能较真实地反映铀尾矿周边地区Ra污染状况,但仍需对各多样性指数的适用范围和条件进行研究,并对各指数的数学方法和生物学意义进行深入研究,才能更好地了解尾矿库微生物群落的多样性。
4 结论
通过对我国某典型铀尾矿库中放射性污染土壤微生物活性及功能多样性特征进行研究,发现放射性污染会对土壤微生物活性产生影响,低浓度污染放射性污染造成的逆境会使微生物活性升高,但高浓度的放射性污染则会抑制微生物生长。在放射性污染对微生物群落功能多样性影响方面,放射性污染使土壤微生物群落结构和功能发生改变,微生物对碳源的利用能力降低,物种丰富度下降,且这种变化主要是由Ra引起的。主成分分析(PCA)表明微生物对碳源的利用差异主要体现在碳水化合物上,其次是氨基酸及其他碳源。
[1]张彬,冯志刚,马强,陈荣,王小龙,段先哲,韩世礼.广东某铀废石堆周边土壤中铀污染特征及其环境有效性[J].生态环境学报,2015(1): 156-162.doi:10.16258/j.cnki.1674-5906.2015.01.023.
ZHANG B,FENG Z G,MA Q,WANG X L,DUAN X Z,HAN S L.Pollution characteristics and environmental availability of uranium in the soils around a uanium waste rock pile in Guangdong Province,China[J].Ecology and Environmental Sciences,2015,24(1): 156-162.doi:10.16258/j.cnki.1674-5906.2015.01.023.
[2]WAGNER F,JUNG H,HIMMELSBACH T,MELESHYN A.Impact of Uranium Mill Tailings on Water Resources in Mailuu Suu,Kyrgyzstan//Uranium-Past and Future Challenges[M].Springer International Publishing,2015.doi:10.1007/978-3-319-11059-256.
[3]李航.尾矿库坝体稳定性及其灾变预警机制研究[D].大连:大连通大学,2014.
LI H.Study of tailing dam stability and disaster early warning mechanism[D].Dalian: Dalian Jiaotong University,2014.
[4]RUEDIG E,JOHNSON T E.An evaluation of health risk to the public as a consequence of in situ uranium mining in Wyoming,USA[J].Journal of Environmental Radioactivity,2015,150:170-178.doi:10.1016/j.jenvrad.2015.08.004.
[5]杨巍,杨亚新,曹龙生,张叶,郑勇明.某铀尾矿库中放射性核素对环境的影响[J].东华理工大学学报(自然科学版),2011,34(2):155-159.doi:10.3969/j.issn.1674-3504.2011.02.009.
YANG W,YANG Y X,CAO L S,ZHANG Y,ZHENG Y M.Environmental impact of radionuclides from uranium tailings[J].Journal of East China Institure of Technology,2011,34(2):155-159.doi:10.3969/j.issn.1674-3504.2011.02.009.
[6]PIGNATARO A,MOSCATELLI M C,MOCALI S,GREGO S,BENEDETTI A.Assessment of soil microbial functional diversity in a coppiced forest system[J].Applied Soil Ecology,2012,62(Complete):115-123.doi:10.1016/j.apsoil.2012.07.007.
[7]LANDA E R.Uranium mill tailings: nuclear waste and natural laboratory for geochemical and radioecological investigations[J].Journal of Environmental Radioactivity,2004,77(1):1-27.doi:10.1016/j.jenvrad.2004.01.030.
[8]TSIAMIS G,KARPOUZAS D,CHERIF A,MAVROMMATIS K.Microbial diversity for biotechnology[J].BioMed Research International,2014,2014:845972.doi:10.1155/2014/845972.
[9]徐文娴,赵从举,朱敏捷,吴喆滢,韩奇,郑庆扬.海南岛桉树人工林土壤微生物功能多样性特征[J].广东农业科学,2016,43(7): 65-72.doi:10.16768/j.issn.1004-874X.2016.07.011.
XU W X, ZHAO C J,ZHU M J,WU Z Y,HAN Q,ZHENG Q Y.Soil microbial functional diversity of Eucalyptus plantation in Hainan Island[J].Guangdong Agricultural Sciences,2016,43(7):65-72.doi:10.16768/j.issn.1004-874X.2016.07.011.
[10]李江涛,罗甜甜,杜满聪,倪杰,龚建周.畜禽粪肥添加及干湿交替强度对土壤微生物功能多样性的影响[J].广东农业科学,2018,45(6):74-83.doi: 10.16768/j.ISSN.1004-874X.2018.06.012.
LI J T,LUO T T,DU M C,NI J,GONG J Z.Effects of livestock and poultry manure amendment and wetting-drying cycle on functional diversity of soil microbial community[J].Guangdong Agricultural Sciences,2018,45(6):74-83.doi: 10.16768/j.ISSN.1004-874X.2018.06.012.
[11]周玉杰,李建华,张广宇,王宁,谭文丽,王永鹏.橡胶林土壤微生物碳代谢功能多样性及其变化[J].广东农业科学,2017,44(11):68-74.doi: 10.16768/j.issn.1004-874X.2017.11.011.
ZHOU Y J,LI J H,ZHANG G Y,WANG N,TAN W L,WANG Y P.Functional diversity of soil microbial carbon metabolism of rubber tree plantations and its changes[J]. Guangdong Agricultural Sciences,2017,44(11):68-74.doi:10.16768/j.issn.1004-874X.2017.11.011.
[12]赵立君,任伟,郑毅,王妍,李佳璇,齐丹卉.砷污染湿地生境下土壤微生物多样性及群落结构特征[J].环境科学研究,2019,32(1):156-164.
ZHAO L J,REN W,ZHENG Y,WANG Y,LI J X,QI D H.Characteristics of soil microbial diversity and community structure in arsenic-polluted wetland habitats[J].Research of Environmental Sciences,2019,32(1):156-164.
[13]李稳, 陈功新,孙占学,刘顺亮,王文凤.某铀尾矿中U、Th在电场作用下释放及迁移规律[J].有色金属(冶炼部分),2019(2):70-75.doi:CNKI:SUN:METE.0.2019-02-015.
LI W,CHEN G X,SUN Z X,ZHAO S L,WANG W F.Release and Migration of U and Th in uranium tailings under electric field[J].Nonferrous Metals(Extractive Metallurgy), 2019(2):70-75.doi:CNKI:S UN:METE.0.2019-02-015.
[14]史鸿晋,彭同江,孙红娟,刘波,张行泉.模拟降雨对铀尾矿中U、Sr、Mn、Fe释放规律的影响[J].环境化学 ,2016(6):1253-1260.doi:10.7524/j.issn.0254-6108.2016.06.2015090802.
SHI H J,PENG T J,SUN H J,LIU B,ZHANG X Q.The release properties of U,Sr,Mn and Fe in uranium mill tailings under simulated rainfall[J].Environmental Chemistry,2016,35(6):1253-1260.doi:10.7524/j.issn.0254-6108.2016.06.2015090802.
[15]刘媛媛,魏强林,高柏,陈功新.放射性核素在不同介质中的迁移规律研究现状及进展[J].有色金属(冶炼部分),2018(6): 76-81.doi:10.3969/j.issn.1007-7545.2018.06.018.
LIU Y Y,WEI Q L,GAO B,CHEN G X.Current status and progress on migration of radionuclides in different media[J].Nonferrous Metals (Extractive Metallurgy),2018(6): 76-81.doi:10.3969/j.issn.1007-7545.2018.06.018.
[16]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学技术出版社,2000:107-108,269-271.
LU R K .Soil Agricultural Chemical Analysis Method[M].Beijing:China Agricultural Science and Technology Press,2000:107-108,269-271.
[17]LI F,LIU M,LI Z,JIANG C,HAN F,CHEN Y.Changes in soil microbial biomass and functional diversity with a nitrogen gradient in soil columns[J].Applied Soil Ecology,2013,64:1-6.doi:10.1016/j.apsoil.2012.10.006.
[18]ZHANG H F,LI G,SONG X L.Changes in soil microbial functional diversity under different vegetation restoration patterns for Hulunbeier Sandy Land[J].Acta Ecologica Sinica,2013,33(1): 38-44.doi:10.1016/j.chnaes.2012.12.006.
[19]VELASCO G V,PROBANZA A,MANERO F J G,TREVINO A C,MORENO J M,GARCIA J A L.Effect of fire and retardant on soil microbial activity and functional diversity in a mediterranean pasture[J].Geoderma,2009,153(1-2),0-193.doi: 10.1016/j.geoderma.2009.08.005.
[20]WEI Y,YU L F,ZHANG J C,YUAN C,Deangelis D.L.Relationship between vegetation restoration and soil microbial characteristics in degraded karst regions: A case study[J].Pedosphere,2011,21(1):0-138.doi:10.1016/s1002-0160(10)60088-4.
[21]孔滨,杨秀娟.Biolog生态板的应用原理及碳源构成[J].绿色科技,2011(7):231-234.doi:10.3969/j.issn.1674-9944.2011.07.100.
KONG B,YANG X J.Application principle of Biolog ECO board and carbon source[J].Journal of Green Science and Technology,2011(7):231-234.doi:10.3969/j.issn.1674-9944.2011.07.100.
[22]孟庆杰,许艳丽,李春杰,韩晓增,裴希超.不同植被覆盖对黑土微生物功能多样性的影响[J].生态学杂志,2008,27(7):1134-1140.
MENG Q J,XU Y L,LI C J,HAN X Z,PEI X C.Effect of different vegetation coverage on microbial functional diversity in black soil [J].Chinese Journal of Ecology,2008,27(7): 1134-1140.
[23]张涪平,曹凑贵,李苹,次仁央金,通乐嘎,李成芳.藏中矿区重金属污染对土壤微生物学特性的影响[J].农业环境科学学报,2010,29(4):698-704.
ZHANG F P,CAO Z G,LI P,CI R Y J,TONG L G,LI C F.Effects of heavy pollution on microbial characteristics of mine soils in central Tibet[J].Journal of Agro-Environment Science,2010,29(4): 698-704.
[24]DAHLIN S,WITTER E,ANNA M,TURNER A,ERLAND B.Where's the limit? Changes in the microbiological properties of agricultural soils at low levels of metal contamination[J].Soil Biology and Biochemistry,1997,29(9-10):1405-1415.doi:10.1016/S0038-0717(97)00048-5.
[25]向彬,王彬,徐卫红,熊治庭.重金属Cd、Zn、Cu、Pb对土壤微生物和酶活性的影响[J].氨基酸和生物资源,2012,34(3):4-8.doi:10.3969/j.issn.1006-8376.2012.03.002.
XIANG B,WANG B,XU W H,XIONG Z T.Effect of Cd,Zn,Cu and Pb on soil microbial biomass and enzyme activities[J].Amino Acids & Boitic Resource,2012,34(3):4-8.doi:10.3969/j.issn.1006-8376.2012.03.002.
[26]JULIA C N,LOLATA G B,CARVALHO G M D,SILVA E M D,JOSE PAULO SOUSA,NOGUEIRA M A.Microbial indicators of soil health as tools for ecological risk assessment of a metal contaminated site in Brazil[J].Applied Soil Ecology,2012,59:96-105.doi:10.1016/j.apsoil.2012.03.019.
[27]JUSSILA M M,JURGENS G,LINDSTR M K,SUOMINEN L.Genetic diversity of culturable bacteria in oil-contaminated rhizosphere of Galega orientalis[J].Environmental Pollution,2006,139(2):0-257.doi:10.1016/j.envpol.2005.05.013.
[28]滕应,黄昌勇,骆永明,龙健,姚槐应.铅锌银尾矿区土壤微生物活性及其群落功能多样性研究[J].土壤学报,2004,41(1):113-119.doi:10.11766/trxb200209100119.
TENG Y,HUANG C Y,LUO Y M,LONG J,YAO H Y.Microbial activities and functional diversity of community in soils polluted with Pb-Zn-Ag mine tailings[J].Acta Pedologica sinica,2004,41(1) :113-120.doi:10.11766/trxb200209100119.