【研究意义】 近年来核电行业对原料核素铀的需求量不断增长,铀矿在开采和冶炼的同时伴随着铀矿废渣、废气以及矿区废水的产生,这些废弃物具有低放射性、分布广、排放量大等特点,同时由于核素具有放射周期长的特性,严重影响周围生态环境[1]。核素对人体和生物的危害主要是辐射能量吸收引起的致电离作用,致使白血球增加、癌变和其他放射性病变,乃至危害生命[2]。因此,铀矿废水对人类和环境存在较大的危害,应采取措施进行治理和控制。【前人研究进展】 国内外对含铀废水的处理方法主要包括混凝沉淀法、蒸发浓缩法、离子交换法、膜处理法、吸附法等物理化学法以及生物富集法[3-5]。由于生物富集治理低浓度含铀废水具有效率高、成本低、耗能少、无二次污染物等优点,受到众多学者的关注和研究[6]。国内外目前对植物修复[7]的研究主要集中在陆生植物(如吊竹梅[8]、商陆[9]、鸭拓草[10]等),较少报道湿生植物。研究表明,伊乐藻[11]、凤眼莲[12]、鱼腥藻[13]、浮萍[14]、酸模[15]和铜钱草[16]等水生植物对铀有一定的累积能力。泽泻[17]和鱼腥草[18]这两种广泛分布的湿生植物对重金属有较强的耐受性,但泽泻和鱼腥草对放射性核素的累积及耐受性研究尚未见报道。植物的抗氧化酶活性、光合及荧光参数[19]对重金属胁迫较为敏感,可作为评判植物受重金属污染毒害程度指标。
【本研究切入点】 目前关于重金属对湿生植物抗氧化酶活性、光合、荧光参数影响的报道较多,但放射性核素对湿生植物抗氧化酶活性及光合、荧光参数影响的报道较少。【拟解决的关键问题】 本研究通过水培试验,探究不同铀浓度处理对泽泻和鱼腥草的抗氧化酶活性、光合荧光参数的影响以及它们对铀的积累能力,旨在为湿生植物处理低浓度铀矿废水提供数据参考和科学依据。
1 材料与方法
1.1 试验材料
试验地点位于西南科技大学重金属污染修复试验场,实验时间为2018年夏,试验地夏季平均温度30(±5)℃,年平均湿度79%,以泽泻和鱼腥草为供试植物,用去离子水洗净泽泻和鱼腥草幼苗根部淤泥,再将幼苗置1/2Hoagland营养液中驯化培养10 d,挑选大小和生长情况基本一致的植株作试验材料。
1.2 试验设计
试验设计铀浓度5、30、55 mg/L和空白对照4个处理,每个处理3次重复,每个重复1塑料框(21.28 L)。称取乙酸双氧铀(分析纯药品)配成相应浓度铀溶液,调节pH值至5.5左右,再将所挑选的泽泻和鱼腥草植株分别定植于各铀溶液的塑料筐中培养,每隔5~7 d补去离子水至刻度处。
1.3 测定指标及方法
供试泽泻和鱼腥草培养21 d后,每个塑料框中随机采集3个重复样,测定植株新鲜叶片的可溶性蛋白含量、过氧化氢酶活性(CAT)、过氧化物酶活性(POD)、超氧化物歧化酶活性(SOD)、丙二醛含量(MDA)以及铀胁迫下对植物光合、荧光参数的影响;培养到22 d时,分别采集植株茎叶和根部分别制备成干样,测定泽泻和鱼腥草植株中铀的累积量。
在泽泻和鱼腥草生长旺盛期7月21日,称取植物叶片鲜样0.2 g,用考马斯亮蓝染色法测定可溶性蛋白含量;采用LC Pro-S+全自动便携式光合仪(北京澳作生态仪器有限公司),于稳定光照下,选取相同叶位测定各植株叶片的光合参数,包括气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)和光合速率(A),每个处理测3次取均值;采用M-PEA叶绿素荧光仪(英国Hansatech公司)测定叶片叶绿素荧光参数[20]; SOD活性采用氮蓝四唑(NBT)光化还原法测定[21],POD活性采用愈创木酚法测定[22],CAT活性采用分光光度法测定[23],MDA含量用硫代巴比妥酸(TBA)提取法测定;使用ETHOS UP微波消解仪(意大利Milestone公司)进行消解,消解液通过注射过滤器过滤后使用Agilent 7700x ICP-MS(美国安捷伦科技有限公司)测定铀含量。
试验数据应用IBM SPSS Statistics 20进行分析,应用Origin2016软件作图。

2 结果与分析
2.1 铀对泽泻和鱼腥草可溶性蛋白含量的影响
由图1可知,泽泻的可溶性蛋白质含量随水中铀浓度的增加而逐渐减少,其中铀浓度55 mg/L处理的可溶性蛋白含量最低,与空白对照组相比,降幅达60.6%。鱼腥草的可溶性蛋白含量随水中铀浓度增加呈现先增后降的趋势,铀浓度为5 mg/L时可溶性蛋白质含量达到最大,与空白对照相比,其涨幅达29.5%;铀浓度为55 mg/L时可溶性蛋白质含量最少,与空白对照相比,其降幅达59.8%。
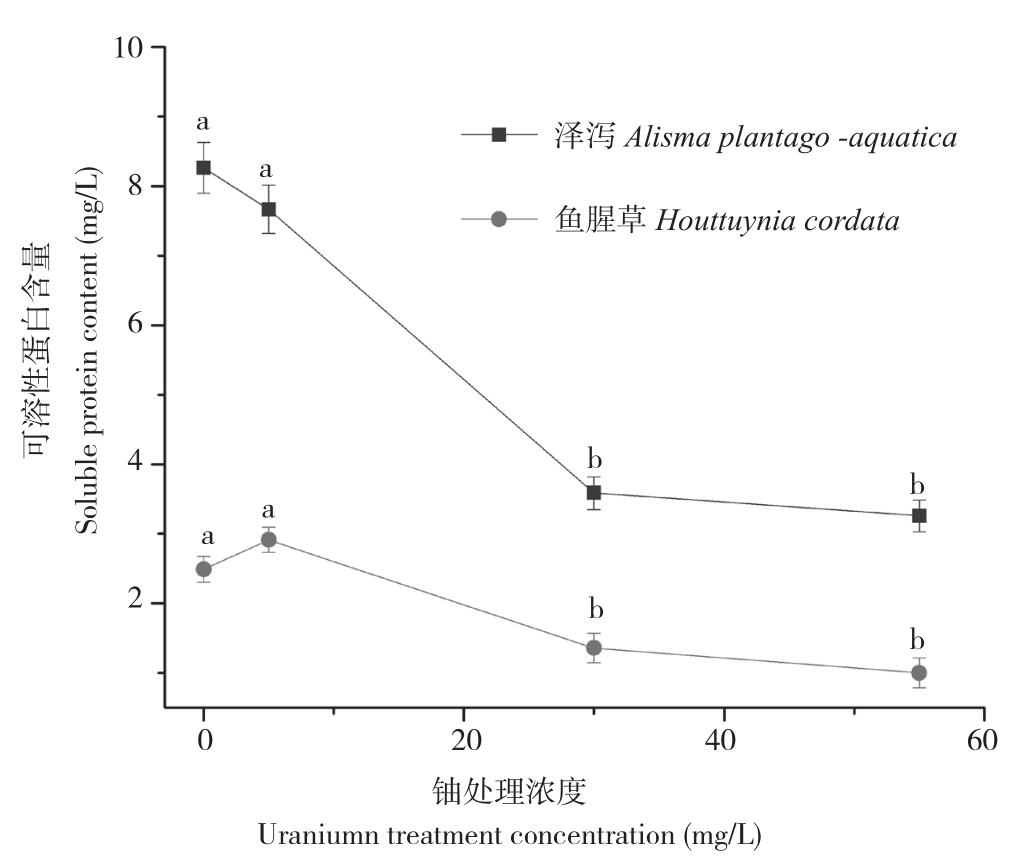
图1 不同铀浓度下2植物可溶性蛋白含量
Fig.1 Soluble protein content of 2 plants at different uranium concentrations
小写英文字母不同者表示差异显著
Different lowercase letters represent significant differences
2.2 铀对泽泻和鱼腥草抗氧化酶系统的影响
由图2可知,泽泻和鱼腥草的SOD、POD和CAT活性都随着水中铀浓度的增加而呈现先上升后下降的趋势,均在水中铀浓度为30 mg/L时SOD、POD和CAT活性达到最大,相较于空白对照,分别上升11.79%、114.69%、69.64%和6.03%、19.91%、10.71%。随着铀浓度的增加,泽泻和鱼腥草的MDA含量逐渐增加,均在铀浓度55 mg/L处理下达到最大值,相较于空白对照,分别增加70.42%和55.42%。
2.3 铀对泽泻和鱼腥草光合参数的影响
由表1可知,随着铀浓度的逐渐增加,泽泻和鱼腥草叶片胞间CO2浓度(Ci)逐渐降低,均在铀浓度55 mg/L处理下达到最低,相较于空白对照,分别降低13.14%和27.49%。泽泻叶片的气孔导度(Gs)随着铀浓度的增加呈先增后降的趋势,在铀浓度5 mg/L处理下达到最大,相较于空白对照,增加184.26%;鱼腥草叶片的气孔导度(Gs)随着铀浓度的增加而逐渐增加,在铀浓度55 mg/L处理下达到最大,比对照增加295.24%。泽泻和鱼腥草叶片的蒸腾速率(Tr)随着铀浓度的增加均呈现先增后降的趋势,在铀处理浓度5 mg/L时达到最大,分别增加0.17%和6.5%。随着铀浓度的逐渐增加,泽泻和鱼腥草叶片的光合速率(A)逐渐降低,在铀浓度55mg/L时达到最低,相较于空白对照,分别降低55.19%和85.92%。
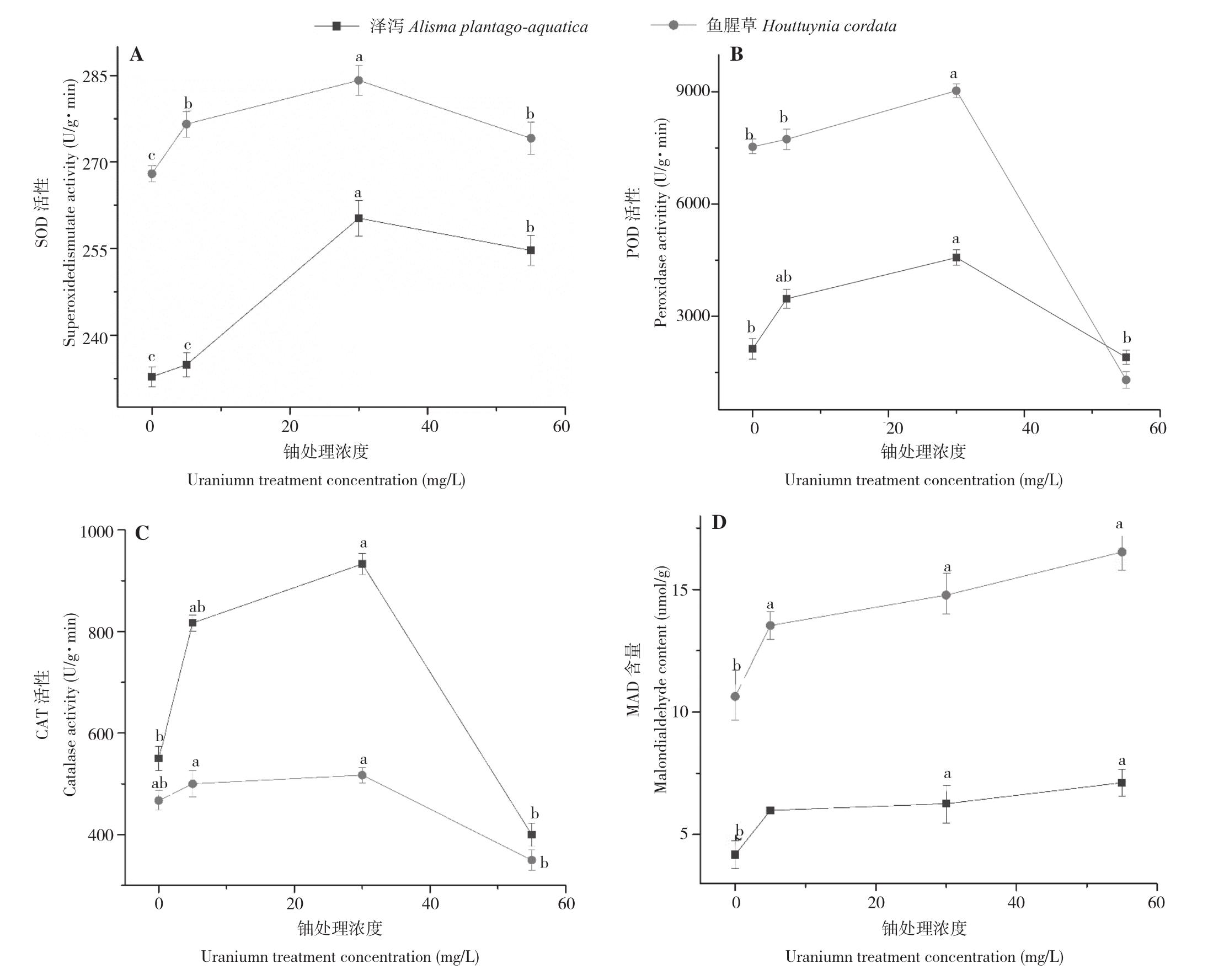
图2 不同铀浓度处理对泽泻和鱼腥草抗氧化酶活性和MDA含量的影响
Fig.2 Effects of different uranium concentration on antioxidase activity and MDA conten of Alisma plantago-aquatica Linn and Houttuynia cordata Thunb
小写英文字母不同者表示差异显著
Different lowercase letters in the same column represent significant differences
表1 不同铀浓度对泽泻和鱼腥草光合参数的影响
Table 1 Effects of different uranium concentration on photosynthetic parameters of Alisma plantago-aquatica Linn and Houttuynia cordata Thunb
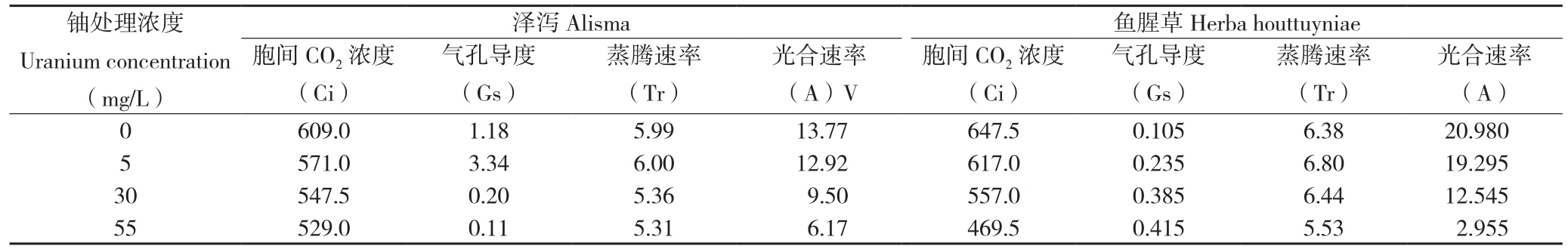
铀处理浓度Uranium concentration(mg/L)鱼腥草Herba houttuyniae胞间CO2浓度(Ci)泽泻Alisma气孔导度(Gs)蒸腾速率(Tr)光合速率(A)V胞间CO2浓度(Ci)气孔导度(Gs)蒸腾速率(Tr)光合速率(A)0 609.0 1.18 5.99 13.77 647.5 0.105 6.38 20.980 5 571.0 3.34 6.00 12.92 617.0 0.235 6.80 19.295 30 547.5 0.20 5.36 9.50 557.0 0.385 6.44 12.545 55 529.0 0.11 5.31 6.17 469.5 0.415 5.53 2.955
2.4 铀对泽泻和鱼腥草叶绿素荧光参数的影响
由图3可知,随着铀浓度的增加,泽泻和鱼腥草叶片的最大光化学效率(Fv/Fm)逐渐降低,与对照相比,分别下降25.27%和1.45%;光合性能指数(PIABS)均呈现先增后降的趋势,其中泽泻叶片PIABS在铀浓度5 mg/L时达最大值、较空白对照增加146.43%,鱼腥草叶片PIABS在铀浓度30 mg/L处理下达最大值、较对照增加86.57%。
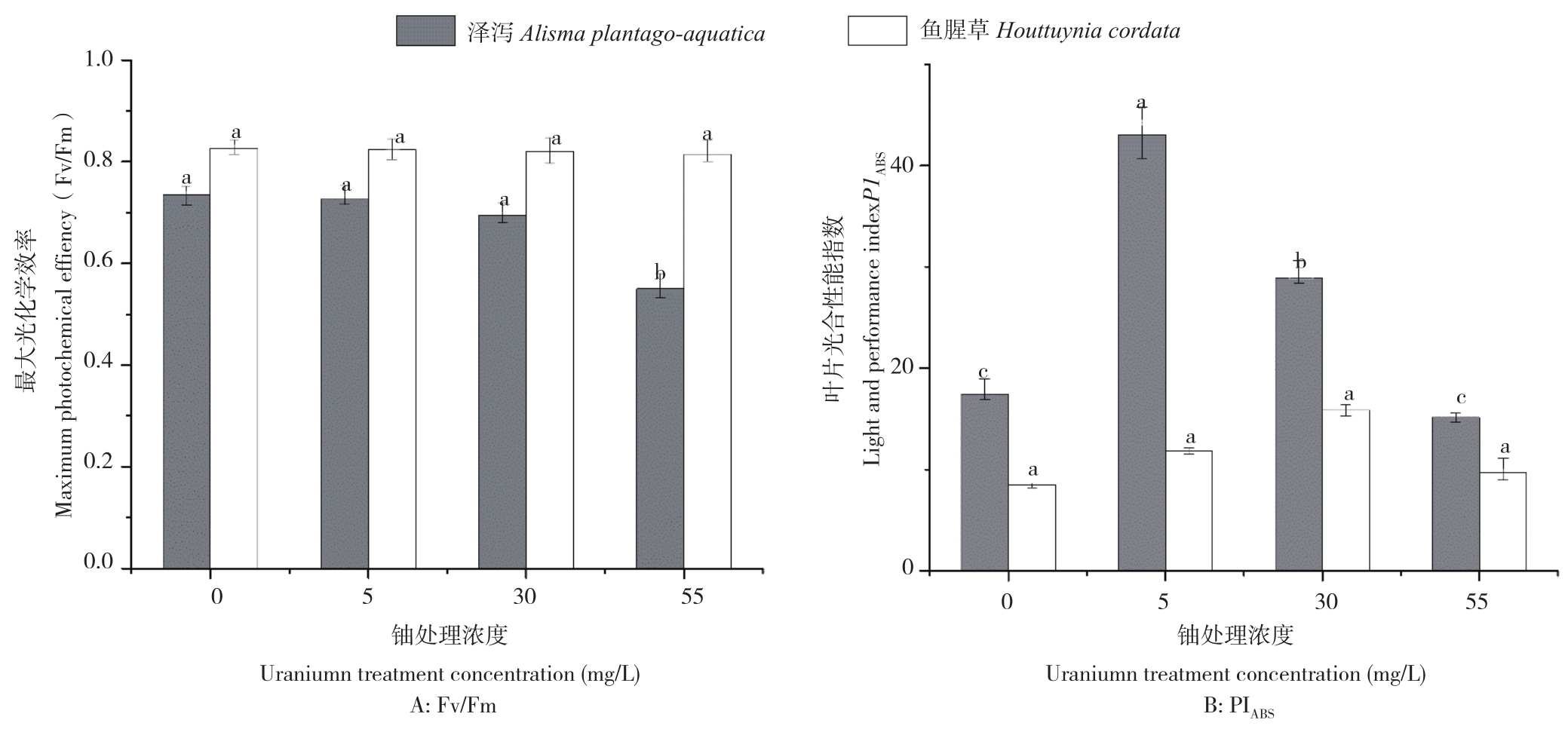
图3 不同铀浓度对泽泻和鱼腥草荧光参数的影响
Fig.3 Effects of different uranium concentration on chlorophyll fluorescence parameter of Alisma plantago-aquatica Linn and Houttuynia cordata Thunb
2.5 泽泻和鱼腥草对铀的富集特性
由图4可知,随着铀浓度的增加,泽泻和鱼腥草各部对铀的富集浓度也逐渐升高,其中根部对铀的富集最为明显,在铀浓度55 mg/L处理下,泽泻和鱼腥草茎叶中铀的富集浓度分别为2 778.74和3 184.91 mg/kg,根部铀的富集浓度分别为10 393.94和6 515.00 mg/kg。由表2可知,泽泻和鱼腥草在不同铀浓度处理下,其对铀的总富集系数(BCF)、生物转运系数(TF)和总提取率均呈现不同的变化,其中BCF在铀浓度5 mg/L处理下的泽泻最高、为434.19,TF在铀浓度55 mg/L处理下的鱼腥草最高、为0.49,对铀的总提取率均在铀浓度30 mg/L处理下达到最高,分别为0.61和 0.22。
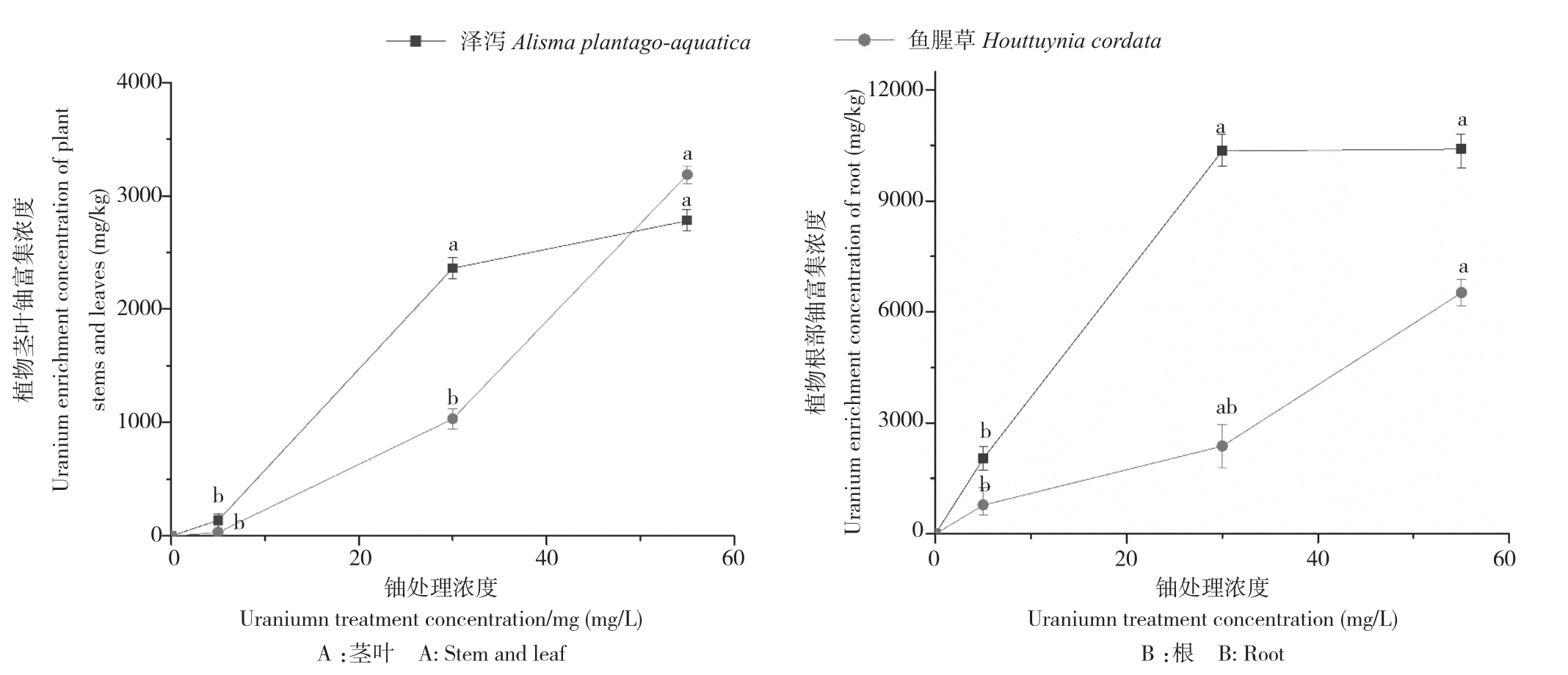
图4 泽泻和鱼腥草茎叶、根部对铀的富集浓度
Fig.4 Enrichment concentration of uranium in stem and leaf,root of Alisma plantago-aquatica Linn and Houttuynia cordata Thunb
表2 泽泻和鱼腥草对铀的富集特性
Table 2 Uranium enrichment properties of Alisma plantago-aquatica Linn and Houttuynia cordata
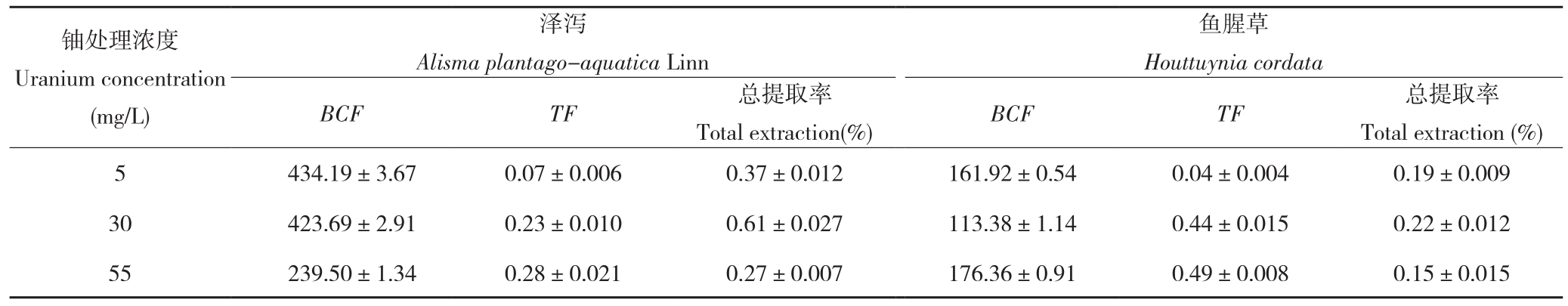
铀处理浓度Uranium concentration(mg/L)泽泻Alisma plantago-aquatica Linn Total extraction(%) BCF TF 总提取率Total extraction (%)5 434.19±3.67 0.07±0.006 0.37±0.012 161.92±0.54 0.04±0.004 0.19±0.009 30 423.69±2.91 0.23±0.010 0.61±0.027 113.38±1.14 0.44±0.015 0.22±0.012 55 239.50±1.34 0.28±0.021 0.27±0.007 176.36±0.91 0.49±0.008 0.15±0.015鱼腥草Houttuynia cordata BCF TF 总提取率
3 讨论
植物受逆境胁迫时,可溶性蛋白质含量是其生长发育的一个重要指标[24]。本试验中,低浓度铀处理下泽泻的可溶性蛋白含量有一定上升趋势,说明低浓度铀溶液对泽泻生长有一定的促进作用,而高浓度铀处理下泽泻和鱼腥草可溶性蛋白质含量显著降低,表明高浓度铀会一定程度抑制泽泻和鱼腥草的生长。
当植物受到外界胁迫时会产生大量的自由基[25],这些自由基会造成植物生长缓慢或正常代谢活动遭到抑制。于是植物自身会启动一套抗氧化酶系统来减少这种自由基,以保证植物的正常生长,这套系统中发挥主要作用的是超氧化歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)[26],三者联合作用以清除植物体内产生过量的自由基和过氧化物[27]。MDA是植物细胞发生膜脂过氧化后的最终产物,因此被用来衡量植物受迫害程度[28]。本试验中,泽泻和鱼腥草的SOD、POD和CAT均随着铀处理浓度的增加呈现先升高后降低的趋势,说明在铀处理浓度5、30 mg/L时植株体抗氧化酶系统清理多余的自由基和过氧化物,而在55 mg/L 铀处理下植物体产生的抗氧化酶无法清除所产生的大量自由基和过氧化物从而使抗氧化酶含量降低;泽泻和鱼腥草的MDA含量皆在最高铀处理浓度时达到最大,表明高浓度铀处理下植物体细胞膜脂过氧化程度加剧影响植物健康。
通过测定植物光合参数胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(E)和光合速率(A)的含量可以一定程度上反映植物光合作用能力的强弱,进一步了解植物的光合作用受胁迫情况。FARQUHAR[29]认为,Ci是评判气孔和非气孔因素影响的重要参数,若A减小的同时Tr、Ci和Gs也随之减小,则A的减小主要因素为气孔因素;反之,光合效率的下降主要因素为非气孔因素,即光系统受到损害或者暗反应受阻。本试验中,随着铀浓度的逐渐增加,泽泻和鱼腥草叶片Ci逐渐降低,均在铀浓度55 mg/L处理下达到最低;泽泻叶片的气孔导度(Gs)随着铀浓度的增加呈先增后降的趋势、在铀浓度5 mg/L时达到最大,而鱼腥草叶片的气孔导度(Gs)随着铀浓度的增加而逐渐增加、在铀浓度55 mg/L时达到最大;泽泻和鱼腥草叶片的蒸腾速率(Tr)随着铀浓度的增加均呈现先增后降的趋势,均在铀处理浓度5 mg/L时达到最大;随着铀浓度的逐渐增加,泽泻和鱼腥草叶片的光合速率(A)逐渐降低,在铀浓度55 mg/L时达到最低,表明泽泻和鱼腥草光合速率的降低主要因素为光系统受到损害,次要因素为叶片气孔因素。
植物抗逆性相关研究表明叶绿素荧光参数是一项较好的参考指标[30]。最大光化学效率(Fv/Fm)是与光合效率直接相关的非入侵参数,与光系统PSII的损伤呈负相关,是目前使用最多的生理荧光参数[31]。当植物受到外界胁迫时,Fv/Fm值的下降与光合能力下降有关[32]。本试验中,随着铀处理浓度增加,泽泻和鱼腥草的Fv/Fm值均逐渐下降,说明泽泻和鱼腥草的PSII系统受到抑制;PIABS均呈现先增后减的趋势。PIABS 能综合反映 PSII的最大光化学效率、有活性反应中心数目和受体侧电子传递效率的荧光参数,能更加准确地反映 PSII 所受的影响[33]。
本试验中,随着铀处理浓度的不断增大,泽泻和鱼腥草对水体中铀的富集浓度也不断增大,且根部铀含量远高于高于茎和叶;泽泻的BCF值在5 mg/L铀处理浓度下达到最大,这可能是由于低浓度铀处理下,泽泻各部位对铀的富集能力有一定的促进作用所致,鱼腥草的BCF值在55 mg/L铀处理浓度下达到最大;泽泻和鱼腥草的TF值均在铀处理浓度55 mg/L时达到最大;泽泻和鱼腥草植株铀总提取率随着铀浓度增加呈现先升后降的趋势,均在铀处理浓度30 mg/L时达到最大,而单株铀提取量皆在 55 mg/L 铀浓度处理下达到最高。运用IBM SPSS Statistics 20对5个生化指标进行方差齐性检验,对方差齐性检验>0.05的可溶性蛋白含量、抗氧化酶活性、光合参数、荧光参数采用Duncan、SNK两种方法分析比较;而方差齐性检验<0.05的对铀富集特性参数采用Tamhane、DunnettT3、Games-Howell(A)、Dunnett C 4种方法分别进行事后检验的多重比较,结果显示不同处理间没有显著性差异,可见各处理铀浓度下泽泻和鱼腥草生长情况良好,表明两种植物对铀均有一定的耐受性。
4 结论
本试验结果表明,在中低浓度(5~30 mg/L)铀处理下,泽泻和鱼腥草的SOD、POD和CAT均呈现逐渐升高的趋势,而MDA含量逐渐增大;泽泻和鱼腥草的Fv/Fm值与对照相比下降幅度较低,而PIABS有不同程度的上升趋势,这说明泽泻和鱼腥草植株内部启动抗氧化系统发挥保护作用,避免植物体受到过大影响。铀处理浓度55 mg/L时,泽泻和鱼腥草的抗氧化系统和光系统均受到严重的影响。两种湿生植物在试验中生长状态良好,对铀的富集效果较好,表现出一定的耐铀能力,有用于治理低浓度铀矿废水的潜力。
[1]吕俊文,徐乐昌,杨勇.某地浸采铀矿山采区井场地下水中铀迁移预测[J].铀矿冶,2007,26(2):84-89.doi: 10.3969/j.issn.1000-8063.2007.02.006.
LYU J W,XU L C,YANG Y.Predicting the migration of uranium in groundwater of a leaching uranium mine[J].Uranium Mining and Metallurgy,2007,26(2):84-89.doi: 10.3969/j.issn.1000-8063.2007.02.006.
[2]魏广芝,徐乐昌.低浓度含铀废水的处理技术及其研究进展[J].铀矿冶,2007,26(2):90-95.doi: 10.3969/j.issn.1000-8063.2007.02.007.
WEI G Z,XU L C.Treatment technology and research progress of low concentration uranium containing wastewater[J].Uranium Mining,2007,26(2):90-95.doi: 10.3969/j.issn.1000-8063.2007.02.007.
[3]郭栋清,李静,张利波,吴宏伟,闫汉洋,郭晓冬,许德杰.核工业含铀废水处理技术进展[J].工业水处理,2019,39(1):22-28.
GUO D Q,LI J,ZHANG L B,WU H W,YAN H Y,GUO X D,XU D J.Progress in treatment technology of uranium-containing wastewater in nuclear industry[J].Industrial Water Treatment,2019,39(1):22-28.
[4]吴素强,刘永,何鹏.椰壳活性炭对水溶液中铀(VI)的吸附研究[J].安徽农学通报,2019,53(7):126-129.doi: 10.16377/j.cnki.issn.1007-7731.2019.07.050.
WU S Q,LIU Y,HE P.Adsorption of uranium(VI) in aqueous solution by coconut shell activated carbon[J].Anhui Agricultural Science Bulletin,2019,53(7):126-129.doi: 10.16377/j.cnki.issn.1007-7731.2019.07.050.
[5]杨亮,黄建辉,曹斌,赵亦康.含铀废水处理方法进展[J].江西化工,2018(1):10-12.doi: 10.14127/j.cnki.jiangxihuagong.2018.01.004.
YANG L,HUANG J H,CAO B,ZHAO Y K.Progress in treatment of uranium-containing wastewater[J].Jiangxi Chemical Industry,2018(1):10-12.doi: 10.14127/j.cnki.jiangxihuagong.2018.01.004.
[6]王焯,罗学刚,丁翰林,杨昊.一种耐铀植物促生菌的筛选及促生特性研究[J].生物技术通报,2019,35(1):48-56.doi:10.13560/j.cnki.biotech.bull.1985.2018-0577.
WANG Z,LUO X G,DING H L,YANG H.Screening and growth promoting characteristics of a uranium-producing plant promoting bacteria[J].Biotechnology Bulletin,2019,35(1):48-56.doi: 10.13560/j.cnki.biotech.bull.1985.2018-0577.
[7]王浩,王艳琴.铀污染土壤的植物修复技术[J].环境与发展,2019,53(3):36-38.doi: 10.16647/j.cnki.cn15-1369/X.2019.03.021.
WANG H,WANG Y Q.Phytoremediation technology for uranium contaminated soil[J].Environment and Development,2019,53(3):36-38.doi: 10.16647/j.cnki.cn15-1369/X.2019.03.021.
[8]陈立,王丹,龙婵,崔正旭.三种螯合剂对吊竹梅修复铀镉复合污染土壤的影响[J].原子能科学技术,2018,52(8):1359-1366.doi:10.7538/yzk.2017.youxian.0729.
CHEN L,WANG D,LONG C,CUI Z X.Effects of three chelating agents on the recovery of uranium-cadmium complex contaminated soil[J].Atomic Energy Science and Technology,2018,52(8):1359-1366..doi:10.7538/yzk.2017.youxian.0729.
[9]谷雨,蒋平,李明德,李志明,吴海勇,刘琼峰.商陆修复土壤重金属污染研究进展[J].湖南农业科学,2018(1):119-122.doi:10.16498/j.cnki.hnnykx.2018.001.033.
GU Y,JIANG P,LI M D,LI Z M,WU H Y,LIU Q F.Research progress on remediation of soil heavy metal pollution by Shanglu[J].Hunan Agricultural Science,2018(1):119-122.doi: 10.16498/j.cnki.hnnykx.2018.001.033.
[10]刘来,王卫红,张艳.鸭跖草的铀富集与耐性特征研究[J].广东农业科学,2018,45(2):86-92.doi: 10.16768/j.issn.1004-874X.2018.02.015.
LIU L,WANG W H,ZHANG Y.Study on uranium enrichment and tolerance characteristics of Eucalyptus[J].Guangdong Agricultural Science,2018,45(2):86-92.doi: 10.16768/j.issn.1004-874X.2018.02.015.
[11]杨昊,罗学刚,丁翰林,王卓.铀胁迫下伊乐藻的生理响应与富集特性研究[J].生物技术通报,2019,35(3):45-52.doi: 10.13560/j.cnki.biotech.bull.1985.2018-0773.
YANG H,LUO X G,DING H L,WANG Z.Physiological response and enrichment characteristics of Elodea under uranium stress[J].Biotechnology Bulletin,2019,35(3):45-52.doi: 10.13560/j.cnki.biotech.bull.1985.2018-0773.
[12]邓闻杨,罗学刚,罗蓝,王焯.三种微生物对铀胁迫下凤眼莲荧光生理及铀累积特性的影响[J].农业环境科学学报,2018(8):1626-1633.doi: 10.11654/jaes.2018-0417.
DENG W Y,LUO X G,LUO L,WANG Z.Effects of three microorganisms on fluorescence physiology and uranium accumulation characteristics of Eichhornia crassipes under uranium stress[J].Journal of Agricultural Environmental Science,2018(8):1626-1633.doi: 10.11654/jaes.2018-0417.
[13]胡南,丁德馨,赵维超,胡劲松,谭煜健,李乐.鱼腥藻在满江红-鱼腥藻共生体系去除水中铀时的作用[J].环境科学学报,2017,37(1):162-168.doi:10.13671/j.hjkxxb.2016.0161.
HU N,DING D X,ZHAO W C,HU J S,TAN Y J,LI L.The role of Anabaena in the removal of uranium from water by the Azolla-Anabaena symbiosis system[J].Journal of Environmental Science,2017(1):162-168.doi:10.13671/j.hjkxxb.2016.0161.
[14]CHEN B D,ZHU Y G,SMITH F A. Effects of arbuscular mycorrhizal inoculation on uranium and arsenic accumulation by Chinese brake fern (Pteris vittata L.) from a uranium mining-impacted soil[J].Chemosphere,2006,62(9): 1464-1473.
[15]罗蓝,罗学刚,韩旭,邓闻杨,杨昊,丁翰林.酸模对水中U、Cd、As、Mn的富集特征与去除能力[J].环境科学与技术,2018,41(1):84-89.doi: 10.19672/j.cnki.1003-6504.2018.01.015.
LUO L,LUO XG,HAN X,DENG W Y,YANG H,DING H L.Accumulation characteristics and removal ability of U,Cd,As and Mn by Rumex acetosa[J].Environmental Science and Technology,2018,41(1):84-89.doi: 10.19672/j.cnki.1003-6504.2018.01.015.
[16]韩旭,罗学刚,司慧,罗蓝.铀胁迫对2种植物荧光生理及累积特性的影响[J].环境科学与技术,2016,39(11):36-41.doi: 10.3969/j.issn.1003-6504.2016.11.008.
HAN X,LUO X G,SI H,LUO L.Effects of uranium stress on fluorescence physiology and accumulation characteristics of two plants[J].Environmental Science and Technology,2016,39(11):36-41.doi:10.3969/j.issn.1003-6504.2016.11.008.
[17]杨俊东.彭山泽泻质量与土壤理化性质现状及其相关性的研究[D].成都:四川农业大学,2012.
YANG J D.Study on the Status Quo and Correlation of Quality and Soil Physical and Chemical Properties of Pengshan Alisma [D].Chengdu:Sichuan Agricultural University,2012.
[18]沈斌.EDTA和柠檬酸对鱼腥草修复矿区重金属污染土壤的影响研究[D].成都:四川农业大学,2015.
SHEN B.Effects of EDTA and Citric Acid on Heavy Metal Contaminated Soil in Houttuynia cordata Thunb Rehabilitation Area[D].Chengdu:Sichuan Agricultural University,2015.
[19]张艳,王卫红,张文君,刘来.铀污染下的商陆叶片反射光谱特征与铀含量关系研究[J].光谱学与光谱分析,2019,39(4):153-157.doi:10.3964/j.issn.1000-0593(2019)04-1143-05.
ZHANG Y,WANG W H,ZHANG W J,LIU L.Study on the relationship between the reflectance spectral characteristics of Pokeweed leaves and uranium content under uranium pollution[J].Spectroscopy and Spectral Analysis,2019,39(4):153-157.doi: 10.3964/j.is sn.1000-0593(2019)04-1143-05.
[20]SCHANSKER G,SRIVASTAVA A,STRASSER R J.Characterization of the 820-nm transmission signal paralleling the chlorophyll afluorescence rise(OJIP)in pea leaves[J].Functional Plant Biology,2003,30(7):785-796.
[21]TEWARI A,SINGH R,SINGH N K.Amelioration of municipal sludge by Pistia stratiotes L.:role of antioxidant enzymes in detoxification od metals[J].Bioresource Techno logy,2008,99(18):8715-8721.
[22]LI Z G,GONG M.The improvement of determi-nation peroxidase activity in plants by guaiacol [J].Plant Physiology Communications,2008,44(4):323-324.
[23]YANG L F,PANG J,PENG X L.Measure-ment of catalase activity in plants by ultraviolet spectrophotometry[J].Modern Agricultural Sciences and Technology,2009(20):364-366.
[24]李彧.旱柳对干旱胁迫生理生态响应的研究[D].哈尔滨:东北林业大学,2009.
LI Y.Physiological and Ecological Responses of Salix matsudana to Drought Stress[D].Harbin: Northeast Forestry University,2009.
[25]武孔焕,陈奇,李昆志,王永雄,陈丽梅.铝胁迫对黑大豆膜脂过氧化及抗氧化酶活性的影响[J].西北植物学报,2012,32(3):511-517.doi:10.3969/j.issn.1000-4025.2012.03.012.
WU K H,CHEN Q,LI K Z,WANG Y X,CHEN L M.Effects of aluminum stress on membrane lipid peroxidation and antioxidant enzyme activities in black soybean[J].Northwest Plant Journal,2012,32(3):511-517.doi:10.3969/j.issn.1000-4025.2012.03.012.
[26]杨兴洪.甜菜碱提高植物光合作用对逆境抗性机理的研究[D].北京:中国科学院,2005.
YANG X H.Study on the Mechanism of Betaine Enhancing Plant Photosynthesis to Stress Resistance[D].Beijing: Chinese Academy of Sciences,2005.
[27]严政,谢水波,李仕友,唐东山,刘迎九,闫震.凤眼莲、大薸对铀胁迫的生理生化响应[J].安全与环境学报,2012,12(3):1-5.doi:10.3969/j.issn.1009-6094.2012.03.001.
YAN Z,XIE S B,LI S Y,et al.Physiological and biochemical responses of Eichhornia crassipes and Pistia stratiotes induced at uranium stress[J].Journal of Safety and Environment,2012,12(3):1-5.doi: 10.3969/j.issn.1009-6094.2012.03.001.
[28]杨瑞丽.螯合剂诱导黑麦草等植物修复铀(Ⅵ)污染土壤试验研究[D].衡阳:南华大学,2016.
Yan R L.Experimental study on chelating agent inducing uranium (VI)contaminated soil by ryegrass and other plants[D].Hengyang: Nanhua University,2016.
[29]MACHLIS,LEONARD.Annual review of plant physiology[J].Soil Science,1962,94(5):349.
[30]宋婷,张谧,高吉喜,韩永伟,宋婷,张谧.快速叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].生物学杂志,2011(6):81-86.doi: 10.3969/j.issn.2095-1736.2011.06.081.
SONG T,ZHANG M,GAO J X,et al.Fast chlorophyll fluorescence kinetics and its application in plant physiology research[J].Journal of Biology,2011(6):81 -86.doi: 10.3969/j.issn.2095-1736.2011.06.081.
[31]LAFABRIE C,MAJOR K M,MAJOR C S.Comparison of morphology and photo-physiology with metal/metalloid contamination in Vallisneria neotropicalis[J].Journal of Hazardous Materials,2011,191(1-3):356-365.
[32]PRIETO P,PENUELAS J,LLLUSIA J.Effects of long-term experimental night-time warming and drought on photosynthesis,Fv/Fm and stomatal conductance in the dominant species of a Mediterranean shrubland[J].Acta Physiologiae Plantarum,2009,31:729-739.
[33]SCHANSKER G,SRIVASTAVA A,STRASSER R J.Characterization of the 820 nm transmission signal paralleling the chlorophyll a fluorescence rise(OJIP)in pea leaves[J].Functional Plant Biology,2003(30):785-796.