菠萝(Ananas comosus L.)又称凤梨、黄梨,是仅次于香蕉、芒果的第三大热带果树[1]。菠萝原产于南美洲的巴西、巴拉圭一带,随后由西班牙殖民者扩散至其位于加勒比海、东南亚的殖民地 ,并于 16~17世纪传入我国[2],是 “岭南四大佳果”之一。菠萝因其独特的口感、丰富的营养成为许多热带、亚热带国家出口创汇的重要产品[3]。据联合国粮农组织统计,2017年世界菠萝总产量已达27.4 Mt。哥斯达黎加、菲律宾与巴西是目前菠萝年产量最高的国家,2017年菠萝年产量分别为3.1 Mt、2.7 Mt与2.3 Mt。我国大陆地区菠萝年产量约为1.6 Mt(FAO官网数据)。与季节性水果不同,菠萝通过调节催花时间即可实现全年上市销售,但菠萝夏季果一般更受消费者欢迎,主要是由于菠萝秋、冬季果具有机酸含量高、糖份低、易患黑心病等缺陷。
菠萝黑心病(Black heart)亦被称为菠萝内部褐化病(Internal Browning)、小果心腐病、小果褐腐病等,是菠萝主要的采后病害之一[4]。黑心病常导致巨大的经济损失,主要是因为病果无明显的外部特征,只有将果实切开后才能观察到褐变的组织。当前,研究者们普遍认为菠萝黑心病是一种主要由低温胁迫诱发的菠萝生理性病害[5-6]。采前生长过程(寒潮等)与采后贮运(低温船运、仓储等)中的低温均可能导致菠萝黑心病的发生[7]。采后低温贮运能推迟果实衰老、降低呼吸作用损耗,已在包括菠萝在内的多种果蔬采后生产实践中得到广泛应用[8]。然而,菠萝等热带水果对低温胁迫的耐受性较差,低温贮运会导致菠萝黑心病等生理性病害的产生。因此,如何在减少细胞呼吸损耗与防止低温应激损伤之间寻找最佳平衡点,是果蔬采后研究的重要课题。
菠萝黑心病过去常见于菠萝秋、冬季果,然而近年来由于滥用赤霉素壮果等原因,菠萝夏季果中也常有黑心病的报道,黑心病对菠萝产业造成的经济损失日益严重。近几十年来,研究者们已尝试了多种方法防治菠萝黑心病,包括热处理、打蜡、水杨酸处理等[6,9]。总结现有的菠萝黑心病研究进展,对于研究菠萝黑心病的内在机理,培育抗黑心病菠萝品种以及提高菠萝产业的生产效率均具有积极作用。本文总结了影响菠萝黑心病发生的采前与采后因素以及可能的应对策略,回顾菠萝黑心病发生的生理生化背景,并结合相关激素信号通路的研究进展提出菠萝黑心病发生过程的可能模型。
1 菠萝黑心病主要症状及影响因素
1.1 主要症状
菠萝黑心病的初期症状是果心基部出现半透明的小斑点;随着病情的发展,半透明的果肉组织中逐渐出现黑褐色色素沉着;在黑心病发展末期,黑褐色色素会扩散到全部的菠萝果肉中,严重情况下会导致菠萝果肉与果心完全变黑。尽管菠萝果实内部在黑心病发生过程中发生了剧烈变化,但其外部并没有明显的特征,只有切开后才能观察到褐变组织[10]。菠萝黑心病的严重程度与时空发育在不同菠萝品种间存在差异。皇后类菠萝(如我国主栽种巴厘等)属于菠萝黑心病易感品种,在低温条件下(10~12 ℃)贮藏1~2周即可观察到黑心病症状的产生;卡因类菠萝(如无刺卡因)的黑心病抗性强于皇后类品种,且其发病部位局限于果肉部分。部分菠萝杂交品种被报道具有较强的菠萝黑心病抗性,如Hawaiian Gold 53-116在多种低温处理条件下均未表现出明显的黑心病症状;杂交品种73-50也具备部分菠萝黑心病抗性以及较高的抗坏血酸含量[11]。
1.2 采前因素
尽管菠萝黑心病是一种采后生理性病害,但多种采前因素也对菠萝黑心病的发生率具有重大影响,综合控制采前生长以及采后储藏因素是控制菠萝黑心病发生率的关键。
1.2.1 季节性因素 季节性因素,主要指季节性低温,是影响菠萝黑心病发生的主要采前因素。菠萝夏季果一般不发生黑心病,即使有少数发生程度也很轻微,菠萝黑心病主要发生在秋冬季,且菠萝冬季果的发病率显著高于秋季果。研究表明,成熟菠萝在低于15 ℃条件下暴露数天再返回较高温度后即可能导致菠萝黑心病的产生[10]。在我国广东地区,菠萝冬季果发生黑心病的概率远高于夏季果,不但影响了消费者的购买欲,而且严重制约了我国菠萝产业生产效率的提高[12]。同处于亚热带的澳大利亚昆士兰地区也有类似的报道[13]。由于菠萝黑心病与果实成熟期的低温胁迫过程直接相关,适当调整菠萝的催花时间,避免使菠萝果实成熟期处于容易遭受寒潮侵袭的季节,可在一定程度上降低菠萝黑心病的发病率。
1.2.2 种植条件与栽培措施 菠萝种植园的土壤条件也是影响菠萝黑心病发生率的重要采前因素。充足的矿质营养对于提高菠萝品质与产量至关重要,其中钙元素含量被报道直接与菠萝的黑心病抗性有关。钙元素缺乏的菠萝果实更容易发生黑心病等生理性病害,而具有较高钙离子含量的菠萝果实对低温胁迫的敏感性较弱,对菠萝黑心病的抗性也更强[14]。科研实践也表明在菠萝果实膨大期喷施氯化钙溶液具有一定的抗黑心病作用;采前喷施适宜浓度的氯化钙溶液能增强菠萝果实对轻微低温胁迫的抗性,降低菠萝黑心病发生率[15]。此外,土壤中适宜浓度的钾离子对于生产优质菠萝也具有一定的积极作用,能促进菠萝果实中总固形物含量的增加、产生直径较大的果实,并能在一定程度上降低菠萝黑心病的发生率[3]。
近几十年来,我国菠萝种植者在果实膨大期普遍采用赤霉素(商品名“920”)壮果以提高单果重量,然而这也同时提高了菠萝黑心病的发病率以及发病程度。赤霉素已被报道在菠萝黑心病的形成过程中扮演着重要角色[16]。赤霉素能促进菠萝果内的氧化反应,并能在缺乏低温胁迫的条件下导致菠萝黑心病的发生;此外,与黑心病组织褐变直接相关的PPO基因的启动子区域也被报道具有赤霉素响应元件[17]。因此,赤霉素是诱发菠萝黑心病的一个重要因素,在生产上不施或少施‘920’能直接降低菠萝黑心病的发生率。
1.3 采后因素
蔬果的采后处理在极大程度上决定了蔬果的货架期以及菠萝黑心病等生理性病害的发生率,适宜的采后处理甚至能在一定程度上延缓由不利采前因素所引起的菠萝黑心病。
1.3.1 采摘时间 采摘时间是影响菠萝黑心病发生的重要采后因素之一。采摘时间决定了菠萝果实的成熟度,而菠萝果实的成熟度与黑心病的发病率呈正相关:成熟度高的菠萝易于发生黑心病,未完全成熟的菠萝不易发生黑心病,但其风味较差而不具有良好的商品性[18]。乙烯在植物果实成熟的过程中扮演着极为重要的作用,能显著影响果实品质。这些影响可能是有益的或有害的,主要取决于果实种类及其成熟阶段[19]。研究表明,适宜浓度的1-MCP(乙烯受体拮抗剂)处理能延缓菠萝成熟,显著降低菠萝黑心病的发生率。1-MCP处理能显著抑制脂氧合酶途径,降低菠萝果实膜脂过氧化程度,有效延迟过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等酶活性高峰的出现,从而延缓菠萝的衰老进程,延长货架期,降低菠萝黑心病发生率[19]。因此,合适的采摘时间结合适当的保鲜技术与通畅的销售渠道能在一定程度上降低菠萝黑心病带来的不利影响。
1.3.2 贮藏温度 贮藏过程中的低温被认为是导致菠萝黑心病的主要采后因素[5,13]。低温贮藏能推迟果实衰老、降低呼吸作用损耗,已在多种果蔬的采后生产实践中得到了广泛应用。然而,以菠萝为代表的热带、亚热带水果对低温胁迫的耐受性较差,长期低温贮藏会诱发菠萝黑心病,且其严重程度与低温贮藏的温度及持续时间直接相关。细胞质膜是低温胁迫的主要作用部位,低温胁迫作用于细胞质膜会导致磷脂酸水平升高、磷脂酰肌醇水平降低,降低细胞质膜的不饱和脂肪酸度比例,并最终导致细胞间隔丧失[8]。多酚氧化酶(PPO,定位于质体中)在细胞间隔丧失的果肉组织中催化多酚类化合物等底物(多位于液泡中)产生黑褐色色素类物质,是黑心病病果在宏观上呈现褐变的直接原因[20]。但也有部分研究认为低温与菠萝黑心病的严重程度并不呈现线性关系,随着冷胁迫温度由10℃降低至2℃,无刺卡因菠萝果肉的黑心病症状反而有所减轻。Stewart等认为这是由于多酚氧化酶(PPO)的相对活性降低所致[21]。
1.3.3 贮藏条件 蔬果采后贮藏过程中的气体环境会显著影响菠萝黑心病等生理性病害的发生率。在采后对蔬果进行短时间缺氧预处理能显著降低呼吸速率、抑制乙烯产生,从而达到延缓成熟、降低菠萝黑心病等生理性病害发生率的作用。Techavuthiporn等报道短时缺氧处理(16 h)能延缓‘Phulae’菠萝发生黑心病的时间,可能是由于缺氧处理抑制了菠萝果肉中多酚氧化酶的活性[22]。因此,在菠萝采收后、贮藏前进行短时缺氧处理有望在一定程度上延长菠萝的货架期、降低菠萝黑心病的发生率。此外,在菠萝采后应用热水浸泡的形式进行预处理,也能有效增强菠萝果实的低温胁迫抗性,降低菠萝黑心病发生率:菠萝果实在38℃下处理60 min后,果肉和果心区域的褐变程度分别比未处理的对照低70%和45%[9]。而Lu等研究表明,采后水杨酸处理能显著降低菠萝黑心病的发生率:水杨酸处理能降低POD与PPO的活性,降低果实呼吸速率,并提高APX与SOD等抗氧化酶的活性[6,12]。
2 菠萝黑心病的生理生化背景
2.1 低温胁迫是诱发菠萝黑心病的主要原因
多酚类化合物是蔬果内广泛存在的一类具有抗氧化性的有机小分子,其被氧化后产生的黑褐色多聚化合物是黑心病病变组织在宏观上呈现黑褐色的直接原因。PPO催化多酚类化合物氧化的第一步反应,即多酚类化合物转变为醌类化合物的过程,影响该反应的主要因素包括多酚类化合物含量和PPO催化活性。菠萝果实内的多酚类化合物主要包括绿原酸和单宁鞣质。绿原酸亦称为咖啡酰奎尼酸,参与多种水果的褐变过程;单宁鞣质也是一种易被氧化的多酚衍生物,多分布于果实细胞壁、细胞质与液泡中。菠萝中多酚化合物的含量受到低温胁迫的诱导,但多酚化合物含量并不是黑心病组织褐变的决定性因素,菠萝黑心病抗性品种与易感品种的多酚化合物含量并无显著性差别[10]。20世纪70年代,PPO曾被认为是导致菠萝黑心病病变组织褐变的主要原因[23],许多研究者都试图通过抑制PPO催化的多酚氧化反应以降低菠萝黑心病的发生水平,相关研究可归为两大类:(1)抑制AcPPO的表达量或降低PPO的催化活力,如Ko等通过转基因技术抑制菠萝AcPPO基因的表达,获得了22株AcPPO的基因敲除植株,并进一步通过田间试验筛选获得了5个黑心病症状减轻的AcPPO基因敲除株系[13];(2)防止PPO与其多酚类底物结合,如热处理可以抑制磷脂酶D以及脂氧合酶的活性,改变膜系统中的不饱和脂肪酸比例,增强膜系统在低温胁迫下的稳定性,防止多酚类化合物与PPO结合,最终降低菠萝黑心病的发生率[9]。但上述方案均只能在一定程度上降低菠萝黑心病的发生率。进一步研究也表明PPO活性与褐变起始间并不存在明显相关性,多种植物的褐变过程中其PPO活性并无明显变化[24]。
低温是限制植物分布的不利环境条件之一,许多植物在低温胁迫下表现出应激损伤的症状,尤其是那些起源于温暖区域的植物[25]。低温胁迫是导致菠萝黑心病发生的重要因素,大多数菠萝品种在15 ℃以下的非冻结低温(Non-freezing Chilling temperature)环境中易发生黑心病[10]。低温胁迫对植物的主要危害在于其可导致质膜损伤[26-27]:低温胁迫能改变质膜的流动性,促使质膜由可变的液晶态向固体凝胶态转变(质膜相变);质膜相变使得细胞质膜的半通透性消失,致使细胞间隔丧失、细胞代谢稳态破坏,并最终导致植物细胞死亡[26,28]。此外,低温胁迫还能诱导活性氧的产生,活性氧(ROS)不仅能直接与膜脂类发生过氧化反应,还能诱导脂氧合酶(LOX)的活性[29]。质膜的低温稳定性主要是由其化学组成,尤其是不饱和脂肪酸的比例所决定[30]。LOX能催化不饱和脂肪酸的降解反应,降低不饱和脂肪酸比例,降低质膜的稳定性,导致质膜损伤。由于多酚氧化酶与多酚类化合物分别位于不同的细胞器中(PPO位于细胞质、质体中,多酚类化合物位于液泡中),只有在质膜损伤、细胞间隔丧失的组织中PPO与其多酚类底物才能相互接触[31-32]。因此,低温胁迫诱导的质膜损伤(而非多酚氧化酶活性)可能是导致菠萝黑心病的主要原因。
2.2 菠萝黑心病的实质是一个细胞程序性死亡过程
细胞程序性死亡(Programmed cell death,PCD)是一种生物体必需的生理过程,在生长发育、逆境胁迫响应等过程中均发挥着重要作用[33]。低温胁迫能诱导烟草BY-2细胞的细胞程序性死亡过程,凋亡细胞具有梯状DNA 、染色质皱缩等PCD过程的典型特征[34]。Chen等认为黄瓜水心病(一种与菠萝黑心病类似的采后生理性病害)是低温胁迫诱导的细胞程序性死亡的宏观表现形式,低温胁迫处理9d的黄瓜果实中出现了阶梯状DNA等典型的PCD特征[35]。本课题组前期研究发现菠萝黑心病病变组织具有阶梯状DNA等PCD反应的典型特征,并且病变组织中PCD相关基因的表达水平也发生了显著变化(未发表结果)。
近年来,有研究表明赤霉素(GA3)参与调节谷类糊粉层细胞的PCD过程,外源赤霉素处理能促进糊粉层细胞PCD的发生[36]。Fernando等报道GA3能诱导一种与糊粉层细胞PCD相关的核酸酶的表达[37]。张鹤婷等报道GA3能显著提高糊粉层PCD过程关键水解蛋白酶OsVPE3的表达,并能通过提高VPE 的活性促进水稻糊粉层的PCD进程[38]。此外,赤霉素还能激活钙依赖蛋白激酶(CDPK)的表达[39]。CDPK与动物细胞中的蛋白激酶C(PKC)具有高度同源性,能调节线粒体钙离子的` 转运,是PCD调控过程的一个重要上游分子[33,40]。由于PCD过程不可避免的伴随着细胞膜完整性的丧失,因而赤霉素也有可能通过诱导PCD反应造成质膜损伤,最终诱发菠萝黑心病[40]。因此,菠萝黑心病的实质是一个由低温胁迫或赤霉素诱导的局部细胞程序性死亡过程,这种植物的局部细胞凋亡过程可能是植物整体应对胁迫过程的一种生理机制,起到物理隔离健康与受损组织的作用[41]。
2.3 赤霉素信号位于低温胁迫信号的下游
既然低温胁迫与赤霉素均可诱导菠萝黑心病的产生,那么低温胁迫与赤霉素信号之间具有怎样的关系呢?首先,低温胁迫能诱导活性氧的产生,而活性氧能促进赤霉素的合成。低温胁迫能诱导ROS的产生,并且ROS的产生量随着温度持续下降或低温持续时间延长而持续增加;而ROS能通过促进KAO1与GA3-ox基因的表达正向调节赤霉素的合成[42]。其次,低温胁迫信号能通过影响作用于DELLA蛋白的CBF1转录因子间接调控赤霉素信号途径。DELLA蛋白是赤霉素信号途径中一个重要的负调控因子,拟南芥中共有5种DELLA蛋白(GAI,RGA,RGL1,RGL2,与RGL3),它们的功能各有侧重且具有重叠性,缺失3~5种DELLA基因的拟南芥突变体对GA诱导不敏感,并具有高而细长的表型[43]。CBF1则是一类与植物抗寒性有关的转录因子,在低温条件下它能与COR以及其他冷胁迫响应基因的启动子区域结合,激活冷响应基因的表达,增强植物的抗寒性。Achard等报道低温胁迫能激活CBF1的表达,并通过CBF1促进DELLA蛋白的积累,从而抑制GA信号传导。CBF1能通过激活GA2-OX(具有降解GA3的作用)的表达以降低GA3的含量,进而抑制GA3依赖的DELLA蛋白降解,最终抑制GA信号传导[43]。CBF1对GA信号通路的抑制作用有可能是短期低温胁迫下果实黑心病发生率降低的原因。综上,低温胁迫能直接或间接地影响赤霉素信号通路,赤霉素信号位于低温胁迫信号的下游。
2.4 菠萝黑心病发生过程的可能模型
基于现有文献可将菠萝黑心病的发生过程大致分为3个阶段,即起始阶段(Initial stage)、细胞凋亡执行阶段(Execution stage)与褐变阶段(Browning stage)(图1)。(1)低温胁迫是引起菠萝黑心病褐变等一系列事件的重要因素,但我们认为低温胁迫仅在黑心病的起始阶段起到损伤质膜、诱发黑心病的作用。首先,菠萝果实只有经过一段时间的低温胁迫处理后才可能发生菠萝黑心病,而一直处于室温条件的对照组却不会发生菠萝黑心病,表明菠萝黑心病需要低温过程的诱导[16];其次,当质膜已发生损伤后,持续低温组的黑心病程度反而低于后续转入室温条件的处理组,表明黑心病后续的细胞凋亡执行阶段与低温胁迫并不直接相关,而可能与赤霉素信号途径有关[1,44]。这可能是因为低温胁迫能诱导CBF1的表达,进而促进GA2-OX的表达以降低细胞中GA3的水平,从而抑制或延缓细胞程序性死亡与黑心病褐变过程[43]。
(2)赤霉素及其信号通路在细胞凋亡执行阶段发挥着核心作用。DELLA蛋白是GA信号途径重要的负调控因子,对GA信号下游的细胞凋亡过程的具有抑制作用。赤霉素与受体GID1结合能激活DELLA蛋白的降解机制,解除其对GA下游信号途径的抑制作用。GA-DELLA信号机制被认为在植物整合外界刺激与内源信号的过程中发挥着重要作用[45-46]。Jiang等报道GA-DELLA信号机制在缺磷胁迫响应中发挥着重要作用。当细胞感应到缺磷胁迫信号后,会激活GA2-OX的表达,降低GA3的含量、积累DELLA蛋白,并抑制GA信号通路的下游途径[47]。因此,在低温导致的菠萝黑心病过程中,DELLA-GA信号机制可能在决定短期低温耐受以及长期低温胁迫相关的PCD过程中扮演着调节者的作用。此外, DELLA蛋白同时受到乙烯信号通路的调节,这也解释了为什么成熟菠萝更容易发生黑心病[46,48]。
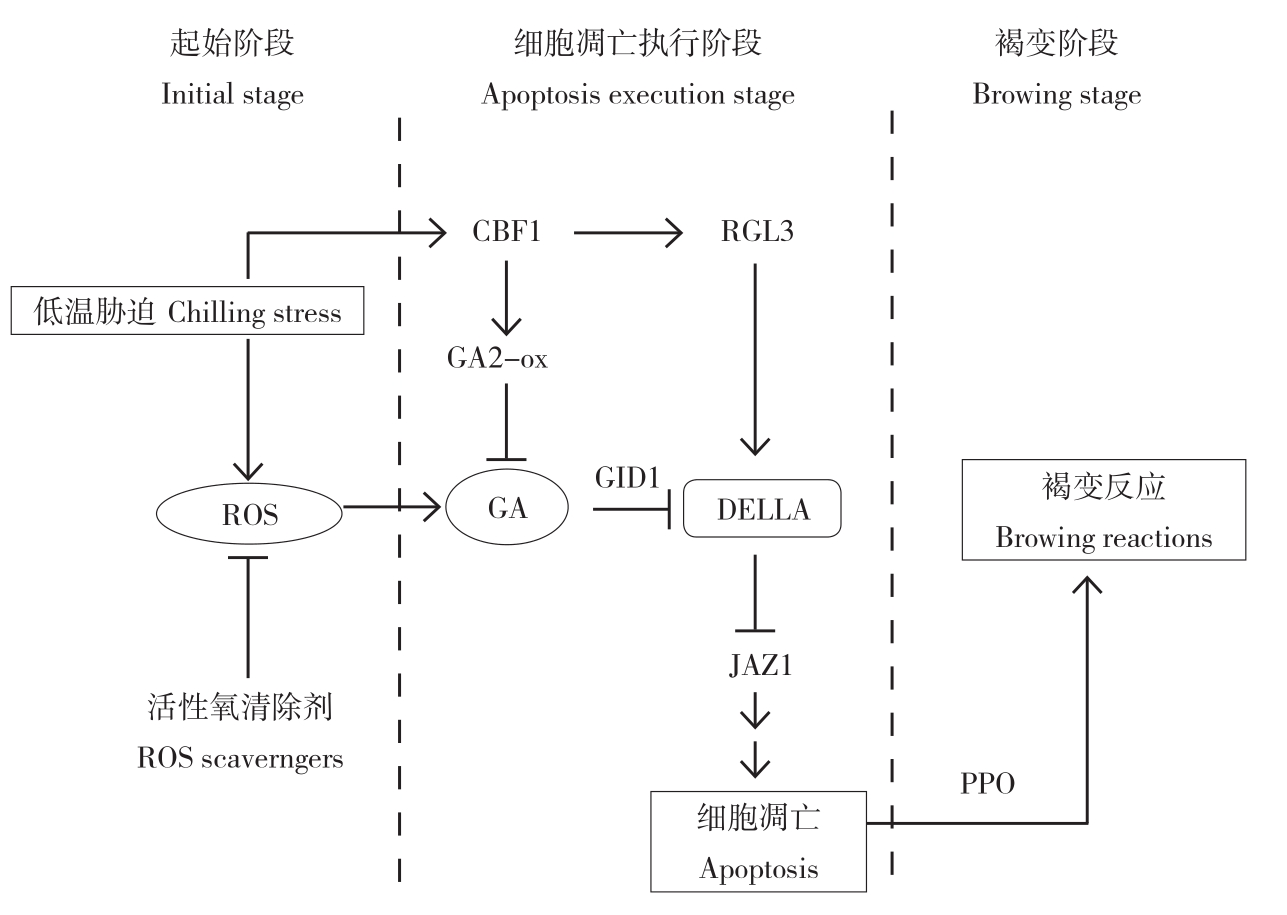
图1 菠萝黑心病发生过程的可能模型
Fig.1 A possible model for pineapple blackheart
(3)多酚氧化酶在菠萝黑心病褐变阶段催化的褐变反应是一种次级反应。PPO活性及其底物含量与菠萝黑心病发生率并无直接关联性[10,16],AcPPO的表达也受到赤霉素信号的调控[17]。其他物种黑心病(褐心病)的相关研究也表明,PPO的表达水平与黑心病的发生率间并无直接关联性,PPO催化的褐变反应可能只是质膜损伤后发生的次级反应[49]。但也有研究表明多酚类化合物氧化产生的多聚化合物在生物胁迫引起的超敏反应(HR response)中起到了物理防御屏障的作用[41,50],因此,黑心病褐变阶段中产生的黑褐色聚合物是否在非生物胁迫响应中发挥作用还有待于进一步研究。
3 结语与展望
总之,菠萝黑心病是一种主要由采后不利贮藏条件引起的菠萝生理性病害。但采前因素也对菠萝黑心病的发生具有重要影响,可能是造成不同种植地、不同收获季节菠萝黑心病发病率不同的直接原因。采前与采后的低温胁迫过程是自然条件下诱发菠萝黑心病的主要原因,低温胁迫不仅能直接造成质膜损伤,还能诱导活性氧的产生并对DNA、蛋白、脂质等细胞组分造成氧化损伤。由于赤霉素信号位于低温胁迫的下游,因此菠萝黑心病的实质是一个低温胁迫诱导、赤霉素介导的细胞程序性死亡过程,这种低温下局部细胞的PCD过程有可能是植物整体应对长期低温胁迫的一种生理机制。而PPO催化的组织褐变则是细胞凋亡发生后的一种次级反应。
尽管目前菠萝黑心病相关的机理研究已取得了一定的进展,但由于菠萝黑心病是一个受多因素影响的复杂生理过程,以下几个方面仍有待于进一步深入研究:(1)未成熟菠萝不易发生菠萝黑心病的相关机理;(2)不同菠萝品种黑心病抗性不同的相关机理;(3)果心附近小果易发生黑心病的相关机理。
[1]HONG K Q,XU H B,WANG J N,ZHANG L B,HU H G,JIA Z W,GU H,HE Q G,GONG D Q.Quality changes and internal browning developments of summer pineapple fruit during storage at different temperatures[J].Scientia Horticulturae,2013,151(151): 68-74.doi:10.1016/j.scienta.2012.12.016.
[2]GILBERT E.Pineapple culture: A history of the tropical and temperate zones (review) [J].Journal of Interdisciplinary History,2010,41(2):266-267.
[3]ANTONIO G S,TRUGO L C,BOTREL N,FRANCISCO L.Reduction of internal browning of pineapple fruit (Ananas comusus L.) by preharvest soil application of potassium[J].Postharvest Biology and Technology,2005,35(2): 201-207.doi: 10.1016/j.postharvbio.2004.07.005.
[4]张惠云,吴青松,孙伟生,侍文博,窦美安.菠萝黑心病研究进展[J].广东农业科学,2009 (3): 94-96.
ZHANG H Y,WU Q S,SUN W S,FU W B,DOU M A.Advance on research of blackheart in pineapple (Ananas comosus (L.) Merr.) [J].Guangdong Agricultural Sciences,2009(3): 94-96.
[5]ZHOU Y C,DAHLER J M,UNDERHILL S J R,WILLS R B H.Enzymes associated with blackheart development in pineapple fruit[J].Food Chemistry,2003,80(4): 565-572.doi: 10.1016/S0308-8146(02)00375-8.
[6]LU X H,SUN D Q,MO Y W,XI J G,SUN G M.Effects of post-harvest salicylic acid treatment on fruit quality and antioxidant metabolism in pineapple during cold storage[J].Journal of Horticultural Science and Biotechnology,2010,85(5): 5.doi:10.1080/14620316.2010.11512697.
[7]GRAHAM M,KO L,HARDY V,ROBINSON S,SAWYER B,O'HARE T,JOBIN M,DAHLER J,UNDERHILL S,SMITH M.The development of blackheart resistant pineapples through genetic engineering[C].International Pineapple Symposium ,2000.doi:10.17660/ActaHortic.2000.529.15.
[8]ZHOU Y C,PAN X P,QU H X,UNDERHILL S J R.Low temperature alters plasma membrane lipid composition and ATPase activity of pineapple fruit during blackheart development[J].Journal of Bioenergetics and Biomembranes,2014,46(1): 59-69.doi: 10.1007/s10863-013-9538-4.
[9]WEERAHEWA D,ADIKARAM N K B.Heat-induced tolerance to internal browning of pineapple (Ananas comosus cv.‘Mauritius’)under cold storage[J].Journal of Pomology and Horticultural Science,2005,80(4): 503-509.doi: 10.1080/14620316.2005.11511968.
[10]STEWART R J,SAWYER B J B,ROBINSON S P.Blackheart development following chilling in fruit of susceptible and resistant pineapple cultivars [J].Australian Journal of Experimental Agriculture,2002,42(42): 195-199.doi: 10.1071/ea01094.
[11]LUENGWILAI K,BECKLES D M,SIRIPHANICH J.Postharvest internal browning of pineapple fruit originates at the phloem [J].Journal of Plant Physiology,2016,202: 121-133.doi: 10.1016/j.jplph.2016.07.011.
[12]LU X H ,SUN D Q ,LI Y H,SHI W Q,SUN G M.Pre-and postharvest salicylic acid treatments alleviate internal browning and maintain quality of winter pineapple fruit[J].Scientia Horticulturae,2011,130(1): 97-101.doi: 10.1016/j.scienta.2011.06.017.
[13]KO L,ECCLESTON K,O’HARE T,WONG L,GILES J,SMITH M.Field evaluation of transgenic pineapple (Ananas comosus (L.)Merr.) cv.‘Smooth Cayenne’ for resistance to blackheart under subtropical conditions[J].Scientia Horticulturae,2013,159: 103-108.doi:10.1016/j.scienta.2013.05.006.
[14]HEWAJULIGE I G,WIJERATNAM S W,WIJESUNDERA R L.Pre-harvest application of calcium to control black heart disorder in Mauritius pineapples during low-temperature storage[J].Journal of the Science of Food and Agriculture,2010,86(3): 420-424.doi:10.1002/jsfa.2361.
[15]YOURYON P,WONGS-AREE C.Postharvest application of calcium chloride affects internal browning reduction during low temperature storage of ‘sawi’ pineapple[J].Acta Horticulturae,2015,(1088):197-200.doi: 10.17660/actahortic.2015.1088.29.
[16]PUSITTIGUL I,KONDO S,SIRIPHANICH J.Internal browning of pineapple (Ananas comosus L.) fruit and endogenous concentrations of abscisic acid and gibberellins during low temperature storage[J].Scientia Horticulturae,2012,146(3): 45-51.doi: 10.1016/j.scienta.2012.08.008.
[17]ZHOU Y,O'HARE T J,JOBIN-DECOR M,UNDERHILL S J,WILLS R B,GRAHAM M W.Transcriptional regulation of a pineapple polyphenol oxidase gene and its relationship to blackheart[J].Plant Biotechnology Journal,2003,1(6): 463-478.
[18]DAHLER J M,UNDERHILL S J,ZHOU Y C,GILES J E.Biochemical changes associated with chilling in pineapple fruit[J].Acta Horticulturae,2002,575: 603-610.doi: 10.17660/ActaHortic.2002.575.71.
[19]Machado F L D C,Lima R M T,Alves R E,Figueiredo R W .Influence of waxing coupled to 1-methylcyclopropene on compositional changes in early harvested 'Gold' pineapple for export[J].Acta Scientiarum Agronomy,2014,36(2): 219-225.doi: 10.4025/actasciagron.v36i2.17192.
[20]LUENGWILAI K,BECKLES D M,ROESSNER U,DIAS D A,LUI V,SIRIPHANICH J.Identification of physiological changes and key metabolites coincident with postharvest internal browning of pineapple(Ananas comosus L.) fruit[J].Postharvest Biology and Technology,2018,137(56): 65.doi: 10.1016/j.postharvbio.2017.11.013.
[21]STEWART R J,SAWYER B J B,BUCHELI C S,ROBINSON S P.Polyphenol oxidase is induced by chilling and wounding pineapple[J].Australian Journal of Plant Physiology,2001,28(3): 181-191.doi:10.1071/pp00094.
[22]TECHAVUTHIPORN C,BOONYARITTHONGCHAI P,SUPABVANICH S.Physicochemical changes of 'Phulae' pineapple fruit treated with short-term anoxia during ambient storage[J].Food Chemistry,2017,228: 388-393.doi: 10.1016/j.foodchem.2017.02.028.
[23]Milne D L,Van Lelyveld L J,De Villiers E A.The response to peroxidase and indolacetic acid oxidase in pineapple roots to foliar applications of fenamiphos[J].Agrochemophysica ,1977,9(3): 65-69.
[24]LENG P S,SU S C,FANG W,FEI Y,DUAN Y F,GEIJSKES R J,LAKSHMANAN P,TAJI A.Correlation between browning,total phenolic content,polyphenol oxidase and several antioxidation enzymes during pistachio tissue culture[J].Acta Horticulturae,2009,829:127-132.doi:10.17660/ActaHortic.2009.829.17.
[25]KANIUGA Z.Chilling response of plants: importance of galactolipase,free fatty acids and free radicals[J].Plant Biology,2010,10(2): 171-184.doi: 10.1111/j.1438-8677.2007.00019.x.
[26]NISHIDA I AND MURATA N.Chilling sensitivity in plants and cyanobacteria: the crucial contribution of membrane lipids[J].Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(1):541-568.doi: 10.1146/annurev.arplant.47.1.541.
[27]WOLFE J .Chilling injury in plants—the role of membrane lipid fluidity[J].Plant,Cell and Environment,1978,1(4):241-247.doi: 10.1111/j.1365-3040.1978.tb02036.x.
[28]WONGSHEREE T,KETSA S,VAN DOORN W G .The relationship between chilling injury and membrane damage in lemon basil (Ocimum× citriodourum) leaves[J].Postharvest Biology and Technology,2009,51(1): 91-96.doi: 10.1016/j.postharvbio.2008.05.015.
[29]AGHDAM M S,Bodbodak S.Physiological and biochemical mechanisms regulating chilling tolerance in fruits and vegetables under postharvest salicylates and jasmonates treatments[J].Scientia Horticulturae,2013,156(156): 73-85.doi: 10.1016/j.scienta.2013.03.028.
[30]ZHANG X D,WANG R P,ZHANG F J,TAO F Q,LI W Q.Lipid profiling and tolerance to low-temperature stress in Thellungiella salsuginea in comparison with Arabidopsis thaliana[J].Biologia Plantarum,2013,57(1): 149-153.doi: 10.1007/s10535-012-0137-8.
[31]FERRERES F,FIGUEIREDO R,BETTENCOURT S,CARQUEIJEIRO I,OLIVEIRA J,GILIZQUIERDO A,PEREIRA D M,VALENTÃO P,ANDRADE P B,DUARTE P.Identification of phenolic compounds in isolated vacuoles of the medicinal plant Catharanthus roseus and their interaction with vacuolar class III peroxidase: an H2O2 affair[J].Journal of Experimental Botany,2011,62(8): 2841-2854.doi: 10.1093/jxb/erq458.
[32]MURATA N AND LOS D A.Membrane fluidity and temperature perception[J].Plant Physiology,1997,115(3): 875-879.doi: 10.1104/pp.115.3.875.
[33]Rantong G,GUNAWARDENA A.Programmed cell death: genes involved in signaling,regulation,and execution in plants and animals[J].Botany,2015,93(4): 193-210.doi: 10.1139/cjb-2014-0152.
[34]KOUKALOVÁ B,KOVARÍK A,FAJKUS J,SIROKÝ J.Chromatin fragmentation associated with apoptotic changes in tobacco cells exposed to cold stress[J].FEBS Letters,1997,414(2): 289-292.doi:10.1016/S0014-5793(97)01008-9.
[35]CHEN X H,PENG N,DENG H J,MI H B,HOU X R,PING L,MAO L C.Evidence of programmed cell death induced by reconditioning after cold stress in cucumber fruit and possible involvement of ethylene[J].Journal of the Science of Food & Agriculture,2014,94(7): 1299-1304.doi: 10.1002/jsfa.6410.
[36]BETHKE P C,SCHUURINK R,JONES R L.Hormonal signalling in cereal aleurone[J].Journal of Experimental Botany,1997,48(312):1337-1356.doi: 10.1093/jxb/48.7.1337.
[37]FERNANDO D,JAVIER M,JAVIER C F.A gibberellin-induced nuclease is localized in the nucleus of wheat aleurone cells undergoing programmed cell death[J].Journal of Biological Chemistry,2004,279(12): 11530-11536.doi: 10.1074/jbc.M308082200.
[38]张鹤婷,肖羽,陈惠萍.OsVPE3参与GA、ABA调节水稻糊粉层细胞程序性死亡的发生[J].分子植物育种,2018,16(7): 2197-2204.
ZHANG H T,XIAO Y,CHEN H P.OsVPE3 Involved in the GA-and ABA-regulated programmed cell death of rice aleurone layers [J].Molecular Plant Breeding,2018,16(7): 2197-2204.
[39]ABBASI F,ONODERA H,TOKI S,TANAKA H,KOMATSU S.OsCDPK13,a calcium-dependent protein kinase gene from rice,is induced by cold and gibberellin in rice leaf sheath[J].Plant Molecular Biology,2004,55(4): 541-552.doi: 10.1007/s11103-004-1178-y.
[40]TAKASHI K,YURI T,RYOTA T,MEGUMI I,HIROYOSHI M,SEIJI T,AKIRA I,Che F.The transcription factor OsNAC4 is a key positive regulator of plant hypersensitive cell death[J].EMBO Journal,2009,28(8): 926-36.doi: 10.4161/psb.4.8.9087.
[41]IAKIMOVA E T,WOLTERING E J.The wound response in freshcut lettuce involves programmed cell death events[J].Protoplasma,2018(3): 1-14.doi: 10.1007/s00709-018-1228-y.
[42]KAI K,KASA S,SAKAMOTO M,AOKI N,WATABE G,YUASA T,IWAYA-INOUE M,ISHIBASHi Y.Role of reactive oxygen species produced by NADPH oxidase in gibberellin biosynthesis during barley seed germination[J].Plant Signaling and Behavior,2016,11(5): 00-00.doi: 10.1080/15592324.2016.1180492.
[43]ACHARD P,GONG F,CHEMINANT S,ALIOUA M,HEDDEN P.The cold-inducible cBF1 factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on Gibberellin metabolism[J].The Plant Cell ,2008,20(8):2117-2129.doi: 10.1105/tpc.108.058941.
[44]弓德强,谢江辉,张鲁斌,谷会,孙光明,朱世江.低温贮藏对控制菠萝黑心病和保持品质的影响[J].农业工程学报,2010,26(1):365-369.doi: 10.3969/j.issn.1002-6819.2010.01.065.
GONG D Q,XIE J H,ZHANG L B,GU H,SUN G M,ZHU S J.Effects of low temperature storage on blackheart incidence and quality maintenance of pineapple fruits[J].Transactions of the CSAE,2010,26(1): 365-369.doi: 10.3969/j.issn.1002-6819.2010.01.065.
[45]ZHANG Y,LIU Z,LIU J,LIN S,WANG J,LIN W,XU W.GADELLA pathway is involved in regulation of nitrogen deficiencyinduced anthocyanin accumulation[J].Plant Cell Reports,2017,36(4):557-569.doi: 10.1007/s00299-017-2102-7.
[46]ACHARD P,BAGHOUR M,CHAPPLE A,HEDDEN P,VAN DER STRAETEN D,GENSCHIK P,MORITZ T,HARBERD N P.The plant stress hormone ethylene controls floral transition via DELLA-dependent regulation of floral meristem-identity genes[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(15): 6484-6489.doi: 10.1073/pnas.0610717104.
[47]JIANG C,GAO X,LIAO L,HARBERD N P,FU X.Phosphate starvation root architecture and anthocyanin accumulation responses are modulated by the gibberellin-DELLA signaling pathway in Arabidopsis[J].Plant Physiol,2007,145(4): 1460-70.doi: 10.1104/pp.107.103788.
[48]LUO J,MA N,PEI H X,CHEN J W,LI J,GAO J P .A DELLA gene,RhGAI1,is a direct target of EIN3 and mediates ethylene-regulated rose petal cell expansion via repressing the expression of RhCesA2[J].Journal of Experimental Botany,2013,64(16): 5075.doi: 10.1093/jxb/ert296.
[49]LARRIGAUDIERE C,LENTHERIC I,VENDRELL M.Relationship between enzymatic browning and internal disorders in controlledatmosphere stored pears[J].Journal of the Science of Food and Agriculture,2010,78(2): 232-236.doi: 10.1002/(sici)1097-0010(199810)78:2<232::aid-jsfa108>3.0.co;2-4.
[50]CUI F Q,BROSCHÉ M,SIPARI N,TANG S J,OVERMYER K.Regulation of ABA dependent wound induced spreading cell death by MYB108[J].New Phytologist,2013,200(3): 634-640.doi: 10.1111/nph.1245.