【研究意义】干旱胁迫是限制植物光合作用、产量和影响植物分布的重要非生物因子[1]。干旱胁迫过程中,植物的生长和发育会受到抑制,植物能通过调节自身的生命活动来适应环境的改变[2]。沈媛媛[3]认为在不同程度的干旱胁迫下,植物叶绿素含量降低、光合速率下降以及叶绿素荧光参数变化也不同程度地发生。通过检测和分析植物的光合生理指标,了解植物对干旱胁迫环境的响应机制,能够充分了解干旱胁迫对植物光合作用的影响程度以及作用机理[4]。【前人研究进展】黑果腺肋花楸(Aronia melanocarpa)是蔷薇科腺肋花楸属多年生落叶灌木,别名野樱莓、不老莓,世界通用名Aronia(阿龙尼亚),树高1.5~2.5 m,丛状树形[5-6];原产地在美国东北部,在波罗的海沿岸至太平洋沿岸均有分布,在欧洲国家已有100多年的引种栽培历史[7-8]。黑果腺肋花楸果实中的花青素、黄酮、多糖和多酚是目前为止已知植物中含量最高的,超过长白山浆果类植物蓝靛果和蓝莓等的含量。黑果腺肋花楸是集食用、药用和园林观赏于一身的经济林与生态林树种,被称为自然界的“抗癌剂”[9]。我国于1990年从朝鲜引进黑果腺肋花楸[10],2013年引进新疆乌鲁木齐等地开始栽植试验[11]。2018年9月12日,国家卫生健康委员会认为黑果腺肋花楸可以作为新食品原料[12],这必将推动黑果腺肋花楸产业的发展。【本研究切入点】近年来,国内外有关黑果腺肋花楸的繁殖技术、栽培技术、生物活性成分以及相关产品研发上的研究报道较多,而有关黑果腺肋花楸生理特性方面的研究较少。研究表明,黑果腺肋花楸的适应能力较强,具有很强的抗旱和抗寒能力[13-14]。黑果腺肋花楸的根系为浅根性,水平根较发达,主根主要分布在30~40 cm的土壤中,当这个范围内的土壤水分不足时,黑果腺肋花楸的根系就很难从较深土壤中充分利用其水分,很容易使黑果腺肋花楸的水分利用不平衡,导致土壤干旱,影响生长发育。然而目前国内外关于黑果腺肋花楸的抗逆性研究还鲜见报道。【拟解决的关键问题】本试验以2年生黑果腺肋花楸为材料,研究其光合特性对干旱胁迫及复水的响应,为黑果腺肋花楸集约化大规模种植提供支撑。
1 材料与方法
1.1 试验材料
供试材料为2年生黑果腺肋花楸苗,由新疆维吾尔自治区五一农场提供。
1.2 试验设计
试验在新疆农业大学林学与园艺学院大棚网室进行。2018年5月,选取生长健壮、长势基本一致的2年生黑果腺肋花楸苗木为材料进行盆栽培育(花盆内径38 cm、深45 cm),栽培基质为园土∶沙子=2∶1的混合基质,每盆1株。处理前进行常规管理,保证其生长良好,至8月份进行土壤逐渐干旱处理和光合参数观测。选取生长健壮的盆栽苗20株,分别作为对照组和处理组,进行土壤逐渐干旱胁迫和旱后复水处理。2018年8月4日开始进行处理,干旱胁迫处理前1 d浇透水使土壤水分饱和(以花盆底部有水流出为准,下同),之后不再浇水使其自然干旱下形成土壤逐渐干旱胁迫梯度,每隔3 d测定1次花盆总质量,在干旱胁迫15、30 d时,每隔10 cm为一层采集土壤样品,测定土壤含水量。对照组每隔2 d 19:00采用称重法进行补水,旱后复水处理组在干旱胁迫30 d时浇透水。在整个试验过程中每隔3 d对光合作用参数进行测定。在干旱胁迫15、30 d和复水后5 d采集中上部叶片,冲洗干净,测定光合色素含量,每个处理5株。逐渐干旱试验过程(8月4日至9月3日)中,共下2次大雨和2次微雨,为减少降雨对土壤水分消耗的干扰,雨天时于顶部覆盖塑料薄膜简易遮雨棚。
1.3 测定指标及方法
1.3.1 土壤含水量测定 参照王燕凌等[16]的土壤烘干称重法。
1.3.2 叶片相对含水量测定 参照王燕凌等[16]的饱合称重法。
1.3.3 光合色素含量测定 参照王文杰等[17]的二甲基亚砜法。
1.3.4 叶片气体交换参数测定 从2018年8月4日开始,选择典型的晴朗天气,于每天9:00-11:00利用Licor-6400型的便携式光合作用测定系统,全面测定黑果腺肋花楸叶片的气体交换参数。
每个处理选择3株幼苗,每株测两个叶片重复测2次,选择中上部生长良好的叶片,测定黑果腺肋花楸的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)以及蒸腾速率(Tr)。测定时采用开放式气路,CO2浓度约为390 mol/L,采用光合仪内置模拟光照强度,光合有效辐射(PAR)为1 300 μmol/m2·s。计算水分利用效率(WUE),WUE=Pn/Tr,式中Pn为净光合速率,Tr为蒸腾速率。
光合CO2(Pn-Ci)响应曲线的测定参照艾力江·麦麦提等[15]的方法并加以改善:光强采用设定光合有效辐射强度(PAR)为1 300 μmol/m2·s作为测定时的光强,用Li-6400-01的液态CO2小钢瓶为气源,通过CO2注入系统控制叶室中CO2浓度分别为50、100、150、200、300、400、600、800、1 000、1 200 μmol/mol的条件下测定黑果腺肋花楸叶片法人光合速率(Pn)。测定Pn前首先使用1 300 μmol/m2·s光源诱导10 min左右。当空气环境中的CO2浓度达到平衡状态时,可以再次测定Pn。在这样的条件下,当测量过程中的变异率小于0.05时,便可以通过红外气体分析仪进行全面记录。
1.4 数据处理
应用Execl 2010软件进行数据处理和作图。利用SPSS 18.0软件采用Dancan新复极差法进行数据统计与分析。
2 结果与分析
2.1 不同处理花盆土壤质量和含水量的变化
2.1.1 土壤质量 由图1可知,随着停灌时间的延长,干旱处理的花盆质量不断降低,下降幅度逐渐减小。干旱处理3 d时,干旱处理花盆质量下降7.31%,干旱处理30 d时干旱处理花盆质量下降28.95%。
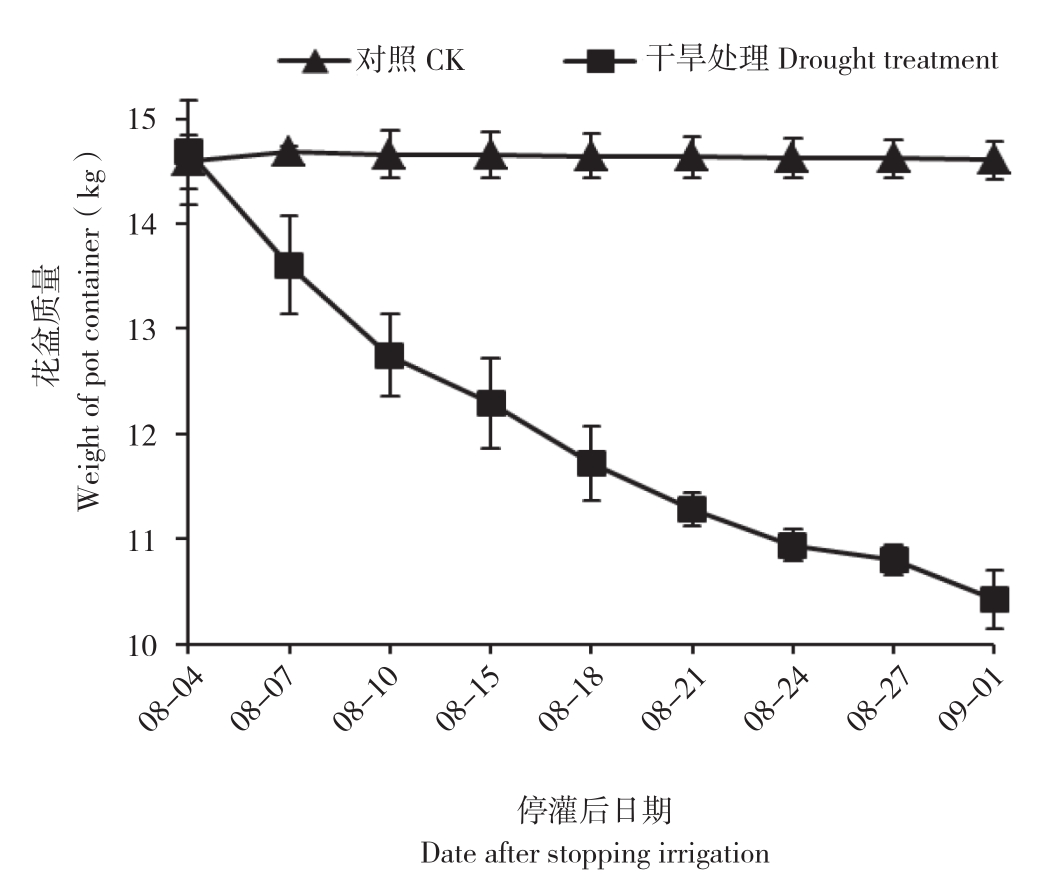
图1 干旱处理土壤不同时间花盆质量的变化
Fig. 1 Changes of flower pot weight of different time during drought stress
2.1.2 土壤含水量 由图2可知,随着停灌时间的延长,土壤含水量不断降低。停灌后,表层和深层的土壤含水量变化趋势一致,但深层土壤含水量比表层土壤含水量高。停灌30 d时,表层和深层的土壤含水量分别下降20.06%、17.41%。
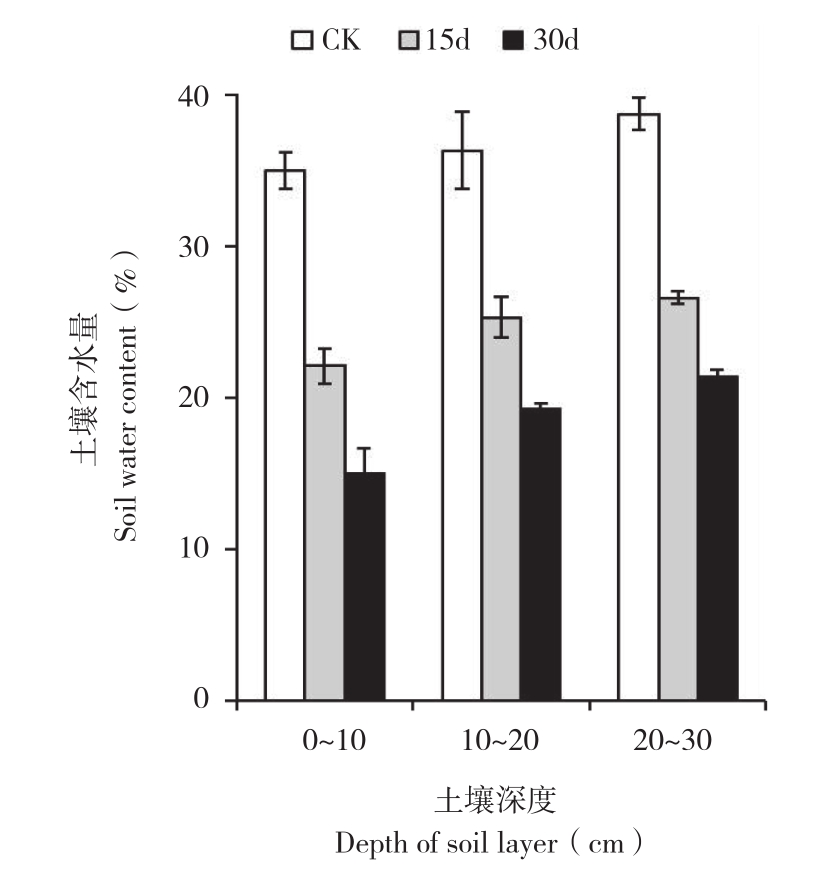
图2 干旱处理土壤不同层次土壤含水量的变化
Fig. 2 Changes of soil water content of different soil layers during drought stress
2.2 土壤逐渐干旱及复水过程中黑果腺肋花楸叶片相对含水量的变化
植物体内水分亏缼的程度可以通过植物叶片相对含水量反映出来。由图3可知,随着土壤干旱胁迫的逐渐加剧,黑果腺肋花楸叶片相对含水量逐渐降低。干旱处理15 d时,黑果腺肋花楸叶片相对含水量下降6.81%;干旱处理30 d时,黑果腺肋花楸叶片相对含水量下降10.85%,与对照相比呈现显著差异。复水后,黑果腺肋花楸叶片相对含水量迅速升高,比干旱处理30 d时增加5.17%,但尚未恢复至干旱处理前的水平。
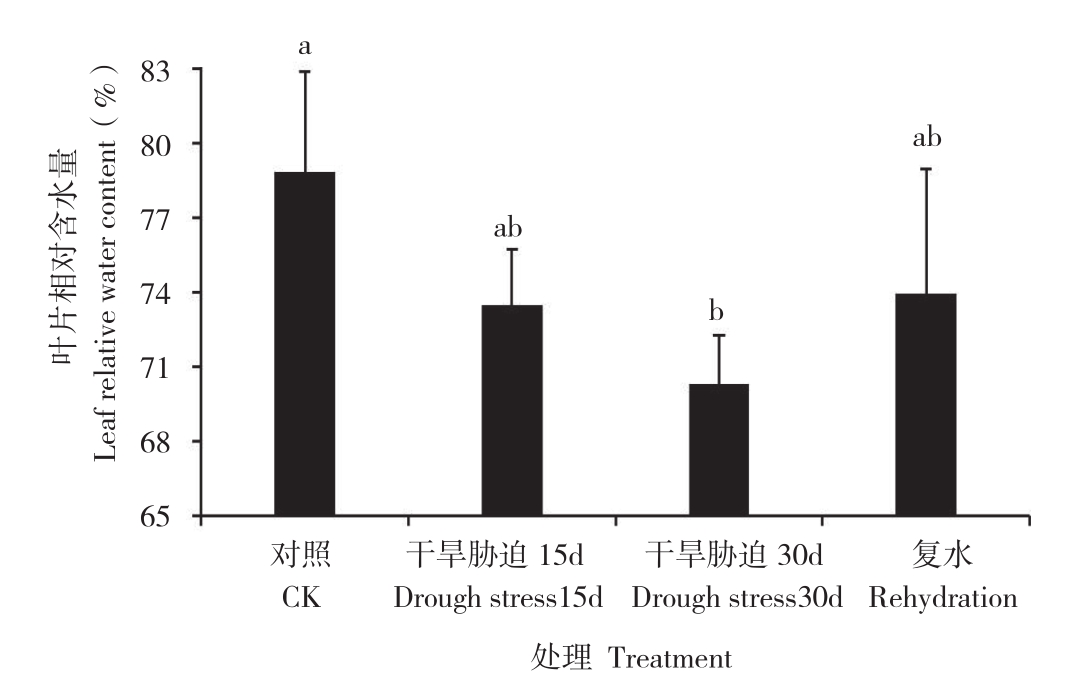
图3 干旱胁迫及复水过程中黑果腺肋花楸叶片相对含水量的变化
Fig. 3 Changes of leaf relative water content of A. melanocarpa during drought stress and rehydration
2.3 土壤逐渐干旱及复水过程中黑果腺肋花楸叶片光合色素含量的变化
土壤逐渐干旱及复水过程中黑果腺肋花楸叶片光合色素的变化如图4所示,随着土壤干旱胁迫的逐渐加剧,黑果腺肋花楸叶片总叶绿素、叶绿素a、叶绿素b含量均逐渐减少,叶绿素a/b值逐渐增加,干旱胁迫30 d时,均与对照差异显著,类胡萝卜素含量的变化不明显。复水后,总叶绿素、叶绿素a、叶绿素b含量均迅速增加,叶绿素a/b值减小。
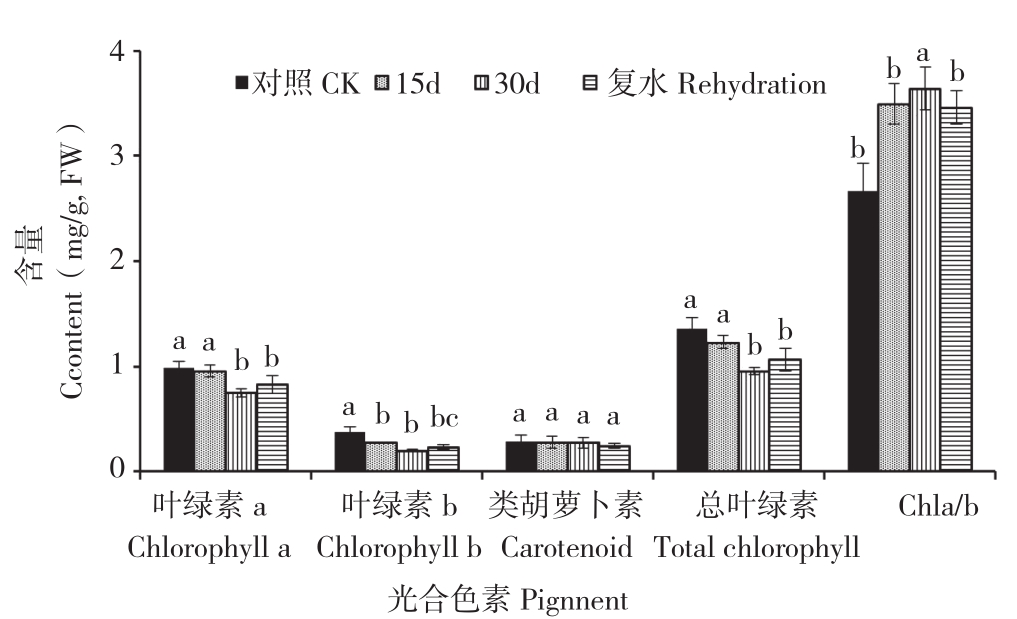
图4 干旱胁迫及复水过程中黑果腺肋花楸光合色素含量的变化
Fig. 4 Changes of photosynthetic pigment content of A. melanocarpa during drought stress and rehydration
2.4 土壤逐渐干旱及复水过程中黑果腺肋花楸叶片光合参数的变化
土壤逐渐干旱及复水过程中黑果腺肋花楸叶片光合参数的变化如图5所示。随着干旱胁迫的逐渐加剧,Pn、Gs、Ci、Tr均逐渐降低,WUE呈现先升后降的现象。干旱处理30 d时,Pn、Gs、Ci、Tr均降到最低值,显著低于干旱处理前的水平,分别比干旱胁迫处理前下降85.4%、79.86%、31.98%、91.55%,说明黑果腺肋花楸的光合作用因水分胁迫而受到抑制。WUE在8月24日达到最大值、为6.74 mmol/mol,比干旱胁迫处理前上升56.49%,8月27日开始逐渐降低。复水后,Gs、Ci、Tr均未恢复到干旱处理3 d时的水平,分别比干旱处理3 d时降低27.99%、14.15%、16.58%,Pn比干旱处理3 d时升高0.54%,但未恢复到对照水平,WUE超出干旱处理3 d时的水平甚至超过对照水平,比干旱处理3 d和对照分别升高15.44%、7.6%。从Pn、Gs、Ci、Tr的变化可以看出,在黑果腺肋花楸干旱胁迫处理期间,4个指标的变化趋势基本一致。Gs、Ci随着Pn的变化而变化,这可能因为干旱胁迫致使光合作用受到阻碍,叶片气孔关闭致使CO2供应不足,导致Ci值降低。4个指标均在干旱胁迫严重时降到最小值,由此可见,干旱胁迫严重时抑制黑果腺肋花楸的光合作用,但复水后能迅速恢复。
2.5 CO2浓度升高对干旱胁迫黑果腺肋花楸叶片光合参数的影响
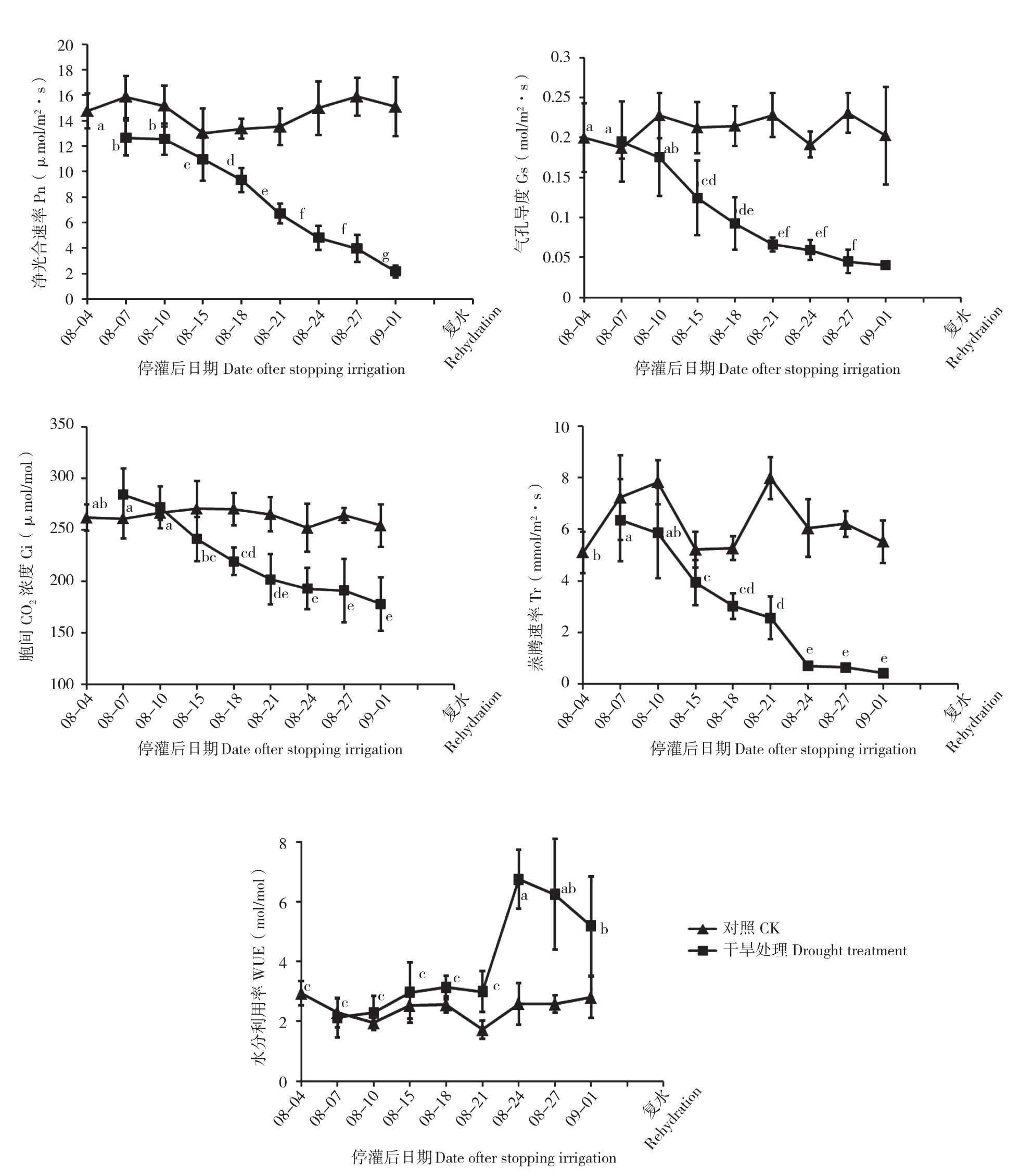
图5 干旱胁迫及复水过程中黑果腺肋花楸光合参数的变化
Fig. 5 Changes of photosynthetic parameters of A. melanocarpa during drought stress and rehydration
2.5.1 Pn 由图6A可知,随着CO2浓度的增加,对照黑果腺肋花楸叶片的Pn逐渐增加,干旱处理植株的Pn先增加后降低,当CO2浓度为50 μmol/mol时,干旱处理Pn比对照高出1.16 μmol/m2·s;当CO2浓度增加到100 μmol/mol时,对照Pn比干旱处理高0.81 μmol/m2·s;当 CO2浓度为 600 μmol/mol时,干旱处理Pn达到最大值(为5.08 μmol/m2·s);当 CO2浓度在 200~600 μmol/mol范围内时,对照 Pn随着CO2浓度增加而增加的幅度最大。
2.5.2 Gs 干旱处理和对照黑果腺肋花楸叶片的Gs随着CO2浓度的升高,呈现先减小后增加的趋势,但对照的Gs一直高于干旱处理(图6B)。CO2浓度在 800~1 200 μmol/mol时,干旱处理的Gs随CO2浓度增加而增加的幅度最大,并在CO2浓度为1 200 μmol/mol时达到最大值0.11 mol/m2·s,Gs较高有利于提高光合速率。
2.5.3 Ci 图6C显示,随着CO2浓度的升高,干旱处理和对照黑果腺肋花楸叶片的Ci的浓度逐渐升高,CO2浓度为800~1 200 μmol/mol时,干旱处理组的Ci随着CO2浓度增加而增加的幅度比对照大。当CO2浓度为1 000、1 200 μmol/mol时,干旱处理的Ci都比对照高,分别高出102.52、249.08 μmol/mol,说明提高CO2浓度可以促进水分胁迫下黑果腺肋花楸胞间CO2浓度Ci值的升高。
2.5.4 Tr 随着CO2浓度的增高,干旱处理黑果腺肋花楸叶片的Tr出现两个峰值,分别是当CO2浓度为100、1 200 μmol/mol时,Tr值分别为0.38、1.26 mmol/m2·s,对照的Tr值先减小后增加,且对照的Tr值一直高于干旱处理(图6D),说明水分胁迫下CO2浓度的增加不能提高黑果腺肋花楸叶片的Tr值,以致于不能对水分和矿物质进行很好的吸收,不能降低水分胁迫对黑果腺肋花楸的伤害。
2.6 干旱胁迫黑果腺肋花楸CO2响应特征参数的模型模拟
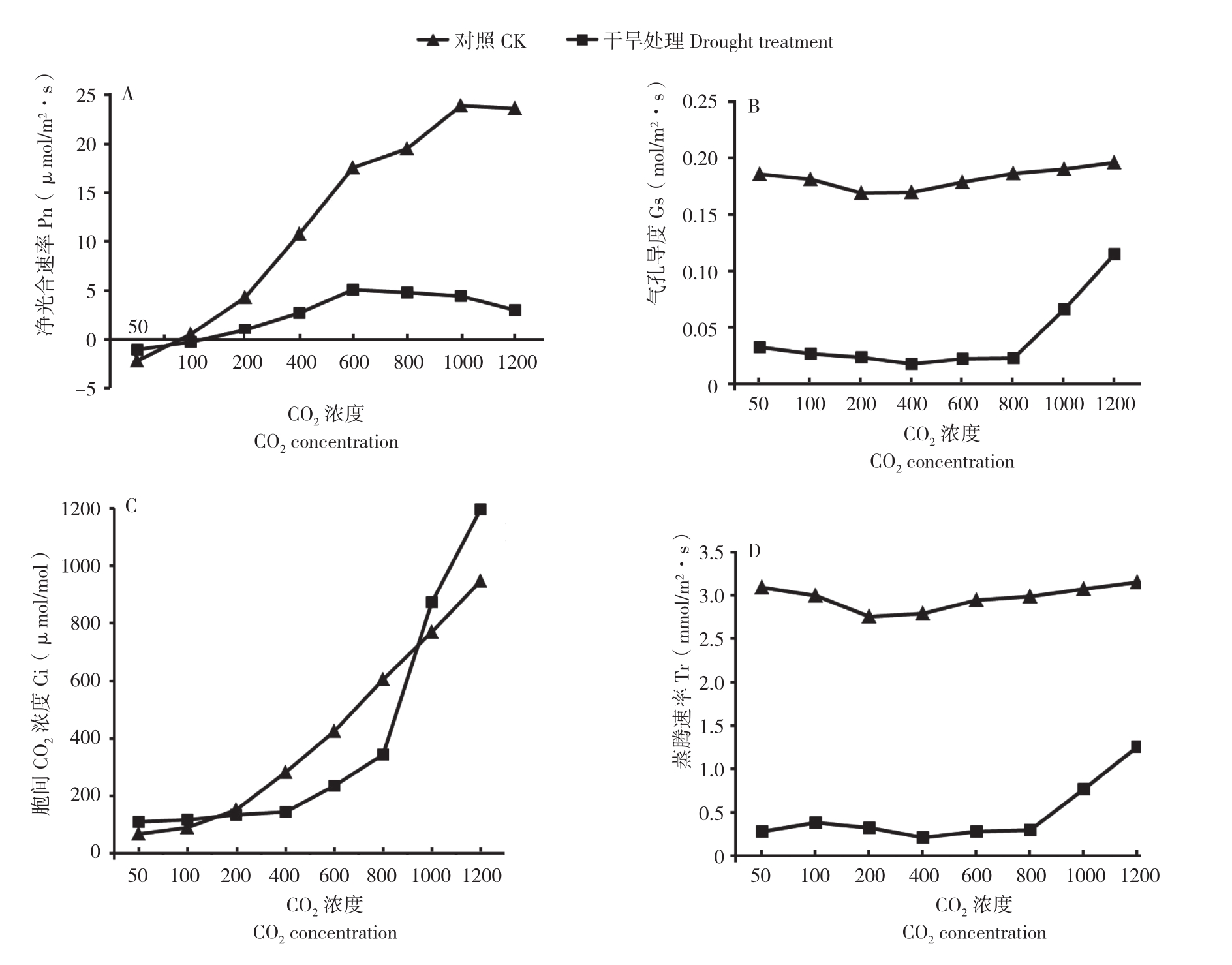
图6 CO2浓度对干旱胁迫下黑果腺肋花楸光合参数的变化
Fig. 6 Variation of photosynthetic parameters of A. melanocarpa with different CO2 concentration during drought stress
对低CO2浓度下的Pn-Ci曲线作线性回归,根据线性回归方程可求出黑果腺肋花楸的羧化效率(CE)和CO2补偿点等光合生理参数。结果表明,干旱处理和对照的CO2补偿点分别为138.8、77.4 μmol/mol,干旱处理的CO2补偿点升高,说明干旱处理的呼吸速率增加,而Pn降低。干旱处理和对照CE分别为0.01 mol/m2·s和0.029 mol/m2·s,说明黑果腺肋花楸受到干旱胁迫,使得CE降低,上述结果表明土壤水分过低对黑果腺肋花楸叶片的CO2同化能力造成影响。
3 讨论
干旱是抑制植物光合作用最主要的环境因子,因此,植物抗旱性的强弱可以根据其光合作用强弱来进行评判[18]。水是植物生长发育过程中重要的生态因子,是植物进行光合作用的一种原料,当出现土壤水分不足时,植物会通过关闭叶片气孔,抑制植物从外界吸收CO2,进而导致植物叶片蒸腾速率和光合速率都降低[19]。光合色素是绿色植物光合作用的物质基础,光合色素含量及叶绿素a/b值对植物的光合速率有直接影响[20]。研究表明,干旱胁迫下植物光合速率的降低主要受气孔限制因素和非气孔限制因素的双重作用影响[21-22]。本试验中,随着干旱胁迫的逐渐加剧,净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)均逐渐降低。干旱处理15 d时,土壤含水量下降12.94%,黑果腺肋花楸的净光合速率只比对照低30.07%,干旱持续30 d仍具有一定的生物活性、没有死亡,表明黑果腺肋花楸的抗旱性较好。干旱处理30 d时,叶片相对含水量降低,且下降幅度与干旱程度呈正相关,但黑果腺肋花楸仍保持较高叶片相对含水量,表明能适应一定的干旱胁迫。干旱复水后,黑果腺肋花楸的叶片相对含水量能恢复至对照水平,表明其自身具有较强的调节能力。当植物处于逆境环境时,光合色素含量能在一定程度上反映该植物的同化能力[23],逆境对植物造成的伤害程度可以通过叶绿素a/b值来进行判断[24]。干旱胁迫处理30 d时,叶绿素a/b值最高,表明此时黑果腺肋花楸没有受到极为严重的干旱伤害。干旱胁迫过程中,类胡萝卜素的含量变化不明显,说明黑果腺肋花楸和蒲苇一样,自身清除活性氧游离基的能力较强和能够很好保护光合系统免受光动力氧化作用的破坏[25]。干旱胁迫下,Gs降低的同时,Pn、Tr、Ci也降低,表明黑果腺肋花楸光合速率的降低是由气孔限制因素造成的,这与在其他植物上的研究结果[3,21,23]相符合。复水后,Pn、Tr、WUE、Ci和Gs均迅速升高,其中Pn和Tr均恢复到干旱处理3 d前的水平,说明干旱胁迫没有对黑果腺肋花楸叶片造成很严重的损伤,当土壤水分情况恢复正常后,干旱胁迫造成的损伤将得到修复,光合速率也得到很好的恢复。
目前,关于植物光合特性对CO2浓度和干旱胁迫双重处理的响应研究较多。有研究认为干旱胁迫会抑制高CO2浓度对植物生长发育的促进作用,也有研究认为干旱胁迫下高CO2浓度对植物生长发育的促进作用能发挥得更好[26]。本试验中,对照的Pn、Gs、Tr几乎一直高于干旱处理,对照的Ci一直低于干旱处理,因此,黑果腺肋花楸受到干旱胁迫时光合速率的降低不是完全因为气孔关闭所导致的,不能直接通过增加CO2浓度来恢复光合速率[21]。在一定的CO2浓度范围内,增加CO2浓度会促进干旱胁迫中黑果腺肋花楸Pn的提高。在干旱胁迫中,黑果腺肋花楸的CO2补偿点升高,羧化效率(CE)明显减小,说明在干旱胁迫过程中,黑果腺肋花楸对CO2的同化作用降低,对CO2的利用能力也减弱。
4 结论
土壤逐渐干旱过程中,黑果腺肋花楸各项光合生理指标都有所降低,但干旱胁迫时间不同降低幅度也有所差别。干旱处理30 d时,黑果腺肋花楸净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)均降到最低值,均显著低于干旱处理前的水平(P<0.05),分别比干旱胁迫处理前下降85.4%、79.86%、31.98%和91.55%。在胁迫去除即干旱复水后,叶片相对含水量和叶绿素含量有所增高;各项光合参数有所回升,Gs、Ci、Tr均未恢复到干旱处理3 d时的水平,但仅比干旱处理3 d时降低27.99%、14.15%、16.58%,Pn比干旱处理3 d时升高0.54%,反映出黑果腺肋花楸在复水后具有较强的自我调节能力。根据干旱胁迫和复水下叶片Gs和Ci的变化趋势发现,气孔限制是影响黑果腺肋花楸光合特性的主要因素;土壤逐渐干旱胁迫下,黑果腺肋花楸促进气孔关闭,减轻叶片水分散失,仍维持较高的叶片相对含水量,这有利于提高抗旱能力。黑果腺肋花楸通过维持较高的Pn、较低的Tr来提高WUE,保持良好叶片水分状况来抵御干旱胁迫的伤害,通过表现出较强的恢复能力适应土壤干旱环境。
[1] XU Z Z, ZHOU G S, SHIMIZU H. Plant responses to drought and rewatering[J]. Plant Signal Behav,2010,5(6):649-654. doi:10.4161/psb.5.6.11398.
[2] 王龙强. 盐地枸杞对土壤盐分的影响及生理指标研究[D].兰州:甘肃农业大学,2005.WANG L Q. Study on the effects of medlar on soil salinity and its physiological indexes[D]. Lanzhou: Gansu Agricultural University,2005.
[3] 沈媛媛. 不同水分胁迫对核桃叶片SPAD及光合特性的影响研究[D].郑州:河南农业大学,2017.SHEN Y Y. SPAD and photosynthetic characteristics of Juglans regia leaves under different water stress[D]. Zhengzhou: Henan Agricultural University, 2017.
[4] 王彬,胡红玲,胡庭兴,何时东,胡义,周鑫,谭飞.干旱胁迫对桢楠幼树生长及光合特性的影响[J].西北农林科技大学学报(自然科学版),2019,47(2):79-87,96. doi:10.13207/j.cnki.jnwafu.2019.02.010.WANG B, HU H L, HU T X, HE S D, HU Y ZHOU X TAN F. Effects of drought stress on photosynthetic characteristics and growth of phoebe zhennan seedlings[J]. Journal of Northwest A&F University(Science Edition), 2019,47(2):79-87,96. doi:10.13207/j.cnki.jnwafu.2019.02.010.
[5] 韩文忠,马兴华,姜镇荣,孙文生,龙忠伟,连永刚,张大龙.黑果腺肋花楸形态特征和生长发育特性研究[J].中国林副特产,2008(3):4-6. doi:10.13268/j.cnki.fbsic.2008.03.028.HAN W Z, MA X H,JIANG Z R, SUN W S, LONG Z W, LIAN Y G, ZHANG D L. Form features and growth properties research of Aronia melanocarpa[J]. Chinese Forest Sideline, 2008(3): 4-6.doi:10.13268/j.cnki.fbsic.2008.03.028.
[6] KULLING S E, RAWEL H M . Chokeberry(Aronia Melanocarpa)-a review on the characteristic components and potential health effects[J]. Planta Medica, 2008, 74(13):1625-1634. doi:10.1055/s-0028-1088306.
[7] JAN O, SABINA L. Effect of the production of dried fruits and juice from chokeberry(Aronia melanocarpa L.)on the content and antioxidative activity of bioactive compounds[J]. Molecules(Basel,Switzerland), 2016, 21(8):1-14 doi:10.3390/molecules21081098.
[8] 景安麒,朱月.基于文献计量的黑果腺肋花楸国内研究现状分析[J].食品工业科技,2018,39(23):351-356.JING A Q, ZHU Y. The domestic research progress of Aaronia mealnocarpa[J]. Science and Technology of Food Industry, 2018,39(23):351-356.
[9] THI N D, HWANG E S. Bioactive compound contents and antioxidant activity in Aronia(Aaronia melanocarpa)leaves collected at different growth stages[J]. Preventive Nutrition and Food Science, 2014, 19(3):204-212. doi.org/10.3746/pnf.2014.19.3.204.
[10] 刘珈铭,刘欣.黑果腺肋花楸果的功能与应用价值[J].食品安全导刊,2018(18):130. doi:10.16043/j.cnki.cfs.2018.18.103.LIU J M, LIU X. The function and application value of Aronia melanocarpa[J]. Food Safety Guide,2018(18):130. doi:10.16043/j.cnki.cfs.2018.18.103.
[11] 亚里坤·努尔,吐尔逊古丽·托乎提,张玉莲.黑果腺肋花楸形态特征与种植栽培管理研究[J].中国林副特产,2018(6):9-13,16.doi:10.13268/j.cnki.fbsic.2018.06.003.NUER Y L K, TUOHUTI T E X G L, ZHANG Y L. Study on morphological characteristics and planting and cultivation management of Aronia melanocarpa[J]. Chinese Forest Sideline, 2018(6):9-13,16.doi:10.13268/j.cnki.fbsic.2018.06.003.
[12] 关于黑果腺肋花楸果等2种新食品原料的公告[J]. 中国食品卫生杂志,2018,30(6):638.Notice on two new food raw materials, such as Aronia melanocarpa[J].Chinese Journal of Food Hygiene, 2008,30(6):638.
[13] 韩文忠,马兴华.黑果腺肋花楸抗旱生理特性的初步研究[J].辽宁林业科技,2004(6):12-13,38.HAN W Z, MA X H. Physiological characteristics of drought resistance for Aronia melanocarpa[J]. Journal of Liaoning Forestry Science& Technology, 2004(6):12-13,38.
[14] 田明芳.黑果腺肋花楸的组织培养快繁技术[J].农民致富之友,2018(11):190.TIAN M F. Tissue culture and rapid propagation technique of Aronia melanocarpa[J]. Friends of the Farmers to Get Rich, 2018(11):190.
[15] 艾力江·麦麦提,买尔旦·阿不都卡德,木合太·尼亚孜,艾比布拉·艾合买提,库尔班尼萨·艾力木.乌鲁木齐城市绿化树种光合能力对CO2浓度增高的响应[J].绿色科技,2019(9):6-8. doi:10.16663/j.cnki.lskj.2019.09.003.MAIMAITI A L J, ABUDUKADE M E D, NIYAZI M H T, AIHEMAITI A B B L, AILIMU K E B N S. Response of photosynthetic capacity to increased CO2 concentration of urban greening tree species in urumqi[J]. Green Science and Technology, 2019(9):6-8. doi:10.16663/j.cnki.lskj.2019.09.003.
[16] 王燕凌,刘君,齐曼·尤努斯.植物生理学实验指导[M].北京:中国农业出版社,2014.WANG Y L, LIU J, QIMAN Y N S. Experimental guidance of plant physiology[M]. Beijing: China Agricultural Press,2014.
[17] 王文杰,贺海升,关宇,李文馨,张衷华,祖元刚.丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较[J].植物研究,2009,29(2):224-229.WANG W J, HE H S, GUAN Y, LI W X, ZHANG Z H, ZU Y G.Comparison of methodologies for determination of chlorophyll and carotenoids in plants by acetone and dimethyl sulfoxide[J]. Plant Research, 2009,29(2):224-229.
[18] 齐曼·尤努斯,木合塔尔·扎热,塔衣尔·艾合买提.干旱胁迫下尖果沙枣幼苗的根系活力和光合特性[J].应用生态学报,2011,22(7):1789-1795. doi:10.13287/j.1001-9332.2011.0251.QIMAN Y N S,MUHETAER Z R, TAYIER A H M T. Root activity and photosynthetic characteristics of Elaeagnus oxycarpa seedlings under drought stress[J]. Journal of Applied Ecology, 2011,22(7):1789-1795.doi:10.13287/j.1001-9332.2011.0251.
[19] 张文丽,张彤,吴冬秀,张岁岐,山仑.土壤逐渐干旱下玉米幼苗光合速率与蒸腾速率变化的研究[J].中国生态农业学报,2006(2):72-75.ZHANG W L, ZHANG T, WU D X, ZHANG S Q, SHAN L. The changes of photosynthetic rate and transpiration rate of maize seedling under soil progressive drought[J]. Chinese Journal of Eco-Agriculture, 2006(2):72-75.
[20] 张慕黎. 刺槐和侧柏苗木对干旱胁迫及旱后复水的生理反应研究[D].杨凌:西北农林科技大学,2009.ZHANG J X. Physiological response of Robinia pseudoacacia and Platyclatus orientalis to stress and re-watering[D]. Yangling:Northwest A & F University,2009.
[21] 路丙社,白志英,孙浩元,李会平,刘忠华,董源.土壤含水量对阿月浑子叶片净光合速率及叶绿素荧光参数的影响[J].园艺学报,2004(6):727-731. doi:10.16420/j.issn.0513-353x.2004.06.005.LU B S, BAI Z Y, SUN H Y, LI H P, LIU Z H, DONG Y. Effects of soil water content level on net photosynthetic rate and chlorophyll fluorescence parameters in pistachio leaves[J]. Journal of Horticulture, 2004(6):727-731. doi:10.16420/j.issn.0513-353x.2004.06.005.
[22] 吴俊文,刘珊,李吉跃,何茜,苏艳,邱权,白晶晶,王燕,贾鹏.干旱胁迫下广东石漠化地区造林树种光合和耗水特性[J].生态学报,2016,36(11):3429-3440. doi: 10.5846/stxb201505060937.WU J W, LIU S, LI J Y, HE Q, SU Y, QIU Q, BAI J J, WANG Y, JIA P. Photosynthetic and water consumption of tree species utilized for afforestation of rocky desert in Guangdong Province[J]. Acta Oecologica, 2016,36(11):3429-3440. doi:10.5846/stxb201505060937.
[23] 姚春娟,郭圣茂,马英超,赖晓莲,杨肖华.干旱胁迫对4种决明属植物光合作用和叶绿素荧光特性的影响[J].草业科学,2017,34(9):1880-1888. doi:10.11829/j.issn.1001-0629.2016-0588.YAO C J, GUO S M, MA Y C, LAI X L, YANG X H. Effect of drought stress on characteristics of photosynthesis and chlorophyll fluorescence of four species of Cassia[J]. Practaculture Science, 2017,34(9):1880-1888. doi:10.11829/j.issn.1001-0629.2016-0588.
[24] 逯久幸,李闯,李永华,杨秋生.逐渐干旱对牡丹实生苗某些生理指标的影响[J].河南农业科学,2011,40(2):125-127. doi:10.15933/j.cnki.1004-3268.2011.02.037.LU J X, LI C, LI Y H, YANG Q S. Effects of gradual drought on physiological indexs of seedling in Paeonia suffruticosa[J].Henan Agricultural Sciences,2011,40(2):125-127. doi:10.15933/j.cnki.1004-3268.2011.02.037.
[25] 孔兰静. 三种观赏草对土壤干旱胁迫的生理响应[D].泰安:山东农业大学,2009.KONG L J. Physiological response to soil drought stress in there ornamental grasses[D]. Tai’an: Shandong Agricultural University,2009.
[26] 田露. 水稻幼苗对高浓度CO2和水分胁迫的生理响应研究[D].沈阳:沈阳师范大学,2016.TIAN L. Physiological response of rice seedlings to elevated CO2 concentration and water stress[D]. Shenyang: Shenyang Normal University, 2016.