【研究意义】铬(Cr)是一种潜在毒性元素(PTE),与铅、镉、砷和汞合称为“五毒”[1]。含铬污水的灌溉、含铬农药和化肥的不合理使用以及城市垃圾的随意排放是农田土壤铬污染的重要来源[2]。土壤中的铬元素形态以三价和六价为主,这两者对人类和其他生物均有高度毒性[3]。在土壤中Cr(Ⅲ)表现较为稳定,它被土壤胶体吸附后能形成溶解度极低的沉淀物,因此降低了其浸入地下水或被植物吸收的可能[4]。而土壤中Cr(Ⅵ)包括铬酸盐和重铬酸盐化合物等,易通过食物链进入生物体并在其中积累,相比之下,Cr(Ⅵ)表现出强氧化性和高溶解度,Cr(Ⅵ)的毒性约为Cr(Ⅲ)的100倍[5-6]。因此,高毒性的Cr(Ⅵ)在废水和农田土壤中非常活跃,且由于其无法被生物降解、高持久性的特点,严重威胁着环境生态平衡和公共健康[7-8]。据报道,Cr在植物的生理生化代谢中没有任何已知的生物学作用[6]。Cr是一种植物体非必需的元素,能够通过硫酸盐转运体与其他必需元素一起被吸收进植物体[9-10]。而植物中积累过量的Cr元素会导致机体形态和生理生态等发生毒性反应[11-12]。为抵制高质量浓度铬的毒性,植物细胞会产生大量的活性氧(ROS)[13]。然而,植物中活性氧达到一定水平后,将会导致植物细胞内DNA和RNA损伤、酶活性受抑制、脂质过氧化和蛋白质氧化等氧化反应,最终导致细胞中毒[14-15]。中毒的植物细胞膜受损,叶绿体超微结构发生改变,色素含量降低,进而导致整个植株根部受损而无法正常吸收矿物质营养,叶片褪绿,甚至导致植株枯萎死亡[16-17]。因此,如何安全有效地治理和修复农田铬污染已成为全球亟待解决的重大难题。【前人研究进展】与电动法、淋洗法和固化/稳定化法等常用的修复方法相比,微生物法由于低成本、无二次污染以及可操作性强等特点成为重金属铬污染修复的研究热点[18-19]。研究表明,在Cr(Ⅵ)含量达到250 mg/kg的土壤中利用黑曲霉作为吸附剂,15 d内可吸附75%的Cr(Ⅵ)[20];将链霉菌与含铬土壤混合培养30 d,可以将泥土中含有的1 800 mg/kg Cr(Ⅵ)完全还原[21];在厌氧条件下,铬还原菌能够在20 d内将土壤中Cr(Ⅵ)质量浓度为5.6 mg/g的Cr(Ⅵ)完全还原[22]。【本研究切入点】选取具有一定Cr(Ⅵ)耐受能力、生长速率较快的小白菜作为试验材料,在模拟小白菜生长的含Cr(Ⅵ)水培环境中添加一株具有Cr(Ⅵ)还原能力的菌Exiguobacterium sp.EH5(菌株E)。【拟解决的关键问题】通过检测小白菜幼苗生物量、叶片抗氧化酶和非酶抗氧化物含量的变化,研究Cr(Ⅵ)胁迫下菌株E对小白菜幼苗生长及生理生态效应的影响,以期为进一步利用Cr(Ⅵ)还原菌修复农田重金属铬污染提供可靠的实验材料以及科学的理论依据。
1 材料与方法
1.1 试验材料
试验菌株是从某电镀厂废水活性污泥系统中分离筛选得到的具有高效Cr(Ⅵ)还原能力的微小杆菌Exiguobacterium sp. EH5(菌株E)。将菌株E接种至LB培养基中,于170 r/min、30 ℃条件下培养24 h,用无菌去离子水离心洗涤2次后,加无菌去离子水重悬至OD600nm≈4得到菌悬液。
供试四季小白菜种子购自河北石家庄禾硕种业。
Cr(Ⅵ)水培液为1 000 mg/L的重铬酸钾(K2Cr2O7)储备液:准确称取烘干的2.829 g(110 ℃,2 h)重铬酸钾,充分溶解于去离子水中,移入1 000 mL容量瓶定容至刻度,保存备用。
水培营养液(霍格兰培养液),其组分为:硫酸钾607 mg/L,磷酸二氢铵11.5 mg/L,硫酸镁493 mg/L,EDTA铁钠盐20 mg/L,硫酸亚铁2.86 mg/L,硼砂4.5 mg/L,硫酸锰2.13 mg/L,硫酸铜0.05 mg/L,硫酸锌0.22 mg/L,硫酸铵118.9 mg/L,硝酸钙945 mg/L。试验所用药品均为分析纯。
1.2 试验方法
育苗前,为了避免微生物污染,小白菜种子表面均用10%次氯酸钠溶液浸泡10 min,无菌水反复冲洗5次。播种前,将种子浸泡在无菌水中6 h,以保证其吸足水分。将大小相近、吸足水分的种子,播种至无菌水浸湿的30 cm×20 cm×2.4 cm的育苗海绵中,每块海绵播96颗种子。将育苗盘置于相对湿度为60%的室内植物培养架上,用无菌去离子水培养,设置昼夜比为16 h/8 h,每天添加无菌去离子水以保持海绵中有足够水分。培养7 d后,将长势均匀、两叶一心的芽苗移植入半透明塑料容器中继续培养,每箱6株。每箱装满2 L霍格兰溶液后,再加入不同质量浓度的重铬酸钾溶液。将所有盆栽分为C组(对照)和T组,T组按1%接种量(体积比)添加菌悬液(表1),所有处理均设置3个重复。培养过程中每天根据液面变化添加无菌去离子水,以保持总的培养液体积不变。移植后培养时间为14 d。
表1 试验设计
Table 1 Experiment design
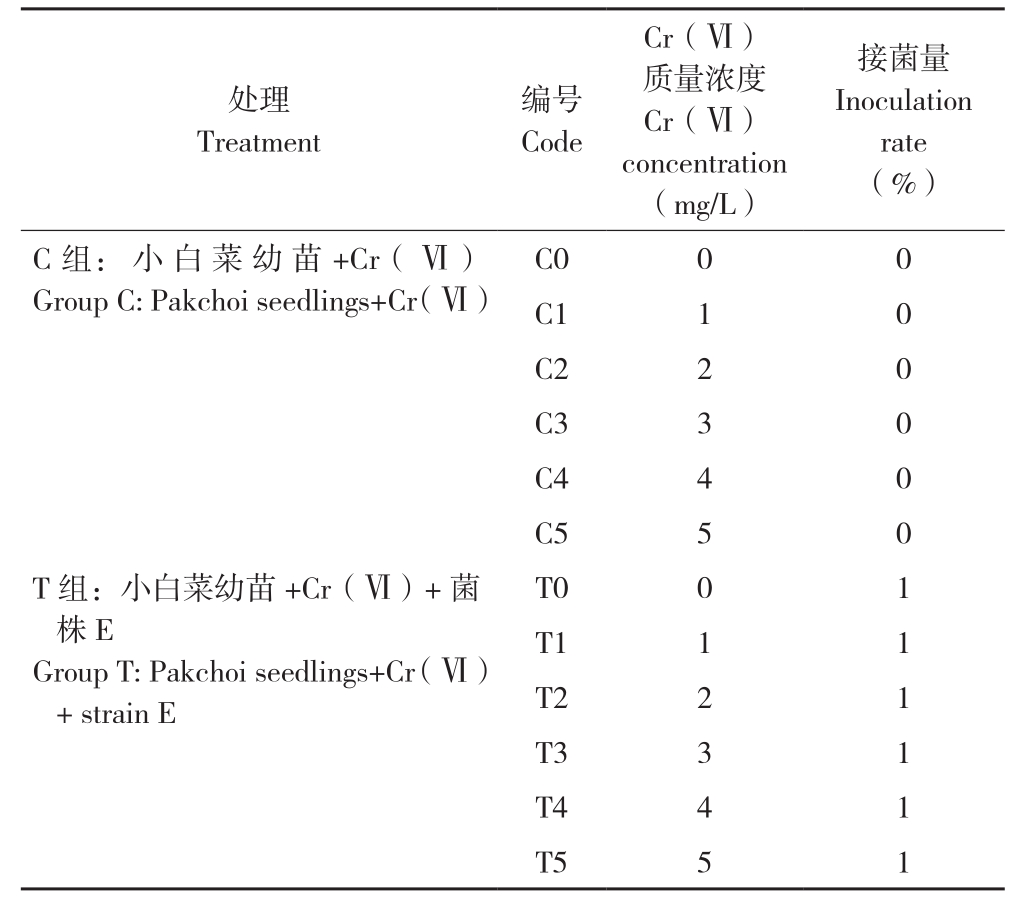
接菌量Inoculation rate(%)处理Treatment编号Code Cr(Ⅵ)质量浓度Cr(Ⅵ)concentration(mg/L)C组:小白菜幼苗+Cr(Ⅵ)Group C: Pakchoi seedlings+Cr(Ⅵ)C0 0 0 C1 1 0 C2 2 0 C3 3 0 C4 4 0 C5 5 0 T组:小白菜幼苗+Cr(Ⅵ)+菌株E Group T: Pakchoi seedlings+Cr(Ⅵ)+ strain E T0 0 1 T1 1 1 T2 2 1 T3 3 1 T4 4 1 T5 5 1
1.3 测定指标及方法
1.3.1 小白菜幼苗生物量的测定 培养结束(14 d)后,将小白菜幼苗整株取出,用无菌水充分冲洗干净根部残留的培养液,并用滤纸吸干表面水珠后,测定小白菜幼苗株高、根长及鲜重。
1.3.2 小白菜幼苗叶片叶绿素含量的测定 用丙酮法[23]测定。
1.3.3 小白菜幼苗叶片MDA、蛋白质含量和SOD活性的测定 (1)匀浆液制备:将叶片置于4 ℃、0.1 mol/L的磷酸盐缓冲液(pH=7.4)中漂洗,滤纸擦干,剪碎;准确称取0.5 g叶片,放入5 mL的匀浆管中,按重量(g)∶体积(mL)=1∶4加入4倍匀浆介质(0.1 mol/L磷酸盐缓冲液,pH=7.4);左手持匀浆管将下端插入盛有冰水混合物的器皿中,右手将捣杆垂直插入管中,上下转动研磨6~8 min,然后于3 500~4 000 r/min下离心10 min,上清液为20%的匀浆液[24]。
(2)测定方法:参照南京建成生物工程研究所相对应的生物试剂盒说明书,上清液中MDA含量采用硫代巴比妥酸法(TBA法)测定,蛋白质含量采用BCA法测定,SOD活性采用黄嘌呤氧化酶法测定。
1.3.4 小白菜幼苗铬含量的测定 培养结束后将整株小白菜幼苗植株完整取出,用自来水反复冲洗叶片表面及根部残留培养液,再用去离子水冲洗,用滤纸吸干表面水分。将小白菜幼苗地上部分与根部剪开,置于105 ℃烘箱中杀青0.5 h后,以80 ℃干燥至恒重后粉碎备用。准确称取0.2 g样品于消解管中,加入6 mL浓硝酸于通风橱中反应0.5 h后置于微波消解仪中进行消解。消解结束,取消解液进行赶酸之后转移至50 mL容量瓶用去离子水定容成样品液。样品液经0.45 μm滤膜过滤后用火焰原子吸收光谱仪(日立Z-2000)测定Cr元素的质量浓度。
试验数据采用Excel 10、Origin 9.0和SPSS 17进行统计分析和绘图,采用Duncan多重比较进行差异显著性测验。
2 结果与分析
2.1 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗生长的影响
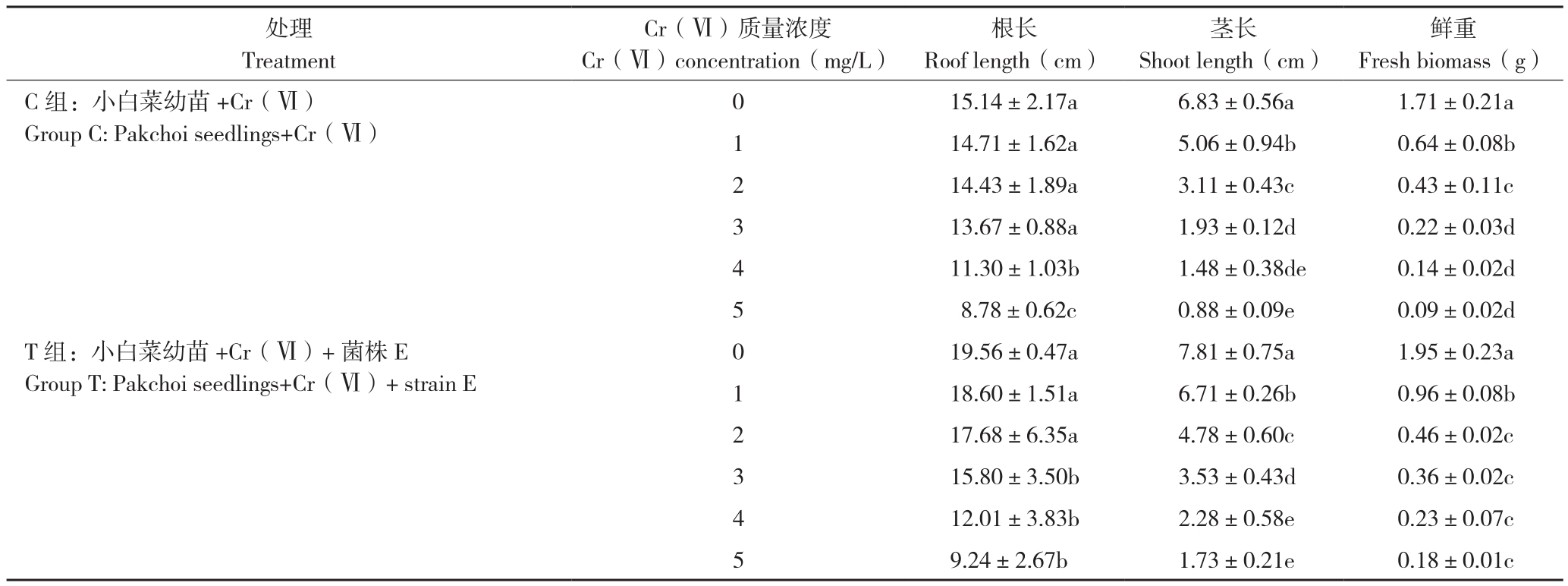
从表2可以看出,不加菌E处理(C组)随着Cr(Ⅵ)质量浓度升高,对小白菜幼苗的茎长、根长及鲜重抑制作用越显著。处理C5与C0相比,小白菜幼苗的根长和茎长分别减少42.05%和87.18%。同时,Cr(Ⅵ)质量浓度的升高对小白菜幼苗鲜重也产生了显著的抑制作用,处理C1~C5与C0相比,小白菜幼苗的鲜重分别降低62.57%、74.85%、87.13%、91.81% 和 94.73%。由图1可知,处理C0和T0的小白菜幼苗均生长良好,株高相对较高、茎叶相对粗壮、主根较长且侧根较多,根部较为粗黑;随着Cr(Ⅵ)处理质量浓度的升高,小白菜幼苗逐渐变矮,根部变短、侧根减少、根茎逐渐软黄,叶片稀少,逐渐变黄甚至全黄,叶片蜷缩甚至萎焉。
从表2还可以看出,在Cr(Ⅵ)胁迫下,添加菌E处理(T组)能显著促进小白菜幼苗根、茎、鲜重的增长。处理T1~T5与C1~C5对应相比较,小白菜幼苗茎长分别增加32.62%、53.89%、83.12%、53.93%和98.10%,根长分别增加26.46%、22.53%、15.61%、6.34%和5.32%,鲜重分别增加50.31%、7.13%、64.31%、58.77%和90.49%。在同一Cr(Ⅵ)质量浓度下,相对于C组,T组小白菜幼苗主根较长,侧根及叶片数量较多且叶片较舒展,叶片较绿(图1)。T组小白菜幼苗生长量增加的原因可能是由于添加菌株E能增强小白菜幼苗对Cr(Ⅵ)的抗逆性,从而促进其对营养成分及水分的吸收,促进生长。
表2 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗根长、茎长及鲜重的影响
Table 2 Effects of strain E on root length, shoot length and fresh biomass of Pakchoi seedlings under different concentrations of Cr (Ⅵ) stress
注:同组处理同列数据后小写英文字母不同者表示经Ducan’s检验差异显著。
Note: Different lowercase letters in the same column of same group represent significant differences by Ducan’s test.
鲜重Fresh biomass(g)C组:小白菜幼苗+Cr(Ⅵ)Group C: Pakchoi seedlings+Cr(Ⅵ)处理Treatment Cr(Ⅵ)质量浓度Cr(Ⅵ)concentration(mg/L)根长Roof length(cm)茎长Shoot length(cm)15.14±2.17a 6.83±0.56a 1.71±0.21a 1 14.71±1.62a 5.06±0.94b 0.64±0.08b 2 14.43±1.89a 3.11±0.43c 0.43±0.11c 3 13.67±0.88a 1.93±0.12d 0.22±0.03d 4 11.30±1.03b 1.48±0.38de 0.14±0.02d 5 8.78±0.62c 0.88±0.09e 0.09±0.02d T组:小白菜幼苗+Cr(Ⅵ)+菌株E Group T: Pakchoi seedlings+Cr(Ⅵ)+ strain E 0 0 19.56±0.47a 7.81±0.75a 1.95±0.23a 1 18.60±1.51a 6.71±0.26b 0.96±0.08b 2 17.68±6.35a 4.78±0.60c 0.46±0.02c 3 15.80±3.50b 3.53±0.43d 0.36±0.02c 4 12.01±3.83b 2.28±0.58e 0.23±0.07c 5 9.24±2.67b 1.73±0.21e 0.18±0.01c
2.2 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗叶绿素含量的影响
由图2可知,Cr(Ⅵ)质量浓度的增加对小白菜幼苗叶片的叶绿素含量有显著的抑制作用。在C组处理中,叶片叶绿素含量随着Cr(Ⅵ)质量浓度的升高而逐渐降低,处理C1~C5与C0相比,叶绿素含量分别降低6.42%、10.20%、16.58%、22.69%和46.30%,其中处理C3~C5与C0对比叶片黄化现象明显,甚至有叶片枯黄、萎缩(图1)。而菌株E对Cr(Ⅵ)胁迫下小白菜幼苗叶片的叶绿素含量有显著促进作用(图2)。在相同质量浓度下,与C组处理相比,T组处理小白菜幼苗叶片的叶绿素含量均有所增加,处理T0~T5相较于C0~C5,叶绿素含量增长率分别为0.64%、4.87%、0.79%、5.12%、2.74%和10.07%。
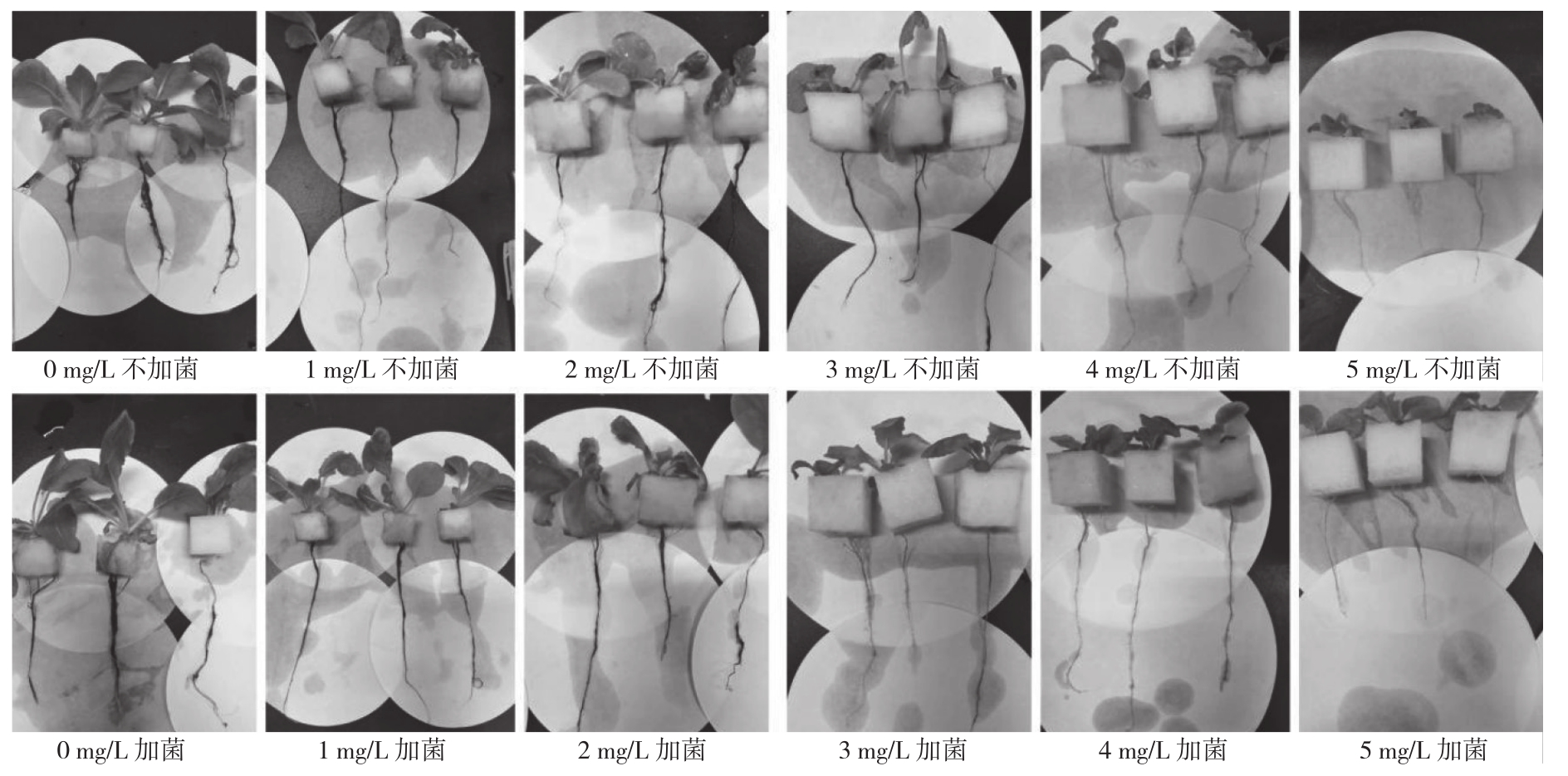
图1 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗生长的影响
Fig. 1 Effects of strain E on the growth of Pakchoi seedlings under different concentrations of Cr(Ⅵ)stress
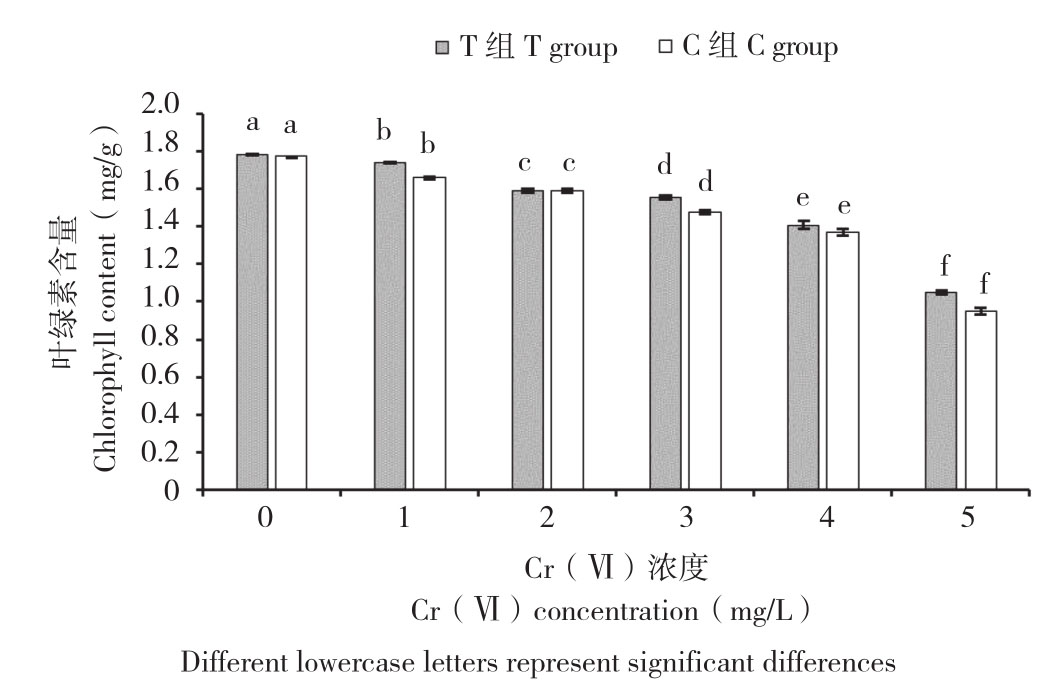
图2 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗叶绿素含量的影响
Fig. 2 Effect of strain E on chlorophyll of Pakchoi seedlings under different concentrations fo Cr(Ⅵ)stress
2.3 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗蛋白质含量的影响
由图3可知,Cr(Ⅵ)质量浓度的增加能引起小白菜幼苗叶片中蛋白质含量显著降低,不同质量浓度Cr(Ⅵ)胁迫下,处理C1~C5与C0相比,蛋白质含量分别降低17.22%、45.57%、68.35%、82.28%和88.61%。而在Cr(Ⅵ)胁迫处理下添加菌株E,能使小白菜幼苗叶片中蛋白质含量显著增加(图3)。在相同的Cr(Ⅵ)质量浓度胁迫下,处理T0~T5相较于C0~C5,小白菜幼苗叶片中的蛋白质含量分别增长5.06%、9.23%、11.63%、40.00%、14.29%和11.11%。
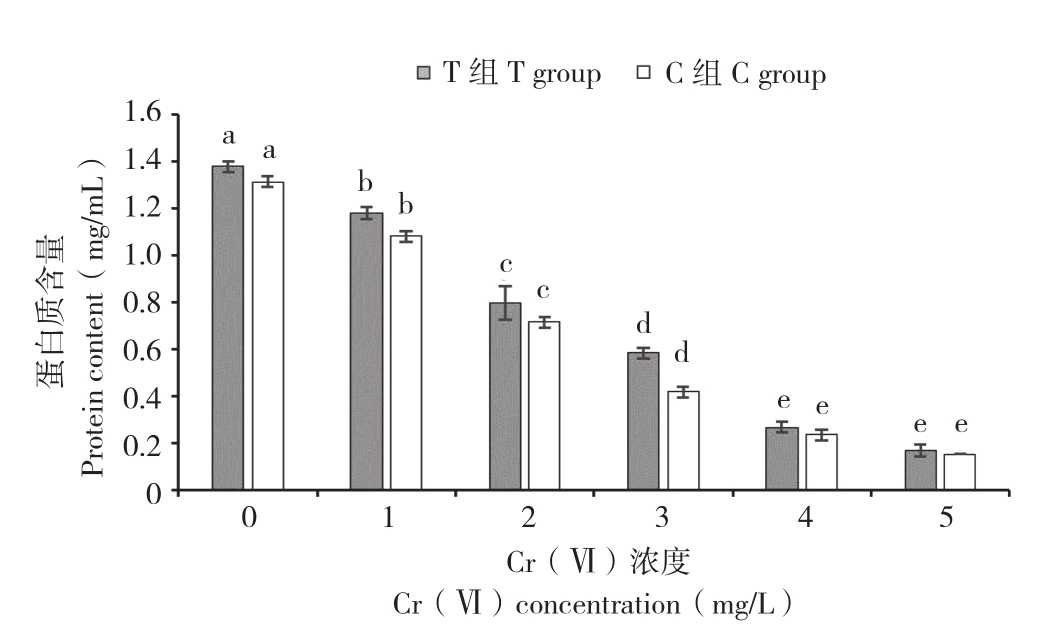
图3 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗蛋白质含量的影响
Fig. 3 Effect of strain E on protein content of Pakchoi seedlings under different concentrations Cr(Ⅵ)stress
2.4 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗超氧化物歧化酶(SOD)活性的影响
由图4可知,Cr(Ⅵ)质量浓度对小白菜幼苗叶片SOD活性有显著影响。在C组处理中,处理C1~C4小白菜幼苗叶片SOD活性随着Cr(Ⅵ)质量浓度的升高而增加,且以处理C4达到峰值;但随着Cr(Ⅵ)质量浓度的进一步升高(处理C5),SOD活性反而下降。
在相同质量浓度Cr(Ⅵ)胁迫下,处理T1~T4相较于C1~C4,SOD活性均有所降低;而处理T5相较于C5,原本降低的SOD活性有所提高,SOD活性增加11.51%。SOD活性变化的原因可能是由于加入菌株E能减轻体系中的Cr(Ⅵ)胁迫,缓解了Cr(Ⅵ)诱导的氧化应激,从而在较低质量浓度时(C1~C4)植物体无需产生大量SOD以抵制Cr(Ⅵ)的胁迫作用,SOD活性下降;而在较高质量浓度(C5)时,加入菌株E使得体系中的Cr(Ⅵ)胁迫减弱,机体抗氧化防御体系没有过度受损,可以通过增加抗氧化酶的活性来抵制Cr(Ⅵ)带来的氧化胁迫,导致SOD活性有所提高。
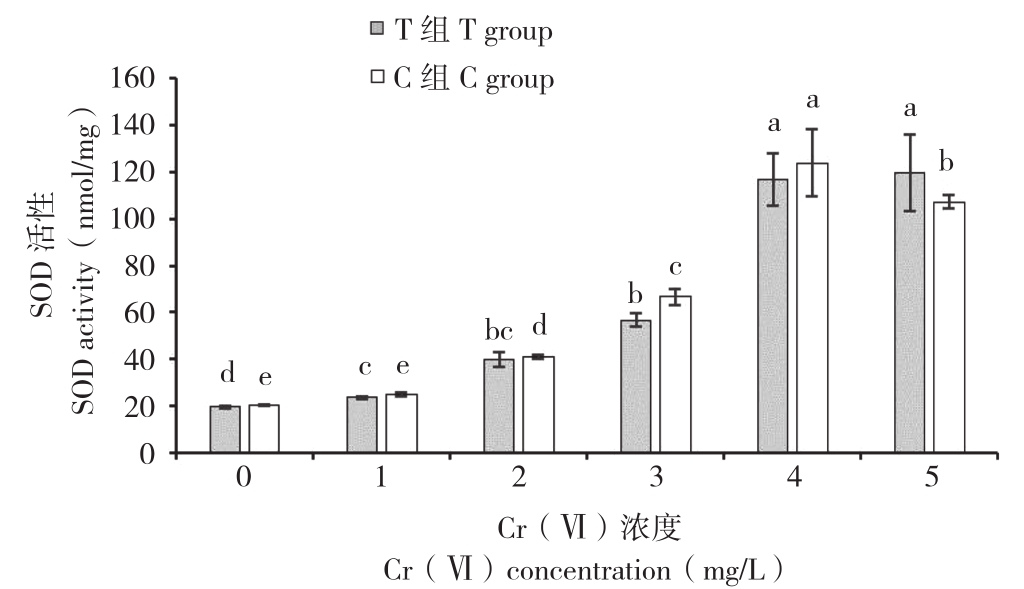
图4 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗叶片SOD活性的影响
Fig. 4 Effects of strain E on SOD activity of Pakchoi seedlings leaves under different Cr(Ⅵ)concentrations
2.5 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗丙二醛(MDA)含量的影响
由图5可知,在Cr(Ⅵ)胁迫下,小白菜幼苗MDA含量随着Cr(Ⅵ)质量浓度的升高而显著升高。在C组处理中,处理C1~C5与C0相比,小白菜幼苗MDA含量分别是C0的1.33、2.27、6.49、19.71、33.01倍,其中处理C1~C3的MDA增加幅度相对较低,而处理C4~C5的小白菜幼苗MDA含量剧增,叶片黄化早衰现象越加明显(图1)。而在添加菌株E的T组处理发现,在相同质量浓度下,处理T1~T5与C1~C5组比,小白菜幼苗MDA含量有不同程度的降低,分别降低16.09%、19.60%、17.05%、58.85%、28.19% 和11.66%,且叶片黄化早衰状况有所缓解。
2.6 菌株E对Cr(Ⅵ)胁迫下小白菜幼苗铬吸收的影响
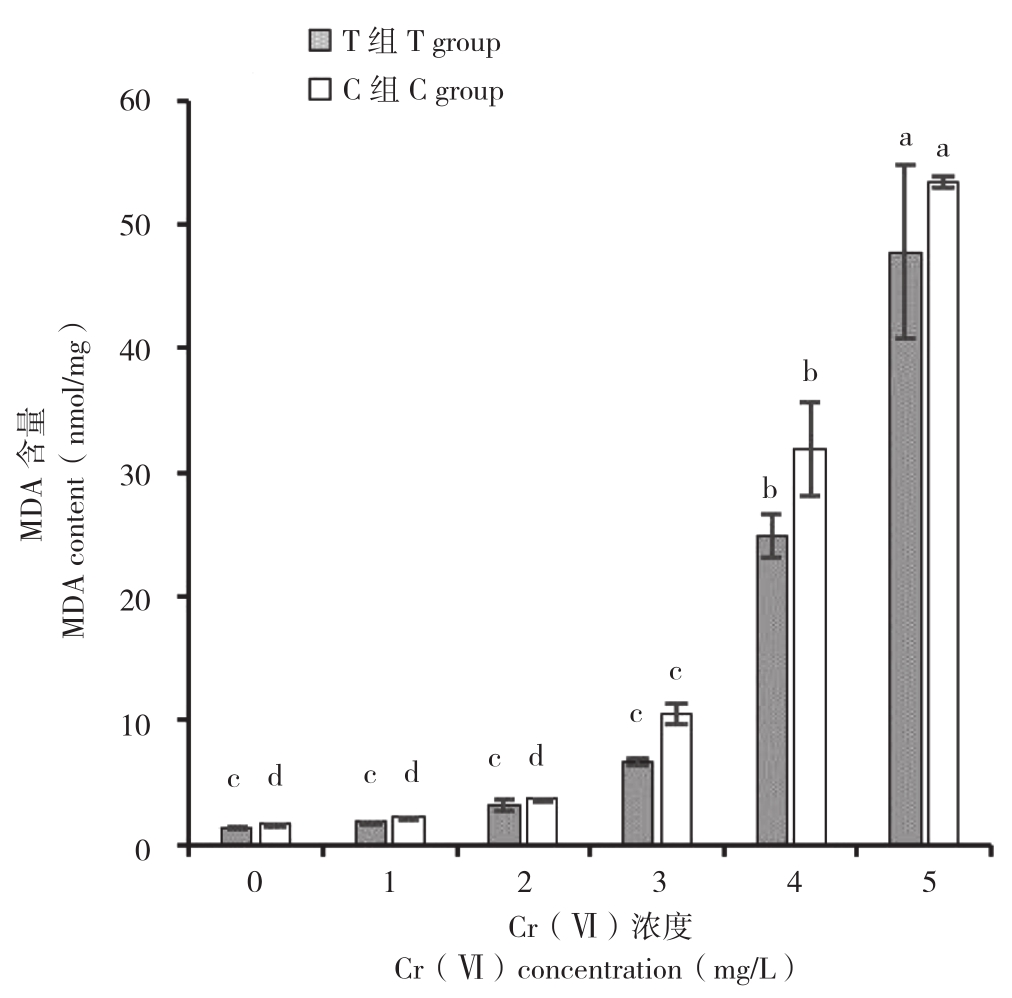
图5 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗MDA含量的影响
Fig. 5 Effects of strain E on MDA content of Pakchoi seedlings under different concentrations of Cr(Ⅵ)stress
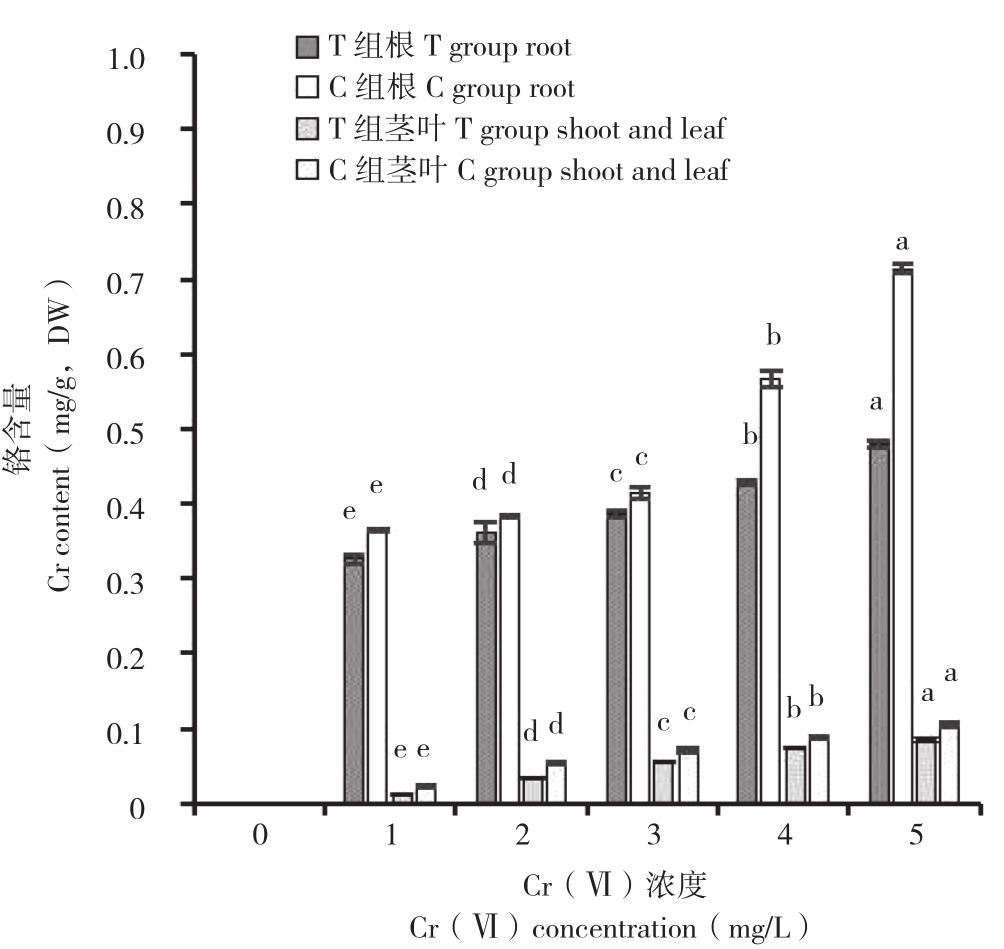
图6 菌株E对不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗铬含量的影响
Fig. 6 Effects of strain E on chromium content of Pakchoi seedlings under different concentrations of Cr(Ⅵ) stress
由图6可知,Cr(Ⅵ)质量浓度对小白菜幼苗(根、茎叶)铬含量有显著影响。在C组处理中,处理C1~C5与C0相比,小白菜幼苗铬含量随着处理液质量浓度的上升而显著增加。同一质量浓度处理(处理C1~C5)下,根部积累铬含量分别是相对应茎叶部分含量的16.76、7.25、5.80、6.47、6.80 倍,表明Cr主要积累在小白菜根部。而加入菌株E后,相同质量浓度处理下,处理T1~T5与C1~C5相比,小白菜幼苗根部铬含量分别降低10.67%、5.55%、6.83%、24.44%和32.80%,茎叶部分铬含量分别降低37.98%、34.76%、23.14%、14.44%和18.60%。
3 讨论
株高、根长、鲜重是衡量植物生长的重要指标。通过测量在不同质量浓度Cr(Ⅵ)胁迫下小白菜幼苗茎长、根长及鲜重变化,可以较直观地观察到接种菌株前后Cr(Ⅵ)对小白菜幼苗生长的毒性效应。本试验中,不加菌E处理(C组)随着Cr(Ⅵ)质量浓度升高,对小白菜幼苗的茎长、根长及鲜重抑制作用越显著。Shanker等[25]、Shaikh等[26]研究表明,Cr(Ⅵ)能引起根细胞表面破裂,阻止根细胞分裂和伸长,从而使植物对水分和必要营养元素的吸收减少,导致根、茎长度衰减。植物鲜重的减少可能与Cr(Ⅵ)胁迫下,作物生长时营养物质吸收和迁移间失衡、植物选择性无机营养吸收效率低下、或对必需元素的吸收减少导致的代谢活动紊乱等原因有关[25,27-28]。一定质量浓度的重金属Cr(Ⅵ)能引起植物毒性,导致植物生长发育迟缓、生物量减少、黄化、光合作用受损,甚至引起植物死亡[29-30]。而加菌株E处理的小白菜幼苗生长量比对照有所增加,表明菌株E能在一定程度上缓解Cr(Ⅵ)对小白菜幼苗生长的毒性作用。
本试验中,Cr(Ⅵ)对小白菜幼苗叶片的叶绿素含量有显著的抑制作用,叶片叶绿素含量随着Cr(Ⅵ)质量浓度的升高而逐渐降低;而添加菌株E对Cr(Ⅵ)胁迫下小白菜幼苗叶片的叶绿素含量有显著促进作用。叶绿素含量的降低可能是由于Cr(Ⅵ)可以与许多酶活性位点上的镁离子竞争,使叶绿体的超微结构发生改变,从而抑制了叶片的光合作用并引起植物的缺绿病[31]。研究表明,Cr(Ⅵ)对叶片光合作用中CO2固定、电子传递、光磷酸化或卡尔文循环酶等相关酶活性存在抑制作用[32-33]。而菌株E本身具有的还原性能将体系中的Cr(Ⅵ)大量还原,从而提高小白菜幼苗中相关酶的活性,使叶绿素总量得到增加。
本试验中,Cr(Ⅵ)质量浓度的增加导致小白菜幼苗叶片的蛋白质含量显著降低,而添加菌株E后小白菜幼苗叶片中蛋白质含量显著增加。研究表明,Cr(Ⅵ)能抑制硝酸还原酶(NR)的活性,进而导致机体的氮代谢出现紊乱,造成作为蛋白质组成部分的氨基酸合成量减少,最终导致植物叶片蛋白质含量下降[26];Cr(Ⅵ)对植物相关蛋白质合成酶活性具有抑制作用,而Cr(Ⅵ)还原菌(菌E)能对这种抑制作用进行缓解[34]。这与本试验结果相似。
研究表明,在过量重金属Cr(Ⅵ)胁迫下,植物会产生大量活性氧(ROS)[12]。由于过量ROS能与脂类、蛋白质、酶和DNA相互作用,导致细胞膜渗漏和酶失活,从而引起植物体多种生化和生理障碍[35]。而植物体由于缺乏逃避环境压力的能力,会采取一系列的防御机制来抵制ROS带来的氧化应激[36]。SOD的诱导就是植物体内主要的重金属解毒机制之一[37]。因此,通过测定植物叶片中SOD活性,可以间接反映植物机体内清除氧自由基的能力。本试验中,处理C1~C4小白菜幼苗叶片SOD活性随着Cr(Ⅵ)质量浓度的升高而增加,但随着Cr(Ⅵ)质量浓度的进一步升高(处理C5),SOD活性反而下降,其原因可能是由于植物体内SOD活性的增加不足以抵抗Cr(Ⅵ)带来的氧化胁迫,导致机体抗氧化防御体系过度受损[38]。而加入菌株E后,SOD活性随着Cr(Ⅵ)质量浓度的升高呈现先降后升的趋势,其原因可能是由于加入菌株E能减轻体系中的Cr(Ⅵ)胁迫,缓解了Cr(Ⅵ)诱导的氧化应激,从而在较低质量浓度(处理C1~C4)时植物体无需产生大量的SOD以抵御Cr(Ⅵ)的胁迫作用,SOD活性下降;而在较高质量浓度(处理C5)时,加入菌株E使得体系中的Cr(Ⅵ)胁迫减弱,机体抗氧化防御体系没有过度受损,可通过增加抗氧化酶的活性抵御Cr(Ⅵ)带来的氧化胁迫,从而SOD活性有所提高。此前有研究发现,在Cr(Ⅵ)胁迫下向培养体系中接种具有铬还原菌能力的菌株MAI3,能使大豆的氧化应激相应降低[39]。这与本试验结果相一致。
脂质过氧化是氧化应激的生物指标[40]。丙二醛(MDA)是脂质过氧化的产物之一[23],能够反映植物细胞内自由基产生和清除之间是否失衡,而此失衡的现象可能会导致蛋白质和生物大分子的降解,随后增加细胞膜脂质过氧化,引起细胞损伤[41]。因此,植物中MDA含量可以反映机体内脂质过氧化程度,从而间接反映Cr(Ⅵ)对细胞损伤的程度。本试验中,在Cr(Ⅵ)胁迫下,小白菜幼苗叶片MDA含量随着Cr(Ⅵ)质量浓度的升高而显著升高,其中处理C1~C3的MDA增加幅度相对较低,表明植物可能通过将重金属转入到液泡中进行隔离,或通过转运蛋白调节金属摄入以及强化抗氧化机制来抵抗环境中过量的重金属,因此细胞损伤程度并没有太高[42];而处理C4~C5的小白菜幼苗叶片MDA含量剧增,叶片黄化早衰现象越加明显,表明在Cr(Ⅵ)胁迫诱导下,小白菜幼苗的膜脂质化程度较高,已经对细胞质膜产生了较为严重的损伤。而加入菌株E后,体系中Cr(Ⅵ)胁迫降低,缓解了氧化应激诱导的细胞膜脂氧化,从而导致MDA含量下降,与SOD活性的变化相对应。
有相关报道,棉花、水稻和豌豆等农作物及药用植物,根部Cr的积累量也较茎叶部多[43-44]。在所有重金属元素中,Cr在植物根部是最不具流动性的元素[45]。根细胞能将重金属离子吸附在负极细胞表面或者液泡内,因此Cr在根部细胞积累且不易向茎部转移,这可能是植物一种天然的抵御重金属毒性作用的耐受机制[28,46],这与本研究结果相一致。还有研究表明,植物体内Cr的运输可能依赖于其价态,其中Cr(III)的运输表现为消耗能量的被动运输[25],Cr(Ⅵ)的运输表现为无需能量的主动运输[9-10]。而在体系中加入Cr(Ⅵ)还原菌后能使培养体系中Cr(Ⅵ)含量降低,从而使植物体内Cr的积累量减少,降低植物对Cr(Ⅵ)的可利用度[34,47]。因此,小白菜幼苗中Cr积累量降低的原因可能是加入菌株E使得体系中Cr(Ⅵ)质量浓度下降,降低了小白菜幼苗对Cr的可利用度。
4 结论
本研究结果表明,随着Cr(Ⅵ)质量浓度的升高,Cr(Ⅵ)对小白菜幼苗生长的抑制作用越显著。Cr(Ⅵ)对幼苗的生理生化毒性主要包括抑制生长发育、抑制叶绿素以及蛋白质的合成,并且诱导细胞的氧化应激,造成细胞损伤。
具有Cr(Ⅵ)还原能力的菌株E可以在一定程度上缓解Cr(Ⅵ)对小白菜幼苗的植物毒性和氧化应激效应。菌株E可以通过增强小白菜幼苗对Cr(Ⅵ)的抗逆性,增加其对水分及必要营养成分的吸收,从而促进小白菜幼苗的生长。通过降低Cr(Ⅵ)对叶片光合作用相关酶活性及相关蛋白质合成酶的抑制作用,提高叶绿素及蛋白质合成量。在高质量浓度的胁迫条件下(>4 mg/L),菌株E能够通过促进植物细胞的SOD活性并且降低叶片细胞中的MDA含量,从而缓解Cr(Ⅵ)诱导的氧化胁迫,减少细胞损伤。
Cr在小白菜幼苗中根、茎叶中的含量,随着Cr(Ⅵ)的质量浓度升高而增加。根部对Cr元素的富集显著高于上半部分(茎叶)。Cr主要积累在小白菜根部,且不容易向茎叶部分转移。添加菌株E可以在一定程度上降低小白菜幼苗对Cr(Ⅵ)的可利用度。
[1] MA H W, HUNG M L, CHEN P C. A systemic health risk assessment for the chromium cycle in Taiwan[J]. Environment International,2007, 33(2): 206-218. doi: 10.1016/j.envint.2006.09.011.
[2] 张亚莉,杨杰文. 零价铁粉对水稻土总六价铬的还原作用及其影响因素研究[J]. 广东农业科学,2019, 46(4): 51-57. doi: 10.16768/j.issn.1004-874X.2019.04.008.ZHANG Y L, YANG J W. Study on the reduction effect of zerovalent iron on Cr(Ⅵ)in paddy soil and its influencing factors[J].Guangdong Agricultural Sciences, 2019, 46(4): 51-57. doi:10.16768/j.issn.1004-874X.2019.04.008.
[3] 于修乐,马义兵,孙宗全,李合莲,李士伟,韩雪梅. 土壤中Cr(Ⅵ)和Cr(Ⅲ)生态毒性的差异性研究[J]. 农业环境科学学报,2018,37(11): 2522-2531.doi:10.11654/jaes.2018-0946.YU X Y, MA Y B, SUN Z Q, LI H L, LI S W, HAN X M. Study on ecotoxicity differences of Cr(Ⅵ)and Cr(III)in soil[J]. Journal of Agro-Environment Science, 2018, 37(11): 2522-2531.doi:10.11654/jaes.2018-0946.
[4] GUO L L, CHAO X, LI S P, YANG Y W, LI S. Biochemical reducing stabilization of soil contamination by chrome(Ⅵ)[J]. Environmental Engineering, 2014, 32: 152-156.
[5] ANAM A, IRSHAD B B, NABEEL K N, YONG S O, GHULAM M,MUHAMMAD S, ANITHA K, DONG W L, TARIQ M. Chromium(Ⅵ)sorption efficiency of acid-activated banana peel over organo-montmorillonite in aqueous solutions[J]. International Journal of Phytoremediation, 2017,19(7): 605-613. doi: 10.1080/15226514.2016.1256372.
[6] REALE L, FERRANTI F, MANTILACCI S, CORBOLI M,AVERSA S, LANDUCCI F, BALDISSEROTTO C, FERRONI L,PANCALDI S, VENANZONI R. Cyto-histological and morphophysiological responses of common duckweed(Lemna minor L.)to chromium[J]. Chemosphere, 2016, 145: 98-105. doi: 10.1016/j.chemosphere.2015.11.047.
[7] ANTONIADIS V, ZANNI A A, LEVIZOU E, SHAHEEN S M,DIMIRKOU A, BOLAN N, RINKLEBE J. Modulation of hexavalent chromium toxicity on Οriganum vulgare in an acidic soil amended with peat, lime, and zeolite[J]. Chemosphere, 2018, 195: 291-300. doi:10.1016/j.chemosphere.2017.12.069.
[8] JOBBY R, JHA P, YADAV A K, DESAI N. Biosorption and biotransformation of hexavalent chromium[Cr(Ⅵ)]: a comprehensive review[J]. Chemosphere, 2018, 207: 255-266. doi: 10.1016/j.chemosphere.2018.05.05.
[9] DE OLIVEIRA L M, MA L Q, SANTOS J A G, GUILHERME L R G, LESSL J T. Effects of arsenate, chromate, and sulfate on arsenic and chromium uptake and translocation by arsenic hyperaccumulator Pteris vittata L[J]. Environment Pollution, 2014, 184: 187-192. doi:10.1016/j.envpol.2013.08.025.
[10] DE SOUZA F B, DE LIMA B, HACKBARTH F V, DE SOUZA A A U,BOAVENTURA R A R, DE SOUZA S M A G U, VILAR V J P. Marine macro-alga Sargassum cymosum as electron donor for hexavalent chromium reduction to trivalent state in aqueous solutions[J].Chemical Engineering Journal, 2016, 283: 903-910. doi: 10.1016/j.cej.2015.08.038.
[11] ELEFTHERIOU E P, ADAMAKIS I D S, PANTERIS E, FATSIOU M.Chromiuminduced ultrastructural changes and oxidative stress in roots of Arabidopsis thaliana[J]. International Journal of Molecular Sciences, 2015, 16(7): 15852-15871. doi: 10.3390/ijms160715852.
[12] GILL R A, ALI B, ISLAM F, FAROOQ M A, GILL M B, MWAMBA T M,ZHOU W J. Physiological and molecular analyses of black and yellow seeded Brassica napus regulated by 5-aminolivulinic acid under chromium stress[J]. Plant Physiology and Biochemisty, 2015, 94:130-143. doi: 10.1016/j.plaphy.2015.06.001.
[13] ISLAM M K, KHANAM S, LEE S Y. The interaction of arsenic(As)and chromium(Cr)influences growth and antioxidant status in tossa jute(Corchorus olitorius)[J]. Plant Omics, 2014, 7(6): 499-509.
[14] FAROOQ M, ALI S, HAMEED A, BHARWANA S A, RIZWAN M,ISHAQUE W, FARID M, MAHMOOD K, IQBAL Z. Cadmium stress in cotton seedlings: physiological, photosynthesis and oxidative damages alleviated by glycinebetaine[J]. South African Journal of Botany,2016, 104: 61-68. doi: 10.1016/j.sajb.2015.11.006.
[15] SHAHID M, KHALID S, ABBAS G, SHAHID N, NADEEM M, SABIR M, ASLAM M, DUMAT C. Heavy metal stress and crop productivity[J].Crop Production and Global Environmental Issues, 2015,1:1-25. doi:10.1007/978-3-319-23162-4_1.
[16] UDDIN I, BANO A, MASOOD S. Chromium toxicity tolerance of Solanum nigrum L. and Parthenium hysterophorus L. plants with reference to ion pattern, antioxidation activity and root exudation[J].Ecotoxicology and Environmental Safety, 2015, 113: 271-278. doi:10.1016/j.ecoenv.2014.12.014.
[17] ALI S, CHAUDHARY A, RIZWAN M, ANWAR H T, ADREES M,FARID M, IRSHAD M K, HAYAT T, ANJUM S A. Alleviation of chromium toxicity by glycinebetaine is related to elevated antioxidant enzymes and suppressed chromium uptake and oxidative stress in wheat(Triticum aestivum L.)[J]. Environmental Science and Pollution Research, 2015, 22(14): 10669-10678. doi: 10.1007/s11356-015-4193-4.
[18] 樊霆, 叶文玲, 陈海燕, 鲁洪娟, 张颖慧, 李定心, 唐子阳, 马友华. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报,2013, 22(10): 1727-1736. doi: 10.3969/j.issn.1674-5906.2013.10.015.FAN T, YE W L, CHEN H Y,LU H J, ZHANG Y H, LI D X, TANG Z Y,MA Y H. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environment Sciences,2013, 22(10): 1727-1736. doi: 10.3969/j.issn.1674-5906.2013.10.015.
[19] QU M M, XU Y B, CHEN J M, HUANG Q Q, CHEN J L .Bioremediation of hexavalent chromium contaminated soil by a bioleaching system with weak magnetic fields[J]. International Biodeterioration & Biodegradation, 2016, 128: 1-7. doi: 10.1016/j.ibiod.2016.08.022.
[20] SRIVASTAVA S, THAKUR E S. Biosorption and biotransformation of chromium by Serratia sp. isolated from tannery effluent[J].Environmental Technology, 2012, 33(1): 113-22.
[21] VALERIE D, REMY B, PHILIPPE L, GOURDON R. Utilisation of supernatants of pure cultures of Streptomyces thermocarboxydus NH50 to reduce chromium toxicity and mobility in contaminated soils[J]. Water, Air, and Soil Pollution, 2003, 3(3): 156-160. doi:10.1023/a:1023965314747.
[22] JEYASINGH J, PHILIP L. Bioremediation of chromium contaminated soil: optimization of operating parameters under laboratory conditions[J]. J Hazard Mater, 2005, 118(1-3): 113-20. doi: 10.1016/j.jhazmat.2004.10.003.
[23] 苏正淑, 张宪政. 几种测定植物叶绿素的方法比较[J]. 植物生理学通讯 , 1989(5): 77-78.SHU Z S, ZHANG X Z. Comparison of several methods for determination of chlorophyll in plants[J]. Plant Physiology Communications, 1989(5): 77-78.
[24] 季 建平. 实 验 方 法 学[EB/OL]. http://www.njjcbio.com/contents.asp?title=实验方法学&wid=2&id=507.(2014-02-07),2019-06-18.JI J P. Experimental Methodology[EB/OL]. http://www.njjcbio.com/contents.asp?title=实 验 方 法 学&wid=2&id=507.(2014.02-07),2019-06-18.
[25] SHANKER A K, CERVANTES C, LOZA-TAVERA H,SUBRAMANIAN A. Chromium toxicity in plants[J].Environmental International, 2005, 31(5): 739-753. doi: 10.1016/j.envint.2005.02.003.
[26] SHAIKH I R, RAFIQUE A S , SHAIKH A A. Phytotoxic effects of heavy metals(Cr, Cd, Mn and Zn)on wheat(Triticum aestivum L.)seed germination and seedlings growth in black cotton soil of Nanded India[J]. Journal of Chemical Science, 2013, 3: 14-23.
[27] CERVANTES C, CAMPOS-GARCÍA J, DEVARS S, GORONA G F, TAVERA L H, GUZMAN J C T, SANCHEZ R M. Interactions of chromium with microorganisms and plants[J]. FEMS Microbiology Review, 2001, 25(3): 335-347. doi: 10.1111/j.1574-6976.2001.tb00581.x.
[28] SINGH H P, MAHAJAN P, KAUR S, BATISH D. Chromium toxicity and tolerance in plants[J]. Environmental Chemistry Letters, 2013,11(3): 229-254. doi: 10.1007/s10311-013-0407-5.
[29] SHARMA D, SHARMA C. Chromium uptake and toxicity effects on growth and metabolic activities in wheat, Triticum aestivum L[J].Indian Journal of Experimental Biology, 2003, 34(4): 689-691.
[30] VERNAY P, GAUTHIER M C, JEAN L, BORDAS F, FAURE O,LEDOIGT G, HITMI A. Effect of chromium species on phytochemical and physiological parameters in Datura innoxia[J]. Chemosphere,2008, 72(5): 763-771. doi: 10.1016/j.chemosphere.2008.03.018.
[31] 龚林. 铬胁迫对植物的毒害和抗胁迫机制的概览[J]. 科技致富向导,2014(26): 26-39. doi: 10.3969/j.issn.1007-1547.2014.18.037.GONG L. An overview of the toxicity and anti-stress mechanism of chromium stress on plants[J]. Guide of Sci-tech Magazine, 2014, 26:26-39. doi: 10.3969/j.issn.1007-1547.2014.18.037.
[32] LIU D, ZOU J, WANG M, JIANG W S. Hexavalent chromium uptake and its effects on mineral uptake, antioxidant defence system and photosynthesis in Amaranthus viridis L[J]. Bioresource Technology,2008, 99(7): 2628-2636. doi: 10.1016/j.biortech.2007.04.045.
[33] DIXIT V, PANDEY V, SHYAM R. Chromium ions inactivate electron transport and enhance superoxide generation in vivo in pea(Pisum sativum L. cv. Azad)root mitochondria[J]. Plant Cell Environmental,2002, 25(5): 687-693. doi: 10.1046/j.1365-3040.2002.00843.x.
[34] MARYEM A, KHAN A H A, UZ ZAMAN B, ANEES M, SOJA G,LINDE C, YOUSAF S. The reduction of chromium(Ⅵ)phytotoxicity and phytoavailability to wheat(Triticum aestivum L.)using biochar and bacteria[J]. Applied Soil Ecology, 2017, 114: 90-98. doi:10.1016/j.apsoil.2017.02.021.
[35] POURRUT B, SHAHID M, DOUAY F, DUMAT C, PINELLI E. Molecular mechanisms involved in lead uptake, toxicity and detoxification in higher plants[J]. Heavy Metal Stress in Plant, 2013,121-147. doi: 10.1007/978-3-642-38469-1_7.
[36] SHAHID M, FERRAND E, SCHRECK E, DUMAT C. Behavior and impact of zirconium in the soileplant system: Plant uptake and phytotoxicity[J]. Reviews of Environmental Contamination and Toxicology, 2013, 221: 107-127. doi: 10.1007/978-1-4614-4448-0_2.
[37] MAITI S, GHOSH N, MANDAL C, DAS K, DEY N, ADAK M K.Responses of the maize plant to chromium stress with reference to antioxidation activity[J]. Brazilian Society of Plant Physiology,2012, 24(3): 203-212. doi: 10.1590/S1677-04202012000300007.
[38] SHAHID M, SABIR M, ALI M A, GHAFOOR A. Effect of organic amendments on phytoavailability of nickel and growth of berseem(Trifolium alexandrinum)under nickel contaminated soil conditions[J]. Chemical Speciation & Bioavailablity, 2014, 26(1): 37-42.doi: 10.3184/095422914X13886890590610.
[39] WANI P A, WANIA S, SINGH R, KEHINDE A M. Antioxidant and chromium reductase assisted chromium(Ⅵ)reduction and Cr(Ⅲ)immobilization by the rhizospheric Bacillus helps in the remediationof Cr(Ⅵ)and growth promotion of soybean crop[J]. Rhizosphere, 2018,6: 23-30. doi: 10.1016/j.rhisph.2018.01.004.
[40] SHAHID M, DUMAT C, SILVESTRE J, PINELLI E. Effect of fulvic acids on leadinduced oxidative stress to metal sensitive Vicia faba L plant[J]. Biology and Fertility Soils, 2012, 48(6): 689-697. doi:10.1007/s00374-012-0662-9.
[41] SYTAR O, KUMAR A, LATOWSKI D, KUCZYNSKA P, STRALKA K, PRASAD M N V. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanismsin in plants[J]. Acta Physioloiae Plantarum, 2013, 35(4): 985-999. doi: 10.1007/s11738-012-1169-6.
[42] 乔维川, 罗杨, 徐立杰, 余顺慧. 不同钾水平对延胡索幼苗的生理特征和铬吸收影响[J]. 生态环境学报, 2018, 27(4): 761-768. doi:10.16258/j.cnki.1674-5906.2018.04.023.QIAO W C, LUO Y, XU L J, YU S H. Effects of different potassium levels on physiological characteristics and Cr absorption of Corydalis yanhusuo seedlings[J]. Ecology and Environment Sciences, 2018,27(4): 761-768. doi: 10.16258/j.cnki.1674-5906.2018.04.023.
[43] DAUD M K, MEI L, VARIATH M T, ALI S, LI C, RAFIQ M T, ZHU S J.Chromium(Ⅵ)uptake and tolerance potential in cotton cultivars: effect on their root physiology, ultramorphology, and oxidative metabolism[J]. BioMed Research Internation, 2014, 2014: 1-12. doi: 10.1155/2014/975946.
[44] LUKINA A, BOUTIN C, ROWLAND O, CARPANTER D J.Evaluating trivalent chromium toxicity on wild terrestrial and wetland plants[J]. Chemosphere, 2016, 162: 355-364. doi: 10.1016/j.chemosphere.2016.07.055.
[45] SHUKLA O P, DUBEY S, RAI U N. Preferential accumulation of cadmium andchromium: toxicity in Bacopa monnieri L. under mixed metal treatments[J]. Bulletin Environmental Contamination Toxicology, 2007, 78(3-4): 252-257. doi: 10.1007/s00128-007-9155-1.
[46] SHANKER A K, DJANAGUIRAMAN M, SUDHAGAR R,CHANDRASHEKAR C N, PATHMANABHAN G. Differential antioxidative response of ascorbateglutathione pathway enzymes and metabolites to chromium speciation stressin green gram(Vigna radiata(L.)R. Wilczek. cv CO 4)roots[J]. Plant Science, 2004, 166(4):1035-1043. doi: 10.1016/j.plantsci.2003.12.015.
[47] MAQSOOD M, ASGHAR H N, SHAHCAD T, HUSSAIN S, RIAZ M,ALI S ARIF M S, MAQSOOD M. Isolating, screening and applying chromium reducing bacteria to promote growth and yield of okra(Hibiscus esculentus L.)in chromium contaminated soils[J].Ecotoxicology and Environmental Safety, 2015, 114: 343-349.