【研究意义】草胺磷(glufosinate ammonium,GA)属膦酸类除草剂,是谷氨酰胺合成抑制剂,具有杀草谱广、低毒、活性高、部分传导性和环境相容性好等特点,常用于果园、葡萄园、非耕地防除双子叶及禾本科杂草。在大田里,草胺磷降解迅速,半衰期为2.30~2.93 d,衍生物为3-甲基膦-丙酸(MPP)和2-甲基膦-乙酸(MPA)[1] ,这一过程与温度密切相关。草胺磷的转基因作物有马铃薯[2]、水稻[3]、棉花[4]、小麦[5]、烟草[6]等,使草胺磷拥有巨大的潜在商业市场。但除草剂的广泛使用对土壤及整个生态系统影响深远,科学合理使用草胺磷,需要从整个环境全面考虑,评估其在生态环境中的安全性。
【前人研究进展】据研究报道,施用草胺磷的麦田土壤微生物中,细菌和放线菌数量随着草胺磷浓度的增加呈先增加后减少趋势[7]。在高温高湿的热带,草胺磷对土壤细菌和放线菌种群的生长表现为低剂量促进、高浓度抑制;对土壤真菌种群的生长表现为抑制作用[8]。葡萄园用草胺磷除草剂比机械除草平均减少了53%的葡萄根菌根化,但是土壤中蚯蚓或凋落物分解不受除草剂影响[9]。小鼠在出生前后暴露于低剂量草胺磷可诱发自闭症样表型[10],小鼠围产期暴露于草胺磷会通过破坏细胞骨架而影响神经发生和神经母细胞迁移[11]。王彦华等[12]研究了22种常用除草剂对蚯蚓的急性毒性,其中草胺磷染毒24 h的LC50值大于1 258 μg/cm2,将其归入微毒级。关于草胺磷对环境中动物的影响研究报道并不多。
【本研究切入点】蚯蚓是土壤生态系统中最重要的一类无脊椎动物,是土壤生态毒理学最常用的实验材料,用于重金属污染[14]、油类污染[15]及农药污染[16]等生态毒理学相关研究,以及污泥处理、土壤重金属积累[17]等生物修复探索。然而草胺磷在亚急性毒性下对蚯蚓的细胞毒性研究还未见报道。单细胞凝胶电泳(single cell gel electrophoresis, SCGE)又名彗星电泳,可用于检测各种理化因子作用于细胞后引起的DNA链断裂,并在统计学基础上评估损伤程度[13],是一种快速、灵敏、可靠的定量DNA损伤及修复的方法,被广泛应用于医学、生物学、毒理学和环境生物监测等领域。【拟解决的关键问题】本研究采用彗星电泳技术,研究不同浓度草胺磷胁迫蚯蚓24 h和96 h后,蚯蚓体腔细胞DNA损伤程度,揭示草胺磷对土壤动物蚯蚓的影响。
1 材料与方法
1.1 试验材料
供试赤子爱胜蚓(Eisenia fetida)购自河北石家庄晋州市蚯蚓养殖场。在室内预养约2~4周,挑选体重为400~500 mg、大小较一致的健康蚯蚓进行试验。
供试草胺磷乳液(浓度200 g/L),由山东润扬化学有限公司生产;正常熔点琼脂糖(NMA,西班牙)、低熔点琼脂糖(LMA)、Triton X-100、肌氨酸钠、DMSO,上述试剂均为Amresco分装产品;自制蚯蚓体腔细胞提取液(EM,含5%乙醇、95%生理盐水、2.5 mg/mL Na2EDTA、10 mg/mL 愈疮木酚甘油醚,pH7.3)、裂解液( 含2.5 mol/L NaCl、0.1 mol/L EDTA、0.01 mol/LTris、1%肌氨酸钠、1% Triton X-100、10%DMSO,pH 10)、电泳缓冲液( 含0.3 mol/L NaOH、1 mmol/L EDTA,pH>13)。试验仪器有倒置荧光显微镜(DMI 3000,德国Leica 公司)、电泳仪(Tanon EPS 300,上海天能科技有限公司)、电泳槽(DYCP-33A,北京六一生物科技有限公司)。
1.2 试验方法
1.2.1 试验设计 经过预试验后,设置胁迫24 h和96 h的草胺磷浓度梯度分别为0、37.5、75、150、300 mg/L 和 0、18.75、37.5、75 mg/L,每个浓度处理3次重复。
将蚯蚓在25℃、湿度65%、暗环境下清肠24 h。用去离子水将供试农药按试验设计浓度稀释,同时用去离子水作为空白对照。分别将不同浓度的草胺磷加入垫有滤纸的培养皿中。将清肠后的蚯蚓洗净,用滤纸吸干水分。在每一个浓度梯度中放入5条蚯蚓,盖上培养皿盖子,用封口膜封口,留1 cm长的缝隙做通气孔。将培养皿置于室温25℃、湿度65%的环境中黑暗培养。胁迫时间为96 h的蚯蚓需要每天重新更换相同浓度的草胺磷溶液,以消除蚯蚓自身代谢产物的影响。分别于胁迫24 h和96 h后,提取蚯蚓体腔细胞,用于彗星电泳。
1.2.2 蚯蚓体腔细胞的提取 根据Eyambe等[18]的方法稍改动后提取蚯蚓体腔细胞。胁迫结束后,将不同浓度草胺磷处理的蚯蚓随机选取2条,剪取其身体中后部约2 cm长的躯干,移入2 mL离心管中,加入400 μL 4℃的体腔细胞提取液;1 min后,再加入1.5 mL 4℃磷酸盐缓冲液(PBS),弃沙蚕,得到体腔细胞。于800~1 000 r/min下离心3 min,弃上清,两管合为一管,重新加入1 mL PBS。显微镜下观察细胞活力,调整细胞密度,准备电泳。
1.2.3 彗星电泳 按Zhang等[19]改良方法进行彗星电泳。将细胞悬液和1%低熔点胶按1∶1体积混合均匀,铺在预处理后的载玻片上,4℃放置5 min,使琼脂糖凝固。将铺好胶的载玻片放入新鲜配制的裂解液中裂解90 min。蒸馏水冲洗后,将载玻片放入电泳缓冲液中,变性解旋20 min,电泳20 min(26 V,300 mA)。用400 mmol/L Tris缓冲液(pH 7.5)中和3次,每次中和5 min,从裂解到中和的所有过程需在4℃下进行。将载玻片置于20 μg/mL EB中染色20 min后,于荧光显微镜下观察拍照。
1.3 数据处理
从每个浓度草胺磷处理随机取大约50个细胞,用CASP软件进行分析,可得到多项反应DNA损伤程度的参数。本试验选用头部DNA含量(HDNA%)、尾部DNA含量(TDNA%)、尾长(TailLength,TL)、尾矩(TailMoment,TM)和Olive尾矩(Olive TailMoment,OTM)5个最常用的参数作为DNA损伤程度的评价指标。采用Spss13.0 对数据进行单因素方差分析(ANOVA)和Dunnett多重比较,对各浓度处理与对照之间进行差异显著性分析,显著性以3个水平表示,分别为P<0.05、P<0.01和P<0.001。
2 结果与分析
2.1 草胺磷胁迫24 h对蚯蚓体腔细胞DNA的影响
由表1可知,与空白对照比较,37.5、75、150、300 mg/L草胺磷胁迫处理24 h蚯蚓的TDNA%、HDNA%、TL、TM和OTM值都有显著差异(P<0.05),其中TDNA%、TL、TM、OTM随草胺磷浓度升高而提高,HDNA%随草胺磷浓度升高而降低,且草胺磷浓度越高,差异越显著。两个低浓度(37.5、75 mg/L)处理间各参数值变化未达到显著水平,但与高浓度(150、300 mg/L)处理相比,差异均达到显著水平(P<0.05)。草胺磷质量浓度最高达300 mg/L时,与空白对照比较,TDNA%提高了2.8倍(P<0.001)、TL提高了2.2倍(P<0.01)、TM提高了5倍(P<0.001)、OTM提高了3.6倍(P<0.001)、HDNA%则降低了1.48倍(P<0.001)。因此,在24 h的短期胁迫下,草胺磷使蚯蚓体腔细胞DNA产生了明显的损伤,草胺磷浓度越高,损伤越严重;草胺磷浓度与蚯蚓体腔细胞DNA损伤程度彼此间呈显著的剂量-效应关系。
表1 不同浓度草胺磷胁迫蚯蚓24 h后彗星电泳各项参数比较
Table 1 Comet assay results of earthworms under different concentrations of glufosinate stress for 24 h
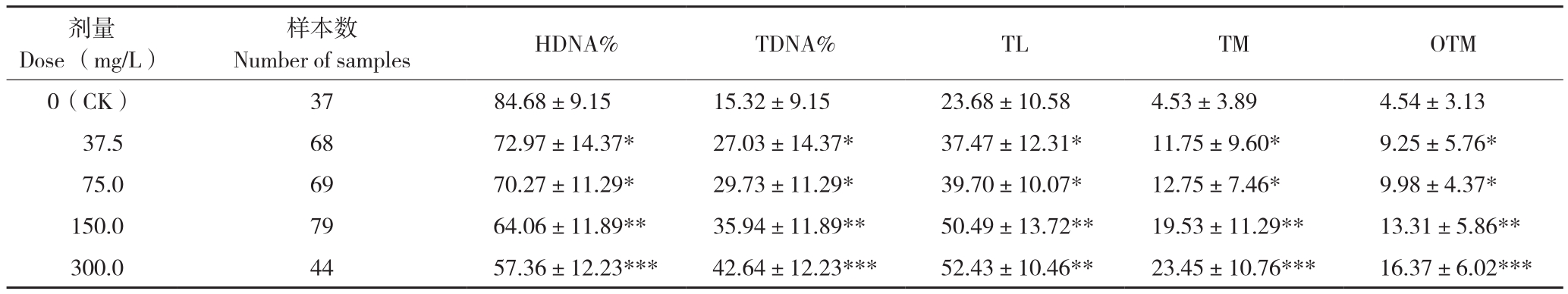
注:*、**、***分别表示与空白对照相比,达到P<0.05、P<0.01、P<0.001显著水平。
Note: Compared with control group, *, ** and *** represent significant levels at P<0.05, P<0.01 and P<0.001, respectively.
剂量Dose (mg/L)样本数Number of samples HDNA% TDNA% TL TM OTM 0(CK) 37 84.68±9.15 15.32±9.15 23.68±10.58 4.53±3.89 4.54±3.13 37.5 68 72.97±14.37* 27.03±14.37* 37.47±12.31* 11.75±9.60* 9.25±5.76*75.0 69 70.27±11.29* 29.73±11.29* 39.70±10.07* 12.75±7.46* 9.98±4.37*150.0 79 64.06±11.89** 35.94±11.89** 50.49±13.72** 19.53±11.29** 13.31±5.86**300.0 44 57.36±12.23*** 42.64±12.23*** 52.43±10.46** 23.45±10.76*** 16.37±6.02***
2.2 草胺磷胁迫96 h对蚯蚓体腔细胞DNA的影响
降低草胺磷胁迫浓度,延长胁迫时间至96 h后,提取蚯蚓体腔细胞进行彗星电泳,结果见图1。
由表2可知,与空白对照比较,18.75、37.5、75 mg/L草胺磷胁迫处理96 h蚯蚓的TDNA%、TL、TM和OTM值随草胺磷浓度升高而提高(P<0.05),HDNA%值随草胺磷浓度升高而降低(P<0.05);草胺磷浓度越高,差异越显著。最低草胺磷浓度(18.75 mg/L)胁迫下,TDNA%、TL、TM和OTM分别为空白对照的1.48、1.17、1.66、1.4倍,HDNA%降低1.22倍(P<0.05)。因此,草胺磷胁迫96 h对蚯蚓体腔细胞DNA产生了明显损伤,浓度越高,损伤越严重;草胺磷浓度与蚯蚓体腔细胞DNA损伤程度呈现显著的剂量-效应关系。
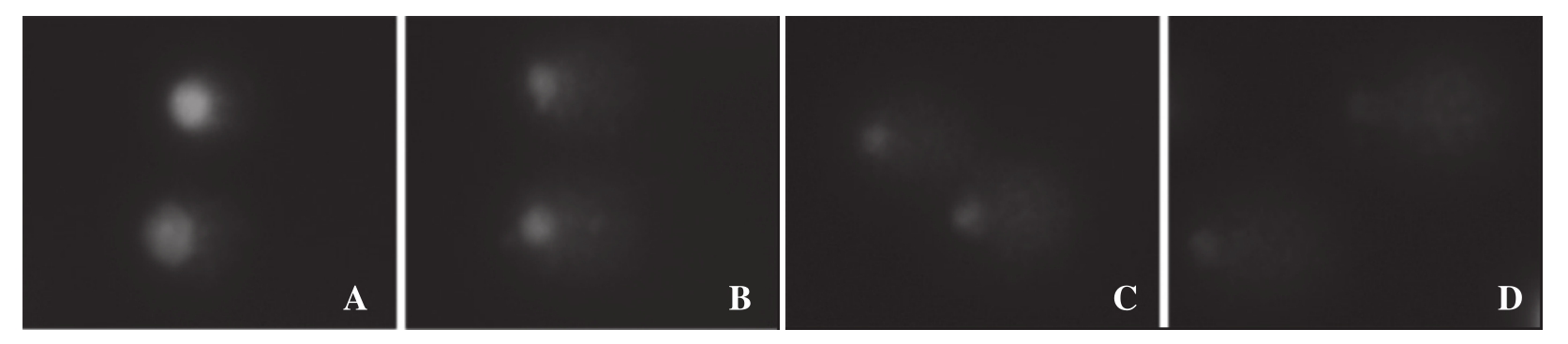
图1 不同浓度草胺磷胁迫96 h后蚯蚓体腔细胞DNA受损彗星电泳结果(400×)
Fig. 1 Comet assay image of DNA damage in coelomocytes of earthworm under different concentrations of glufosinate stress for 96 h (400×)
A: 0 mg/L(CK); B: 18.75 mg/L;C: 37.5 mg/L;D: 75 mg/L
表2 不同浓度草胺磷胁迫蚯蚓96 h后彗星电泳各项参数比较
Table 2 Comet assay results of earthworms under different concentrations of glufosinate stress for 96 h
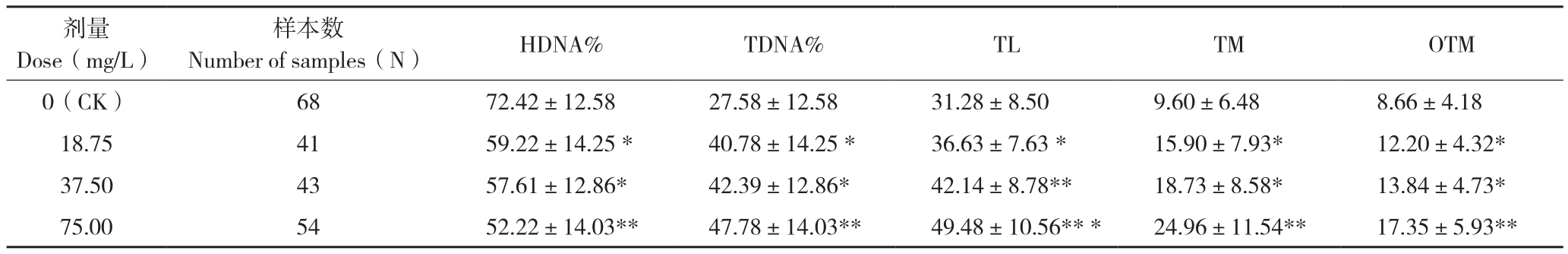
注:*、**、***分别表示与空白对照相比,达到P<0.05、P<0.01、P<0.001显著水平。
Note: compared with control group, *, ** and *** represent significant levels at P<0.05, P<0.01 and P<0.001, respectively.
剂量Dose(mg/L)样本数Number of samples(N) HDNA% TDNA% TL TM OTM 0(CK) 68 72.42±12.58 27.58±12.58 31.28±8.50 9.60±6.48 8.66±4.18 18.75 41 59.22±14.25 * 40.78±14.25 * 36.63±7.63 * 15.90±7.93* 12.20±4.32*37.50 43 57.61±12.86* 42.39±12.86* 42.14±8.78** 18.73±8.58* 13.84±4.73*75.00 54 52.22±14.03** 47.78±14.03** 49.48±10.56** * 24.96±11.54** 17.35±5.93**
37.5、75 mg/L草胺磷胁迫蚯蚓24 h时,两组彗星电泳参数值变化并不显著;延长胁迫时间至96 h后,两个处理间各项参数值差异均达到显著水平(P<0.05),反映了草胺磷浓度越高,胁迫时间越长,对蚯蚓的伤害越严重。
3 讨论
2016年草胺磷成为全球第二大除草剂,销售额达到6.6亿美元;同时欧盟对活性物质草胺磷再评审也将不再批准,主要原因是不能排除草胺磷对哺乳动物潜在的危害风险,也不能排除对非靶标节肢动物的影响[20]。除草剂滥用或长期以抗除草剂作物为主的广谱除草剂农业管理,不仅减少植物的多样性和丰富性,影响了节肢动物和其他农田动物[20],甚至使一些持效期长、残留久的除草剂在土壤中富积量越来越高,对后茬作物造成毁灭性的损失[21-22]。草甘膦在过去20年曾广泛使用,抗除草剂作物连续多年持续轮作,使得全世界出现了至少34种抗草甘膦杂草[20]。工业上仍然在开发带有抗除草剂基因的转基因作物。研究发现,一味增加农药使用强度并不能有效抑制农作物病虫害的发生,反而是作物多样性的增加可减少农作物病虫害的发生面积,因为作物多样性保障了生态系统的自动调节能力[23]。因此,除草剂的使用推广需要对整个环境作全面考虑,以严谨的态度评估其在生态环境中的安全性。
本试验在室温、避光、温湿度恒定的条件下采用彗星电泳技术反映草胺磷对蚯蚓体腔细胞的影响,结果发现草胺磷引起蚯蚓体腔细胞的损伤,在一定范围内,草胺磷浓度越高,胁迫时间越长,损伤越严重。蚯蚓体腔细胞DNA的损伤与草胺磷浓度间呈明显的正相关关系,该结果对草胺磷的安全使用和生态环境保护具有一定的指导意义。但由于草胺磷在大田或果园实际应用过程中,温度、湿度和光照以及土壤微生物等的作用,与在实验室环境的应用效果差距很大,因此草胺磷对所施用的环境中蚯蚓及其他动物的实际毒性影响还需要进行广泛的研究和探索。
4 结论
本试验结果表明,草胺磷对蚯蚓体腔细胞产生损伤,草胺磷浓度越高,胁迫时间越长,损伤越严重。此外,彗星电泳对反映草胺磷浓度与蚯蚓体腔细胞DNA损伤程度两者关系灵敏快捷,是揭示彼此之间相互关系的有效实验手段。
[1] ZHANG Y, WANG K, WU J, ZHANG H G. Field dissipation and storage stability of glufosinate ammonium and its metabolites in soil[J].International Journal of Analytical Chemistry, 2014(2014): 1-8.doi: 10.1155/2014/256091.
[2] 贾小霞,刘石,齐恩芳,吕和平,文国宏,李掌,马胜,曲亚英. 草胺磷对转基因抗草胺磷马铃薯田间杂草的防效及安全性评价[J]. 核农学报,2019, 33(10): 2040-2047.JIA X X, LIU S, QI E F, LV H P, WEN G H, LI Z, MA S, QU Y Y.Safety assessment of glufosinate to transgenic glufosinate-resistant potato and its control effect on field weeds[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(10): 2040-2047.
[3] FARTYAL D, AGARWAL A, JAMES D, BORPHUKAN B, RAM B,SHERI V, AGRAWAL K P, ACHARY V M M, REDDY M K. Developing dual herbicide tolerant transgenic rice plants for sustainable weed management[J]. Scientific Reports, 2018, 8(1):11598. doi: 10.1038/s41598-018-29554-9.
[4] CARBONARI C A, LATORRE D O, GOMES G L G C, VELINI E D, OWENS D K, PAN Z Q, DAYAN F E. Resistance to glufosinate is proportional to phosphinothricin acetylltransferase expression and activity in LibertyLink® and WideStrike®. Cotton[J]. Planta, 2016,243(4):925-933. doi: 10.1007/s00425-015-2457-3.
[5] ÁY Z, MIHÁLY R, CSERHÁTI M, KÓTAI É, PAUK J. The effect of high concentrations of glufosinate ammonium on the yield components of transgenic spring wheat(Triticum aestivum L.)constitutively expressing the bar gene[J]. The Scientific World Journal,2012(2012):1-9. doi: 10.1100/2012/657945.
[6] FUKUZAWA H, ARAI S, KAWAI-YAMADA M, DAS A, TAGAWA M, UCHIMIYA H. Glifosinate-tolerant tobacco plants directed by the promoter of adenylate kinase gene of rice[J]. Annals of Botany, 2002,89(3):351-354. doi: 10.1093/aob/mcf041.
[7] 张叶子,王依惠,董成武,佘晓云,石岩. 草胺磷对麦田土壤微生物数量及酶活性的影响[J]. 麦类作物学报,2019, 39(1):114-119.ZHANG Y Z, WANG Y H, DONG C W, SHE X Y, SHI Y. Effect of glufosinate-ammonium on soil microbial biomass and enzyme activity in wheat field[J]. Journal of Triticeae Crops, 2019, 39(1):114-119.
[8] 邓晓,武春媛,李怡,吴东明,谭华东,李勤奋.土壤微生物种群与酶活性对草胺磷和草甘麟胁迫响应的差异[J]. 农药,2019, 58(8):580-583.DENG X, WU C Y, LI Y, WU D M, TAN H D, LI Q F. Differences in the stress responses of soil microbial populations and enzyme activities to glufosinate-ammonium and glyphosate[J]. Agrochemicals, 2019,58(8): 580-583.
[9] ZALLER J G, CANTELMO C, SANTOS G D, MUTHER S, GRUBER E, PALLUA P, MANDL K, FRIEDRICH B, HOFSTETTER I,SCHMUCKENSCHLAGER B, FABER F. Herbicides in vineyards reduce grapevine root mycorrhization and alter soil microorganisms and the nutrient composition in grapevine roots, leaves, xylem sap and grape juice[J].Environmental Science and Pollution Research, 2018, 25(23):23215-23226. doi: 10.1007/s11356-018-2422-3.
[10] LAUGERAY A, HERZINE A, PERCHE O, HÉBERT B, AGUILLONNAURY M, RICHARD O, MENUET A, MAZAUD-GUITTOT S, LESNÉ L, BRIAULT S, JEGOU B, PICHON J, MONTÉCOTDUBOURG C, MORTAUD S. Pre- and postnatal exposure to low dose glufosinate ammonium induces autism-like phenotypes in mice[J].Frontiers in Behavioral Neuroscience, 2014(8):390. doi: 10.3389/fnbeh.2014.00390.
[11] HERZIN A, LAUGERAY A, FEAT J, MENUET A, QUESNIAUX V,RICHARD O, PICHON J, MONTÉCOT-D, PERCHE O, MORTAUD S. Perinatal exposure to glufosinate Ammonium Herbicide impairs neurogenesis and neuroblast migration through cytoskeleton destabilization[J]. Frontiers in Cellular Neuroscience, 2016(10):191.doi: 10.3389/fncel.2016.00191
[12] 王彦华,俞卫华,杨立之,苍涛,俞瑞鲜,王强,赵学平. 22种常用除草剂对蚯蚓的急性毒性[J]. 生态毒理学报,2012, 7(3): 317-325.WANG Y H, YU W H, YANG L Z, CANG T, YU R X, WANG Q, ZHAO X P. Acute toxicity of twenty two commonly used herbicides to earthworm(Eisenia fetida)[J]. Asian Journal of Ecotoxicology, 2012, 7(3):317-325.
[13] 李岗,吴声敢,蔡磊明. 彗星实验技术及其应用[J]. 生态毒理学报,2018, 13(6):79-96.LI G, WU S G, CAI L M.The comet assay and its applications[J].Asian Journal of Ecotoxicology, 2018, 13(6):79-96.
[14] IRIZAR A, DUARTE D, GUILHERMINO L, MARIGOMEZ I, SOTO M. Optimization of NRU assay in primary cultures of Eisenia fetida for metal toxicity assessment[J]. Ecotoxicology, 2014, 23(7):1326-1335.doi:10.1007/s 10646-014-1275-x.
[15] RAMADASS K, PALANISAMI T, SMITH E, MAYILAWAMI S,MEGHARAJ M, NAIDU R.Earthworm comet assay for assessing the risk of weathered petroleum hydrocarbon contaminated soils: Need to look further than target contaminants[J]. Archives of Environmental Contamination and Toxicology, 2016,71(4):561-571. doi: 10.1007/s00244-016-0318-0.
[16] CHEN J Q, SALEEM M, WANG C X, LIANG W X, ZHANG Q M.Individual and combined effects of herbicide tribenuron-methyl and fungicide tebuconazole on soi earthworm Eisenia fetida[J]. Scientific Reports, 2018, 8(1):2967. doi:10.1038/s41598-018-21288-y.
[17] 罗天相,姜国清,龚国勇. 蚯蚓对污泥理化性质及重金属含量的影响研究进展[J].广东农业科学,2017, 44(9):75-81. doi:10.16768/j.issn.1004-874X.2017.09.012.LUO T X, JIANG G Q, GONG G Y. Efects of earthworms on physiochemical properties and heavy metal content of sludge: a review[J]. Guangdong Agricultural Sciences, 2017, 44(9):75-81.doi:10.16768/j.issn.1004-874X.2017.09.012.
[18] EYAMBE G S, GOVEN A J, FITZPATRICK L C, VENABLES B J,COOPER E L. A non-invasive technique for sequential collection of earthworm(Lumbricus terrestris)leukocytes during subchronic immunotoxicity studies[J]. Laboratory Animals, 1991, 25(1): 61-67. doi:10.1258/002367791780808095
[19] ZHANG L J, JIA J F, HAO J G, CEN J R, LI T K. A modified protocol for the comet assay allowing the processing of multiple samples[J]. Mutation Research, 2011, 721(2): 153-156. doi: 10.1016/j.mrgentox.2011.01.006
[20] SCHÜTTE G, ECKERSTORFER M, RATELLI V, REICHENBECHER W, RESTREPO-VZSSALLI S, RUOHONEN-LEHTO M, SAUCY A G W, MERTENS M. Herbicide resistance and biodiversity:agronomic and environmental aspects of genetically modified herbicide-resistant plants[J]. Environmental Sciences Europe, 2017, 29(1):1-12.doi: 10.1186/s12302-016-0100-y.
[21] 冯莉,田兴山,杨彩宏,张泰劼. 不同蔬菜对甲咪唑烟酸土壤残留的敏感性[J]. 广东农业科学,2016, 43(11):103-108. doi:10.16768/j.issn.1004-874X. 2016.11.016.FENG L, TIAN X S,YANG C H, ZHANG T J. Sensitivity of different vegetables to imazapic residue in soil[J]. Guangdong Agricultural Sciences, 2016, 43(11):103-108. doi:10.16768/j.issn.1004-874X.2016.11.016.
[22] 杨彩宏,冯莉,田兴山,陶卫萍,岳茂峰,崔烨. 二氯哇琳酸土壤残留对后茬蔬菜药害测定及修复研究[J]. 广东农业科学2016,43(2):62-66. doi:10.16768/j.issn.1004-874X.2016.02.012.YANG C H, FENG L, TIAN X S, TAO W P, YUE M F, CUI Y. Assay on the residue of quinclorac in soil to the succession vegetables and remediation effects of two antidotes[J]. Guangdong Agricultural Sciences, 2016, 43(2): 62-66. doi:10.16768/j.issn.1004-874X.2016.02.012.
[23] 聂弯,谢彦明. 农药使用强度对农作物病虫害发生面积的影响-基于随机效应面板模型的实证分析[J]. 广东农业科学,2018, 45(1):135-142. doi: 10.16768/j.issn.1004-874X.2018.01.022.NIE W, XIE Y M. Impact of pesticide use intensity on the occurrence area of crop diseases and insect pests-Empirical analysis based nn the random effects model[J]. Guangdong Agricultural Sciences, 2018,45(1):135-142. doi: 10.16768/j.issn.1004-874X.2018.01.022.