【研究意义】随着生命科学的发展,辅助生殖技术(Assisted Reproductive Technology,ART)[1]和基因编辑技术扮演着越来越重要的角色。小鼠作为人类疾病动物模型,对一些疾病研究具有重要意义,如阿尔茨海默病[2]、帕金森病[3]等。利用小鼠的辅助生殖技术来改善甚至增强小鼠的机能和贡献力,成为小鼠研究的关键环节[4]。【前人研究进展】在辅助生殖技术的研究中,已有对精液保存、卵母细胞体外培养、人工授精、体外受精、胚胎移植和胚胎体外培养等研究[1,4-5],但在体外受精这一研究中缺乏精子数量对小鼠的体外受精和胚胎早期发育的影响研究。精液分析是评估雄性动物生育能力的最基本检测项目,精子计数更是其中重要的指标之一[6]。相关研究表明,精液常规分析对预测精子结构和功能完整性的有效性达38.13%[7]。【本研究切入点】关于精液对辅助生殖技术的研究较多,如精液保存的条件及体外受精条件的探讨,但从精子数量或密度角度对体外受精及胚胎体外发育的研究较少。【拟解决的关键问题】本试验通过利用不同精子数量对小鼠体外受精及胚胎早期体外发育影响的研究,进一步完善小鼠体外受精技术,促进辅助生殖技术的发展,从而提高小鼠的繁育工作,为人类疾病动物模型的发展提供一定的研究基础。
1 材料与方法
1.1 试验材料
实验动物:SPF级C57BL/6雌鼠(4周龄,60只)、雄鼠(9周龄,16只),均由广东省医学实验动物中心提供,生产许可证号为SCXK(粤)2018-0002。
主要仪器:体视显微镜(ZSA302T,中国)、倒置显微镜(MI 12,中国)、二氧化碳培养箱(热电3111,美国)、分体式恒温加热台(JR-3020,中国)、血细胞计数板(上海求精生化试剂仪器有限公司)
主要试剂:注射用血促性素(PMSG)、注射用绒促性素(hCG),均购自宁波第二激素厂;人输卵管培养液(HTF),配方见表1;M16胚胎培养基、矿物油,均购自Sigma公司。
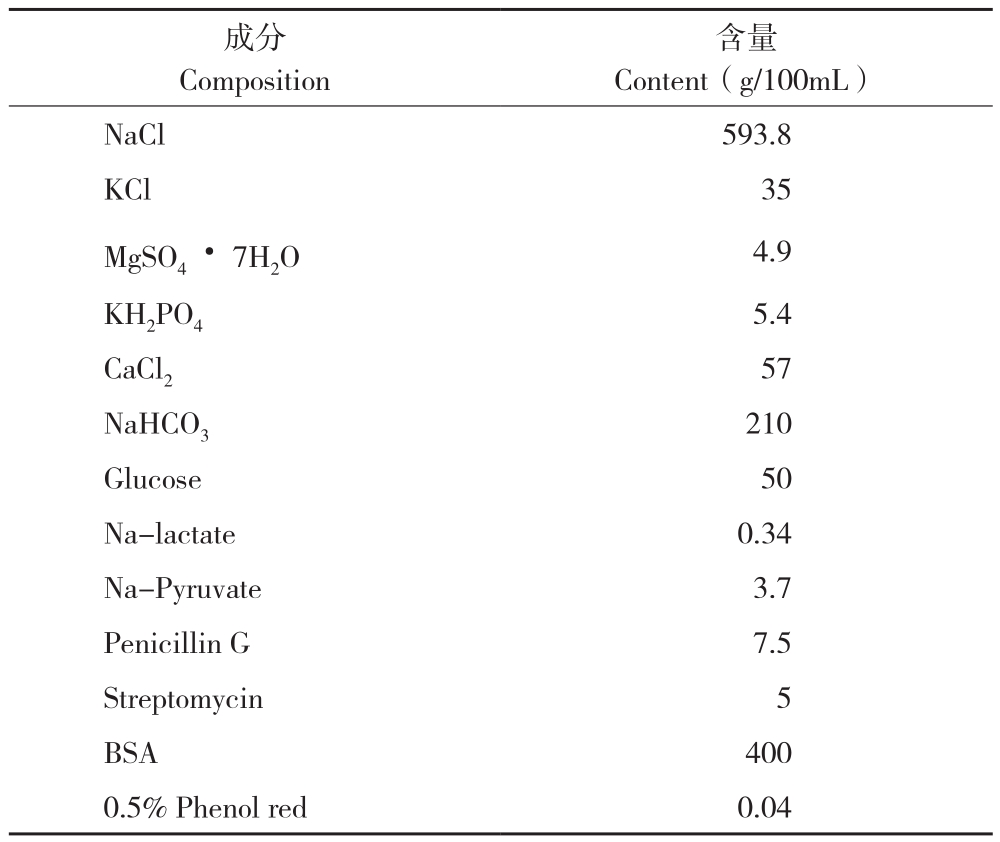
表1 人输卵管培养液(HTF)配方
Table 1 Formula of human fallopian tube culture fluid(HTF)
注:0.22 μm滤膜过虑除菌,4℃保存,1周内备用。
Note: 0.22 μm filter membrane is over-sterilized and stored at 4℃ for standby in 1 week.
含量Content(g/100mL)NaCl 593.8 KCl 35 MgSO4·7H2O 4.9 KH2PO4 5.4 CaCl2 57 NaHCO3 210 Glucose 50 Na-lactate 0.34 Na-Pyruvate 3.7 Penicillin G 7.5 Streptomycin 5 BSA 400 0.5% Phenol red 0.04成分Composition
1.2 试验方法
1.2.1 饲养方法 C57BL/6雌雄小鼠均饲养在SPF级屏障设施环境中,温度控制在20~26℃,相对湿度为40%~70%。光照周期为10 h明/14 h暗,换气次数大于20次/ h。饮用水均经过高温灭菌,紫外照射消毒。饲料为广东省医学实验动物中心提供的无菌繁殖鼠料,小鼠自由饮食、饮水。笼具与饲料按2次/周进行更换,均经过严格的高温蒸汽灭菌消毒,进出屏障设施均严格遵守相关标准操作规程。动物饲养及试验均在广东省医学实验动物中心SPF级屏障设施内进行。本试验经广东省医学实验动物中心实验动物伦理委员会审查批准(IACUC审查号:B201712-21),严格按照实验动物使用的3R原则给予人道关怀。
1.2.2 超数排卵 随机选取60只4周龄C57BL/6雌鼠,注射PMSG(10 IU/只),并于46~48 h 后注射hCG(10 IU/只)进行超数排卵,15 h后颈椎脱臼处死,从输卵管膨大部获取卵母细胞团放置于提前准备好含HTF的受精皿(含2个160 μL HTF滴和2个50 μL HTF滴,下同)内。
1.2.3 精子计数 随机选取16只9周龄C57BL/6雄鼠,与欲将淘汰的雌鼠合笼试配3 d,取出雌鼠,单放雄鼠3 d后颈椎脱臼处死后,附睾尾获取的精子放入提前准备好的含HTF精子皿(含200 μL HTF滴,下同)内,置于37℃、5% CO2、饱和湿度的二氧化碳培养箱中孵育1 h。用移液枪将获能后的精子从精子滴边缘分别吸取1、3、5、10、15、20 μL精子溶液滴入血细胞计数板上进行精子计数[8-10]。
1.2.4 体外受精 将60只各装有两个卵丘卵母细胞团的受精皿随机分为6组,每组10个受精皿。从二氧化碳培养箱中取出精子皿,用移液枪从精子滴边缘分别吸取1、3、5、10、15、20 μL精液置于6个试验组中,记录精子计数后,将受精皿置于37℃、5% CO2、饱和湿度的二氧化碳培养箱中培养24 h。
1.2.5 胚胎的体外培养和胚胎收集 精卵共孵育24 h后,从培养箱取出受精皿,捡出未受精的卵母细胞、1-细胞合子、2-细胞胚胎及畸形胚胎,放于受精滴旁边的50 μL HTF滴中洗净后,置于提前准备并已孵育2 h的M16培养滴中。准确计数卵母细胞、1-细胞合子、2-细胞胚胎及畸形胚胎,并计算受精率、2-细胞胚胎发育率和畸形率。
1.3 数据统计分析
利用SPSS 21.0软件进行数据处理及差异显著性分析,组间差异用Duncan's 多重范围检验法进行多重比较。
2 结果与分析
2.1 不同精子数量对体外受精率的影响
从不同精子溶液体积的精子数量(表2)可以看出,在精子外环境相同的情况下,不同精子溶液体积的精子数量不同。通过同批次超排后取得的卵母细胞团中加入不同精子数量的精子溶液后发现,其体外受精率随精子数量的增加而出现一定的降低趋势,且差异较大。进一步比较发现,精子数量为1.23(±0.31)×106个/mL和2.03(±0.35)×106个/mL的体外受精率较高,分别为95.17%、94.29%,但差异不显著,与精子数量 为 0.25(±0.23)×106、3.95(±0.33)×106个/mL的体外受精率差异显著,而极显著高于精子数量 为 6.50(±0.76)×106、9.88(±0.52)×106个/mL的体外受精率。
表2 不同精子数量与体外受精率的影响
Table 2 Numbers of sperm and in vitro fertilization rates with different sperm solution volumes

注:同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters in the same column represent significant differences, different capital letters represent extremely significant differences.
体外受精率In vitro fertilization rate(%)1 10 0.25±0.23 10 88.92±2.74aA 3 10 1.23±0.31 10 95.18±2.69bA 5 10 2.03±0.35 10 94.29±3.59bA 10 10 3.95±0.33 10 90.56±3.96aA 15 10 6.50±0.76 10 85.88±4.41B 20 10 9.88±0.52 10 78.25±7.53C精子溶液体积Semen volume(μL)计数次数Number of counts精子数量Sperm counts(×106/mL)雌小鼠数量Number of female mice
2.2 不同精子数量对胚胎生长发育的影响
小鼠体外受精过程中,不同精子数量不仅使体外受精率有较大差异,也会使胚胎的发育受到一定影响。体外受精24 h后,正常2-细胞胚胎随精子数量的不同存在一定差异(图1A)。进一步比较发现,精子数量为1.23(±0.31)×106、2.03(±0.35)×106个/mL时,2-细胞胚胎发育率较好,均显著高于精子数量为(6.50±0.76)×106个/mL的情况,均极显著高于精子数量为9.88(±0.52)×106个/mL的情况。同时,精子数量数 为 3.95(±0.33)×106、6.50(±0.76)×106个/mL的2-细胞胚胎发育率均极显著高于精子计数为9.88(±0.52)×106个/mL的情况。
在胚胎体外发育过程中,不同精子数量导致胚胎异常发育的差异较大(图1B)。通过比较发现,精子数量为9.88(±0.52)×106个/mL时,胚胎异常发育的概率较大,与精子数量分别为0.25(±0.23)×106、1.23(±0.31)×106、2.03(±0.35)×106、3.95(±0.33)×106、6.50(±0.76)×106个/mL的情况相比,差异均极显著。

图1 不同精子数量对胚胎生长发育的影响
Fig. 1 Effects of different sperm counts on the growth and development of embryos
A:胚胎正常发育 B:胚胎异常发育 A: Normal development B: Abnormal development
*和* *分别表示差异显著、差异极显著 * and ** represent siguificant difference and extremely significant difference, respeetively
3 讨论
血细胞计数板是最早应用于精子计数的计数池之一,也是目前WHO推荐使用的精子计数工具,目前仍被广泛应用[9]。虽然血细胞计数板的计数池深度为0.1 mm,精子容易互相重叠,但使用血细胞计数板时,精液标本需要稀释,因此,血细胞计数板的结果更接近于真实值。Johnson等[10]认为血细胞计数板可作为精液常规分析的“金标准引”。因此,本研究在对小鼠精液的常规分析中利用血细胞计数板进行精子计数是常见且较为准确的方法。本试验中精液获能1 h后,活力较好的精子会逐渐向精子滴四周边缘游去,精子滴中间留下的精子活力较差或是死精。随着精子溶液体积的增加精子数量也不断增加,且具有一定的差异性。
ART是利用人工的方法使精子和卵子相互结合的技术,包括精液保存、卵母细胞的体外培养、人工授精、体外受精、胚胎移植和胚胎体外培养等技术[11-12]。ART的不断完善在一定程度上对动物及人类生殖过程、遗传病机制、干细胞定向分化[13]等研究课题提供了基础;同时,ART的临床应用为这些课题的深入研究积累经验,创造发展条件,推动医学及生命科学的不断发展进步[14]。体外受精技术是ART重要的组成部分,将从母体取出的卵细胞置于培养皿内,加入经优选诱导获能处理的精子,使精卵合适的条件下进行体外受精,获取一定数量优质胚胎的技术。在相关小鼠体外受精技术研究中,遗传背景[15-16]、品系[17-19]、培养液成分[20-21]、精子与卵母细胞质量等相关研究都较为成熟,但对精子计数的研究较少。通过对不同精子计数进行体外受精实验可以发现精子数量为1.23(±0.31)×106~2.03(±0.35)×106 个/mL时,小鼠的体外受精率较高,随着精子数量的增加,体外受精率呈现一定的下降趋势,这一结论与Fraser等[22]的研究结果相似。在本试验中小鼠的体外受精率随精子数量的增加而降低,该趋势的出现与营养物质和共存环境有关。在一定范围内,HTF培养液中的营养可以促使精子与卵母细胞发生受精作用形成受精卵,进一步发育成胚胎。随着精子数量的增加,精子间的“竞争”与精子与卵母细胞的“竞争”都会导致其活力的下降,从而使受精率降低;同时,过多的精子与卵母细胞的代谢产物在一定程度上也会导致受精率降低,进而导致胚胎的正常发育。
正常情况下,有些精子5 min内就能到达输卵管壶腹部[23],但并不具备受精能力,需要在输卵管内进行获能。HTF液为输卵管培养液,在37℃、5%CO2、饱和水分的环境下,所处环境和理化因子与雌鼠输卵管内环境相似。精子首先穿过卵丘团和透明带,发生顶体反应后方可与卵母细胞膜融合完成受精。体外受精后胚胎在11~18 h完成DNA复制,17~20 h后进行卵裂[24],在受精24~27 h后胚胎能正常发育到2-细胞中期[25]。因此,精子需在HTF液中培养1 h获能后方可进行体外受精试验,体外培养24 h后可正常发育到2-细胞。
相关研究表明,胚胎的发育不仅与排卵率、生存空间、胎儿先天性缺陷、生殖激素、子宫感染及营养水平等有关,同时还受品种、遗传、胎次和环境条件的影响[26]。37℃、5% CO2、饱和水分的环境下发现,不同数量的精子参与体外受精,在经过24 h后胚胎发育正常至2-细胞胚胎的概率有较大差异。精子数量为0.25(±0.32)×106 ~3.95(±0.33)×106 个/mL时,正常发育到2-细胞胚胎的概率差异不显著,但精子计数为1.23(±0.31)×106~2.03(±0.35)×106 个/mL时胚胎受精率及2-细胞胚胎发育率较好;随着精子数量增加到6.50(±0.76)×106个/mL时,2-细胞胚胎率显著性降低;精子计数增加到9.88(±0.52)×106 个/mL时,胚胎正常发育情况较差,且畸形胚胎较多。该现象表明未受精的精子在一定程度上成为了胚胎发育的“竞争者”,不仅与胚胎争夺营养物质与生存环境,其代谢产物也会影响胚胎的正常发育,进一步说明胚胎的发育与所处的营养环境密不可分。不利的胚胎营养环境可以阻碍胚胎发育,影响胚胎代谢,导致胚胎发生慢性疾病甚至停止发育,甚至会增加动物出生后代谢性疾病的发生率[27]。由此看来,精子数量不仅对小鼠体外受精率有影响,而且也会影响小鼠胚胎的正常发育。
4 结论
本试验通过血细胞计数板对小鼠精子进行计数,利用不同精子数量参与小鼠体外受精并进行体外培养,对体外受精率和正常发育到2-细胞胚胎的概率比较分析得出,精子数量为1.23(±0.31)×106 ~2.03(±0.35)×106 个/mL时,小鼠的体外受精和胚胎体外培养发育较好,从而获得较多优质的胚胎。本试验结果丰富了体外受精技术,促使小鼠的辅助生殖技术得到进一步完善,同时对小鼠的辅助生殖技术、基因工程等研究提供了一定的参考。
[1] 胡永艳,孔申申. 辅助生殖技术对小鼠表型影响的研究进展[J]. 中 国 比 较 医 学 杂 志,2018,22(3):114-118. doi:10.3969/j.issn.1671-7856.2018.03.022.HU Y Y, KONG S S. Research progress on the effects of assisted reproduction technology on mice phenotype[J]. Chinese Journal of Comparative Medicine, 2018,22(3): 114-118. doi:10.3969/j.issn.1671-7856.2018.03.022.
[2] GUO X D, LYU J L, LU J, FAN L, HUANG X, HU L H, WANG J Y,SHEN X. Protopanaxadiol derivative DDPU improves behavior and cognitive deficit in AD mice involving regulation of both ER stress and autophagy[J]. Neuropharmacology,2017(11): 77- 91. doi: 10.1016/j.neuropharm.2017.11.033.
[3] KUSUDA Y, TAKEMURA A, NAKANO M, ISHIHARA A. Mild hyperbaric oxygen inhibits the decrease of dopaminergic neurons in the substantia nigra of mice with MPTP-induced Parkinson's disease[J]. Neurosci Research,2017,11(8):58-62. doi: 10.1016/j.neures.2017.11.008.
[4] JENSEN C, KHAN O, SONKSEN J, FODE M. Comparison of semen quality between university-based and private assisted reproductive technology laboratories[J]. Scandinavian Journal Urology, 2017,10(3):1-5. doi: 10.1080/21681805.2017.1409264.
[5] 马红. 奶牛卵丘细胞和共培养细胞对体外受精胚胎发育的影响[J].广东农业科学,2009(6):130-132. doi:10.16768/j.issn.1004-874X.2009.06.041.MA H. Effect of dairy cumulus cells and co-culture cells on in vitro fertilization embryo development[J]. Guangdong Agricultural Sciences, 2009(6): 130-132. doi:10.16768/j.issn.1004-874X.2009.06.041.
[6] 胡毓安,陆金春,吕年青,黄宇烽. 4种精子计数方法的比较[J]. 中华男科学杂志,2006,12(3):222-224, 227. doi:10.3969/j.issn.1009-3591.2006.03.008.HU Y A, LU J C, LU N Q, HUANG Y F. Comparison of four sperm counting methods[J]. Chinese Journal of Andrology, 2006,12(3):222-224, 227. doi:10.3969/j.issn.1009-3591.2006.03.008.
[7] GOPALKRISHNAN K, PADWAL V, BALAIAH D. Efficiency of routine semen analysis to predict functional and structural integrity of human spermatozoa[J]. Indian Journal of Expreimental Biology,1995,33(9):652-654.
[8] 陆金春,吕年青,黄宇烽,李石华,HARRY F . 3种精子计数池的质量评估[J]. 中华男科学杂志,2004(10):755-757, 760. doi:10.3969/j.issn.1009-3591.2004.10.009.LU J C, LYU N Q, HUANG Y F, LI S H, HARRY F. Quality evaluation of three kinds of sperm counting pools[J]. Chinese Journal of Andrology, 2004(10): 755-757, 760. doi:10.3969/j.issn.1009-3591.2004.10.009.
[9] AUGER J, KUNSTMANN J M, CZYGLIK F, JOUANNET P. Decline in semen quality among fertile men in Paris during the past 20 years[J].The New England Journal of Medicine,1995,332(5):281-285.
[10] JOHNSON J E, BOONE W R, BLACKHURST D W. Manual versus computer-automated semen analyses. Part III. Comparison of old versus new design MicroCell Chambers[J].Fertility and Sterility,1996,65(2):446-447. doi: 10.1016/S0015-0282(16)58115-1.
[11] TAL l R, SEIFER D B, WANTMAN E,BAKER V, TALl O.Antimullerian hormone as a predictor of live birth following assisted reproduction: an analysis of 85,062 fresh and thawed cycles from the Society for Assisted Reproductive Technology Clinic Outcome Reporting System database for 2012-2013[J]. Fertility and Sterility,2018,109(2):258-265. doi:10.1016/j.fertnstert. 2017.10.021.
[12] VEGA M, ZAGHI S, BUYUK E, JINDAL S. Not all twins are monozygotic after elective single embryo transfer: analysis of 32,600 elective single embryo transfer cycles as reported to the Society for Assisted Reproductive Technology[J]. Fertility and Sterility, 2018,109(1): 118-122. doi:10.1016/j. fertnstert.2017.10.003.
[13] HMADCHA A, AGUILERA Y, LOZANO-ARANA M D, MELLADO N, SANCHEZ J, MOYA C, SANCHEZ-PALACIOS L, PALACIOS J, ANTINOLO G, BERNAT S. Derivation of HVR1, HVR2 and HVR3 human embryonic stem cell lines from IVF embryos after preimplantation genetic diagnosis(PGD)for monogenic disorder[J].Stem Cell Reearch,2016,16(3):635-639. doi:10.1016/j.scr.2016.03.012.
[14] VEGA M, ZAGHI S, BUYUK E,JINDAL S. Not all twins are monozygotic after elective single embryo transfer: analysis of 32,600 elective single embryo transfer cycles as reported to the Society for Assisted Reproductive Technology[J]. Fertility and Sterility,2018,109(1): 118-122. doi:10.1016/j. fertnstert.2017. 10. 003.
[15] 赵丹凤,刘丽均,赵立虎,张春燕,狄敏,郁丽丽,张守纯,徐平. 不同遗传背景小鼠的超排与体外受精率的比较研究[J]. 上海交通大学学报(农业科学版),2006,24(5):465-470. doi:10.3969/j.issn.1671-9964.2006.05.012.ZHAO D F, LIU L J, ZHAO L H, ZHANG C Y, DI M, YU L L,ZHANG S C, XU P. Comparative study of superovulation and in vitro fertilization rates in mice with different genetic backgrounds[J]. Journal of Shanghai Jiaotong University(Agricultural Science), 2006,24(5):465-470. doi:10.3969/j.issn. 1671-9964.2006.05.012.
[16] YOSHIZAKI K, FURUSE T, KIMURA R, TUCCI V, KANEDA H,WAKANA S, OSUMI N. Paternal aging affects behavior in Pax6 mutant mice: A gene/environment interaction in understanding neurodevelopmental disorders[J]. PLoS One, 2016(11): 1665. doi:10.1371/journal.pone.0166665. eCollection 2016.
[17] 陆晔,唐一岷,刘丽均,谢恩,薛志谋,徐平. 不同品系小鼠精子冷冻及冻融精子体外受精的研究[J]. 上海交通大学学报(农业科学版),2003,21(S1):6-9, 13. doi:10.3969/j.issn.1671-9964.2003.z1.002.LU Y, TANG Y M, LIU L J, XIE E, XUE Z M, XU P. Study on frozen and thawed sperm in vitro fertilization of different strains of mice[J].Journal of Shanghai Jiaotong University(Agricultural Science),2003,21(S1): 6-9, 13. doi:10.3969/j.issn.1671-9964. 2003.z1.002.
[18] 吴红,孙强,范士明,毛慧华,谢夏阳,李厚达. 不同品系小鼠体外受精方法的研究[J]. 扬州大学学报,2004,25(1):18-21. doi:10.3969/j.issn.1671-4652.2004.01.005.WU H, SUN Q, FAN S M, MAO H H, XIE X Y, LI H D. Research on in vitro fertilization methods of mice of different strains[J].Journal of Yangzhou University, 2004,25(1): 18-21. doi:10.3969/j.issn.1671-4652.2004.01.005.
[19] VERGARA G J, IRWIN M H, MOFFATT R J, PINKERT CA.In vitro fertilization in mice: Strain differences in response to superovulation protocols and effect of cumulus cell removal[J].Theriogenology,1997,47(6):1245-1252. doi: 10.1016/s0093- 691x(97)00104-0.
[20] 吴凌峰,郑月慧,张静. c-myb对小鼠体外受精的影响及作用机制的分析[J]. 中国应用生理学杂志,2005(1):82-86, 124. doi:10.3969/j.issn.1000-6834.2005.01.017.WU L F, ZHENG Y H, ZHANG J. Effect of c-myb on in vitro fertilization in mice and its mechanism of action[J]. Chinese Journal of Applied Physiology, 2005(1): 82-86, 124. doi:10.3969/j.issn.1000-6834. 2005.01.017
[21] KRANIA F, DOVOLOU E, REKKAS C A,THEODOSIADOU EK, PAPPAS I, AMIRIDIS GS. Effects of addition of tissue-type plasminogen activator in in vitro fertilization medium on bovine embryo development and quality[J]. Reproduction in Domestic Animals,2015,50(1):112-120.[21]doi: 10.1111/rda. 12456.
[22] FRASER L R, DANDEKAR P V, VAIDYA R A. In vitro fertilization of tubal rabbit ova partially or totally denuded of follicular cells[J].Biology of Reproduction,1971,4(2):229-233. doi: 10.1093/biolreprod/4.2.229.
[23] HOGAN B, COSTANTINI F, LACY E. Manipulating the mouse embryo:A laboratory manual[M]. America:Cold Spring Harbor Laboratory Press,2014.
[24] LEHTONEN E, LEHTO V P, VATRTIO T, BADIEY R A, VIRTANEN I. Expression of cytokeratin polypeptides in mouse oocytes and preimplantation embryos[J]. Developmental Biology,1983,100(1):158-165. doi:10.1016/0012-1606(83)90206-3.
[25] NAGY A, GERTSENSTEIN M, VINTERSTEN K, BAHRINNER R.Manipulating the mouse embryo: A laboratory manual[M]. America:Cold Spring Harbor Laboratory Press,2003.
[26] 杜双和. 影响猪胚胎发育的因素与胚胎死亡[J]. 畜牧兽医科技信 息,2017(10):73-74. doi:10.3969/J.ISSN.1671-6027.2017.10.062.DU S H. Factors influencing pig embryo development and embryo death[J]. Animal Husbandry and Veterinary Science and Technology Information, 2017(10): 73-74. doi:10.3969/J.ISSN.1671-6027.2017.10.062.
[27] 吕佳琪,华雯妤,王恬. 胚胎营养环境对动物出生后营养代谢的调控研究[J]. 动物营养学报,2016(2):335-344. doi:10.3969/j.issn.1006-267x.2016.02.005.LYU J Q, HUA W Y, WANG T. Regulation of the nutritional environment of embryos on postnatal nutrition metabolism of animals[J]. Journal of Animal Nutrition, 2016(2): 335-344. doi:10.3969/j.issn.1006-267x.2016.02.005.