【研究意义】Janus激酶(Janus kinase,JAK)为一类与膜受体相关、存在于胞内的酪氨酸蛋白激酶,是JAK-STAT(Signal transducers and activators of transcription,STAT)信号传导通路的重要组成部分。当细胞因子(如IL-2、IL-4和IL-7等)结合相应受体后,JAK负责将细胞因子受体、自身和STAT磷酸化,磷酸化的STAT转入细胞核内调节相关基因的转录与表达,从而调控细胞存活、增殖、分化、发育、维持内环境稳态和免疫反应等多种生命活动过程[1-3]。在哺乳动物中,JAK家族有4个蛋白成员,分别为JAK1、JAK2、JAK3和TYK2(Tyrosine kinase 2)。其中,JAK3分布于哺乳动物的骨髓和淋巴系统,可以磷酸化STAT1、STAT3和STAT5,将细胞因子信号传递并激活下游通路[1,4]。卵形鲳鲹(Trachinotus ovatus)是华南沿海地区重要的海水养殖经济鱼类之一,但随着养殖规模的扩大和产量上升,养殖过程中病害频发,给卵形鲳鲹养殖业造成了巨大经济损失。近年来,以疫苗接种作为主要方式的免疫防治被认为是防制鱼类病害的安全有效途径。因此有必要开展卵形鲳鲹的基础免疫学研究。本研究以免疫通路中重要效应分子JAK3为研究对象,开展卵形鲳鲹JAK3(TroJAK3)蛋白表达与纯化,为了解TroJAK3蛋白结构、相互作用及抗体制备提供科学依据。【前人研究进展】哺乳动物JAK3可以介导IL-2、IL-7和IL-15信号传导,参与调控巨噬细胞的极化、调节细胞发育和调节骨骼肌细胞对葡萄糖的摄取[6-9];JAK3可以减少巨噬细胞入侵的数量,从而减弱肾间质纤维化,与肾小管上皮细胞的分化有关[10]。此外,JAK3基因突变是人类常染色体隐性严重联合免疫缺陷综合征的病因,与患者的复发白血病也有紧密联系[11-12]。目前,鱼类JAK3的研究非常有限,仅在鲤鱼(Cyprinus carpio)[13]、黄颡鱼(Pelteobagrus fulvidraco)[14]、复鰕虎鱼(Synechogobius hasta)[1]、斑点叉尾鮰(Ictalurus punctatus)[15] 和 鳜 鱼(Siniperca chuatsi)[16]等少数鱼类中有JAK3基因序列及其mRNA表达分析的相关报道,而有关鱼类JAK3蛋白功能未见报道。【本研究切入点】目前有关鱼类JAK3蛋白的相互作用、蛋白表达及抗体制备等蛋白水平研究匮乏,市面上缺乏鱼类JAK3蛋白的商品化抗体,而海水养殖重要经济鱼类卵形鲳鲹的JAK3基因序列和蛋白的研究未见报道。【拟解决的关键问题】通过构建原核表达载体pET-32a-TroJAK3,表达与纯化获得重组蛋白,为研究TroJAK3蛋白的功能和抗体制备奠定基础。
1 材料与方法
1.1 试验材料
含有TroJAK3基因的pMD18-T-TroJAK3质粒、pET-32a载体、E.Coli TOP10和BL21(DE3)感受态细胞均由本实验室保藏。T4 DNA连接酶、DNA Taq酶、限制性内切酶(HindⅢ和XhoⅠ)和预染蛋白Marker购自TaKaRa公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、脱脂奶粉和West Pico ECL超敏发光液购自北京索莱宝科技有限公司;蛋白Marker、SDS-PAGE凝胶制备试剂、Ni-IDA琼脂糖纯化树脂、PCR产物胶回收试剂盒和质粒提取试剂盒购自生工生物工程(上海)股份有限公司;小鼠抗His单克隆抗体和辣根过氧化物酶(horseradishperoxidase,HRP)标记的山羊抗小鼠IgG抗体购自ImmunoWay(美国)生物技术公司。
1.2 试验方法
1.2.1 TroJAK3基因扩增与原核表达载体构建 根据TroJAK3基因序列(GenBank:M N 7 8 2 0 0 2)设计带酶切位点引物J A K 3 F:CCAAGCTTACATGGATCTCAGTGAGGAG(HindⅢ)和JAK3 R:CCCTCGAGTGCCTTTAGGGTTCTCTCT(XhoⅠ),以pMD18-T-TroJAK3质粒作为模板,PCR扩增程序:94℃预变性4 min;94℃ 30 s、65℃ 30 s、72℃ 210 s,30 个循环;72℃延伸10 min。将PCR产物按照胶回收试剂盒说明书进行目的片段纯化,用HindⅢ、XhoⅠ对pET-32a和目的片段进行双酶切,回收酶切片段用T4 DNA连接酶16℃过夜连接,连接产物转化到E.Coli TOP10感受态细胞中,挑选单个菌落进行检测,引物选用通用引物(T7:TAATACGACTCACTATAGGG和T7 teminal:GCTAGTTATTGCTCAGCGG),PCR扩增程序:95℃预变性5 min;94℃ 30 s、58℃ 30 s、72℃210 s,30 个循环;72℃延伸10 min。挑选阳性克隆扩大培养并抽提重组质粒,命名为pET-32a-TroJAK3,应用HindⅢ和XhoⅠ双酶切鉴定。鉴定成功后送生工生物工程(上海)股份有限公司测序。
1.2.2 TroJAK3重组蛋白的诱导表达和可溶性分析 重组质粒(pET-32a-TroJAK3)转化至E.coli BL21(DE3)感受态细胞中,挑选单克隆接种至含氨苄(100 μg/mL)抗性的5 mL LB培养基中,37℃过夜振荡培养。过夜培养的菌液按照1∶100接种于含氨苄的20 mL LB培养基中37℃振荡培养至菌液OD600为0.6时(约3 h),取出1 mL作对照样品,加入终浓度为1 mmol/L的IPTG 37℃诱导4 h。取诱导后菌液1 mL,9 000 g离心3 min去上清,收集菌体作为样品。其余菌液9 000 g离心3 min去上清,收集菌体后加入PBS重悬,冰上进行超声破碎,离心收集上清和沉淀进行SDSPAGE和考马斯亮蓝染色检测表达情况。
1.2.3 诱导TroJAK3重组蛋白纯化 将pET-32a-TroJAK3转化至E. coli BL21(DE3)感受态细胞,37℃过夜振荡培养。次日按照1∶100接种于含氨苄的300 mL LB培养基中37℃振荡培养至菌液OD600为0.6时(约3 h),加入IPTG使终浓度为1 mmol/L,37℃诱导4 h,4℃ 9 000 g离心3 min收集菌体。按照0.1 g/mL的比例加入pH为8.0细菌裂解液(50 mmol/L Tris HCl、500 mmol/L NaCl、0.1 mmol/L PMSF、1 mg/mL溶菌酶和5 mmol/L EDTA),悬浮菌体,冰浴30 min使其充分混匀后,在冰上进行超声破碎使细菌裂解。4℃ 9 000 g离心10 min后弃去上清,应用洗涤液A(50 mmol/L Tris HCl、500 mmol/L NaCl、2%Tween-20和 2 mol/L 尿素)洗涤去除少量脂类、核酸和其他杂蛋白等,涡旋震荡,4℃ 9 000 g离心10 min,弃去上清;应用洗涤液B(50 mmol/L Tris HCl和 500 mmol/L NaCl)洗涤,去除样品中的EDTA,4℃ 9 000 g离心10 min,弃去上清;加入结合缓冲液(20 mmol/L Tris HCl、500 mmol/L NaCl、20 mmol/L咪唑、1 mmol/L β-巯基乙醇和8mol/L尿素)应用磁力搅拌器4℃溶解包涵体8 h。将上述样品4℃ 9 000 g离心10 min,将上清流经Ni-IDA琼脂糖纯化树脂柱,收集流出液体,并用2 mL结合缓冲液冲洗。用50、100、150、200 mmol/L咪唑洗脱液各4 mL依次洗脱,分别收集流出液体,通过SDS-PAGE和考马斯亮蓝染色检测分析。
1.2.4 TroJAK3重组蛋白Western blot鉴定 将纯化后的重组蛋白进行SDS-PAGE后,转至NC膜,经5%脱脂奶粉室温封闭2 h,加入小鼠抗His标签的单克隆抗体(1∶3 000)4℃孵育过夜。次日,将样品TBST室温下洗膜3次(10 min/次),加入HRP标记的山羊抗小鼠IgG抗体(1∶5000)室温孵育1 h后,再次用TBST洗膜3次(10 min/次),应用ECL超敏发光液显影并拍照。
2 结果与分析
2.1 原核表达质粒的构建与鉴定
以PCR扩增TroJAK3,扩增产物经1%琼脂糖凝胶电泳分析,获得3 300 bp的目的条带,条带与预期条带相符。目的条带与空载体双酶切(HindⅢ和XhoⅠ)后,得到3 300 bp和5 800 bp条带(图1),经连接转化,质粒提取。测序结果显示插入的TroJAK3基因表达框无移码或突变,表明重组质粒构建成功。
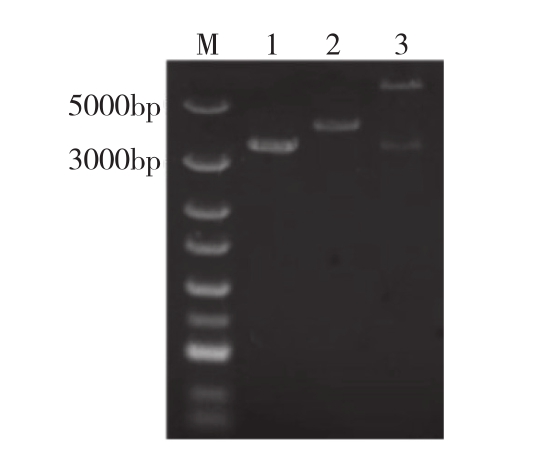
图1 原核表达质粒的构建和鉴定
Fig. 1 Construction Identification of prokaryotic expression plasmid
M:DNA Marker;1:TroJAK3基因PCR扩增片段;2:含重组质粒pET-32a-TroJAK3的菌落PCR鉴定;3:重组质粒pET-32a-TroJAK3双酶切验证
M: DNA Marker; 1: PCR amplification fragment of TroJAK3;2: Identification of colony containing pET-32a-TroJAK3 by PCR assay;3: Identification of recombinant plasmid pET-32a-TroJAK3 by double enzyme digestion
2.2 融合蛋白表达与可溶性分析
将构建好的重组质粒(pET-32a-TroJAK3)转化至E.coli BL21感受态细胞,挑取单克隆37℃振荡培养,加入IPTG使目的蛋白表达。经SDSPAGE后,未加入IPTG蛋白有少量表达,经终浓度为1 mmol/L IPTG诱导的重组蛋白高表达,与未诱导的重组蛋白对比发现在140 ku处有明显的条带,与预期目的蛋白的条带相符。诱导后经超声破碎,将上清和沉淀进行SDS-PAGE,结果显示,目的蛋白主要以包涵体的形式表达(图2)。
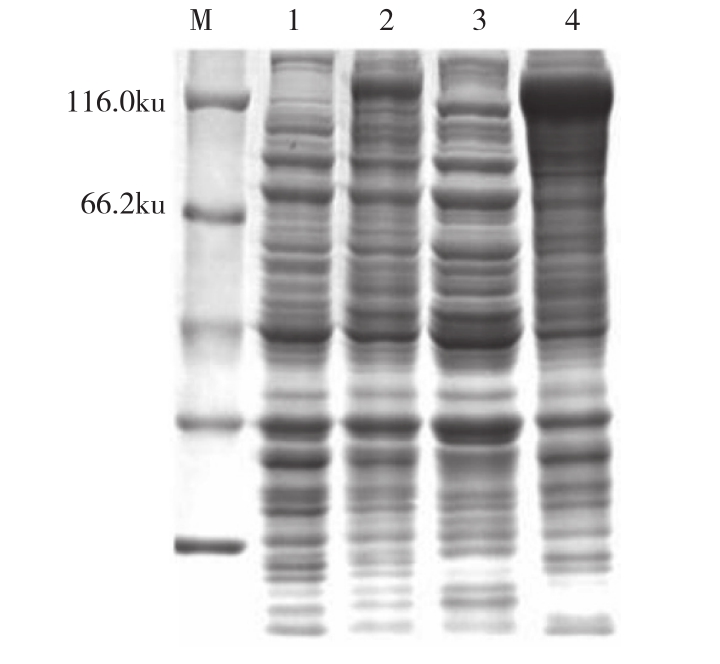
图2 TroJAK3重组蛋白的诱导表达与可溶性分析
Fig. 2 Induction expression and dissolubility of TroJAK3 recombinant protein
M:蛋白Marker;1:未诱导的重组菌;2:IPTG诱导4 h的重组菌;3:上清液;4:沉淀物
M: Protein Marker; 1: Non-reduced recombinant bacteria;2: Recombinant bacteria induced by IPTG for 4 h; 3: Supernatant; 4: Inclusion
2.3 目的蛋白纯化
目的蛋白在大肠杆菌BL21感受态细胞诱导表达后,利用Ni-IDA琼脂糖纯化树脂进行过柱,并用不同浓度的咪唑洗脱缓冲液进行梯度洗脱,将收集的样品进行SDS-PAGE检测。结果显示,用150 mmol/L咪唑洗脱缓冲液能去掉大量杂蛋白(图3)。
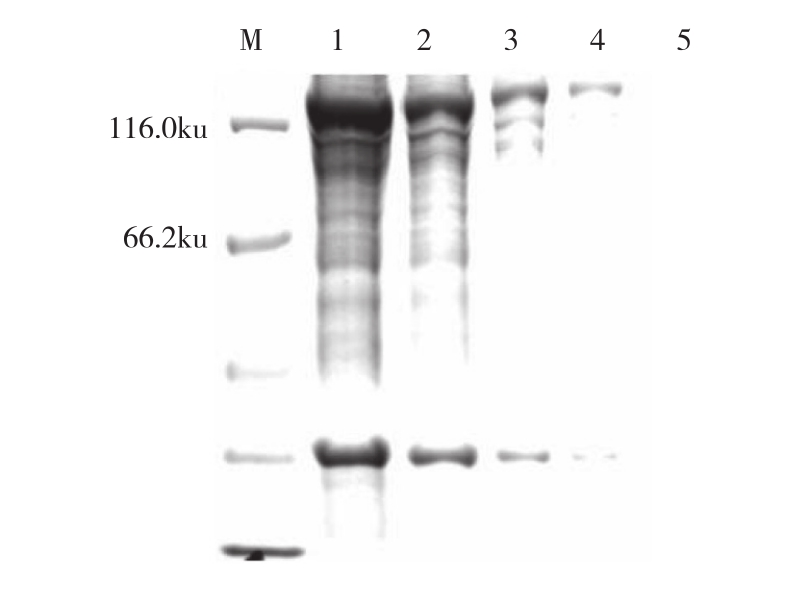
图3 TroJAK3重组蛋白的纯化
Fig. 3 Purification of TroJAK3 recombinant protein
M:蛋白Marker;1:流穿Ni-IDA树脂柱收集液;2:50 mmol/L咪唑洗脱;3:100 mmol/L咪唑洗脱;4:150 mmol/L咪唑洗脱;5:200 mmol/L咪唑洗脱
M: Protein Marker; 1: Proteins flowing through Ni-IDAresin column;2: Elution with 50 mmol/L imidazole; 3: Elution with 100 mmol/L imidazole;4: Elution with 150 mmol/L imidazole; 5: Elution with 200 mmol/L imidazole
2.4 Western blot鉴定重组蛋白
纯化的样品经SDS-PAGE后转至NC膜,进行Western blot鉴定。结果(图4)显示,140 ku处有明显的条带,与重组蛋白的大小一致,证明重组蛋白成功表达。
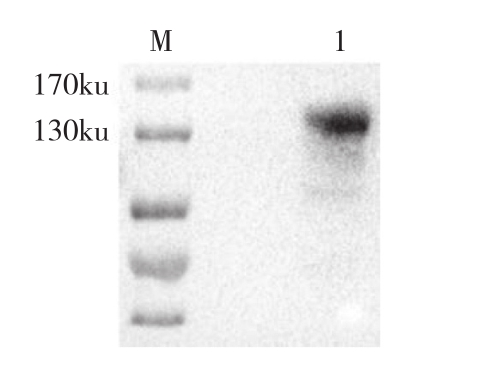
图4 TroJAK3重组蛋白Western blot鉴定
Fig. 4 Western blot identification of TroJAK3 recombinant protein
M:蛋白Marker;1:纯化的TroJAK3重组蛋白
M: Protein Marker; 1. Purified TroJAK3 recombinant protein
3 讨论
JAK3是JAK家族重要成员,可将细胞因子信号从外部环境转导至细胞核,且在调节细胞内各种活动中发挥关键性作用[1]。免疫系统中细胞因子表面受体因缺乏酪氨酸蛋白激酶活性而聚集,导致细胞不被识别,对细胞发育及功能的发挥产生影响。鱼类JAK3的研究主要集中在基因序列和正常组织的表达分析。研究表明,鲤鱼[13]、黄颡鱼[14]、复鰕虎鱼[1]和鳜鱼[16]的JAK3基因cDNA全长分别为3 739、3 817、3 524、4 634 bp,推定编码的氨基酸数目分别为1 126、1 095、1 103、1 112。正常组织分布分析显示,鲤鱼、黄颡鱼、复鰕虎鱼和鳜鱼JAK3 mRNA分别在头肾、中肾、脾脏和腮中表达量最高,但并不一致。这种差异可能与品种、年龄、生理及遗传因素有关。鱼类JAK3分子表达已有所报道,但有关鱼类JAK3蛋白功能与抗体制备的研究鲜有报导,因此对TroJAK3蛋白进行纯化,可为了解TroJAK3蛋白功能及抗体制备提供基础数据。
3.1 原核表达载体的选择
重组蛋白原核表达系统中应用最广泛的系统是大肠杆菌表达系统,原因是其背景清晰、培养周期短、培养条件简单、价格便宜和操作方便。表达菌株通常采用BL21,可以减少目的蛋白在胞内环境表达的限制,从而使目的蛋白大量表达[19-20]。大肠杆菌表达系统中应用最广泛的3种载体为pGE、pQE和pET系列表达载体,其中最高效的表达载体为pET系列[21-22]。研究表明,pET系列载体可以在IPTG诱导下高效表达,并具有产量高、表达产物易纯化等较多优点[21,23-24]。本研究选择pET-32a表达载体,将重组质粒pET-32a-JAK3转化至BL21菌株,使目的重组蛋白高效表达,也说明了pET-32a为效率较高的表达载体。
3.2 目的蛋白的存在形式
重组蛋白诱导表达成功后对样品进行超声等处理,高速离心后收集样品进行SDS-PAGE检测。与上清样品比较,沉淀样品在140 ku有明显条带,表明重组蛋白表达形式为包涵体。包涵体是稳定的蛋白质沉积,重组蛋白大量产生时会形成包涵体,其可以通过简单的物理方式和增溶的方式将其转变为可溶性的形式分离出来[25]。研究显示,包涵体蛋白表达具有高表达量和高纯度等优点,在商业化生产中得到了广泛应用[26-28]。本研究TroJAK3重组蛋白以包涵体的形式表达,并获得了较纯的重组蛋白。
4 结论
本研究通过构建pET-32a-TroJAK3原核表达载体,应用终浓度为1 mmol/L IPTG 于37℃诱导4 h,TroJAK3重组蛋白以包涵体形式表达,分子量约为140 ku。通过扩大培养重组菌、菌体破碎、洗涤包涵体、溶解包涵体、流经Ni-IDA树脂柱、梯度浓度咪唑洗脱等步骤,最终纯化得到较高纯度的TroJAK3重组蛋白。
[1] WU K, TAN X Y, XU Y H, SHI X, FAN Y F, LI D D, LIU X. JAK family members: Molecular cloning, expression profiles and their roles in leptin influencing lipid metabolism in Synechogobius hasta[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology,2017,203:122-131. doi:10.1016/j.cbpb.2016.10.004.
[2] CLARK J D, FLANAGAN M E, TELLIEZ J B. Discovery and development of Janus Kinase(JAK)inhibitors for inflammatory diseases[J].Journal of Medicinal Chemistry,2014, 57(12):5023-5038. doi:10.1021/jm401490p.
[3] 黄昊哲,张吉星,刘佳,徐云根,孙丽萍. Janus激酶及其抑制剂的研究进展[J].药学进展,2019,43(1):42-50.HUANG H Z, ZHANG J X, LIU J, XU Y G, SUN L P. Research progress of janus kinases and their inhibitors[J].Progress In Pharmaceutical Sciences,2019, 43(1):42-50.
[4] 宋舟,张立艳,董海兵,白换力,陈伟,吴帅成,伊鹏霏,付本懂,申海清,韦旭斌.JAK-STAT信号通路研究进展[J].中国畜牧兽医,2012,39(6):128-132.SONG Z, ZHANG L Y, DONG H B, BAI H L, CHEN W, WU S C, YIN P F, FU B D, SHEN H Q, WEI X F. Advances in JAK-STAT signaling pathway[J].China Animal Husbandry & Veterinary Medicine,2012,39(6):128-132.
[5] 刘忠松,李清,王立新. 2019 4月全国水产养殖病害预测预报[J].中国水产,2019(4):74-79.LIU Z S, LI Q, WANG L X. National aquaculture disease forecast in April 2019[J].China Fisheries,2019(4):74-79.
[6] 亓文静,李岩,王玉,于爱莲. IL-2通过Jak3-Stat5通路促进巨噬细胞 M1极化[J].基础医学与临床,2015,35(8):1055-1060.doi:10.16352/j.issn.1001-6325.2015.08.009.QI W J, LI Y, WANG Y, YU A L. IL-2 promotes macrophage M1 polarization via the Jak3-Stat5 signal pathway[J].Basic& Clinical Medicine,2015, 35(8):1055-1060. doi:10.16352/j.issn.1001-6325.2015.08.009.
[7] 胡若飞,徐跃洋,张二利,吴俊军. 酪氨酸蛋白激酶JAK3抑制剂研究进展[J].中国新药杂志,2015,24(9):1017-1023.HU R F, XU Y Y, ZHANG E L, WU J J. Development of JAK3 inhibitors[J].Chinese Journal of New Drugs,2015, 24(9):1017-1023.
[8] 王颍源,方盼盼,田亮,张耀东,康文清. JAK3突变相关重型联合免疫缺陷症1例报告并文献复习[J].中国免疫学杂志,2019,35(14):1760-1764. doi:10.3969/j.issn.1000-484X.2019.14.020.WANG Y Y, FANG P P, TIAN L, ZHANG Y D, KANG W Q. A case report of JAK3 mutation-associated severe immunodeficiency and literature review[J].Chinese Journal of Immunology,2019, 35(14):1760-1764. doi:10.3969/j.issn.1000-484X.2019.14.020.
[9] KROLOPP J E, THORNTON S M, ABBOTT M J. IL-15 Activates the Jak3/STAT3 signaling pathway to mediate glucose uptake in skeletal muscle cells[J].Front Physiol,2016,7:626. doi:10.3389/fphys.2016.00626.
[10] 李亮.JAK3/STAT1通路在CTGF诱导的HK-2细胞转分化中的影响[D].福州:福建医科大学,2018.LI L.Effect of JAK3/STAT1 pathway on CTGF-induced EMT in HK-2 cells[D].Fuzhou:Fujian Medical University,2018.
[11] RIESE R J, KRISHNASWAMI S, KREMER J. Inhibition of JAK kinases in patients with rheumatoid arthritis: Scientific rationale and clinical outcomes[J].Best Practice & Research in Clinical Rheumatology,2010, 24(4):513-526.
[12] 肖丽婵.成人急性淋巴细胞白血病预后分子标记IL7R和JAK3特征研究[D].南京:南京医科大学,2016.XIAO L C. Features of prognostic molecular markers IL7R and JAK3 in adult acute lymphoblastic leukemia[D].Nanjing:Nanjing Medical University,2016.
[13] YIN Z, KWANG J. Molecular cloning of a carp Jak3 from activated leukocytes[J].Veterinary Immunology and Immunopathology,2000,74(3/4):225-236. doi:10.1016/S0165-2427(00)00174-4.
[14] WU K, TAN X Y, XU Y H, CHEN Q L, PAN Y X. JAK and STAT members of yellow catfish Pelteobagrus fulvidraco and their roles in leptin affecting lipid metabolism[J].General and Comparative Endocrinology,2016,226: 14-26. doi:10.1016/j.ygcen.2015.12.014.
[15] JIN Y L, ZHOU T, LI N, LIU S K, XU X Y, PAN Y, TAN S X,SHI H T, YANG Y J, YUAN Z H, WANG W W, LUO J, GAO D Y,DUNHAM R, LIU Z J. JAK and STAT members in channel catfish:Identification, phylogenetic analysis and expression profiling after Edwardsiella ictaluri infection[J].Developmental and Comparative Immunology,2018,81:334-341. doi:10.1016/j.dci.2017.12.019.
[16] GUO C J, ZHANG Y F, YANG L S, YANG X B, WU Y Y, LIU D,CHEN W J, WENG S P, YU X Q, HE J G. The JAK and STAT family members of the mandarin fish Siniperca chuatsi: Molecular cloning,tissues distribution and immunobiological activity[J].Fish & Shell fish Immunology,2009, 27(2):349-359. doi:10.1016/j.fsi.2009.06.001.
[17] QI Z T, SUN B B, ZHANG Q H, MENG F C, XU Q Q, WEI Y C, GAO Q. Molecular cloning, structural modeling, and expression analysis of MyD88 and IRAK4 of golden pompano(Trachinotus ovatus)[J].Developmental and Comparative Immunology,2017,74:19-24.doi:10.1016/j.dci.2017.04.004.
[18] WEI Y C, HU S, SUN B B, ZHANG Q H, QIAO G, WANG Z S,SHAO R, HUANG G Q, QI Z T. Molecular cloning and expression analysis of toll-like receptor genes(TLR7, TLR8 and TLR9)of golden pompano(Trachinotus ovatus)[J].Fish & Shellfish Immunology,2017,63:270-276. doi:10.1016/j.fsi.2017.02.026
[19] 黄浩,王阳,堵国成,康振. 重组蛋白微生物表达系统的研究进展[J].生物产业技术,2019,(3):36-43.HUANG H, WANG Y, DU G C, KANG Z. Research progress in microbial expression systems for recombinant protein production[J].Biotechnology & Business,2019,(3):36-43.
[20] 祁浩,刘新利. 大肠杆菌表达系统和酵母表达系统的研究进展[J].安 徽 农 业 科 学,2016,44(17):4-6,52. doi:10.13989/j.cnki.0517-6611.2016.17.002.QI H, LIU X L. Research progress of expression systems of escherichia coli and yeast[J]. Journal of Anhui Agricultural Sciences,2016, 44(17):4-6,52. doi:10.13989/j.cnki.0517-6611.2016.17.002.
[21] 郭林红,周炜. 人钾离子通道调节蛋白的原核表达及纯化[J].中国免疫学杂志,2019,35(11):1348-1353. doi:10.3969/j.issn.1000-484X.2019.11.013.GUO L H, ZHOU W. Prokaryotic expression and purification of human potassium channelregulator protein[J].Chinese Journal of Immunology,2019, 35(11):1348-1353. doi:10.3969/j.issn.1000-484X.2019.11.013.
[22] 韦友传,孙宝宝,陆专灵,高谦,罗廷荣. 斜带石斑鱼MyD88基因的原核表达及蛋白纯化[J].水生生物学报,2014,38(1):200-202.doi:10.7541/2014.29.WEI Y C, SUN B B, LU Z L, GAO Q, LUO T R. Prokaryotic expression and protein purification of the MyD88 gene in grouper epinephelus coioides[J].Acta Hydrobiologica Sinica,2014, 38(1):200-202.doi:10.7541/2014.29.
[23] 张永德,林勇,潘传燕,冯鹏霏,陈晓汉,罗洪林. 尼罗罗非鱼MyD88基因的表达及多克隆抗体制备[J].水产科学,2019,38(5):595-602. doi:10.16378/j.cnki.1003-1111.2019.05.003.ZHANG Y D, LIN Y, PAN C Y, FENG P F, CHEN X H, LUO H L.Prokaryotic expression and polyclonal antibody preparation of Myd88 gene in Nile Tilapia[J].Fisheries Science,2019, 38(5):595-602.doi:10.16378/j.cnki.1003-1111.2019.05.003.
[24] 何明旺,项雅婧,孙云,曹贞洁,周永灿. 卵形鲳鲹Hepcidin-5的原核表达、纯化及多克隆抗体的制备[J].海南大学学报(自然科学版),2019,37(1):34-40. doi:10.15886/j.cnki.hdxbzkb.2019.0006.HE M W, XIANG Y J, SUN Y, CAO Z J, ZHOU Y C. Prokaryotic expression,purification and polyclonal antibodypreparation of hepcidin-5 from golden pompano(Trachinotus ovatus)[J].Natural Science Journal of Hainan University,2019, 37(1):34-40.doi:10.15886/j.cnki.hdxbzkb.2019.0006.
[25] RINAS U, GARCIA-FRUITOS E, CORCHERO J L, VAZQUEZ E,SERAS-FRANZOSO J, VILLAVERDE A. Bacterial inclusion bodies:discovering their better half[J].Trends in Biochemical Sciences,2017,42(9):726-737. doi:10.1016/j.tibs.2017.01.005.
[26] 柴燕涛,姜棋予,谢国明,胡燕,邬顺全,杨锐创,貌盼勇,侯俊.包涵体蛋白3种纯化方法的比较[J].中国医药导报,2016,13(10):4-6.CHAI Y T, JIANG Q Y, XIE G M, HU Y, WU S Q, YANG R C, MAO P Y,HOU J. Comparison of three methods for purification of inclusion body protein[J].China Medical Herald,2016, 13(10):4-6.
[27] 张鹤铭,焦雪苗,甘龙站,田杰伟,田永强. 重组人白血病抑制因子的表达、包涵体复性、纯化及其活性[J].应用与环境生物学报,2018,24(1):1-6. doi:10.19675/j.cnki.1006-687x.2016.12059.ZHANG H M, JIAO X M, GAN L Z, TIAN J W, TIAN Y Q. Expression,inclusion body renaturation, purification, and activity of recombinant human leukemia inhibitory factor[J].Chinese Journal of Applied and Environmental Biology,2018, 24(1):1-6. doi:10.19675/j.cnki.1006-687x.2016.12059.
[28] VILLAVERDE A, CORCHERO J L, SERAS-FRANZOSO J,GARCIA-FRUITOS E. Functional protein aggregates: just the tip of the iceberg[J].Nanomedicine,2015, 10(18):2881-2891. doi:10.2217/nnm.15.125.