【研究意义】CO2施肥技术是实现人工栽培温室植物高产优质的重要手段之一,随着设施栽培产业的快速发展,设施内CO2施肥作为一项高产优质、抗病的技术手段越来越受到人们的关注。铁皮石斛(Dendrobium officinale)作为我国传统名贵中药材,其人工繁育和栽培技术不断成熟,但品质和产量仍参差不齐。CO2作为植物光合作用的原料,研究CO2施肥情况下铁皮石斛的光合特性、生长和有效成分的变化,对促进铁皮石斛生长与改良其产量与品质具有重要意义。【前人研究进展】铁皮石斛是兰科石斛属多年生草本附生植物,以茎入药,具有滋阴清热、益胃生津等功效,富含多糖、氨基酸、菲类、联苄类等70余种化合物,具有抗肿瘤、抗氧化和增强免疫力等作用[1-2]。铁皮石斛的弱光适应能力较强,具有明显的阴生植物特征[3],但铁皮石斛对环境中CO2 的要求较高,CO2 补偿点和CO2 饱和点都比较高[4]。大量研究表明,增加CO2浓度可显著提高葡萄、大豆、水稻、小麦等植物的生物量和产量[5-7],也能促进番茄果实、黄瓜、甜瓜中可溶性糖和淀粉的积累[8-10]。刘汉峰等[11]曾报道CO2浓度倍增能提高鼓槌石斛和金钗石斛的日均净光合速率和水分利用效率。Cho等[12]也发现增加CO2浓度能提高蝴蝶兰品种的开花质量,但高CO2浓度下铁皮石斛等兰科药用植物生长、有效成分和产量变化尚不清楚。
【本研究切入点】近年来,铁皮石斛在我国的种植范围迅速扩大,主要以大棚栽培和仿野生栽培为主,种植面积已超过6 700 hm2,产业规模达百亿元[13],但有关铁皮石斛栽培中CO2处理的研究还鲜有报道。【拟解决的关键问题】本研究参考前人在鼓槌石斛、蝴蝶兰和非洲菊上等植物上报道的CO2浓度(800 μmol/mol)[11-12,14],通过倍增铁皮石斛栽培环境中的CO2浓度,评估铁皮石斛光合特性的动态变化,以及处理180 d后铁皮石斛生长、有效成分和产量的变化,为提高其产量与品质提供理论依据。
1 材料与方法
1.1 试验材料
采用秋季分蘖的铁皮石斛(D.officinale)秋芽为试验材料,株高4~5 cm,单株叶片数4~5片,长势良好,玻璃温室中栽培1个月。
1.2 试验方法
试验于2016年5月1日至10月25日(处理时间共180 d)在广州华南师范大学兰花研究中心进行,玻璃温室顶端覆盖遮阳网(遮阳率75%),环境温度24(± 1)℃,相对湿度80%左右。栽培基质为树皮∶木炭∶小石子∶红砖细石 =4∶2∶1∶1,环境因子由浙江求是公司记录仪实时监控并记录(每隔0.5 h记录1次)。温室内CO2由钢瓶供给(纯度95%,广州气体厂提供)。选取长势一致的铁皮石斛苗,参考前人报道的最佳CO2处理浓度[11-12,14],每天7:00—17:00进行CO2倍增处理,CO2浓度为倍增的大气CO2浓度800(±50)μmol/mol,以大气CO2浓度400(±50)μmol/mol作对照,每个处理45盆,3次重复。每盆每周施用200 mL 0.5 g/L德国进口COMPO肥1次(N∶P2O5∶K2O = 30∶10∶10),每隔2 d浇水1次。
1.3 测定项目及方法
1.3.1 叶片光合指标 分别于处理后0、10、20、30、60、90、120、150、180 d随机取长势健康的第4片完全展开的功能叶(从植株顶端往下数)进行光合、形态及各项生理生长指标的测定,上午9:30—11:00,利用LI-6400便携式光合测定仪(北京力高泰科技有限公司)分别测定CO2处理和对照的铁皮石斛功能叶的光合指标,包括净光合速率(Pn)、细胞间隙CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)、水分利用效率(WUE)等,流速设定为500 mL/min。
1.3.2 生长相关参数 处理180 d后随机选取对照和CO2倍增处理植株各50株(5个重复,每个重复10株),分别测定单株苗的茎高、茎粗(电子游标卡尺测量)、叶片数、茎鲜质量、茎干质量(105 ℃杀青15 min,80 ℃烘至恒重)、单叶面积(杭州绿博YMJ-A叶面积仪测定)、比叶面积SLA(单叶面积/单叶干重)和叶片厚度(石蜡切片观测,金华科迪KD-2260石蜡切片机)。
1.3.3 叶片可溶性蛋白含量 参考Bradford[15]的方法略加改进。称取0.1 g叶片剪碎于冷冻过的研钵中,加入1 mL磷酸缓冲液(pH 7.8)和少量石英砂,在冰浴中快速研磨成匀浆,匀浆倒入离心管中,再用4 mL的磷酸缓冲液将研钵中的匀浆洗入离心管中。在4 ℃、5 000 r/min条件下离心10 min,取上清液倒入10 mL的容量瓶中,残渣加入5 mL磷酸缓冲液悬浮再离心,将上清液倒入容量瓶中混匀,定容至10 mL待测。取0.3 mL样品提取液,加入0.7 mL磷酸缓冲液(pH 7.8),再加5 mL考马斯亮蓝G-250试剂显色,摇匀,放置2 min,利用UV-2550 分光光度计测定595 nm吸光值。以牛血清蛋白为标准品绘制标准曲线。
1.3.4 有效成分含量 铁皮石斛茎的多糖含量测定参照《中华人民共和国药典》(2015年版)中的苯酚-硫酸法[16],总生物碱含量测定参照章金辉等[17]报道的方法,总黄酮含量测定参考Amri等[18]的方法,以芦丁为标准品绘制标准曲线。
总氨基酸含量测定参考鲁芹飞[19]的方法稍作改进:取0.3 g干燥的铁皮石斛茎段粉末,置于具塞试管中,加入6 mol/L盐酸10 mL,110 ℃烘箱中水解24 h,冷却过滤,滤液移至25 mL容量瓶,加水定容,然后量取10 mL移至25 mL容量瓶中,用30% NaOH调至中性,加水定容至刻度。取样液2.0 mL置25 mL试管中,加入1.0 mL磷酸盐缓冲液和1.0 mL 2%茚三酮,摇匀,沸水浴30 min,冷却加水定容至25 mL,利用UV-2550分光光度计测定570 nm吸光值。以天冬氨酸为标准品绘制标准曲线。
试验数据用Excel 2010进行统计处理并作图,利用SPSS软件进行LSD差异显著性检验。
2 结果与分析
2.1 CO2倍增处理对铁皮石斛光合特性的影响
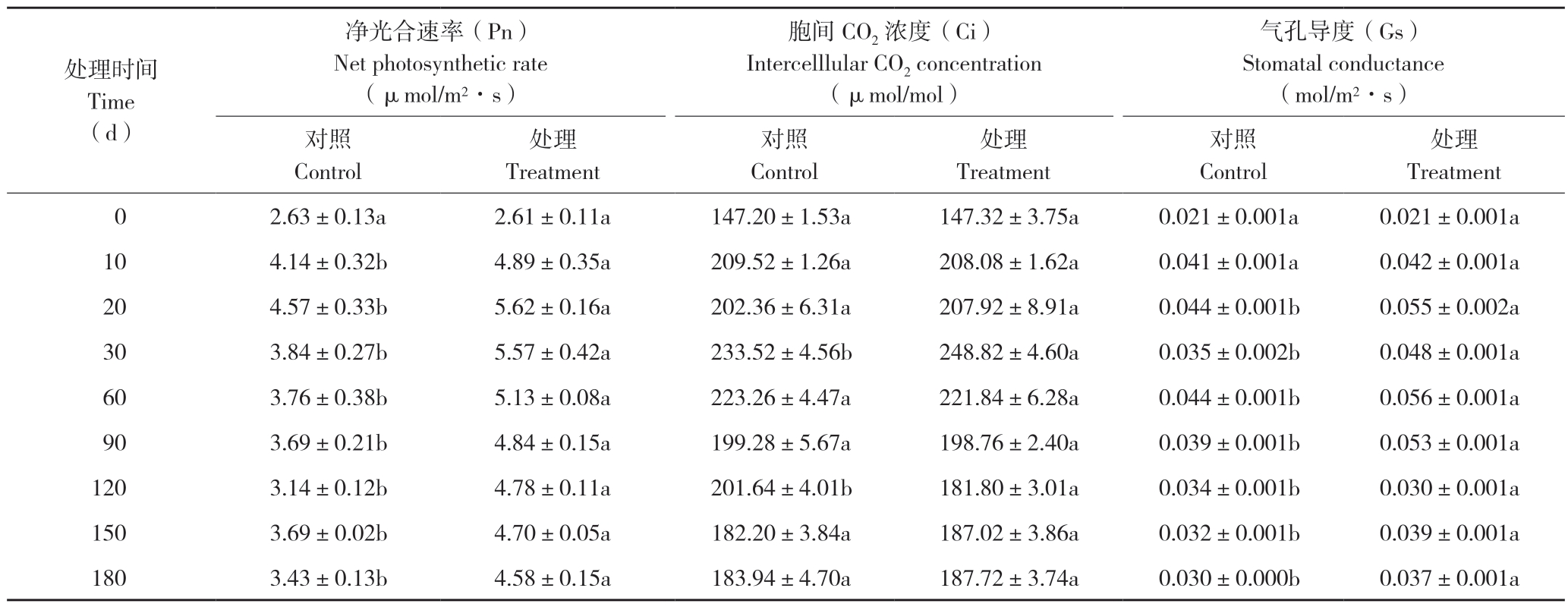
由表1可知,CO2倍增处理和对照的铁皮石斛叶片净光合速率(Pn)前期均逐渐增加,在处理后20 d达到最大值后稍有下降,并维持相对稳定的水平,这表明光合速率随着叶片的生长而相应提高,且CO2倍增处理的Pn显著高于对照;处理后30 d,CO2倍增处理和对照的Pn分别为5.57、3.84 μmol/(m2·s),差异达到最大。同时,在CO2倍增处理的180 d期间,铁皮石斛没有出现“光合适应”现象。
整体上看,CO2倍增处理对铁皮石斛叶片的胞间CO2浓度(Ci)没有显著影响(表1),CO2倍增处理及对照在30 d时均达到最大值且差异显著,CO2倍增处理的Ci比对照增加7%,在倍增处理150~180 d期间,铁皮石斛叶片的Ci与对照总体上没有显著差异,并均维持在一个相对稳定的水平,这可能与CO2倍增处理显著增加铁皮石斛叶片的Pn有关。
表1 CO2倍增处理对铁皮石斛叶片净光合速率、胞间CO2浓度和气孔导度的影响
Table 1 Effects of doubling the CO2 concentration on net photosynthetic rate,intercelllular CO2 concentration and stomatal conductance in leaves of D.officinale
注:同一指标同行数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same line of the same index represent significant differences.
处理时间Time(d)净光合速率(Pn)Net photosynthetic rate(μmol/m2·s)胞间CO2浓度(Ci)Intercelllular CO2 concentration(μmol/mol)气孔导度(Gs)Stomatal conductance(mol/m2·s)对照Control处理Treatment对照Control处理Treatment对照Control处理Treatment 0 2.63±0.13a 2.61±0.11a 147.20±1.53a 147.32±3.75a 0.021±0.001a 0.021±0.001a 10 4.14±0.32b 4.89±0.35a 209.52±1.26a 208.08±1.62a 0.041±0.001a 0.042±0.001a 20 4.57±0.33b 5.62±0.16a 202.36±6.31a 207.92±8.91a 0.044±0.001b 0.055±0.002a 30 3.84±0.27b 5.57±0.42a 233.52±4.56b 248.82±4.60a 0.035±0.002b 0.048±0.001a 60 3.76±0.38b 5.13±0.08a 223.26±4.47a 221.84±6.28a 0.044±0.001b 0.056±0.001a 90 3.69±0.21b 4.84±0.15a 199.28±5.67a 198.76±2.40a 0.039±0.001b 0.053±0.001a 120 3.14±0.12b 4.78±0.11a 201.64±4.01b 181.80±3.01a 0.034±0.001b 0.030±0.001a 150 3.69±0.02b 4.70±0.05a 182.20±3.84a 187.02±3.86a 0.032±0.001b 0.039±0.001a 180 3.43±0.13b 4.58±0.15a 183.94±4.70a 187.72±3.74a 0.030±0.000b 0.037±0.001a
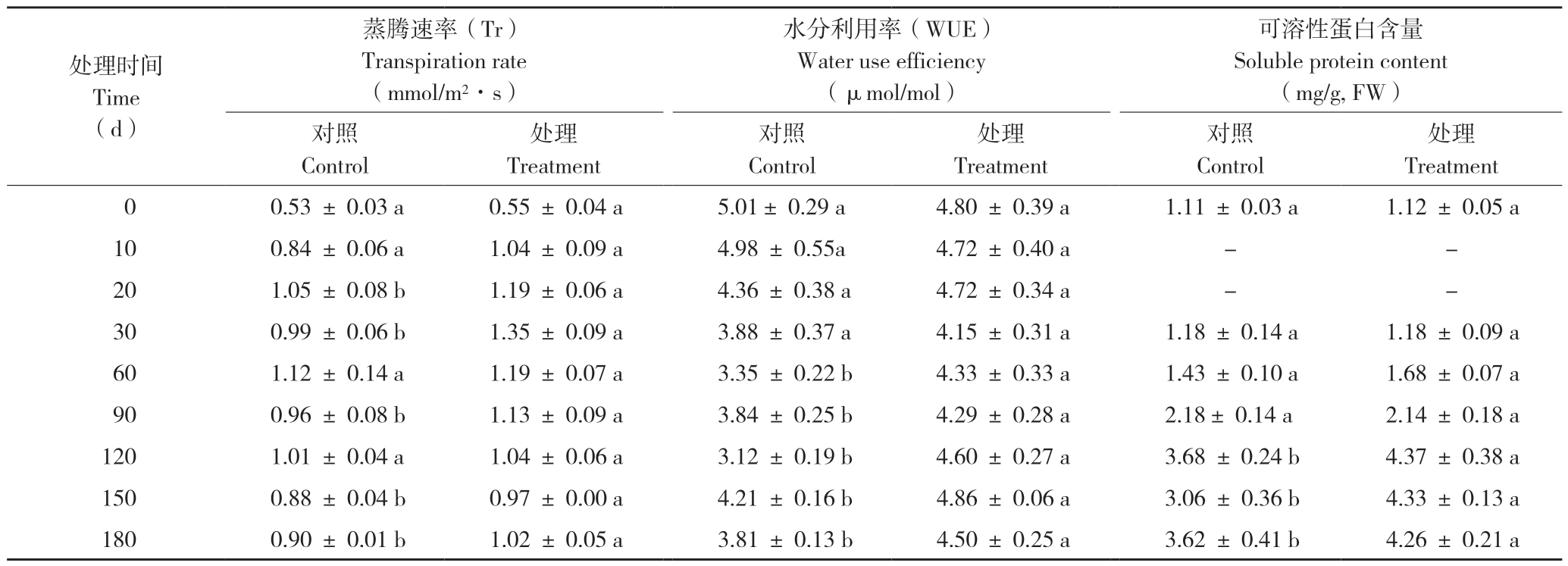
CO2倍增处理也显著增加了铁皮石斛叶片的气孔导度(Gs),平均增加20%,其中CO2倍增处理60 d后Gs达到最大值,为0.056 mol/(m2·s),比同期对照显著增加27%。气孔导度的增大必然会导致蒸腾速率(Tr)的增加。由表2可知,CO2倍增处理铁皮石斛叶片的Tr显著高于同期的对照,平均增加21%,其中CO2倍增处理的前30 d,对照和处理叶片的Tr均显著增加,在30 d时达到最大值,CO2倍增处理为1.35 mmol/(m2·s),比同期对照显著增加35%。随后,Tr呈现逐渐下降趋势,在60 d时比30 d下降13.45%,但仍然高于同期的对照。
植物水分利用效率(WUE)能在一定程度上反映植物的耗水性和抗寒性。CO2倍增处理20 d和30 d,铁皮石斛的WUE均超过对照,但差异不显著;CO2倍增处理60 d后,铁皮石斛的WUE显著高于同期对照,且呈逐渐增加的趋势;CO2倍增处理120 d,铁皮石斛的WUE出现最大差异值,比对照显著提高47%。虽然在CO2倍增条件下,铁皮石斛叶片的Tr总体上高于对照,但CO2倍增增加光合同化CO2的物质的量(Pn)的幅度远大于其引起的蒸腾散失H2O的物质的量(Tr)的幅度,进而使得CO2倍增处理的WUE在 60 d后就一直显著高于对照(表2)。
表2 CO2倍增处理对铁皮石斛叶片蒸腾速率、水分利用率和可溶性蛋白含量的影响
Table 2 Effects of doubling the CO2 concentration on transpiration rate,water use efficiency and soluble protein content in leaves of D.officinale
注:同一指标同行数据后小写英文字母不同者表示差异显著。可溶性蛋白含量每30 d测定1次,“-”表示未测定。
Note:Different lowercase letters in the same line of the same index represent significant differences.Soluble protein content is measured every 30 d, and “-”represents unmeasured.
处理时间Time(d)蒸腾速率(Tr)Transpiration rate(mmol/m2·s)水分利用率(WUE)Water use efficiency(μmol/mol)可溶性蛋白含量Soluble protein content(mg/g, FW)对照Control处理Treatment对照Control处理Treatment对照Control处理Treatment 0 0.53 ± 0.03 a 0.55 ± 0.04 a 5.01± 0.29 a 4.80 ± 0.39 a 1.11 ± 0.03 a 1.12 ± 0.05 a 10 0.84 ± 0.06 a 1.04 ± 0.09 a 4.98 ± 0.55a 4.72 ± 0.40 a - -20 1.05 ± 0.08 b 1.19 ± 0.06 a 4.36 ± 0.38 a 4.72 ± 0.34 a - -30 0.99 ± 0.06 b 1.35 ± 0.09 a 3.88 ± 0.37 a 4.15 ± 0.31 a 1.18 ± 0.14 a 1.18 ± 0.09 a 60 1.12 ± 0.14 a 1.19 ± 0.07 a 3.35 ± 0.22 b 4.33 ± 0.33 a 1.43 ± 0.10 a 1.68 ± 0.07 a 90 0.96 ± 0.08 b 1.13 ± 0.09 a 3.84 ± 0.25 b 4.29 ± 0.28 a 2.18± 0.14 a 2.14 ± 0.18 a 120 1.01 ± 0.04 a 1.04 ± 0.06 a 3.12 ± 0.19 b 4.60 ± 0.27 a 3.68 ± 0.24 b 4.37 ± 0.38 a 150 0.88 ± 0.04 b 0.97 ± 0.00 a 4.21 ± 0.16 b 4.86 ± 0.06 a 3.06 ± 0.36 b 4.33 ± 0.13 a 180 0.90 ± 0.01 b 1.02 ± 0.05 a 3.81 ± 0.13 b 4.50 ± 0.25 a 3.62 ± 0.41 b 4.26 ± 0.21 a
2.2 CO2倍增处理对铁皮石斛叶片可溶性蛋白质含量的影响
由表2可知,铁皮石斛单位叶片的可溶性蛋白质含量随着栽培时间的延长而呈增加趋势,但CO2倍增处理90 d前增加不显著。CO2倍增处理90 d后,对照和处理均出现显著增加并维持在一个稳定水平,但CO2倍增处理的增幅显著大于对照,在120 d达到最大值4.37 mg/g(FW),比对照提高19%。
2.3 CO2倍增处理对铁皮石斛生长的影响
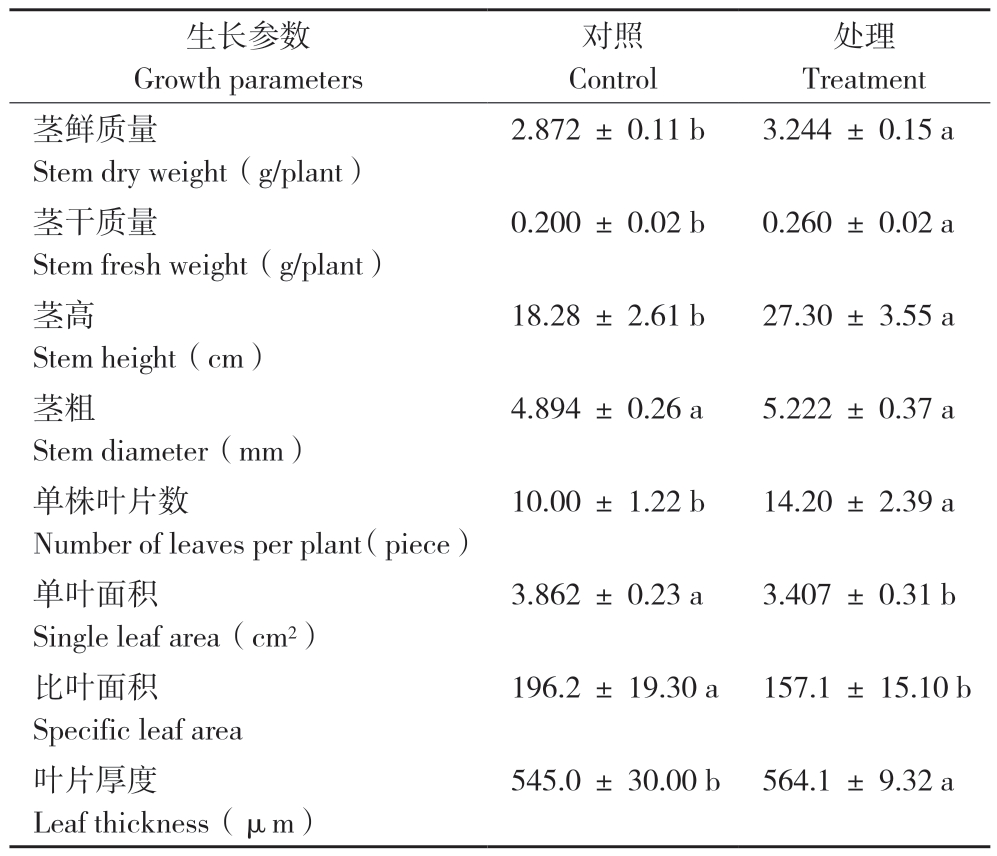
由表3可知,CO2倍增处理对铁皮石斛的生长有显著影响。在试验处理180 d后,CO2倍增处理的干质量和鲜质量均显著高于对照,分别增加30%和13%。CO2倍增虽然对茎粗无显著影响,但茎高显著增加49.3%(图1)。同时,CO2倍增处理的单株叶片数和叶片厚度也显著增加、分别提高42%和3.5%,但铁皮石斛的单叶面积和比叶面积显著降低、分别下降11.8%和20%。
表3 CO2倍增处理对铁皮石斛生长的影响
Table 3 Effects of doubling the CO2 concentration on growth of D.officinale
注:同行数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same line represent significant differences.
生长参数Growth parameters对照Control处理Treatment茎鲜质量Stem dry weight(g/plant)2.872 ± 0.11 b 3.244 ± 0.15 a茎干质量Stem fresh weight(g/plant)0.200 ± 0.02 b 0.260 ± 0.02 a茎高Stem height(cm)18.28 ± 2.61 b 27.30 ± 3.55 a茎粗Stem diameter(mm)4.894 ± 0.26 a 5.222 ± 0.37 a单株叶片数Number of leaves per plant(piece)10.00 ± 1.22 b 14.20 ± 2.39 a单叶面积Single leaf area(cm2)3.862 ± 0.23 a 3.407 ± 0.31 b比叶面积Specific leaf area 196.2 ± 19.30 a 157.1 ± 15.10 b叶片厚度Leaf thickness(μm)545.0 ± 30.00 b 564.1 ± 9.32 a

图1 CO2倍增处理180 d 后铁皮石斛的生长情况
Fig.1 Growth of D.officinale after doubling the CO2 concentration for 180 d
2.4 CO2倍增处理对铁皮石斛有效成分含量的影响
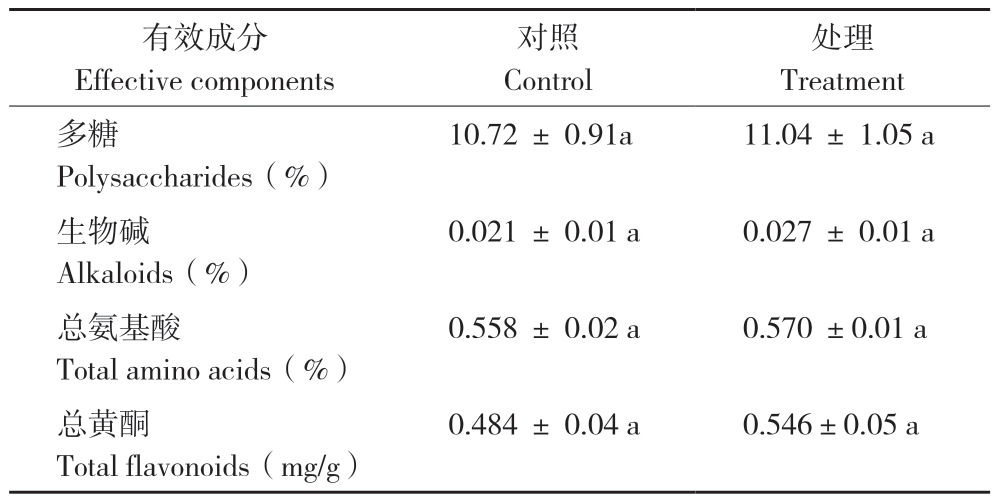
从表4可以看出,CO2倍增处理能够影响铁皮石斛有效成分的含量。CO2倍增处理180 d后,铁皮石斛茎中的多糖、生物碱、总氨基酸和总黄酮含量均有一定程度的提高,但与对照无显著差异。
表4 CO2倍增对铁皮石斛有效成分含量的影响
Table 4 Effects of doubling the CO2 concentration on the contents of effective components of D.officinale
注:同行数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same line represent significant differences.
有效成分Effective components对照Control处理Treatment多糖Polysaccharides(%)10.72 ± 0.91a 11.04 ± 1.05 a生物碱Alkaloids(%)0.021 ± 0.01 a 0.027 ± 0.01 a总氨基酸Total amino acids(%)0.558 ± 0.02 a 0.570 ±0.01 a总黄酮Total flavonoids(mg/g)0.484 ± 0.04 a 0.546±0.05 a
3 讨论
CO2作为植物光合作用的原料之一,其浓度的增加有利于提高植物的净光合效率,促进植物其他相关代谢活动的进行[20]。前人研究发现,在CO2倍增条件下,植物的净光合速率提高了19%~68.2%,气孔导度和蒸腾速率有所下降,提高了瞬时水分利用率[21-24]。本研究中,CO2倍增处理显著增加了铁皮石斛叶片的气孔导度(Gs),CO2倍增处理60 d达到最大值,这可能与铁皮石斛生境的相对湿度较高有关,水分是影响气孔运动的最主要的外界因素,在相对湿度较高的情况下,Gs会相应增大。即使在倍增条件下,胞间CO2浓度依然较低,植物提高气孔导度以便获取更多的CO2进行光合作用。
长期CO2倍增作用下植物会出现“光合适应”或“光合下调”现象[25-26]。对大豆[27]、金钗石斛[28]等的研究发现,这些植物在长期CO2倍增作用下并没有出现“光合适应”现象。本研究中,CO2倍增大大提高了铁皮石斛的光合能力,也没有出现“光合适应”现象。
大部分植物在长期CO2倍增条件下都会出现叶片可溶性蛋白质含量下降的现象,如蝴蝶兰[21]、芥菜[23]等。但另有研究表明CO2倍增引起大豆可溶性蛋白质含量增加,原因可能是豆科植物具有根瘤菌,能够从空气中获取氮素,以适应植物在高CO2浓度下快速生长对氮素的需求[29],但大多数非豆科植物并不具备这种功能。CO2倍增降低植物体内N浓度的机制还不大清楚,有学者提出CO2倍增提高了N的获取,并在一定程度上促进植物生长[30],单国雷等[31]也发现CO2倍增增加了西瓜可溶性蛋白质含量。本研究中,CO2倍增处理后期(120~180 d),铁皮石斛单位叶片可溶性蛋白质含量显著增加,这可能是由于CO2倍增条件下铁皮石斛生长较快,有机物积累增多,第4片功能叶为倍增条件下新长的叶片,加上施用的高氮肥满足了铁皮石斛新叶对N的需求,从而促进了可溶性蛋白质的积累。
Centritto等[32]研究发现,CO2倍增促进了白杨叶片的生长,增加了叶片的数量,但对叶面积没有显著影响。本研究中铁皮石斛的叶片数和叶片厚度显著增加,但其单叶面积和比叶面积明显降低。铁皮石斛茎的干质量和鲜质量分别显著提高30%和13%;茎高显著增加49.3%,但对铁皮石斛的茎粗没有显著影响。叶面积的减少有利于减少蒸腾速率进而提高植物的水分利用率。对同一物种,比叶面积的下降有助于植物在获取更多光能的同时保证自身不受强光的伤害[33]。
CO2倍增会诱导植物的营养组分发生变化,如初级生产、营养物在植物不同部位的循环、化学成分的比例和可食用部位的产量等[34-35],进而改变作物的营养价值。Högy等[36]对春小麦进行了3年CO2施肥的研究发现,CO2施肥后春小麦的地上生物量增加了11.8%,谷物产量增加了10.4%,但CO2加富后谷物显著变小,谷物中的蛋白质显著下降,因而引起氨基酸含量下降。Mamatha等[37]对番茄进行700 μmol/mol CO2施肥,发现CO2施肥增加了番茄的氨基酸含量,但CO2加富后的总酚、总黄酮、抗氧化物质和番茄红素含量都出现了下降。郑金英等[8]发现,CO2加富能够促进番茄果实中淀粉的转化和还原糖的积累,较高浓度的CO2能够促进果实生长前期合成类酶活性的增强和后期蔗糖转化酶活性的增强,且800 μmol/mol处理下成熟期果实中还原糖含量最高。张志鹏等[9]认为800 μmol/mol CO2时最经济实用,该倍增处理使可溶性固形物含量增加了6.7%,蔗糖含量增加了12.7%,果糖含量增加了6.0%。本研究中,CO2倍增处理同样也是采用800 μmol/mol的CO2,与对照相比,铁皮石斛茎的多糖、生物碱、总氨基酸和总黄酮含量均有所提高,但差异不显著。由于本次试验材料为铁皮石斛一年生茎,CO2倍增处理和对照的茎多糖含量暂未达到药典的标准[16],而随着栽培时间的延长,铁皮石斛茎中的多糖含量会不断积累,绝大部分铁皮石斛茎多糖积累量的高峰值出现二年生茎中,而铁皮石斛有效成分含量的后续变化将有待进一步研究。
4 结论
CO2倍增处理能够提高铁皮石斛的净光合速率、气孔导度、蒸腾速率和水分利用率,而处理180 d后,铁皮石斛主要药用部位茎的鲜质量、干质量和高度均显著增加,从而提高了茎产量,但茎的多糖、生物碱、总氨基酸和总黄酮等有效成分的含量与对照无显著差异。
[1] ZHANG Y,ZHANG L H,LIU J J,LIANG J L, SI J P, WU S H.Dendrobium officinale leaves as a new antioxidant source[J].Journal of Functional Foods, 2017,37:400-415.doi:10.1016/j.jff.2017.08.006.
[2] YU Z M, YANG Z Y, JAIME A, SILVA T D, LUO J P, DUAN J.Influence of low temperature on physiology and bioactivity of postharvest Dendrobium officinale stems[J].Postharvest Biology and Technology, 2019,148:97-106.doi:10.1016/j.postharvbio.2018.10.014.
[3] 张玲菊,高亭亭,章晓玲,斯金平.5个种源铁皮石斛的光合特性[J].浙江 农林大学学报,2013,30(3):359-363.doi:10.11833/j.issn.2095-0756.2013.03.009.ZHANG L J, GAO T T, ZHANG X L, SI J P.Photosynthetic characteristics of Dendrobium officinale from five provenances[J].Journal of Zhejiang Agricultural and Forestry University, 2013,30(3):359-363.doi:10.11833/j.issn.2095-0756.2013.03.009.
[4] 沈宗根,陈翠琴,王岚岚,姜波,吕洪飞.3种石斛光合作用和叶绿素荧光特性的比较研究[J].西北植物学报,2010,30(10):2067-2073.doi:CNKI:SUN:DNYX.0.2010-10-026.SHEN Z G, CHEN C Q, WANG L L, JIANG B, LYU H F.Photosynthesis and chlorophyll fluorescence characteristics of three Dendrobium species[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(10):2067-2073.doi:CNKI:SUN:DNYX.0.2010-10-026.
[5] BINDI M, FIBBI L, MIGLIETTA F.Free air CO2 enrichment(FACE)of grapevine(Vitis vinifera L.):II.growth and quality of grape and wine in response to elevated CO2 concentrations[J].European Journal of Agronomy, 2001,14(2):145-155.doi:10.1016/S1161-0301(00)00093-9.
[6] TAUSZ M, TAUSZ-POSCH S, NORTON R M,FITZGERALD G J, NICOLAS M E, SENEWEERA S.Understanding crop physiology to select breeding targets and improve crop management under increasing atmospheric CO2 concentrations[J].Environmental and Experimental Botany, 2013, 88(4):71-80.doi:10.1016/j.envexpbot.2011.12.005.
[7] MA H L, ZHU J G, XIE Z B, HAN Y.Responses of rice and winter wheat to free-air CO2 enrichment(China FACE)at rice/wheat rotation system[J].Plant Soil, 2007, 294:137-146.doi:10.1007/s11104-007-9241-5.
[8] 郑金英,孙胜,邢国明,刘洋,李靖,张振花,袁宏霞.CO2加富下温室番茄果实中糖分积累的研究[J].山西农业大学学报.2018,28(8):46-51.doi:10.13842/j.cnki.issn1671-8151.201801032.ZHENG J Y, SUN S, XING G M, LIU Y, LI J, ZHANG Z H,YUAN H Y.Elevated CO2 stimulates carbohydrate accumulation in greenhouse tomato fruits[J].Journal of Shanxi Agricultural University, 2018, 28(8):46-51.doi:10.13842/j.cnki.issn1671-8151.201801032.
[9] 张志鹏,李甜,孙胜,邢国明.CO2 加富对温室薄皮甜瓜果实品质的影响[J].中国瓜菜.2019,32(4):20-25.doi:10.16861/j.cnki.zggc.20190408.005.ZHANG Z P, LI T, SUN S, XING G M.Effect of CO2 enrichment on melon fruit quality in greenhouse[J].China Cucurbits and Vegetables.2019, 32(4):20-25.doi:10.16861/j.cnki.zggc.20190408.005.
[10] 夏永恒,崔世茂,刘杰才,付崇毅,马博,任杰.CO2加富条件下高温对温室黄瓜可溶性糖和淀粉含量的影响[J].内蒙古农业大学学报, 2013,34(4):16-20.doi:10.16853/j.cnki.1009-3575.2013.04.004.XIA Y H, CUI S M,LIU J C, FU C Y, MA B, REN J.The effects of Elevated CO2 on the content of carbohydrate and starch to high temperature in cucumber[J].Journal of Inner Mongolia Agricultural University, 2013, 34(4):16-20.doi:10.16853/j.cnki.1009-3575.2013.04.004.
[11] 刘汉峰.CO2倍增对三种石斛光合特性的影响[D].北京:中国林业大学,2012.LIU H F.Photosynthetic effects to doubled CO2 in three species of Dendrobium[D].Beijing:Beijing Forestry University, 2012.
[12] CHO A R, SONG S J, CHUNG S W, KIM Y J.CO2 enrichment with higher light level improves flowering quality of Phalaenopsis Queen Beer‘Mantefon’[J].Scientia Horticulturae, 2019, 247:356-361.doi:10.1016/j.scienta.2018.12.030.
[13] 陈晓梅, 田丽霞,单婷婷,孙乐,郭顺星.铁皮石斛种质资源和遗传育种研究进展[J].药学学报,2018, 53(9):1493-1503.doi:10.16438/j.0513-4870.2018-0286.CHEN X M, TIAN L X, SHAN T T, SUN L, GUO S X.Advances in germplasm resources and genetics and breeding of Dendrobium officinale[J].Acta Pharmaceutica Sinica, 2018, 53(9):1493-1503.doi:10.16438/j.0513-4870.2018-0286.
[14] XU S P, ZHU X S, LI C, YE Q S.Effects of CO2 enrichment on photosynthesis and growth in Gerbera jamesonii[J].Scientia Horticulturae, 2014, 177:77-84.doi:10.1016/j.scienta.2014.07.022.
[15] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry, 1976, 72:247-254.doi:10.1016/0003-2697(76)90527-3.
[16] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China[M].Beijing:China Medical Sciences Press, 2015 .
[17] 章金辉,王再花,李杰,叶庆生,朱根发.大苞鞘石斛与铁皮石斛主要活性成分比较分析[J].热带作物学报,2015,36(12):2192-2197.doi:10.3969/j.issn.1000-2561.2015.12.014.ZHANG J H, WANG Z H, LI J, YE Q S, ZHU G F.Comparative analysis of main active ingredient contents between Dendrobium warkianum and Dendrobium catenatum[J].Chinese Journal of Tropical Crops,2015, 36(12):2192-2197.doi:10.3969/j.issn.1000-2561.2015.12.014.
[18] AMR I Z, ZAOUAY F, L A ZR EG-AR EF H, SOLTANA H.Phytochemical content, fatty acids composition and antioxidant potential of different pomegranate parts:comparison between edible and non edible varieties grown in Tunisia[J].International Journal of Biological Macromolecules, 2017, 104:274-280.doi:10.1016/j.ijbiomac.2017.06.022.
[19] 鲁芹飞.铁皮石斛质量评价及干燥工艺研究[M].广州:广州中医药大学, 2014.LU Q F.Study on quality standards and drying methods of Dendrobium candidum[M].Guangzhou:Guangzhou University of Chinese Medicine, 2014 .
[20] DRAKE B G, GONE LEZMELER M A, LONG S P.More efficient plants:A consequence of rising atmospheric CO2[J].Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48(4):609-639.doi:10.1146/annurev.arplant.48.1.609.
[21] 李华云.CO2倍增对蝴蝶兰(Phalaenopsis)生长发育的影响[D].广州:华南师范大学,2007.LI H Y.Effects of CO2 enrichment on the growth and development of Phalaenopsis[D].Guangzhou:South China Normal University, 2007.
[22] MAMTHA H, RAO N K S, LAXMAN R H, SHIVASHANKARA K S, BHATT R M, PAVITHRA K C.Impact of elevated CO2 on growth,physiology, yield and quality of tomato(Lycopersicon esculentum Mill)cv.Arka Ashish[J].Photosynthetica, 2014, 52(4):519-528.doi:10.1007/s11099-014-0059-0.
[23] RUHIL K, SHEEBA, AHMAD A, IQBAL M, TRIPATHY B C.Photosynthesis and growth responses of mustard(Brassica junceaL.cv Pusa Bold)plants to free air carbon dioxide enrichment(FACE)[J].Protoplasma, 2015, 252(4):935-946.doi:10.1007/s00709-014-0723-z.
[24] 吉燕.CO2倍增对红掌(Anthurium andraeanum)光合速率和生长发育的影响[D].广州:华南师范大学,2010.JI Y.Effects of CO2 enrichment on photosynthetic rate and growth of Anthurium andraeanum[D].Guangzhou:South China Normal University, 2010.
[25] LONG S P, AINSWORTH E A, ROGER A, ORT D R.Rising atmospheric carbon dioxide:plants FACE the future[J].Annual Review of Plant Biology, 2004, 55(1):591-628.doi:10.1146/annurev.arplant.55.031903.141610.
[26] AINSWORTH E A, ROGERS A.The response of photosynthesis and stomatal conductance to rising[CO2]:mechanisms and environmental interactions[J].Plant Cell and Environment, 2007, 30(3):317-328.doi :10.1111/j.1365-3040.2007.01641.x.
[27] ROGERS A, ALLEN D J, DAVEY P A, MORGAN P B, AINSWORTH E A, BERNACCHI C J, CORNIC G, DERMODY O.Leaf photosynthesis and carbohydrate dynamics of soybeans grown throughout their lifecycle under free-Air carbon dioxide enrichment[J].Plant, 2004, 27(4):449-458.doi:10.1111/j.1365-3040.2004.01163.x.
[28] 闵伦仔.CO2倍增对金钗石斛光合速率和生长的影响[D].广州:华南师范大学,2013.MIN L Z.Effects of CO2 enrichment on photosynthetic rate and growth of Dendrobium nobile[D].Guangzhou:South China Normal University,2013.
[29] BOTTOMMLY P A, ROGERS H H, PRIOR S A.NMR imaging of root water distribution in intact Vicia faba L plants in elevated atmospheric CO2[J].Plant Cell and Environment, 1993,16(3):335-338.doi:10.1111/j.1365-3040.1993.tb00878.x.
[30] DIER M, SICKORA J, ERBS M, WEIGEL H J.Positive effects of free air CO2 enrichment on N remobilization and postanthesis N uptake in winter wheat[J].Field Crop Research, 2019, 234:107-118.doi:10.1016/j.fcr.2019.02.013.
[31] 单国雷,赵冠艳,刘娟,王安源.CO2加富对西瓜幼苗生理生化特性的影响[J].中国瓜菜,2010,23(2):28-30.doi:10.16861/j.cnki.zggc.2010.02.011.SHAN G L, ZHAO G Y, LIU J, WANG A Y.Effects of CO2 enrichment on physiological and biochemical characteristics of watermelon seedlings[J].China Cucurbits and Vegetables, 2010, 23(2):28-30.doi:10.16861/j.cnki.zggc.2010.02.011.
[32] CENTRITTO M, NASCETTI P, PETRILLI L, RASCHI A, LORETO F.Profiles of isoprene emission and photosynthetic parameters in hybrid poplars exposed to free-air CO2 enrichment[J].Plant Cell and Environment, 2015, 27(4):403-412.doi:10.1111/j.1365-3040.2003.01156.x.
[33] WILSON P J, THOMPSON K, HODGSON J G.Specific leaf area and leaf dry matter content as alternative predictors of plant strategies[J].New Phytologist, 1999, 143(1):155-162.doi:10.1046/j.1469-8137.1999.00427.x.
[34] BAZZAZ F A.The response of natural ecosystems to the rising global CO2 levels[J].Annual Review of Ecology and Systematics, 1990, 21(1):167-196.doi:0.1146/annurev.es.21.110190.001123.
[35] LUO Y, BO S U, CURRIE W S, DUKE J S.Progressive nitrogen limitation of ecosystem responses to rising atmospheric carbon dioxide[J].Bioscience, 2004, 54(8):731-739.doi:10.1641/0006-3568(2004)054.
[36] HÖGY P, WIESER H, KÖHLER P, Fangmeier A.Effects of elevated CO2 on grain yield and quality of wheat:results from a 3-year free-air CO2 enrichment experiment[J].Plant Biology, 2009, 11(1):60-69.doi:10.1111/j.1438-8677.2009.00230.x.
[37] MAMATHA H, RAO N K S, LAXMAN R H, SHIVASHANKARA K S.Impact of elevated CO2 on growth,physiology, yield and quality of tomato(Lycopersiconesculentum Mill)cv.Arka Ashish[J].Photosynthetica, 2014, 52(4):519-528.doi:10.1007/s11099-014-0059-0.