【研究意义】姬松茸(Agaricus blazei Murill)又称巴西蘑菇、柏氏蘑菇和小松菇。属于担子菌亚门层菌纲伞菌目蘑菇科蘑菇属[1]。姬松茸口感脆嫩,营养丰富,含有活性多糖体、蛋白质、维生素B1、维生素B2、烟碱酸等,具有增强免疫系统功能、降血糖、降血脂、调节血压、改善肝功能、抗过敏反应等功效[2]。因此,姬松茸作为一种珍稀的食药兼用真菌,在食品加工、医疗卫生领域具有广阔的开发和应用前景[3]。【前人研究进展】传统的姬松茸培养采用固体栽培法,但其对于固体栽培的环境条件要求严格,培养周期长,子实体产量低且不稳定,易受气候变化的影响。采用液体发酵培养姬松茸菌丝体,则可把生产周期缩短到15 d内,而且生产工艺简便,培养材料易得,产品质量易于控制,生产成本大幅度下降[4]。邹祥等研究表明,在初始pH 5.5、250 mL摇瓶装液量50 mL、接种量15%、温度26℃的培养条件下,姬松茸深层发酵结果最佳,胞外多糖最高可达 3.48 g/L,摇瓶发酵实验测定,姬松茸适宜发酵周期为108 h[5]。刘冬华等研究发现,在葡萄糖2.5%、玉米淀粉2.0%、麦芽粉1.2%、豆饼粉1.2%、硫酸镁0.1%、磷酸二氢钾0.3%,采用500 mL锥形瓶,pH自然、装量80 mL、培养温度25℃、转速200 r/min的条件下培养10 d,姬松茸发酵培养情况最佳,胞内多糖产量达到7.028 mg/mL[6]。【本研究切入点】目前,关于姬松茸液体发酵的研究主要通过评价发酵后的胞多糖产量,且研究大多集中在对碳源、氮源、碳氮比、无机盐、生长因子和 pH值等条件的单因素优化上。在实际发酵培养中,单因素之间是相互影响的,因此研究姬松茸液体发酵的多因素影响,对摸索姬松茸液体发酵的最适条件具有重要意义。【拟解决的关键问题】本研究拟对姬松茸液体发酵过程中的碳源、氮源、pH值以及无机盐等发酵条件进行单因子优化,根据单因子发酵结果进行正交组合实验,以姬松茸发酵后菌丝量的干重为评价指标,确定姬松茸液体发酵最佳条件,为姬松茸进一步深层发酵和应用提供科学参考。
1 材料与方法
1.1 试验材料
姬松茸菌(中国热带农业科学院环境与植物保护研究所保存的菌种IPPI-ABM-03),菌种以菌棒保存,实验中将菌棒中的菌接种到PDA固体斜面培养基上纯化,扩繁。
PDA固体培养基:马铃薯200 g、葡萄糖20 g、琼脂15~20 g、蒸馏水1 000 mL。
1.2 试验方法
1.2.1 姬松茸液体培养 从纯化、扩繁的姬松茸菌株固体斜面取菌,将其接种至PDA固体平板培养基,25℃培养5 d,随后用无菌打孔器(直径0.5 cm)从长满菌丝体的平皿培养基上取菌种块,接种至装有100 mL灭菌液体培养基的250 mL三角瓶中,25℃、150 r/min振荡培养5 d后,测定菌丝体生物量。每个处理设置3个平行样。
1.2.2 菌丝体生物量(菌丝体干重)的测定将发酵液用烘干至恒重的孔径为0.15 mm铜网过滤,滤网上的菌丝团经去离子水冲洗3~5遍,随后将铜网和菌丝体置于烘箱中,60℃烘干至恒重,冷却后称重,记为M1,过滤前烘干至恒重的铜丝网质量记为M0,则液体发酵后菌丝体干重为M1-M0。
1.2.3 单因素实验 (1)不同碳源对姬松茸菌丝量的影响。将PDA培养基中的葡萄糖分别更换成相同质量的羧甲基纤维素钠(CMC)、甘露醇、可溶性淀粉和蔗糖,配置成不同碳源的液体发酵培养基,考察不同碳源下姬松茸的菌丝生长情况。(2)不同氮源对姬松茸菌丝量的影响。每100 mL液体PDA培养基中分别加入0.3 g的氯化铵、硫酸铵和硝酸钾,配置不同氮源发酵培养基,考察不同氮源下姬松茸的菌丝生长情况。(3)不同pH值对姬松茸菌丝量的影响。用0.1 mol/L盐酸和0.1 mol/L氢氧化钠分别将PDA液体培养基的pH值调节至5.0、5.5、6.0、6.5、7.0,以自然条件的PDA液体培养基为对照,考察不同pH值下姬松茸的菌丝生长情况。(4)其他营养元素对姬松茸菌丝量的影响。在100 mL液体PDA培养基中分别加入0.05 g维生素B2、硫酸镁、氯化钾、磷酸二氢钠等营养物质,考察添加不同营养元素对姬松茸菌丝生长的影响。
1.2.4 正交实验 根据单因素实验结果,对不同碳源种类(葡萄糖、甘露醇、可溶性淀粉)、氮源(氯化铵、硫酸铵、硝酸钾)、pH(5.0、5.5、6.0)、其他营养元素(硫酸镁、氯化钾、磷酸二氢钠)进行正交试验,确定最适发酵培养基,选用正交表L9(34),以菌丝体生物量为考察指标,详见表1。
表 1 正交实验因素水平
Table 1 Combination of factors in orthogonal test
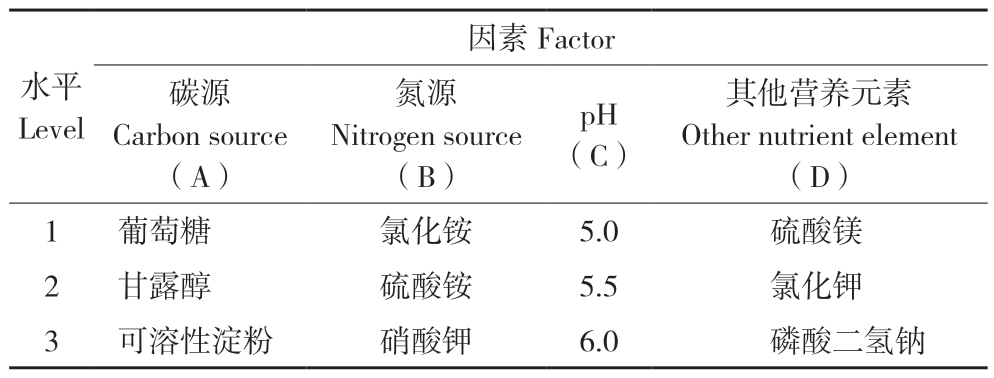
水平Level因素 Factor碳源Carbon source(A)氮源Nitrogen source(B)pH(C)其他营养元素Other nutrient element(D)1 葡萄糖 氯化铵 5.0 硫酸镁2 甘露醇 硫酸铵 5.5 氯化钾3 可溶性淀粉 硝酸钾 6.0 磷酸二氢钠
试验数据采用 Excel 2013进行处理统计,采用Origin 8.0进行作图处理。
2 结果与分析
2.1 不同碳源对姬松茸菌丝量的影响
碳是构成菌体细胞和发酵产物分子的主要骨架成分,常用的微生物碳源种类很多,主要有无机碳化合物(CO2、CO32-)、碳氢化合物(甲烷、石蜡)及各种碳水化合物(糖类、淀粉、纤维素)等[7]。本试验分别以葡萄糖、CMC、甘露醇、可溶性淀粉、蔗糖为碳源,比较培养液中姬松茸的生物生长量,结果见图1。以甘露醇为碳源时,姬松茸菌丝干重最大、达到0.3427 g,葡萄糖和可溶性淀粉次之。因此,本试验选取甘露醇、葡萄糖和可溶性淀粉进行正交实验。
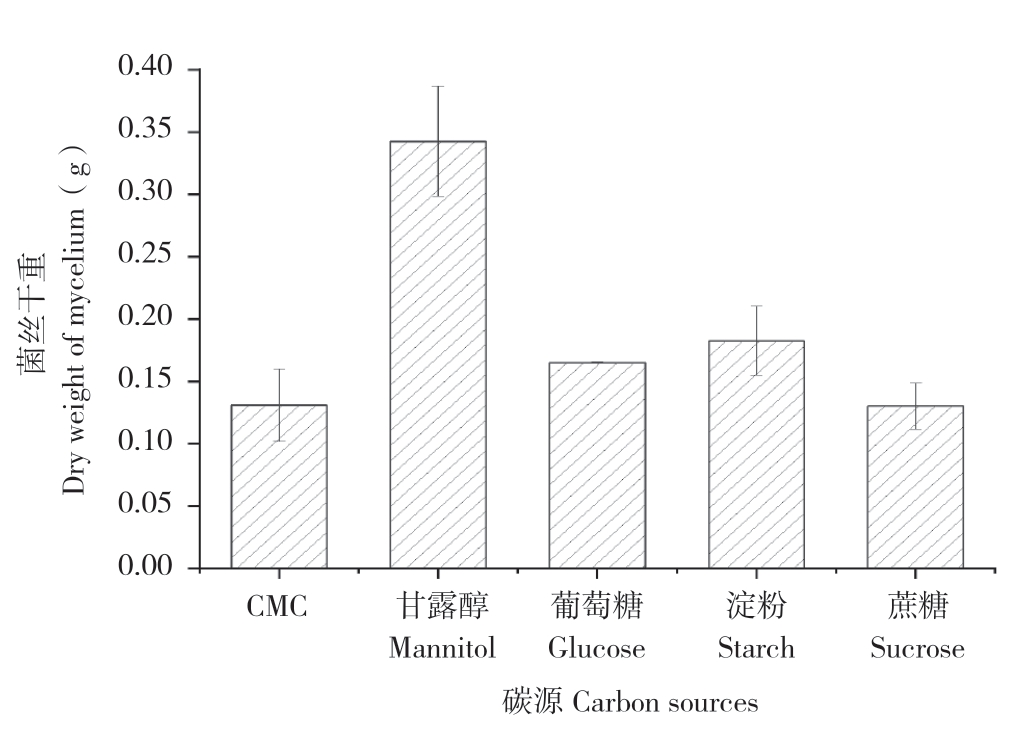
图1 不同碳源对姬松茸菌丝干重的影响
Fig.1 Effects of different carbon sources on dry weight of A.blazei mycelium
2.2 不同氮源对姬松茸菌丝量的影响
氮是微生物生长不可缺少的营养元素之一,其既是菌体的构成元素,也是代谢产物中氮源的来源。本试验分别以氯化铵、硫酸铵、硝酸钾为唯一氮源,以普通PDA液体培养基为空白对照,考察不同氮源下,姬松茸菌丝量生长情况。结果(图2)发现,添加不同氮源后,姬松茸菌丝量明显高于空白对照,其中以硝酸钾为外加氮源时效果最好,菌丝干重达到0.4718 g。后续研究选用氯化铵、硫酸铵、硝酸钾进行正交实验。
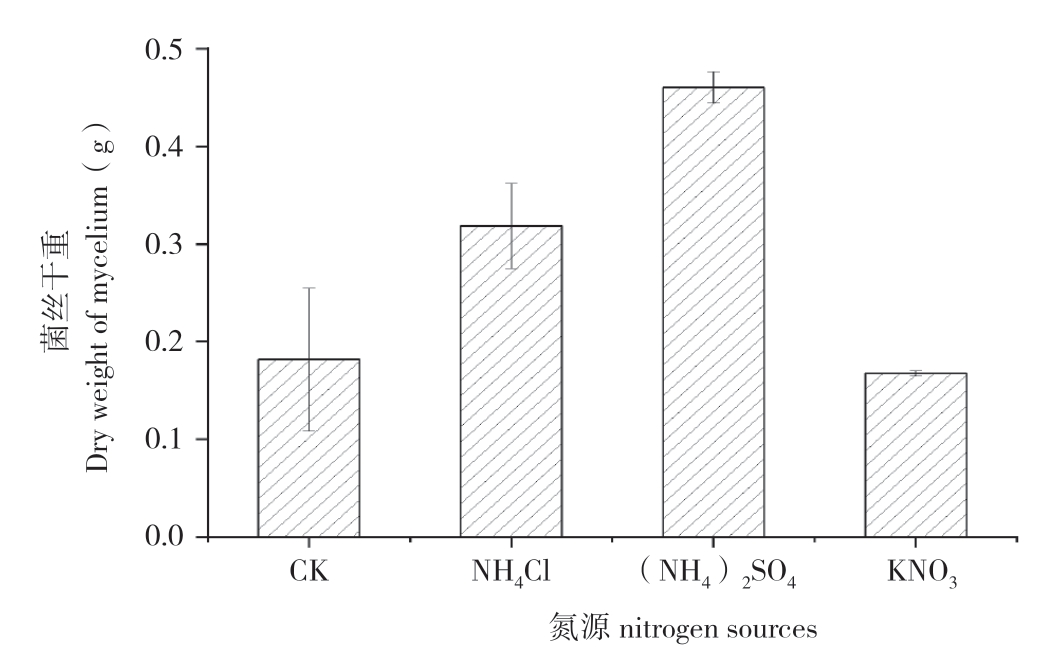
图2 不同氮源对姬松茸菌丝干重的影响
Fig.2 Effects of different nitrogen sources on dry weight of A.blazei mycelium
2.3 不同pH值对姬松茸菌丝量的影响
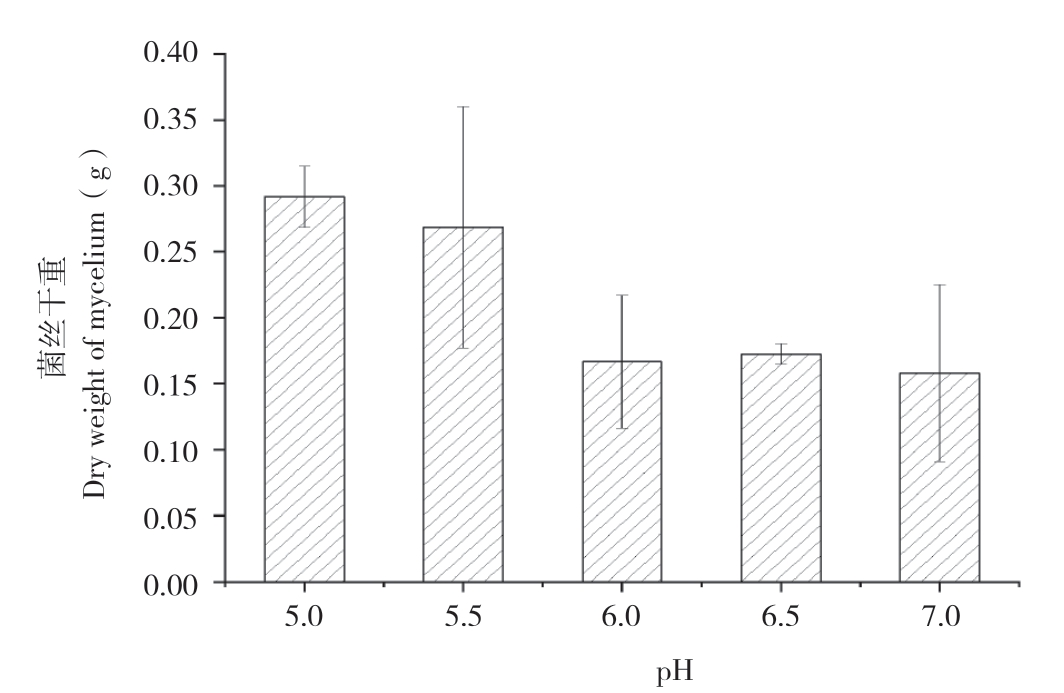
图3 不同pH值对姬松茸菌丝干重的影响
Fig.3 Effects of different pH on dry weight of A.blazei mycelium
有研究表明,姬松茸菌丝能在 pH值为3.5~9.5的基质中生长[8]。本试验设计了液体培养基的pH值范围为5.0~7.0。从图3可以看出,当pH值为5.0~6.0时,姬松茸菌丝生长最好。因此,后续研究选择pH值为5.0、5.5、6.0进行正交实验。
2.4 其他营养元素对姬松茸菌丝量的影响
除基本的碳源、氮源外,姬松茸菌丝的生长还需要一些矿质元素和其他营养元素[9]。本试验营养元素的添加对姬松茸菌丝生长均有促进作用(图4),其菌丝干重明显高于对照,其中硫酸镁、氯化钾、磷酸二氢钠的效果优于维生素B2,后续研究选取硫酸镁、氯化钾、磷酸二氢钠进行正交实验。
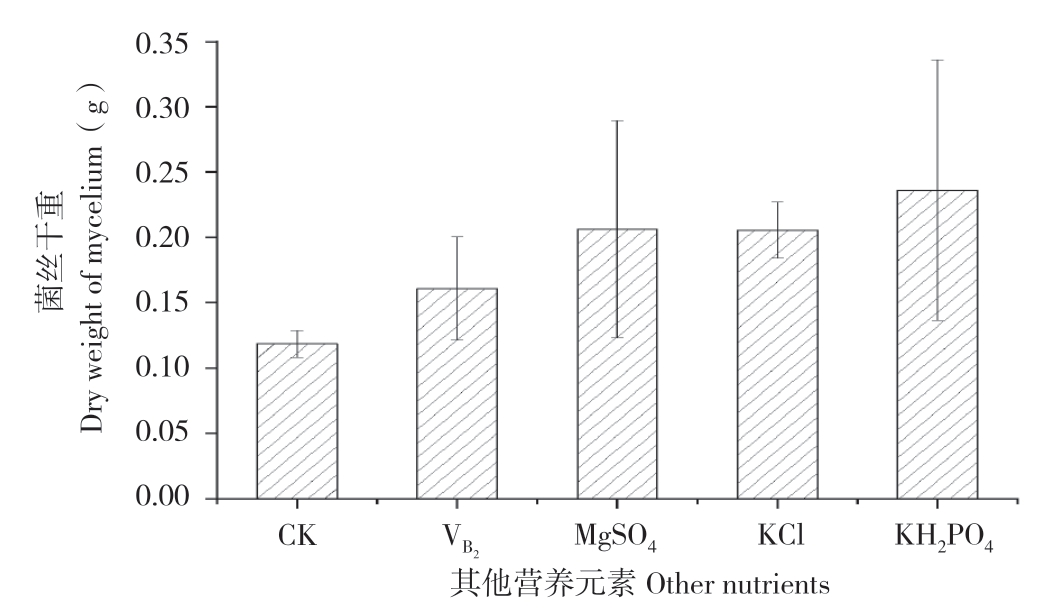
图4 其他营养元素对姬松茸菌丝干重的影响
Fig.4 Effects of other nutrients on dry weight of A.blazei mycelium
2.5 液体发酵培养基及条件优化
根据液体发酵培养基的正交实验结果及极差分析(表2)可知,本试验各因素对姬松茸菌丝产量的影响由大到小依次为碳源、营养元素、pH值和氮源,最佳因素水平组合为A1B2C3D3。根据姬松茸液体发酵培养最佳条件进行3次平行培养试验,姬松茸菌丝干重为0.4463±0.0132 g。确定的最佳培养条件与正交实验中的产量最高组合接近,且重复性良好,从而可以确定姬松茸液体发酵培养条件:葡萄糖为碳源、硫酸铵为氮源、磷酸二氢钠为其他营养元素,液体初始pH值为6.0。
表 2 正交组合结果及极差分析
Table 2 Orthogonal combination results and range analysis

序号S/N因素Factor碳源Carbon source(A)氮源Nitrogen source(B)pH(C)其他营养元素Other nutrient element(D)菌丝干重Dry weight of mycelium(g)1 1 1 1 1 0.3433 2 1 2 2 2 0.4343 3 1 3 3 3 0.4680 4 2 1 2 3 0.3529 5 2 2 3 1 0.3670 6 2 3 1 2 0.3502 7 3 1 3 2 0.3972 8 3 2 1 3 0.3961 9 3 3 2 1 0.3370 K1 0.4152 0.3645 0.3632 0.3491 K2 0.3567 0.3991 0.3747 0.3939 K3 0.3768 0.3851 0.4107 0.4057 R 0.0585 0.0346 0.0475 0.0566
3 讨论
食用菌液体发酵培养是一个复杂过程,影响菌丝生长的因素很多,主要有碳源、氮源、温度、pH值、无机盐等营养元素[10]。陈博文等研究绣球菌的液体发酵工艺条件表明,以葡萄糖为碳源、蛋白胨为氮源时对菌丝的生长速率和胞外多糖产量影响最大[11];张学秋等研究表明,以蔗糖为碳源、牛肉膏和酵母膏(质量比1∶1)作为复合氮源时,蝉拟青霉多糖含量和菌体干重均最高[12]。因此,不同种类真菌对碳源、氮源的要求不同[13-14]。本研究中,姬松茸在单因子发酵实验中,以甘露醇为外加碳源时,姬松茸菌丝量最大,其次为淀粉、葡萄糖和蔗糖。而在研究外加氮源的影响时,添加硝酸铵时姬松茸菌丝量最大,其次为硫酸铵和氯化铵,与前人研究结果存在差别。但前人研究选择的碳、氮源大多为纯天然来源的有机碳源和氮源,成分较为复杂,而本研究主要选择结构确定的化合物作为碳、氮源,因此与前人结果存在差异。
在食用菌的液体培养中,pH 值是重要的影响因素之一[15]。康林芝等[16]以菌丝体生物量为检测指标对金耳液体发酵条件进行研究,结果表明金耳菌在pH值为3.0~6.0的条件下均能生长,且pH值为5.0时菌丝量达到最大。刘青娥对褐环粘盖牛肝菌进行液体发酵条件研究考察其产多糖的能力,结果表明pH值在5.6时产糖量最大[10]。本研究中姬松茸在pH值为5.0时,菌丝量产量最高,这与前人结果基本一致,食用真菌在偏酸性环境中生长较好。
此外,矿物质营养元素也是微生物生长必不可少的成分,对真菌生长、代谢物的合成和分泌有十分重要的作用[17]。VB1和VB2对桑黄菌丝体发酵生长有着不同的促进作用,并具有协同效应。在PDA培养基中分别添加0.3 g/L VB1和VB2进行发酵,菌丝体产量提高,且多糖产量也提高[18]。本研究选用的4种营养物质均能提高姬松茸的菌丝产量,磷酸二氢钠效果最好,且3种无机盐的效果均优于维生素B1,这可能是无机盐在发酵过程中起到调节渗透压、氧化还原电位等作用,添加少量无机盐能促进菌丝体的生长。
4 结论
本研究通过单因素实验和正交实验优化了姬松茸液体发酵培养的碳源、氮源、pH值和其他营养元素,得到其最优组合,即在25℃条件下,以葡萄糖为碳源、硫酸铵为氮源、磷酸二氢钠为其他营养元素,液体初始pH值为6,培养5 d,100 mL发酵液中姬松茸菌丝干重为0.4463(±0.0132)g。本研究探索的姬松茸液体发酵条件,能实现姬松茸菌丝的快速生长,提高姬松茸菌丝生长量。相对于固体培养,时间更短,菌株发育更快,为进一步发酵提取姬松茸胞外多糖、实现其大规模工业化生产、扩大发酵培养提供技术支持。
[1] 郑美腾.福建食用菌[M].北京:中国农业出版社,2000:194-495.ZHENG M T.Edible fungi of fujian province[M].Beijing:China Agriculture Press, 2000:194-495.
[2] 王丽娟,张彦青,王勇,曹金燕,李娜.姬松茸多糖增强免疫作用及急性毒性研究[J].食品科学,2014, 35(13):258-261.doi:10.7506/spkx1002-6630-201413051.WANG L J, ZHANG Y Q, WANG Y, CAO J Y, LI N.Immuneenhancing effects and acute toxicity of Agaricus blazei polysaccharide in mice[J].Food Science, 2014, 35(13):258-261.doi:10.7506/spkx1002-6630-201413051.
[3] 韩彦艳,刁治民,杜军华,解婧,冯常红.食药用蕈菌姬松茸经济价值及发展前景的探讨[J].青海草业,2010, 19(2):21-26.doi:10.3969/j.issn.1008-1445.2010.02.007.HAN Y Y, DIAO Z M, DU J H, XIE J, FENG C H.The economic value of edible and medicinal moushroom Agaricus blazei and development prospect[J].Qinghai Prataculture, 2010, 19(2):21-26.doi:10.3969/j.issn.1008-1445.2010.02.007.
[4] 殷蓓蓓,周晓燕,李爽.姬松茸的研究与进展[J].工业微生物,2007(2):52-56.doi:10.3969/j.issn.1001-6678.2007.02.012.YIN P P, ZHOU X Y, LI S.Research advance in Agaricus blazei murill[J].Industrial Microbiology, 2007(2):52-56.doi:10.3969/j.issn.1001-6678.2007.02.012.
[5] 邹祥,张梁,章克昌.姬松茸液体培养工艺条件的研究[J].药物生物技术,20 02(6):339-343.doi:10.19526/j.cnki.1005-8915.2002.06.007.ZOU X, ZHANG L, ZHANG K C.Studies on submerged culture process of Agaricus blazei murill[J].Pharmaceutical Biotechnology, 2002(6):339-343.doi:10.19526/j.cnki.1005-8915.2002.06.007.
[6] 刘冬华,刘红,汪彬,张爱群,李咏梅.姬松茸液体深层发酵培养条件的研究[J].湖南农业大学学报(自然科学版),2007(4):475-479.doi:10.13331/j.cnki.jhau.2007.04.027.LIU D H, LIU H, WANG B, ZHANG A Q, LI Y M.Liquid submersion culture condition of Agaricus blazei[J].Journal of Hunan Agricultural University(Natural Sciences), 2007(4):475-479.doi:10.13331/j.cnki.jhau.2007.04.027.
[7] 王萍.真姬菇液体培养条件优化[D].杨凌:西北农林科技大学,2008.WANG P.Optimization of conditions for growth and polysaccharide prouction by Hypsizigus marmoreus in liquid cultivation[D].Yangling:Northwest Agricultural and Forestry University, 2008.
[8] 高瑀珑,薛景珍,江汉湖,苏立敏.姬松茸菌丝生长条件的试验研究[J].食用菌,20 0 4(2):9-10.doi:10.3969/j.issn.1000-8357.2004.02.005.GAO Y L, XUE J Z, JIANG H H, SU L M.Study of mycelial growth conditions of Agaricus blazei Murill[J].Edible Fungi, 2004(2):9-10.doi:10.3969/j.issn.1000-8357.2004.02.005.
[9] 杨淑云.姬松茸栽培研究进展[J].北方园艺,2017(2):191-195.doi:10.11937/bfyy.201702046.YANG S Y.Research advances in cultivation of Agaricus blazei Murill[J].Northern Horticulture, 2017(2):191-195.doi:10.11937/bfyy.201702046.
[10] 刘青娥.褐环粘盖牛肝菌多糖发酵工艺研究[J].广东农业科学,2015, 42(1):87-91.doi:10.16768/j.issn.1004-874X.2015.01.030.LIU Q E.Fermentation process of Suillus luteus gray polysaccharides[J].Guangdong Agricultural Sciences, 2015, 42(1):87-91.doi:10.16768/j.issn.1004-874X.2015.01.030.
[11] 陈博文,常明昌,孟俊龙,徐丽婧,张小林,孙晓瑞,骆燕,杜红霞.珍稀食用菌绣球菌液体发酵工艺条件优化[J].核农学报,2017, 31(10):1979-1985.doi:10.11869/j.issn.100 -8551.2017.10.1979.CHEN B W, CHANG M C, MENG J L, XU L J, ZHANG X L, SUN X R, LUO Y, DU H X.Optimization on liquid fermentation of Sparassis crispa, the precious edible mushroom[J].Journal of Nuclear Agricultural Sciences, 2017, 31(10):1979-1985.doi:10.11869/j.issn.100-8551.2017.10.1979.
[12] 张学秋,余晓斌,刘咏梅.蝉拟青霉液体发酵条件优化[J].微生物学杂志,2019, 39(2):18-24.doi:10.3969/j.issn.1005-7021.2019.02.003.ZHANG X Q, YU X B, LIU Y M.Optimization of liquid fermentation condition of Paecilomyces cicadae[J].Journal of Microbiology,2019, 39(2):18-24.doi:10.3969/j.issn.1005-7021.2019.02.003.
[13] 唐思煜,赵优萍,吴迪,蔡成岗,毛建卫.桑黄液体深层发酵培养基优化研究[J].浙江科技学院学报,2018, 30(3):193-198.doi:10.3969/j.issn.1671-8798.2018.03.003.TANG S Y, ZHAO Y P, WU D, CAI C G, MAO J W.Study on optimal culture medium of submerged fermentation of Phellinus linteus[J].Journal of Zhejiang University of Science and Technology, 2018, 30(3):193-198.doi:10.3969/j.issn.1671-8798.2018.03.003.
[14] 王正齐,张薄博,陈磊,关锋.响应面法优化樟芝胞外多糖的发酵条件[J].食品工业科技,2018, 39(11):99-107.doi:10.13386/j.issn1002-0306.2018.11.018.WANG Z Q, ZHANG B B, CHEN L, GUAN F.Optimization of exopolysaccharide yieldproduced by submerged fermentation of Antrodia cinnamomea by response surface methodology[J].Science and Technology of Food Industry, 2018, 39(11):100-107.doi:10.13386/j.issn1002-0306.2018.11.018.
[15] 郑晓雅,殷伟伟,张松,兰瑛.不同发酵条件对柱状田头菇菌丝产胞外多糖的影响[J].广东农业科学,2019, 46(5):25-32.doi:10.16768/j.issn.1004-874X.2019.05.004.ZHEN X Y, YIN W W, ZHANG S, LAN Y.Effects of different fermentation conditions on extracellular polysaccharides produced by mycelia of Agrocybe aegerita[J].Guangdong Agricultural Sciences,2019, 46(5):25-32.doi:10.16768/j.issn.1004-874X.2019.05.004.
[16] 康林芝,林小乔,金磊,门戈阳,刘永吉.金耳深层发酵培养基筛选和条件优化研究[J]食用菌,2019, 41(2):13-15,39.doi:10.3969/j.issn.1000-8357.2019.02.005.KANG L Z, LIN X Q, JIN L, MEN G Y, LIU Y J.Study on optimization of submerged fermentation medium and conditions for Tremella aurantialba mycelium[J].Edible Fungi, 2019, 41(2):13-15, 39.doi:10.3969/j.issn.1000-8357.2019.02.005.
[17] 苏跃稳,路鹏,郭群群,王健.食用菌液体深层发酵的研究进展[J].食品安全质量检测学报,2016, 7(2):645-650.doi:10.19812/j.cnki.jfsq11-5956/ts.2016.02.045.SUY W, LU P, GUO Q Q, WANG J.Progress in edible fungus by submerged fermentation[J].Journal of Food Safety Quality, 2016, 7(2):645-650.doi:10.19812/j.cnki.jfsq11-5956/ts.2016.02.045.
[18] 丁兴红,温成平,丁志山,范永升.桑黄液体发酵生产多糖工艺研究[J].中草药,2012, 43(5):906-909.doi:10.7501/j.issn.0253-2670.2012.05.004.DING X H, WEN C P, DING Z S, FAN Y S.Liquid fermentation of Phellinus igniarius for production of polysaccharide[J].Chinese Traditional and Herbal Drugs, 2012, 43(5):906-909.doi:10.7501/j.issn.0253-2670.2012.05.004.