嘌呤生物碱是一类含氮杂环有机化合物,茶树中的生物碱主要有咖啡碱、可可碱、茶碱及其他黄嘌呤甲基衍生物。在Camellia sinensis茶种中,咖啡碱是生物碱的特征性成分,一般占茶叶干重的2%~4%,其次是可可碱(0.05%)和茶碱(0.002%)[1]。茶叶中的咖啡碱有提神、醒脑等功效,但过多摄入则会导致失眠、心悸等负面影响,而且不适合儿童、老人和孕妇等一些特殊人群[2]。而富含可可碱的茶树因其高可可碱、低咖啡碱的特点从而避免了过多摄入咖啡碱对身体产生的负面影响而受到人们的重视。野生天然生长的高可可碱茶树种质资源在我国境内多地已陆续被发现,如广东南昆山的可可茶、福建南部山区的红芽茶、云南马关和西畴一带的厚轴茶(Camellia crassicoluma Chang)、广西大瑶山的秃房茶(Camellia gymnogyna Chang)等。广东南昆山的可可茶属于毛叶茶类(Camellia ptilophylla Chang),是20世纪80年代由植物学家张宏达教授发现的一种天然富含可可碱的茶树品种资源。以可可茶鲜叶按照传统加工工艺制成的茶叶与普通茶叶在风味品质上无明显差别,而在保健方面却具有突出的保护缺氧心肌、膳食抗氧化、抗炎和一定的抗肿瘤功效[3-4]。福建红芽茶是发现于福建省南部地区海拔700~1 000 m之间的狭窄山区中野生富含可可碱的茶树资源,当地人称之为“红叶茶”并认为饮用这种茶有减少体内热量、治疗感冒和胃痛等药用效果[5]。秃房茶也是一种野生茶树资源,在我国西南多个地区均有发现,除了高可可碱的特点外,其茶叶中还富含苦茶碱,有清热、解毒、消肿的医疗效果[6]。厚轴茶是发现于云南境内的一种富含可可碱的野生茶树资源,马关县区域内90%的厚轴茶只含有可可碱,大坝大树茶、金厂大树茶均属于厚轴茶,其成茶制品具有扩张冠状动脉、兴奋心肌、松弛气管平滑肌等作用[7-8]。这些茶种的生物碱均以可可碱为主,具有独特的保健功效,是一类稀有的茶树种质资源。本文从生化成分组成特征、可可碱生物合成与分解途径、可可碱在茶树体内富含的分子机理及其保健功效对上述4份茶种资源进行比较分析与综述,并对其资源挖掘与利用前景进行展望。
1 天然富含可可碱茶树的生化成分组成特征
1.1 生物碱单体组成特征
Jin等[5]、Teng等[6]以春茶一芽一叶中的生物碱为研究对象,以常规种茶树龙井43(LJ 43)作对照,结果表明,与茶树龙井43春茶一芽一叶中生物碱的组成特点不同,秃房茶(CGY)、可可茶(CCT)和红芽茶(HYC)中的生物碱均以可可碱为主,可可碱的质量分数显著高于咖啡碱(表1)。由表1可知,可可茶、红芽茶和厚轴茶的叶片中均检测不到咖啡碱,而可可茶、红芽茶的可可碱质量分数高达5.5%,是龙井43的近24倍;厚轴茶的可可碱质量分数在1.9%左右,低于可可茶和红芽茶,但也高出龙井43的8倍左右;秃房茶的生物碱组成与可可茶、红芽茶和厚轴茶稍有差异,主要由可可碱、咖啡碱和苦茶碱组成,其生物碱以可可碱为主,质量分数在3.7%左右,介于红芽茶和厚轴茶之间,而咖啡碱仅有0.188%,前者是后者近20倍。除此之外,秃房茶一芽一叶的苦茶碱质量分数介于可可碱和咖啡碱之间,是咖啡碱的3.2倍左右,而在此之前,苦茶碱仅被发现于Camellia assamica var.Kucha和Camellia sinensis var.puanensis Kurihara.两个茶种中[9],表明了秃房茶的又一特殊性。
表1 5份茶树品种一芽一叶的生物碱组分(%)
Table 1 Content of alkaloid in one bud with one leaf of five tea varieties
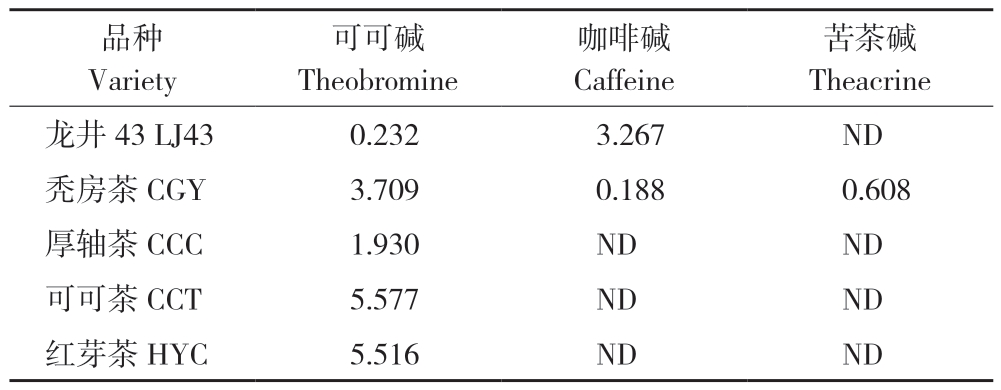
注:ND表示未检测到。
Note:ND represents non-detected.
品种Variety可可碱Theobromine咖啡碱Caffeine苦茶碱Theacrine龙井43 LJ43 0.232 3.267 ND秃房茶 CGY 3.709 0.188 0.608厚轴茶 CCC 1.930 ND ND可可茶 CCT 5.577 ND ND红芽茶 HYC 5.516 ND ND
可可碱含量与咖啡碱含量同属于数量性状,因茶树内部条件如树龄、发育阶段和外部条件如季节、温度、土壤等因素的影响会发生变化,但其总的分布规律是不变的。可可碱在这些富含可可碱的茶种体内的分布规律与Camellia sinensis茶种相同,与咖啡碱的分布规律也基本相似[10]。可可碱集中分布在新嫩的茶梢中,随着叶质的老化而逐渐减少,而在叶片之外的器官如茶花、茎梗、茶籽和根部的含量极其微少[11]。可可碱在秃房茶的第一叶中含量最高,达到39.72 mg/g,而第四叶的可可碱含量仅有14.37 mg/g,降低了63.8%左右(图1)[6]。
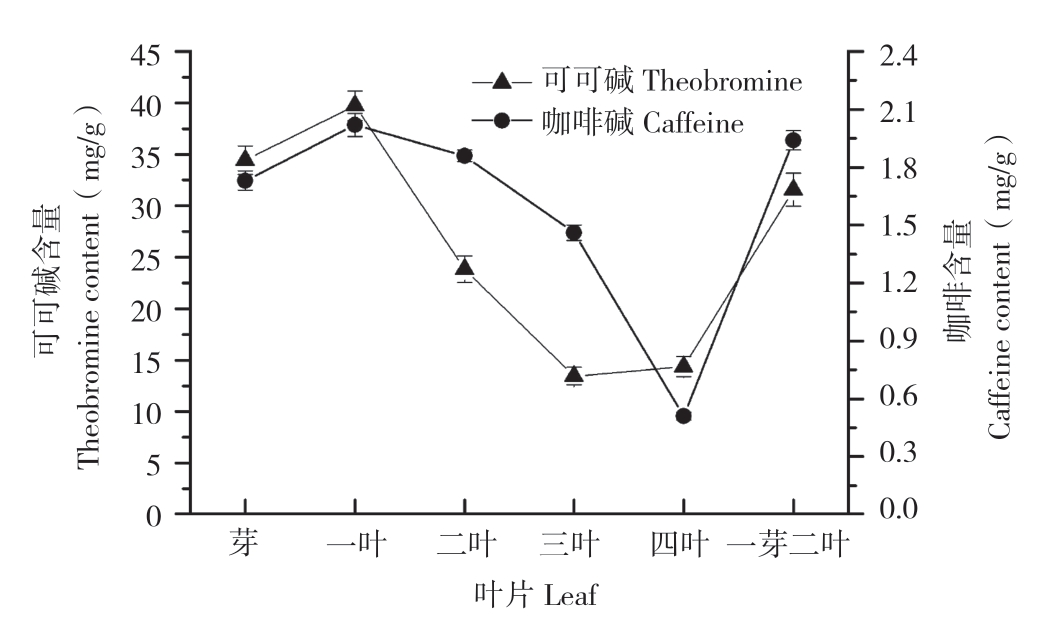
图1 秃房茶叶片的可可碱和咖啡碱含量
Fig.1 Contents of theobromine and caffeine in CGY leaves of Camellia gymnogyna Chang
1.2 其他品质成分组成特征
富含可可碱的茶树除了在生物碱的组成上与龙井43不同外,其儿茶素单体的组成和含量也与龙井43有很大的区别,而茶多酚总量、黄酮类化合物含量和氨基酸含量没有显著差异。可可茶、厚轴茶和秃房茶的茶多酚总质量分数分别为31.39%、28.22%和35.73%,黄酮类化合物质量分数分别为0.37%、1.20%和1.81%,氨基酸质量分数分别为3.48%、1.22%和2.16%[5-7]。
茶叶中的儿茶素分为简单儿茶素和酯型儿茶素,是茶叶多酚类的主要组分和茶叶保健功效的首要成分,对茶叶感官品质的形成起着重要的作用,通常占茶叶干重的12%~24%[12-14]。对于各主要儿茶素组分,传统茶树Camellia sinensis如龙井43的优势儿茶素单体为表没食子儿茶素没食子酸酯(EGCG)质量分数在6.27%,其次为表儿茶素没食子酸酯(ECG),而不含没食子儿茶素没食子酸酯(GCG),其组分由大到小为EGCG>ECG>C>GC>EGC>EC。与 龙 井43相反,可可茶和红芽茶的组分特点相似,两者的优势儿茶素均为GCG[15-16],质量分数分别为8.07%和10.20%,其次为没食子儿茶素(GC)和儿茶素(C),而EGCG、ECG和表没食子儿茶素(EGC)的质量分数都显著低于龙井43,且不含表儿茶素单体(EC),儿茶素组分由大到小为GCG>C>GC>EGCG>ECG>EGC;秃房茶的优势儿茶素为EGCG,质量分数约为龙井43的50%,其次为C(2.46%),其组分由大到小为EGCG>C>EGC>ECG>EC>GC>GCG[6](表2)。EGCG一般被认为是绿茶中最具有生物活性的成分,参与人体胆固醇代谢等多种代谢途径,而现有许多研究发现GCG抑制胆固醇的吸收效率要优于EGCG;在抗菌活性方面,GCG对芽孢杆菌(Bacillus cereusis)的抑制作用优于EGCG,对韦罗毒素(Vero toxins)的释放也有良好的抑制效果;此外,GCG的苦涩味也显著低于EGCG,说明高含量GCG能提高茶叶的滋味品质[17-18]。这表明以GCG为主要儿茶素单体的可可茶和红芽茶具有较大的资源挖掘价值。
表2 4份茶树品种一芽一叶的儿茶素组分含量(%)
Table 2 Content of catechin in one bud with one leaf of four tea varieties
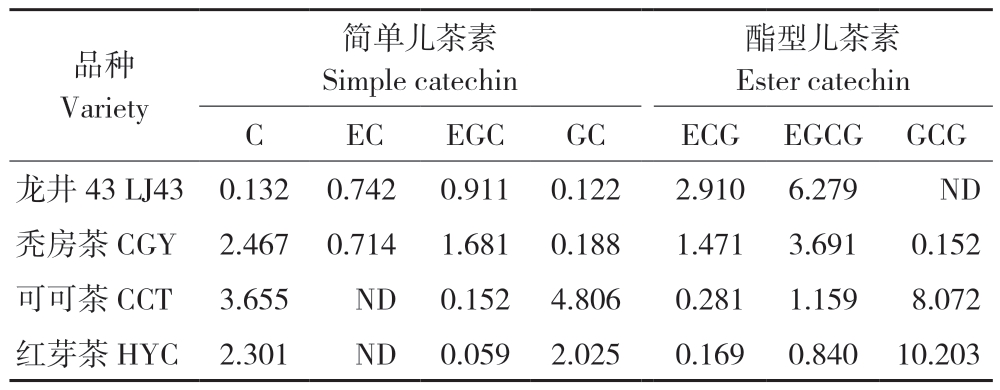
注:ND表示未检测到。
Note:ND represents non-detected.
品种Variety简单儿茶素Simple catechin酯型儿茶素Ester catechin C EC EGC GC ECG EGCG GCG龙井43 LJ43 0.132 0.742 0.911 0.122 2.910 6.279 ND秃房茶 CGY 2.467 0.714 1.681 0.188 1.471 3.691 0.152可可茶 CCT 3.655 ND 0.152 4.806 0.281 1.159 8.072红芽茶 HYC 2.301 ND 0.059 2.025 0.169 0.840 10.203
2 可可碱在茶树体内的生物代谢
2.1 可可碱的生物合成
在茶树(Camellia sinensis)体内如龙井43,可可碱是咖啡碱合成过程的中间产物,而在零咖啡碱茶树如红芽茶和可可茶中,可可碱则作为最终产物,其主要合成途径为:黄苷→7-甲基黄苷→7-甲基黄嘌呤→可可碱(3,7-二甲基黄嘌呤)[19-20]。首先,在黄苷-N-甲基转移酶的作用下,黄苷的7-N-甲基化并转化为7-甲基黄苷(8);7-甲基黄苷在黄苷酶的催化下水解生成7-甲基黄嘌呤(17);7-甲基黄嘌呤经可可碱合成酶(单甲基黄嘌呤-N-甲基转移酶)的作用进一步甲基化转化成可可碱(18)。另外,Ashihara等[21]发现在茶树幼叶中还存在另外一条可可碱合成路径,即黄苷→黄嘌呤→3-甲基黄嘌呤→可可碱(19-21)(图2)。
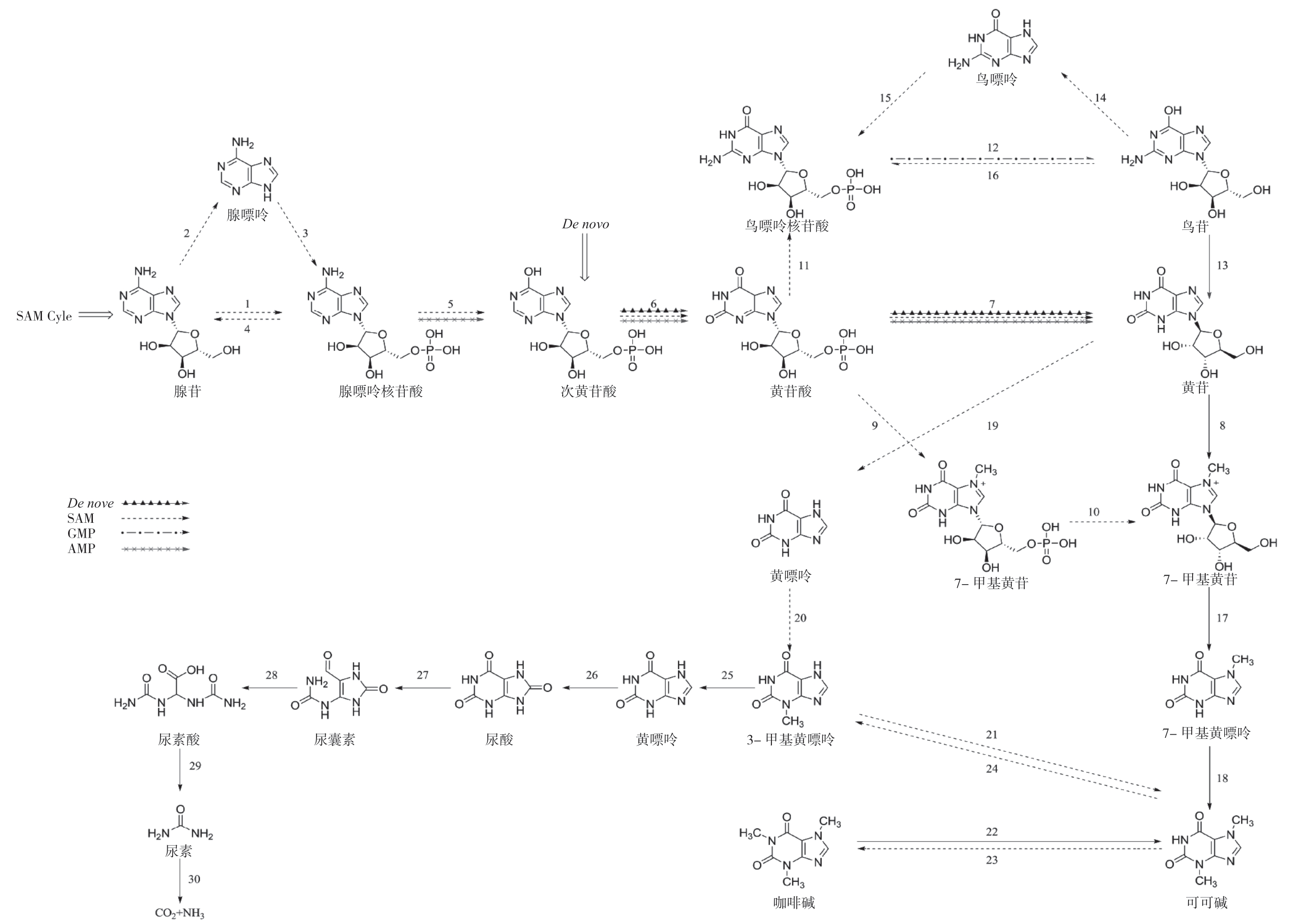
图2 可可碱的生物代谢途径
Fig.2 Biological metabolic pathway of theobromine
黄苷是嘌呤生物碱合成的起始底物,主要合成途径包括二次利用途径(De novo途径)、S-腺苷-L-蛋氨酸循环途径(SAM途径)、鸟嘌呤核苷酸途径(GMP途径)和腺嘌呤核苷酸合成途径(AMP途径)[22]。
(1)De novo途径:次黄苷酸(IMP)→黄苷酸(XMP)→黄苷。IMP在脱氢酶的作用下生成XMP(6),继而在5’-核苷酶的作用下生成黄苷(7)。其中,IMP脱氢酶是该途径的控速因子,决定了De novo途径的效率[23]。
(2)SAM途径:腺苷→AMP→IMP→XMP→黄苷。SAM是咖啡碱合成途径中三步甲基化反应的甲基供体,SAM首先被转化为S-腺苷-L-半胱氨酸(SAH),然后水解为半胱氨酸和腺苷。半胱氨酸通过SAM循环途径来补救SAM水平,腺苷则从循环中释放出来继而直接转化为AMP进入黄苷合成途径或先经腺苷核苷酶作用转化为腺嘌呤再经腺嘌呤磷酸核糖转移酶作用转化为AMP进入黄苷合成途径(5-7)。腺苷除了生成AMP进入嘌呤碱合成途径,还有一部在腺苷核苷酶的作用下转化为腺嘌呤进入腺嘌呤核苷酸池(2-4)[24]。
(3)GMP途径:GMP(鸟嘌呤核苷酸)→鸟苷→黄苷。其过程为GMP经5’-核苷酶的催化生成鸟苷(12),继而在脱氨酶的作用下生成黄苷(13)。鸟苷除了生成黄苷进入嘌呤碱合成途径,还有一部在鸟苷核苷酶的作用下转化为鸟嘌呤进入鸟嘌呤核苷酸池(14,15,12)[25]。
(4)AMP途径:AMP→IMP→XMP→黄苷。其过程为AMP在脱氨酶的作用下脱去氨基转化为IMP(5),IMP在脱氢酶的作用下生成XMP(6),继而在5’-核苷酶的作用下生成黄苷(7)(图2)。
2.2 可可碱的分解代谢
14C同位素示踪实验证明可可碱的分解首先经过两步脱甲基化转化为黄嘌呤(24,25),再经黄嘌呤降解途径最终分解为CO2和NH3(26-30),即可可碱→3-甲基黄嘌呤→黄嘌呤→尿酸→尿囊素→尿囊酸→尿素→CO2和NH3[26-27](图2)。其过程如下:可可碱(3,7-二甲基黄嘌呤)首先脱去7-甲基转化为3-甲基黄嘌呤,再经3-N-脱甲基酶的催化转化为黄嘌呤,黄嘌呤最初经黄嘌呤脱氢酶氧化生成尿酸,进一步在尿酸氧化酶的作用下氧化生成尿囊素,继而被尿囊素酶水解为尿囊酸,然后经尿囊酸酶水解生成尿素,最终在尿酶的作用下分解为CO2和NH3。可可碱等嘌呤生物碱在茶树体内的分解代谢主要发生在老叶中,其代谢产物可作为储备物质供再次利用[22]。
3 可可碱在茶树体内富含的分子机理
3.1 NMT与SAM
N-甲基转移酶(N-methyltransferase, NMT)和S-腺苷-L-蛋氨酸(S-adenosyl-L-methionine,SAM)是嘌呤碱合成的关键物质,嘌呤碱的甲基化反应是在NMT的催化作用下完成的,而NMT需依赖甲基供体SAM才能完成甲基化反应[28]。Motiff A、B和C是广泛分布在嘌呤碱合成酶氨基酸序列中的保守结构域,对识别嘌呤环N-甲基化位置起着重要的作用[29-30]。从黄苷到可可碱的生成主要涉及到两步甲基化反应,由7-甲基黄苷合成酶(催化黄苷形成7-甲基黄苷)和可可碱合成酶(3,7-二甲基黄嘌呤合成酶,催化7-甲基黄嘌呤形成可可碱)催化完成。例如,秃房茶可可碱合成酶CgcTS专一催化7-甲基黄嘌呤转化为可可碱,其转录和翻译水平以及可可碱在秃房茶中的分布规律一致,均为幼嫩叶高而老化叶低[6]。
3.2 氨基酸残基突变
在以咖啡碱为主的茶树品种中,可可碱会在咖啡碱合成酶(1,3,7-三甲基黄嘌呤合成酶)的作用下进一步甲基化并转化为咖啡碱,在茶树体内的积累很少。TCS1是最初从茶树(Camellia sinensis)幼叶中提取纯化得到的咖啡碱合成酶,其编码cDNA由1 483对碱基组成,编码369个氨基酸,既可催化7-甲基黄嘌呤转化为可可碱,也可催化可可碱转化形成咖啡碱[31-32]。HYC和CCT分别是红芽茶和可可茶的咖啡碱合成酶基因,编码365个氨基酸,仅第287位(Arg287His)氨基酸不同,但其编码蛋白酶HYC和CCT均只能催化可可碱的形成而不能以可可碱为底物继续合成咖啡碱[5],说明HYC和CCT只具有3-N-甲基化活性而不具有1-N-甲基化活性[33]。氨基酸序列比对结果表明,TCS1、HYC和CCT均具有SAM靶结合位点保守性结构域motiff A、B’、C和YFFF,但与TCS1不同的是,HYC和CCT的第221位氨基酸均为组氨酸(H),而TCS1的则为精氨酸(R)(图3),已有研究证明组氨酸在底物识别中扮演着重要的角色[34]。
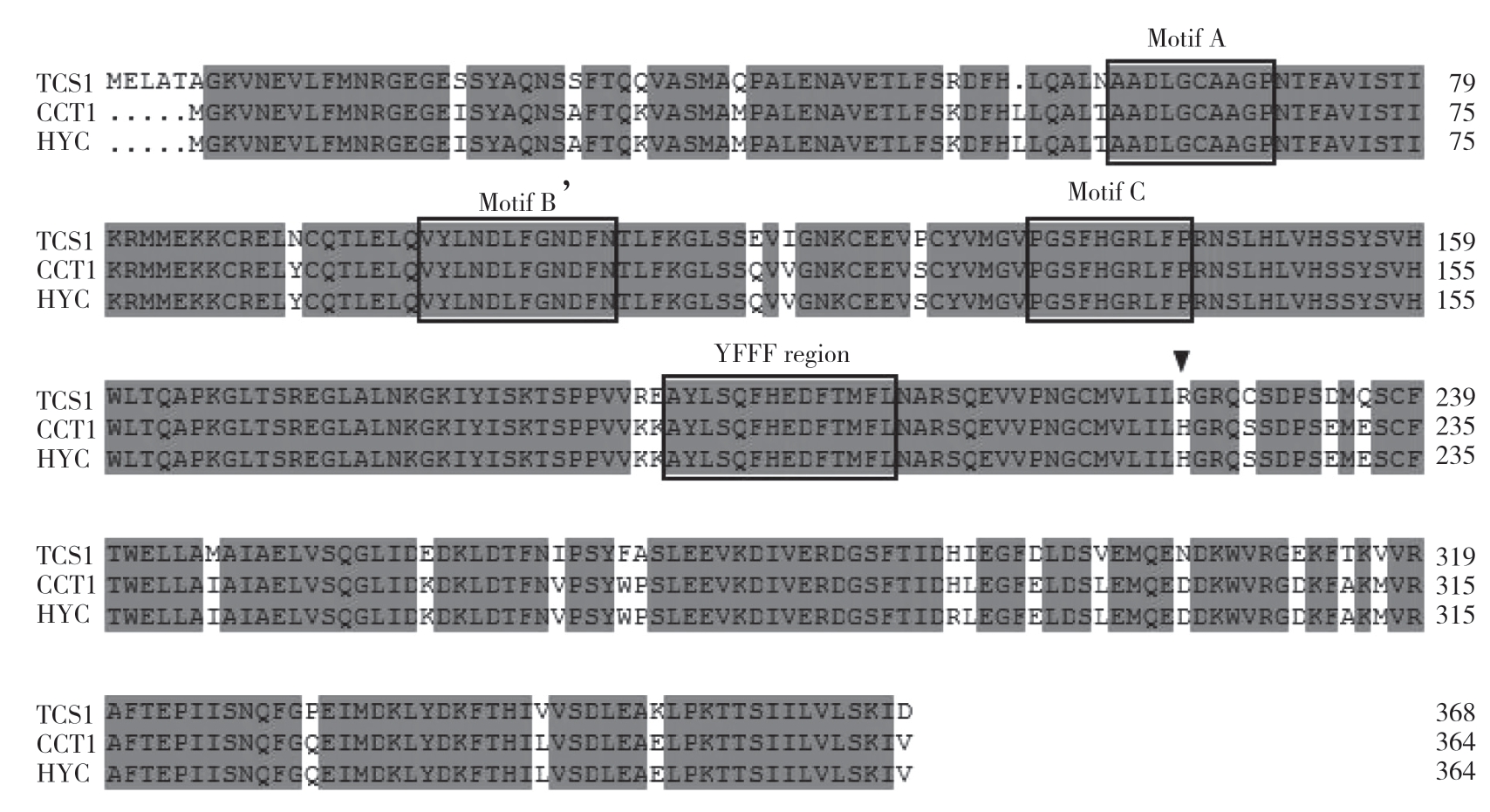
图3 咖啡碱合成酶的氨基酸序列比对结果
Fig.3 Comparison result of the amino acid sequences of caffeine synthases
因此,咖啡碱合成酶的活性位点氨基酸残基在富含可可碱的茶树体内与富含咖啡碱的茶树体内的差异可能是导致其只具有3-N-甲基化活性催化7-甲基黄嘌呤形成可可碱而无法进一步转化为咖啡碱的重要原因。针对于可可茶的体外碱基恢复突变实验结果表明,当把CCT1的第221号组氨酸(H)替换为精氨酸(R),或者把CCT1的第110~283位的氨基酸序列替换为TCS1的相应序列时,重组后的CCT1则具有了合成咖啡碱的能力[33,35]。从而,我们可以得出咖啡碱合成酶的活性位点氨基酸残基的突变改变了N-甲基转移酶的底物特异性,是导致咖啡碱合成酶无法继续合成咖啡碱并使得可可碱富集的重要分子机理。
另外,可可碱在茶树体内的生物代谢与蛋白质、嘌呤核苷酸等的代谢密切相关。在蛋白质、嘌呤核苷酸代谢旺盛的茶树新梢中,CgcTS、HYC和CCT转录水平高,可可碱以合成代谢为主,分解代谢缓慢,因此含量较高。
4 展望
富含可可碱的茶树以其低含量咖啡碱的特点使得人们在饮用其茶制品时不会产生过多摄入咖啡碱引起的负面影响。除此之外,由这些茶树鲜叶按照传统加工工艺制成的茶叶在风味品质上与普通茶叶并不存在显著的差别,而又因其高含量可可碱的特点具备了与普通茶叶不同的养生效果。可可茶被认为是一种保健饮料,当地居民称为“百岁茶”,是一种有效的解热剂,具有解毒和降低血脂的作用,而且具有突出的保护缺氧心肌、膳食抗氧化、抗炎和一定的抗肿瘤功效[36]。低咖啡碱茶产品以其特殊的功效逐渐形成一种消费主流,但市场上流通的低咖啡碱茶产品大多通过物理、化学等加工工艺来脱除茶叶咖啡碱,其加工成本高并存在一定的溶剂残留[37-38],而且在很大程度上影响到成品茶的风味品质,降低了消费者的品饮体验。而天然富含可可碱的茶树则是以其自身基因遗传特性决定的低咖啡碱茶树种质资源,其鲜叶通过传统的加工工艺便可制成低咖啡碱、高可可碱茶叶,极大地节省了再加工的成本,同时也保证了消费者的感官体验。但由于这类茶树资源稀少,人工栽培面积少,其茶产品尚不能满足市场的需求,因此深度挖掘利用富含可可碱茶树资源成了重要的课题。
茶树资源的繁殖主要有常规杂交育种、扦插、嫁接和基因工程等手段。目前对于富含可可碱茶树的繁育主要通过扦插和嫁接两种方法,但成活率偏低,且存在遗传不稳定现象,成为大面积种植的难题。因此,提高扦插成活率和遗传稳定性是扩繁这类茶树资源所亟待解决的问题。常规杂交育种培育较经济、安全、有效,红芽茶、可可茶这类茶树资源可以作为常规育种的优质母本材料,但茶树属于木本植物,生长周期长,投入成本高,达不到良好的效果[39]。基因工程育种以其周期短、定向选择的优势成为选育低咖啡碱茶树品种的重要科学方法,但茶树转基因一直是难以攻破的难题。2011年印度科学家以茶树幼苗子叶和根系为对象利用RNAi介导的方法成功获得18株转基因植株,其咖啡碱含量下降幅度达44%~61%,成为茶树转基因去咖啡碱育种的一道曙光[40-41]。随着对富含可可碱茶树体内生物碱的代谢途径和规律以及可可碱积累的分子调控机理逐渐明确,为繁育高可可碱、低咖啡碱的茶树品种奠定了理论基础。
[1] 宛晓春.茶叶生物化学[M].第三版.北京:中国农业出版社,2003:36-39.WAN X C.Tea Biochemistry[M].Third edition.Beijing:China Agriculture Press, 2003:36-39.
[2] JODRA P, LAGO R A, SANCHEZ O A J, LOPEZ S A, PEREZ L A, VEIGA H P, SAN J A F, DOMINGUEZ R.Effects of caffeine supplementation on physical performance and mood dimensions in elite and trained-recreational athletes[J].Journal of the International Society of Sports Nutrition, 2020, 17:2.doi:10.1186/s12970-019-0332-5.
[3] L I W X, X I NG F, NG W L, Z HOU Y B, SH I X G.T he complete chloroplast genome sequence of Camellia ptilophylla(Theaceae):a natural caffeine-free tea plant endemic to China[J].Mitochondrial DNA Part B, 2018, 3(1):426-427.doi:o rg/10.1080/23802359.2018.1457996.
[4] GAO X, LIN X R, LI X F, ZHANG Y Y, CHEN Z Z, LI B.Cellular antioxidant, methylglyoxal trapping, and anti-inflammatory activities of cocoa tea(Camellia ptilophylla Chang)[J].Food & Function, 2017,8(8):2836-2846.doi:10.1039/c7fo00368d.
[5] JIN J Q, CHAI Y F, LIU Y F, ZHANG J, YAO M Z, CHEN L.Hongyacha, a naturally caffeine-free tea plant from Fujian, China[J].Journal of Agricultural and Food Chemistry, 2018, 66(43):11311-11319.doi:10.1021/acs.jafc.8b03433.
[6] TENG J, YAN C Y, ZENG W, ZHANG Y Q, ZENG Z, HUANG Y H.Purification and characterization of theobromine synthase in a theobromine-enriched wild tea plant(Camellia gymnogyna Chang)from Dayao mountain, China[J].Food Chemistry, 2019, 12:125875.doi:10.1016/j.foodchem.2019.125875.
[7] 杨晓绒.野生五柱茶和厚轴茶主要生化成分的研究[D].广州:中山大学,2005.YANG X R.Studies on the main biochemistry components of wild Camellia pentastyla and Camellia crassicolumna[D].Guangzhou:Sun Yat-sen University, 2005.
[8] 唐一春,宋维希,矣兵,季鹏章,王平盛,张俊.低咖啡碱茶树种质资源的鉴定及评价[J].西南农业学报,2010, 23(4):1051-1054.doi:10.16213/j .cnki .scjas.2010.04.032.TANG Y C, SONG W X, YI B, JI P Z, WANG P S, ZHANG J.Identification and evaluation on low caffeine contentin tea germplasm[J].Southwest China Journal of Agricultural Sciences, 2010, 23(4):1051-1054.doi:10.16213/j .cnki .scjas.2010.04.032.
[9] LI M M, SUN Y, PAN S A, DENG W W, YU O, ZHANG Z Z.Engineering a novel biosynthetic pathway in Escherichia coli for the production of caffeine[J].RSC Advances, 2017, 7(89):56382-56389.doi:10.1039/c7ra10986e.
[10] 周顺珍,姚雍静,郭灿,赵华富,周国兰.不同采收时期茶叶主要生化成分的变化[J].天津农业科学,2016, 22(6):17-19.doi:10.3969/j.ssin.1006-6500.2016.06.004.ZHOU S Z, YAO Y J, GUO C, ZHAO H F, ZHOU G L.Changes of main biochemical components of tea in different harvest[J].Tianjin Agricultural Sciences, 2016, 22(6):17-19.doi:10.3969/j.ssin.1006-6500.2016.06.004.
[11] 张梁,陈琪,宛晓春,李大祥.中国茶叶生物化学研究40年[J].中国茶叶,2019, 41(9):1-10.ZHANG L, CHEN Q, WAN X C, LI D X.Research on tea biochemistry in past 40 years in China[J].China Tea, 2019, 41(9):1-10.
[12] MONIRA P, KEIKO U, AKIKO T, MAMOUR I, YORIYUKI N.Function of green tea catechins in the brain:epigallocatechin gallate and its metabolites[J].International Journal of Molecular Sciences,2019, 20(15):3630.doi:org/10.3390/ijms20153630.
[13] SUK S, KWON G T, LEE E, JANG W J, YANG H, KIM J H,THIMMEGOWDA N R, ChUNG M Y, KWON JY, YANG S, KIM J K,PARK J H Y, LEE K W.Gingerenone A, a polyphenol present in ginger,suppresses obesity and adipose tissue inflammation in high-fat diet-fed mice[J].Molecular Nutrition & Food Research, 2017, 61(10):1-37.doi:10.1002/mnfr.201700139.
[14] KHAN N, MUKHTAR H.Tea polyphenols in promotion of human health[J].Nutrients, 2018, 11(1):300585192.doi:10.3390/nu11010039.
[15] PENG J M, JIA Y, HU T Y, DU J, WANG Y, CHENG B H, LI K K.GC-(4→8)-GCG, a proanthocyanidin diimer from Camellia ptilophylla,modulates obesity and adipose tissue inflammation in high-fat diet induced obese mice[J].Molecular Nutrition & Food Research,(IP)2019-04-03.doi:10.1002/mnfr.201900082.
[16] LINX, CHEN Z, ZHANG Y, GAOX, LUOW, LIB.Interactions among chemical components of Cocoa tea(Camellia ptilophylla Chang), a naturally low caffeine-containing tea species[J].Food Function,2014, 5(6):1175-1185.doi:10.1039/c3fo60720h.
[17] CHEN C S, WEI K, WANG L Y, RUAN L, LI H L, ZHOU X G, LIN Z H, SHAN R Y, CHENG H.Expression of key structural genes of the phenylpropanoid pathway associated with catechin epimerization in tea cultivars[J].Frontiers in Plant Science, 2017, 8:702.doi:10.3389/fpls.2017.00702.
[18] HUI X, HUA S H, WU Q Q, LI H, GAO W Y.Antimicrobial mechanism of epigallocatechin gallate and gallocatechin gallate:They target 1-deoxy-d-xylulose 5-phosphate reductoisomerase, the key enzyme of the MEP terpenoid biosynthetic pathway[J].Archives of Biochemistry and Biophysics, 2017, 622:1-8.doi:10.1016/j.abb.2017.04.007.
[19] WANG W, ZHU B Y, WANG P, PENG Z, DENG W W, WU F H, HO C T, LING T J, ZHANG Z Z, WAN X C, BAO G H.Enantiomeric trimethylallantoin monomers, dimers, and trimethyltriuret:evidence for an alternative catabolic pathway of caffeine in tea plant[J].American Chemical Society, 2019, 21:5147-5151.doi:10.1021/acs.orglett.9b01750.
[20] ZHU B Y, CHEN L B, LU M Q, ZHANG J, HAN J Y, DENG W W,ZHANG Z Z.Caffeine content and related gene expression:novel insight into caffeine metabolism in Camellia plants containing low,normal and high caffeine concentrations[J].Journal of Agruritual and Food Chemistry, 2019, 67(12):3400-3411.doi:10.1021/acs.jafc.9b00240.
[21] ASHIHARA H, GILLIES F M, CROZIER A.Metabolism of caffeine and related purine alkaloids in leaves of tea(C amellia sinensis L.)[J].Plant Cell Physiology, 1997a, 38:413-419.
[22] ASHIHARA H, MIZUNO K, Yokota T, CROZIER A.Xanthine alkaloids:occurrence, biosynthesis, and function in plants[J].Progress in the Chemistry of Organic Natural Products, 2017, 105:1-88.doi:10.1007/978-3-319-49712-9-1.
[23] KEYA C A, ROZIER A, ASHIHARA H.Inhibition of caffeine biosynthesis in tea(Camellia sinensis)and coffee(Coffea arabica)plants by ribavirin[J].FEBS Lett, 2003, 554:473-477.doi:org/10.1016/S0014-5793(03)01213-4.
[24] KOSHIISHI C, KATO A, YAMA S, CROZIER A, ASHIHARA H.A new caffeine biosynthetic pathway in tea leaves:utilisation of adenosine released from the S-adenosyl-L-methionine cycle[J].FEBS Lett,2001, 499:50-54.doi:doi.org/10.1016/S0014-5793(01)02512-1.
[25] DENG W W, ASHIHARA H.Profiles of purine metabolism in leaves and roots of Camellia sinensis seedlings[J].Plant Cell Physiology,2010, 51(12):2105-2118.doi:10.1093/pcp/pcq175.
[26] ZRENNER R, STITT M, SONNEWALD U, BOLDT R.Pyrimidine and purine biosynthesis and degradation in plants[J].Annual Review of Plant Biology, 2006, 57:805-836.doi:10.1146/annurev.arplant.57.032905.105421.
[27] STASOLLA C, KATAHIRA R, THORPE T A, ASHIHARA H.Purine and pyrimidine nucleotide metabolism in higher plants[J].Journal of Plant Physiology, 2003, 160:1271-1295.doi:org/10.1078/0176-1617-01169.
[28] SUZUKI T.The participation of S-adenosy-L-methionine in the biosynthesis of caffeine in the tea plants[J].FEBS Letters, 1972, 24:18-20.doi:org/10.1016/0014-5793(72)80815-9.
[29] JOSHI C P, CHIANG V L.Conserved sequence motifs in plant S-adenosyl-L-methionine-dependent methyltransferases[J].Plant Molecular Biology, 1998, 37:663-674.doi:10.1023/A:1006035210889.
[30] NAKAYAMA F, MIZUNO K, KATO M.Biosynthesis of caffeine underlying the diversity of motif B’methyltransferase[J].Natural Production Communications, 2015, 10(5):799-801.
[31] JIN J Q, YAO M Z, MA L C, MA J Q, CHEN L.Association mapping of caffeine content with TCS1 in tea plant and its related species[J].Plant Physiology & Biochemistry, 2016, 105:251-259.doi:10.1016/j.plaphy.2016.04.032.
[32] JIN J Q, YAO M Z, MA L C, MA J Q, CHEN L.Natural allelic variations of TCS1 play a crucial role in caffeine biosynthesis of tea plant and its related species[J].Plant Physiology & Biochemistry,2016, 100:18-26.doi:10.1016/j.plaphy.2015.12.020.
[33] YONEYAMA N, MORIMOTO H, YE C X, ASHIHARA H, MIZUNO K C, KATO M.Substrate specificity of N-methyltransferase involved in purine alkaloids synthesis is dependent upon one amino acid residue of the enzyme[J].Molecular Genetics and Genomics, 2006, 275:125-135.doi:10.1007/s00438-005-0070-z.
[34] MCCARTHY A A, MCCARTHY J G.The structure of two N-Methyltransferases from the caffeine biosynthetic pathway[J].Plant Physiology, 2007, 144:879-989.doi:10.1104/pp.106.094854.
[35] JIN L, BHUIYA M W, LI M, LIU X, HAN J, DENG W, WANG M,YU O, ZHANG Z.Metabolic engineering of saccharomyces cerevisiae for caffeine and theobromine production[J].Plos One, 2014, 9(8):e105368.doi:10.1371/journal.pone.0105368.
[36] LI K K, LIU C L, SHIU H T, WONG H L, SIU W S, ZHANG C, HAN X Q, YE C X, LEUNG P C, KO C H.Cocoa tea(Camellia ptilophylla)water extract inhibits adipocyte differentiation in mouse 3T3-L1 preadipocytes[J].Scientific Report, 2016, 6:20172.doi:10.1038/srep20172.
[37] GUMMADI S N, BHAVYA B, ASHOK N.Physiology, biochemistry and possible applications of microbial caffeine degradation[J].Applied Microbiology and Biotechnology, 2012, 93(2):545-54.doi:10.1007/s00253-011-3737-x.
[38] RANATUNGE I, ADIKARY S, DASANAYAKE P, FERNANDO C D, SOYSA P.Development of a rapid and simple method to remove polyphenols from plant extracts[J].International Journal of Analytical Chemistry, 2017, 2017:7230145.doi:10.1155/2017/7230145.
[39] 王新超,王璐,郝心愿,曾建明,杨亚军.中国茶树遗传育种40年[J].中国茶叶,2019, 41(5):1-6.WANG X C, WANG L, HAO X Y, ZENG J M, YANG Y J.Research on tea genetic breeding in past 40 years in China[J].China Tea, 2019, 41(5):1-6.
[40] MOHANPURIA P, KUMAR V, AHUJA P S, YADAV S K.Producing low-caffeine tea through post-transcriptional silencing of caffeine synthase mRNA[J].Plant Molecular Biology, 2011,76(6):523-534.doi:10.1007/s11103-011-9785-x.
[41] ZHOU B, MA C, WANG H, XIA T.Biodegradation of caffeine by whole cells of tea-derived fungi Aspergillus sydowii, Aspergillus niger and optimization for caffeine degradation[J].BMC Microbiology, 2018, 18(1):53.doi:10.1186/s12866-018-1194-8.