【研究意义】水是干旱区最重要的生态限制因子,植物根从土壤不同深度吸收水分,有研究表明,植物根系吸收的水分在达到叶片或者未栓化的嫩枝之前不会发生同位素分馏,植物茎秆水分中的同位素含量可以反映土壤水分的来源,因此,通过比较植物木质部水与各潜在水源的稳定性氢氧同位素组成,即可分析出植物的水分来源情况。在研究植物水分来源的诸多方法中,氢氧稳定同位素技术被认为是精确度较高、破坏性低且最高效的一种方法[1]。【前人研究进展】自20世纪80年代以来,国外学者就开始将氢氧稳定同位素技术应用在河岸、荒漠、森林及海岸等群落植物水分来源和植物水分利用关系的研究上。Thorbum等研究表明,生长于河流边的赤桉(Eucalyptus camaldulensis)的主要水分来源是土壤水和地下水,河流径流量增大时对河水的利用率最高可达到30%,该研究指出生长在河岸边的赤桉会随着径流的改变作出相应调整[2]。Ehleringer等通过研究犹他州与亚利桑那州交界处荒漠优势植物水分来源表明,夏季降水是一年生和肉质荒漠植物的主要水分来源,而多年生植物的主要水分来源是夏季降水和深层土壤水(来自土壤中保存的冬季降雨),草本植物最多利用91%的夏季降雨,木本植物也可利用57%的夏季降雨,深根系多年生植物对夏季降雨利用较少,主要利用地下水和冬季残留的土壤水分[3]。Aravena等首次分析了智利北部山区植被对雾水的利用状况,推断雾水是智利北部山区植被的一个重要水源[4]。Dawson分析对比了加利福尼亚北海岸红杉林(Sequoia sempervirens)木质部水和雾水、雨水、土壤水、稳定氢氧同位素组成,结果表明红杉林可吸收利用34%的雾水[5]。近年来,我国学者将稳定性氢氧稳定同位素应用到西北干旱区[6-9]、喀斯特岩溶地区[10-13]、东部季风区[14-17]的植物水分来源研究,并取得了许多研究成果。巩国丽等运用吸水深度模型结合Matlab软件计算了格尔木市柴达木盆地南部白刺的平均吸水深度,结果显示格尔木白刺稳定地吸收土壤深度为60~95 cm之间的土壤水,且平均吸水深度为74 cm[18]。周雅聃等研究了油蒿和白刺在甘肃省民勤县以及内蒙古自治区磴口县、杭锦旗3个不同降水区的水分来源,发现在降水量较高的地区,油蒿和白刺主要利用浅层土壤水;在降水量较低的地区,两种植物主要利用深层土壤水和地下水[6]。孙守家等在太行山南麓通过测定枣树稳定同位素比值反映季节尺度下不同水分条件对枣树水分来源的影响,结果表明枣树对深层土壤水的利用率达50%以上[7]。赵良菊等对黑河下游荒漠河岸林生态系统植物水分来源的研究发现,在黑河下游荒漠河岸林生态系统,胡杨最多能利用93%的地下水,柽柳最多可利用90%的地下水,而苦豆子97%水分来源于80 cm土层范围内的土壤水,同时表明黑河下游天然河岸林乔木和灌木较多地利用地下水,而草本植物仍以地表水为主[8]。【本研究切入点】植物稳定同位素技术是近30年来得到迅速发展和应用的一种新技术手段,旨在通过分析植物体稳定性同位素组成来揭示地理环境要素的时空变化特征[9]。【拟解决的关键问题】本研究以氢氧稳定同位素示踪技术为依托,分析塔里木河下游极端干旱区长势良好的成年柽柳对不同深度土壤(50~70、70~90、90~110、110~130、130~150 cm)的水分利用率,通过定量化分析极端干旱区植物的水分来源,为沙漠化防治及物种保护提供科学依据。
1 材料与方法
1.1 研究区概况
塔里木河流域管理局沿塔里木河沿岸布置了9个生态监测断面,其中英苏断面(87°94′08″E,40°42′88°″N)位于塔里木河下游、若羌县铁干里克乡的其文阔尔河上,距大西海子水库的河道距离约61 km[10],其东侧为库鲁克沙漠,西侧为塔克拉玛干沙漠。该区为典型的大陆性气候,冬冷夏热,昼夜温差大,日照时间长,多风沙和浮尘天气。区内多年平均降水量在28~50 mm间,蒸发量高达2 500~3 000 mm、是降水量的69~130倍,生态环境极其脆弱。研究区天然植被主要有胡杨(Populus euphratica)、柽柳(Tamarix spp.)、黑果枸杞(Lycium ruthenicum)、铃铛刺(Halimodendron halodendron)、芦苇(Phragmites communist)、罗布麻(Poacynum hendersonii)、疏叶骆驼刺(Alhagi sparsifolia)、胀果甘草(Glycyrrhiza inflata)等[11]。
1.2 野外取样
塔里木河流域管理局在英苏断面距河道不同距离布置了11个地下水位监测井(F1~F11),我们选取F1、F3、F5、F7、F9、F11井作为研究样点,分别在这些监测井周围采集土壤样本和植物样本(图1)。本次样品采集于2019年10月15—16日,共采集到土壤样品36个、植物样品12个。在各个研究样地内,在离监测井最近处随机选取1株无人工干扰、长势良好的柽柳,利用枝剪选取长势良好的非一年生栓化枝条与柽柳叶片,在采集枝条植株附近,利用长100 cm、内径3.5 cm的手持土钻和铁锹采集土壤样品[12]。由于研究区地处极端干旱区,地表蒸发极强,0~50 cm处几乎无水分存在,故按照50~70、70~90、90~110、110~130、130~150 cm共5个层次采集土壤样品,每层3次重复,将样品分为两部分:一部分放入铝盒内,用烘干称量法测定土壤含水率;另一部分置于聚乙烯瓶内,密封并放入随身携带的冷藏箱,避免蒸发过程造成同位素分馏,带回实验室用于氢氧同位素组成分析。
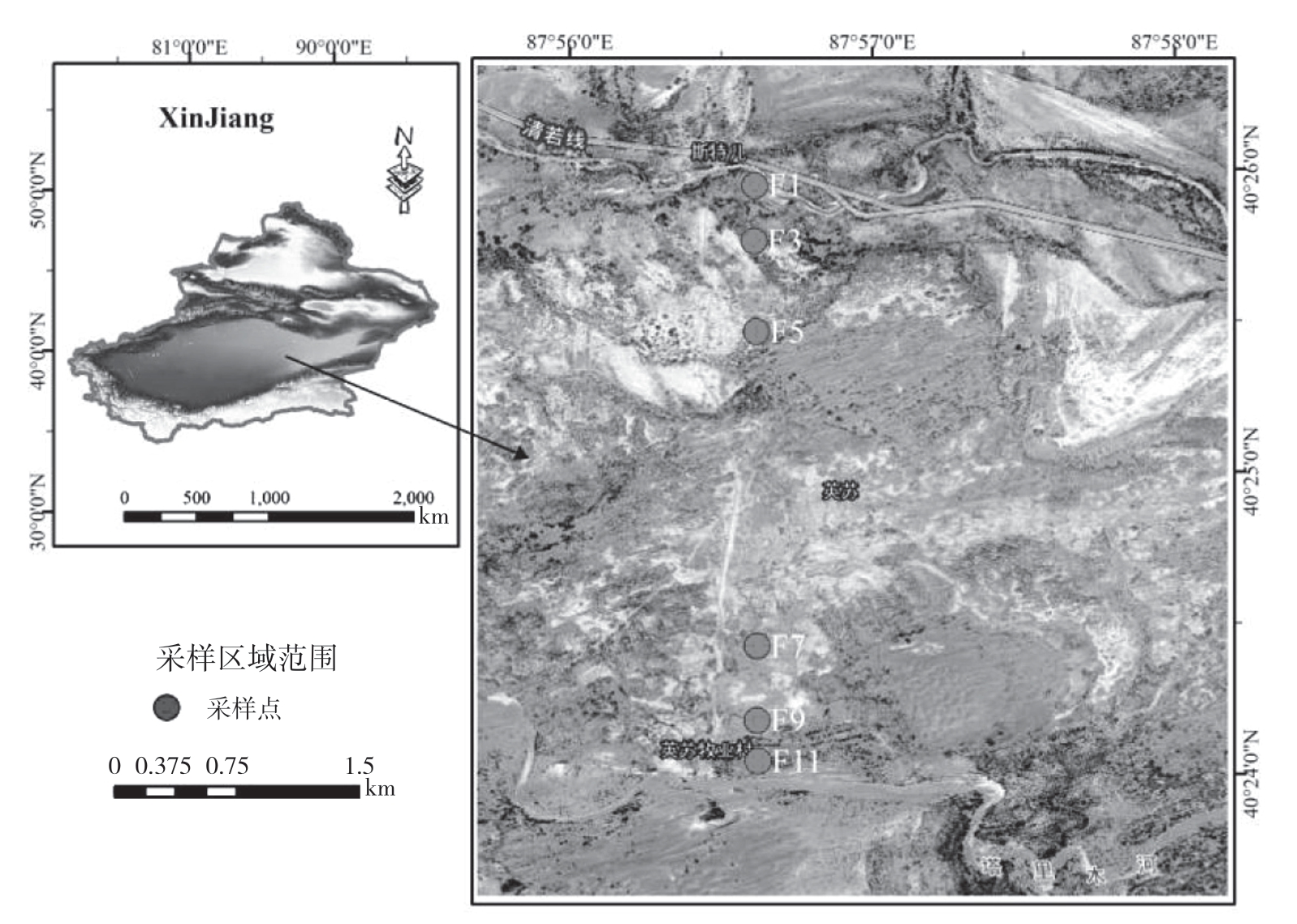
图1 研究区概况
Fig.1 Overview map of research area
1.3 样品分析
利用全自动超低压无分馏水分无损提取系统LI-2100 Pro抽提植物枝叶和土壤的水分,用LGR DLI-100液态水同位素分析仪测定抽提出的植物和土壤样品中的δD、δ18O同位素值[13],δD、δ18O的测定误差分别为±0.1‰和±0.2‰。测量土壤水氢氧稳定氢同位素比率,计算公式为:
式中,Rsample是样品中元素的重轻同位素丰度比(如D/H、16O/18O);Rstandard是国际通用标准物的重轻同位素丰度比(氢、氧稳定性同位素采用V-SMOW标准)[14]。
有研究者提出,真空蒸馏提取植物和土壤水时可能同时馏出有机物质导致数据存在误差,故利用NB、BB系数与污染物建立了修正曲线[15]。甲醇类污染修正曲线为:
δD Y=26.942787+13.888X(R2=0.9253)
δ18O Y=-13.70462-7.36932X(R2=0.9090)
乙醇类污染修正曲线为:
δD Y=97.34868-95.09271X(R2=0.9239)
δ18O Y=-34.23433+33.50574X(R2=0.9901)
将采集到的土壤样本称样放入80°恒温烘箱中不间断烘干24 h,计算土壤含水量:
1.4 数据处理
IsoSource是Donald L.Phillips创立的可以估算出各类初级生产者对消费者相对贡献率的可能范围及其平均值的分析软件[16],基于稳定同位素的质量守恒原理,有如下公式:
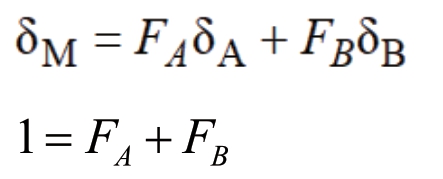
式中,FA、FB表示两种资源A、B的比例(未知量);δA、δB分别表示A、B中同位素的值(已知量);δM表示混合物(消费者)的同位素值(已知量)。以上方程组有唯一解,对其进一步扩展至3种或更多资源,方程组的解唯一对于n个同位素种类(>n+1)种资源的系统,可利用这种质量守恒来求解资源比例的多种组合的可能解[17]。
直接对比法是将植物茎秆水的同位素δD或δ18O与各潜在水源的同位素δD或δ18O直接进行对比,认为交叉点或相近区域的水源为植物主要利用的潜在水源。两者距离越近,则植物利用该水源的比例越大。直接对比法只能定性直观描述植物的主要吸水深度范围,但没有考虑不同深度土壤混合的情况,也不能定量计算出各潜在水源对植物的贡献率。
数据统计分析与作图采用Origin Pro 8软件。
2 结果与分析
2.1 不同深度土壤水分变化特征
土壤含水量如图2所示,样点F1土壤含水量在50~70 cm处有减少趋势,70~110 cm含水量极速上升,110~130 cm含水量没有变化,可能与作为吸水层有关,130~150 cm含水量增加。样点F3土壤含水量随深度的加深而增加。样点F5土壤含水量极低,在50~150 cm处最高含水量为0.95%。样点F7土壤含水量相对较低,50~90 cm处逐渐增高,90 cm处达到最大值5.88%,后迅速降低至110 cm处的1.10%,110~150 cm则无明显上升。样点F9从70 cm以下才逐渐呈上升趋势,含水量最高处为150 cm的8.27%。样点F11土壤含水量50~90 cm呈显著增加趋势,90~110 cm变化不明显,110~150 cm缓慢增加。F1、F3、F11样点的土壤含水量随深度的增加呈上升趋势,F5、F7、F9变化趋势较弱。
2.2 各样点柽柳吸水深度分析
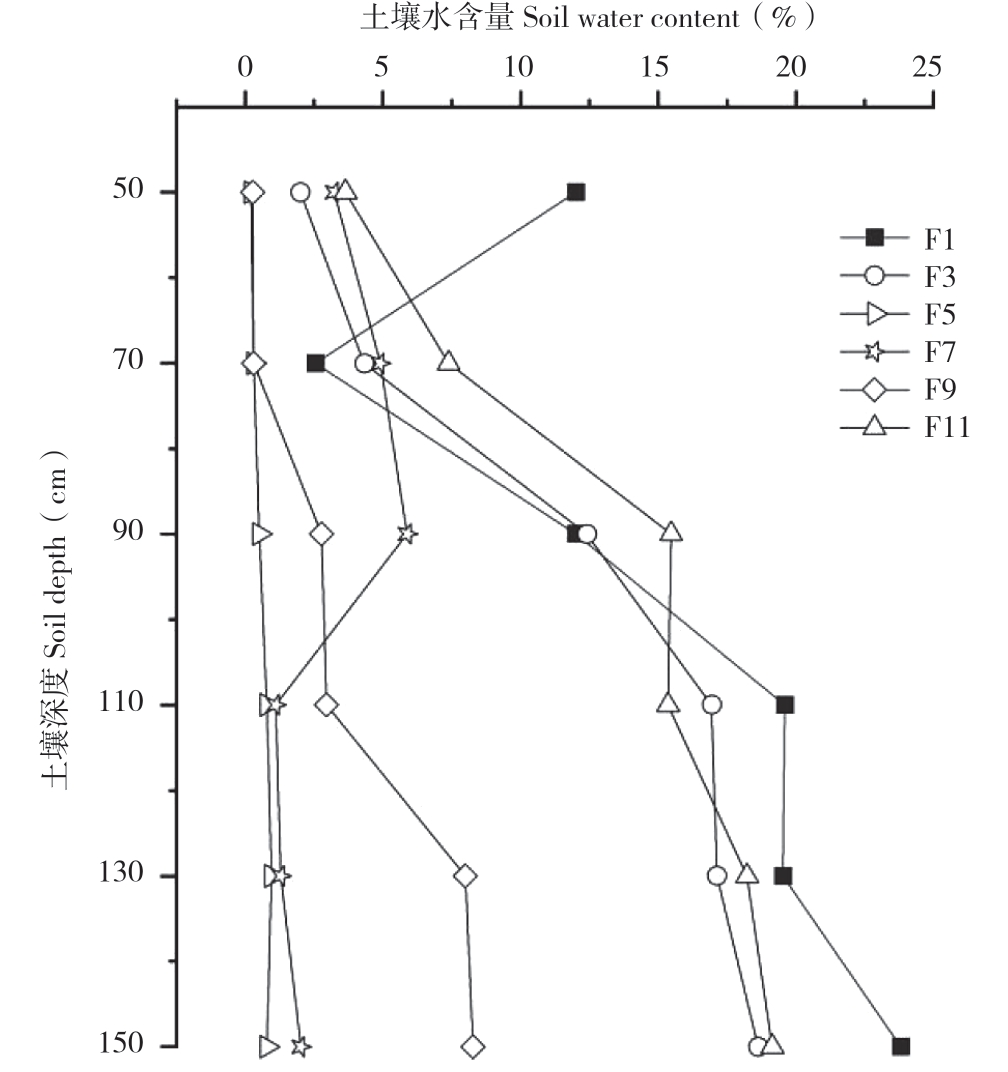
图2 各样点不同深度土壤含水量
Fig.2 Soil moisture content at different depths of various sampling points
从柽柳茎秆水δD含量对比(图3)可以看出,样点F1土壤水δD值在50~110 cm处逐渐降低,在80 cm处与茎秆水δD值有一个交叉点,可判断70~90 cm为该点柽柳的一个吸水层;110~130 cm土壤水δD值有所上升并再次接近茎秆水δD含量,说明该点柽柳在130 cm附近也有根系分布;130~150 cm土壤水δD值逐渐降低。样点F3土壤水δD含量从50~150 cm逐渐降低,说明蒸发作用随着土层深度的增加而减弱,土壤水δD值从90 cm以下开始迅速接近茎秆水,在110 cm处趋于重合,并将次趋势延续到150 cm以下,说明110~150 cm是该试验点柽柳根系所在的吸水深度。样点F5土壤水含量极低,未提取出实验所需液态水样品,该点柽柳茎秆水的土壤水δD值为-16.77‰,远高于其他试验点茎秆水的δD含量,反映出极强的干旱蒸发作用。样点F7干旱作用也相对明显,茎秆水含量为-25.15‰;土壤水50~70 cm δD呈递增趋势,在之间的60 cm处有交叉点,可看作是柽柳的一个吸水深度,50~90 cm土壤水与茎秆水δD值比较接近,说明柽柳较多利用该深度的土壤水。样点F9相对干旱,50 cm、70 cm处的土壤含水量分别为0.27%、0.30%,未提取出足够进行氢氧同位素分析的液态水,故这两层土壤水的δD值缺失。δD值在90~110 cm呈上升趋势,110~150 cm间缓慢下降,90~130 cm处茎秆水与土壤水δD值趋于接近并在90、120 cm处有两次交叉,故可认为该点柽柳主要吸收利用90~130 cm处的土壤水。样点F11土壤水与茎秆水的δD值偏负,土壤水δD值在50~130 cm逐渐降低,130~150 cm有增高趋势,与茎秆水在80 cm处有交点,可认为80 cm存在一个吸水层,在150 cm处趋于重合,说明该柽柳可能存在两个吸水层。可见,F1、F3、F11等3个试验点土壤水在110 cm以下δD值逐渐偏负且趋近,三地茎秆水δD值分布在-50‰~-60‰之间,偏差较小。F1、F3两试验点土壤水δD值在130 cm处重叠,两试验点距离较近,可能在此深度受同一水源补给。几处试验点土壤水的δD值均在150 cm以下趋于降低,可能逐渐接近地下水的δD值。
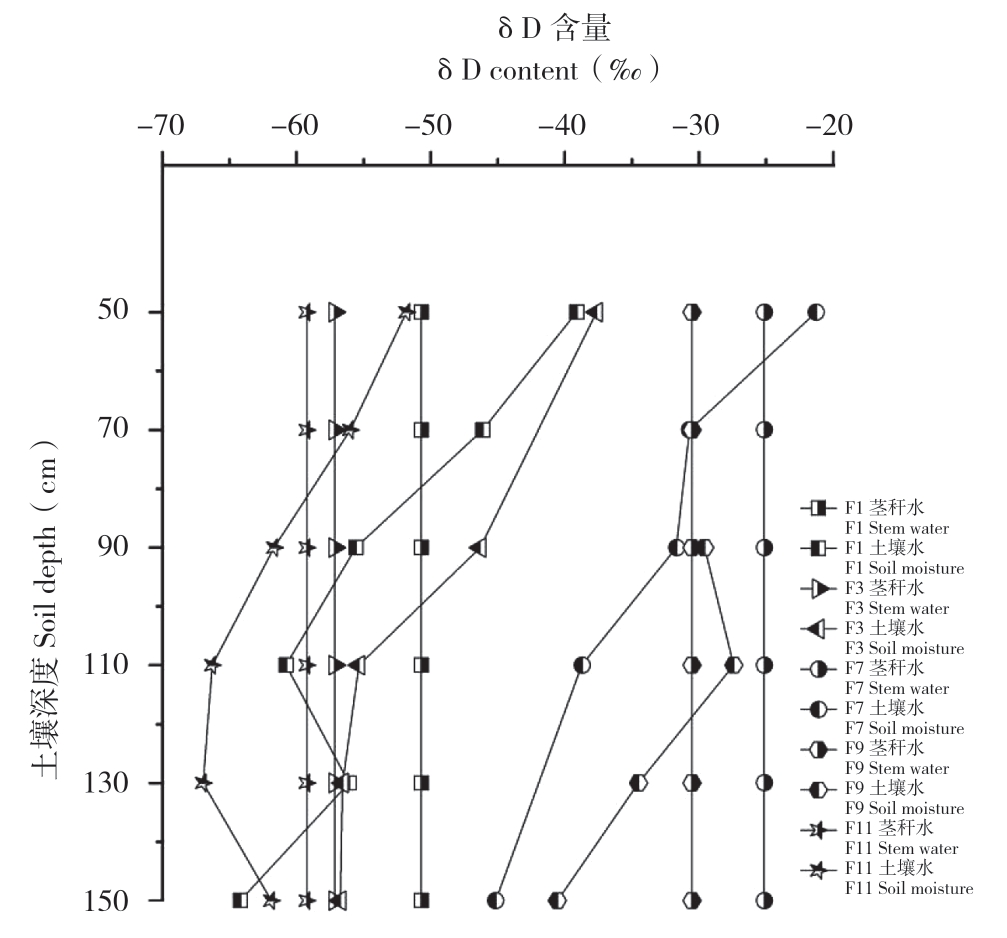
图3 各样点不同深度土壤水和茎秆水的δD含量
Fig.3 δD content of soil moisture and stem water at different depths of various sample points
2.3 柽柳水分来源定量分析
IsoSource软件分析可得出每个样点柽柳不同吸水深度的水分利用率。为便于区分,将0~50 cm划分为浅层土壤,50~100 cm划分为中层土壤,100~150 cm划分为深层土壤。由表1可知,样点F1土壤水分利用率最大为24.80%(50 cm处)、最小为0.99%(150 cm处);样点F7土壤水分利用率最大为70.40%(50 cm处)、最小为0.38%(150 cm处);样点F9土壤水分利用率最大为37.60%(110 cm处)、最小为0.86%(150 cm处);样点F11土壤水分利用率最大为70 cm处的23.50%,最小为130 cm处的10.80%。样点F3、F5未计算出结果。
表1 不同土壤深度对柽柳水分来源的贡献率(%)
Table 1 Contribution rate of different soil depths to Tamarix water source (%)
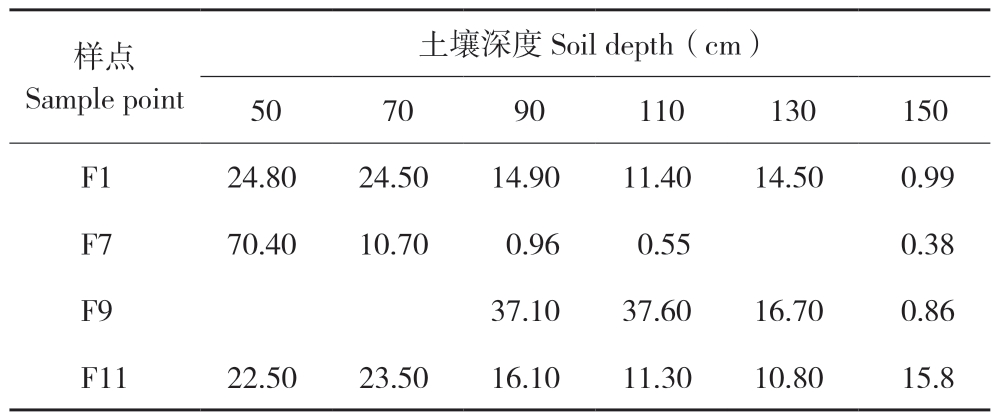
样点Sample point土壤深度Soil depth(cm)50 70 90 110 130 150 F1 24.80 24.50 14.90 11.40 14.50 0.99 F7 70.40 10.70 0.96 0.55 0.38 F9 37.10 37.60 16.70 0.86 F11 22.50 23.50 16.10 11.30 10.80 15.8
英苏断面柽柳在土壤深度50 cm处平均水分利用率为39.23%,70 cm处水分利用率为19.56%,90 cm处水分利用率为17.26%,110 cm处水分利用率为15.21,130 cm处水分利用率为14%,150 cm处水分利用率为4.50%。可见,柽柳更多地利用50~100 cm处的中层土壤水。
6个样点距离河道的距离分别为F1 50 m、F3 300 m、F5 750 m、F7 968 m、F9 412 m、F11 70 m。由图2可知,各点土壤含水量随距河道距离的增加而减少;由图4可知,随着距河道距离的增加,柽柳利用中层土壤水的比例由70%下降到40%,即呈现出由利用中层土壤水逐渐转变为吸收利用更深层次的土壤水的现象。样点F7虽距河道较远,但含水量由50~90 cm向110 cm以下急剧减少,故该点柽柳更多地利用含水量较多的中层土壤水。
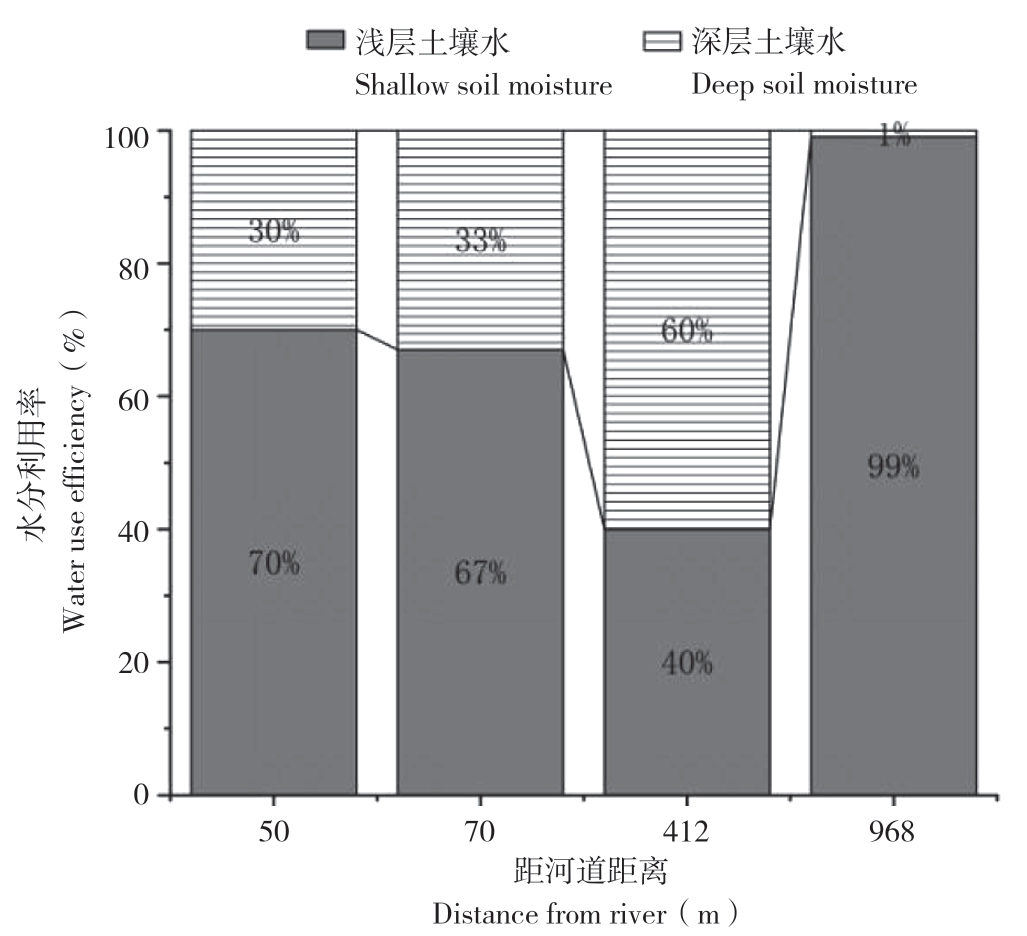
图4 柽柳吸水深度与距河道远近关系
Fig.4 Relationship between Tamarix water absorption depth and distance from river
3 讨论
土壤水稳定同位素易受到蒸发分馏作用的影响,表层比下层土壤水更易富集重同位素[19]。英苏断面地表层土壤粒组以粉砂和砂为主,其次是粘土[20],持水力弱。土壤水分受降水入渗补给和蒸腾消耗等的影响,处于不断变化的状态。土壤水分补给、消耗、地表水分蒸发、季节变化、地表土壤蒸发以及土壤水和地下水之间的同位素差异,使土壤水分产生同位素组成产生梯度变化,故利用氢氧同位素示踪技术能够高效准确地分析植物水分来源,目前极端干旱区针对柽柳水分来源及用水机制的研究报道较为鲜见,且少有学者做长期跟踪研究。本试验旨在弥补极端干旱区内水分变化对柽柳的影响机制,以期对极端干旱区的生态保护及恢复提供科学依据。周海等在准格尔盆地东南缘的研究表明,多枝柽柳属于深根系植物,其90%以上的水分来源于深层土壤水和地下水,基本不受土壤水分变化的影响[6],与本研究结果不一致,这可能与研究区地下水位深度不同有关。周天河等在塔里木河上游的研究表明,柽柳对河水的依赖性较强,且利用浅层土壤水的程度高于深层土壤水,该研究结果与本文结论类似。邢星等在柴达木盆地诺木洪地区的研究表明,柽柳在50~70 cm土层对土壤水分吸收最大,且在生长季存在水源转换现象;陈小丽等在黑河下游荒漠的研究表明,柽柳主要利用200~300 cm的深层土壤水。以上研究结果不尽相同,但可以肯定的是,在水分极其缺乏的荒漠生态系统中,根据不同区域地理环境的差异性植物可以通过自身调节向着最优(最有利)表现型发展,从而最大程度地获取水分[21],荒漠地区的生态保护与物种选择应充分结合本地区的实际情况进行。本试验点位于极端干旱区,0~50 cm土壤极为破碎,故未将0~50 cm深度土壤水作为植物水分来源深度,可能会导致其他深度土壤水分对植物的贡献率增高;样点F5 50~150 cm含水量极低,几乎不存在柽柳吸水层,该点柽柳可能利用更深层次的土壤水。值得注意的是,样点F7从90 cm以下含水量急剧减少,110~150 cm含水量平均为1.5%,相对于其他样点表现出极度干旱的特征,可能与地下水埋深、地形等因素有关,在未来研究中应对这两个现象加以深入分析。
4 结论
本研究利用氢氧稳定同位素技术和直接对比法分析了英苏断面柽柳吸水深度,利用IsoSource线性混合模型定量分析了不同土壤深度水分对柽柳水分利用的贡献率,分析了距河道距离不同柽柳吸水深度的变化。利用烘干法计算了土壤含水量,英苏断面柽柳在土壤深度50 cm处平均水分利用率为39.23%,70 cm处水分利用率为19.56%,90 cm处水分利用率为17.26%,110 cm处水分利用率为15.21%,130 cm处水分利用率为14%,150 cm处水分利用率为4.50%。英苏断面土壤水分含量极低,最小值为样点F5土壤深度50 cm处的0.20%,最大值为样点F1 150 cm处的23.81%,土壤含水量大致随深度的加深而增加;英苏断面柽柳多利用50~100 cm间的中层土壤水,平均利用率达69%;英苏断面柽柳呈现出距河道距离增加,转为逐渐利用更深层次土壤水的现象。
[1] 李晖,周宏飞.稳定性同位素在干旱区生态水文过程中的应用特征及机理研究[J].干旱区地理,2006,29(6):810-816.doi:10.13826/j.cnki.cn65-1103/x.2006.06.007.LI H, ZHOU H F.Application of stable isotopes in the eco-hydrological process of arid regions and their mechanisms[J].Arid Land Geography, 2006,29(6):810-816.doi:10.13826/j.cnki.cn65-1103/x.2006.06.007.
[2] THORBUM P J, WALKE G R.Variations in stream water uptake by Eucalyptus camaldulensis withdiffering access to stream water[J].Oecologia,1994,100(3):293-301.doi:10.2307/4220816.
[3] EHLERINGER J R,PHILLIP S L, SCHUSTER W S.Differential utilization ofsummer rains by desertplants[J].Oecologia,1991,88:430-434.doi:10.1007/bf00317589.
[4] ARAVENA R, SUZAUKI O, POLLASTRI A.Coastal fog and its relmion to groundwater in the IV region of northern Chile[J].Chemical Geology:Isotope Geoscience Section,1989,79(1):83-91.doi:10.1016/0168-9622(89)90008-0.
[5] DAWASON T E.Fog in the California red wood forest:Ecosystem inputs and use by plants[J].Oecologia,1998,117:476-485.doi:10.2307/4222190.
[6] 袁雪竹,贾岱,张晓惠,卢学强,邓小文,陈红.基于稳定同位素的天津市北塘排污河污染源解析研究[J].城市环境与城市生态,2013(2):6-9..YUAN X Z, JIA D, ZHANG X H, LU X Q, DENG X W, CHEN H.Analysis of pollution sources of Beitang Sewage River in Tianjin based on stable isotope[J].Urban Environment and Urban Ecology, 2013(2):6-9.
[7] 周雅聃,陈世苹,宋维民,卢琦,林光辉.不同降水条件下两种荒漠植物的水分利用策略[J].植物生态学报,201l,35(8):789-800.doi:10.3724/SP.J.1258.2011.00789.ZHOU Y D, CHEN S P, SONG W M,LU Q, LING G H.Water use strategies of two desert plants under different precipitation conditions[J].Chinese Journal of Plant Ecology, 201l, 35(8):789-800.doi:10.3724/SP.J.1258.2011.00789.
[8] 孙守家,孟平,张劲松,万贤崇.利用氘同位素研究太行山南麓枣树水分利用的季节性变化[J].林业科学,2011,47(5):46-53.doi:10.5846/stxb201302030225.SUN S J, MENG P, ZHANG J S, WAN X C.Seasonal changes in water use of jujube trees in the southern foot of Taihang Mountain using deuterium isotopes[J].Forestry Science, 2011,47(5):46-53.doi:10.5846/stxb201302030225.
[9] 尹力,赵良菊,阮云峰,肖洪浪,程国栋,周茅先,王芳,李彩芝.黑河下游典型生态系统水分补给源及优势植物水分来源研究[J].冰川冻土,2012,34(6):1478-1486.YIN L, ZHAO L J, RUAN Y F, XIAO H L, CHENG G D, ZHOU M X,WANG F, LI C Z.Study on water supply sources of typical ecosystems in the lower Heihe River and water sources of dominant plants[J].Glacier Permafrost, 2012, 34(6):1478-1486.
[10] 段德玉,欧阳华.稳定氢氧同位素在定量区分植物水分利用来源中的应用[J].生态环境,2007(2):655-660.doi:10.16258/j.cnki.1674-5906.2007.02.076.DUAN D Y, OUYANG H.Application of stable hydrogen and oxygen isotopes in quantitatively differentiating plant water use sources[J].Ecology and Environment, 2007(2):655-660.doi:10.16258/j.cnki.1674-5906.2007.02.076.
[11] 杨鹏年,邓铭江,李霞,董新光.塔里木河下游间歇输水下地下水响应宽度——以塔里木河下游英苏断面为例[J].干旱区研究,2008(3):331-335.doi:10.13866/j.azr.2008.03.011.YANG P N, DENG M J, LI X, DONG X G.Response width of groundwater intermittently transported in the lower reaches of the Tarim River:A case study of Yingsu section in the lower reaches of the Tarim River[J].Arid Land Research, 2008(3):331-335.doi:10.13866/j.azr.2008.03.011.
[12] 杨玉海,陈亚宁,李卫红.荒漠河岸林植物丛枝菌根真菌侵染及环境影响因子——以塔里木河下游为例[J].自然科学进展,2008(4):397-405.doi:10.3321/j.issn:1002-008X.2008.04.006.YANG Y H, CHEN Y N, LI W H.Arbuscular mycorrhizal fungi infection and environmental influence factors in desert riparian forests—Taking the lower reaches of Tarim River as an example[J].Progress in Natural Science, 2008(4):397-405.doi:10.3321/j.issn:1002-008X.2008.04.006.
[13] 张欢,曹俊,王化冰,宋波,贾国栋,刘自强,余新晓,曾佳.张北地区退化杨树防护林的水分利用特征[D].北京:北京林业大学,2018.ZHANG H, CAO J, WANG H B, SONG B, JIA G D, LIU Z Q, YU X X,ZENG J.Water use characteristics of degraded poplar shelter forests in Zhangbei area[D].Beijing:Beijing Forestry University, 2018.
[14] 陈小丽,陈亚宁,陈亚鹏.黑河下游荒漠河岸林植物水分利用关系研究[J].中国生态农业学报,2014,22(8):972-979.doi:10.13930/j.cnki.cjea.140169.CHEN X L, CHEN Y N, CHEN Y P.Study on the relationship of plant water use in desert riparian forests in the lower Heihe River[J].Chinese Journal of Eco-Agriculture, 2014,22(8):972-979.doi:10.13930/j.cnki.cjea.140169.
[15] 孙双峰,黄建辉,林光辉,赵威,韩兴国.稳定同位素技术在植物水分利用研究中的应用[J].生态学报,2005(9):2362-2371.SUN S F, HUANG J H, LIN G H, ZHAO W, HAN X G.Application of stable isotope techniques in the study of plant water utilization[J].Acta Ecologica Sinica, 2005(9):2362-2371.
[16] 刘文茹,彭新华,沈业杰,陈效民.激光同位素分析仪测定液态水的氢氧同位素及其光谱污染修正[J].生态学杂志,2013,32(5):1181-1186.doi:10.13292/j.1000-4890.2013.0207.LIU W R, PENG X H, SHEN Y J, CHE X M.Determination of hydrogen and oxygen isotopes in liquid water by Laser Isotope Analyzer and its spectral pollution correction[J].Chinese Journal of Ecology, 2013,32(5):1181-1186.doi:10.13292/j.1000-4890.2013.0207.
[17] 张璇,华宁,汤臣栋,马强,薛文杰,吴巍,马志军.崇明东滩黑腹滨鹬(Calidris alpina)食物来源和组成的稳定同位素分析[J].复旦学报(自然科学版),2013,52(1):112-118.doi:10.15943/j.cnki.fdxbjns.2013.01.018.ZHANG X, HUA N, TANG C D, MA Q, XUE W J, WU W, MA Z J.Stable isotope analysis of food source and composition of Calidris alpina in Chongming Dongtan[J].Journal of Fudan University(Natural Science), 2013, 52(1):112-118.doi:10.15943/j.cnki.fdxbjns.2013.01.018.
[18] 巩国丽,陈辉,段德玉.利用稳定氢氧同位素定量区分白刺水分来源的方法比较[J].生态学报,2011,31(24):7533-7541.doi:10.7666/d.y1868918.GONG G L, CHEN H, DUAN D Y.Comparison of the methods for quantitatively distinguishing the water source of Nitraria nitra using stable hydrogen and oxygen isotopes[J].Acta Ecologica Sinica,2011,31(24):7533-7541.doi:10.7666/d.y1868918.
[19] 冯蕴.基于氢氧稳定同位素浑善达克沙地杨树吸水规律研究[D].呼和浩特:内蒙古农业大学,2019.FENG Y.Study on the water absorption of poplar trees in Hunshandake Sandy Land based on hydrogen and oxygen stable isotope[D].Hohhot:Inner Mongolia Agricultural Science, 2019.
[20] 涂文霞,叶茂,柯琳.新疆塔里木河下游表层土壤粒度分异特征研究——以英苏断面为例[J].北京农业,2013(30):255-256.doi:10.3969/j.issn.1000-6966.2013.30.211.TU W X, YE M, KE L.Study on grain size differentiation characteristics of surface soil in the lower reaches of Tarim River in Xinjiang—Taking Yingsu Section as an example[J].Beijing Agriculture, 2013(30):255-256.doi:10.3969/j.issn.1000-6966.2013.30.211.
[21] 周海,郑新军,唐立松,李彦.准噶尔盆地东南缘多枝柽柳、白刺和红砂水分来源的异[J].植物生态学报,2013,37(7):665-673.doi:10.3724/SP.J.1258.2013.00069.ZHOU H, ZHENG X J, TANG L S, LI Y.Different water sources of Tamarix ramosissima, Nitraria lanceolata and Red Sand in the southeast margin of Junggar Basin[J].Chinese Journal of Plant Ecology, 2013,37(7):665-673.doi:10.3724/SP.J.1258.2013.00069.