【研究意义】核素90Sr、137Cs是核裂变反应的主要放射性产物,核试验、核事故和核武器的使用等导致核素90Sr、137Cs大量释放到环境中,大气中的放射性核素污染物随降水进入土壤环境[1]。90Sr、137Cs半衰期较长,进入环境很难清除,容易通过食物链进入人体,对人体产生危害[2]。目前对土壤核素污染的监测方法主要是取样检测法[3],这种监测方式工作量大,监测成本高且不具有长期性和连续性。在实际应用中多采用生物监测与理化监测相结合的方式,可以真实有效全面反映污染对环境的危害。早在1987年我国就开始了生物监测工作,在水体、土壤、大气等领域开展生物监测并取得了多方面的应用成果[4]。随着我国加大对核资源的开发利用,造成核废弃物、废渣的产生,无疑增加了环境放射性污染的可能性[5-6]。因此,做好核素污染监测和防治是一项势在必行的工作,具有一定的前瞻性。
【前人研究进展】当环境发生改变时,生物针对环境变化做出适应性改变,植物对不同胁迫产生的特征反应,对环境有直接或间接的指示作用。核素和重金属等胁迫在植物个体水平、细胞水平、分子水平各级产生影响[7-9];对植物的营养生长有抑制作用,使植物外观表现出病态特征[10];对植物的生殖生长产生影响,影响植物开花结果等[11-14]。研究Sr、Cs对植物生长发育的影响,以期从众多植物中寻找到敏感植物,为土壤核素Sr、Cs污染的生物监测打下良好基础。
【本研究切入点】目前已有大量关于生物监测的研究报道,主要在大气和水体污染方面取得了良好效果。由于土壤环境的复杂情况,鲜有针对土壤核素Sr、Cs污染,利用高等植物作为指示植物的研究。有研究发现,三叶草对大气污染敏感[15],有作为敏感植物的特征。同时,在植物修复领域,豆科植物对重金属污染更为敏感,三叶草是豆科植物中很受欢迎的研究材料,对重金属具有较强的转运能力[16-17]。其生长快速,用途广泛,常被用作草坪绿植,牧草、绿肥等,具有很大的实际应用价值。【拟解决的关键问题】本研究选取豆科植物三叶草作为试验材料,参照前人研究设置极低处理浓度,在环境条件更单一的水培环境中,分别研究Sr、Cs和Sr+Cs处理对植物生长和生理生化的影响,对以高等植物作为土壤污染指示植物进行初探。
1 材料与方法
1.1 试验材料
供试植物为三叶草(Trifolium pratense L.),种子购于江苏省宿迁市辉煌花木院。供试试剂SrCl2·6H2O和CsCl购于绵阳市信捷商贸有限责任公司。
1.2 试验方法
试验于2018年10月26日至2019年1月在西南科技大学温室进行。三叶草种子在育苗盆中用河沙∶珍珠岩=3∶1基质育苗,待植株生长到4片真叶时进行移栽。试验采取盆栽水培方法,每盆(长43.5 cm×宽20 cm×高14 cm)加入Hogland营养液5 L(营养液参照张晓雪等[18]的方法进行配制,用1 mol/L NaOH溶液调制pH 6.0)。纯营养液培养7 d,待三叶草适应水培环境后,更换营养液并一次性添加SrCl2·6H2O和CsCl溶液。试验设3种处理,每种处理设置4个水平,分别为0.1、0.5、1、2 mg/L,Sr处理分别表示为Sr 0.1、Sr 0.5、Sr 1.0、Sr 2.0,Cs处理分别表示为Cs 0.1、Cs 0.5、Cs 1.0、Cs 2.0,Sr+Cs(1∶1)处理分别表示为(Sr+Cs)0.1、(Sr+Cs)0.5、(Sr+Cs)1.0、(Sr+Cs)2.0,以只含营养液的空白处理作对照(CK)。每个处理3次重复,每个重复1盆,共39盆,每盆定植10株,共390株。每隔1 d向盆中打入等量空气,补充氧气,同时观察记录三叶草生长情况。每隔10 d向盆中补充营养液,保证三叶草正常生长。
1.3 测定指标及方法
盆栽培养45 d统计三叶草植株冠径、叶面积、单株黄叶率等生长指标。培养50 d,每盆收获8株三叶草,剪取植物叶片鲜样保存测定相关生理生化指标。用电子天平称量鲜重后烘干至恒重称取干重。
1.3.1 三叶草生理生化指标测定 用硫代巴比妥酸(TBA)加热比色法[19]测定植物叶片丙二醛(MDA)含量,用95%乙醇浸提比色法[20]测定叶片叶绿素含量;在整个培养过程中,每隔1 d观察记录1次三叶草生长状况,在试验处理后50 d统计各项生长指标。
1.3.2 植株Sr、Cs含量测定 将植物烘干样品研磨成粉末,称取0.5 g,加入10 mL硝酸(分析纯)、5 mL高氯酸(分析纯)于消解炉上消解至透明,然后每30 min赶酸1次,待酸雾赶尽冷却后定容至10 mL,采用火焰原子吸收光谱法[21]测定样品Sr、Cs含量。
试验数据采用采用Microsoft Excel 2007和SPSS 25.0软件进行处理和单因素方差分析及多重比较。图表采用Origin 9.0绘制。
2 结果与分析
2.1 Sr、Cs、Sr+Cs处理对三叶草生长的影响
2.1.1 不同处理对三叶草各生长指标的影响 由表1可知,Sr处理对三叶草单株叶面积有显著促进作用,且随处理浓度的升高呈下降趋势,其中Sr0.1处理的叶面积比对照高8.6%,其余生长指标与对照无显著差异。Cs处理对三叶草植株冠径、单株叶面积、地上部鲜重均有显著抑制作用,表现为Cs0.1、Cs0.5、Cs1.0、Cs2.0处理植株冠径比对照分别低35.0%、25.0%、34.9%、28.0%,单株叶面积比对照分别低31.6%、32.4%、38.2%、41.7%,地上部鲜重比对照分别低46.2%、42.7%、41.7%、48.0%; Cs2.0处理三叶草地部鲜重显著低于对照33.8%,其余Cs处理三叶草地下部鲜重与对照无显著差异,说明较低浓度Cs处理对三叶草地下部生长影响不大。Sr+Cs处理三叶草各项生长指标均显著低于对照,表现为(Sr+Cs)0.1、(Sr+Cs)0.5、(Sr+Cs)1.0、(Sr+Cs)2.0处理植株冠径比对照分别低31.6%、37.1%、29.5%、34.8%,单株叶面积比对照分别低16.8%、17.4%、19.4%、21.1%,地上部鲜重比对照分别低47%、51.6%、52.4%、59.9%,地下部鲜重比对照分别低26.2%、41.6%、43.9%、47.8%,表明Sr+Cs复合处理对三叶草地下部生长抑制作用更强。
表1 Sr、Cs和Sr+Cs不同处理对三叶草各生长指标的影响
Table 1 Effects of Sr, Cs and Sr+Cs treatments on the growth indicators of clover

注:同列数据后小写英文字母不同者表示差异显著。
Note:Different lowercase letters in the same column represent significant differences.
处理Treatments植株冠径Crown diameter(cm)单株叶面积Leaf area per plant(cm2)地上部鲜重Fresh weight of shoot(g)地下部鲜重Fresh weight of root(g)CK 18.99±1.67a 122.57±3.42c 3.79±0.08a 3.85±0.45ab Sr0.1 18.78±0.56a 133.10±2.56a 3.71±0.20a 3.98±0.17a Sr0.5 18.57±2.25a 129.92±1.30ab 3.26±0.16ab 3.89±0.55ab Sr1.0 19.49±1.29a 128.01±1.54b 3.32±0.52ab 3.68±0.78ab Sr2.0 19.61±1.14a 127.40±1.53b 3.11±0.19b 3.46±0.55abc Cs0.1 12.35±0.57b 83.88±1.81f 2.04±0.10cd 3.1±0.13abcd Cs0.5 14.14±1.58b 82.91±1.56f 2.17±0.34c 3.56±0.14abc Cs1.0 12.37±3.23b 75.73±2.18g 2.21±0.44c 3.05±0.46abcd Cs2.0 13.68±2.56b 71.50±1.20h 1.97±0.26cd 2.55±0.22cde(Sr+Cs)0.1 12.99±1.15b 101.99±4.85d 2.01±0.15cd 2.84±0.62bcde(Sr+Cs)0.5 11.95±0.19b 101.23±1.27d 1.84±0.32cd 2.25±0.68de(Sr+Cs)1.0 13.38±1.03b 98.85±1.65de 1.81±0.48cd 2.63±0.71cde(Sr+Cs)2.0 12.39±0.25b 96.65±0.72e 1.52±0.43d 2.01±0.87e
2.1.2 不同处理三叶草叶片黄化表现 三叶草经Sr、Cs和Sr+Cs处理后的前15 d生长缓慢,未观察到黄化叶片。处理后17 d,首先在Cs 2.0处理发现三叶草叶片表现异常(图1 A),少数叶片出现边缘黄化;在之后的观察中发现,Cs处理和Sr+Cs处理的三叶草叶片陆续出现此现象,图1B~D为叶片黄化过程,叶片黄化从边缘开始,逐渐向叶片中心蔓延,最终整个叶片黄化坏死。从整株来看,叶片黄化从植株底部老叶开始向生长点发展,严重的植株出现大量叶片黄化,但没有植株彻底死亡。处理后45 d统计的三叶草单株黄叶率如图2所示,可以看出Sr处理各浓度间三叶草单株黄叶率与对照无显著差异;Cs和Sr+Cs处理下三叶草单株黄叶率随处理浓度升高而逐渐上升,最高分别为38.2%、39.9%,在浓度大于0.5 mg/L时Sr+Cs处理下黄叶率大于Cs处理,说明当Sr、Cs复合处理对三叶草生长影响更大。

图1 三叶草生长过程中叶片黄化表现
Fig.1 Leaf yellowing performance in the growth of clover
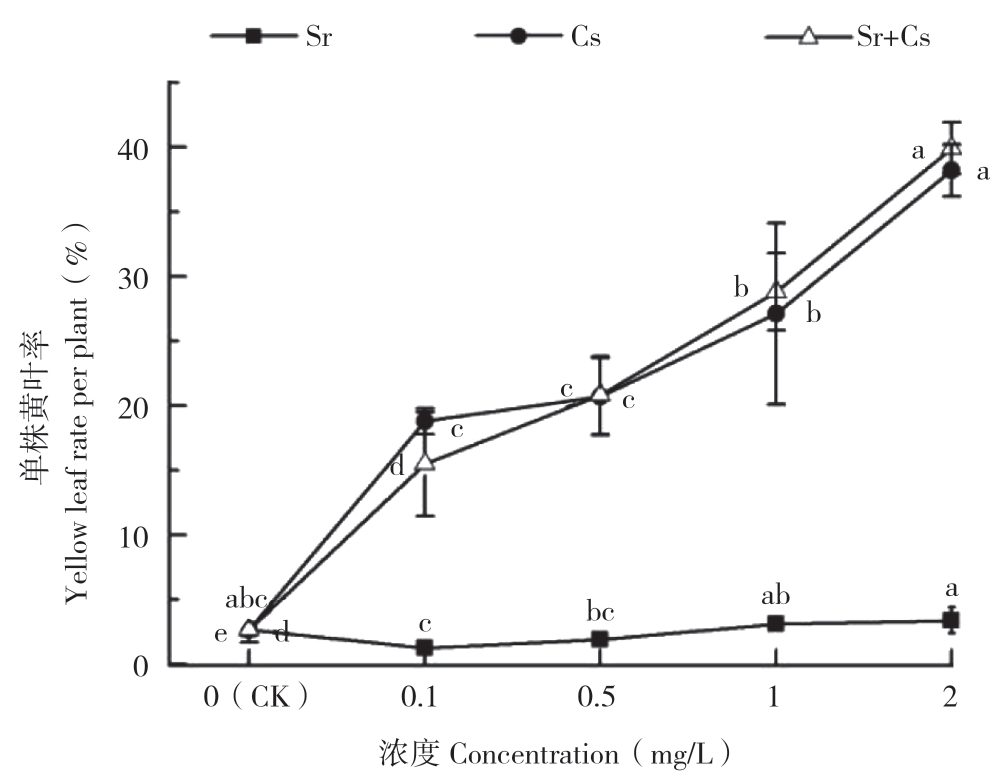
图2 三叶草单株黄叶率
Fig.2 Yellow leaf rate of per plant of clover
2.1.3 不同处理对三叶草生物量的影响 植物生物量变化可以直接表明重金属对植物生长的影响。如图3所示,比较3种处理三叶草地上部干质量的大小关系可知,Sr处理下,仅Sr2.0处理地上部干质量显著低于对照;Cs处理和Sr+Cs处理下,地上部干质量均显著低于对照,以Cs2.0和(Sr+Cs)1.0处理的干质量最低,比对照分别低48%和56%。比较3种处理三叶草地下部干质量的大小关系可知,仅Sr+Cs处理的地下部干质量显著低于对照,以(Sr+Cs)1.0处理的干质量最低,比对照低44%。综上所述,Sr+Cs处理对三叶草的抑制作用最显著,其次为Cs处理,Sr处理对三叶草生长的影响较小。
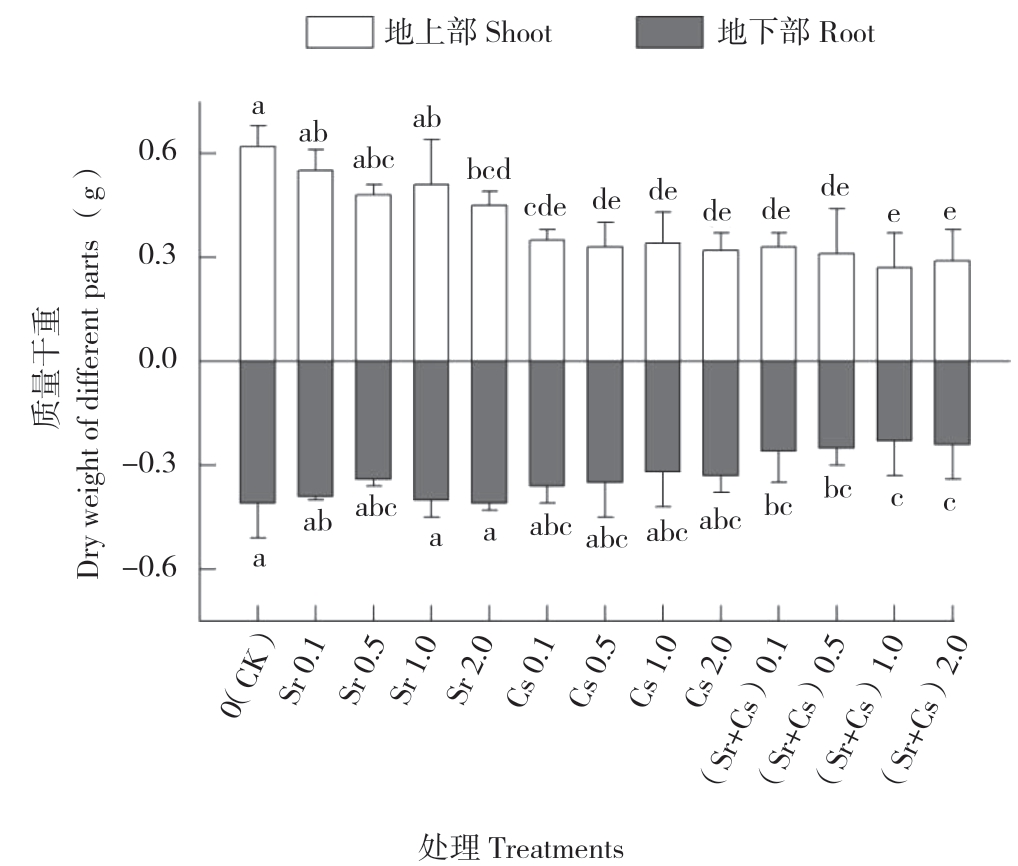
图3 三叶草植株地上部、地下部生物量
Fig.3 Average shoot and root biomass of per plant of clover
2.2 Sr、Cs和Sr+Cs处理对三叶草生理生化的影响
2.2.1 不同处理对三叶草叶片MDA含量的影响 MDA是植物膜脂过氧化产物,其含量间接反映植物膜脂过氧化程度和植物所受的逆境胁迫。由图4可知,三叶草叶片MDA含量在3种处理下均随处理浓度升高而逐渐增加,其中Sr处理浓度1.0 mg/L、Cs 处理浓度0.5 mg/L、Sr+Cs处理浓度1.0 mg/L时,三叶草叶片MDA含量显著高于对照,说明三叶草叶片MDA含量对Cs处理浓度更敏感;Cs 2.0处理三叶草叶片MDA含量最高达35.06 nmol/g,为对照的2.06倍,而(Sr+Cs)0.1处理下三叶草叶片MDA含量低于对照,随后逐渐升高且显著高于对照。综上所述,三叶草叶片膜脂过氧化程度随处理浓度升高而逐渐加重。
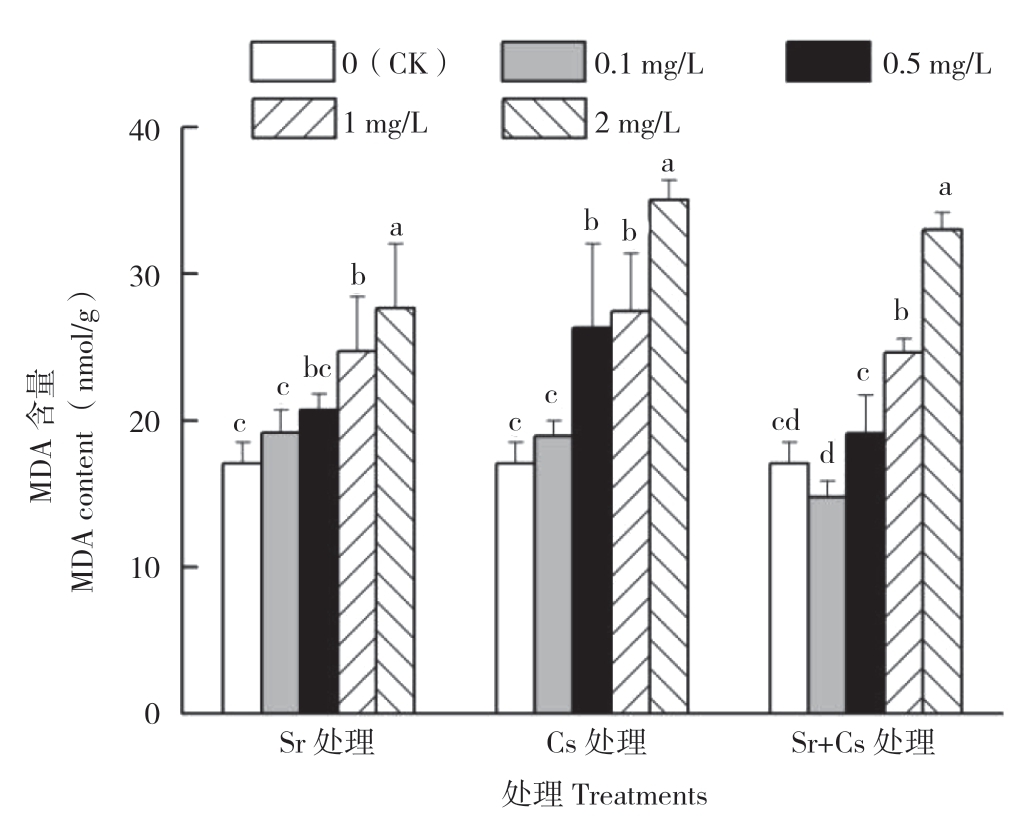
图4 三叶草叶片MDA含量比较
Fig.4 Comparison of MDA contents in leaves of clover
2.2.2 不同处理对三叶草叶片叶绿素含量的影响 植物叶绿素含量直接影响植物光合作用,与植物营养生长和叶片黄化密切相关。由图5可知,Sr处理三叶草叶片叶绿素含量随处理浓度升高逐渐降低,与对照差异不显著;Cs 0.1、Cs 0.5、Cs 2.0处理三叶草叶片叶绿素总含量显著低于对照,比对照分别低40%、53%、43%;(Sr+Cs)0.1、(Sr+Cs)1.0处理叶片叶绿素总含量显著低于对照,比对照分别低32%、35%。综上结果表明,Cs处理和Sr+Cs处理三叶草叶片叶绿素合成受到显著抑制,植株形态发生明显变化,叶面积减小,叶片黄化数量增多。
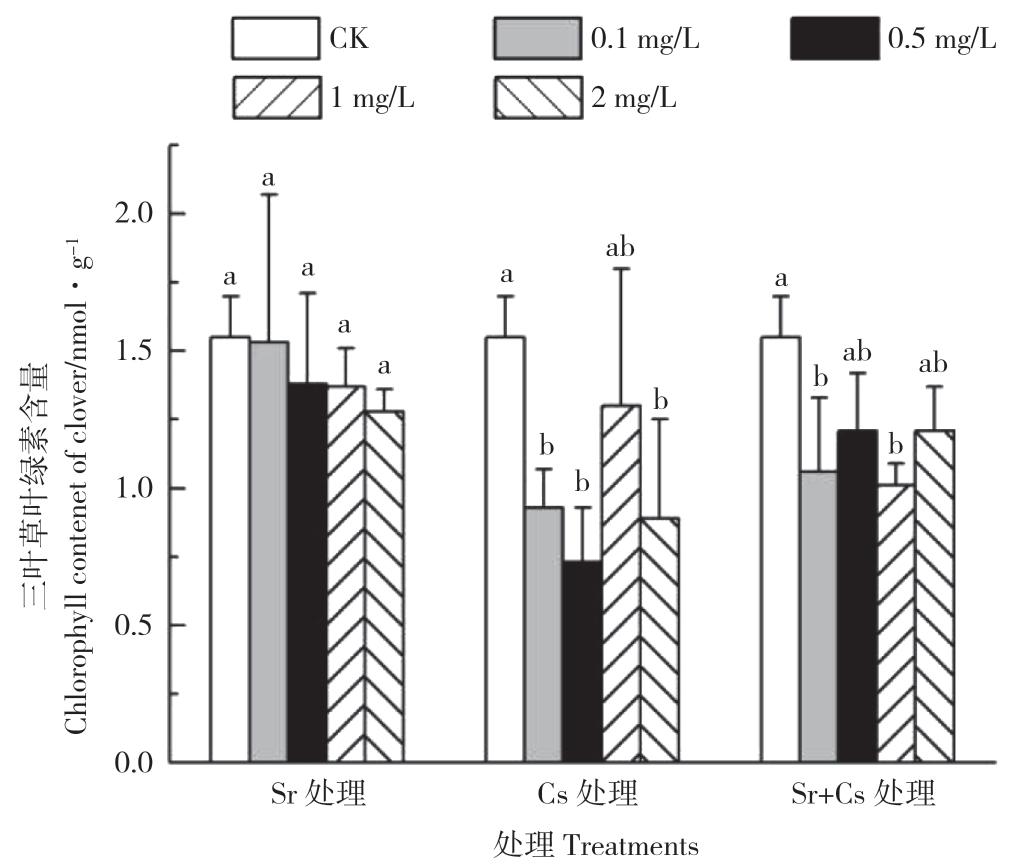
图5 三叶草叶片叶绿素总含量比较
Fig.5 Comparison of chlorophyll contents in leaves of clover
2.3 三叶草植株对Sr、Cs吸收情况比较
由图6A可知,三叶草地上部和地下部Sr含量均随Sr处理浓度的升高而显著升高,其地上部Sr含量在0.49~1.89 mg/kg之间,地下部Sr含量在0.31~1.13 mg/kg之间,在Sr处理浓度2.0 mg/L时植株Sr含量达到最高,且表现为地上部>地下部,表明三叶草对Sr有一定的转运能力。由图6 B可知,三叶草地上部和地下部Cs含量均随Cs处理浓度的升高而显著升高,其地上部Cs含量在1.80~14.54 mg/kg之间,地下部Cs含量在1.65~11.25 mg/kg之间,在Cs处理浓度2.0 mg/L时植株Cs含量达到最高。在单一Cs处理浓度超过0.1 mg/kg时,三叶草地上部Cs含量高于地下部;Sr+Cs处理三叶草地上部Cs含量高于地下部,说明三叶草对Cs具有较强的转运能力。比较图6A与图6B,在同一浓度Sr+Cs处理下,三叶草对Cs有更强的积累能力,其地上部和地下部Cs含量远远大于Sr含量。综上所述,三叶草对Sr的积累量较低,对三叶草生长的影响较小,对Cs积累量较高,使三叶草生长受到影响,且表现出受胁迫特征。
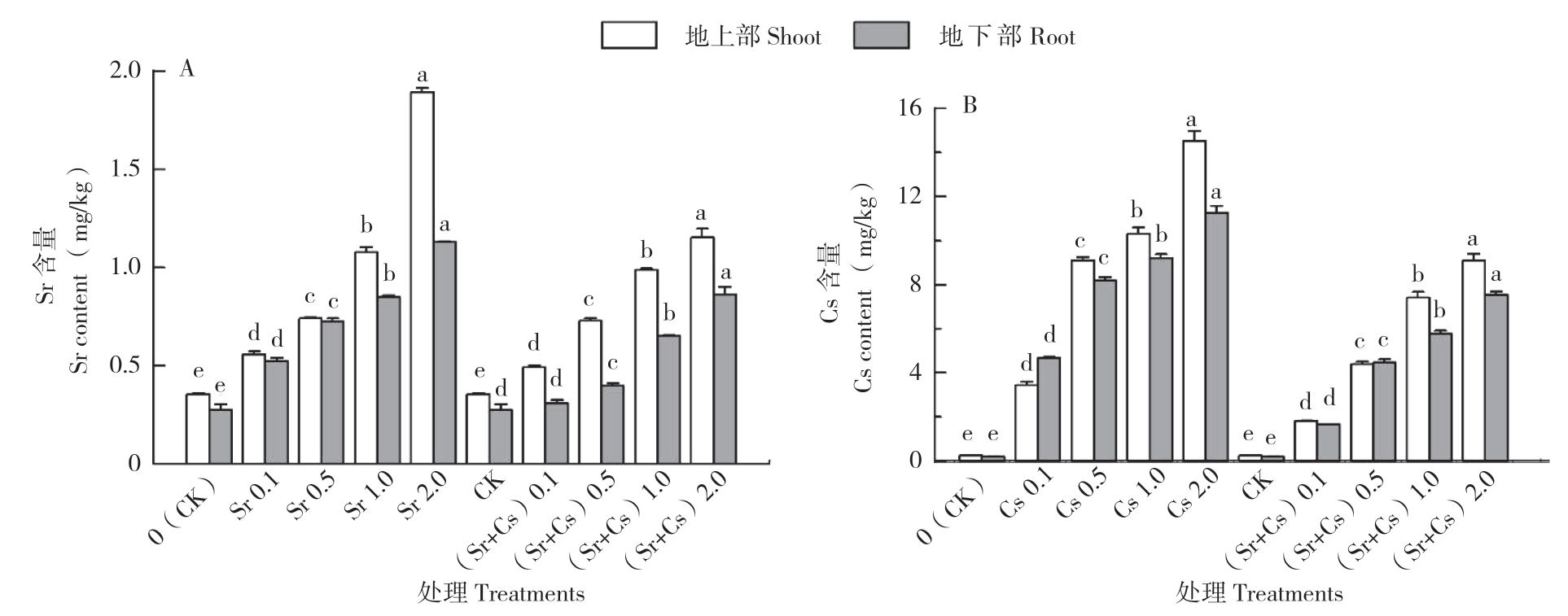
图6 三叶草不同部位Sr、Cs含量
Fig.6 Contents of Sr and Cs in different parts of clover
3 讨论
对土壤Sr、Cs污染的研究主要针对植物修复方面,研究者往往重点关注植物对Sr和Cs耐受性、生物量大小、吸收能力以及转运能力等,以期筛选出超富集植物。本研究中,参照前人[18,22-23]研究的基础,设置了比以往研究更低的浓度,表现出Cs处理比Sr处理对三叶草生长抑制作用更大。唐永金等[24]研究在高浓度Sr、Cs(500 mg/kg)处理下,Sr处理植物生长更好。有研究表明,低浓度Sr处理对植物生长有促进作用,高浓度Sr抑制植物生长[25]。本研究中,Sr处理对三叶草生长无显著影响,但其单株叶面积显著增加,可能是由于三叶草对Sr的吸收量较小且三叶草对Sr不敏感,因此与对照无显著差异。洪晓曦等[26]研究发现,低浓度Cs处理对油菜生长发育有促进作用,而高浓度Cs处理油菜生长受到抑制,株高、生物量、叶绿素含量、POD活性都呈下降趋势。本研究中,添加Cs的处理浓度较低,但Cs处理和Sr+Cs处理对三叶草的生长具有抑制作用,表现为植株冠径、单株叶面积、植株鲜重和叶绿素含量等均显著低于对照,表明三叶草对Cs处理较为敏感。
本研究结果表明,三叶草叶片MDA含量随3种处理浓度的升高呈显著上升的趋势,与安冰等[22]、储玲等[27]的研究结果一致。这表明Sr处理对三叶草的影响首先表现在生理水平,其生长表现与对照无显著差异,可能原因是三叶草对Sr的吸收量还不足以打破三叶草生理平衡以及三叶草对Sr、Cs的响应程度不同。在Cs处理和Sr+Cs处理下,三叶草无论是在生理水平和个体水平均表现出胁迫反应,进一步表明三叶草对Cs的敏感性。有研究表明,重金属胁迫会影响植物叶绿素的合成,进而影响植物光合作用合成有机物,使植物生长受到抑制,表现出黄叶现象[28]。本研究中,Sr处理三叶草的生长与对照无显著差异,且其叶片叶绿素含量与对照亦无显著差异,这与多数低Sr促进叶绿素形成的研究结果存在差异[29],其原因可能为不同植株对Sr的抗逆性存在明显差异。然而,Cs处理和Sr+Cs处理,三叶草叶片明显黄化,且叶片叶绿素含量显著低于对照,这与武慧斌[30]研究中Cs处理红三叶草叶绿素含量降低的结果一致。
不同植物对Sr、Cs的吸收能力不同,有的植物对Cs的吸收能力大于对Sr的吸收能力[18,31],有的植物则相反[23],但均表现为植物体内Sr、Cs含量随处理浓度的升高而升高[22,24,32]。本研究3种处理下三叶草对Cs的吸收能力均强于对Sr的吸收能力,两种元素的含量均随处理浓度的升高而逐渐升高。有研究报道,Sr和Ca具有相似化学性质,Ca的存在会降低植物对Sr的吸收[33],试验所用营养液Ca离子丰富,这可能是三叶草对Sr吸收量较小的原因。三叶草地上部Cs含量也大于其地下部,Hampton等[34]、White等[35]、Qi等[36]报道的Cs毒性机理表明,植物对K和Cs的吸收依赖同一载体,二者具有竞争关系。杨俊诚等[37]研究表明,在Cs污染的土壤中施加K可有效减少植株对Cs的吸收。此外,植物在缺少K元素时叶片也会表现出叶缘呈黄色或赤褐色焦枯[38],还会表现出叶绿素含量下降和叶面积减小等特征[39]。本研究中,Cs处理和Sr+Cs处理三叶草叶片黄化特征明显,从叶片边缘黄化至整个叶片,此现象与植物缺钾症状极为相似,且三叶草对Cs有较强的吸收和转运能力。这可能是由于Cs存在时,Cs元素竞争性占用了K元素的转运蛋白,抑制了三叶草对K元素的吸收,最终导致三叶草叶片出现缺钾症状。研究表明,Sr和Cs相互影响、相互抑制植物对Sr和Cs的吸收[40],当Sr、Cs复合处理后,植物对Sr、Cs的积累量均小于单一Sr、Cs处理,这与本研究结果一致。由于水培环境与土壤环境存在很大差异,水培结果不能完全代表土壤污染情况,需进一步进行土培验证,探究三叶草对Cs的敏感性,并且在之后的研究中应注意Sr与Ca、Cs与K元素之间的相互影响,进一步探究植物对Sr、Cs的敏感机理。
4 结论
本试验结果表明,Sr、Cs和Sr+Cs处理三叶草生长情况存在差异,其中Sr处理对三叶草生长无显著影响,而Cs处理和Sr+Cs处理对三叶草产生了一定程度的毒害作用,导致三叶草叶绿素含量显著降低,叶面积减小,生物量降低,叶片黄化,膜脂过氧化程度加重,表明三叶草对Cs较为敏感,具有作为Cs污染土壤指示植物的潜力。Cs处理三叶草个体水平表现出特异性特征,即三叶草叶片边缘出现褐色斑点,在叶片边缘形成一圈黄色干枯,并逐渐向叶片中心发展,直至整个叶片黄化干枯,此现象可能成为三叶草对Cs污染土壤的指示特征。
[1] STEINHAUSER G, BRANDL A, JOHNSON T E.Comparison of the Chernobyl and Fukushima nuclear accidents:A review of the environmental impacts[J].Science of The Total Environment, 2014,470/471:800-817.doi:10.1016/j.scitotenv.2013.10.029.
[2] 朱阿娜.环境样品中90Sr,137Cs放射性水平[J].工业卫生与职业病,2000,26(3):162-164.doi:10.3969/j.issn.1000-7164.2000.03.012.ZHU A N.90Sr, 137Cs radioactive levels in environment samples[J].Industrial Health and Occupational Diseases, 2000,26(3):162-164.doi:10.3969/j.issn.1000-7164.2000.03.012.
[3] 齐文启,陈光,席俊清,宗惠娟,孙宗光,汪志国,王强..放射性核素污染及监测(续一)[J].环境监测管理与技术,2003,15(5):11-14.doi:10.3969/j.issn.1006-2009.2003.05.006.QI W Q, CHEN G, XI J Q, ZONG H J,SUN Z G,WANAG Z G,WANG Q.The pollution and monitoring of radioactive nuclides(Continuation)[J].The Administration and Technique of Environmental Monitoring,2003,15(5):11-14.doi:10.3969/j.issn.1006-2009.2003.05.006.
[4] 厉以强.生物监测的意义、现状及展望[J].环境导报,1996(2):26-27.doi:CNKI:SUN:HJDB.0.1996-02-012.L I Y Q.Significance, situation and future of biological monitoring[J].Environment Herald, 1996(2):26-27.doi:CNKI:SUN:HJDB.0.1996-02-012.
[5] 韩均先.我国核电站运行对周围居民健康的影响分析[J].产业与科技论坛,2018, 17(6):137-138.HAN J X.Analysis of the impact of nuclear power plant operation on the health of the residents around China[J].Industrial Science Tribune,2018, 17(6):137-138.
[6] 吴玉林,陈志刚.中国核电核安全文化建设实践及思考[J].环境保护,2018, 46(12):36-38.doi:CNKI:SUN:HJBU.0.2018-12-009.WU Y L, CHEN Z G.Summary and cogitation of China nuclear power industry safety culture construction[J].Environmental Protection.2018, 46(12):36-38.doi:CNKI:SUN:HJBU.0.2018-12-009.
[7] 张军,王文科,耿雅妮,任雪盈,王周锋,曹书苗.黑麦草抗氧化酶对Cd、Zn和Pb复合污染的响应[J].农业环境科学学报,2018, 37(6):79-86.doi:CNKI:SUN:NHBH.0.2018-06-010.ZHANG J, WANG W K, GENG Y N, WANG Z F,CAO S Y.The response to the combined pollution of cadmium, zinc, and lead by the antioxidant enzyme activity of Lolium perenne L[J].Journal of Agro-Environment Science, 2018, 37(6):79-86.doi:CNKI:SUN:NHBH.0.2018-06-010.
[8] 杨俊兴,胡健,雷梅,杨军,郭俊娒,曹绍宽,叶志鸿,曹柳.锌胁迫下湿地植物抗氧化系统反应及锌富集能力[J].生态学杂志,2017,36(8):2274-2281.doi:10.13292/j.1000-4890.201708.006.YANG J X, HU J, LEI M, YANG J,GUO J M,CAO S K,YE Z H,CAO L.Antioxidant system responses and bioaccumulation of Zn in wetland plants under Zn stress[J].Chinese Journal of Ecology, 2017,36(8):2274-2281.doi:10.13292/j.1000-4890.201708.006.
[9] ROY S, ARORA A, CHINNUSAMY V, Singh V P.Endogenous reduced ascorbate:an indicator of plant water deficit stress in wheat[J].Indian Journal of Plant Physiology, 2017,22(9):365-368.doi:10.1007/s40502-017-0308-x.
[10] 万五星,夏亚军,张红星,王娇,王效.北京远郊区臭氧污染及其对敏感植物叶片的伤害[J].生态学报,2013, 33(4):1098-1105.doi:10.5846/stxb201203220388.WAN W X, XIA Y J, ZHANG H X, WANG J,WANG X.The ambient ozone pollution and foliar injury of the sensitive woody plants in Beijing exurban region[J].Acta Ecologica Sinica, 2013, 33(4):1098-1105.doi:10.5846/stxb201203220388.
[11] 公勤,康群,王玲,李兆华.重金属铜对植物毒害机理的研究现状及展望[J].南方农业学报,2018(3):469-475.doi:CNKI:SUN:GXNY.0.2018-03-009.GONG Q, KANG Q, WANG L,LI Z H .Toxicity mechanism of heavy metal copper to plants :A review[J].Journal of Southern Agriculture,2018(3):469-475.doi:CNKI:SUN:GXNY.0.2018-03-009.
[12] 姜瑢,王美娥,陈卫平.环草隆与重金属复合污染对黄瓜及小麦的毒性效应评估[J].生态毒理学报,2017(3):544-555.doi:10.7524/AJE.1673-5897.20170113003.JIANG R, WANG M E, CHEN W P.Joint toxicity assessment of Siduron and heavy metals on cucumber and wheat seed germination and seedling growth[J].Asian Journal of Ecotoxicology, 2017(3):544-555.doi:10.7524/AJE.1673-5897.20170113003.
[13] 李慧蓉.生物监测技术及其研究进展[J].常州大学学报(自然科学版),2002, 14(2):57-60.doi:10.3969/j.issn.2095-0411.2002.02.018.LI H R.Biological monitoring technology and its progress in research[J].Journal of Jiangsu Institute of Petrochemical Technology,2002, 14(2):57-60.doi:10.3969/j.issn.2095-0411.2002.02.018.
[14] 张晓天.植物的“指示”功能[J].大自然探索,2000(1):10-11.ZHANG X T.The indicative function of plants[J].Exploration of Nature, 2000(1):10-11.
[15] 闫光兰,杨显金.大气污染对城市绿化植物叶片叶绿素含量的影响[J].南阳师范学院学报,2007, 23(6):55-57.doi:10.3969/j.issn.1002-6002.2007.02.022.YAN G L, YANG X J.Effect of atmosphere pollution on content of chlorophyll of plants leaf[J].Journal of Nanyang Teachers College,2007, 23(6):55-57.doi:10.3969/j.issn.1002-6002.2007.02.022.
[16] 储玲.铜尾矿废弃地重金属污染对三叶草幼苗生长和植物—土壤酶系统影响的研究[D].芜湖:安徽师范大学,2004.CHU L.Effects of heavy metals pollution on the seedling growth and plant-soil enzyme system of Trifolium repens in copper tail mining wasteland[D].Wuhu:Anhui Normal University, 2004.
[17] 刘勇,刘燕,杨丹,梁清,娄杰.三叶草(Trifolium repens)用于土壤镉污染的修复潜力[J].农业环境科学学报,2017, 36(11):2226-2232.doi:10.11654/jaes.2017-0518.LIU Y, LIU Y, YANG D,LIANG Q,LOU J.Remediation potential of Trifolium repens used in cadmium-contaminated soils[J].Journal of Agro-Environment Science, 2017, 36(11):2226-2232.doi:10.11654/jaes.2017-0518.
[18] 张晓雪,王丹,张志伟,徐长合,钟钼芝.水培条件下十种植物对88Sr和133Cs的吸收和富集[J].北方园艺,2009(10):65-67.doi:CN KI:SUN:BFYY.0.2009-10-020.ZHAGN X X, WANG D, ZHANG Z, XU C H,ZHONG M Z.Uptake and accumulation of 88Sr and 133Cs in ten plants of green manure and flower[J].Northern Horticulture, 2009(10):65-67.doi:CNKI:SUN:BFYY.0.2009-10-020.
[19] 赵世杰,许长成,邹琦,孟庆伟.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994(3):207-210.doi:CNKI:SUN:ZW SL.0.1994-03-017.ZHAO S J, XU C Z, ZOU Q, MENG Q W.Improvements of method for measurement of malondialdehvde in plant tissues[J].Plant Physiology Communications, 1994(3):207-210.doi:CNKI:SUN:ZW SL.0.1994-03-017.
[20] 向芬,李维,刘红艳,周凌云,丁玎,曾振.茶树叶绿素测定方法的比较研究[J].茶叶通讯,2016,43(04):37-40.doi:10.3969/j.issn.1009-525X.2016.04.010.XIANG F,LI W,LIU H Y, ZHOU L Y,DING D,ZENG Z.Comparisonon methods of chlorophyll extraction in Camellia sinensis[J].Tea Communication, 2016,43(04):37-40.doi:10.3969/j.issn.1009-525X.2016.04.010.
[21] 王喜全.原子吸收光谱法测定植物叶中微量重金属[J].理化检验(化学分册),2 0 0 7, 43(5):36 0-361.doi:10.3321/j.issn:1001-4020.2007.05.006.WANG X Q.Atomic absorption spectrometric determination of microamounts of heavy metals in plant leaves[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2007, 43(5):360-361.doi:10.3321/j.issn:1001-4020.2007.05.006.
[22] 安冰,唐运来,陈梅,王丹,罗学刚.玉米对Cs+的富集能力及Cs+对其抗氧化指标影响的研究[J].原子能科学技术,2011,45(10):1275-1280.AN B, TANG Y L, CHEN M, WANG D, LUO X G.Accumulation capability for Cs+ and Effects of Cs+ on antioxidant parameters in maize[J].Atomic Energy Science and Technology, 2011,45(10):1275-1280.
[23] 任少雄,王丹,闻方平,徐长合,徐凤亭.4种植物对133Cs和88Sr污染土壤的修复研究[J].西北植物学报,2012, 32(7):1433-1439.doi:10.3969/j.issn.1000-4025.2012.07.023.REN S X, WANG D, WEN F P, XU C H, XU F T.Phytoremediation of four plant species in 133Cs and 88Sr contaminated soil[J].Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(7):1433-1439.doi:10.3969/j.issn.1000-4025.2012.07.023.
[24] 唐永金,罗学刚,曾峰,江世杰.不同植物对高浓度Sr、Cs胁迫的响应与修复植物筛选[J].农业环境科学学报,2013,32(5):960-965.doi:CNKI:SUN:NHBH.0.2013-05-014.TANG Y J, LUO X G, ZENG F,JIANG S J.The responses of plants to high concentrations of strontium, cesium stress and the screening of remediation plants[J].Journal of Agro-Environment Science,2013,32(5):960-965.doi:CNKI:SUN:NHBH.0.2013-05-014.
[25] 杨叶.几种杨树对土壤锶及柴油胁迫的生理生化响应[D].绵阳:西南科技大学,2015.YANG Y.The physio-biochemical responses and enrichments of several populus species to strontium and diesel stress[D].Mianyang:Southwest University of Science and Technology, 2015.
[26] 洪晓曦,袁静,郑现明,夏梦,丁爱中,豆俊峰.油菜对Cs胁迫的响应及其对Cs富集规律的研究[J].农业环境科学学报,2017,36(12):2394-2400.doi:10.11654/jaes.2017-0688.HONG X X, YUAN J, ZHENG X M, XIA M, DING A Z, DOU J F.Accumulation and physio-biochemical responses of Brassia campestris L.to Cs stress[J].Journal of Agro-Environment Science, 2017,36(12):2394-2400.doi:10.11654/jaes.2017-0688.
[27] 储玲,刘登义,王友保,李影,刘慧君.铜污染对三叶草幼苗生长及活性氧代谢影响的研究[J].应用生态学报,2004,15(1):119-122.CHU L, LIU D Y, WANG Y B,LI Y,LIU H J.Effect of copper pollution on seedling growth and activate oxygen metabolism of Trifolium pratense[J].Chinese Journal of Applied Ecology,2004,15(1):119-122.
[28] 乔琳,盛东风,邓艳.重金属铜、锌、铁、铅污染对白菜幼苗鲜重及叶绿素含量的影响[J].广东农业科学,2010(2):40-42,47.doi:10.16768/j.issn.1004-874X.2010.02.013.QIAO L, SHENG D F, DENG Y.Effect of Cu, Zn, Fe and Pb pollution on the fresh weight and chlorophyll content of cabbage seedling[J].Guangdong Agricultural Sciences, 2010(2):40-42,47.doi:10.16768/j.issn.1004-874X.2010.02.013.
[29] ZHENG G, PEMBERTON R, LI P.Bioindicating potential of strontium contamination with Spanish moss Tillandsia usneoides[J].Journal of Environmental Radioactivity, 2016, 152:23-27.doi:10.1016/j.jenvrad.2015.11.010.
[30] 武慧斌.二氧化碳浓度升高对诱导高丹草和红三叶蓄积铯的影响[D].武汉:华中农业大学,2009.doi:10.7666/d.y1598356.WU X H.Effect of elevated carbon dioxide concentration on caesium accumulation induced by Hypericum and red clover[D].Wuhan:Huazhong Agricultural University, 2009.doi:10.7666/d.y1598356.
[31] 张晓雪,王丹,钟钼芝,徐长合,于海蛟,周国辉.鸡冠花(Celosia cristata Linn)对Cs和Sr的胁迫反应及其积累特征[J].核农学报,2010, 24(3):628-633.ZHANG X X, WANG D, ZHONG M Z,XU C H, YU H J,ZHOU G H.Response of Celosia cristata Linn.to Cs and Sr stress and their accumulation characteritic[J].Acata Agriculturae Nucleatae Sinica,2010, 24(3):628-633.
[32] 曾宪录,韩飞,钟艳梅,骆均平,廖富林.紫云英、田菁及光叶苕子富集硒、锶能力研究[J].福建农业科技,2017, 48(1):15-19.doi:10.13651/j.cnki.fjnykj.2017.01.004.ZENG X L, HAN F, ZHONG Y M,LUO J P,LIAO F L.Study on selenium-and strontium-concentrating capacity of milk vetch, Sesbania and smooth vetch[J].Fujian Agricultural Science and Technology,2017, 48(1):15-19.doi:10.13651/j.cnki.fjnykj.2017.01.004.
[33] 姜晓燕,刘淑娟,闫冬,何映雪,丁库克.植物对核素锶的吸附与富集作用研究现状[J].癌变·畸变·突变,2014, 26(6):463-466.doi:10.3969/j.issn.1004-616x.2014.06.014.JIANG X Y, LIU S J, YAN D, HE Y X, DIGN K K.Study on adsorption and enrichment of strontium by plants[J].Carcinogenesis,Teratogenesis and Mutagenesis, 2014, 26(6):463-466.doi:10.3969/j.issn.1004-616x.2014.06.014.
[34] HAMPTON C R, BOWEN H C, BROADLEY M R,HAMMOND J P,MEAD A, PAYNE K A, PRITHARD J, WHITE P J.Cesium toxicity in Arabidopsis[J].Plant Physiology, 2004, 136(3):3824-3837.
[35] WHITE P J, BROADLEY M R.Mechanisms of caesium uptake by plants.[J].New Phytologist, 2000, 147(2):241-256.doi:10.1046/j.1469-8137.2000.00704.x.
[36] QI Z, HAMP TON C R, SHIN R,BARKLA B J, WHITE P J, SCHSCHTMAN D P.The high affinity K+ transporter AtHAK5 plays a physiological role in planta at very low K+ concentrations and provides a caesium uptake pathway in Arabidopsis[J].Journal of Experimental Botany, 2008, 59(3):595-607.doi:10.1093/jxb/erm330.
[37] 杨俊诚,朱永懿,陈景坚,潘家荣,余柳青.137Cs在土壤中的污染行为与钾盐的防治效果[J].核农学报,2002, 16(6):376-381.doi:10.3969/j.issn.1000-8551.2002.06.009.YANG J C, ZHU Y Y, CHEN J J, PAN J R,YU L Q.Behavior of 137Cs in soils and potassium countermeasures[J].Journal of Nuclear Agricultural Sciences, 2002, 16(6):376-381.doi:10.3969/j.issn.1000-8551.2002.06.009.
[38] 陈继侠,任艳华.植物缺氮、磷、钾元素症状及防治技术[J].中 国农村 小康科技,2008(9):51-52.doi:10.3969/j.issn.1007-7774.2008.09.026.CHEN J X, REN Y H.Symptoms and control techniques of nitrogen,phosphorus and potassium deficiency in plants[J].Chinese Counfryside Well-off Technology, 2008(9):51-52.doi:10.3969/j.issn.1007-7774.2008.09.026.
[39] 陈佳广.植物适应钾营养胁迫的形态及生理特性[J].农业科技与装备,2015(5):31-32.doi:10.16313/j.cnki.nykjyzb.2015.05.010.CHEN J G.Form and physiological property of plant adaptation to potassium stress[J].Agricultural Science & Technology and Equipment, 2015(5):25-26.doi:10.16313/j.cnki.nykjyzb.2015.05.010.
[40] ZHENG G, PEMBERTON R, LI P.Assessment of Cs and Sr accumulation in two epiphytic species of Tillandsia(Bromeliaceae)in vitro[J].Chemistry & Ecology, 2016, 33(1):51-60.