植物转基因技术是一种将目的基因导入宿主植物并在植物中表达,以产生在农艺性状、抗性、营养品质等方面满足人类需求的技术[1]。转基因技术为作物新品种培育提供了新的技术途径,随着现代生物技术的迅速发展,植物转基因技术的研究与应用取得了显著成效,转基因技术也因此成为国际农业高新技术竞争的焦点和热点。
大豆是世界上最重要的粮油兼用的作物,是植物蛋白和油脂的重要来源,也是转基因技术商业化程度最高的作物。自1996年转基因作物商业化种植以来,全球转基因大豆的种植面积持续增加。据国际农业生物技术应用服务组织(ISAAA, http://www.isaaa.org/)统计,1996年转基因大豆种植面积为50万hm2,此后每年种植面积迅速扩增;2018年全球转基因农作物种植面积为1.917亿hm2,其中转基因大豆种植面积达到9 590万hm2,占全球转基因作物种植面积的50%。转基因大豆在世界上大面积种植创造了巨大的经济效益和社会效益,既降低了资金投入,又有效地保障了世界粮食安全。
大豆基因组测序的结果表明,大豆基因组中编码蛋白的基因超过4万个,挖掘和研究控制大豆产量、品质、抗病虫性、抗非生物胁迫和营养等重要性状的基因受到国内外学者广泛关注,并为大豆转基因育种提供基因资源[2]。相比较而言,转基因技术在我国大豆新品种培育方面的研究起步较晚,经过近10年的努力,我国在控制大豆重要性状的基因挖掘、功能验证、遗传转化、安全评价等方面开展研究并取得了重要研究进展。转基因大豆育种的推广和应用表明,高效、简便的遗传转化技术是推动大豆基因功能基因组学研究和应用的重要措施之一。因此,本文旨在通过对大豆遗传转化的再生体系的构建与优化、转化方法的探索与研究、大豆转化效率的关键影响因素等进行阐述,为大豆遗传转化技术的提高、转基因新品种培育的相关研究提供参考。
1 大豆遗传转化体系
大豆遗传转化主要包括外源基因导入大豆细胞和转化细胞能否再生出完整植株两个环节。转化细胞的再生频率和外植体的转化效率取决于受体系统和转化方法的有机结合,因此,外植体细胞的再生性及其再生频率的高低是开展大豆遗传转化的先决条件[3-4]。大豆遗传转化的受体系统有多种,主要包括体细胞胚受体系统、原生质体再生系统、愈伤组织再生系统、直接分化再生系统、生殖细胞再生受体系统[5]。随着大豆组织培养技术和转化方法的不断优化和完善,目前大豆遗传转化研究以不定芽器官发生再生体系和体细胞胚胎再生体系为主[6]。
1.1 不定芽器官发生再生体系
不定芽器官发生再生体系的外植体种类较多,主要包括子叶节、半种子、茎尖、下胚轴、初生叶、成熟叶、花序等。其中,应用最广最成熟的是以子叶节不定芽器官发生的再生体系。1980年,Cheng等[7]利用B5培养基首次以大豆子叶节为外植体诱导丛生芽,并获得了转基因大豆再生植株。以此为基础,国内外学者利用子叶节为外植体均获得了转基因大豆再生植株。在转化时,因子叶节划伤和摆放的位置、培养基组分、激素的种类和配比的不同等均会影响转化效率,因此,国内外学者一直在对子叶节转化的再生系统进行优化。
自2008年转基因生物新品种培育重大专项实施以来,国内学者利用不同基因型纷纷建立或优化大豆遗传转化体系。统计结果表明,大豆遗传转化主要集中在器官发生再生系统的建立与优化,且以农杆菌介导法为主要转化方法,以大豆子叶节、胚尖、半种子等为主要外植体(表1)。姬月梅等[8]以中豆32、Peking、早熟18和绥农14的子叶节为外植体,对外植体大小、培养基组分、培养时间等因素进行研究,优化遗传转化体系并获得TaNHX2转基因植株,转化率为3.78%。郝荣华等[9]以13个大豆品种为材料,根据再生过程中丛生芽数目、分析草丁膦和潮霉素对外植体再生的影响并确定其合适的筛选浓度,对农杆菌介导的子叶节转化体系进行了优化,转化效率达到3.2%。此后,我国学者利用不同大豆的基因型对遗传转化过程中各个环节/因素都进行了有益的探索,主要集中在种子消毒方法和时间、消毒剂的选择、不同除草剂及其浓度、农杆菌菌株及菌液浓度、侵染浓度和侵染时间、光照或黑暗共培养、共培养时间、乙酰丁香酮浓度、6-BA、IBA等因素,建立和优化了以农杆菌介导大豆子叶节的遗传转化体系[10-15]。杨权以河北省推广的3个大豆品种为材料,对农杆菌侵染后子叶节不定芽诱导的影响因素如萌发培养基、子叶节苗龄、外植体预处理温度、超声波处理时间和抗氧化剂浓度等转化条件进行了摸索,建立了一套转化系统,并将AtNHX5基因转入五星2号大豆品种[16]。姬长媛[17]从大豆种子的萌发方式和时间、子叶节的划伤方式、共培养阶段外植体的摆放方式、生长调节剂对芽诱导与芽伸长的影响等方面进行优化,建立了以吉林47子叶节为外植体的遗传转化体系。王爽等以中黄10号、Jack和水里站3个大豆品种为材料,将子叶和下胚轴的颜色和形态变化分成6种状态,以GUS基因瞬时表达效率为观察指标,比较了不同状态外植体靶细胞对农杆菌的敏感性,对农杆菌介导大豆子叶节遗传转化体系进行了有益的探索[18]。李冬梅等[19]以4个大豆品种的子叶节为外植体,观测了子叶节和丛生芽中GUS瞬时表达率,建立了一个稳定高效的大豆遗传转化体系。Li等[20]以Tianlong 1、Jack Purple、 DLH、NN419、Williams 82、HZM、NN34和NN88-1等受体,改进了农杆菌侵染子叶节的效率和外植体的再生率,设置并优化GA3和IAA的浓度组合,通过观测子叶节和丛生芽中GUS瞬时表达率,优化了再生体系,转化效率高达7%~10%。张福丽等利用中黄20、周豆02005、周豆11和周豆18整体子叶节为材料,以MSB为基本培养基,对6-BA、IBA和KT等激素设计9种浓度组合研究大豆整体子叶节丛生芽再生的影响,PCR分析和GUS染色分析表明转化效率为7.8%,获得转化体的周期缩短为35~42 d[21],进而以中黄13的整体子叶节为外植体,转化效率高达23.1%[22]。
表1 2010年以来大豆遗传转化研究进展情况
Table 1 Research progress of soybean genetic transformation since 2010
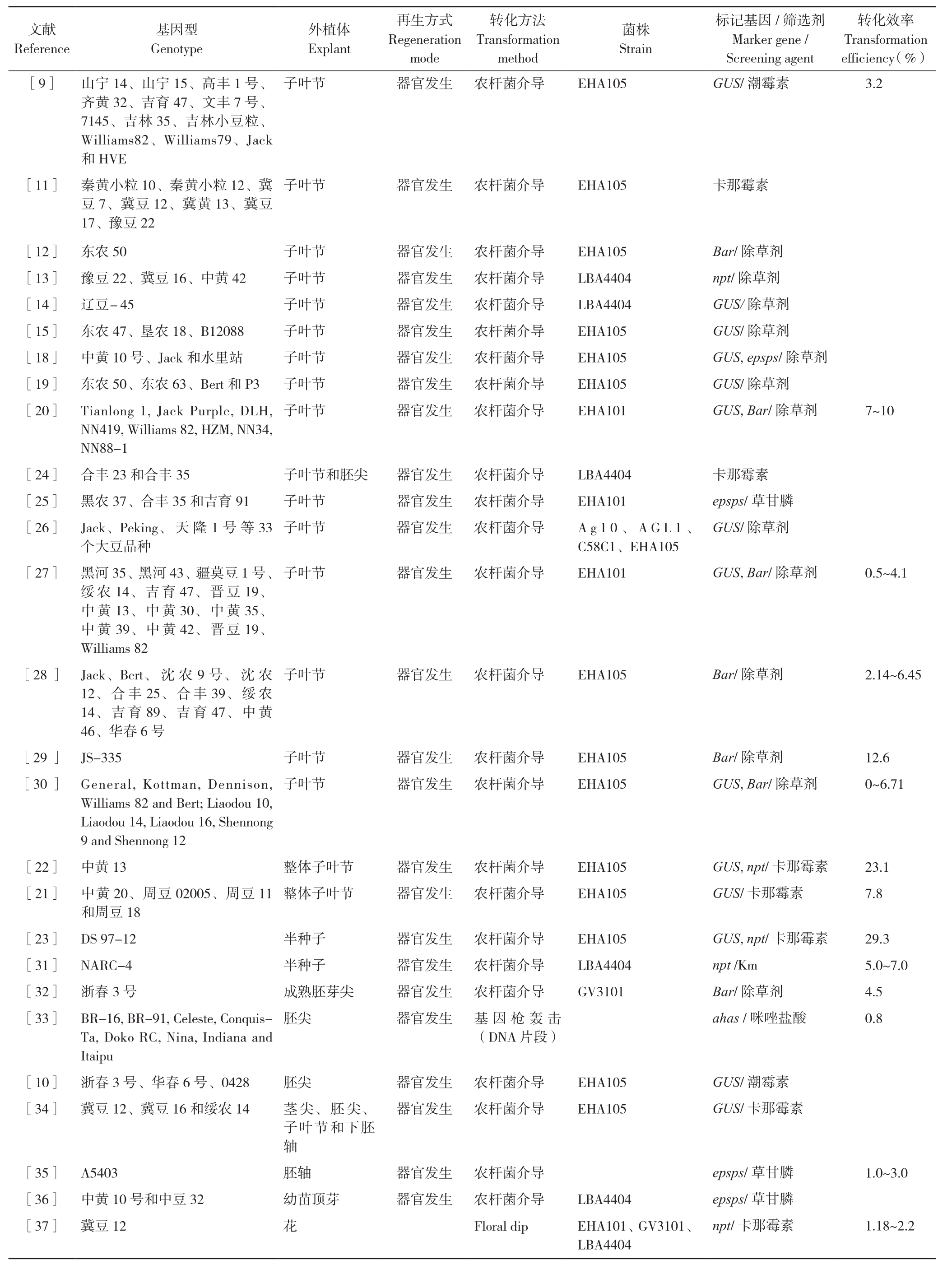
文献Reference基因型Genotype外植体Explant再生方式Regeneration mode转化方法Transformation method菌株Strain标记基因/筛选剂Marker gene /Screening agent转化效率Transformation efficiency(%)[9] 山宁14、山宁15、高丰1号、齐黄32、吉育47、文丰7号、7145、吉林35、吉林小豆粒、Williams82、Williams79、Jack和HVE子叶节 器官发生 农杆菌介导 EHA105 GUS/潮霉素 3.2[11] 秦黄小粒10、秦黄小粒12、冀豆7、冀豆12、冀黄13、冀豆17、豫豆22子叶节 器官发生 农杆菌介导 EHA105 卡那霉素[12] 东农50 子叶节 器官发生 农杆菌介导 EHA105 Bar/除草剂[13] 豫豆22、冀豆16、中黄42 子叶节 器官发生 农杆菌介导 LBA4404 npt/除草剂[14] 辽豆- 45 子叶节 器官发生 农杆菌介导 LBA4404 GUS/除草剂[15] 东农47、垦农18、B12088 子叶节 器官发生 农杆菌介导 EHA105 GUS/除草剂[18] 中黄 10 号、Jack和水里站 子叶节 器官发生 农杆菌介导 EHA105 GUS, epsps/除草剂[19] 东农50、东农63、Bert和P3 子叶节 器官发生 农杆菌介导 EHA105 GUS/除草剂[20] Tianlong 1, Jack Purple, DLH,NN419, Williams 82, HZM, NN34,NN88-1子叶节 器官发生 农杆菌介导 EHA101 GUS, Bar/除草剂 7~10[24] 合丰23和合丰35 子叶节和胚尖 器官发生 农杆菌介导 LBA4404 卡那霉素[25] 黑农37、合丰35和吉育91 子叶节 器官发生 农杆菌介导 EHA101 epsps/草甘膦[26] Jack、Peking、天隆1号等33个大豆品种子叶节 器官发生 农杆菌介导 A g 1 0、A G L 1、C58C1、EHA105 GUS/除草剂[27] 黑河35、黑河43、疆莫豆1号、绥农14、吉育47、晋豆19、中黄13、中黄30、中黄35、中黄 39、中黄42、晋豆19、Williams 82子叶节 器官发生 农杆菌介导 EHA101 GUS, Bar/除草剂 0.5~4.1[28 ] Jack、Bert、 沈农 9号、沈农12、合丰25、合丰39、绥农14、吉育89、吉育47、中黄46、华春 6 号子叶节 器官发生 农杆菌介导 EHA105 Bar/除草剂 2.14~6.45[29 ] JS-335 子叶节 器官发生 农杆菌介导 EHA105 Bar/除草剂 12.6[30 ] General, Kottman, Dennison,Williams 82 and Bert; Liaodou 10,Liaodou 14, Liaodou 16, Shennong 9 and Shennong 12子叶节 器官发生 农杆菌介导 EHA105 GUS, Bar/除草剂 0~6.71[22] 中黄13 整体子叶节 器官发生 农杆菌介导 EHA105 GUS, npt/卡那霉素 23.1[21] 中黄20、周豆02005、周豆11和周豆18整体子叶节 器官发生 农杆菌介导 EHA105 GUS/卡那霉素 7.8[23] DS 97-12 半种子 器官发生 农杆菌介导 EHA105 GUS, npt/卡那霉素 29.3[31] NARC-4 半种子 器官发生 农杆菌介导 LBA4404 npt /Km 5.0~7.0[32] 浙春3号 成熟胚芽尖 器官发生 农杆菌介导 GV3101 Bar/除草剂 4.5[33] BR-16, BR-91, Celeste, Conquis-Ta, Doko RC, Nina, Indiana and Itaipu胚尖 器官发生 基因枪轰击(DNA片段)ahas /咪唑盐酸 0.8[10] 浙春3号、华春6号、0428 胚尖 器官发生 农杆菌介导 EHA105 GUS/潮霉素[34] 冀豆12、冀豆16和绥农14 茎尖、胚尖、子叶节和下胚轴器官发生 农杆菌介导 EHA105 GUS/卡那霉素[35] A5403 胚轴 器官发生 农杆菌介导 epsps/草甘膦 1.0~3.0[36] 中黄10号和中豆32 幼苗顶芽 器官发生 农杆菌介导 LBA4404 epsps/草甘膦[37] 冀豆12 花 Floral dip EHA101、GV3101、LBA4404 npt/卡那霉素 1.18~2.2
国外学者采用子叶节、胚尖和半种子等外植体,通过农杆菌介导法优化了遗传转化体系,也取得了较高的转化效率。例如,Arun等[23]以DS 97-12的半种子为外植体,在培养基中加入多胺,并与植物生长调节因子进行组合,通过PCR和GUS染色分析添加多胺对共培养、芽诱导、茎伸长和生根阶段对转化体系的影响,统计结果表明转化效率高达29.3%。近10年以来的统计结果表明,农杆菌介导的大豆遗传转化体系被国内学者广泛采用,转化效率也有较大提高,但与国外成熟的遗传转化体系相比较,转化效率总体偏低。国内大多数实验室主要采用大豆子叶节为外植体,通过建立和优化相关环节,筛选到合适的基因型,可稳定地获得转化体,但转化效率整体没有突破性进展,稳定在10%以上转化效率的体系较少(表1)。
1.2 体细胞胚胎发生再生体系
体细胞胚胎发生再生体系是以植物的体细胞胚胎作为遗传转化受体,结合适当的转化方法,把外源基因转入不同的基因型形成再生植株的系统。植物体细胞胚再生体系的理论基础是植物细胞全能性,体细胞胚胎起源于单细胞,具有两极性、再生能力强,且体细胞团密度大稳定性高、可一次性得大量植株。大豆体细胞胚胎再生体系常用的外植体有未成熟子叶、未成熟胚和未成熟下胚轴等,可有效避免嵌合体的产生,通过提高转化效率而成为适合大豆遗传转化的再生系统之一[38]。
1983年,Christianson等[39]首次以未成熟胚的胚轴为外植体,在MS培养基中添加5 mg/L 2,4-D和20 mmol/L柠檬酸铵,诱导体细胞胚胎发生并获再生植株。Finer等利用体细胞胚胎悬浮培养技术建立了体细胞胚胎发生再生体系,随后采用胚性细胞团作为外植体对该体系进行改进,转化效率和筛选效率均得到提高[40-41]。在此基础上,国内外学者分别以大豆未成熟体细胞胚、未成熟子叶等诱导胚状体并获得了再生植株[42]。王晓春等对受体胚的发育状态、体细胞胚受伤处理、预培养和筛选时间等因素进行分析,研究结果表明受伤处理球形期的体细胞胚作为转化受体,体细胞胚团的转化率可达8.0%,而发育晚期的子叶胚的转化率为0[43]。Raza等[44]以9个澳大利亚不同熟期的大豆栽培种为材料,对体细胞胚胎诱导、再生、成熟、萌发和植株再生等器官发生过程进行研究,诱导效率的统计结果表明,大豆体细胞胚胎和植株再生存在基因型差异,其中品种Snowy适合做体细胞胚胎发生再生体系的受体。分子机制研究发现,GmAGL15直接调控GmSERF1和GmSERF2促进乙烯生物合成和响应,进而促进大豆体细胞胚胎发生,且胚胎发生的早期及调控基因的变化均与GmAGL15的表达量积累有关[45-46]。GmESR1基因编码茎再生增强子,调控大豆再生相关的基因;GmESR1基因过表达可促进大豆种子萌发、幼苗茎和根的伸长,为建立有效和稳定的大豆胚胎再生转化系统提供基础[47]。
经过多年研究,前人主要在大豆基因型、体细胞胚的取材大小及时间、预培养时间、激素种类和浓度等因素进行探索,建立并优化了大豆体细胞胚再生体体系。与不定芽器官发生再生体系相比较,大豆体细胞胚再生体系的细胞生物学、分子基础、基因型与农杆菌菌株的敏感性等研究不足,表现为遗传转化再生频率低、重复性差,多为单基因转化、受体基因型单一、诱导出的体细胞易发生突变、多次继代后体细胞胚性丧失等问题,因此,大豆体细胞胚胎发生再生系统尚待深入研究和应用。
2 大豆遗传转化方法
遗传转化方法是基因功能验证、转基因大豆性状改良和新品种培育的前提条件。国内外大豆遗传转化的方法较多,主要包括农杆菌介导法、基因枪法、花粉管通道法、显微注射法、PEG法、电激法、超声波辅助农杆菌转化法等,其中农杆菌介导法和基因枪法是最常用的遗传转化方法[3,6]。
2.1 农杆菌介导法
农杆菌在侵染植物伤口进入细胞后,其自身细胞内Ti质粒或Ri质粒上的T-DNA可插入到植物基因组中,形成一种天然的植物遗传转化体系。农杆菌介导法是指人们对T-DNA区进行改造并将目的基因插入其中,借助农杆菌感染植物伤口实现将外源基因整合进植物的基因组中,再通过细胞和组织培养技术再生出转基因植株,实现目标基因在植物体内表达而改变植物的遗传特性[3]。农杆菌介导法具有操作流程简单、经济成本低、外源基因插入的拷贝数低、转移的基因片段较长(≥50 kb)等优点[48],是应用最广泛的一种植物遗传转化技术。
农杆菌介导法是在大豆中应用最早、最常用的方法。Hinchee等[49]首次以大豆叶盘为外植体进行遗传转化,获得大豆转基因植株。Parrot等[50]对叶盘法进行改良,以大豆子叶为外植体进行遗传转化,以100个栽培大豆品种为研究材料,通过农杆菌侵染诱导产生不定芽并获得再生植株,并鉴定了不同大豆基因型对农杆菌的敏感性,其中有3个基因型对农杆菌敏感。叶盘法此后便得到不断的改良,农杆菌介导的大豆遗传转化大多采用子叶、下胚轴、子叶节、胚尖等器官为外植体。在早期的研究中,人们利用农杆菌介导子叶节转化系统,将nptⅡ、GUS、bar、Bt基因等导入大豆,所有这些基因便作为标记基因或筛选基因广泛应用于不同的大豆遗传转化体系,推动农杆菌介导的大豆遗传转化体系优化和转化效率的提高。
近10年来,农杆菌介导法在国内外大豆基因遗传转化中的应用越来越广泛,其中以大豆子叶节为外植体进行转化的研究报道居多。2012年,张福丽等以中黄20、周豆02005、周豆11和周豆18整体子叶节为材料,以MSB为基本培养基,通过正交设计研究了6-BA、IBA和KT等9种浓度组合对大豆整体子叶节丛生芽再生的影响,建立了农杆菌介导的大豆整体子叶节再生体系,转化效率为7.8%[21];以中黄13为受体并优化了农杆菌介导大豆子叶节转化系统,转化效率高达23.1%[22]。郝荣华等以13种大豆品种为材料,根据丛生芽数目选取优势基因型为受体材料,依据外植体的再生情况确定草丁膦和潮霉素的合适筛选浓度,并结合GUS基因的分子鉴定优化农杆菌介导大豆子叶节的遗传转化体系及其转 化 效 率[9]。Jia 等[30] 以 General、Kottman、Dennison、Williams 82、Bert、Liaodou 10、Liaodou 14、Liaodou 16、Shennong 9和 Shennong 12为受体,检测转化过程中植物内源激素和小分子物质含量、相关基因的表达量变化,结果表明农杆菌介导法存在基因型显著差异,其中Williams 82、Shennong 9和Bert受体的转化效率为5%~6.71%,而其他受体的转化效率则较低。王爽等[18]以中黄10、Jack和水里站3个品种为材料,以GUS基因瞬时表达效率为指标,以子叶和下胚轴的颜色和形态变化划分外植体的6种状态,比较不同状态外植体靶细胞对农杆菌的敏感性,以确定制备外植体的最佳时期。皮照兴等[14]以辽豆45为材料,对消毒方法、草铵膦浓度、侵染浓度、侵染时间、乙酰丁香酮浓度、共培养时间等方面进行了优化。Hada等[29]以印度大豆JS-335为受体,对除草剂浓度和暴露程度等因素进行研究,优化了农杆菌介导大豆子叶节的遗传转化体系,转化效率为12.6%。Li等[20]以Tianlong 1、Jack Purple、 DLH、NN419、Williams 82、HZM、NN34和NN88-1为受体,建立并优化了再生体系,转化效率高达7%~10%。李冬梅等以东农50、Bert、东农63和P3为受体,以子叶节为外植体,以子叶节和丛生芽GUS瞬时表达率为指标,优化了大豆遗传转化过程并建立一个稳定高效的大豆遗传转化体系[19]。
此外,杨海英等[32]以浙春3号成熟胚尖为受体,姚丙晨等[24]以合丰23和合丰35的子叶节和胚尖为外植体,舒英杰等[51]以湘豆3号的胚尖为受体,对建立稳定高效的农杆菌介导的大豆遗传转化再生体系作了有益的探索。郭兵福等[34]以萌发大豆幼苗顶芽为外植体建立的大豆遗传转化体系,有效地解决了基因型依赖及再生植株困难等问题。Arun等[23]以DS 97-12的半种子为外植体,采用农杆菌EHA105介导,转化效率高达29.3%。统计结果表明,农杆菌介导法存在基因型差异,且与培养基组分、外植体状态存在互作,即使采用相同的基因型,转化效率也存在较大差异(表1)。
2.2 基因枪法
基因枪法又叫粒子轰击细胞法或微弹技术,是利用压缩气体(氮气或氦气)产生的冷气体冲击波将包裹外源基因或目的DNA片段的钨或金颗粒表面,加速轰击植物外植体组织,粘有DNA的细微金属颗粒穿过细胞壁、细胞膜和细胞质到达细胞核,将外源基因整合进植物细胞核,基因枪法在对农杆菌侵染不敏感植物中广泛应用[38]。与农杆菌介导法相比,基因枪法具有相对较高的转化率、对外植体的基因型没有依赖性、可多拷贝转移目的DNA片段或者重组DNA等优点,其缺点表现为需要特定设备、转化成本高、转移相对较小的外源基因片段(≥10 kb)、转基因植株易发生基因重组和嵌合体等[6]。
Mccabe等[52]以大豆茎尖分生组织为受体,用基因枪将外源DNA包被的钨粉粒轰击茎尖细胞团,并获得转基因大豆。此后,利用基因枪介导大豆体细胞胚进行遗传转化的报道不断出现,受体材料主要包括大豆未成熟子叶体细胞胚、子叶节胚性细胞团、悬浮体细胞团、胚性悬浮培养物外植体和体细胞团等,转化效率远远高于农杆菌介导法。2000年,Aragão等[53]以大豆胚尖为外植体,利用基因枪进行遗传转化并获得了转基因植株,转化效率高达20.1%。国内学者也对基因枪转化法进行了优化。王鹏飞[54]以北方41个春大豆品种为受体,将抗病hrpZ基因转入大豆未成熟子叶体细胞胚中,并对体细胞胚发生率和转基因株系进行观测和鉴定,筛选到垦丰23等9个品种为理想的受体材料。研究表明,幼胚组织是最适于采用基因枪法进行大豆遗传转化的材料,在基因枪遗传转化体系中,转化效率和效果随金属微粒包裹的DNA纯度和浓度的升高而提高,且转基因拷贝数与DNA的用量直接相关,一般情况下采用DNA浓度≤1 mg/mL较为合适[55]。
2.3 花粉管通道法
花粉管通道法的主要原理是植物具有天然的花粉管通道,外源DNA在植物授粉后可沿着花粉管通道进行渗透,经过珠心进入胚囊,转化早期胚胎细胞的生殖细胞(如精子、卵子)或者尚未形成胞壁的受精卵细胞,进而被整合到受体细胞的基因组中,随受精卵的发育而形成转基因新个体。1980年,Hess[56]首次报道了花粉粒可吸收外源DNA的研究结果,这是花粉管通道技术的雏形。20世纪80年代初期,我国学者周光宇提出花粉可与外源DNA进行远源杂交的原理,并于1983年成功地将外源海岛棉DNA导入陆地棉,培育出抗枯萎病的栽培品种,创立了花粉管通道法[57]。该法无需装备精良的实验室、常规育种者易于掌握、技术简单且不依赖于组织培养。花粉管通道法包括有微注射法、柱头滴加法、花粉粒携带法、子房注入法、开苞叶导入法等[58]。
1991年,Lei等[59]利用花粉管通道法将外源DNA导入大豆,转化后代表型分析的结果表明,转基因株系涉及成熟期、株型、花色等多个性状的变异。1994年,Lei等[60]将野生大豆DNA转化栽培大豆,获得转基因大豆植株并用RAPD分子标记进行分子验证。2009年,Liu等[61]利用花粉管通道法将无标记的smGFP片段转入大豆中,转化效率为3.2%。崔岩采[62]用花粉管通道技术将几丁质酶基因和Bt基因导入27个大豆品种,建立了花粉管通道转化法;形态学研究发现,根据大豆自花授粉后花蕾的形态特征进行遗传转化具有可行性。王翠艳等[37]研究了表面活性剂silwet L-77浓度、农杆菌浓度、不同农杆菌菌株对花粉管通道法遗传转化的影响,并成功将植酸酶基因转化冀豆12,转化效率为1.18%~2.22%。
研究表明,与农杆菌介导法和基因枪法相比,花粉管通道法转化效率低且重复性不高,这不仅取决于外源DNA片断的大小、DNA的纯度和浓度、进入胚囊的DNA能否参与受精,同时也受到外源DNA导入的方法和时期、大豆花期和环境因素的影响。因此,花粉管通道法并未得到广泛应用[6]。
2.4 其他转化方法
除了农杆菌介导法、基因枪法和花粉管通道法外,电激法、PEG法、超声波辅助农杆菌转化法、复合针刺伤法等也曾用于大豆遗传转化,这里不再阐述。
3 影响大豆转化效率的主要因素
与水稻和拟南芥相比,大豆的遗传转化效率依然偏低。影响大豆转化效率的因素较多,其中以基因型、农杆菌菌株、抗氧化剂、筛选剂、激素种类和浓度、胚状体的大小和状态等,且再生体系、转化方法、受体材料、培养条件等均会导致转化率差异较大。
3.1 基因型
对于农杆菌介导的遗传转化体系,基因型差异主要表现为农杆菌的易感性和组织培养的再生率。Hinchee等[49]以100多个大豆品种为材料研究基因型对农杆菌的敏感程度,结果表明,只有Peking大豆对农杆菌具有敏感反应。Donaldson等[63]以12个大豆品种为材料,只有1个品种(Accolibri)获得了遗传稳定的转基因植株。王凤敏等[64]比较了24个大豆基因型的再生能力,发现再生能力最强的品种是吉林小豆和Maverick。邱波等[65]以16个大豆品种为材料,采用农杆菌介导的子叶节法进行遗传转化,结果表明,大豆基因型再生性及其对农杆菌的敏感性均存在较大差异。杨向东等[4]分析了10个大豆基因型对农杆菌的敏感程度,结果表明GUS基因瞬时表达水平88%以上的只有JACK基因型。郝荣华等以13个大豆品种为受体,采用农杆菌介导法建立并优化大豆遗传转化体系,根据GUS基因的表达情况进行分析,在相同的芽诱导条件下,山宁14产生的丛生芽最多,更适合于大豆子叶节转化,其转化效率高达3.2%[9]。郭兵福等利用4种农杆菌菌株对33个大豆不同基因型进行分析,观测基因型对农杆菌的敏感性,结果表明,超毒农杆菌菌株Ag10对靶组织的侵染能力最强,且地方品种和野生种质在农杆菌侵染后GUS的平均瞬时表达效率显著高于栽培大豆品种,并筛选出6个对农杆菌敏感的受体材料[26]。杨静等[28]通过农杆菌介导子叶节法对11个国内外大豆品种对农杆菌的敏感性进行研究,BAR试纸条和PCR检测再生植株的结果表明,不同大豆基因型的再生率及转化效率存在显著差异,其中华春6号和沈农9号对农杆菌敏感,可用作转基因受体品种。陈普等[27]以国内不同地域的13个主栽大豆品种为材料,以丛生芽诱导率、芽伸长率和遗传转化效率为观察指标的研究结果表明,遗传转化率存在基因型差异,且高蛋白品种中黄42对农杆菌最敏感,转化效率可达4.1%。Li等[20]以9个大豆品种为受体,研究农杆菌浓度、外植体、农杆菌悬浮液等因素对转化效率的影响,观测不同浓度的GA3、IAA、AgNO3对芽诱导和茎伸长的作用,结果表明Jack Purple和天隆1号的转化效率最高。综合国内外学者的研究表明,器官发生再生系统和胚状体再生系统等主要遗传转化体系的转化效率对大豆基因型具有较高的依赖性(表1)。
3.2 农杆菌菌株
农杆菌菌株与大豆基因型也存在着互作,合适的农杆菌菌株影响着大豆遗传转化效率,目前常用的菌株包括EHA101、EHA105、LBA4404、GV3101、AGL1等[6]。国内外学者先后开发出多种农杆菌菌株,进行比较研究且用于大豆遗传转化。早期研究发现,强毒菌株具有较高的侵然效率和转化效率,且存在对再生体系的选择性差异。在大豆体细胞胚状体再生体系中,KYRT1菌株的侵染效率和转化效率均显著高于EHA101、EHA105、LBA4404等菌株;在大豆子叶节转化的再生体系中,KYRT1和EHA105的转化率无显著差异[66-67]。党尉等[68]利用 KYRT1、EHA105、LBA4404菌株侵然7个大豆基因型,也得到了类似的研究结果,即KYRT1比EHA105和LBA4404菌株具有更强的侵然能力。野生菌株KAT23是从桃树根部分离的一个新型强毒农杆菌菌株,该菌株对大豆和其他豆科植物具有较强的侵染能力,其致瘤效率比对照菌株C58高2倍以上[69]。将KAT23菌株进行改造,去掉Ti质粒上原有的致廇基因形成农杆菌菌株Soy2。Yukawa等[70]用Soy2菌株侵染5个不同的大豆品种,研究结果表明,Soy2对大豆的侵然效率比EHA105高2 倍以上。王凤敏等[64]选用EHA101、LBA4404和EHA105菌株同时侵然24个大豆基因型,结果表明,农杆菌EHA101菌株的侵染能力最强,LBA4404菌株的侵染效果最差,3种菌株侵然再生能力最强的基因型吉林小豆和Maverick后,EHA101菌株的侵染效果最好,吉林小豆和Maverick的GUS阳性率分别为40.25%和29.89%。郭兵福等[26]以易感性的大豆品种水里站和齐茶豆2号为受体,分析农杆菌菌株Ag10、AGL1、C58C1和EHA105对子叶节的侵然能力,结果表明,超毒农杆菌菌株Ag10对这2种基因型的侵染能力均最强,GUS在子叶节处靶细胞的瞬时表达效率分别为50%和38.1%,显著高于其它菌株。因此,通过研究农杆菌菌株与大豆基因型的互作关系,筛选毒性较强的农杆菌菌株和易感性大豆基因型,可有效提高大豆遗传转化效率。
3.3 抗氧化剂
农杆菌侵染大豆外植体后往往产生多酚氧化酶和过氧化氢酶等物质,影响细胞的正常代谢,常会导致外植体褐化和坏死,这是植物对农杆菌侵染防御反应的一种表现[71]。国内外学者早期的研究表明,在组织培养基中加入抗氧化剂如L-半胱氨酸、AgNO3、抗坏血酸(Vc)、二硫苏糖醇(DTT)、聚乙烯吡咯烷酮(PVP)等,可减轻组织的褐化和坏死,提高遗传转化效率。Olhoft等[72]首次研究抗氧化剂的作用,发现在共培养基中加入单一的抗氧化剂L-Cys可提高大豆遗传转化效率3倍以上。王昌陵等[73]将一定浓度的L-Cys加入共培养或诱导丛生芽阶段的培养基中,结果表明,抗氧化剂的使用可以显著提高抗性丛生芽的诱导率。若在共培养培养基中添加DTT、L-Cys和硫代硫酸钠等混合物,受体Bert的转化效率大大提高,平均为16.4%[72]。在培养基中加入适量AgNO3也可降低外植体褐化的发生,Olhoft 等[74]最早在培养基中加入AgNO3降低了外植体的褐化作用。李海燕等[75]将L-Cys和AgNO3混合物添加到培养基中,能够显著抑制大豆外植体的褐化。Wang等[76]以大豆的下胚轴为外植体,将适量的AgNO3加入诱导培养基中,可显著提高不定芽诱导率。
除大豆基因型、农杆菌菌株、抗氧化剂外,国内外学者对筛选剂、激素、胚状体、转化方法、培养条件等因素也进行过广泛研究,并对不同类型的再生体系进行优化,提高了大豆遗传转化效率,为大豆基因挖掘和分子育种提供理论依据。
4 展望
国内外学者经过多年研究,建立和优化了多套遗传转化体系,在大豆基因功能验证、性状改良、新品种培育等方面发挥重要作用。随着大豆功能基因组学的发展和我国转基因大豆新品种培育研究的推进,拥有稳定、高效的遗传转化技术依然是大豆转基因研究的核心问题之一。多年的研究结果表明,不定芽器官发生再生体系依然是大豆遗传转化的主要采用的再生系统,而农杆菌介导法则是大豆遗传转转化的主流方法。由于大豆对光周期敏感性强,生产上推广应用品种的适应区域有限,因此,今后大豆遗传转化研究应以生产上主栽品种作为主要基因型,对该转化方法和再生体系进行优化;同时,推进其他再生系统的优化和完善,以满足我国转基因大豆新品培育和功能基因研究的需要。
[1]屈聪玲,贺榆婷,王瑞良,杨致荣,王兴春.植物转基因技术的过去、现在和未来[J].山西农业科学,2017, 45(8): 1376-1380, 1383.doi:10.3969/j.issn.1002-2481.2017.08.39.QU C L, HE Y T, WANG R L, YANG Z R, WANG X C.The past,present and future of plant transgenic technology[J].Journal of Shanxi Agricultural Sciences, 2017, 45(8): 1376-1380, 1383.doi:10.3969/j.issn.1002-2481.2017.08.39.
[2]SCHMUTZ J, CANNON S B, SCHLUETER J, JACKSON S A.Genome sequence of the palaeopolyploid soybean[J].Nature, 2010, 463:178-183.doi:10.1038/nature08670.
[3]任海洋,南海洋,曹东,刘晓冰,刘宝辉,孔凡江.大豆转化技术研究进展[J].东北农业大学学报,2012, 43(7): 6-12.doi: 10.19720/j.cnki.issn.1005-9369.2012.07.002.REN H X, NAN H Y, CAO D, LIU X B, LIU B H, KONG F J.Progress and perspective on soybean genetic transformation[J].Journal of Northeast Agricultural University, 2012, 43(7): 6-12.doi:10.19720/j.cnki.issn.1005-9369.2012.07.002.
[4]杨向东,隋丽,李启云,杨静,邢国杰,郭东全,董英山.大豆遗传转化技术研究进展[J].大豆科学,2012, 31(2): 302-310, 315.doi:10.11861/j.issn.1000-9841.2012.02.0302.YANG X D, SUI L, LI Q Y, YANG J, XING G J, GUO D Q,DONG Y S.Recent advances in soybean transformation[J].Soybean Science, 2012, 31(2): 302-310, 315.doi: 10.11861/j.issn.1000-9841.2012.02.0302.
[5]王关林,方宏筠.植物基因工程原理与技术[M].北京: 科学出版社,1998.GUAN Z L, FAGN H J.Principles and techniques of plant genetic engineering[M].Beijing: Science Press, 1998.
[6]李艳超,赵青松,王凤敏,陈强,史晓蕾,杨春燕.大豆遗传转化技术研究进展[J].大豆科学,2015, 34(1): 155-162.doi: 10.11861/j.issn.1000-9841.2015.01.0155.LI Y C, ZHAO Q S, WANG F M, CHEN Q, SHI X L, YANG C Y.Research progress on soybean genetic transformation technology[J].Soybean Science, 2015, 34(1): 155-162.doi: 10.11861/j.issn.1000-9841.2015.01.0155.
[7]CHENG T Y, SAKA T, VOQUI-DINH T H.Plant regeneration from soybean cotyledonary node segments in culture[J].Plant Science Letters, 1980, 19: 91-99.
[8]姬月梅,陈受宜,李英慧,张丽娟,宋晓华,常汝镇,邱丽娟.农杆菌介导大豆子叶节遗传转化体系的优化研究[J].大豆科学,2008,27(1): 26-32.JI Y M, CHEN S Y, LI Y H, ZHANG L J, SONG X H, CHANG R Z,QIU L J.Optimization of genetic transformation system from soybean cotyledon mediated by agrobacterium[J].Soybean Science, 2008, 27(1):26-32.
[9]郝荣华,邵群,杨素欣,李继存,冯献忠,赵彦修.根癌农杆菌介导的大豆子叶节转化体系的优化[J].大豆科学,2012, 31(2): 167-172.doi: 10.11861/j.issn.1000-9841.2012.02.0167.HAO R H, SHAO Q, YANG S X, LI J C, FENG X Z, ZHAO Y X.Optimization of agrobacterium-mediated soybean transformation using the cotyledonary node[J].Soybean Science, 2012, 31(2): 167-172.doi: 10.11861/j.issn.1000-9841.2012.02.0167.
[10]马晓丽,冯小锋,杨清华,郁晓敏,朱丹华.影响大豆遗传转化主要因素及相关条件优化[J].浙江农业学报,2013, 25(6): 1183-1188.doi: 10.3969/j.issn.1004-1524.2013.06.03.MA X L, FENG X F, YANG Q H, YU X M, ZHU D H.Optimization of main factors and relevant conditions affecting soybean agrobacteriummediated transformation system[J]. Acta Agriculturae Zhejiangensis,2013, 25(6): 1183-1188.doi: 10.3969/j.issn.1004-1524.2013.06.03.
[11]李桂兰,刘晨光,乔潇,杨晓倩,王迪,乔亚科.共培养条件对农杆菌转化大豆子叶节的影响[J].核农学报,2014, 28(9): 1567-1575.doi: 10.11869/j.issn.100-8551.2014.09.1567.LI G L, LIU C G, QIAO X, YIANG X Q, WANG D, QIAO Y K.Conditions of co-culture affecting on the efficiency of agrobacteriummediated transformation of cotyledonary node of soybean[J].Journal of Nuclear Agricultural Sciences, 2014, 28(9): 1567 -1575.doi:10.11869/j.issn.100-8551.2014.09.1567.
[12]刘银,孔月琴,唐慧,史秀岚,王幼平.影响农杆菌介导大豆遗传转化的因素[J].扬州大学学报,2014, 35(1): 71-75.doi: 10.16872/j.cnki.1671-4652.2014.01.017.LIU Y, KONG Y Q, TANG H, SHI X L, WANG Y P.Affecting factors of agrobacterium-mediated transformation of soybean[J].Journal of Yangzhou UniversityAgricultural and Life Science Edition), 2014,35(1): 71-75.doi:10.16872/j.cnki.1671-4652.2014.01.017.
[13]刘晨光,董秋平,乔亚科,杨晓倩,张锴,李桂兰.农杆菌介导大豆遗传转化优化的初步研究[J].河北农业大学学报,2016, 39(2):126-130.doi: 10.13320/j.cnki.jauh.2016.0047.LIU C G, DONG Q P, QIAO Y K, YANG X Q, ZHANG K, LI G L.Preliminary study on agrobacterium-mediated genetic transformation optimization of soybeans[J].Journal of Agricultural University of Hebei, 2016, 39(2): 126-130.doi: 10.13320/j.cnki.jauh.2016.0047.
[14]皮照兴,廉玉利,李依娜,崔唱,杨楠.农杆菌介导的大豆子叶节遗传转化研究[J].辽宁师专学报,2016, 18(3): 85-90.PI Z X, LIAN Y L, LI Y N, CUI C, YANG N.On agrobacteriummediated genetic transformation system of soybean cotyledon node[J].Journal of Liaoning Teachers College, 2016, 18(3): 85-90.
[15]杨明明,高海京,马啸燕,孙英楠,邵宇鹏,包格格,李文滨,王志坤.利用GUS基因的瞬时表达优化大豆根癌农杆菌介导的遗传转化[J].大豆科学,2019, 38(3): 353-359.doi: 10.11861/j.issn.1000-9841.2019.03.0353.YANG M M, GAO H J, MA X Y, SUN Y N, SHAO Y P, BAO G G, LI W B, WANG Z K.Optimization of agrobacterium-mediated genetic transformation of soybean with transient expression of GUS gene[J].Soybean Science, 2019, 38(3): 353-359.doi: 10.11861/j.issn.1000-9841.2019.03.0353.
[16]杨权.大豆子叶节转化体系的优化及抗逆基因AtNHX5的遗传转化研究[D].保定: 河北农业大学,2012.YANG Q.The research on optimization of soybean cotyledonary node regeneration and genetic transformation of resistance gene AtNHX5[D].Baoding: Agricultural University of Hebei, 2012.
[17]姬长媛.大豆子叶节遗传转化体系的优化及大豆异黄酮相关合成酶基因转基因大豆的鉴定[D].长春: 吉林大学,2015.JI CHANGYUAN.Optimization of soybean cotyledonary-node genetic transformation system and identification of soybean isoflavone synthase gene transgenic plant[D].Changchun: Jilin University, 2015.
[18]王爽,郭兵福,张丽娟,郭勇,金龙国,杨慧,邱丽娟.农杆菌介导大豆子叶节转化法外植体选择新方法[J].大豆科学,2016, 35(5):723-729.doi: 10.11861/j.issn.1000-9841.2016.05.0723.WANG S, GUO B F, ZHANG L J, GUO Y, JIN L G, YANG H, QIU L J.New method for the selection of explants in the agrobacterium mediated cotyledon nodes transformation in soybean(Glycine max L.)[J].Soybean Science, 2016, 35(5): 723-729.doi: 10.11861/j.issn.1000-9841.2016.05.0723.
[19]李冬梅,陈薇,李永光,李文滨.大豆子叶节遗传转化体系的优化研究[J].大豆科学,2018, 37(4): 531-538.doi: 10.11861/j.issn.1000-9841.2018.04.0531.LI D M, CHEN W, LI Y G, LI W B.Optimization for the transformation system of soybean cotyledon node[J].Soybean Science, 2018, 37(4):531-538.doi: 10.11861/j.issn.1000-9841.2018.04.0531.
[20]LI S X, CONG Y H, LIU Y P, WANG T T, SHUAI Q, CHEN N N, GAI J Y, LI Y.Optimization of agrobacterium-mediated transformation in soybean[J].Frontiers in Plant Science, 2017, 8: 246.doi: 10.3389/fpls.2017.00246.
[21]张福丽,舒文涛,张怡,高丹,张丽,陆亚杰,罗祥,李成伟.大豆整体子叶节再生体系的建立及应用于农杆菌介导遗传转化初探[J].大豆科学,2012, 31(6): 865-868.doi: 10.11861/j.issn.1000-9841.2012.06.0865.ZHANG F L, SHU W T, ZHANG Y, GAO D, ZHANG L, LU Y J, LUO X, LI C W.Cluster bud induction of soybean whole cotyledonary node and application in agrobacterium-mediated genetic transformation[J].Soybean Science, 2012, 31(6): 865-868.doi: 10.11861/j.issn.1000-9841.2012.06.0865.
[22]ZHANG F L, CHEN C, GE H L, LIU J M, LUO Y L, LIU K, CHEN L,XU K D, ZHANG Y, TAN G X, LI C W.Efficient soybean regeneration and agrobacterium-mediated transformation using a whole cotyledonary node as an explant[J].Biotechnol Appl Biochem, 2014, 61(5): 620-625.doi: 10.1002/bab.1207.
[23]ARUN M, CHINNATHAMBI A, SUBRAMANYAM K, KARTHIK S, SIYANANDHAN G, THEBORAL J, ALHARBI S A, KIM C K,GANAPATHI A.Involvement of exogenous polyamines enhances regeneration and agrobacterium-mediated genetic transformation in half-seeds of soybean[J].Biotechnology, 2016, 6:148.doi: 10.1007/s13205-016-0448-0.
[24]姚丙晨,沈艳茹,韩雪,王琳琳,刘春燕,胡国华,陈庆山.大豆子叶节和胚尖再生体系的比较及大豆SR1基因的遗传转化[J].大豆科学,2012, 31(3): 364-373.doi: 10.11861/j.issn.1000-9841.2012.03.0364.YAO B C, SHEN Y R, HAN X, WANG L L, LIU C Y, HU G H,CHEN Q S.Comparison with cotyledonary node and embryonic tip regeneration system in soybean[Glycine max(L.)Merrill]and genetic transformation of SR1[J].Soybean Science, 2012, 31(3): 364-373.doi: 10.11861/j.issn.1000-9841.2012.03.0364.
[25]王伟,王罡,季静,郑丽红,关春峰.大豆子叶节植株再生体系的优化及转 EPSPS基因的研究[J].作物杂志,2012(3): 23-27.doi:10.16035/j.issn.1001-7283.2012.03.010.WANG W, WANG G, JI J, ZHENG L H, GUAN C F.Optimization of plant regeneration system via cotyledonary node and transformation of EPSPS gene in soybean[J].Crops, 2012(3): 23-27.doi:10.16035/j.issn.1001-7283.2012.03.010.
[26]郭兵福,马岩松,张丽娟,洪慧龙,常汝镇,郭勇,邱丽娟.不同大豆基因型对农杆菌敏感性研究及优异种质筛选[J].植物遗传资源学报,2015, 16(3): 569-575.doi: 10.13430/j.cnki.jpgr.2015.03.020.GUO B F, MA Y S, ZHANG L J, HONG H L, CHANG R Z, GUO Y,QIU L J.Assessment of agrobacterium sensitivity for different soybean genotypes and suitable germplasm screening[J].Journal of Plant Genetic Resources, 2015, 16(3): 569-575.doi: 10.13430/j.cnki.jpgr.2015.03.020.
[27]陈普,陈莉,韩天富,东方阳,侯文胜.中国大豆主栽品种遗传转化效率相关性状的比较研究[J].中国油料作物学报,2016, 38(1):27-33.doi: 10.7505/j.issn.1007-9084.2016.01.005.CHEN P, CHEN L, HAN T F, YANG D F, HOU W S.Comparative studies on traits related to agrobacterium-mediated transformation efficiency of popular soybean cultivars in China[J].Chinese Journal of Oil Crop Sciences, 2016, 38(1): 27-33.doi: 10.7505/j.issn.1007-9084.2016.01.005.
[28]杨静,邢国杰,杜茜,隋丽,郭东全,牛陆,杨向东.不同大豆基因型对大豆遗传转化效率的影响及外源T-DNA插入分析[J].大豆科学,2016, 35(4): 562-567.doi: 10.11861/j.issn.1000-9841.2016.04.0562.YANG J, XING G J, DU Q, SUI L, GUO D Q, NIU L, YANG X D.effects of different soybean genotypes on the transformation efficiency of soybean and analysis of the T-DNA insertions in the soybean genome[J].Soybean Science, 2016, 35(4): 562-567.doi: 10.11861/j.issn.1000-9841.2016.04.0562.
[29]HADA A, KRISHNAN V, PUNJABI M, BASAK N, PANDEY V,JEEVARAJ T, MARATHE A, GUPTA A K, JOLLY M, KUMAR A,DAHUJA A, MANICKAVASAGAM M, GANAPATHI A, SACHDEY A.Refined glufosinate selection and its extent of exposure for improving the agrobacterium-mediated transformation in Indian soybean(Glycine max)genotype JS-335[J].Plant Biotechnology, 2016, 33:341-350.doi: 10.5511/plantbiotechnology.15.0901a.
[30]JIA Y Y, YAO X D, ZHAO M Z, ZHAO Q, DU Y L, YU C M, XIE F T.Comparison of soybean transformation efficiency and plant factors affecting transformation during the agrobacterium infection process[J].International Journal of Molecular Sciences, 2015, 16, 18522-18543.doi: 10.3390/ijms160818522.
[31]ZIA M, MIRZA B, MALIK S A, CHAUDHARY M F.Expression of rol genes in trans-genic soybean(Glycine max L.)leads to changes in plant phenotype, leaf morphology, and flowering time[J].Plant Cell Tissue & Organ Culture, 2010, 103: 227-236.doi: 10.1007/s11240-010-9771-z.
[32]杨海英,朱丹华,胡小丽,杨清华,袁凤杰,董德坤.农杆菌介导的大豆成熟胚芽尖遗传转化体系的优化[J].核农学报,2011, 25(4):665-672.doi: 10.11869/j.issn.100-8551.2011.04.0665.YANG H Y, ZHU D H, HU X L, YANG Q H, YUAN F J, DONG D K.Optimization of agrobacterium-mediated transformation systems[J].Journal of Nuclear Agricultural Sciences, 2011, 25(4): 665-672.doi: 10.11869/j.issn.100-8551.2011.04.0665.
[33]VIANNA GR, ARAGO F J L, RECH E L.A minimal DNA cassette as a vector for genetic transformation of soybean(Glycine max)[J].Genetics and Molecular Research, 2011, 10(1): 382-390.doi:10.4238/vol10-1gmr1058.
[34]郭兵福.农杆菌介导的大豆遗传转化体系优化与应用[D].南昌:南昌大学,2012.GUO B F.The optimization and application of soybean genetic transformation system mediated by agrobacterium[D].Nanchang:Nanchang University, 2012.
[35]MARTINELL B J, JULSON L S, EMLER C A, HUANG Y, MCCABE D E.Soybean transformation method: US Patents,US 8030076 B2[P].2011-10-04.
[36]郭兵福,刘杰,洪慧龙,邱丽娟.一种简便大豆原位转基因方法研究[J].大豆科学,2012, 31(3): 347-352.doi: 10.11861/j.issn.1000-9841.2012.03.0347.GUO B F, LIU J, HONG H L, QIU L J.A simple soybean in planta transformation method[J].Soybean Science, 2012, 31(3): 347-352.doi: 10.11861/j.issn.1000-9841.2012.03.0347.
[37]王翠艳,丁东风,丁晓菊,阎瑞香,廖芳,赵磊,陈苗,李伟东,乔坤艳,刘菁,李明刚.Floral dip法在大豆遗传转化中的应用研究[J].南开大学学报,2010, 43(1): 34-38.WANG C Y, DING D F, DING X J, YAN R X, LIAO F, ZHAO L, CHEN M, LI W D, QIAO Y K, LIU J, LI M G.Application of Floral dip on the transformation of soybean[J].Acta Scientiarum Naturalium Universitatis Nankaiensis, 2010, 43(1): 34-38.
[38]何禹璇,郭东全,钱雪艳,杨向东,李闯,董英山,王丕武.大豆体细胞胚胎组织培养及遗传转化研究进展[J].中国农学通报,2013,29(36): 21-27.HE Y X, GUO D Q, QIAN X Y, YANG X D, LI C, DONG Y S, WANG P W.The research process on somatic embryo tissue culture and genetic transformation in soybean[J].Chinese Agricultural Science Bulletin,2013, 29(36): 21-27.
[39]CHRISTIANSON M L, WARNICK DA, CARLSON P S.A morphogenetically competent soybean suspension culture[J].Science,1983, 222: 632-634.
[40]FINER J J.Apical proliferation of embryogenic tissue of soybean(Glycine max L.Merrill)[J].Plant Cell Reports, 1988, 7(4):238-241.
[41]FINER J J, NAGASAWA A.Development of an embryogenic suspension culture of soybean(Glycine max L.Merrill)[J].Plant Cell Tissue and Organ Culture, 1988, 15(2): 125-136.
[42]程琳静.大豆体细胞胚再生体系的优化和遗传转化的初步研究[D].上海: 上海交通大学,2013.CHENG L J.Research of soybean somatic embryo regeneration optimized and genetic transformation[D].Shanghai: Shanghai Jiaotong University, 2013.
[43]王晓春,王罡,季静,王萍,刘尚前.农杆菌介导的大豆体细胞胚遗传转化影响因子的研究[J].大豆科学,2005, 24(1): 21-26.WANG X C, WANG G, JI J, WANG P, LIU S Q.The factors influencing genetic transformation system in somatic embryos of soybean mediated by agrobacterium[J].Soybean Science, 2005, 24(1): 21-26.
[44]RAZA G, SINGH M B, BHALLA P L.Somatic embryogenesis and plant regeneration from commercial soybean cultivars[J].Plants,2020, 9(1): 38.doi:10.3390/plants9010038.
[45]ZHENG Q L, ZHENG Y M, PERRY S E.AGAMOUS-like15 promotes somatic embryogenesis in Arabidopsis and soybean in part by the control of ethylene biosynthesis and response[J].Plant Physiology,2013, 161: 2113-2127.doi: 10.1104/pp.113.216275.
[46]PERRY S E, ZHENG Q L, ZHENG Y M.Transcriptome analysis indicates that GmAGAMOUS-Like 15 may enhance somatic embryogenesis by promoting a dedifferentiated state[J].Plant Signaling & Behavior, 2016, 11(7): e1197463.doi:10.1080/15592324.2016.1197463.
[47]ZHENG C, WU X D, ZHENG B B, CHEN Q S, LIU M, XIN D W, QI Z M, LI S N, MA Y L, WANG L S, JIN Y M, LI W B, WU X X, SU A Y.Functional analysis of the GmESR1 gene associated with soybean regeneration[J].PLoS ONE, 2017, 12(4): e0175656.doi: 10.1371/journal.pone.0175656.
[48]HANSEN G, WRIGHT M S.Recent advances in the transformation of plants[J].Trends Plant Science, 1999, 4: 226-231.doi: 10.1016/S1360-1385(99)01412-0.
[49]HINCHEE M A, CONNOR-WARD D V, NEWELL C A, MCDONNELL R E, SATO S J, GASSER C S, FISCHHOFF D A, RE D B, FRALEY R T, HORSCH R B.Production of transgenic soybean plants using agrobacterium-mediated DNA transfer[J].Nature Biotechnology,1988, 6: 915-922.
[50]PARROTT W A, HOFFMAN L M, HILDEBRAND D F, WILLIAMS E G, COLLINS G B.Recovery of primary transformants of soybean[J].Plant Cell Reports, 1989, 7(8): 615-617.
[51]舒英杰,唐玉超,周玉丽,胡能兵,何庆元,黄守程.“湘豆3号”大豆胚尖遗传转化受体再生系统的建立[J].基因组学与应用生物学,2016, 35(12): 3507-3513.doi: 10.13417/j.gab.035.003507.SHU Y J, KANG Y C, ZHOU Y L, HU N B, HE Q Y, HUANG S C.Establishment of the genetic transformation receptor regeneration system of Xiangdou No.3〔Glycine max(L.)Merr.〕[J].Genomics and Applied Biology, 2016, 35(12): 3507-3513.doi: 10.13417/j.gab.035.003507.
[52]MCCABE D E, SWAIN WF, MARTINELL BJ, CHRISTOU P.Stable transformation of soybean(Glycine max)by particle acceleration[J].Biotechnology, 1988, 6: 923-926.
[53]ARAGÃO FJL, SAROKIN L, VIANNA GR, RECH E L.Selection of transgenic meristematic cells utilizing a herbicidal molecule results in the recovery of fertile transgenic soybean〔Glycine max(L.)Merrill〕plants at a high frequency[J].Theoretical and Applied Genetics,2000, 101: 1-6.
[54]王鹏飞.利用基因枪转化技术创造抗病大豆新材料[D].哈尔滨:东北农业大学,2013.WANG PENGFEI.Create resistance of new soybean by using bombardment technology[D].Harbin: Northeast Agricultural University, 2013.
[55]王军,付爱根,徐敏,王玉华.基因枪法在遗传转化中的研究进展[J].基因组学与应用生物学,2018, 37(1): 459-468.doi: 10.13417/j.gab.037.000459.WANG J, FU A G, XU M, WANG Y H.Research progress of gene gun bombardment in genetic transformation[J].Genomics and Applied Biology, 2018, 37(1): 459-468.doi: 10.13417/j.gab.037.000459.
[56]HESS D.Pollen based techniques in genetics manipulation[J].International Review of Cytology, 1987, 107:376-395.
[57]周光宇,翁坚,龚蓁蓁,曾以申,杨晚霞,沈慰芳,王自芬,陶全洲.农业分子育种-授粉后外源DNA导入植物的技术[J].中国农业科学,1988, 21(3): 1-6.ZHOU G Y, WENG J, GONG Q Q, ZENG Y S, YANG W X, SHEN W F,WANG Z F, TAO Q Z.Molecular breeding of agriculture-A technique for introducing exogenous DNA into plants after self-pollination[J].Scientia Agricultura Sinica, 1988, 21(3): 1-6.
[58]简纯平,李开绵,欧文军.花粉管通道法转基因育种研究进展[J].热带作物学报,2012, 33(5): 956-961.doi: 10.3969/j.issn.1000-2561.2012.05.033.JIAN C P, LI K J, OU W J.Research progress in pollen-tube pathway method in transgenic plants[J].Chinese Journal of Tropical Crops,2012, 33(5): 956-961.doi: 10.3969/j.issn.1000-2561.2012.05.033.
[59]雷勃钧,尹光初,卢翠华,钱华,张开旺,周思君,王树林.外源DNA直接导入大豆的研究[J].大豆科学,1991, 10(1): 58-63.LEI B J, YIN G C, LU C H, QIAN H, ZHANG K W, ZHOU S J, WANG S L.Study of exogeneous DNA directly transferred into soybean[J].Soybean Science, 1991, 10(1): 58-63.
[60]LEI B J, LI X C, LU C H, QIAN H, ZHOU S J, XIE W W, WANG B.Introduction of wild soybean DNA into cultivar soybean and molecular RAPD confirmation[J].Science in China(Series B), 1994, 24: 596-601.
[61]LIU J F, SU Q, AN L J, YANG A F.Transfer of a minimal linear marker free and vector-free smGFP cassette into soybean via ovary-drip transformation[J].Biotechnological Letters, 2009, 31(2): 295-303.doi: 10.1007/s10529-008-9851-x.
[62]崔岩.大豆利用花粉管通道技术导入抗病虫目的基因的研究[D].哈尔滨: 东北农业大学,2000.CUI Y.The study on the technique of pollen tube pathway used to introduce insect-resistant and disease-resistant gene into soybeans[D].Harbin: Northeast Agricultural University, 2000.
[63]DONALDSON P A, SIMMONDS D H.Susceptibility to agrobacterium tumefaciens and cotyledonary node transformation in short-season soybean[J].Plant Cell Reports, 2000, 19(5): 478-484.
[64]王凤敏,李涛,王运杰,荆慧贤,史晓蕾,张孟臣,邸锐,蒋春志.影响农杆菌介导大豆子叶节遗传转化因素的研究[J].大豆科学,2011, 30(4): 557-562.doi: 10.11861/j.issn.1000-9841.2011.04.0557.WANG F M, LI T, WANG Y J, JING H X, SHI X L, ZHANG M C, DI R,JIANG C Z.Assessment of factors affecting soybean cotyledonary-node agrobacterium-mediated genetic transformation[J].Soybean Science,2011, 30(4): 557-562.doi: 10.11861/j.issn.1000-9841.2011.04.0557.
[65]邱波,王志坤,孟凡立,李文滨.不同大豆基因型再生性及对农杆菌敏感性的研究[J].大豆科学,2011, 30(5): 752-756.doi:10.11861/j.issn.1000-9841.2011.05.0572.QIU B, WANG Z K, MENG F L, LI W B.Regeneration and sensitivity to agrobacterium of different soybean genotype[J].SOYBEAN SCIENCE, 2011, 30(5): 752-756.doi: 10.11861/j.issn.1000-9841.2011.05.0572.
[66]MEURER C A, DINKINS R D, COLLINS G B.Factors affecting soybean cotyledonary node transformation[J]. Plant Cell Reports,1998, 18(3): 180-186.
[67]TORISKY RS, KOVACS L, AVDIUSHKO S, NEWMAN J D, HUNT A G, COLLINS G B.Development of a binary vector system for plant transformation based on the super-virulent agrobacterium tumefaciens strain Chry5[J].Plant Cell Reports, 1997, 17: 102-108.
[68]党尉,卫志明.根癌农杆菌介导的高效大豆遗传转化体系的建立[J].分子细胞生物学报,2007(3): 185-195.DANG W, WEI Z M.Efficient agrobacterium-mediated transformation of soybean[J].Journal of Molecular Cell Biology, 2007(3): 185-195.
[69]YUKAWA K, KAKU H, TANAKA H.Characterization and host range determination of soybean super virulent Agrobacterium tumefaciens KAT23[J].Bioscience, Biotechnology and Biochemistry, 2007, 71(7):1676-1682.doi: 10.1271/bbb.70082.
[70]YUKAWA K, KAKU H, TANAKA H.Enhanced soybean infection by the legume ‘super-virulent’ Agrobacterium tumefaciens strain KAT23[J].Bioscience, Biotechnology and Biochemistry, 2008, 72(7):1809-1816.doi:10.1271/bbb.80080.
[71]王栋,买合木提·克衣木,王永雄,胡艳.植物组织培养中的褐化现象及其防止措施[J].黑龙江农业科学,2008(1): 7-10.doi:10.3969/j.issn.1002-2767.2008.01.002.WANG D, MAIHEMUTI K, WANG Y X, HU Y.Browning phenomenon in plant tissue culture and its prevention measures[J].Heilongjiang Agricultural Sciences, 2008(1): 7-10.doi: 10.3969/j.issn.1002-2767.2008.01.002.
[72]OLHOFT P M, FLAGEL L E, DONOVAN C M, SOMERS D A.Efficient soybean transformation using hygromycin B selection in the cotyledonarynode method[J].Planta, 2003, 5: 723-735.doi: 10.1007/s00425-002-0922-2.
[73]王昌陵,赵军,李英慧,范云六,张丽娟,刘章雄,关荣霞,吕淑霞,常汝镇,邱丽娟.转录因子ABP9转化大豆(Glycine max L.)及遗传转化条件优化[J].中国农业科学,2008, 41(7): 1908-1916.doi:10.3864/j.issn.0578-1752.2008.07.005.WANG C L, ZHAO J, LI Y H, FAN Y L, ZHANG L J, LIU Z X, GUAN R X, LV S X, CHANG R Z, QIU L J.Transforming transcription factor ABP9 into soybean and optimization of the transformation system[J].Scientia Agricultura Sinica, 2008, 41(7): 1908-1916.doi: 10.3864/j.issn.0578-1752.2008.07.005.
[74]OLHOFT P M, FLAGEL L E, SOMERS D A.T-DNA locus structure in a large population of soybean plants transformed using the agrobacterium-mediated cotyledonary-node method[J].Plant Biotechnology Journal, 2004, 2: 289-300.
[75]李海燕,刘淼,武小霞,韩英鹏,李文滨.大豆转化过程中的褐化现象研究[J].作物杂志,2010(1): 33-36.doi: 10.16035/j.issn.1001-7283.2010.01.011.LI H Y, LIU M, WU X X, HAN Y P, LI W B.Study on the browning during soybean transformation[J].Crops, 2010(1): 33-36.doi:10.16035/j.issn.1001-7283.2010.01.011.
[76]WANG G L, XU Y N.Hypocotyl based Agrobacterium mediated transformation of soybean(Glycine max)and application for RNA interference[J].Plant Cell Reports, 2008, 27(7): 1177-1184.