【研究意义】芥蓝(Brassica oleracea var.alboglabra)为十字花科芸薹属甘蓝种的一个变种,以花薹为主要食用部分,风味独特,是华南地区的特色蔬菜品种[1]。芥蓝纯系(即自交系)的创制,是进一步选育芥蓝常规种、杂交种的基础和前提。传统的纯系生产方法,主要依赖于杂交后的连续自交纯化,一般需自交6~8个世代。然而,芥蓝是喜凉蔬菜作物,在华南地区只有冬春季能正常开花结实,使其自交系的选育周期漫长、育种效率低下。因此,芥蓝育种发展较慢,品种数量较少、类型较单一[2],已经越来越难以满足生产需求。利用组织培养或诱导系诱发单倍体,再通过染色体加倍产生纯合度为100%的双单倍体(Doubled Haploid, DH),是一种快速创制纯系(即DH系)的途径。在此基础上发展形成的单倍体育种技术,只需2~3个世代即可创制自交系,能大幅缩短育种周期、提高育种效率[3-4]。更为重要的是,单倍体育种技术的成熟发展,为作物基因组选择育种提供了重要支撑[5]。【前人研究进展】目前,单倍体育种已在跨国种子企业玉米、小麦和油菜等大田作物的育种中得到大规模应用[6-7]。在甘蓝、花椰菜、大白菜、萝卜等蔬菜作物,基于小孢子培养的单倍体育种技术也得到较多应用[8-11]。随着单倍体育种理论和应用基础研究的发展,可以预见,单倍体育种将成为未来最重要的育种关键技术之一。单倍体育种的技术流程,主要包括诱导产生单倍体、染色体加倍以及加倍植株的自交成系。单倍体育种流程相对较复杂,需要对各技术环节不断优化,加以改进。单倍体育种流程的建立和优化,对于缩短芥蓝育种周期、提高育种效率有重要意义。【本研究切入点】我们前期已对芥蓝小孢子培养技术开展了初步研究[12],发现胚状体的诱导率与材料基因型密切相关。在此基础上对芥蓝单倍体育种的技术流程进行整合和优化。【拟解决的关键问题】建立一套较完整有效的芥蓝单倍体育种技术流程,探讨芥蓝DH系的规模化生产和育种应用。
1 材料与方法
1.1 试验材料
利用Lb07M、612M、孤老种等14份不同类型的芥蓝材料(表1)开展小孢子培养。上述材料于2017年秋季播种于广东省农业科学院蔬菜研究所白云基地,按常规方法管理,至2017年12月中旬(盛花期)采集花蕾进行试验。
游离小孢子的采集和培养,使用B5液体培养基和NLN液体培养基;胚状体和小苗的培养,使用培养基B5固体培养基、MS和1/2 MS固体培养基。上述培养基均为公开配方,为方便使用,直接购买商业的预配培养基粉末,按厂家推荐方法进行配制和灭菌处理。其中,B5液体培养基和NLN液体培养基添加13%蔗糖,B5固体培养基、MS和1/2 MS固体培养基添加3%的蔗糖,pH均调整至 5.8~5.9。
用于染色体加倍处理的秋水仙素溶液,质量体积浓度为0.1%,溶剂为磷酸盐缓存溶液(pH7.0),同时含2%二甲基亚砜(DMSO)。
1.2 试验方法
1.2.1 研钵研磨提取芥蓝小孢子 选择处于盛花期的供体植株,于晴天上午采集花蕾。挑取适期(单核靠边期)花蕾40个,置于研钵,用75%乙醇消毒30 s,再用8%次氯酸钠灭菌15 min,最后用无菌蒸馏水冲洗3次。于研钵中加入5 mL的B5液体培养基,用研棒轻轻挤压花蕾使小孢子从花药中游离,然后将含游离小孢子的液体培养基倒入过滤器(网格大小为40 μm)过滤,滤液盛入50 mL离心管;重复2次,以尽可能多获得游离小孢子。
表1 供试14份芥蓝材料
Table 1 Fourteen Chinese kale accessions used for the trial
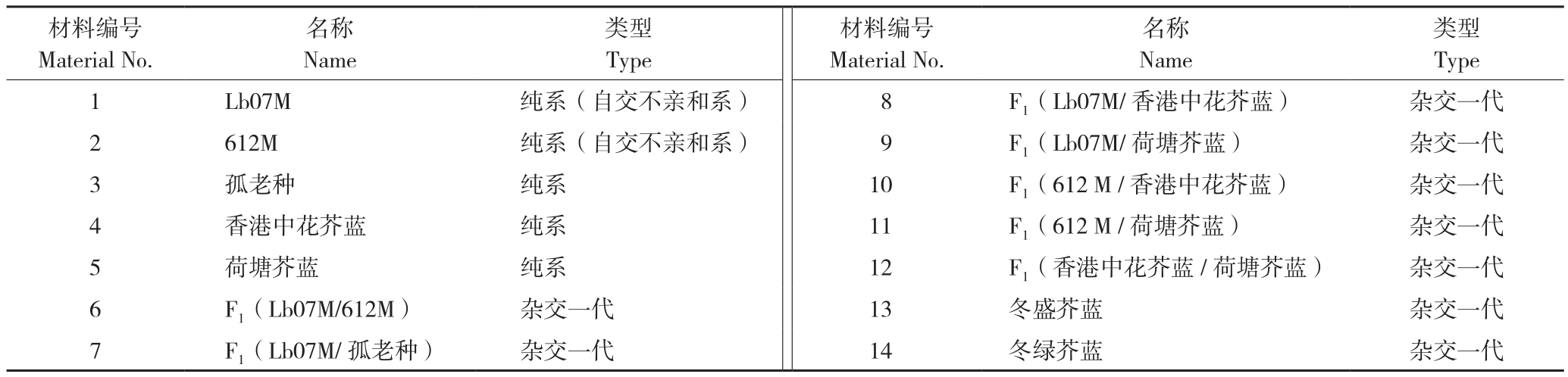
材料编号Material No.类型Type 1 Lb07M 纯系(自交不亲和系) 8 F1(Lb07M/香港中花芥蓝) 杂交一代2 612M 纯系(自交不亲和系) 9 F1(Lb07M/荷塘芥蓝) 杂交一代3孤老种 纯系 10 F1(612 M /香港中花芥蓝) 杂交一代4香港中花芥蓝 纯系 11 F1(612 M /荷塘芥蓝) 杂交一代5荷塘芥蓝 纯系 12 F1(香港中花芥蓝/荷塘芥蓝) 杂交一代6 F1(Lb07M/612M) 杂交一代 13 冬盛芥蓝 杂交一代7 F1(Lb07M/孤老种) 杂交一代 14 冬绿芥蓝 杂交一代名称Name类型Type材料编号Material No.名称Name
装有游离小孢子的离心管以1 000 r/min离心3 min,弃上清;再加入10 mLNLN液体培养基离心洗涤2次(1 000 r/min,3 min),弃上清。向离心管加入NLN液体培养基溶解小孢子,调节浓度,分装于直径60 mm培养皿(每皿约5 mL),用封口膜密封,做好标记。
1.2.2 离心管机械破碎提取芥蓝小孢子 在挑取用于手工研磨芥蓝花蕾的同时,从相同材料中挑取适期花蕾,用于机械破碎提取小孢子。将40个花蕾放入2 mL离心管,用75%乙醇消毒30 s,再用8%次氯酸钠灭菌15 min,最后用无菌蒸馏水冲洗3次。消毒和冲洗后的液体均用移液器尽可能地吸去。离心管内放入直径4 mm的灭菌钢珠,加入1 mL B5液体培养基;离心管盖好,放入FastPrep-24快速核酸提取仪(MP,美国),以4.0 m/s的振荡速度振荡20 s;将含游离小孢子的液体培养基倒入过滤器过滤,滤液盛入50 mL离心管,取适量B5液体培养基冲洗离心管2次,倒入过滤器。
装有游离小孢子的离心管以1 000 r/min离心3 min,弃上清;再加入10 mL NLN液体培养基离心洗涤2次(1 000 r/min,3 min),弃上清。获得的游离小孢子,加入NLN液体培养基调节浓度,分装于直径60 mm培养皿中(每皿约5 mL),用封口膜密封,做好标记。一般40个芥蓝花蕾提取的游离小孢子,调节浓度后可分装5个培养皿。
1.2.3 芥蓝游离小孢子的培养 将封口的培养皿先于32.5℃暗培养24 h,再转至25℃继续暗培养,一般2~3周出现胚状体;将胚状体移入B5固体培养基光照培养(20℃,14 h光/10 h暗,光强2 000 lx),15 d更换一次培养基进行继代培养;待形成子叶型、鱼雷型胚后,转移至MS培养基培养(20℃,14 h光/10 h暗,光强2 000 lx),诱导成苗,15 d更换一次培养基进行继代培养;经3~4次继代培养后,每个株系将不少于5个再生苗转移至1/2 MS固体培养基上进行生根培养,约2周后获得生长健壮的再生植株。
1.2.4 芥蓝单倍体的染色体加倍 将再生植株移至壮苗环境下(24℃,16 h光/8 h暗,光强2 000 lx)生长3~4 d后,用0.1%秋水仙素溶液浸根10 h进行加倍处理,再用自来水冲洗3~4 h,然后移栽至壮苗生长环境下缓苗2~3周。缓苗处理后,与其他未经秋水仙素处理的幼苗同时移栽至人工气候室,控制光照和温度,使其缓慢生长;待天气转凉(2018年9月)移栽至田间,在蕾期进行单株自交留种。
1.2.5 芥蓝再生苗染色体的细胞倍性鉴定 通过分析DNA含量,对芥蓝小孢子培养的再生苗进行染色体倍性鉴定。DNA含量测定利用流式细胞仪(Partec CyFlow PA,美国)完成,具体方法如下:取大小为0.5 cm×0.5 cm的鲜嫩叶片置于6 cm玻璃培养皿中,滴加400 μL核裂解液(Cystain UV precise P,Sysmex)浸没样品;用锋利刀片切割叶片,尽量使每刀都彻底切断,直至成为较小的叶片(注意不要成糊状);滴加1 600 μL核染色液(Cystain UV precise P,Sysmex)染色,然后在30 μm滤网过滤,上机测定染色体含量。
2 结果与分析
2.1 不同方法提取芥蓝小孢子诱导胚胎形成效果
前期研究中,发现芥蓝小孢子培养诱导胚胎形成的频率与基因型密切相关,通过筛选后只有部分材料能够有效诱导出胚状体。本研究利用经筛选过的5个纯系及其配制的杂交一代,以及2个已通过品种审定的杂交一代(冬盛芥蓝、冬绿芥蓝)共14份材料(表1),开展小孢子培养研究,并就不同方法提取小孢子诱导形成胚胎效果进行对比。结果(表2)表明,离心管机械破碎提取的芥蓝小孢子,平均胚状体诱导率为11.96%,略高于手工研磨的10.80%,但差异不显著。通过机械研磨,污染率低于研钵研磨,可能是导致其胚状体诱导率稍高于研钵研磨的主要原因。可见,机械破碎能够替代手工研磨来批量地处理样品,从而提高芥蓝小孢子的提取效率。
2.2 芥蓝再生苗的产生及倍性分析
芥蓝小孢子培养产生的胚状体,经继代培养后诱导形成再生苗(拟单倍体),再生苗又经历多次继代培养(图1A),最后经过生根培养(图1B),至第2年6月共得到112个芥蓝再生株系(每个株系不少于5株)。从诱导产生芥蓝胚状体,到最终形成完整再生植株,整个过程都可能发生染色体的加倍。在获得的芥蓝再生苗株系中,随机选50个单株,取其叶片进行染色体DNA含量测定,发现大多数为单倍体(图1C),仅有6个为二倍体(图1D)。推测通过小孢子培养得到的芥蓝再生苗大多数为单倍体。
2.3 芥蓝再生植株的田间表现
芥蓝小孢子培养获得的再生植株(拟单倍体),需经过染色体加倍,才有可能产生正常的花器官和配子,进而自交产生种子,形成DH系。从获得的112个芥蓝再生苗株系,取62个株系进行秋水仙素处理,再与其他未经处理的株系,一起移植至小盆,置于人工气候室下使其缓慢生长,至9月初移栽到田间。移栽后,持续观察芥蓝植株长势;在开花期,对花器官进行观察,对有花粉的植株进行人工自交。不同芥蓝材料产生的再生株系,秋水仙素处理或清水处理数量,及其获得DH系的数量如表3所示。
表2 不同方法采集芥蓝小孢子的培养效果
Table 2 Culture results of Chinese kale microspores isolated with different methods
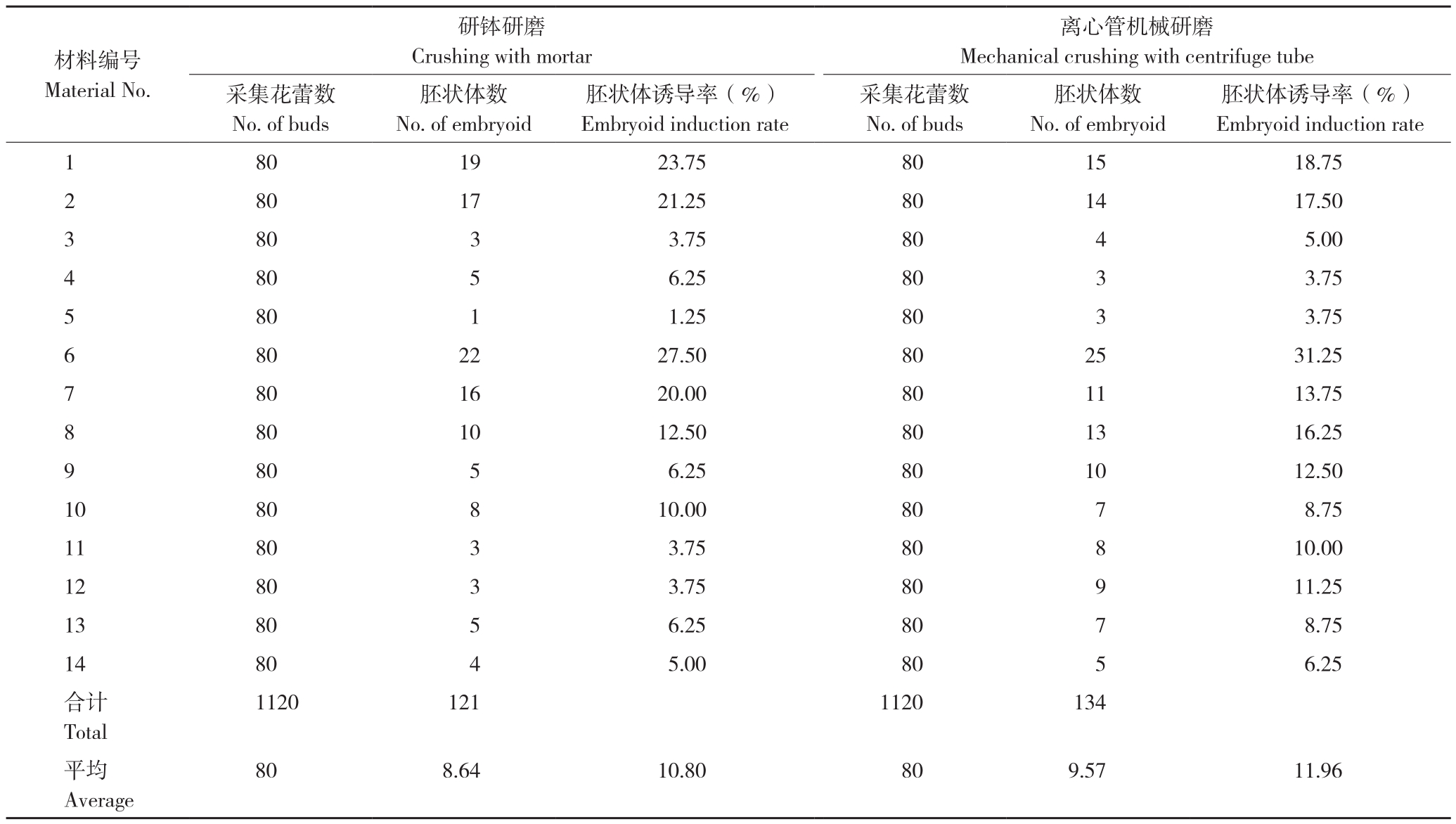
材料编号Material No.胚状体诱导率(%)Embryoid induction rate 1 80 19 23.75 80 15 18.75 2 80 17 21.25 80 14 17.50 3 80 3 3.75 80 4 5.00 4 80 5 6.25 80 3 3.75 5 80 1 1.25 80 3 3.75 6 80 22 27.50 80 25 31.25 7 80 16 20.00 80 11 13.75 8 80 10 12.50 80 13 16.25 9 80 5 6.25 80 10 12.50 10 80 8 10.00 80 7 8.75 11 80 3 3.75 80 8 10.00 12 80 3 3.75 80 9 11.25 13 80 5 6.25 80 7 8.75 14 80 4 5.00 80 5 6.25合计Total离心管机械研磨Mechanical crushing with centrifuge tube采集花蕾数No.of buds研钵研磨Crushing with mortar胚状体数No.of embryoid胚状体诱导率(%)Embryoid induction rate采集花蕾数No.of buds胚状体数No.of embryoid 1120 121 1120 134平均Average 80 8.64 10.80 80 9.57 11.96
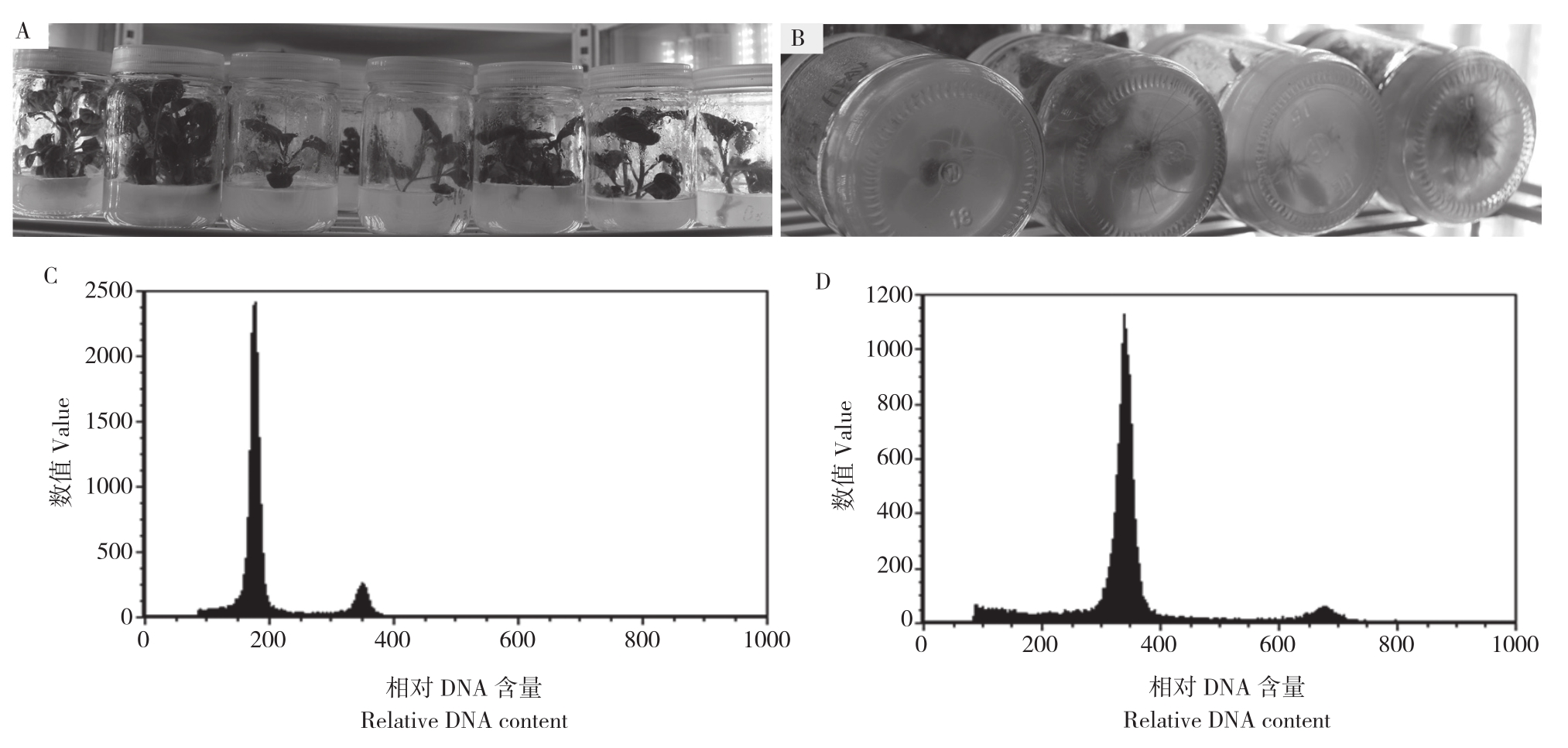
图1 芥蓝小孢子培养再生苗及其染色体DNA含量
Fig.1 Regenerated plantlets of microspore culture-based Chinese kale and determination of DNA content of chromosome
A、B:处于继代培养、生根培养的芥蓝再生苗;C:单倍体芥蓝再生苗的DNA含量;D:二倍体亲本的DNA含量
A, B: Regenerated plantlets at subculture and rooting culture, respectively;C: DNA content of a haploid regenerated plantlet; D: DNA content of diploid parent.
田间观察发现,未经秋水仙素处理的芥蓝再生植株,移栽后绝大多数生长缓慢而瘦小,部分提早衰亡,约一半植株能存活并开花,但植株普遍较细小,只有少数株系能产生花蕾(图2A)。反观经过秋水仙素处理的芥蓝植株,移栽后长势更好,大多数单株存活至开花,而且在多数株系中出现明显变大的植株(图2 B、C)。对芥蓝再生植株的花器官进行观察,发现存在多种不同类型的花(图2D)。其中,未经秋水仙素处理的株系,花普遍很小且花药发育异常,表现为典型的单倍体(图2D第1朵花);经秋水仙素处理的株系,从花的大小、花瓣和花药数量等来看,其种类多样,但单倍体花的比例明显更少,与二倍体对照类似的花(图2D第3朵花)明显增多。此外,秋水仙素处理的芥蓝再生植株,相对更容易发现嵌合体,即不同部位叶片和花大小明显不同植株。上述结果说明,秋水仙素处理提高了芥蓝再生植株的存活率和形成嵌合体的频率。
2.4 芥蓝再生植株的自交成系和DH系表型观察
种植的芥蓝再生植株,在蕾期进行人工授粉自交,果荚黄熟时收获种子。由于芥蓝单倍体或多倍体花蕾一般不育或育性很差,很难自交产生种子,因而自交产生的种子几乎都是DH。最终,112个芥蓝再生株系中,共有41个株系获得不低于10粒的自交种子,即形成41个芥蓝DH系,其来源如表3所示。以芥蓝DH系与再生株系数量之比计算DH成系率,总的DH成系率为36.61%。其中,经秋水仙素处理的62个株系,共获得35个DH系,DH成系率为56.45%;而未经秋水仙素处理的50个株系仅获得6个DH系,DH成系率为12.00%。可见,秋水仙素处理株系的DH成系率是未经处理株系的4.70倍。由DH成系率可知,秋水仙素处理使芥蓝单倍体植株的染色体加倍频率得到大幅增加。
获得的41个芥蓝DH系,在第2年秋季按株系种植,部分株系的植株表现如图3所示。大田观察发现,这些芥蓝株系内单株之间的表现高度一致,不存在表型分离,说明全部均为DH系。由芥蓝纯系材料小孢子培养获得的DH系,植株表型与小孢子供体亲本完全相同;而芥蓝杂交一代产生的DH系,植株表型出现分离,大多介于双亲之间。这些芥蓝DH系部分为自交不亲和,后续将从中选择表现较好的DH系,相互杂交或与其他自交不亲和系杂交配制杂交一代,以选育芥蓝杂交新品种。
表3 不同芥蓝再生株系处理及获得的DH数量
Table 3 Treatment of regeneration lines derived from different Chinese kale and DH lines obtained
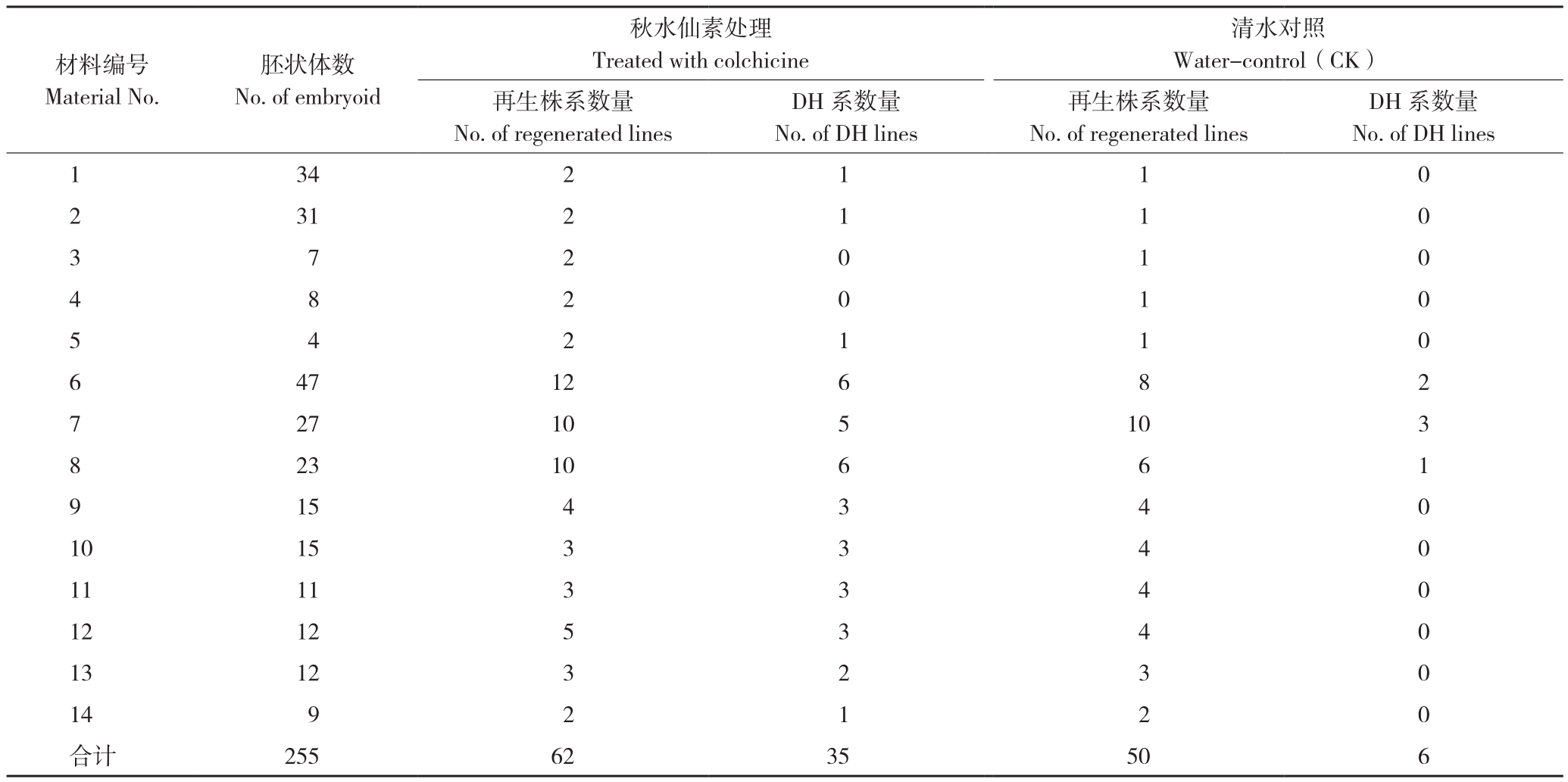
注:材料1~5为自交纯系,仅保留3个再生株系用于后续处理,以减少工作量;每个再生株系均至少5个植株。
Note: Material No.1 to No.5 were inbred lines, only 3 regenerated lines of each accession were used in subsequent processing to reduce work load; every regenerated line contains at least 5 individual plants.
材料编号Material No.DH系数量No.of DH lines 1 34 2 1 1 0 2 31 2 1 1 0 3 7 2 0 1 0胚状体数No.of embryoid清水对照Water-control(CK)再生株系数量No.of regenerated lines秋水仙素处理Treated with colchicine DH系数量No.of DH lines再生株系数量No.of regenerated lines 4 5 8 4 2 2 0 1 1 1 0 0 47 12 6 8 2 7 27 10 5 10 3 8 23 10 6 6 1 9 15 4 3 4 0 10 15 3 3 4 0 11 11 3 3 4 0 12 12 5 3 4 0 13 12 3 2 3 0 14 9 2 1 2 0合计 255 62 35 50 6 6

图2 芥蓝再生植株的田间表现和花器官比较
Fig.2 Comparison of field performance of Chinese kale regenerated plants and their flowers
A~C:部分再生株系在田间的表现(A未经秋水仙素处理,B和C为经过秋水仙素处理);D:部分再生植株的花器官对比(1~4为再生植株的花朵,CK为二倍体供体的花朵)
A-C: Field performance of partial regenerated lines(A was not treated with colchicine, while B and C were treated);D: Flowers of regenerated plants(1 to 4 are flowers of regenerated plants, and CK is flower of diploid line).

图3 部分芥蓝DH系植株的田间表现
Fig.3 Field performance of partial Chinese kale DH lines
A~C:来源于F1(Lb07M/612M)的DH系植株;D~F:来源于F1(612 M /香港中花芥蓝)的DH系植株
A-C: DH plants derived from F1(Lb07M/612M); D-F: DH plants derived from F1(612 M /Xianggang Zhonghua)
3 讨论
利用组织培养或诱导系诱发单倍体进而快速创制纯系,是跨国种子企业的主流育种技术之一[7]。利用单倍体育种,只需2~3个世代即可创制纯系,能够大幅缩短育种周期,提高育种效率[13]。本研究利用14个不同类型的芥蓝供体材料,开展小孢子培养、染色体加倍和自交收获,最终产生了41个DH系。从供体材料种植到最终获得DH系,共经历3年3个世代(2017—2019年),较以往的自交系选育周期(8~10个世代)大幅缩短,且单株完全一致性、纯度更高。
相对传统自交系选育,单倍体育种的流程较为复杂,流程的不断优化,对提高DH系选育效率有重要意义。前期研究中,不同研究者对芥蓝小孢子培养开展研究,主要集中在基因型、培养基和花蕾预处理对小孢子胚发生的影响,而对于如何优化流程、提高获得DH系的效率鲜有提及[12,14-16]。在此基础上,本研究进一步对芥蓝单倍体育种体系的流程进行梳理、整合和优化。通过比较机械破碎和手工研磨提取小孢子,我们发现两种提取方式获得的胚状体诱导率无显著差异,与前人报道结果一致[17]。此外,机械破碎的胚状体诱导率为11.96%,比手工研磨的(10.80%)稍微更高,推测其原因可能是机械破碎提取小孢子的过程中,与空气接触机会更少,因而被污染的机会相对比手工研磨要少。可见,通过离心管机械破碎提取小孢子,较易于实现批量操作,更适合于大规模开展小孢子培养的需要。
理论上,除了在小孢子培养早期的单细胞阶段,从胚状体到再生植株的多细胞阶段,可能只有部分细胞发生染色体加倍,从而产生嵌合体。因而可以推测,再生植株尤其是经过秋水仙素加倍处理后的再生植株,有很大一部分是嵌合体。在十字花科蔬菜上,一些研究者通过观察表型分析二倍体和多倍体植株的频率,证实秋水仙素处理能有效提高小孢子培养再生植株的染色体加倍频率[10,18-20]。本研究中,相对未加倍的(拟)单倍体植株,加倍后的植株往往更高大;但二倍体和多倍体植株往往不易区分,更多表现为嵌合体。因此,我们通过对自交后的种子,即DH成系率来进行分析,发现秋水仙素处理后DH成系率是未处理的4.07倍。由此说明,秋水仙素处理的确能够有效提高芥蓝拟单倍体的染色体加倍频率。另一方面,我们通过DH成系率来衡量染色体的加倍情况,更符合育种实践,也相对更具有操作性。
在实践中,DH成系并能成功繁殖,需要有一定数量的DH种子(如10粒以上);而要获得足够的DH种子,就必须有较多的再生植株为基础(如5株以上)。本研究中,小孢子培养获得胚状体255个,经过多次继代培养和生根等组织培养操作环节,最终形成112个再生苗株系(每株系不少于5株)。可见,只有43.92%的胚状体能产生再生苗株系;结合秋水仙素处理后DH成系率(56.45%),从产生胚状到DH成系的频率为24.79%,即约1/4的胚状体能形成DH系。按当前的流程综合分析,我们认为在开展芥蓝单倍体育种实践中,要获得一个DH系,需要获得4个以上的胚状体,按10%的胚状体诱导率大致计算,需要提取40朵花蕾的小孢子进行培养。此外,由于拟单倍体发育不良,获得胚状体之后的多次组织培养操作,有不少再生苗会死亡,有必要开展进一步研究,将秋水仙素处理提早至胚状体时期或再生苗早期阶段。
4 结论
本研究结果表明,机械破碎提取的芥蓝小孢子,胚状体诱导率与研钵研磨提取的无明显差异,可用于批量处理样品、提高小孢子提取效率;秋水仙素处理提高了芥蓝再生植株在田间的存活率和染色体加倍频率;获得了41个芥蓝DH系,其中秋水仙素处理再生株系的DH成系率为56.45%,是未处理的4.07倍。通过对小孢子提取方法、再生植株处理及其他环节进行优化,本研究建立了一套较为有效的芥蓝单倍体育种技术体系,可在芥蓝育种实践中有推广应用,提高芥蓝育种效率。
[1]LEI J J,CHEN G J,CHEN C M,CAO B H.Germplasm diversity of Chinese kale in China[J].Horticultural Plant Journal,2017,3(3):101-104.doi:10.1016/j.hpj.2017.07.006.
[2]谢景,李智军,卢文佳,曾晶,索海翠.几个芥蓝品种农艺性状及菜薹品质比较[J].中国农学通报,2015,31(22):93-98.XIE J,LI Z J, LU W J, ZENG J,SUO H C.Comparison of agronomic traits and flower stalk quality of several Chinese kale varieties[J].Chinese Agricultural Science Bulletin,2015,31(22):93-98.
[3]殷丽琴,付绍红,杨进,李云,王继胜,王茂林.植物单倍体的产生,鉴定,形成机理及应用[J].遗传,2016,38(11):979-991.doi:10.16288/j.yczz.16-121.YIN L Q, FU S J, YANG J, LI Y,WANG J S, WANG M L.Generation,identification, formation mechanism and application of plant haploids[J].Hereditas, 2016,38(11):979-991.doi:10.16288/j.yczz.16-121.
[4]CHAIKAM V, MOLENAAR W, MELCHINGER A E,BODDUPALLI P M.Doubled haploid technology for line development in maize:technical advances and prospects[J].Theoretical and Applied Genetics,2019,132:1-17.doi:10.1007/s00122-019-03433-x.
[5]BRAUNER P C,MÜLLER D, SCHOPP P, BÖHM J,BAUER E, SCHÖN C C,MELCHINGER A E.Genomic prediction within and among doubled-haploid libraries from maize landraces[J].Genetics, 2018,210(4):1185-1196.doi:10.1534/genetics.118.301286.
[6]BUTRUILLE D V, BIRRU F H, BOERBOOM M L, CARGILL E J, DAVIS D A, DHUNGANA P, DILL G M, DONG F, FONSECA A E, GARDUNIA B W,HOLLAND G J.Maize breeding in the United States: Views from within Monsanto[J].Plant Breeding Reviews,2015,39:199-282.doi:10.1002/9781119107743.ch05.
[7]DWIVEDI S L, BRITT A B, TRIPATHI L, SHARMA S, UPADHYAYA H D, ORTIZ R.Haploids: Constraints and opportunities in plant breeding[J].Biotechnology Advances, 2015,33(6):812-29.doi:10.1016/j.biotechadv.2015.07.001.
[8]ZHANG Y, WANG A J, LIU Y, WANG Y S, FENG H.Improved production of doubled haploids in Brassica rapa through microspore culture[J].Plant Breeding,2012,131(1):164-169.doi:10.1111/j.1439-0523.2011.01927.x.
[9]FERRIE A M, MÖLLERS C.Haploids and doubled haploids in Brassica spp.for genetic and genomic research[J].Plant Cell, Tissue and Organ Culture(PCTOC),2011,104(3):375-386.doi:10.1007/s11240-010-9831-4.
[10]YUAN S X, SU Y B, LIU Y M, LI Z S, FANG Z Y,YANG L M,ZHUANG M, ZHANG Y Y, LV H B, SUN P T.Chromosome doubling of microspore-derived plants from cabbage(Brassica oleracea var.capitata L.)and broccoli(Brassica oleracea var.italica L.)[J].Frontiers in Plant Science, 2015,6:1118.doi:10.3389/fpls.2015.01118.
[11]WĘDZONY M, FORSTER B P, ŻUR I, GOLEMIEC E,SZECHYŃSKA-HEBDA M, DUBAS E, GOTĘBIOWSKA G.Progress in doubled haploid technology in higher plants // In: TOURAEV A,FORSTER BP, JAIN SM(eds.).Advances in Haploid production in higher plants[M].Dordrecht, The Netherlands: Springer, 2009: 1-33.doi:10.1007/978-1-4020-8854-4_1.
[12]李桂花,王亭亭,刘凯,陈汉才,张艳,黎庭耀,蓝华生.芥蓝小孢子培养研究初报[J].热带作物学报,2016,37(8):1518-1525.LI G H, WANG T T, LIU K, CHEN H C, ZHANG Y, LI T Y, LAN H S.Microspore culture of Chinese kale[J].Chinese Journal of Tropical Crops, 2016, 37(8):1518-1525.
[13]AHMADI B, EBRAHIMZADEH H.In vitro androgenesis: spontaneous vs.artificial genome doubling and characterization of regenerants[J].Plant Cell Reports, 2020, 39:299-316.doi:10.1007/s00299-020-02509-z
[14]谢映忠,蒋武生,黄邦海,张晓伟.芥兰游离小孢子培养研究[J].广东农业科学,2010(10):55-56..doi:10.16768/j.issn.1004-874x.2010.10.042.XIE Y Z, JIANG W S, HUANG B H, ZHANG X W.Study on microspore culture of Chinese Kale[J].Guangdong Agricultural Sciences, 2010(10):55-56.doi:10.16768/j.issn.1004-874x.2010.10.042.
[15]赵前程,李素文,文正华,孙德岭.芥蓝游离小孢子培养及植株再生研究[J].北方园艺,2007(9):4-6.ZHAO Q C, LI S W, WEN Z H, SUN D L.Isolated microspore culture and plant regeneration of Chinese kale[J].Northern Horticulture,2007(9):4-6.
[16]何杭军,王晓武,汪炳良.芥蓝游离小孢子培养初报[J].园艺学报,2004, 31(2):239-240.doi:10.16420/j.issn.0513-353x.2004.02.026.HE H J, QANG X W, WANG B L.Embryogenesis and plant regeneration of Chinese kale via isolated microspore culture[J].Acta Horticulturae Sinica, 2004, 31(2):239-240.doi:10.16420/j.issn.0513-353x.2004.02.026.
[17]李菲,张淑江,章时蕃,张慧,孙日飞,张振贤.大白菜游离小孢子培养技术高效体系的研究[J].中国蔬菜,2014(8):12-16.LI F, ZHANG S J, ZHANG S P, ZHANG H, SUN R F, ZHANG Z X.Studies on high efficient system for microspore culture technology of Chinese cabbage[J].China Vegetables, 2014(8):12-16.
[18]MOHAMMADI P P, MOIENI A, EBRAHIMI A, JAVIDFAR F.Doubled haploid plants following colchicine treatment of microspore-derived embryos of oilseed rape(Brassica napus L.)[J].Plant Cell, Tissue and Organ Culture(PCTOC), 2012, 108(2):251-256.doi:10.1007/s11240-011-0036-2.
[19]曾柳,胡承伟,张学昆,程勇,陆光远,邹锡玲.水仙碱对油菜小孢子产胚率和再生植株二倍体率的影响[J].中国油料作物学报,2016, 38(2):254.doi:10.7505/j.issn.1007-9084.2016.02.018.ZENG L, HU C W, ZHANG X K, CHEN Y, LU Y G, ZOU X L.Colchicine effects on microspore embryo yield and diploid regeneration in rapeseed[J].Chinese Journal of Oil Crop Sciences,2016, 38(2):254.doi:10.7505/j.issn.1007-9084.2016.02.018.
[20]CHEN Z Z, SNYDER S, FAN Z G, LOH W H.Efficient production of doubled haploid plants through chromosome doubling of isolated microspores in Brassica napus[J].Plant Breeding,1994, 113(3):217-221.doi:10.1111/j.1439-0523.1994.tb00725.x.