【研究意义】缓释化肥可在保持甚至提高农作物产量的同时,提高肥料利用效率,并减轻其对环境产生的不利影响[1-3]。目前,全球人均粮食需求快速增长,预计到2050年可能会翻一番[4]。化肥利用率低在全球范围内一直是个严重问题[5],但化肥又是粮食生产的限制因素,导致化肥使用量日益增加的同时,对环境产生的不利影响也逐渐增大。因此,研制方法简单且可扩展的、基于生物降解聚合物材料体系的缓释化肥意义重大。同时,含不同营养元素的化肥也进入人们视野,如硅肥、硼肥、微肥等。生物学家已对硅元素(Si)对于植物的益处,特别是在胁迫环境中的益处进行了深入研究[6-8],硅肥已确定作为一种新型肥料并大面积推广和使用。土壤中的硅以不带电荷的原硅酸〔Si(OH)4〕形式被植物根吸收,在蒸腾时被运输到植物的地上部分。植物中硅的干重一般为0.1%~10%,主要取决于其根部对硅的吸收能力[7]。通常认为,硅通过提升植物对各种胁迫环境的抗性来提高产量[9]。但研究表明,在不受胁迫的环境条件下,硅也可以在一定程度上促进植物生长[10]。但是,现有硅肥价格昂贵,且其中可溶性硅的含量较低。因此,需要研制廉价、环保且具有高可溶性硅含量的含硅肥料[11]。
【前人研究进展】众所周知,脲甲醛(UF)肥料是目前使用最广的缓释氮肥,它可以被微生物降解,从而导致氮元素在土壤中缓慢释放[12-13]。但由于UF聚合物的高结晶性,导致其在实际使用中氮素释放速率极低,氮素在植株生长周期内无法完全释放,因此氮素利用率不高[14-15]。此外,包含硅元素的硅肥已经投入使用,如Mushtaq等[16]利用二氧化硅纳米颗粒来降低盐度应力,通过补充硅和改良肥料,在边缘土地和受盐害影响的地区可以提高小麦产量。我们将含磷和钾元素的磷酸二氢钾(MKP)引到具有缓释功能的脲甲醛中,增加脲甲醛肥料所含营养元素,制备了含氮磷钾生物降解聚合物缓释肥料PSRF[13,17-18]。【本研究切入点】鉴于元素硅对植株生长的促进作用和PSRF的缓释性能,我们在制备PSRF过程中又引入硅酸钠,制备了含有营养元素硅的PSRF(表示为Si-PSRF)。【拟解决的关键问题】一方面利用硅酸钠的水解使溶液pH升高,从而阻碍脲甲醛的缩聚反应,以此改变Si-PSRF结构,降低其结晶度,进而调控其生物降解速率,从而调控其所含元素的缓释性能,使其更加适应植株生长过程中的营养需求规律;另一方面,通过引进元素硅,更进一步促进植株的生长发育,提升其果实产量,从而更进一步提高所研制肥料的经济价值,并降低成本。
1 材料与方法
1.1 试验材料
供试土样为未受污染菜园0~20 cm深度的土壤,基本理化性质如下:砂粒38%,粉砂50%,粘粒12%,pH值为8.2,有机质含量10.3 g/kg,总氮含量104 mg/kg,有效磷含量43 mg/kg,有效钾含量132.7 mg/kg。
试验番茄品种为晋源1号番茄,在太原市广泛种植,具有一定代表性。
供试高分子缓释肥由山西省高分子复合材料工程技术中心提供。(1)含氮磷钾生物降解高分子缓释肥料(PSRF肥料):由尿素颗粒、甲醛溶液在碱性条件下合成脲甲醛预聚体,加入磷酸二氢钾使体系pH呈酸性后,脲甲醛预聚体聚合生成PSRF肥料。(2)含硅生物降解高分子缓释肥料(Si-PSRF肥料):由尿素颗粒和甲醛溶液在碱性条件下合成脲甲醛预聚体,加入磷酸二氢钾使体系pH呈酸性并聚合一段时间后,向溶液中加入硅酸钠,最终生成Si-PSRF肥料。
1.2 试验方法
1.2.1 番茄盆栽试验 试验于2019年5—9月在山西太原中北大学进行。盆栽试验在装有20 cm高土壤的矩形盆栽箱(0.56 m×0.37 m×0.25 m)中进行。将约45 kg过筛土与供试的生物降解高分子材料混合均匀后,置入盆栽箱中,表面铺平,并浇入15 kg左右水将盆栽箱中的土壤完全浇透。傍晚时分,选取生长趋势一致的番茄幼苗进行移栽。在每个盆栽箱的中央移栽一株番茄幼苗,定期定量浇水,不定期除草,确保番茄幼苗健康生长。
盆栽试验设空白对照(CK)、T1、T2 3个处理,每个处理12盆番茄盆栽,每个取样阶段选择长势相近的3盆番茄作为3个重复,采集样品时破坏性处理,采集后整个试验周期内盆栽箱废弃。空白对照不施加肥料,T1和T2处理施加肥料,并按照番茄生长所需养分规律,将相同量的氮(4.62 g),磷(4.86 g P2O5)和钾(4.26 g K2O)施加到每个盆栽箱中。具体施肥量为T1处理施加PSRF肥料18.02 g,T2处理施加Si-PSRF肥料21.74 g。所施肥料分两部分:分别取6 g肥料放入12个48 μm尼龙袋(10 cm×8 cm)中,分别埋入盆栽箱中15 cm深土壤中,剩余部分直接与盆栽箱中土壤混合。
1.2.2 样品采集 肥料样品分别在土壤中培养10 d(苗期)、40 d(开花期)、70 d(结果期)和100 d(成熟期)时采集。取出埋于土中3个尼龙袋中的肥料样品,肥料在自然风干后用超声波清洗机在室温下用无水乙醇超声清洗10 min。
在苗期、开花期、结果期、成熟期,避开番茄根系,采用五点混合取样法采集已取出肥料的3个盆栽箱中0~20 cm土壤。土壤样本在测试之前彻底混合并研磨,通过0.25 mm的筛孔后备用。
与肥料采集时间相同,将取出肥料的3个盆栽箱中的番茄连根拔起。用蒸馏水冲洗整株番茄后,70℃下干燥至恒定重量。干燥后的番茄样品用植物粉碎机粉碎成细粉,用0.150 mm筛进行筛分后取样分析。在成熟期收集果实,记录果实个数和重量。
1.2.3 测定项目及方法 (1)肥料结构检测:PSRF和Si-PSRF肥料利用Nicolet-IS50红外光谱仪和ATR装置在500~4000 cm-1范围内进行傅里叶变换红外光谱(FTIR)测试。肥料样品使用热重分析仪(TGA,TAQ50)研究在氮气气氛中的热稳定性。肥料样品采用X射线衍射仪(XRD,HAOYUAN DX-2700B)在 5~80°的 2θ范围内记录晶体结构。
(2)元素含量检测:肥料和番茄中的氮和磷含量采用H2SO4-H2O2消解法和凯氏定氮法、H2SO4-H2O2消解法和钼锑比色法分别测定[19-21],肥料和番茄中的钾含量采用火焰分光光度法测定[22],肥料、土壤和番茄的硅含量采用硅钼蓝比色法测定。用某一时期肥料样品中某一养分的质量分数乘以该时期材料的总重量得该时期样品中该养分的总质量,减去其前一个时期中该养分的总质量,得该时期肥料样品中相应养分的释放质量。此外,土壤中的氮和磷总质量采用半微量凯氏定氮法、氢氧化钠熔融法和钼锑抗比色法测定。土壤有机碳含量用K2Cr2O7和浓H2SO4[23]湿式氧化法测定。
1.3 数据分析
试验数据通过SPSS Statistics 20.0软件进行统计分析。使用Origin 9.0软件(Origin Lab, MA,USA)进行曲线拟合。样品间差异显著性通过Duncan多范围检验确定。
2 结果与分析
2.1 硅酸钠对肥料组成结构的影响
PSRF和Si-PSRF肥料的FTIR光谱见图1。从图1A可以看出,PSRF和Si-PSRF肥料都观察到代表酰胺键的特征吸收峰,即3 440和3 209 cm-1处的-CONH2(NH的拉伸振动)和3 330 cm-1处的-CONH-(HNH的弯曲振动),归因于PSRF聚合链的形成[12-13,24]。Si-PSRF肥料在1 040 cm-1和867 cm-1处出现与PSRF肥料不同的特征吸收峰,分别对应硅酸钠水解生成的硅酸凝胶的Si-O和Si-O-Si拉伸振动,表明硅酸钠确实被引入到Si-PSRF肥料中,且未改变PSRF聚合链的键合模式。1 029和874 cm-1处的特征吸收峰归因于磷酸二氢钾,但在Si-PSRF肥料中被硅酸凝胶的特征峰覆盖。
对PSRF和Si-PSRF肥料进行XRD测试以研究添加硅酸钠对其结晶性能的影响,测试结果如图1B所示。在2θ为22.0°、24.7°处的峰为UF的特征衍射峰,证实Si-PSRF肥料中存在UF结晶区域。在2θ为23.9°、30.8°和38.5°处的峰为磷酸二氢钾的特征衍射峰,证明Si-PSRF肥料中确实存在磷酸二氢钾且以晶体形式存在。
图1C和D分别是PSRF和Si-PSRF肥料的TG和DTG曲线。由图1C可知,Si-PSRF肥料的Td5%(5wt%失重温度)为182.8℃,比PSRF肥料的(212.1℃)低;288.3℃前,Si-PSRF肥料的质量残留率比PSRF肥料的低,而在288.3℃后,则相反;800℃时,PSRF肥料的残炭率为38.87%,低于Si-PSRF肥料的残炭率(42.78%)。对应在图1D中,Si-PSRF肥料的DTG曲线显示在155~213℃较PSRF肥料有更为明显的分解峰。
2.2 硅酸钠对肥料中养分释放和利用的影响
2.2.1 对失重量的影响 由表1可知,PSRF和Si-PSRF肥料的失重规律相似,都是先升高后降低,并在培养10 d时达到最大值。此时Si-PSRF肥料的失重量高于PSRF肥料的且存在显著性差异。而培养40 d后,PSRF和Si-PSRF肥料的失重量相近,没有显著性差异。添加硅酸钠后,提高了Si-PSRF肥料在早期的失重量,但在培养40 d后没有明显影响。
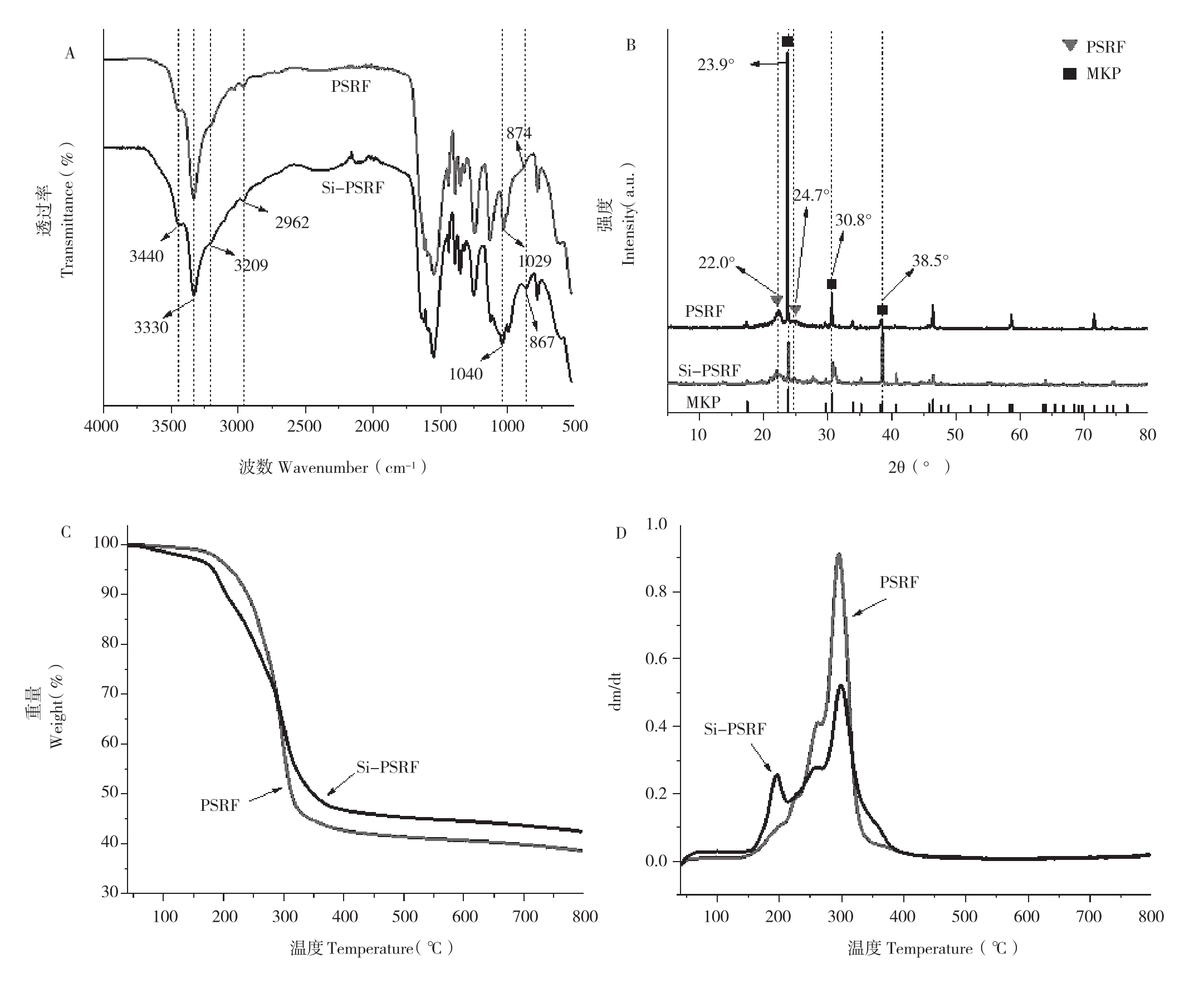
图1 PSRF和Si-PSRF肥料的FTIR(A)、XRD(B)、TG(C)和DTG(D)谱图
Fig.1 FTIR(A), XRD(B), TG(C)and DTG(D)spectra of PSRF and Si-PSRF fertilizer
表1 土壤中不同培养时间PSRF和Si-PSRF肥料的失重量
Table 1 Weight loss of PSRF and Si-PSRF fertilizer in soil at different incubation time

注:同一时间同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column of the same incubation time represent significant differences.
失重量Weight loss(g)10 PSRF 8.79±0.29b Si-PSRF 12.75±0.16a 40 PSRF 0.73±0.15a Si-PSRF 1.41±0.71a 70 PSRF 1.77±0.42a Si-PSRF 1.79±0.43a 100 PSRF 2.00±0.98a Si-PSRF 1.61±0.80a培养时间Incubation time(d)处理Fertilizer
2.2.2 对氮元素释放和利用的影响 表2表明,PSRF和Si-PSRF肥料在番茄整个生长期内的氮释放总量基本相同,分别为2.81、2.88 g,氮释放量都是先升高后降低,在培养70 d时达到最大值。T1和T2处理的土壤全氮量都比CK高。培养100 d时,T1处理的番茄氮积累量为1.83 g,比CK高66.80%;T2处理的番茄氮积累量为3.24 g,比CK高195.66%。此时,T2处理的氮元素利用率为74.26%,比T1处理(26.00%)高185.65%。表明在总氮释放量和释放速率差异不大的情况下,T2处理的番茄氮积累量和肥料的氮利用效率更高。
2.2.3 对磷元素释放和利用的影响 由表3可知,PSRF和Si-PSRF肥料在整个生长周期内的磷释放总量基本一样,分别为1.05、1.09 g。PSRF和Si-PSRF肥料的磷释放量变化趋势一致,都是先升高后降低,并在培养10 d时达到最大值。PSRF肥料的最大磷释放量为1.02 g,占其全磷含量的96.37%;Si-PSRF肥料的最大磷释放量为0.91 g,占其全磷含量的82.78%,比PSRF肥料的低10.73%。培养100 d时,T1处理的土壤有效磷总量和番茄磷积累量分别为0.32、0.65 g、T2处理分别为0.40、1.01 g,比CK分别提高71.69%、67.87%、112.97%、160.80%。同时,T2处理的磷利用率为56.99%,比T1处理(24.93%)高128.57%。
表2 不同处理的肥料氮元素释放和番茄利用情况
Table 2 Fertilizer nitrogen release and tomato utilization under different treatments
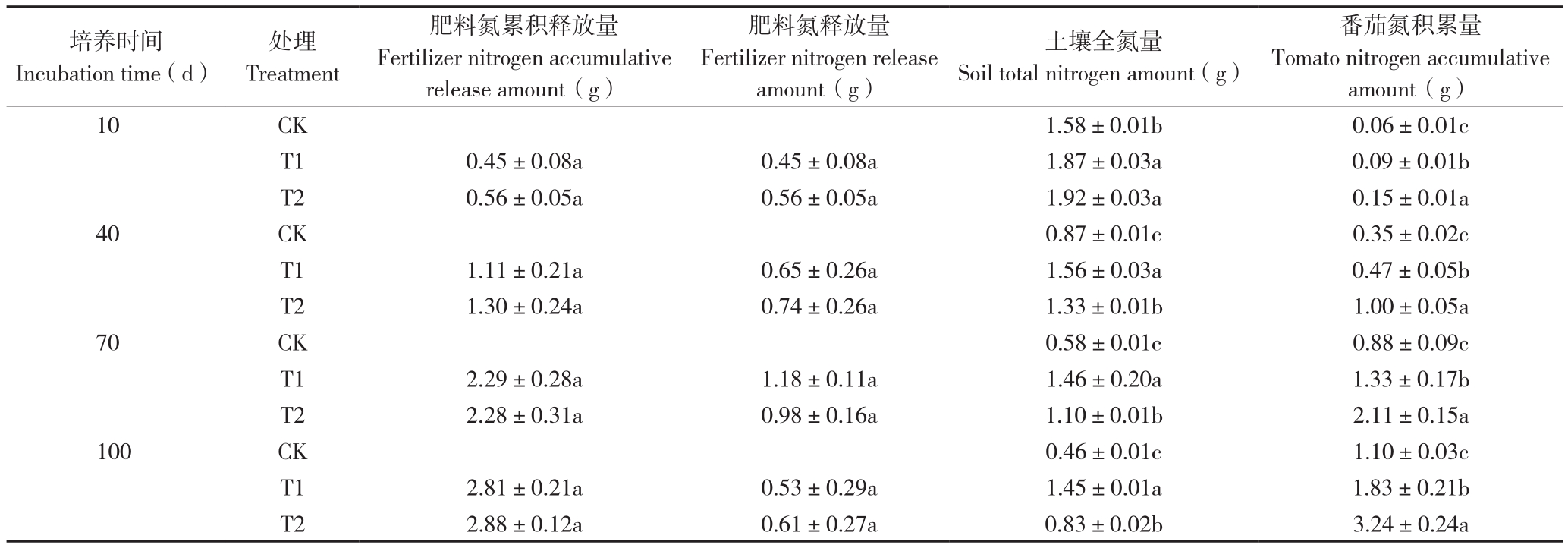
注:同一时间同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column of the same incubation time represent significant differences.
培养时间Incubation time(d)番茄氮积累量Tomato nitrogen accumulative amount(g)10 CK 1.58±0.01b 0.06±0.01c T1 0.45±0.08a 0.45±0.08a 1.87±0.03a 0.09±0.01b T2 0.56±0.05a 0.56±0.05a 1.92±0.03a 0.15±0.01a 40 CK 0.87±0.01c 0.35±0.02c T1 1.11±0.21a 0.65±0.26a 1.56±0.03a 0.47±0.05b T2 1.30±0.24a 0.74±0.26a 1.33±0.01b 1.00±0.05a 70 CK 0.58±0.01c 0.88±0.09c T1 2.29±0.28a 1.18±0.11a 1.46±0.20a 1.33±0.17b T2 2.28±0.31a 0.98±0.16a 1.10±0.01b 2.11±0.15a 100 CK 0.46±0.01c 1.10±0.03c T1 2.81±0.21a 0.53±0.29a 1.45±0.01a 1.83±0.21b T2 2.88±0.12a 0.61±0.27a 0.83±0.02b 3.24±0.24a处理Treatment肥料氮累积释放量Fertilizer nitrogen accumulative release amount(g)肥料氮释放量Fertilizer nitrogen release amount(g)土壤全氮量Soil total nitrogen amount(g)
表3 不同处理的肥料磷元素释放和番茄利用情况
Table 3 Fertilizer phosphorus release and tomato utilization under different treatments
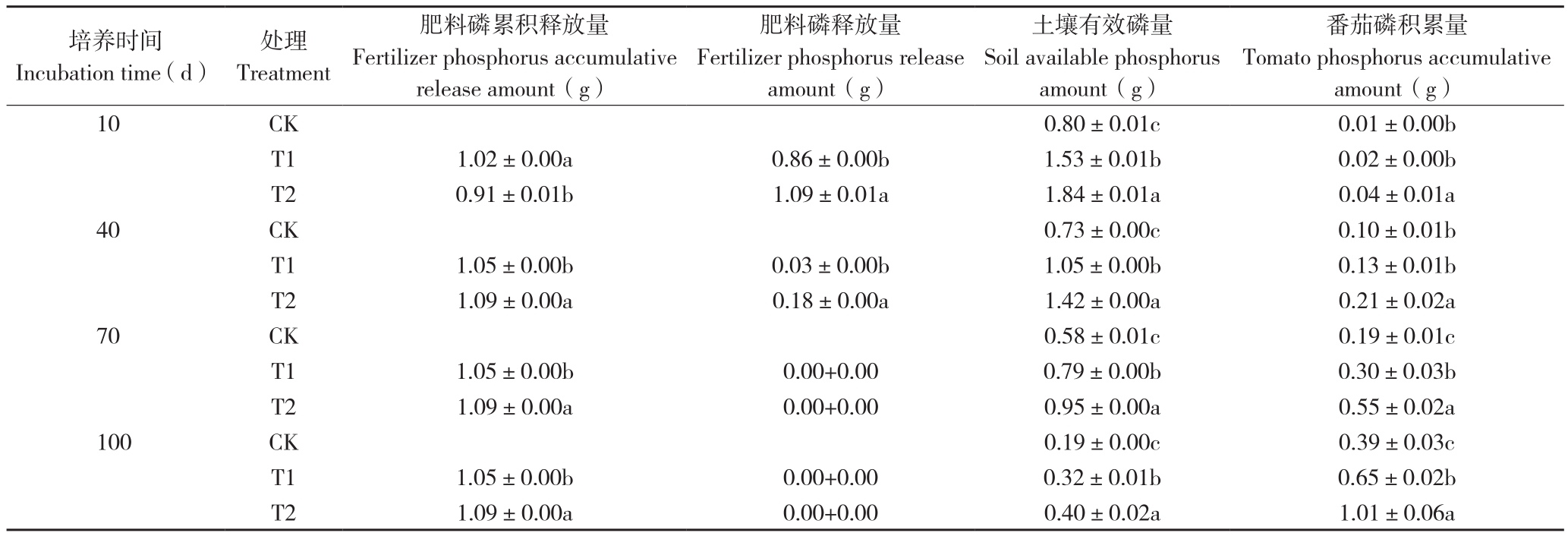
注:同一时间同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column of the same incubation time represent significant differences.
培养时间Incubation time(d)番茄磷积累量Tomato phosphorus accumulative amount(g)10 CK 0.80±0.01c 0.01±0.00b T1 1.02±0.00a 0.86±0.00b 1.53±0.01b 0.02±0.00b T2 0.91±0.01b 1.09±0.01a 1.84±0.01a 0.04±0.01a 40 CK 0.73±0.00c 0.10±0.01b T1 1.05±0.00b 0.03±0.00b 1.05±0.00b 0.13±0.01b T2 1.09±0.00a 0.18±0.00a 1.42±0.00a 0.21±0.02a 70 CK 0.58±0.01c 0.19±0.01c T1 1.05±0.00b 0.00+0.00 0.79±0.00b 0.30±0.03b T2 1.09±0.00a 0.00+0.00 0.95±0.00a 0.55±0.02a 100 CK 0.19±0.00c 0.39±0.03c T1 1.05±0.00b 0.00+0.00 0.32±0.01b 0.65±0.02b T2 1.09±0.00a 0.00+0.00 0.40±0.02a 1.01±0.06a处理Treatment肥料磷累积释放量Fertilizer phosphorus accumulative release amount(g)肥料磷释放量Fertilizer phosphorus release amount(g)土壤有效磷量Soil available phosphorus amount(g)
2.2.4 对碳元素释放和利用的影响 由表4可知,Si-PSRF和PSRF肥料的有机碳释放量间存在明显不同。PSRF肥料在4个培养时间的有机碳释放量比较平稳。Si-PSRF肥料的有机碳释放量则先快速升高,在培养10 d时达到最大值3.12 g,占其总碳含量的56.22%、此阶段总失重量的24.47%;随后Si-PSRF肥料的有机碳释放量一直降低,但培养40 d后的降低速度明显减缓,表明添加硅酸钠对碳的释放有显著影响。T2处理的土壤有机碳含量先升高后降低,在培养10 d时达到最大值。而T1处理的土壤有机碳含量则先升高后降低再升高,与T2处理的变化规律不同。但是,T2处理的土壤有机碳含量在培养10~70 d时均高于T1处理。不同处理的番茄碳积累量在各个培养时期均存在显著性差异,但T2处理的番茄碳积累量一直高于T1处理,尤其是在培养10 d后更加明显。通过相关性分析发现番茄碳积累量与肥料碳释放量间没有相关性,但是与番茄硅含量显著正相关,其中T2处理的相关系数高达0.985,T1处理为0.997。
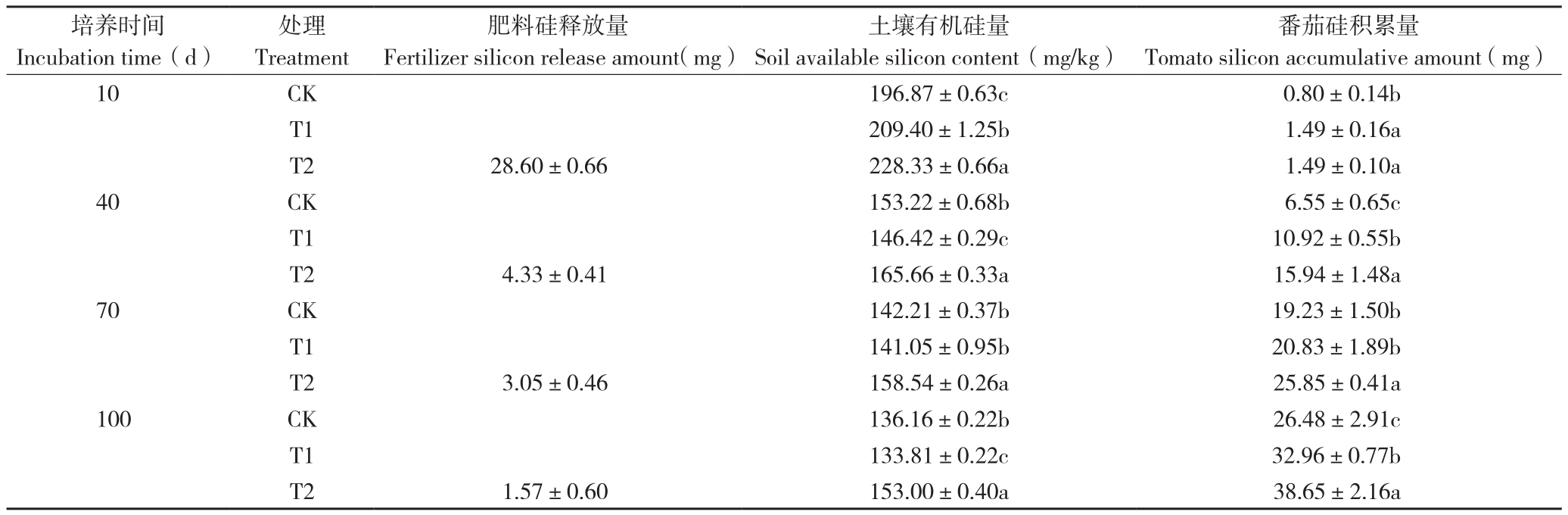
2.2.5 对硅元素释放和利用的影响 由表5可知,Si-PSRF肥料中硅元素的释放与其失重量和磷的释放非常相似,均呈现先升高后降低的趋势。Si-PSRF肥料中硅元素的释放量与其失重量和磷的释放量均显著正相关,相关系数分别高达0.995和1.000,表明添加硅酸钠会对Si-PSRF肥料的降解和元素释放产生影响。由各个培养时期的土壤有效硅含量和番茄硅积累量的结果可知,Si-PSRF肥料中含有的硅酸钠能显著提高土壤和番茄中的硅总量。T2处理中,Si-PSRF肥料中硅的释放量与土壤有效硅含量显著正相关,相关系数高达0.998;而土壤有效硅含量与番茄硅积累量显著负相关,相关系数为-0.763。
2.2.6 对番茄产量的影响 T1和T2处理及CK的番茄产量存在显著性差异,两种施肥处理的番茄产量比CK显著增加。T2处理的番茄产量为2.12 kg,比CK增加51.82%;T1处理的番茄产量为1.71 kg,比CK增加22.43%。T2处理的番茄产量比T1处理高24.01%,表明含有硅元素的Si-PSRF肥料对番茄产量的提升效果显著优于PSRF肥料的。
3 讨论
Si-PSRF肥料的Td5%比PSRF肥料的低,且在155~213℃出现明显的分解峰,主要原因有以下两点:一是PSRF聚合链的聚合过程需要酸性条件,但添加硅酸钠后,其水解会导致体系的pH提升,不利于聚合反应进行;二是水解的硅酸钠会自缩合形成硅酸凝胶[25],也不利于PSRF聚合链的缩聚反应,导致反应聚合度降低,生成易分解的低分子量PSRF链。因此,含有低分子量PSRF链的Si-PSRF肥料比PSRF肥料更易在低温下分解。Si-PSRF肥料在288.3℃后更高的质量残留率和残炭率是因为硅酸凝胶在高温下难以热分解。
表4 不同处理的肥料碳元素释放和番茄利用情况
Table 4 Fertilizer carbon release and tomato utilization under different treatments
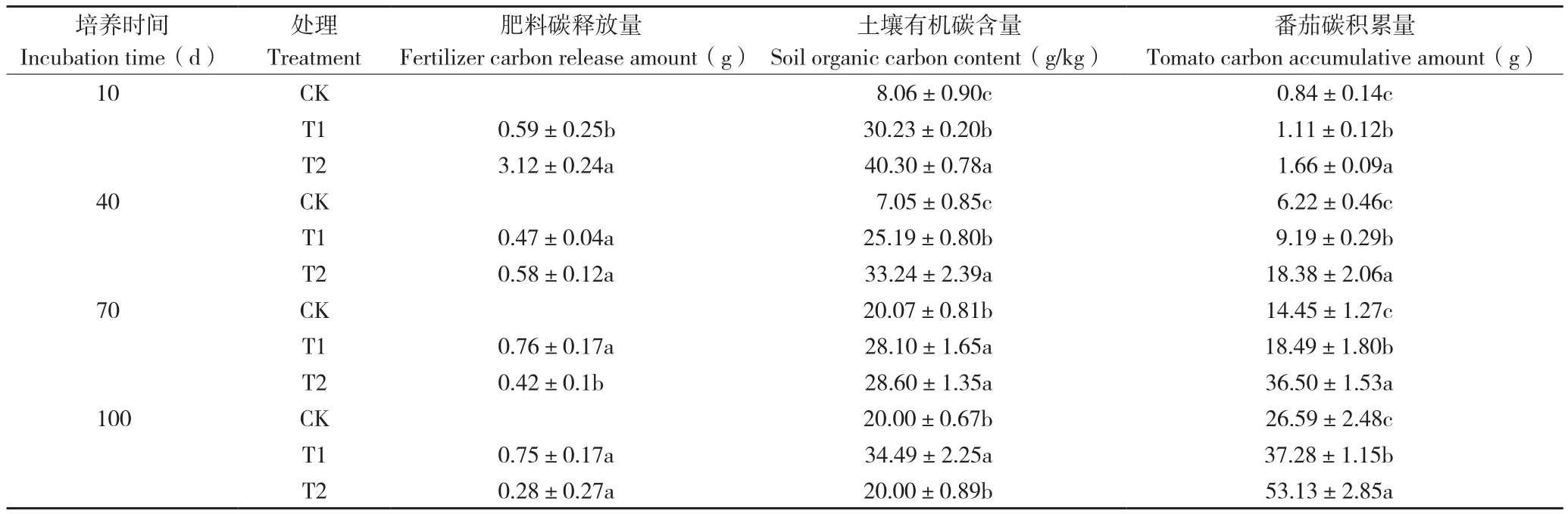
注:同一时间同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column of the same incubation time represent significant differences.
培养时间Incubation time(d)番茄碳积累量Tomato carbon accumulative amount(g)10 CK 8.06±0.90c 0.84±0.14c T1 0.59±0.25b 30.23±0.20b 1.11±0.12b T2 3.12±0.24a 40.30±0.78a 1.66±0.09a 40 CK 7.05±0.85c 6.22±0.46c T1 0.47±0.04a 25.19±0.80b 9.19±0.29b T2 0.58±0.12a 33.24±2.39a 18.38±2.06a 70 CK 20.07±0.81b 14.45±1.27c T1 0.76±0.17a 28.10±1.65a 18.49±1.80b T2 0.42±0.1b 28.60±1.35a 36.50±1.53a 100 CK 20.00±0.67b 26.59±2.48c T1 0.75±0.17a 34.49±2.25a 37.28±1.15b T2 0.28±0.27a 20.00±0.89b 53.13±2.85a处理Treatment肥料碳释放量Fertilizer carbon release amount(g)土壤有机碳含量Soil organic carbon content(g/kg)
表5 不同处理的肥料硅元素释放和番茄利用情况
Table 5 Fertilizer silicon release and tomato utilization under different treatments
注:同一时间同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column of the same incubation time represent significant differences.
培养时间Incubation time(d)番茄硅积累量Tomato silicon accumulative amount(mg)10 CK 196.87±0.63c 0.80±0.14b T1 209.40±1.25b 1.49±0.16a T2 28.60±0.66 228.33±0.66a 1.49±0.10a 40 CK 153.22±0.68b 6.55±0.65c T1 146.42±0.29c 10.92±0.55b T2 4.33±0.41 165.66±0.33a 15.94±1.48a 70 CK 142.21±0.37b 19.23±1.50b T1 141.05±0.95b 20.83±1.89b T2 3.05±0.46 158.54±0.26a 25.85±0.41a 100 CK 136.16±0.22b 26.48±2.91c T1 133.81±0.22c 32.96±0.77b T2 1.57±0.60 153.00±0.40a 38.65±2.16a处理Treatment肥料硅释放量Fertilizer silicon release amount(mg)土壤有机硅量Soil available silicon content(mg/kg)
虽然培养10 d时,PSRF和Si-PSRF肥料的氮释放量没有明显差异,但其结构差异导致氮元素释放形式不同。Si-PSRF肥料释放的氮元素一部分存在于易释放的低分子量PSRF链中,并不能直接被番茄吸收利用,需进一步降解转化才能被番茄吸收利用,因此氮元素的利用存在滞后。PSRF肥料的氮元素由酰胺键降解后直接释放,可直接被番茄吸收利用,不存在滞后效应。由于早期番茄对氮元素的需求量不高,吸收量少,此时氮元素的过快释放会导致变为氨气的损失量增加[26-27],因此PSRF肥料的氮元素损失较多。此外,已有研究证实硅对氮元素的吸收利用具有一定促进作用。因此,总体来说,Si-PSRF肥料的氮释放特性应更符合番茄生长周期对养分氮的需求规律[28]。
PSRF肥料的磷酸二氢钾易溶于水,因此培养10 d时其磷元素溶于水全部释放,但在Si-PSRF肥料中硅酸凝胶具有一定疏水性,其磷元素释放速度明显降低。虽然PSRF和Si-PSRF肥料在培养10 d时磷元素已大量释放,且磷的释放量显著高于番茄所需量,但已有研究表明,磷很容易通过物理吸附或化学反应被土壤固定,从而大大降低其流失量。因此番茄对磷的吸收利用还是取决于植物自身生长发育。
碳元素主要通过主链中酰胺键的降解释放。Si-PSRF肥料中低分子量PSRF链的释放导致其在培养10 d时碳元素的快速释放;培养40 d后Si-PSRF肥料的碳元素主要由酰胺键降解释放,因此碳释放量降低。PSRF肥料的碳元素在培养期内一直由主链酰胺键降解释放,因此碳元素释放速率较慢。Saikia等[29]的研究表明土壤有机碳含量对于促进番茄在光合作用中的碳同化、增加果实产量具有积极作用。因此Si-PSRF肥料在前期有机碳的大量释放可增加土壤有机碳总量,导致T2处理的番茄在光合作用中的碳同化作用比T1处理的强,因而番茄生长更为优良,果实产量也更高。
Si-PSRF肥料中硅元素的释放能显著提高土壤有效硅含量,有利于番茄吸收土壤中的硅元素,导致番茄中硅积累量更高。番茄吸收硅元素后,部分沉积在表皮细胞中,可提高植物叶绿素色素浓度,进而提高光能利用效率,促进番茄植株的光合作用[30]。因此番茄中硅积累量的提高更有利于番茄营养物质的积累,提高了番茄产量。
4 结论
本试验结果表明,硅酸钠的引入增加了脲甲醛基PSRF肥料中低分子量PSRF链的含量,不仅使Si-PSRF肥料的养分释放特性更符合番茄营养需求规律,且硅元素也会促进番茄对养分的吸收利用,可有效提高番茄产量。Si-PSRF肥料作为一种制备简单、绿色环保、含氮磷钾硅多种营养元素的脲甲醛基缓释肥在实际农业生产中具有巨大潜力。
[1]KOTTEGODA N, SANDARUWAN C, PRIYADARSHANA G,SIRIWARDHANA A, RATHNAYAKE U A, BERUGODA A D M,KUMARASINGHE A R, DAHANAYAKE D, KARUNARATNE V, AMARATUNGA G A.Urea-hydroxyapatite nanohybrids for slow release of nitrogen[J].ACS Nano,2017,11(2):1214-1221.doi:10.17863/CAM.7219.
[2]SOURI M K, NAIJI M, KIANMEHR M H.Nitrogen release dynamics of a slow release urea pellet and its effect on growth, yield, and nutrient uptake of sweet basil(Ocimum basilicum L.)[J].Journal of Plant Nutrition,2019,42(6):604-614.doi:10.1080/01904167.2019.156 8460.
[3]NAZ M Y,SULAIMAN S A.Slow release coating remedy for nitrogen loss from conventional urea: a review[J].Journal of Controlled Release,2016,225:109-120.doi:10.1016/j.jconrel.2016.01.037.
[4]HUNTER M C, SMITH R G, SCHIPANSKI M E, ATWOOD L W,MORTENSEN D A.Agriculture in 2050: Recalibrating targets for sustainable intensification[J].Bioscience, 2017,67(4):386-391.doi:10.1093/biosci/bix010.
[5]YE H M, LI H F, WANG C S, YANG J X, HUANG G Y, MENG X Y, ZHOU Q.Degradable polyester/urea inclusion complex applied as a facile and environment-friendly strategy for slow-release fertilizer: Performance and mechanism[J].Chemical Engineering Journal,2020,381:122704.doi:10.1016/j.cej.2019.122704.
[6]COSKUN D, BRITTO D T, HUYNH W Q, KRONZUCKER H J.The role of silicon in higher plants under salinity and drought stress[J].Frontiers in Plant Science,2016,7:1072.doi:10.3389/fpls.2016.01072.
[7]EPSTEIN E.Silicon[J].Annual Review of Plant Biology,1999,50(1):641-664.doi:10.1146/annurev.arplant.50.1.641.
[8]LIANG Y, NIKOLIC M, BéLANGER R, GONG H J, SONG A.Silicon in agriculture[J].Dordrecht: Springer,2015,10:978-994.doi:10.1007/978-94-017-9978-2.
[9]YIN J, JIA J, LIAN Z, HU Y, GUO J, HUO H, ZHU Y, GONG H.Silicon enhances the salt tolerance of cucumber through increasing polyamine accumulation and decreasing oxidative damage[J].Ecotoxicol Environ Saf,2019,169:8-17.doi:10.1016/j.ecoenv.2018.10.105.
[10]SIVANESAN I, JEONG B R.Silicon promotes adventitious shoot regeneration and enhances salinity tolerance of Ajuga multiflora bunge by altering activity of antioxidant enzyme[J].Scientific World Journal,2014,2014:521703.doi:10.1155/2014/521703.
[11]IRFAN S, RAZALI R, KUSHAARI K, MANSOR N.Reaction-multi diffusion model for nutrient release and autocatalytic degradation of PLA-coated controlled-release fertilizer[J].Polymers,2017,9(12):111.doi:10.3390/polym9030111.
[12]XIANG Y, RU X, SHI J, SONG J, ZHAO H, LIU Y, GUO D, LU X.Preparation and properties of a novel semi-IPN slow-release fertilizer with the function of water retention[J].Journal of Agricultural and Food Chemistry,2017,65(50):10851-10858.doi:10.1021/acs.jafc.7b03827.
[13]XIANG Y, RU X, SHI J, SONG J, ZHAO H, LIU Y,ZHAO G.Granular,slow-release fertilizer from urea-formaldehyde, ammonium polyphosphate, and amorphous silica gel: a new strategy using cold extrusion[J].Journal of Agricultural and Food Chemistry,2018,66(29):7606-7615.doi:10.1021/acs.jafc.8b02349.
[14]QU P, HUANG H, WU G, SUN E, CHANG Z.Hydrolyzed soy protein isolates modified urea-formaldehyde resins as adhesives and its biodegradability[J].Journal of Adhesion Science and Technology,2015,29(21):2381-2398.doi:10.1080/01694243.2015.10 67176.
[15]GIROTO A S, GUIMARãES G G F, RIBEIRO C.A novel, simple route to produce urea: urea-formaldehyde composites for controlled release of fertilizers[J].Journal of Polymers and the Environment,2017,26(6):2448-2458.doi:10.1007/s10924-017-1141-z.
[16]MUSHTAQ A, RIZWAN S, JAMIL N, ISHTIAQ T, IRFAN S, ISMAIL T, MALGHANI M N, SHAHWANI M N.Influence of silicon sources and controlled release fertilizer on the growth of wheat cultivars of Balochistan under salt stress[J].Pakistan Journal of Botany, 2019,51(5):1561-1567.doi:10.30848/PJB2019-5(44).
[17]程冬冬,窦午红,赵贵哲,刘亚青.高分子缓/控释肥氮磷养分释放特征及影响因素研究[J].应用基础与工程科学学报,2015, 23(3):484-492.doi: 10.16058 /j.issn.1005-0930.2015.03.007.CHENG D D, DOU W H, ZHAO G Z, LIU Y Q.Study on characteristics and influencing factors of nitrogen and phosphorus nutrient release from polymer slow / controlled release fertilizer[J].Journal of Basic Science and Engineering,2015,23(3):484-492.doi:10.16058/j.issn.1005-0930.2015.03.007.
[18]周丽凤,刘亚青,毋登辉.新型多营养缓释化肥的制备及养分释放性能研究[J].现代化工,2015,35(2):117-120.doi:10.16606/j.cnki.issn0253-4320.2015.02.016.ZHOU L F, LIU Y Q, WU D H.Preparing and properties of a novel slow release fertilizer containing multiple nutrient elements[J].Modern Chemical Industry,2015,35(2):117-120.doi:10.16606/j.cnki.issn0253-4320.2015.02.016.
[19]HURFORD T R, BOLTZ D F.Indirect ultraviolet spectrophotometric and atomic absorption spectrometric methods for determination of phosphorus and silicon by heteropoly chemistry of molybdate[J].Analytical Chemistry,1968,40(2):379-382.doi:10.1021/ac60258a019.
[20]RUDNIK E, BRIASSOULIS D.Degradation behaviour of poly(lactic acid)films and fibres in soil under mediterranean field conditions and laboratory simulations testing[J].Industrial Crops and Products,2011,33(3):648-658.doi:10.1016/j.indcrop.2010.12.031.
[21]BREMNER J.Determination of nitrogen in soil by the Kjeldahl method[J].The Journal of Agricultural Science,1960,55(1):11-33.doi:10.1017/S0021859600021572.
[22]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.BAO S D.Agricultural chemistry analysis of soil[M].Beijing: China Agriculture Press,2000.
[23]THOMAS G, DALAL R, STANDLEY J.No-till effects on organic matter, pH, cation exchange capacity and nutrient distribution in a Luvisol in the semi-arid subtropics[J].Soil and Tillage Research,2007,94(2):295-304.doi:10.1016/j.still.2006.08.005.
[24]PARK B D, CHANG KANG E, YONG PARK J.Effects of formaldehyde to urea mole ratio on thermal curing behavior of urea-formaldehyde resin and properties of particleboard[J].Journal of Applied Polymer Science,2006,101(3):1787-1792.doi:10.1002/app.23538.
[25]YOO B U, HAN M H, NERSISYAN H H, YOON J H, LEE K J,LEE J H.Self-templated synthesis of hollow silica microspheres using Na2SiO3 precursor[J].Microporous and Mesoporous Materials,2014,190:139-145.doi:10.1016/j.micromeso.2014.02.005.
[26]ZHOU L, ZHAO P, CHI Y, WANG D, WANG P, LIU N, CAI D,WU Z, ZHONG N.Controlling the hydrolysis and loss of nitrogen fertilizer(urea)by using a nanocomposite favors plant growth[J].ChemSusChem,2017,10(9):2068-2079.doi:10.1002/cssc.201700032
[27]PEREIRA E I A,NOGUEIRA A R, CRUZ C C T, GUIMARÃES G G F, FOSCHINI M M, BERNARDI A C C, RIBEIRO C.Controlled urea release employing nanocomposites increases the efficiency of nitrogen use by forage[J].ACS Sustainable Chemistry & Engineering,2017,5(11):9993-10001.doi:10.1021/acssuschemeng.7b01919.
[28]NEU S, SCHALLER J, DUDEL E G.Silicon availability modifies nutrient use efficiency and content, C:N:P stoichiometry, and productivity of winter wheat(Triticum aestivum L.)[J].Scientific Reports,2017,7(1):1-8.doi:10.1038/srep40829.
[29]SAIKIA P,BHATTACHARYA S S, BARUAH K K.Organic substitution in fertilizer schedule: Impacts on soil health, photosynthetic efficiency,yield and assimilation in wheat grown in alluvial soil[J].Agriculture,Ecosystems & Environment,2015,203: 102-109.doi:10.1016/j.agee.2015.02.003.
[30]MAGHSOUDI K, EMAM Y, ASHRAF M.Influence of foliar application of silicon on chlorophyll fluorescence, photosynthetic pigments, and growth in water-stressed wheat cultivars differing in drought tolerance[J].Turkish Journal of Botany,2015,39:625-634.doi: 10.3906/bot-1407-11.