【研究意义】水稻细菌性条斑病(bacterial leaf streak,BLS),简称细条病,是由水稻细条 病 病 菌(Xanthomonas oryzae pv.oryzicola,Xooc)感染引起,该病菌为革兰氏阴性、黄单胞菌属细菌[1]。是我国南方稻区主要的检疫性病害之一[2-3],是继水稻稻瘟病、水稻纹枯病和水稻白叶枯病之后的第四大病害[4],1957年在我国广东省发现该病害[5]。病菌的侵染能引起植物一系列生理代谢过程的变化,进而导致各种症状[6],而植物激素的变化可能与病害症状形成有关[7]。因此,研究水稻感染细条病菌后激素的变化可为揭示水稻与病原菌互作机制提供依据,同时为水稻抗性育种提供参考。【前人研究进展】大量研究表明,在植物与病原物互作过程中水杨酸(SA)、茉莉酸(JA)和乙烯(ETH)发挥了关键作用[8-10]。一般认为SA主要调控植物对活体营养型病原菌的抗性,而JA和ETH主要调控植物对死体营养型病原菌的抗性[11]。植物生长发育相关的激素,如赤霉素(GA)、细胞分裂素(CTK)、脱落酸(ABA)、生长素(IAA)等也直接或间接地参与了植物抗病或感病反应[12]。激素合成代谢与信号转导途径是如何调控水稻抗病性的,也引起重视。研究表明SA的信号途径在介导水稻防卫反应中起重要作用[13],其中两个关键调控基因OsNPR1和OsWRKY45在水稻SA途径中具有不同而又互补的作用[14]。许多研究表明JA参与水稻免疫反应[15-16]。Riemann等[17]通过对JA合成途径关键基因OsAOC缺失突变体的研究发现,OsAOC突变后对稻瘟菌的抗性降低,JA介导了对稻瘟菌的防卫反应。Uji等[18]发现水稻OsMYC2作为早期JA信号的正调控因子,能够与JA反应的转录抑制子JAZ互作, OsMYC2在水稻过表达后,通过上调防御相关基因的表达,增强了对白叶枯病菌的抗性。Grewal等[19]利用微阵列研究白叶枯病菌触发的水稻转录调控时发现,大量乙烯信号相关基因参与水稻免疫调节。Qin等[20]在研究赤霉素20-氧化酶基因OsGA20ox3过表达和RNAi转基因植株时发现,通过调节GA含量,可以改变水稻对白叶枯病菌和稻瘟病菌的抗性。Jiang等[21]测定了稻瘟病菌侵染后苗期水稻叶片内植物激素的含量,发现CTK在叶片内积累,并证实CTK信号与SA信号协同参与水稻对稻瘟病菌的数量抗性调控。【本研究切入点】虽然在水稻与病原菌互作过程中植物激素功能的研究已取得一定进展,但是多集中于稻瘟病菌和白叶枯病菌的研究。对于各类植物激素在水稻抵抗细条病菌中所扮演的角色,还缺乏认识,关于Xooc侵染后植株内源激素的变化仍少见报道。【拟解决的关键问题】通过测定Xooc侵染水稻细条病抗、感近等基因系后SA、JA、ETH、GA、玉米素(ZT)在不同时间点的叶片内含量,并与接种无菌水的对照进行比较,明确Xooc侵染对水稻植株内源激素的影响,为研究和防治水稻细条病提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 水稻材料 以感病籼稻品种9311为轮回亲本,抗病野生稻材料DY19为供体亲本,通过杂交、回交和自交培育BC4 F3代,获得水稻细条病抗病近等基因系LR19和感病近等基因系LS19。2019年9月在广西大学农学院科学研究试验基地种植LR19和LS19各100株。
1.1.2 供试菌株 水稻细条病菌(Xooc)采用广西水稻细条病优势生理小种 GX01,由亚热带农业生物资源保护与利用国家重点实验室何勇强教授提供。
1.2 试验方法
2 结果与分析
2.1 SA含量变化
从图1可以看出,接菌0 h,抗病近等基因系LR19较感病近等基因系LS19的SA含量高,前者 SA 含量(10.05 μg/mL)是后者(7.11 μg/mL)的1.48倍。接菌0~96 h,LR19处理组与对照组SA含量整体都呈下降趋势,且在各时间点,接菌处理和对照间差异不显著;接菌0~24 h,LS19处理组与对照组SA含量缓慢上升,并在接菌24 h同时达到峰值,分别为7.61、8.16 μg/mL,接菌24~96 h又皆呈下降趋势,但对照组下降速率更快,而处理组则稍慢。从总体上看,接种0~96 h期间SA含量,LR19和LS19处理组分别为8.32、6.57 μg/mL,对照组分别为8.31、6.27 μg/mL。抗性材料SA含量始终高于感性材料,但两个材料处理组与对照组相比均无显著差异。表明SA含量的变化并不是由Xooc的侵染引起的。
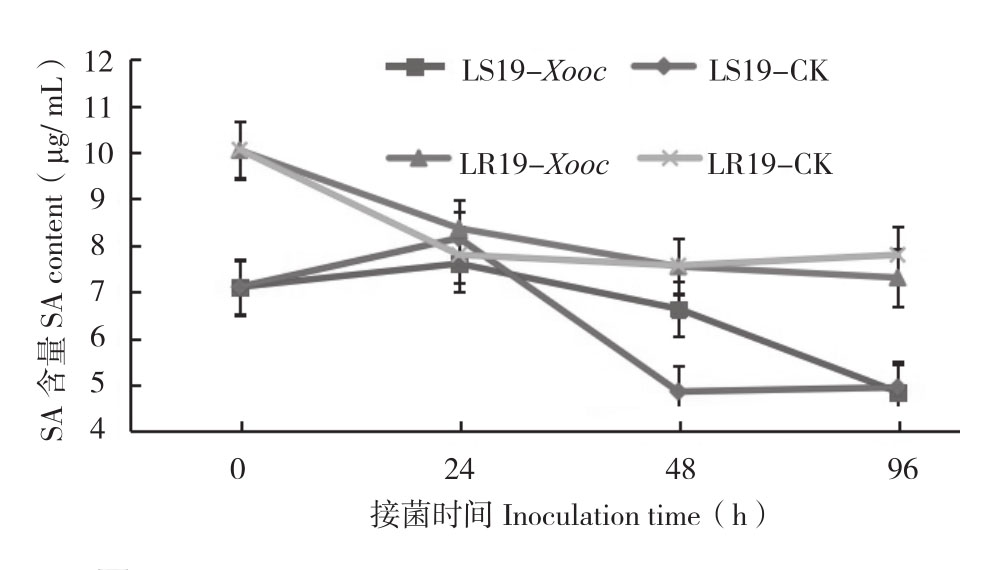
图1 抗、感近等基因系接种细条病菌后不同时间叶片SA含量的变化
Fig.1 Changes of SA content in leaves of resistant and susceptible near-isogenic lines at different times after Xooc inoculation
2.2 JA含量变化
由图2可知,接菌0 h,LR19和LS19叶片JA含量差异不大,前者为1 579.33 pmol/L,后者为1 418.5 pmol/L;接菌24~96 h,LR19和LS19叶片JA含量都升高,而前者JA含量要低于后者。接菌0~24 h,LR19处理组叶片JA含量迅速升高,并达到峰值(2 891.0 pmol/L),较对照(939.33 pmol/L)增加207.77%,差异显著;接菌24~96 h,JA含量随着时间延长而减少,接菌96 h,处理组(2 022.67 pmol/L)较对照组(679.33 pmol/L)增加197.74%,差异显著;接菌0~48 h,LS19处理组叶片JA含量一直保持较高的上升速率,并在接菌48 h达到峰值(4 180.17 pmol/L),较对照(991.83 pmol/L)增加321.46%,差异显著;接菌96 h,处理组叶片JA含量有所下降(3 506.83 pmol/L),较对照(725.17 pmol/L)仍保持较高水平,增加比率达到383.59%(P<0.05)。从总体上看,接菌0~96 h期间JA含量,LR19处理组和对照组分别为2 316.0、1 174.33 pmol/L;LS19处理组和对照组分别为3 043.08、971.83 pmol/L。抗、感材料处理组与对照组相比差异显著,细条病菌侵染后,诱导抗、感病近等基因系叶片JA含量上升,JA参与了水稻与细条病菌的互作。
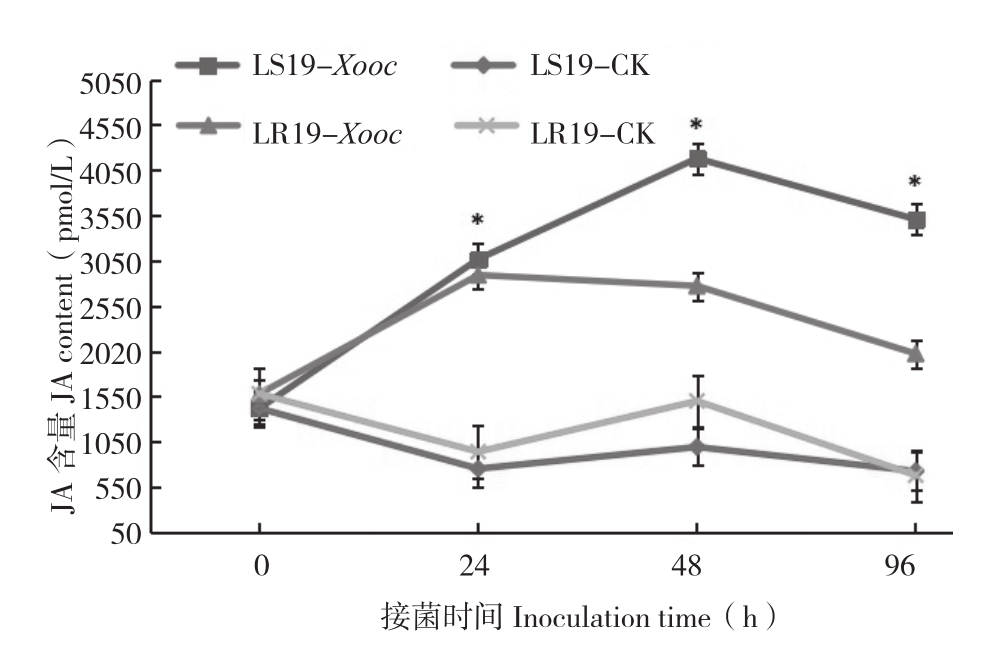
图2 抗、感近等基因系接种细条病菌后不同时间叶片JA含量的变化
Fig.2 Changes of JA content in leaves of resistant and susceptible near-isogenic lines at different times after Xooc inoculation
* 表示经t测验检测接菌处理与对照相比JA含量差异显著
* represents significant difference of JA content between inoculated treatment and control treatment by t-test
2.3 ETH含量变化
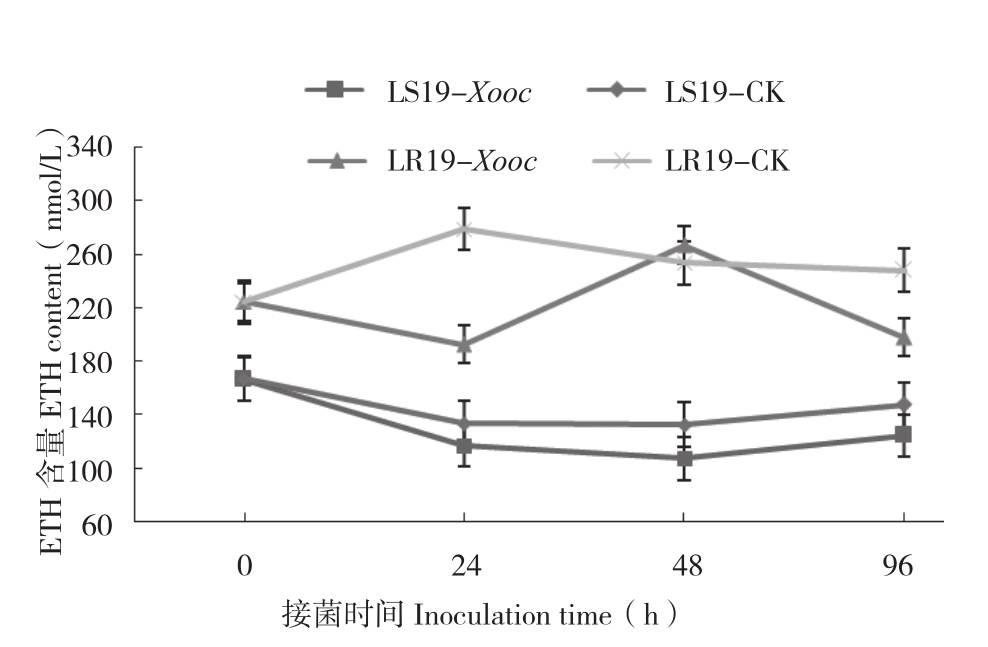
图3 抗、感近等基因系接种细条病菌后不同时间叶片ETH含量的变化
Fig.3 Changes of ETH content in leaves of resistant and susceptible near-isogenic lines at different times after Xooc inoculation
由图3可知,接菌0 h,LR19和LS19叶片ETH含量分别为224.04、166.02 nmol/L,前者是后者的1.35倍,二者之间差异显著;接菌24 h,LR19处理组(192.31 nmol/L)较对照组(278.57 nmol/L)ETH含量减少,减少比率为30.97%,差异显著;接菌24~96 h,处理组ETH含量呈波动趋势,而对照组ETH含量则趋于稳定;接菌0~24 h,LS19处理组叶片ETH含量降低,并在接菌24 h后趋于稳定,且始终低于对照,但是与对照相比没有显著差异。从总体上看,接菌0~96 h,LR19和LS19叶片 ETH含量,处理组分别为220.06、128.32 nmol/L,对照组分别为280.56、144.7 nmol/L,抗病近等基因系高于感病近等基因系,但两个材料ETH含量处理组与对照组间差异未达显著水平。表明ETH含量的变化并不是由Xooc的侵染引起的。
2.4 GA含量变化
由图4可知,接菌0 h,LR19叶片GA含量(76.78 pmol/L)略低于 LS19(81.98 pmol/L),但差异不显著。接菌24 h,LR19处理组叶片GA含量(74.92 pmol/L)较对照组(62.39 pmol/L)增加比率为20.08%;接菌24~48 h,GA含量迅速下降并于接菌96 h达到最低值(42.34 pmol/L),较对照组(88.62 pmol/L)减少52.22%,差异显著;接菌24 h,LS19处理组叶片 GA含量升高至峰值(89.51 pmol/L),较对照组(72.25 pmol/L)增加23.89%,接菌24 h后,GA含量开始下降,接菌96 h下降至最低值(74.43 pmol/L),但与对照组(42.64 pmol/L)差异仍显著。从总体上看,接菌0~96 h期间GA含量,LR19处理组和对照组分别为63.81、75.19 pmol/L,LS19处理组和对照组分别为83.20、66.27 pmol/L,抗、感材料处理组与对照组相比差异显著,细条病菌侵染后,抗、感近等基因系叶片GA含量变化不同,前者下调,后者上调,表明GA参与了水稻与细条病菌的互作。
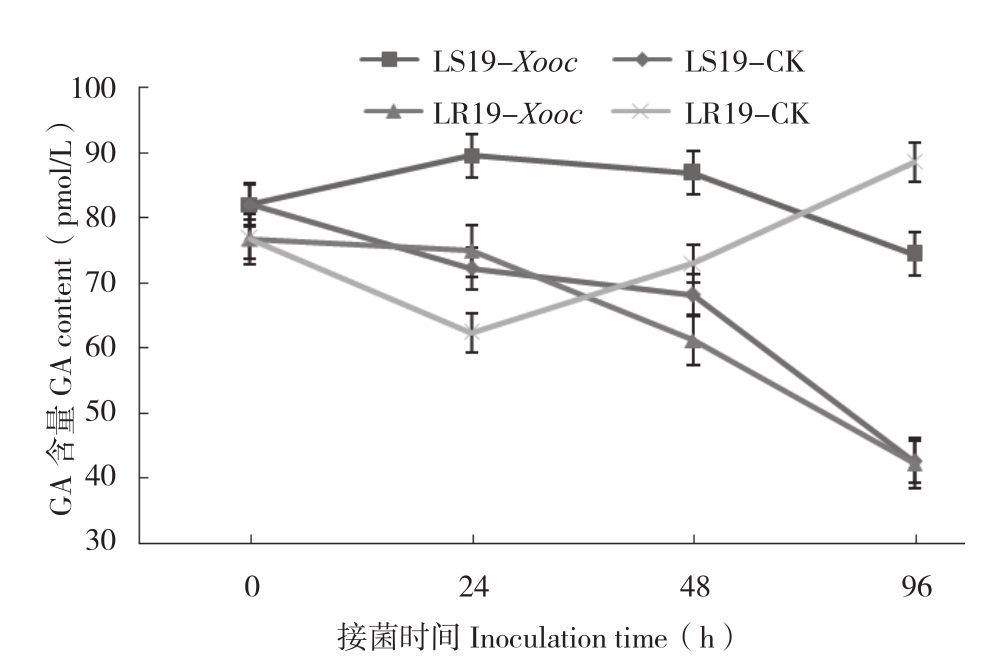
图4 抗、感近等基因系接种细条病菌后不同时间叶片GA含量的变化
Fig.4 Changes of GA content in leaves of resistant and susceptible near-isogenic lines at different times after Xooc inoculation
2.5 ZT含量变化
由图5可知,接菌0 h,LR19和LS19叶片ZT含量分别为6.35、4.84 pmol/L,前者是后者的1.33倍。LR19处理组叶片ZT含量在接菌48 h降到谷值(4.62 pmol/L),较对照(5.64 pmol/L)减少比率为18.09%,接菌48~96 h,ZT含量表现为上升趋势,但始终低于对照;LS19处理组叶片ZT含量在接菌24 h降到最低(3.76 pmol/L),较对照(5.24 pmol/L)减少比率为28.24%,差异显著,接菌48 ~96 h,ZT含量上升,但与对照相比差异不显著。从总体上看,接菌0~96 h,LR19和LS19 叶片ZT含量,处理组分别为5.56、4.37 pmol/L,对照组分别为6.40、4.96 pmol/L,抗病近等基因系高于感病近等基因系,但两个材料ZT含量处理组与对照组间差异不显著。表明ZT含量的变化并不是由Xooc的侵染引起的。
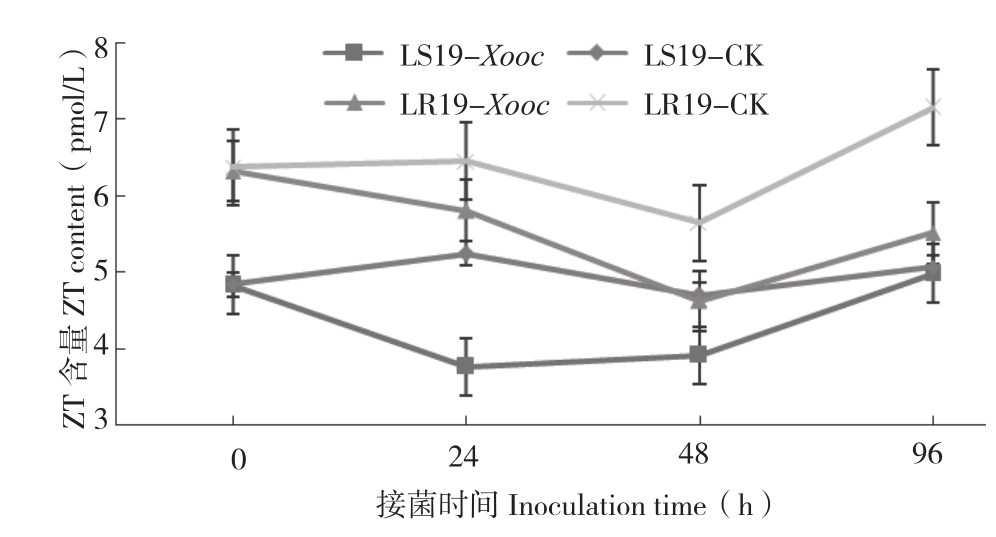
图5 抗、感近等基因系接种细条病菌后不同时间叶片ZT含量的变化
Fig.5 Changes of ZT content in leaves of resistant and susceptible near-isogenic lines at different times after Xooc inoculation
3 讨论
植物激素作为一种天然存在的小的有机分子,不仅对植物的发育过程有重要作用,而且在植物的防御和免疫反应中起着重要的信号分子作用[22-23]。许多最初被认为只与生长过程有关的激素,现在已被认为与对病原体的免疫反应有关[24]。不是由一种激素控制植物免疫的,植物激素通过复杂的拮抗和协同作用相互依赖。植物激素信号通路之间的复杂交流网络被称为激素交联。植物激素积累动态影响着由某一特定植物激素介导的信号输出,以及由此产生的激素交联。因此,测量植物激素浓度,对于理解激素交联至关重要[10]。目前参与防御水稻细条病菌的激素及其信号转导网络尚不清楚,本研究测量水稻细条病抗、感近等基因系受Xooc侵染后,5种激素浓度在不同时间点的变化,将有助于对这一问题的认识。
水杨酸(SA)在植物防卫反应的信号途径和获得性抗性(systemic acquired resistance,SAR)方面起着重要作用[13]。水稻植株内源基础 SA含量相对较高,其占植株鲜重的比例大致为5 000~30 000 ng/g,甚至比受侵染的烟草、拟南芥等植物组织还要高,高含量的SA可充当内源抗氧化剂,为水稻提供保护,不受由病原菌侵染、非生物胁迫和老化引起的损伤[25-28]。然而,SA参与水稻防御更依赖于SA信号传导而不是其内源水平或从头合成的变化[15]。本研究中,接菌Xooc后,抗病近等基因系体内SA含量远高于感病近等基因系,此后,二者中的JA含量均呈下降趋势,但与对照组相比均无显著差异。表明SA含量的变化并不是由Xooc的侵染而引起的。但是在接菌0~96 h,抗病近等基因系SA含量始终高于感病近等基因系,这种高的内源基础SA含量,是否是产生细条病抗性所需要的,还有待进一步研究。
茉莉酸(JA)在植物遭受病原菌入侵时起着重要的保护作用,当病原菌入侵后,植物通过JA信号传递,能够对病原菌的胁迫作出防卫反应[29-30]。越来越多的证据表明,在水稻中JA是个强大的信号,能够抵抗各种不同生活方式的病原菌,包括半活体营养型白叶枯病菌、活体营养型稻瘟病菌和死体营养型纹枯病菌[16]。本试验中,细条病菌侵染后,诱导抗病近等基因系和感病近等基因系叶片内的JA含量上升,而接种无菌水的对照,抗病近等基因系和感病近等基因系叶片内的含量均没有上升,在各时间点,处理组与对照组间差异显著。表明,Xooc能够诱导JA含量的增加。Feng等[31]研究表明OsPGIP4正向调控水稻对细条病菌的防卫反应,而JA可能参与OsPGIP4介导的防卫反应。Ke等[32]研究发现,水稻的植物抗毒素蛋白基因OsPAD4诱导的对白叶枯病菌和半活体营养型细条病菌的抗性,并不依赖SA反应,而是与JA的积累和JA响应基因的表达有关。本研究结果同样提示JA可能参与了水稻与细条病菌的互作。而在接菌24~96 h,抗病近等基因系的JA含量低于感病近等基因系,可能是因为抗病近等基因系产生抗性需要JA参与反应或信号介导而消耗所致。
ETH与JA信号具有协同作用[10]。其作为水稻防御信号的双向调节因子,增强了对稻瘟病等病原菌的抗性,而导致对白叶枯病菌的敏感性,正负调控作用取决于病原体的感染生物学[33]。本试验中,抗、感近等基因系接种细条病菌后,叶片ETH含量与对照组差异不显著。表明ETH含量的变化并不是由Xooc的侵染引起的。接菌0~96 h,抗病近等基因系ETH含量始终高于感病近等基因系,这有可能与细条病抗性差异相关。
赤霉素(GA)是一个四环二萜类激素的大家族,有助于调节植物生长和免疫反应[34]。Yang等[35]研究表明,GA负调控水稻的基础抗病性。外施GA和GA合成抑制剂可分别提高白叶枯病的敏感性和抗性。相似地,生物合成基因OsGA20Ox3的转录增加也导致对白叶枯病菌和稻瘟病菌敏感性的增强[20]。本研究接菌后,抗病近等基因系叶片GA含量较对照下降;而感病近等基因系叶片GA含量较对照上升。受Xooc侵染后,抗、感系叶片GA含量变化不同。从而推测GA在水稻抗细条病的过程中可能发挥着负调控的作用。
玉米素(ZT)是一种植物体内天然存在的细胞分裂素,不仅能促进植物细胞分裂,而且可以阻止叶绿素和蛋白质降解,减慢呼吸作用,延缓植株衰老。细胞分裂素对活体营养型病原菌的免疫具有正负调节双向作用,取决于侵染部位细胞分裂素浓度的高低。高水平的细胞分裂素导致病原菌生长减少和防御反应的激活,而低浓度的细胞分裂素促进病原菌生长[36]。细胞分裂素对活体营养型病原菌的重要性要超过细菌和真菌/卵菌病原体[9]。本试验中,抗、感近等基因系叶片ZT含量虽在接菌处理后表现为下降,但是从整体上看,与对照相比均无显著差异。表明ZT含量的变化,并不是由Xooc侵染引起的。而抗病近等基因系ZT含量始终高于感病近等基因系,这可能有助于抵抗细条病。
4 结论
试验结果表明,接菌后,LR19处理组SA、ETH、ZT含量分别为8.32 μg/mL、220.06 nmol/L和5.56 pmol/L,对照组则分别为8.31 μg/mL、250.86 nmol/L和6.40 pmol/L。LS19处 理组 SA、ETH、ZT含 量 分 别 为 6.57 μg/mL、128.35 nmol/L和4.37 pmol/L,对照组则分别为 6.27 μg/mL、134.7 nmol/L 和 4.96 pmol/L。对于这3种激素,抗、感材料在处理组和对照组间差异均不显著,表明它们的变化不是由Xooc引起的,但是抗性材料SA、ETH、ZT含量始终高于感性材料,可能有助于抵抗病原菌的侵染。接菌后,LR19处理组JA、GA含量分别为2 316.0、63.81 pmol/L,对照组则分别为1 174.33、75.19 pmol/L,LS19处理组JA、GA含量分别为3 043.08、83.20 pmol/L,对照组则分别为971.83、66.27 pmol/L。对于这2种激素,抗、感材料在处理组和对照组间差异显著,且抗性材料的含量低于感性材料。表明它们的变化是由Xooc引起的,JA和GA参与了水稻对细条病的抗性反应。
[1]方中达,任欣正,陈泰英,朱有釭,范怀忠,伍尚忠.水稻白叶枯病及条斑病和李氏禾条斑病病原细菌的比较研究[J].植物病理学报,1957,3(2): 99-124.doi:10.13926/j.cnki.apps.1957.02.001.FANG Z D, REN X Z, CHEN T Y, ZHU Y H, FAN H Z, WU S Z.Comparative Study on the Bacterial Bacteria of Rice Bacterial Leaf Blight and Stripe Leaf Disease[J]. Journal of Plant Pathology, 1957,3(2): 99-124.doi: 10.13926/j.cnki.apps.1957.02.001.
[2]NINO L D, RONALD P C, BOGDANOVE A.Xanthomonas oryzae pathovars : model pathogens of a model crop[J].Molecular Plant Pathology, 2010,7(5): 303-324.doi: 10.1111/j.1364-3703.2006.00344.
[3]许志刚,钱菊梅.水稻细菌性条斑病适生性与控制研究进展[J].植物检疫,1995, 9(4): 239-244.doi:10.19662/j.cnki.issn1005-2755.Xu Z G, Qian J M.Research progress on the adaptability and control of rice bacterial stripe[J].Phytosanitary,1995,9(4):239-244.doi:10.19662/j.cnki.issn1005-2755.
[4]陈玉奇,余明志,乐承伟,黄新燊.水稻细条病发生程度与损失率的关系[J].植物保护,1990,16(4):52.CHEN Y Q,YU M Z,LE C W,HUANG X S.Relationship between incidence of rice thin stripe disease and loss rate[J].Plant protection,1990,16(4):52.
[5]张荣胜,陈志谊,刘永锋.水稻细菌性条斑病研究进展[J].江苏农业学报,2014,30(4):901-908.doi:10.3969/j.issn.1000-4440.2014.04.034.ZHANG R S, CHEN Z Y, LIU Y F.Research progress on rice bacterial Stripe[J].Jiangsu Agricultural Journal, 2014,30(4):901-908.doi:10.3969/j.issn.1000-4440.2014.04.034.
[6]FRASER R S , WHENHAM R J.Plant growth regulators and virus infection:a critical review[J].Journal of Plant Growth Regulation,1982,1(1):37-59.doi:10.1007/BF00024221.
[7]JAMESON P E, CLARKE S F.Hormonevirus interactions in plants[J].Critical Reviews in Plant Sciences, 2002,21(3):205-228.
[8]XIONG G S, LI J Y, WANG Y H.Advances in the resulation and crosstalks of phytohormones[J].Chinese Science Bulletin,2009,54:4069-4082.doi:10.1007/s11434-009-0629.
[9]SHIGENAGA A, ARGUESO C.No hormone to rule them all:interactions of plant hormones during the responses of plants to pathogens[J].Semin.Cell& Dev.Biol,2016,56:174-189.doi:10.1016/j.semcdb.2016.06.005.
[10]SHIGENAGA A, BERENS M, TSUDA K, ARGUESO C.Towards engineering of hormonal crosstalk in plant immunity[J].Current Opinion in Plant Biology,2017, 38:164-172.doi:10.1016/j.pbi.2017.04.021.
[11]BARI R , JONES J.Role of plant hormones in plant defence responses[J].Plant Mol.Biol, 2009,69(4): 473-488.doi:10.1007/s11103-008-9435-0.
[12]旷永洁,柳浪,严芳,任斌,闫大琦,张大伟,林宏辉,周焕斌.水稻与病原物互作中植物激素功能的研究进展[J].生物技术通报,2018,4(2):74-86.doi:10.13560/j.cnki.biotech.bull.1985.2017-1104.KUANG Y J, LIU L,YAN F, REN B,YAN D Q, ZHANG D W, LIN H H, ZHOU H B.Research progress on plant hormone function in ricepathogen interaction[J].Biotechnology bulletin, 2018, 4(2):74-86.doi:10.13560/j.cnki.biotech.bull.1985.2017-1104.
[13]KLESSIG D, CHOI H, DEMPSE D.Systemic acquired resistance and salicylic acid: past, present and future[J].MPMI,2018,31(9):871-888.doi:10.1094/MPMI-03-18-0067-CR.
[14]DE B L, HÖFTE M, DE V D.Connecting growth anddefense: the emerging roles of brassinosteroids and gibberellins in plantinnate immunity[J].Mol.Plant,2014,7: 943-959.doi:10.1093/mp/ssu050.
[15]YANG D L,YANG Y,HE Z H.Roles of plant hormones and their interplay in rice immunity[J].Molecular plant, 2013, 3: 675-685.doi:10.1093/mp/sst056.
[16]SINGH P K,NAG A,ARYA P,KAPOOR R,SINGH A,JASWAL R,SHARMA T R.Prospects of understanding the molecular biology of disease resistance in rice[J].International journal of molecular sciences, 2018,19(4): 1141.
[17]RIEMANN M, HAGA K, SHIMIZU T, OKADA K, IINO M.Identification of rice allene oxide cyclase mutants and the function of jasmonate for defence against magnaporthe oryzae[J].The Plant Journal, 2013,74(2): 226-238.doi:10.1111/tpj.12115.
[18]UJI Y,TANIGUCHI S,TAMAOKI D,SHISHIDO H, AKIMITSU K,GOMI K.Overexpression of OsMYC2 results in the Up-Regulation of early JA-Rresponsive genes and bacterial blight resistance in rice[J].Plant& Cell Physiology,2016,57(9):1814-1827.doi:10.1093/pcp/pcw101.
[19]GREWAL R K, GUPTA S , DAS S.Xanthomonas oryzaepvoryzaetriggers immediate transcriptomic modulations in rice[J].BMC Genomics,2012,13(1):1-12.doi:10.1186/1471-2164-13-49.
[20]QIN X, LIU J H, ZHAO W S, CHEN X J, GUO Z J, PENG Y .Gibberellin 20-Oxidase gene OsGA20ox3 Regulates plant stature and disease development in Rice[J].Plant Microbe,2013,26(2):227-239.
[21]JIANG C J, SHIMONO M, SUGANO S, KOJIMA M, LIU X Q, INOUE H, SAKAKIBARA H, TAKATSUJI H .Cytokinins act synergistically with salicylic acid to activate defense gene expression in rice[J].Plant Microbe,2013,26(3):287-296.
[22]GRANT M, KAZAN K, MANNERS J.Exploiting pathogens’tricks of the trade for engineering of plant disease resistance :challenges and opportunities[J].Microbial Biotechnology, 2013,6(3):212-222.doi:10.1111/1751-7915.12017.
[23]BERENS M, BERRY H, MINE A, ARGUESO C,TSUDA K.Evolution of hormone signaling networks in plant defense[J].Annu Rev Phytopathol, 2017,55(1):401-425.doi:10.1146/annurevphyto-080516-035544.
[24]PIETERSE C, VANDER D D, ZAMIOUDIS C, LEON R A, VAN W S.Hormonal modulation of plant immunity[J].Annual review of cell and developmental biologyl,2012,28:489-521.doi:10.1146/annurevcellbio-092910-154055.
[25]丁丽娜,杨国兴.植物抗病机制及信号转导的研究进展[J].生物技术通报,32(10):109-117.doi:10.13560/j.cnki.biotech.bull.1985.2016.10.013.DING L N, YANG G X.Research progress on plant disease resistance mechanism, and signal transduction[J].Biotechnology,bulletin, 2016,32(10):109-117.doi:10.13560/j.cnki.biotech.bull.1985.2016.10.013.
[26]SILVERMAN P, SESKAR M, KANTER D.Salicylic acid in rice :biosynthesis, conjugation, and possible role[J].Plant Physiology,1995,108(2):633-639.doi:10.1104/pp.108.2.633.
[27]RASKIN I, SKUBATZ H, TANG W, MEEUSE B.Salicylic acid levels in thermogenic and non-thermogenic plants[J].Ann Bot, 1990,66(4):369-373.doi:10.1093/oxfordjournals.aob.a088037.
[28]MALAMY J, CARR J, KLESSIG D,RASKIN I.Salicylic acid :a likely endogenous signal in the resistance response for tobacco mosaic viral infection[J].Science,1990,250(4983):1002-1004.doi:10.1126/science.250.4983.1002.
[29]WILDERMUTH M, DEWDNEY J, WU G,AUSUBEL F.Isochorismate synthase is required to synthesize salicylic acid for plant defence[J].Nature,2001, 414(6863):562-565.doi:10.1038/35107108.
[30]HIEU T, HUONG H, LEBRUN M, BELLAFIORE S, CHAMPION A.Jasmonates-the master regulator of rice development, adaptation and defense[J].Plants, 2019,8: 339.
[31]FENG C, ZHANG X,WU T, XIN H,FANG Y.The polygalacturonaseinhibiting protein 4(OsPGIP4), a potential component of the qBlsr5a locus, confers resistance to bacterial leaf streak in rice[J].Planta,2016,243(5): 1297-1308.doi:10.1007/s00425-016-2480-z.
[32]KE Y, LIU H, LI X , XIAO J, WANG S.Rice OsPAD4 functions differently from Arabidopsis AtPAD4 in host-pathogen interactions[J].Plants, 2014,78: 619-631.doi:10.1111/tpj.12500.
[33]DE V D, GHEYSEN G, HOFTE M.Hormone defense networking in rice: Tales from a different world[J].Trends Plant Sci, 2013, 18:555-565.doi:10.1016/j.tplants.2013.07.002.
[34]DE V D, XU J, HÖFTE M.Making sense of hormone-mediated defense networking: from rice to Arabidopsis[J].Fronties in Plant Science ,2014,5(611):1-15.doi: 10.3389/fpls.2014.00611.
[35]YANG D W, LI Q D , YI W.Altered disease development in the Eui mutants and eui overexpressors indicates that gibberellins negatively regulate rice basal disease resistance[J].Mol Plant, 2008,1(3):528-537.doi:10.1093/mp/ssn021.
[36]HANN D R, DOMNGUEZ F A, MOTYKA V, DOBREV P I,SCHORNACK S, JEHLE A, FELIX G, CHINCHILLA D, RATHJEN J P, BOLLER T.The Pseudomonas type IIIeffector HopQ1 activates cytokinin signaling and interferes with plantinnate immunity[J].New Phytol, 2014, 201: 585-598.doi:10.1111/nph.12544.