卵泡是哺乳动物卵巢的基本功能单位,卵泡发育是一个连续的、有选择性的过程。在哺乳动物胚胎期,原始生殖细胞迁移至生殖嵴分化为生殖细胞,进而分化为卵原细胞。经增殖迁移至卵巢皮质,随即发育为原始卵泡。卵巢中的原始卵泡经过募集、选择和优势化等过程,逐步发育为初级卵泡、次级卵泡、有腔卵泡和成熟卵泡[1]。受促卵泡激素(Folliclestimulating hormone,FSH)、雌激素、促黄体素(Luteinizing hormone,LH)、促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH) 信号通路、成纤维细胞生长因子(fibroblast growth factors,FGF)信号通路、凋亡和自噬信号通路等的调控[2],卵巢组织发生重塑,包括卵泡腔的形成、扩张和卵泡液的积累,使卵泡形态和功能发生周期性的变化,形成成熟的卵母细胞,对动物的繁殖具有重要作用。
卵巢卵泡膜细胞和颗粒细胞的细胞外基质及卵泡液中含有大量的明胶蛋白、纤维蛋白和IV型胶原蛋白等,这些活性蛋白为卵泡膜细胞和颗粒细胞的迁移、增殖和分化提供了必要条件。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一组锌依赖性的内肽酶,由钙保持稳定,分为胶原酶、明胶酶、溶血素、基质溶素、膜型MMPs和其他MMPs[3]。MMPs通过与相关的内源性抑制剂协同作用,能够酶解胶原、明胶、纤连蛋白和层粘连蛋白等胞外基质(extracellular matrix,ECM)的主要成分[4],调控细胞内信号通路,介导细胞微环境变化,从而影响着细胞的存活、形态、组织修复和特异性功能变化[5],在胚胎发育、子宫重塑、伤口愈合、乳腺形态发生等生理过程中发挥重要作用[6]。
基质金属蛋白酶-2(MMP2)和酶-9(MMP9)属于明胶酶,能够特异降解Ⅳ型胶原的一种基质水解酶。MMP2和MMP9结构相似,两者的表达分别在在转录水平、酶原活化水平和酶活性水平相互调节。在内皮素-1、白细胞介素-1β、血管紧张素Ⅱ、肿瘤坏死因子-α、雌激素、孕酮和缺氧等因素的影响下,明胶酶明显上调,酶解ECM中的Ⅳ型胶原等蛋白,改变组织形态[7]。它们不仅能降解多数大分子细胞外基质,还能激活生长因子,参与雌激素信号通路,影响雌激素的合成,进而参与卵泡发育。本文重点对MMP2和MMP9的生物学特性及其在哺乳动物卵泡生长、排卵、黄体化及闭锁过程中的调节作用进行综述。
1 MMP2和MMP9的生物学特性
1.1 MMP2的生物学特性
金属蛋白酶是一种含有金属钙和锌,结构高度同源的内肽酶。目前已经发现200多种金属蛋白酶,其中有40种属于基质金属蛋白酶家族。MMPs分为胶原酶、明胶酶、溶血素、基质溶素、膜型MMPs和其他MMPs。其中MMP2属于明胶酶。最初从人类类风湿滑膜成纤维细胞中纯化出MMP2蛋白,随后发现其分子量为72 ku[8-10]。在人类基因组中,MMP2基因长27.9 kb,包含13个外显子和12个内含子,位于染色体上的16q12.2。人的MMP2基因首先翻译成无活性的酶原,该酶原由5个结构域组成(N端结构域、自身抑制性结构域、催化结构域、铰链区和血凝素结构域)[11],其中血凝素结构域决定底物特异性,铰链区与血凝素结构域的连接对于活化MMP2至关重要。催化结构域中3个重复的纤连蛋白结构域,可与明胶蛋白特异性结合,以及与明胶和层粘连蛋白结合,进而降解ECM中的明胶,Ⅳ、Ⅴ、Ⅶ型胶原,弹性蛋白,纤连蛋白,蛋白聚糖等[12-13]。由于ECM是细胞存活的微环境,因此MMP2能通过酶解明胶蛋白影响细胞的生长、增殖和迁移[14]。MMP2还与肌节蛋白、膜受体、细胞因子和生长因子相互作用,从而调节血管生成、组织重塑的生理过程以及肿瘤和关节炎等病理过程[15]。
1.2 MMP9的生物学特性
MMP9也属于明胶酶,是MMPs家族中分子量最大的明胶酶,于1974年首次在人类中性粒细胞中分离,称为“中性粒细胞明胶酶”[16]。人类的MMP9基因长9.9 kb,含有13个外显子和12个内含子,位于染色体上的20q13.12,分子量为92 ku。MMP9蛋白结构与MMP2结构相似,人MMP9蛋白的主要结构有NH2 -末端亲和域、催化域、连接域和COOH-末端血凝素结构域。锌离子与MMP-9富含半胱氨酸的基序相互协调,首先形成无活性的MMP9蛋白酶原;血凝素结构域与基质金属蛋白酶抑制剂3和抑制剂1在高尔基体分泌前形成紧密的复合物,从而能够抑制其他基质金属蛋白酶[17]。MMP9与MMP2功能也相似,纤维连结蛋白结构域的高度糖基化,能与变性胶原或明胶结合,酶解胶原或明胶蛋白[15],且MMP9底物还有蛋白聚糖、弹性蛋白、纤连蛋白、层粘连蛋白等[18]。由于ECM是细胞迁移的屏障,在胚胎发育中MMP9可通过作用于特定底物介导细胞迁移[19]。MMP9也可通过一些生物活性分子,如血管素、白细胞介素-8和血管内皮生长因子等,影响着血管新生和肿瘤等生命活动[20]。由于在卵泡发育过程中,卵泡的形态发生了显著变化,随着ECM大量的降解和重塑,MMP9可以通过酶解ECM成分诱导细胞迁移,以及调节其抑制剂的活性来影响其他生物分子的活性,影响卵泡发育。
2 MMP2和MMP9对卵泡发育的影响
在哺乳动物卵泡发育的过程中,一部分原始卵泡经过选择逐渐发育形成成熟卵泡,排出卵母细胞,随后形成黄体,促进新一轮的卵泡发育;另一部分卵泡经过闭锁被淘汰。MMP2和MMP9能降解Ⅳ型胶原蛋白等ECM组分,促使改变卵泡形态,对哺乳动物的卵泡发育发挥重要作用。目前已有许多关于MMP2和MMP9对卵泡发育调控的研究(表1、表2)。
2.1 对卵泡生长的影响
在哺乳动物体内,卵泡由原始卵泡逐步发育为初级卵泡、次级卵泡、三级卵泡和成熟卵泡。在卵泡生长中伴随着广泛的血管生成、颗粒细胞大量增殖、卵泡扩张以及卵泡液积聚[21]。卵巢组织中包含大量的胶原蛋白和非胶原蛋白,其中卵泡膜ECM中的胶原蛋白主要含有Ⅳ型胶原蛋白;卵泡的ECM中富含弹性蛋白、蛋白聚糖与氨基聚糖等。MMP2和MMP9可能通过分解ECM的活性蛋白,影响颗粒细胞的增殖、凋亡和迁移,进而影响卵泡的发育。小鼠卵泡中MMP2和MMP9蛋白主要存在于卵泡组织重塑的位置,mRNA和蛋白表达量与卵泡的直径成正比[22]。MMP2和MMP9在小腔卵泡颗粒细胞和卵泡膜细胞中合成和分泌,由于优势卵泡选择发生在腔状卵泡阶段,推测它们参与了优势卵泡的选择过程[23]。为了进一步研究MMP2和MMP9在卵巢内的表达规律,发现MMP9的表达量在正常猪卵泡发育各阶段均高于小型猪,而MMP2的表达量在小型猪卵巢中却高于正常猪[24],推测MMP2和MMP9可分别参与正常和小型猪卵巢卵泡的发育。体外研究表明,MMP2表达量在2~6 mm牛卵泡中与雌二醇(E2)浓度成正相关,与孕酮(P4)浓度呈负相关,从而参与雌激素受体信号通路,影响雌激素的合成[25],推测MMP2通过雌激素信号通路参与卵泡发育调控。此外,MMP2可通过激活表皮生长因子受体(EGFR),触发下游信号通路,增加活性氧的形成,促进血管收缩,进而调节卵泡发育中血管的重塑[26]。由于维甲酸通过调节MMPs的表达改变组织形态,用维甲酸处理的卵巢,MMP9蛋白表达量升高,从而促进卵泡的体外活化[27]。这些研究表明,MMP2和MMP9可能通过分解卵泡液中的明胶蛋白、纤维蛋白和Ⅳ型胶原蛋白等,影响卵泡内颗粒细胞的功能和卵泡腔的形成及扩张,进而影响卵泡生长发育。
表1 MMP2对卵泡发育调控的研究进展
Table 1 Research progress of MMP2 in regulation of follicle development
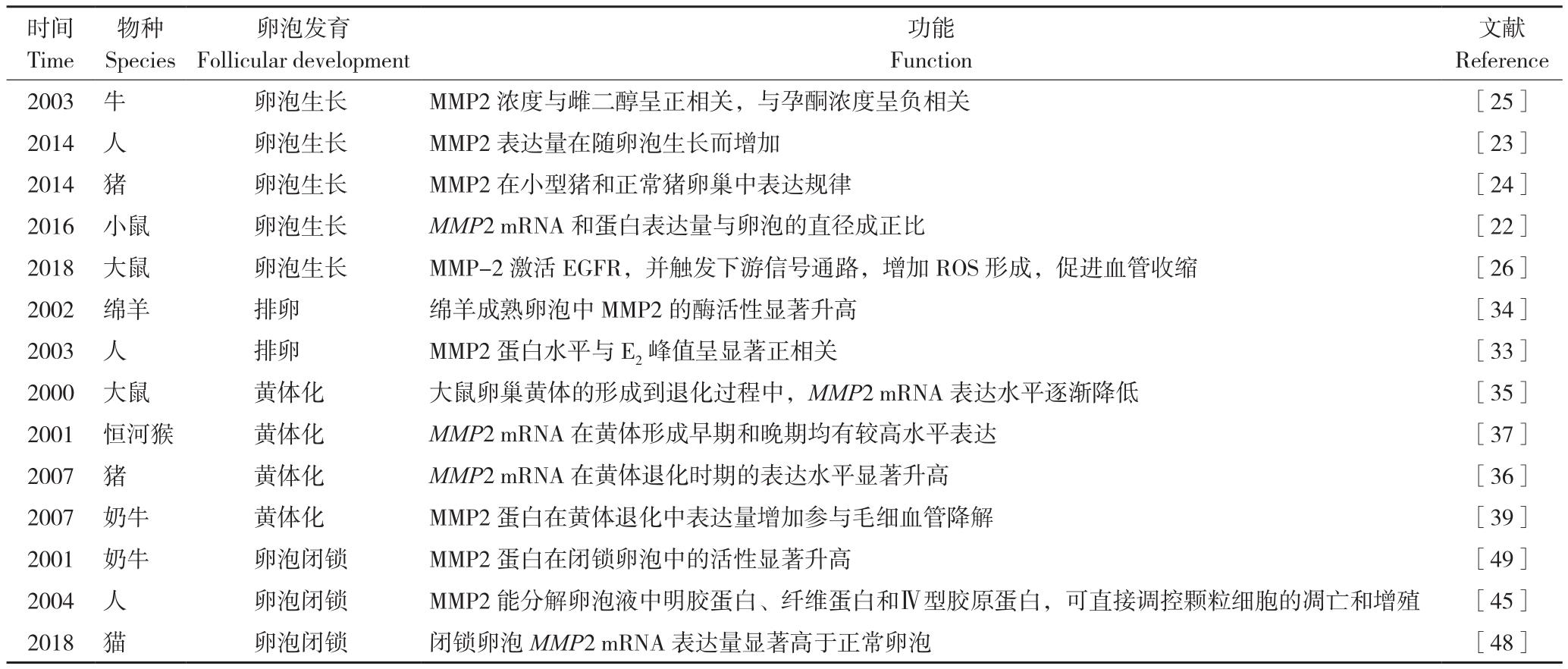
时间Time文献Reference 2003 牛 卵泡生长 MMP2浓度与雌二醇呈正相关,与孕酮浓度呈负相关 [25]2014 人 卵泡生长 MMP2表达量在随卵泡生长而增加 [23]2014 猪 卵泡生长 MMP2在小型猪和正常猪卵巢中表达规律 [24]2016 小鼠 卵泡生长 MMP2 mRNA和蛋白表达量与卵泡的直径成正比 [22]2018 大鼠 卵泡生长 MMP-2激活EGFR,并触发下游信号通路,增加ROS形成,促进血管收缩 [26]2002 绵羊 排卵 绵羊成熟卵泡中MMP2的酶活性显著升高 [34]2003 人 排卵 MMP2蛋白水平与E2峰值呈显著正相关 [33]2000 大鼠 黄体化 大鼠卵巢黄体的形成到退化过程中,MMP2 mRNA表达水平逐渐降低 [35]2001 恒河猴 黄体化 MMP2 mRNA在黄体形成早期和晚期均有较高水平表达 [37]2007 猪 黄体化 MMP2 mRNA在黄体退化时期的表达水平显著升高 [36]2007 奶牛 黄体化 MMP2蛋白在黄体退化中表达量增加参与毛细血管降解 [39]2001 奶牛 卵泡闭锁 MMP2蛋白在闭锁卵泡中的活性显著升高 [49]2004 人 卵泡闭锁 MMP2能分解卵泡液中明胶蛋白、纤维蛋白和Ⅳ型胶原蛋白,可直接调控颗粒细胞的凋亡和增殖 [45]2018 猫 卵泡闭锁 闭锁卵泡MMP2 mRNA表达量显著高于正常卵泡 [48]物种Species卵泡发育Follicular development功能Function
表2 MMP9对卵泡发育调控的研究进展
Table 2 Research progress of MMP9 in regulation of follicle development
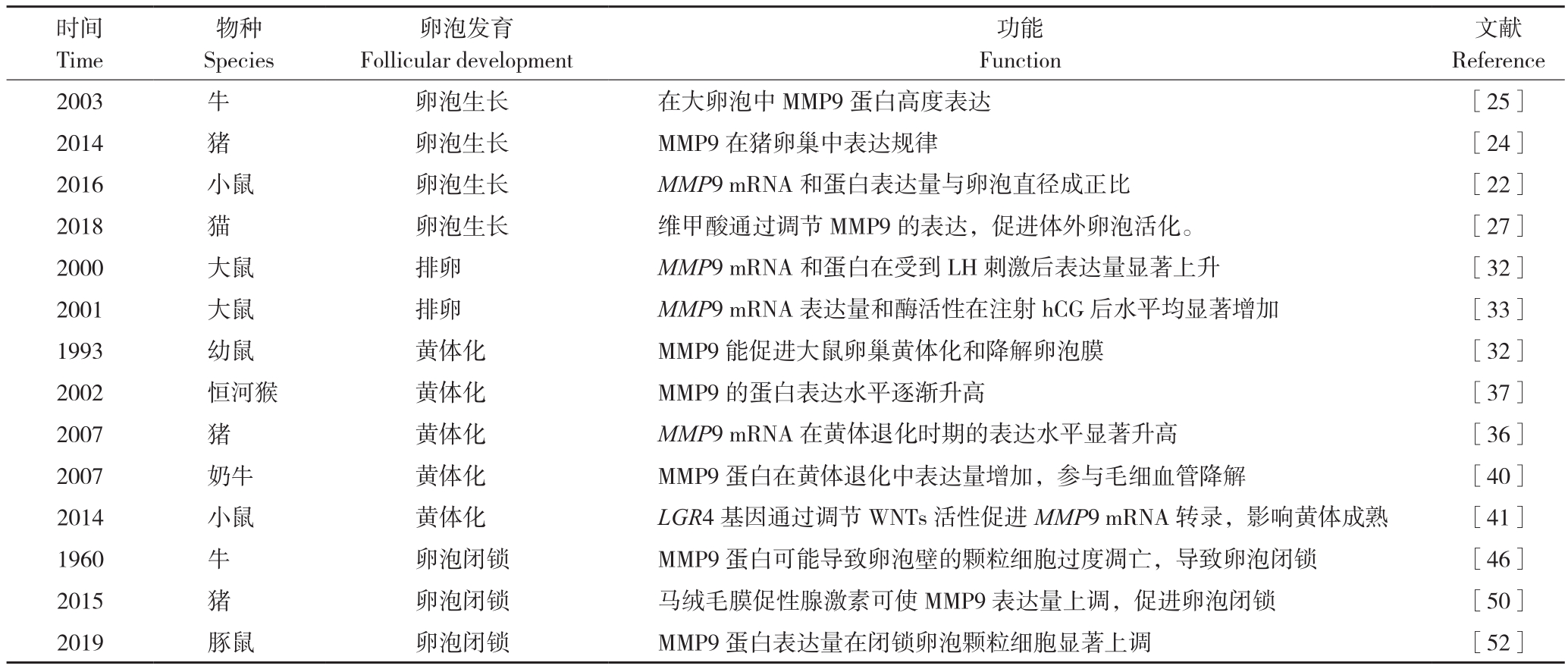
时间Time文献Reference 2003 牛 卵泡生长 在大卵泡中MMP9蛋白高度表达 [25]2014 猪 卵泡生长 MMP9在猪卵巢中表达规律 [24]2016 小鼠 卵泡生长 MMP9 mRNA和蛋白表达量与卵泡直径成正比 [22]2018 猫 卵泡生长 维甲酸通过调节MMP9的表达,促进体外卵泡活化。 [27]2000 大鼠 排卵 MMP9 mRNA和蛋白在受到LH刺激后表达量显著上升 [32]2001 大鼠 排卵 MMP9 mRNA表达量和酶活性在注射hCG后水平均显著增加 [33]1993 幼鼠 黄体化 MMP9能促进大鼠卵巢黄体化和降解卵泡膜 [32]2002 恒河猴 黄体化 MMP9的蛋白表达水平逐渐升高 [37]2007 猪 黄体化 MMP9 mRNA在黄体退化时期的表达水平显著升高 [36]2007 奶牛 黄体化 MMP9蛋白在黄体退化中表达量增加,参与毛细血管降解 [40]2014 小鼠 黄体化 LGR4基因通过调节WNTs活性促进MMP9 mRNA转录,影响黄体成熟 [41]1960 牛 卵泡闭锁 MMP9蛋白可能导致卵泡壁的颗粒细胞过度凋亡,导致卵泡闭锁 [46]2015 猪 卵泡闭锁 马绒毛膜促性腺激素可使MMP9表达量上调,促进卵泡闭锁 [50]2019 豚鼠 卵泡闭锁 MMP9蛋白表达量在闭锁卵泡颗粒细胞显著上调 [52]物种Species卵泡发育Follicular development功能Function
2.2 对排卵的影响
排卵即卵泡发育成熟、卵泡壁分解破裂形成小孔并释放卵母细胞的过程。卵泡发育至成熟时为保持内部压力,卵泡顶端细胞死亡退化和血管破裂,最终导致卵泡膜变薄形成卵泡点;在P4和LH作用下,激活蛋白水解酶活性,卵母细胞与颗粒细胞分离以便卵泡破裂释放出卵子和卵泡液[28]。由于格拉夫卵泡破裂原因可能是卵泡液中的蛋白水解酶消化卵泡膜[29],因此确定哺乳动物卵泡排卵所必需的蛋白酶一直备受关注。在排卵前随着卵泡发育,卵泡内MMP2和MMP9的表达逐渐增加,一方面促进卵泡发育,另一方面也为排卵做准备,保证卵子释放;在排卵时,通过检测卵泡液成分,发现MMP2和MMP9活性增加,其中MMP2是主要蛋白酶[30]。因此,MMP2可能参与排卵过程。在卵泡成熟、E2浓度达到最大值时出现LH峰,并在LH刺激下,成熟卵泡完成排卵。MMP2蛋白水平与E2峰值呈显著正相关,人类卵泡胶原蛋白表达水平在成熟卵泡中显著降低,说明MMP2可能通过降解卵泡胶原蛋白进而促进卵泡成熟[31]。进一步研究明胶酶在排卵中的作用,发现在小鼠卵巢中,注射LH能够显著上调MMP2基因mRNA的表达,而对MMP9的mRNA表达量却无明显影响[32]。在大鼠中注射人绒毛促性腺激素(hCG)或在观察到LH峰之后,MMP2 mRNA和蛋白表达量显著增加;且MMP2的mRNA和蛋白表达量在成熟卵泡的颗粒细胞中也上调[33],由此推测,LH可能通过调控MMP2的分泌进而影响排卵。用LH刺激绵羊卵巢后,成熟卵泡中MMP2的酶活性显著升高,从而促进排卵[34]。
除MMP2促进排卵,有些研究也发现MMP9参与排卵过程。在卵泡逐渐发育过程中,发现MMP9的表达量随卵泡发育成熟而显著增加,发育良好的成熟卵泡膜细胞和颗粒细胞中表达量最多,提示MMP9参与排卵过程[23]。在大鼠卵巢中,MMP9的mRNA和蛋白在受到LH刺激后表达量显著上升[35],LH浓度的不断增加会刺激卵泡成熟,推测LH可诱导MMP9的产生,对卵泡排卵具有重要作用。这些证据表明,MMP2和MMP9可能通过激素相关刺激,促进颗粒细胞膜的溶解和卵泡顶端碎裂,参与协调哺乳动物卵母细胞的释放。
2.3 对黄体形成的影响
成熟卵泡破裂、排出卵母细胞后,卵泡壁塌陷褶皱,卵泡膜血管破裂流血凝集到卵泡腔,从而形成红体。同时FSH诱导颗粒细胞表达LH受体,在出现LH排卵峰后促进颗粒细胞的黄体化,最终卵泡腔充满膜血管、成纤维细胞形成黄体[1]。众多研究证明,ECM结构的降解可扩大黄体化,对黄体的形成和退化具有重要作用。
利用原位杂交技术发现在假孕大鼠卵巢黄体的形成到退化过程中,MMP2基因的mRNA表达水平逐渐降低,这说明MMP2可能在黄体的组织重塑中发挥重要作用[32]。例如,MMP9 mRNA在猪黄体退化期的表达水平显著升高[36]。比较恒河猴黄体退化早期、中期、中晚期、晚期和最晚期的和MMP9表达水平,发现MMP2在早期和晚期表达较高,MMP9在黄体晚期表达最高[37]。这些结果说明,MMP2和MMP9在黄体的组织重塑中发挥着重要作用。由于黄体形成需要大量的细胞和血管生成,因此有研究发现利用LH处理无垂体幼鼠,MMP2和MMP9均能促进大鼠卵巢黄体化以及降解卵泡膜,从而促进膜细胞迁移到颗粒细胞层,诱导血管新生[38]。对奶牛注射GnRH和前列腺素F(PGF)后,MMP2和血管生成因子的mRNA和蛋白表达量在黄体生成期均显著升高,在黄体退化期,血管生成因子减少,MMP2和MMP9蛋白酶表达量增加,进而参与毛细血管的降解和黄体细胞的凋亡[39]。这些结果证明,ECM重塑发生在整个黄体期,MMP2和MMP9可能有助于增强细胞分化、血管生成等;MMP2可能参与黄体的形成和退化,而MMP9可能仅参与黄体退化过程。
由于黄体形成和退化均受激素调节,因此MMP2和MMP9也能受某些激素的调节进而影响黄体形成。研究发现,在小鼠中LGR4基因通过调节WNTs的活性促进MMP9 mRNA翻译,进而激活EGFR-ERK信号通路影响黄体成熟[40]。用LH和非代谢黄体酮分别处理恒河猴,两个处理组黄体中的MMP2和MMP9 mRNA表达量和蛋白活性较对照组显著降低[41],因此LH可能通过促进MMP2和MMP9 mRNA或蛋白水平提高明胶酶活性,进而影响黄体退化。结果表明,性激素可能通过调控MMP2和MMP9的转录表达,进而影响黄体的形成和退化。此外,培养黄体化颗粒细胞发现hCG处理的颗粒细胞中MMP2表达量显著降低,说明hCG能抑制MMP2的表达,从而稳定细胞外基质,延长黄体功能,提示妊娠早期对维持黄体功能具有重要作用[42]。
2.4 对卵泡闭锁的影响
卵泡闭锁主要表现为颗粒细胞层减少,分泌的雌激素减少,P4浓度增加,颗粒细胞的促性腺激素受体减少,胞质溶解退化,且伴随着明显的组织重塑[43]。颗粒细胞的过度凋亡是卵泡闭锁的标志。
卵泡液含有大量明胶蛋白、纤维蛋白和IV型胶原蛋白等[44],这些活性蛋白为颗粒细胞的迁移、增殖和分化提供了必要的条件。MMP2因能分解卵泡液中明胶蛋白、纤维蛋白和IV型胶原蛋白,可直接调控颗粒细胞的凋亡和增殖[45]。同时,在牛[46]、猫[47]和羊[48]的闭锁卵泡液中,MMP2的mRNA表达量显著高于正常卵泡。用明胶酶谱检测2~6 mm奶牛卵泡液内的明胶酶活性,发现MMP2和MMP9蛋白在闭锁卵泡中的活性显著高于正常卵泡;同时,闭锁卵泡中E2与P4的含量也显著降低[49],推测MMP2和MMP9表达量可能是卵泡闭锁的标志。由于大量的颗粒细胞凋亡诱导卵泡闭锁,MMP2和MMP9蛋白可能有利于卵泡壁的颗粒细胞过度凋亡,进而导致卵泡闭锁。在初级卵泡和次级卵泡颗粒细胞中,马绒促性素(equine chorionic gonadotropin,eCG)能显著上调MMP2蛋白表达水平,并促进卵泡闭锁[50]。但是卵泡过度闭锁改变卵泡的ECM,可致使细胞粘附分子表达量下调,从而引起多囊卵巢综合征[51]。研究发现,在人的多囊卵巢综合征卵巢黄体化的颗粒细胞中,MMP2和MMP9的表达量显著高于在正常卵泡中黄体颗粒细胞的表达量,同时,在人的多囊卵巢卵泡液中的MMP2和MMP9的表达量显著高于正常卵巢卵泡液中的表达量[52]。这些证据表明,MMP2和MMP9可能通过影响颗粒细胞的增殖和凋亡,进而在卵泡闭锁过程中起着重要的作用。
3 结语
在卵巢周期性变化中,由于蛋白水解和血管发生,导致ECM降解和重塑,卵泡发生了组织重塑。卵泡液和卵泡膜中含有大量的明胶蛋白、纤维蛋白和Ⅳ型胶原蛋白等蛋白,这些活性蛋白为卵泡膜细胞和颗粒细胞迁移、增殖和分化提供了必要条件。MMP2和MMP9作为水解ECM的关键酶类,能分解卵泡膜细胞和颗粒细胞及卵泡液中的明胶蛋白、纤维蛋白和Ⅳ型胶原蛋白等,参与卵泡腔的形成及扩张、排卵、黄体化及闭锁等过程,对维持卵巢的正常功能具有重要作用。若MMP2和MMP9表达异常,卵巢功能则发生变化,导致卵巢疾病发生,甚至致使卵巢功能发生障碍,如卵泡发育异常、排卵受阻、黄体不全、诱发卵巢癌等癌症发生等。目前针对MMP2和MMP9的表达模式研究甚多,关于多种因子和途径对MMP2和MMP9的精确调控机制仍需深入研究,这将有助于进一步了解MMP2和MMP9对卵巢疾病的发病机制,为相关疾病的诊断和治疗提供新方向。
[1]杨利国.动物繁殖新技术[M].北京:中国农业出版社,2009.YANG L G.New techniques for animal reproduction[M].Beijing:China Agriculture Press, 2009.
[2]RICHARDS J S, IRELAND J J, RAO M C, BERNATH G A, MIDGLEY A R, EREICHERT L.Ovarian follicular development in the rat:Hormone receptor regulation by estradiol, follicle stimulating hormone and luteinizing hormone[J].Endocrinology, 1976,99(6):1562-1570.doi: 10.1210/endo-99-6-1562.
[3]SWARNAKAR S, JANA S.Matrix Metalloproteinases[M].Springer International Publishing AG, 2018:3005-3013.doi: 10.1007/978-3-319-67199.
[4]LIJNEN H R.Matrix metalloproteinases and cellular fibrinolytic activity[J].Biochemistry(Moscow), 2002, 67(1): 92-98.doi:10.1023/a:1013908332232.
[5]STERNLICHT M D, WERB Z.How matrix metalloproteinases regulate cell behavior[J].Annual review of Cell and Developmental Biology,2001, 17(1): 463-516.doi: 10.1146/annurev.cellbio.17.1.463.
[6]PAGE-MCCAW A, EWALD A J, WERB Z.Matrix metalloproteinases and the regulation of tissue remodelling[J].Nature Reviews Molecular Cell Biology 2007, 8:221.doi: 10.1038/nrm2125.
[7]BERGMAN M R, CHENG S, HONBO N, PIACENTINI L, KARLINER J S, LOVETT D H.A functional activating protein 1(AP-1)site regulates matrix metalloproteinase 2(MMP-2)transcription by cardiac cells through interactions with JunB-Fra1 and JunB-FosB heterodimers[J].Biochemical Journal, 2003,369(3):485-496.doi: 10.1042/bj20020707.
[8]LIOTTA L A, ABE S, ROBEY P G, MARTIN G R.Preferential digestion of basement membrane collagen by an enzyme derived from a metastatic murine tumor[J].Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(5): 2268-2272.doi: 10.2307/69366.
[9]COLLIER I E, WILHELM S M, EISEN A Z, MARMER B L,GRANT G A, SELTZER J L, KRONBERGER A, HE C S, BAUER E A, GOLDBER G I.H-ras oncogene-transformed human bronchial epithelial cells(TBE-1)secrete a single metalloprotease capable of degrading basement membrane collagen[J].Journal of Biological Chemistry, 1988, 263(14): 6579-6587.
[10]OKADA Y, MORODOMI T, ENGHILD J J, SUZUKI K, YASUI A,NAKANISHI I, SALVESEN G, NAGASE H.Matrix metalloproteinase 2 from human rheumatoid synovial fibroblasts.Purification and activation of the precursor and enzymic properties[J].European Journal of Biochemistry, 1990, 194(3): 721-730.doi: 10.1111/j.1432-1033.1990.tb19462.x.
[11]CHAN B Y H, ROCZKOWSKY A, ILARRAZA R, RICHARD S.Matrix metalloproteinase-2//Encyclopedia of Signaling Molecules[M].Cham: Springer International Publishing, 2018, 2996-3005.doi:https://doi.org/10.1007/978-3-319-67199-4_101708.
[12]DAS S, MANDAL M, CHAKRABORTI T, MANDAL A,CHAKRABORTI S.Structure and evolutionary aspects of matrix metalloproteinases: A brief overview[J].Molecular and Cellular Biochemistry, 2003, 253(1-2): 31-40.doi: 10.1023/a:1026093016148.
[13]LINASK K K, MINGDA H, HONG C D, BRAUER P R, MAISASTRY S M.Cardiac morphogenesis: Matrix metalloproteinase coordination of cellular mechanisms underlying heart tube formation and directionality of looping[J].Developmental Dynamics, 2005, 233(3): 739-753.doi: 10.1002/dvdy.20377.
[14]KENNY H A, KAUR S, COUSSENS L M, LENGYEL E.The initial steps of ovarian cancer cell metastasis are mediated by MMP-2 cleavage of vitronectin and fibronectin[J].Journal of Clinical Investigation,2008, 118(4): 1367-1379.doi: 10.1172/JCI33775.
[15]HULBOY D L, RUDOLPH L A.MATRISIAN L M.Matrix metalloproteinases as mediators of reproductive function.[J].Molecular Human Reproduction, 1997(3):27-45.doi: 10.1093/molehr/3.1.27.
[16]IYER R P, PATTERSON N L, FIELDS G B, LINDSEY M L.The history of matrix metalloproteinases: Milestones, myths, and misperceptions[J].American Journal of Physiology.Heart and Circulatory Physiology, 2012, 303(8): H919-H930.doi: 10.1152/ajpheart.00577.2012.
[17]HADLEROLSEN E, FADNES B, SYLTE I, UHLIN-HANSEN L,WINBERG J O.Regulation of matrix metalloproteinase activity in health and disease[J].The Febs Journal, 2015, 278(1): 28-45.doi:10.1111/j.1742-4658.2010.07920.x.
[18]YABLUCHANSKIY A, MA Y, IYER R P, HALL M E, LINDSEY M L.Matrix metalloproteinase-9: Many shades of function in cardiovascular disease[J].Physiology(Bethesda), 2013, 28(6): 391-403.doi:10.1152/physiol.00029.2013.
[19]RODRÍGUEZ D, MORRISON C J, OVERALL C M J B.Matrix metalloproteinases: What do they not do? New substrates and biological roles identified by murine models and proteomics[J].Biochimica et Biophysica Acta(BBA)- Molecular Cell Research, 2010, 1803(1):39-54.doi: 10.1016/j.bbamcr.2009.09.015.
[20]BRUNI C A, JOHNSON L C, VESSELLA R L, PETERSON T E,LYNCH C C.Osteoclast-derived matrix metalloproteinase-9 directly affects angiogenesis in the prostate tumor-bone microenvironment[J].Molecular Cancer Research, 2010, 8(4): 459-470.doi:10.1158/1541-7786.MCR-09-0445.
[21]MONNIAUX D, PISSELET C, FONTAINE J.Uncoupling between proliferation and differentiation of ovine granulosa cells in vitro[J].Journal of Endocrinology, 1994, 142(3): 497-510.doi: 10.1677/joe.0.1420497.
[22]ASADZADEH R, KHOSRAVI S, ZAVAREH S, GHORBANIAN M T,PAYLAKHI S H, MOHEBBI S R.Vitrification affects the expression of matrix metalloproteinases and their tissue inhibitors of mouse ovarian tissue[J].International Journal of Reproductive Biomedicine(Yazd),2016, 14(3): 173-180.doi: 10.29252/ijrm.14.3.173.
[23]ZHU G, KANG L, WEI Q, CUI X, WANG S, CHEN Y, JIANG Y.Expression and regulation of MMP1, MMP3, and MMP9 in the chicken ovary in response to gonadotropins, sex hormones, and TGFB11[J].Biology of Reproduction, 2014, 90(3).doi: 10.1095/biolreprod.113.114249.
[24]SANG H K, KANG C W, MIN K S, YOON J T.Matrix metalloproteinases are important for follicular development in normal and miniature pigs[J].Biotechnology Letters, 2014, 36(6): 1187-1196.doi: 10.1007/s10529-014-1474-9.
[25]IMAI K, KHANDOKER M A M Y, YONAI M, TAKAHASHI T, SATO T,ITO A, HASEGAWA Y, HASHIZUME K.Matrix metalloproteinases-2 and -9 activities in bovine follicular fluid of different-sized follicles:Relationship to intra-follicular inhibin and steroid concentrations[J].Domestic Animal Endocrinology, 2003, 24(2): 171-183.doi:10.1016/s0739-7240(02)00235-7.
[26]PRADO A F, PERNOMIAN L, AZEVEDO A, COSTA RAP, RIZZI E,RAMOS J, PAES LEMEAF, BENDHACK LM, TANUS-SANTOS J E,GERLACH R F.Matrix metalloproteinase-2-induced epidermal growth factor receptor transactivation impairs redox balance in vascular smooth muscle cells and facilitates vascular contraction[J].Redox Biology,2018, 18: 181-190.doi: 10.1016/j.redox.2018.07.005.
[27]FUJIHARA M, YAMAMIZU K, COMIZZOLI P, WILDT D E,SONGSASEN N, AMBROSIO C E.Retinoic acid promotes in vitro follicle activation in the cat ovary by regulating expression of matrix metalloproteinase 9[J].Plos One, 2018, 13(8): e202759.doi:10.1371/journal.pone.0202759.
[28]RICHARDS J A S, ASCOLI M.Endocrine, paracrine, and autocrine signaling pathways that regulate ovulation[J].Trends in Endocrinology & Metabolism, 2018: S1602669040.doi: 10.1016/j.tem.2018.02.012.
[29]SCHOCHET S S.A suggestion as to the process of ovulation and ovarian cyst formation[J].The Anatomical Record, 1916, 10(6):447-457.doi: 10.1002/ar.1090100605.
[30]ROBKER R L, RUSSELL D L, ESPEY L L, LYDON J P, O'MALLEY B W, RICHARDS J S.Progesterone-regulated genes in the ovulation process: ADAMTS-1 and cathepsin L proteases[J].Proceedings of the National Academy of Sciences of the United States of America,2000, 97(9): 4689-4694.doi: 10.1073/pnas.080073497.
[31]NIKOLETTOS N, ASIMAKOPOULOS B, TENTES L, SCHOPPER B,AL-HASANI S.Matrix metalloproteinases 2 and 9 in follicular fluids of patients undergoing controlled ovarian stimulation for ICSI/ET[J].In Vivo, 2003, 17(2): 201.doi: 10.1089/104303403321467243.
[32]于晓光,张清媛,倪江,边淑玲,祝城.基质金属蛋白酶-2、-9在大鼠卵巢黄体中的作用[J].哈尔滨医科大学学报, 2000, 34(6):391-393.YU X G, ZHNNG Q Y, NI J, BIAN S L, ZHU C.The role of matrix metalloproteinases -2 and -9 in the corpus luteum of rat ovary[J].Journal of Harbin Medical University, 2000, 34(6):391-393.doi:10.3969/j.issn.1000-1905.2000.06.001.
[33]CURRY T E, SONG L, WHEELER S E.Cellular localization of gelatinases and tissue inhibitors of metalloproteinases during follicular growth, ovulation, and early luteal formation in the rat[J].Biology of Reproduction, 2001, 65(3): 855-865.doi: 10.1095/biolreprod65.3.855.
[34]GOTTSCH M L, VAN KIRK E A, MURDOCH W J.Role of matrix metalloproteinase 2 in the ovulatory folliculo-luteal transition of ewes[J].Reproduction, 2002, 124(3): 347.doi: 10.1530/rep.0.1240347.
[35]JR T E C, KOMAR C M, BURNS P D, NOTHNICK W B.Periovulatory changes in ovarian metalloproteinases and tissue inhibitors of metalloproteinases(TIMPS)following indomethacin treatment[M].New York: Ovulation.Springer, 2000.
[36]RIBEIRO L A, TURBA M E, BERNARDINI C, ZANNONI A, BACCI M L, FORNI M.Matrix Metalloproteinases -2 and -9 in swine luteal tissue angiogenesis and angioregression[J].Veterinary Research Communications, 2007, 31(1): 193-196.doi: 10.1007/s11259-007-0094-4.
[37]YOUNG K A, HENNEBOLD J D, STOUFFER R L J M.Dynamic expression of mRNAs and proteins for matrix metalloproteinases and their tissue inhibitors in the primate corpus luteum during the menstrual cycle[J].Molecular Human Reproduction, 2002, 8(9):833-840.doi: 10.1093/molehr/8.9.833.
[38]ENDO T, ATEN R F, WANG F, BEHRMAN H R.Coordinate induction and activation of metalloproteinase and ascorbate depletion in structural luteolysis[J].Endocrinology, 1993, 133(2): 690-698.doi: 10.1210/endo.133.2.8344207.
[39]KLIEM H, WELTER H, KRAETZL W D, STEFFL M, MEYER H H D,SCHAMA D, BERISHA B.Expression and localisation of extracellular matrix degrading proteases and their inhibitors during the oestrous cycle and after induced luteolysis in the bovine corpus luteum[J].Reproduction, 2007, 134(3): 535-547.doi: 10.1530/REP-06-0172.
[40]PAN H J, CUI H X, LIU S J, QIAN Y, WU H L, LI L, GUAN Y T,GUAN X, ZHANG L, FAN H Y, MA Y L, LI R S, LIU M Y, LI D L.Lgr4 gene regulates corpus luteum maturation through modulation of the WNT-mediated EGFR-ERK signaling pathway[J].Endocrinology,2014, 155(9): 3624.doi: 10.1210/en.2013-2183.
[41]YOUNG K A, STOUFFER R L.Gonadotropin and steroid regulation of matrix metalloproteinases and their endogenous tissue inhibitors in the developed corpus luteum of the rhesus monkey during the menstrual cycle[J].Biology of Reproduction, 2004, 70(1): 244-252.doi:10.1095/biolreprod.103.022053.
[42]STAMOULI A, O'SULLIVAN M J, FRANKEL S, THOMAS E J, RICHARDSON M C.Suppression of matrix metalloproteinase production by hCG in cultures of human luteinized granulosa cells as a model for gonadotrophin-induced luteal rescue[J].Reproduction,1996, 107(2):235-239.doi: 10.1530/jrf.0.1070235
[43]WEBB R, GOSDEN R G, TELFER E E, MOOR R.Factors affecting folliculogenesis in ruminants[J].Animal Science, 1999, 68(2): 257-284.doi: 10.1017/s1357729800050293.
[44]FUJIHARA M, YAMAMIZU K, WILDT D E, SONGSASEN N.Expression pattern of matrix metalloproteinases changes during folliculogenesis in the cat ovary[J].Reproduction in Domestic Animal, 2016, 51(5): 717-725.doi: 10.1111/rda.12736.
[45]GOLDMAN S, SHALEV E.MMPS and TIMPS in ovarian physiology and pathophysiology[J].Frontiers in Bioscience, 2004, 9(1-3):2474.doi: 10.2741/1409.
[46]IMAI K, KHANDOKER M A M Y, YONAI M, TAKAHASHI T, SATO T,ITO A, HASEGAWA Y, HASHIZUME K.Matrix metalloproteinases-2 and -9 activities in bovine follicular fluid of different-sized follicles:Relationship to intra-follicular inhibin and steroid concentrations[J].Domestic Animal Endocrinology, 2003, 24(2): 171-183.doi:10.1016/s0739-7240(02)00235-7.
[47]FUJIHARA M, YAMAMIZU K, COMIZZOLI P, WILDT D E,SONGSASEN N, AMBRóSIO C E.Retinoic acid promotes in vitro follicle activation in the cat ovary by regulating expression of matrix metalloproteinase 9[J].Plos One, 2018, 13(8): e202759.doi:10.1371/journal.pone.0202759.
[48]GARCÍA R, BALLESTEROS L M, HERNÁNDEZ-PÉREZ O,ROSALES A M, ESPINOSA R, SOTO H, DIZA DE LEóN L, ROSADO A.Metalloproteinase activity during growth, maturation and atresia in the ovarian follicles of the goat[J].Animal Reproduction Science,1997, 47(3): 211-228.doi: 10.1016/S0378-4320(96)01637-5.
[49]KHANDOKER M A, IMAI K, TAKAHASHI T, HASHIZUME K.Role of gelatinase on follicular atresia in the bovine ovary[J].Biology of Reproduction, 2001, 65(3): 726-732.doi: 10.1095/biolreprod65.3.726.
[50]LI J, SHEN T, WU G, WEI Q, MAO D, SHI F.Potential roles of matrix metalloproteinases and characteristics of ovarian development in neonatal guinea pigs[J].Tissue Cell, 2015, 47(5): 478-488.doi:10.1016/j.tice.2015.07.005.
[51]HASSANI F, ORYAN S, EFTEKHARI-YAZDI P, BAZRGAR M,MOINI A, NASIRI N, SHARIFI-ZARCHI A.Downregulation of extracellular matrix and cell adhesion molecules in cumulus cells of infertile polycystic ovary syndrome women with and without insulin resistance[J].Cell Journal, 2019, 21(1): 35-42.doi: 10.22074/cellj.2019.5576.
[52]DAMBALA K, VAVILIS D, BILI E, GOULIS D G, TARLATZIS B C.Serum visfatin, vascular endothelial growth factor and matrix metalloproteinase-9 in women with polycystic ovary syndrome[J].Gynecological Endocrinology, 2017, 33(7): 529-533.doi:10.1080/09513590.2017.1296425.