【研究意义】菜心(Brassica campestris L.ssp. chinensis var. utilis Tsenet Lee)是芸薹科芸薹属中以菜薹为产品的一种蔬菜,是华南地区栽培规模最大的特产蔬菜之一,在华南地区的蔬菜周年供应及出口创汇中起着举足轻重的作用[1]。菜心具有明显的杂种优势,目前通过连续自交选育自交系及杂种亲本的传统育种方法存在自交系纯合速度慢、整齐度差、育种周期长等诸多缺陷,且亲本长时间单株选择会造成近交衰退[2]。小孢子培养技术利用未成熟的雄性配子体在离体培养中受到胁迫处理后,其发育命运由花粉向胚胎发育转变,诱导小孢子胚胎发生并发育为成熟植株,加倍后形成纯合的双单倍体(Double haploid,DH),1~2年内即可获得大量基因型丰富且遗传稳定材料,在提高选择效率和准确度的前提下,可快速选育纯系、缩短育种周期,已在作物遗传育种中广泛应用[3]。【前人研究进展】自Lichter于1982年首次从油菜小孢子培养中获得小孢子植株后,Sato报道了通过机械挤压分离白菜小孢子,热激培养获得胚状体体系,此后白菜类的小孢子培养研究进展迅速,并在生产上得到推广应用[4-9]。朱允华等[10]对影响菜心游离小孢子培养诱导胚状体的主要因素研究表明,基因型对小孢子培养出胚率起决定性作用,花序低温预处理、高温起始培养和培养基成分均影响菜心游离小孢子胚状体的诱导。曾小玲等[11]以11个不同基因型的菜心栽培品种为试材,研究不同培养条件对菜心游离小孢子胚诱导和植株再生的影响,结果有7个基因型材料获得小孢子胚,不同基因型诱导成胚的频率存在显著差异,表明基因型是影响菜心小孢子胚发生的主要因素;小孢子第1天热激培养用170 g/L高浓度蔗糖培养基培养后转换成含130 g/L蔗糖培养基能显著提高小孢子胚诱导率;激素配比6-BA 0.05 mg/L+NAA 0.2 mg/L能促进菜心小孢子诱导成胚。牛刘静等[12-13]以增城菜心和连州菜心为试材进行小孢子培养,研究了不同基因型、细胞器抗氧化剂处理(VcNa)和植物生长调节剂(BR和TDZ)对小孢子胚胎发生及胚状体再生成苗的影响,结果显示培养基中适当浓度的植物生长调节剂可显著提高小孢子胚的诱导率。与甘蓝型油菜小孢子培养模式相似,菜心的小孢子培养同样受基因型、供体材料生理状态、培养基成分、热激处理条件等因素影响。【本研究切入点】尽管作物育种中诱导单倍体已被广泛应用,但其主要瓶颈是单倍体胚胎诱导缺乏或效率低下,形成单倍体胚胎的能力高度依赖于物种和基因型。不同物种的小孢子胚胎发生有其自身规律,且受供试植株生长环境、培养基成分及胁迫处理等多方面因素影响,在为特定作物或基因型建立有效培养系统前,需要克服一个或多个瓶颈。目前,在广东高温高湿的自然气候条件下,露天种植环境下的菜心材料处于特定的生理状态,菜心小孢子诱导率极低,培养方案需要根据具体情况开发或微调。【拟解决的关键问题】本研究通过调整菜心小孢子培养诱导培养基配方,针对广东高温高湿的气候环境,对秋冬季露天大田种植的不同基因型菜心材料进行小孢子培养,筛选具有稳定性、广适性、出胚效率高的培养基配方,以期为实现菜心育种亲本的高效率选择和快速纯化。
1 材料与方法
1.1 试验材料
以广东省农业科学院蔬菜研究所叶菜豆类研究室提供的10份菜心为试材,材料名称及类型见表1。2019年11月中旬在广州市白云区试验基地大棚内,穴盘播种育苗,三叶一心后移栽到大田,田间常规栽培管理;2019年12月中下旬至1月中旬花期取样进行小孢子培养。
表1 供试材料基本情况
Table 1 Basic information of test materials
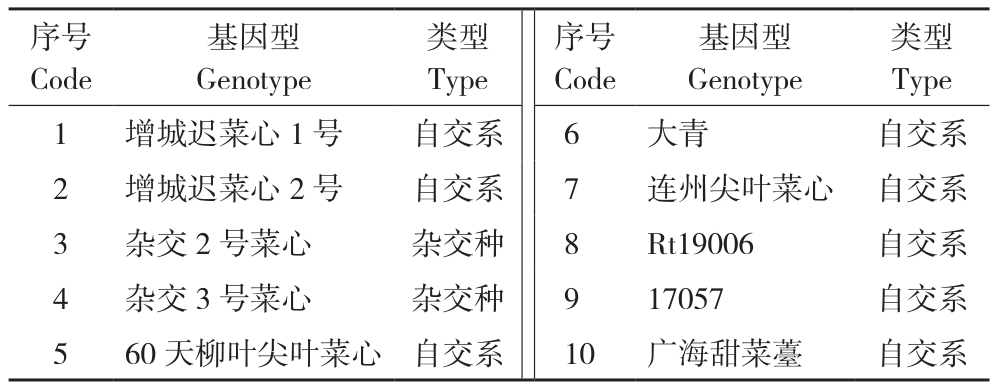
序号Code类型Type 1 增城迟菜心1号 自交系 6 大青 自交系2 增城迟菜心2号 自交系 7 连州尖叶菜心 自交系3 杂交2号菜心 杂交种 8 Rt19006 自交系4 杂交3号菜心 杂交种 9 17057 自交系5 60天柳叶尖叶菜心 自交系 10 广海甜菜薹 自交系基因型Genotype类型Type序号Code基因型Genotype
1.2 试验方法
1.2.1 菜心小孢子培养方法 参照Takahashi等[14]方法对菜心游离小孢子培养方法进行改进。于晴天上午,取处于初花和盛花期生长健壮的菜心植株的主花序带回实验室,4℃低温处理24 h。挑取小孢子发育处于单核靠边期的花蕾,用84消毒液灭菌15 min后用无菌水冲洗3次,置于50 mL无菌离心管中,加入少量蔗糖浓度130 g/L的B5培养液,用玻璃棒研碎花蕾,经直径74.2 μm双层尼龙网过滤,1 100 r/min离心5 min,沉淀小孢子,弃上清液,加入B5重悬,再离心,弃上清,用NLN培养液悬浮小孢子,分装在直径90 mm无菌培养皿中(10个花蕾/皿,NLN培养液 22 mL),Parafilm膜封口,每个处理10皿,3次重复。32℃黑暗培养48 h后,25℃黑暗培养10~15 d,待肉眼可见胚形成。培养皿转移到25℃摇床50 r/min黑暗培养至成熟子叶胚(培养约23 d),统计小孢子出胚数,计算出胚率。转入B5固体培养基培养,置于25℃、光强3 000 lx、光照14 h/d条件下培养。
1.2.2 培养基成分对菜心小孢子出胚率的影响设定100、130和160 g/L蔗糖浓度的NLN培养液和营养元素减半、100 g/L蔗糖浓度NLN培养液,简称为 NLN-10、NLN-13、NLN-16和1/2 NLN-10。分别观察记录不同培养液下小孢子的发育状态及出胚情况。
1.2.3 6-BA和NAA对菜心小孢子胚诱导的影响 以NLN-10为培养基,选取6-BA(6-苄氨基腺嘌呤)和NAA(萘乙酸)为培养基添加激素,6-BA浓度分别为0、0.1、0.2 mg/L,NAA浓度分别为0、0.01、0.1、0.15、0.2 mg/L,设计试验组合,共6个处理,分离试验材料杂交2号菜心、杂交3号菜心、连州尖叶菜心和Rt19006的小孢子,加入不同激素配比的培养基中,每个处理30皿,32℃热激48 h后25℃暗培养,23 d后统计子叶胚数量。
试验数据采用Excel 2013 软件进行统计分析。
2 结果与分析
2.1 不同基因型在不同培养基中菜心小孢子胚胎诱导率的差异比较
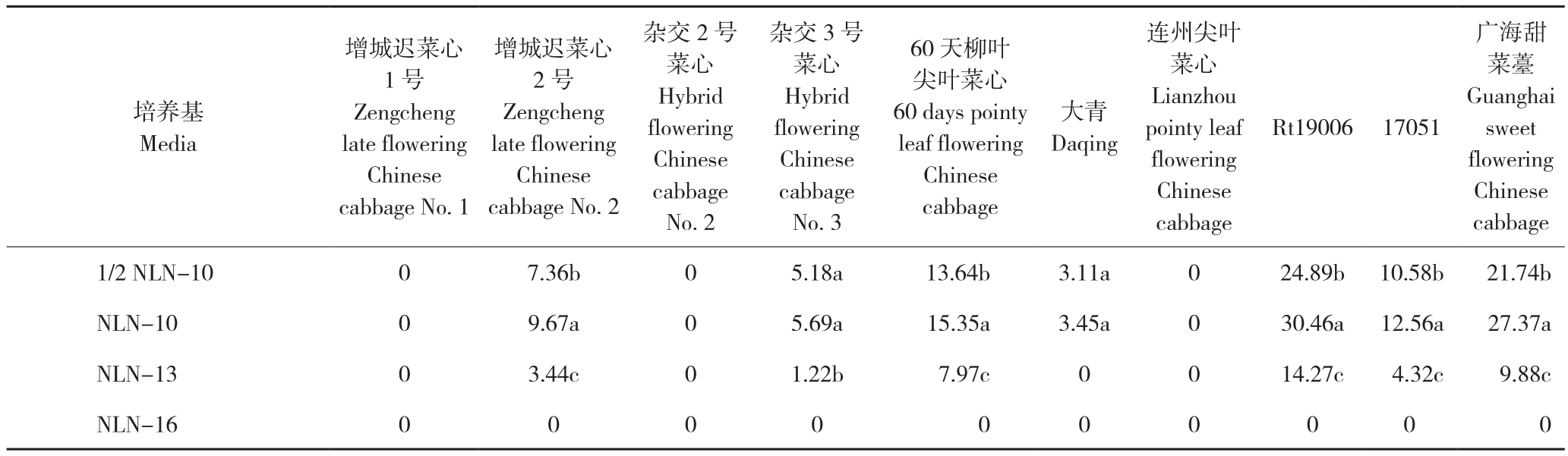
从表2可以看出,不同基因型的菜心胚状体诱导率存在较大差异。在用于游离小孢子培养的10份不同基因型菜心材料中,有7份材料成功产生胚状体,为增城迟菜心2号、杂交3号菜心、60天柳叶尖叶菜心、大青、Rt19006、17057、广海甜菜薹。7份材料的胚状体诱导率相差较大,NLN-10处理最易出胚的 Rt19006菜心胚状体诱导率可达30.36胚/皿,出胚率最低的大青仅为3.45胚/皿,相差近10倍。而增城迟菜心1号、杂交2号菜心、连州尖叶菜心均未产生胚状体。可见,基因型对胚状体诱导率有决定性作用。
2.2 不同蔗糖浓度对菜心胚状体发生的影响
蔗糖在小孢子离体培养中提供营养和维持细胞渗透压。由表2可知,除增城迟菜心1号、杂交2号菜心、连州尖叶菜心3个材料没有出胚外,100 g/L蔗糖浓度的NLN(NLN-10)诱导率最高、达30.46胚/皿,且这一规律在7个出胚材料中表现一致;在 1/2 NLN-10处理中,出胚率约为使用诱导培养基NLN-10处理的2/3,但胚状体的生长速度明显快于NLN-10组;蔗糖浓度为130 g/LNLN(NLN-13)处理出胚率显著降低,最高仅为14胚/皿,且该规律在7份出胚材料中表现一致;蔗糖浓度为160 g/L的NLN(NLN-16)处理未出现胚状体。由此表明,蔗糖浓度为100 g/L和130 g/L(NLN-13)的NLN能够诱导出胚状体,但100 g/L NLN(NLN-10)蔗糖浓度最适于菜心小孢子的胚胎发生。
表2 不同基因型和培养基对菜心小孢子出胚率的影响(个/皿)
Table 2 Effects of different genotypes and media on embryo production rates of microspore in Chinese flowering cabbages (embryo/dish)
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
增城迟菜心1号Zengcheng late flowering Chinese cabbage No. 1培养基Media增城迟菜心2号Zengcheng late flowering Chinese cabbage No. 2杂交2号菜心Hybrid flowering Chinese cabbage No. 2杂交3号菜心Hybrid flowering Chinese cabbage No. 3 60 天柳叶尖叶菜心60 days pointy leaf flowering Chinese cabbage大青Daqing连州尖叶菜心Lianzhou pointy leaf flowering Chinese cabbage Rt19006 17051广海甜菜薹Guanghai sweet flowering Chinese cabbage 1/2 NLN-10 0 7.36b 0 5.18a 13.64b 3.11a 0 24.89b 10.58b 21.74b NLN-10 0 9.67a 0 5.69a 15.35a 3.45a 0 30.46a 12.56a 27.37a NLN-13 0 3.44c 0 1.22b 7.97c 0 0 14.27c 4.32c 9.88c NLN-16 0 0 0 0 0 0 0 0 0 0
2.3 不同激素配比对菜心胚状体发生的影响
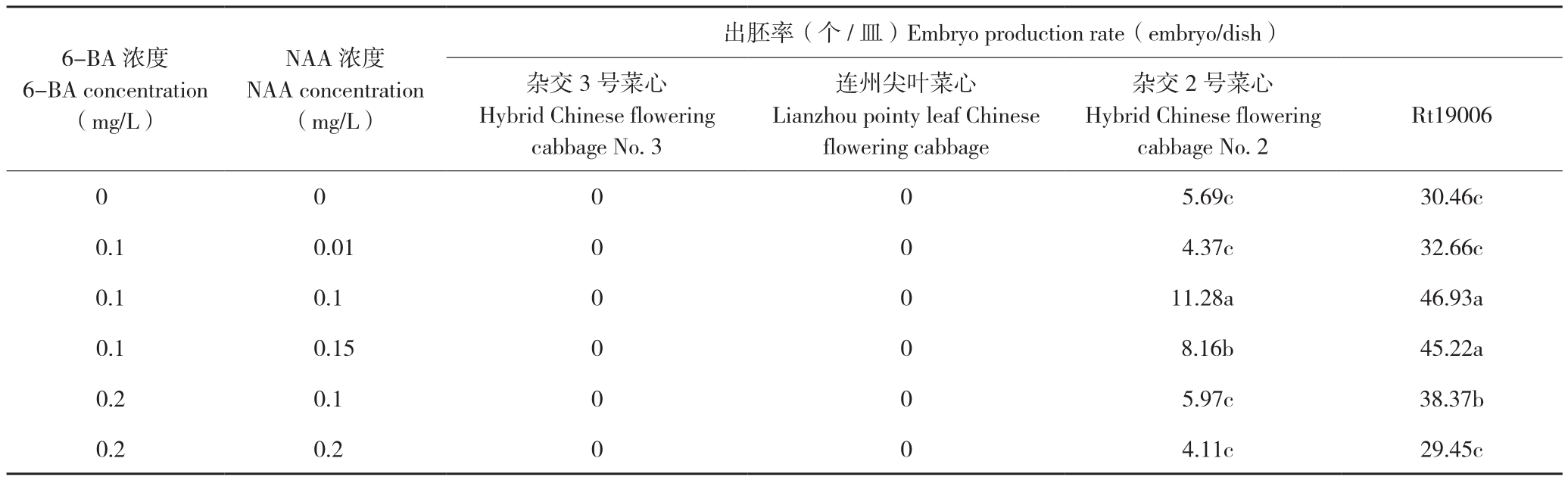
由表3可知,6组激素组合中,添加6-BA 0.1 mg/L+NAA 0.1 mg/L的处理出胚效果最佳,杂交2号菜心和Rt19006出胚率分别达11.28、46.93胚/皿,是不加激素出胚率的1.98、1.54倍,而对不加激素处理中没有出胚的材料杂交3号菜心、连州尖叶菜心的出胚没有促进作用;随着激素浓度升高,出胚率中等的材料杂交2号菜心和出胚率相对高的材料Rt19006胚胎发生能力均有所下降。可见,一定浓度激素有促进小孢子胚胎发生的作用,且对出胚相对率低材料的促进作用高于出胚率高的;激素不能促使基因型顽固的材料出胚。
2.4 菜心小孢子离体培养形成再生植株的过程
游离小孢子经释放离体培养发育成子叶胚(图1A)平均需要23~26 d。子叶胚接种至分化培养基(B5+6-BA 0.2 mg/L+NAA 0.02 mg/L +琼脂13 g/L),置于光照培养室培养。成熟的子叶胚接种见光起开始逐渐转绿,且生长迅速;幼嫩的子叶胚接种后光照条件下一周才开始转绿,且生长缓慢(图1B);而肉眼可见的球形胚接种到分化培养基后,个体变大,但不能转绿,逐渐白化、褐化至死亡。子叶胚分化出侧芽后,侧芽接种到生根培养基(MS+ 6-BA 0.02 mg/L+ NAA 0.2 mg/L + 琼脂12 g/L),7~15 d开始生根(图1C),发育成一棵完整的再生植株(图1C)。图1为菜心游离小孢子培养从诱导出胚状体到形成再生植株过程。据统计,成熟子叶胚接种至分化培养基后,最终能形成再生植株的比例为92.1%~98.3%,而球形胚最终能发育成再生植株的平均比例为0.34%,绝大部分球形胚从肉眼可见到直径2~3 mm后停止发育。
表3 不同激素配比对菜心小孢子胚诱导率的影响
Table 3 Effects of different hormone combinations on embryo induction rates of microspore in Chinese flowering cabbages
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
6-BA 浓度6-BA concentration(mg/L)NAA 浓度NAA concentration(mg/L)出胚率(个/皿)Embryo production rate(embryo/dish)杂交3号菜心Hybrid Chinese flowering cabbage No. 3连州尖叶菜心Lianzhou pointy leaf Chinese flowering cabbage杂交2号菜心Hybrid Chinese flowering cabbage No. 2 Rt19006 0 0 0 0 5.69c 30.46c 0.1 0.01 0 0 4.37c 32.66c 0.1 0.1 0 0 11.28a 46.93a 0.1 0.15 0 0 8.16b 45.22a 0.2 0.1 0 0 5.97c 38.37b 0.2 0.2 0 0 4.11c 29.45c

图1 小孢子培养中植株再生过程
Fig. 1 Plant regeneration during microspore culture
A:小孢子胚;B:子叶胚培养;
C:植株生根培养;D:胚状体分化成植株
A: Embryos regenerated from microspore; B: Embryogenic culture;
C: Rooting culture: D: Embryo regeneration
3 讨论
本研究将10份菜心进行小孢子离体培养,在相同条件下,70%材料成功诱导出子叶胚,而出胚率敏感型材料是不敏感材料的10倍。胚状体的诱导能力与基因型密切相关,不同菜心品种小孢子培养产胚率存在明显差异,这与前人研究结果[15-16]一致。
NLN培养基是芸薹种作物小孢子培养常用配方,也有使用1/2NLN的报道,研究表明,1/2 NLN比全营养的NLN对白菜小孢子胚的诱导效果更好[17-18]。高浓度蔗糖调节细胞渗透压和提供能源,100~130 g/L蔗糖浓度的NLN是白菜类蔬菜小孢子培养常用培养基,也有使用150 g/L的报道,但是培养后期需要换到较低浓度的蔗糖培养基[19]。在现有研究报道中,大白菜中多采用130 g/L 的NLN(NLN-13),而在小白菜中,采用100 g/L NLN(NLN-10)或者1/2 NLN的都有报道,部分报道100 g/L的1/2NLN(1/2 NLN-10)的培养效果更佳。本试验中质量浓度100 g/L的蔗糖培养基NLN-10,相较于NLN-13、NLN-16,显著提高菜心小孢子产胚的数量。其原因是适当的渗透压可以使花粉小孢子冲破花粉外壳,并启动胚胎发育,130 g/L蔗糖相较于100 g/L蔗糖浓度高,也会启动细胞分裂,但会阻碍细胞进一步发育,在显微镜下可以看见后期细胞大部分出现空泡化而凋亡,因此100 g/L蔗糖更适合。而1/2 NLN-10培养基处理小孢子胚诱导率低于NLN-10处理,但胚胎生长速度快,推测由于该培养基中营养元素减半,胁迫胚胎迅速发育,以完成生命周期的竞争,造成生长速度不同。
诱导培养基中添加外源激素在白菜类叶用蔬菜游离小孢子培养中有较多应用,对胚胎发生的影响尚未取得一致的研究结果。Sato等[20]认为NAA和6-BA对大白菜小孢子胚诱导无影响,曾小玲等[11]研究了NAA和6-BA的不同浓度配比对菜心胚诱导的影响,结果表明最适宜诱导菜心小孢子胚胎发生的激素浓度是0.05 mg/L 6-BA 和0.2 mg/L NAA。唐兵等[19]以20个不同基因型白菜栽培品种为供试材料,研究影响白菜游离小孢子胚诱导的因素,结果表明白菜小孢子胚胎诱导的激素最优组合为6-BA 0.1 mg/L+NAA 0.5 mg/L。在本研究中,不同激素组合和浓度对不同基因型小孢子出胚数的影响有显著差异,在NLN-10诱导培养基中添加0.1 mg/L 6-BA和0.1 mg/L NAA能极显著提高小孢子子叶胚的数量;当6-BA、NAA浓度上升至0.2 mg/L时,发育成子叶胚的数量下降,畸形胚数量增加,球形胚数量显著增加,但绝大多数球形胚发育停滞,随着培养时间的延长,小孢子胚逐渐褐化。植物胚胎从受精开始,激素就开始合成并在胚胎发育建成中起到重要作用,并且生长素类激素在早期发育中随着细胞数的增加导致浓度开始上升[21],说明激素在胚胎形成中不可或缺;在本研究中,添加适量外源激素的处理小孢子出胚率显著上升,说明离体培养的菜心小孢子胚在早期发育过程中自身激素合成缺乏,未能支持胚胎细胞持续发育,而添加外源激素处理与不加激素组对照相比,前者获得更多数量的胚,说明在菜心小孢子培养中添加适量激素对胚胎发育具有促进作用。而激素浓度提高到一定程度后,反而会对细胞造成毒害,使胚胎发育停滞。
4 结论
通过采用不同蔗糖浓度和激素配比的诱导培养基对不同基因型菜心进行小孢子离体培养的胚胎诱导率综合分析发现,遗传背景对小孢子的胚胎发生能力起决定性作用,7份材料获得胚状体,各材料间出胚率存在显著差异,其中Rt19006胚产率最高;而改良培养基成分可以提高胚胎发生率,不同蔗糖浓度的NLN诱导率差异显著,NLN-10诱导效果最佳,出胚率最高达30.46胚/皿。随着蔗糖浓度的升高,出胚率显著下降,NLN-13处理出胚率最高仅为14.27胚/皿,NLN-16处理出胚受到抑制,未出现胚状体;在NLN-10中分别添加6-BA 0.1 mg/L和NAA 0.1 mg/L,能显著提高出胚率,最高达46.93胚/皿,是不加激素NLN-10处理出胚率的1.5倍。但该激素组合对难出胚的试验材料无促进出胚作用;当6-BA和NAA浓度均达到0.2 mg/L时,胚胎生长发育受到抑制。
[1] 张艳,陈汉才,李桂花,黎庭耀.菜心Hau CMS雄性不育系的转育研究[J]. 广东农业科学,2016,43(1):30-33. doi:10.16768/j.issn.1004-874X.2016.01.006.ZHANG Y, CHEN H C, LI G H,LI T Y.Trans-breeding Hau cytoplasmic male sterile line in Chinese flowering cabbage[J].Guangdong Agricultural Sciences, 2016,43(1):30-33. doi:10.16768/j.issn.1004-874X.2016.01.006.
[2] 李光光,张华,黄红弟,乔燕春,郑岩松.广东省菜薹(菜心)育种研究进展[J]. 中国蔬菜,2011(20):9-14.LI G G,ZHANG H,HUANG H D,QIAO Y C,ZHENG Y S.Research progress on flowering Chinese cabbage breeding in Guangdong province[J]. China Vegetables,2011(20):9-14.
[3] 陈海强,刘会云,王轲,张双喜,叶兴国.植物单倍体诱导技术发展与创新[J]. 遗传,2020,42(5): 466-482. doi:10.16288/j.yczz.20-033.CHEN H Q, LIU H Y, WANG K,ZHANG S X, YE X G.Development and innovation of haploid induction technologies in plants[J].Hereditas,2020,42(5):466-482. doi:10.16288/j.yczz.20-033.
[4] 董晓颖,程斐,李培环,刘维信.白菜小孢子培养中不同因素对玻璃化及褐变形成的影响[J]. 北方园艺,2016(8):85-89. doi:10.11937/bfyy.201608024.DONG X Y, CHENG F, LI P H, LIU W X. Effect of different factors on the formation of vitrification and browning in the anther culture of Chinese cabbage[J]. Northern Horticulture, 2016(8):85-89.doi:10.11937/bfyy.201608024.
[5] 崔群香,王倩,李英,侯喜林.不结球白菜小孢子胚胎发生过程及发育途径研究[J]. 南京农业大学学报,2012,35(2):21-26.CUI Q X, WANG Q, LI Y, HOU X L.Studies on microspore-derived embryogenesis and developmental pathway in nonheading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2012,35(2):21-26.
[6] 贾俊香.基于小孢子培养的白菜类蔬菜种质创新[D]. 沈阳:沈阳农业大学,2019. doi:27327/d.cnki.gshnu.2019.000077.JIA J X.Reation of the germplasm in Brassica rapa via microspore culture[D]. Shenyang: Shenyang Agricultural and Biotechnology,2019. doi:27327/d.cnki.gshnu.2019.000077.
[7] 付丹丹.抗根肿病大白菜小孢子培养技术体系研究[D]. 杨凌:西北农林科技大学,2019.FU D D. Study on microspore culture technology system of clubrootresistant Chinese cabbage[D]. Yangling: Northwest A & F University,2019.
[8] 栗根义,高睦枪,耿建峰,原玉香,张晓伟,蒋武生,韩永平.春秋适应型大白菜新品种豫白菜11号的选育[J]. 河南农业科学,1999(3):25-27. doi:10.15933/j.cnki.1004-3268.1999.03.011.LI G Y, GAO M Q,GENG J F, YUAN Y X,ZHANG X W,JIANG W S,HAN Y P. Breeding of a new Chinese cabbage variety Yubaicai 11 with spring and autumn adaptation[J]. Henan Agricultural Sciences,1999(3):25-27. doi:10.15933/j.cnki.1004-3268.1999.03.011.
[9] 栗根义,高睦枪,杨建平,徐小利,史宣杰,蒋武生,张晓伟,耿建峰,龙云铭.利用游离小孢子培养技术育成豫白菜7号(豫园1号)[J].中国蔬菜,1998(4):18-21.LI G Y, GAO M Q, YANG J P, XU X L,SHI X J, JIANG W S, ZAHNG X W, GENH J F, LONG Y M.Breeding of a new Chinese cabbage Yubaicai 7 via microspore culture[J]. China Vegetables, 1998(4):18-21.
[10] 朱允华.菜心花药和花粉培养诱导胚状体的研究[D]. 长沙:湖南农业大学,2003.ZHU Y H. Study on embryoid induction of Brassica parachinensis Bailey anther and pollen culture[D]. Changsha: Hunan Agricultural University, 2003.
[11] 曾小玲,方淑桂,朱朝辉,钟开勤.不同基因型菜心游离小孢子培养和植株再生[J]. 热带作物学报,2014,35(12):2397-2402.doi:10.3969/j.issn.1000-2561.2014.12.014.ZENG X L, FANG S G, ZHU C H, ZHONG K Q. Isolated microspore culture and plant regeneration in flowering Chinese cabbage[J].Chinese Journal of Tropical Crops, 2014,35(12):2397-2402.doi:10.3969/j.issn.1000-2561.2014.12.014.
[12] 牛刘静,石凤岩,马钰莹,杨旸,冯辉,章云.连州菜心小孢子培养体系的建立[J]. 沈阳农业大学学报,2019,50(1):28-33. doi:10.3969/j.issn.1000-2561.2014.12.014.NIU L J, SHI F Y, MA Y Y, YANG Y, FENG H, ZHANG Y. Establishment of microspore culture system in Lianzhou flowering Chinese cabbage(Brassica campestris L. ssp.Chinensis var. utilis Tsen et Lee.)[J]. Journal of Shenyang Aricultural University,2019,50(1):28-33.doi 10.3969/j.issn.1000-2561.2014.12.014.
[13] 牛刘静.增城菜心和连州菜心小孢子培养体系的建立[D]. 沈阳:沈阳农业大学,2018. doi:10.3969/j.issn.1000-1700.2019.01.004.NIU L J. Establishment of the systems for microspore culture in Zengcheng flowering Chinese cabbage and Lianzhou flowering Chinese cabbage(Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee)[D]. Shenyang: Shenyang Aricultural University, 2018.doi:10.3969/j.issn.1000-1700.2019.01.004.
[14] TAKAHATA Y, TAKAHASHI Y, TSUWAMOTO R. Microspore culture and doubled haploid technology. In: Gupta SK(ed)Biotechnology of Crucifers[M]. Springer New York, New York, NY, 2013:45-62.
[15] 朱允华,刘明月,吴朝林.影响菜心游离小孢子培养的因素[J]. 长江蔬菜,2003(9):46-47. doi:10.16423/j.cnki.1003-8701.2014.05.020.ZHU Y H, LIU M Y, WU C L.Factors to affect isolated microspore culture im Brassica Parachinensis Bailey[J]. Journal of Changjaing Vegetables, 2003(9):46-47. doi:10.16423/j.cnki.1003-8701.2014.05.020.
[16] 陈晓峰,张明培,徐榕雪,隋好林.影响大白菜游离小孢子培养胚胎发生因素的研究[J]. 吉林农业科学,2014,39(5):76-79.doi:10.16423/j.cnki.1003-8701.2014.05.020.CHEN X F, ZAHNG M P, XU R X, SUI H L. Studies on factors influencing embryogenesis of isolated microspores of Chinese cabbage[J]. Jilin Agricultural Sciences, 2014,39(5):76-79. doi:10.16423/j.cnki.1003-8701.2014.05.020.
[17] TAKAHASHI Y,YOKOI S, TAKAHATA Y. Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies of Brassica rapa L[J]. Plant Biotechnol Reports, 2012,6(4): 297-304. doi:10.1007//s11816-012-0224-5.
[18] WANG T T, LI H X, ZAHNG J H, OUYANG B, LU Y G, YE Z B.Initiation and development of microspore embryogenesis in recalcitrant purple flowering stalk(Brassica campestris ssp. chinensis var.purpurea Hort.)genotypes[J]. Scientia Horticulture, 2009,121(4):419-424. doi:10.1016/j.scienta.2009.03.012.
[19] 唐兵,陶莲,卢松,杨静,吴康云,张丽,邓英.白菜游离小孢子培养高频胚诱导技术体系优化[J]. 热带作物学报,2017,38(10):1913-1920. doi:10.3969/j.issn.1000-2561.2017.10.023.TANG B, TAO L, LU S, YANG J, WU K Y, ZHANG L, DENG Y. Optimization of high frequency embryo induction system for isolated microspore culture in Chinese cabbage[J]. Chinese Journal of Tropical Crops, 2017,38(10):1913-1920. doi:10.3969/j.issn.1000-2561.2017.10.023.
[20] TAKANORI S, TAKESHI N, MASASHI H. Plant regeneration from isolated microspore cultures of Chinese cabbage(Brassica campestris spp. pekinensis)[J]. Plant Cell Reports, 1989,8:486-488.
[20] LIAO C Y, SMET W, BRUNOUD G, YOSHIDA S, VERNOUX T,WEIJERS D. Reporters for sensitive and quantitative measurement of auxin response[J]. Nature Methods, 2015 ,12(3):207-10.doi:10.1038/nmeth.3279.