【研究意义】母猪初情期是指母猪第一次发情并排卵的过程,是母猪性成熟和获得繁殖能力的标志[1]。在养猪生产中,须挑选优质后备母猪更新母猪群、补充生产。初情期越早,母猪就能越早进行配种和进入繁殖服役年限,且表现出更高的繁殖性能[2-3]。虽然母猪初情期日龄是中等遗传力的重要经济性状,其遗传改良必将提高猪场的经济效益,但其启动的机制仍不清楚。本研究拟筛选影响母猪初情期启动的候选基因,为母猪初情期日龄的遗传改良提供参考。【前人研究进展】母猪初情期的启动是在性腺轴(下丘脑-垂体-卵巢)的调控下完成的,即母猪第一次卵泡成熟时,由下丘脑分泌促性腺激素释放激素刺激垂体分泌卵泡刺激素和促黄体素,卵巢在促性腺激素的作用下分泌睾酮、雌激素和孕激素,成熟卵泡进行排卵,进而启动母猪的第一次发情并达到性成熟[4]。学者已尝试通过多种方法筛选和鉴定影响母猪初情启动的重要候选基因,例如Yang等[5]和Holl等[6]利用微卫星技术初步鉴定了影响母猪初情期日龄的候选数量性状基因座,李平华等[7]通过对白色杜洛克×二花脸杂交的F2代群体的母猪进行全基因组关联分析,初步筛选了LIN28B、TMEM38B、RAB23等影响初情期日龄的重要候选基因。【本研究切入点】当前已有一些研究筛选和鉴定了许多影响母猪初情期日龄的基因,但已有的候选基因不足以解析母猪初情期启动的机制以及改良母猪的初情期日龄。【拟解决的关键问题】以杜洛克猪群体为研究对象,利用商业芯片和混合线性模型进行全基因组关联分析,筛选影响母猪初情期日龄的潜在分子标记和候选基因,不仅为进一步解析母猪的初情期启动机制提供一定水平的理论依据,还能为母猪初情期启动日龄的遗传改良提供参考。
1 材料与方法
1.1 试验材料
本试验收集了福建某国家核心种猪场共571头杜洛克母猪的初情日龄、出生日期、产仔数和窝重等生产记录。试验个体健康,发育状况良好,均采用半开放式栏舍饲养。所有猪只的日粮营养水平一致,自由饮水。
1.2 初情期日龄测定及方法
挑选该场160日龄左右杜洛克母猪进行查情,每天9∶00和16∶00各观察1次。根据母猪阴门检查及压背后的静立反应来判断母猪发情状况[8],记录初情期日龄。
1.3 基因组DNA提取及全基因组芯片分型
采集杜洛克母猪耳组织,使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit(Version 4.0)进行基因组DNA抽提,并用琼脂糖凝胶电泳进行检测,采用NanoDrop 2000进行质量评估。合格的基因组DNA利用Illumina PorcineSNP60 BeadChip或GeneSeek GGP-Porcine Chip进行全基因组芯片分型。两款芯片所包含的SNP位点不同,共有的SNP位点被保留,并使用BEAGLE软件[9]对缺失位点进行填充。使用PLINK软件[10]对SNP位点进行质量评估,剔除检出率<90%、次等位基因频率<1%以及显著偏离哈迪-温伯格平衡的位点,得到30 281个SNP位点用于后续研究。
1.4 全基因组关联分析
本研究使用GEMMA软件[11]构建混合线性模型进行GWAS分析,模型如下:
式中,Y为每个个体的初情期日龄表型;α是固定效应,包括年份和季节;β为每一个SNP位点的替代效应;μ为随机效应并符合μ~N(0,Gσμ2),其中G为基因组亲缘关系矩阵;W、X和Z分别为α、β和μ的关联矩阵;e为随机残差并符合e~N(0,Iσe2),其中 I为单位阵。
1.5 候选基因筛选和功能富集分析
本研究根据P值选择最显著的10个SNP位点,并将这些SNP位点上下游200 kb内的基因筛选为潜在影响初情期日龄的基因,并对这些候选基因进行生物学进程Gene Ontology(GO)富集分析[12]。
2 结果与分析
2.1 初情期日龄的描述性统计
经分析发现,571头杜洛克母猪的初情期日龄最早为173 d,最晚为291 d,平均为224 d。从图1可见,杜洛克母猪的初情期日龄表型值符合正态分布(Shapiro-Wilk Test,W = 0.96737,P =4.509×10-10)。
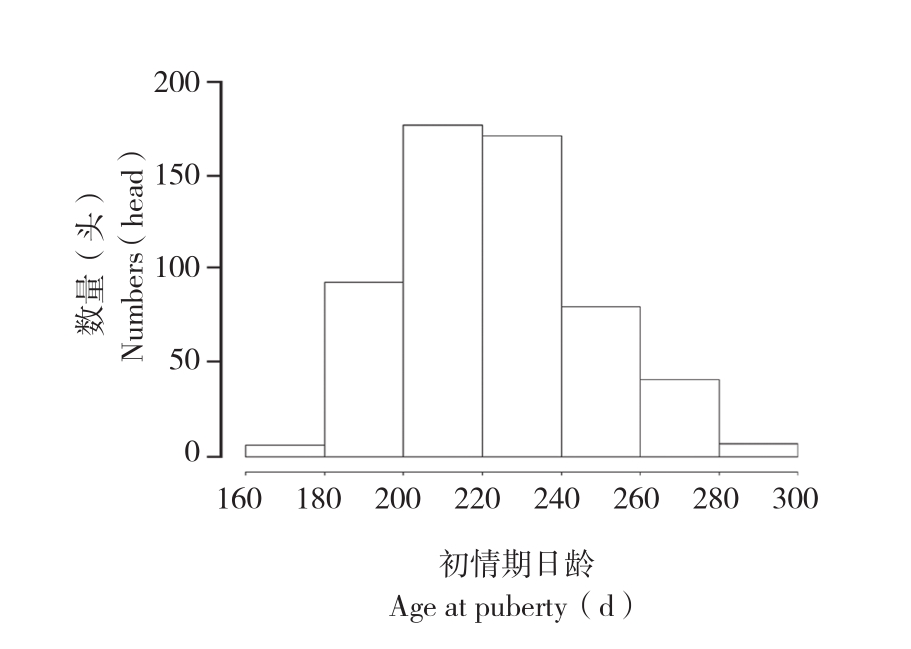
图1 杜洛克母猪初情期日龄
Fig. 1 Age at puberty of Duroc sows
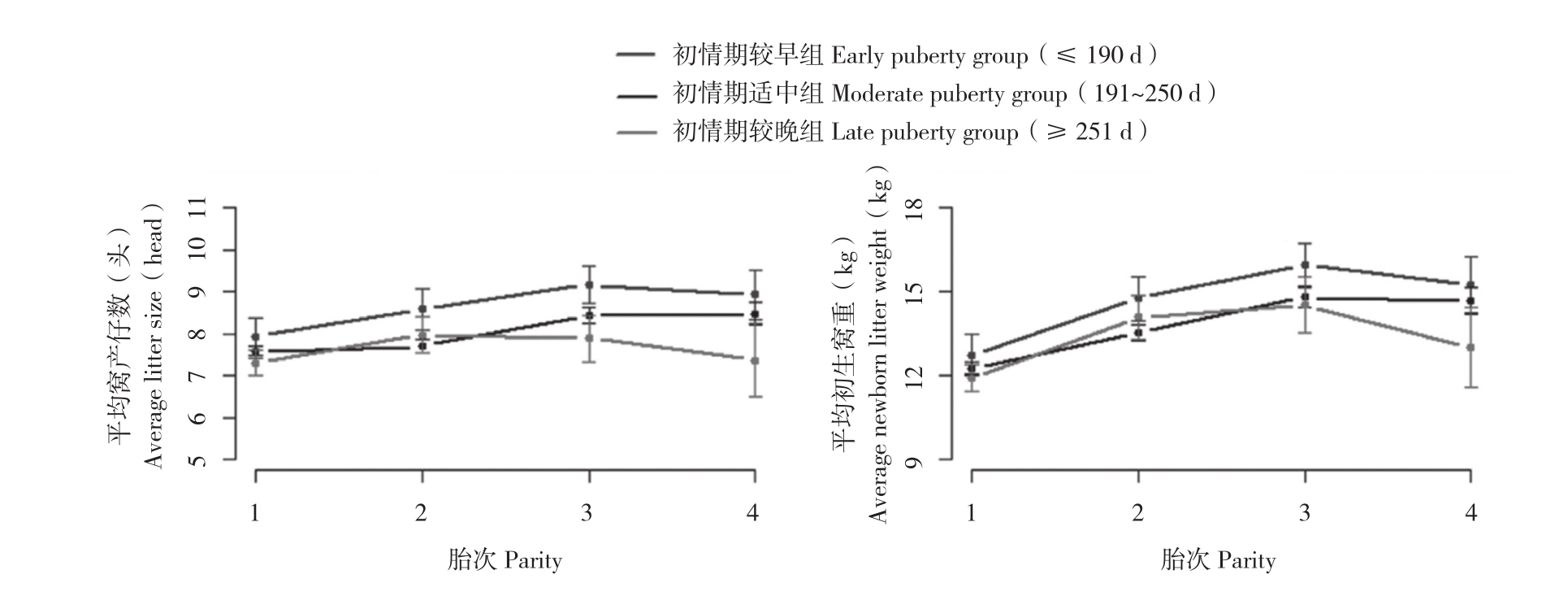
图2 不同初情期日龄母猪的平均窝产仔数和平均初生窝重
Fig. 2 Average litter size and average newborn litter weight of Duroc sows with different ages at puberty
2.2 初情期日龄与繁殖性能的关系
为探索杜洛克母猪初情期日龄与其繁殖性能的关系,分析了具有初情期日龄和繁殖记录的433头杜洛克母猪的数据。根据杜洛克母猪初情期日龄的分布,把杜洛克母猪分为3组,即初情期较早组(≤190 d)、初情期适中组(191~250 d)、初情期较晚组(≥251 d),并分别统计3组母猪1~4胎的平均窝产活仔数和平均初生窝重。如图2所示,虽然各组间经Student’s t检验,P值并没有达到显著阈值,但初情期日龄较早的母猪的平均窝产仔数和平均初生窝重高于初情期适中和较晚组母猪;在第四胎时,初情期日龄较早的母猪的平均窝产仔数和平均初生窝重高于初情期适中组母猪,初情期日龄适中组的母猪的平均窝产仔数和平均初生窝重高于初情期较晚组的母猪。结果表明初情期越早的母猪可能表现出更高的窝产仔数和平均窝重。
2.3 全基因组关联分析
通过全基因组关联分析,未筛选到达到显著阈值的SNP位点(P≤10-(0.05/30281),图3);继续筛选P值最小的10个位点,发现这些位点主要分布在2、4、5、7、12号等染色体上(图3,表1)。10个SNP位点上下游200 kb内的基因包含ABCC8、BCAR3、NELL2、NSF等基因(表1),这些基因的主要功能是ATP binding、第二性征发育、激素分泌的调控等生物学进程(表1)。
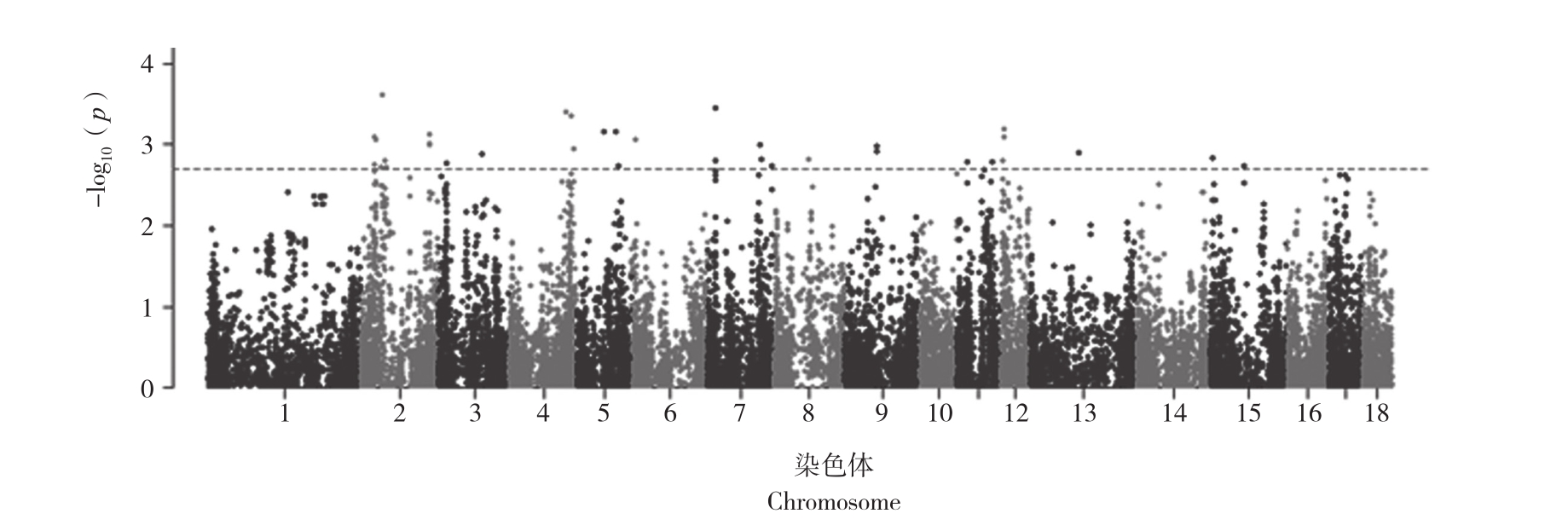
图3 杜洛克母猪初情期日龄全基因组关联分析
Fig. 3 Genome-wide association analysis for age at puberty of Duroc sows
表1 前10个潜在SNP位点及其附近基因
Table 1 Top 10 potential SNP and the related genes
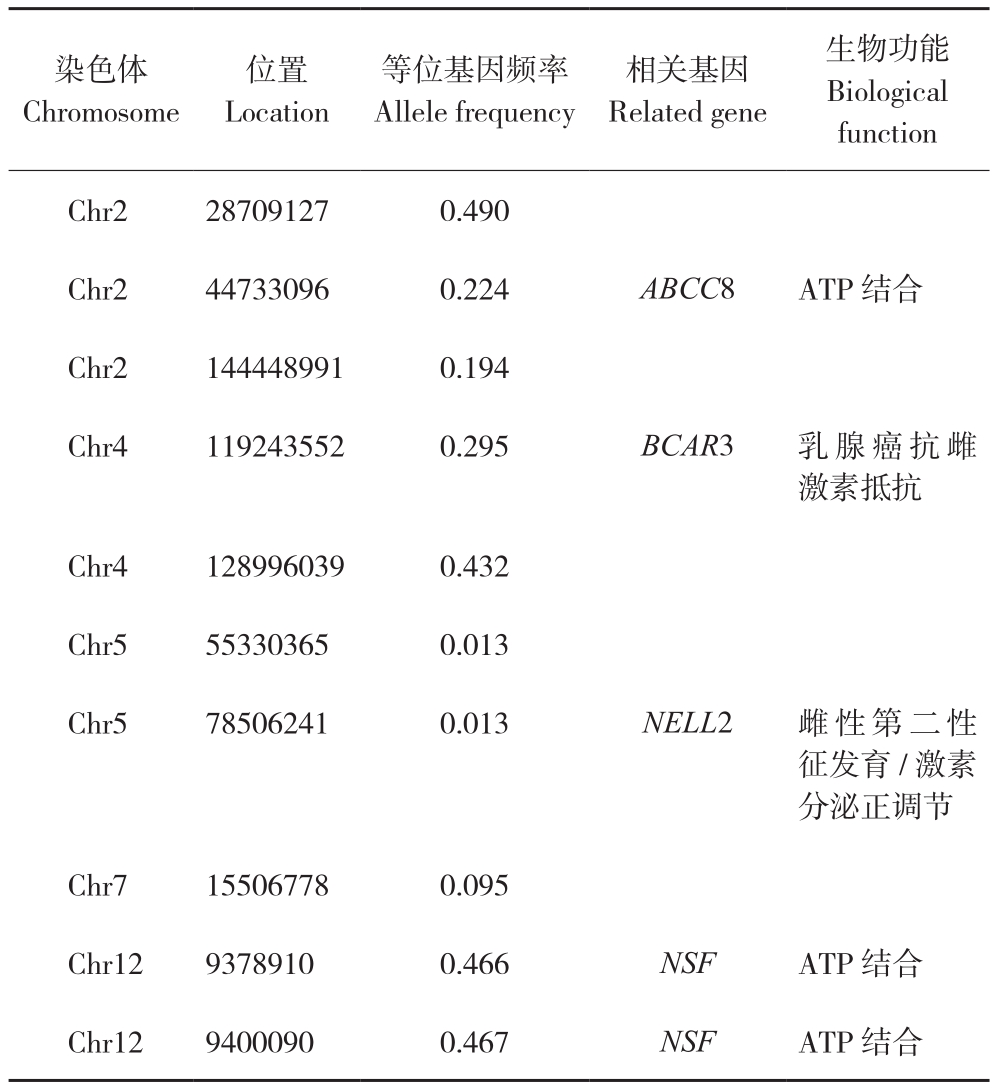
染色体Chromosome位置Location等位基因频率Allele frequency相关基因Related gene生物功能Biological function Chr2 28709127 0.490 Chr2 44733096 0.224 ABCC8 ATP结合Chr2 144448991 0.194 Chr4 119243552 0.295 BCAR3 乳腺癌抗雌激素抵抗Chr4 128996039 0.432 Chr5 55330365 0.013 Chr5 78506241 0.013 NELL2 雌性第二性征发育/激素分泌正调节Chr7 15506778 0.095 Chr12 9378910 0.466 NSF ATP 结合Chr12 9400090 0.467 NSF ATP 结合
3 讨论
本研究发现571头杜洛克母猪的初情期日龄服从正态分布(Shapiro-Wilk Test,P =4.509×10-10),并且平均初情期日龄为224 d。根据初情期日龄的早晚,把433头杜洛克母猪分为3组,与初情期适中组和初情期较晚组相比,从,1~4胎初情期早的母猪具有较高的平均窝产仔数和平均初生窝重;初情期早的母猪的第四胎的平均窝产仔数和平均初生窝重高于初情期适中的母猪,而初情期适中母猪的平均窝产仔数和平均初生窝重高于初情期较晚的母猪。尽管各组间的差异没有达到统计显著水平,但这些结果表明,初情期早的母猪可能具有相对高的繁殖性能,这与郭红洲等[13]对大白母猪的研究结果一致。
利用全基因组芯片数据,本研究对571头杜洛克母猪初情期日龄进行了全基因组关联分析,初步筛选了ABCC8、BCAR3、NELL2和NSF等基因。其中,ABCC8是ATP结合盒转录蛋白超家族的成员之一[14]。前人研究表明,该基因编码的蛋白具有调节ATP敏感性钾离子通道和胰岛素分泌的作用,当ABCC8基因突变,会导致青少年出现肥胖症状和性早熟[15]。同时,ABCC8基因与胰腺神经内分泌肿瘤发生相关[15-16]。BCAR3是编码细胞内转导的蛋白质之一,该基因与雌激素异常导致的疾病显著相关,比如抗性、乳腺癌和子宫内膜异位症[17-18]。BCAR3基因可以调控乳腺癌细胞不再依赖雌激素而大量增殖,同时,BCAR3的高表达量可以促进子宫内膜异位症患者的局部间质细胞迁移和侵袭,促进子宫内膜异位症的发生[19]。NELL2编码的蛋白是一类糖蛋白,在神经细胞的生长、分化以及肿瘤的发生中起重要作用,与生物体内钙离子、蛋白质和肝素结合均具有紧密联系[20]。研究表明,NELL2基因可调控促性腺激素释放激素的分泌,从而调节雌性大鼠的初情期启动[21]。NSF编码的蛋白是一类与神经元疾病相关的蛋白质,参与囊泡介导的转运[22-23]。
本研究没有直接鉴定出显著影响母猪初情期日龄的分子标记,可能是由于该性状是复杂性状、群体不够大、SNP芯片密度低造成的,在后续研究中需继续扩大群体和提高SNP密度。本研究筛选的潜在SNP位点附近基因的功能富集在类胰岛素生长因子与调控激素分泌的信号通路上,这些信号通路是影响母猪初情期日龄的重要信号通路。本研究结果表明,这些候选基因可能影响母猪的初情期日龄,但需要进一步验证。
4 结论
杜洛克母猪的初情期日龄平均为224 d,初情期越早的母猪可能具有越高的繁殖性能;基于全基因组SNP芯片数据和全基因组关联分析,筛选到ABCC8、BCAR3、NELL2和NSF等可能影响杜洛克母猪初情期日龄的重要基因,这些基因显著富集在类胰岛素生长因子与调控激素分泌的信号通路上。本研究结果不仅为解析母猪初情期启动的遗传机制提供参考,还为母猪初情期日龄的遗传改良提供一定的理论基础。
[1] NONNEMAN D J, SCHNEIDER J F, LENTS C A, WIEDMANN R T, VALLET J L, ROHRER G A. Genome-wide association and identification of candidate genes for age at puberty in swine[J]. BMC Genetics, 2016,17:50. doi:10.1186/s12863-016-0352-y.
[2] LUO L, YAO Z, YE J, TIAN Y, YANG C, GAO X, SONG M, LIU Y,ZHANG Y, LI Y, ZHANG X, FANG F. Identification of differential genomic DNA methylation in the hypothalamus of pubertal rat using reduced representation bisulfite sequencing[J]. Reproductive Biology and Endocrinology, 2017,15(1):81. doi:10.1186/s12958-017-0301-2.
[3] ROSALES NIETO C A, THOMPSON A N, MACLEAY C A, BRIEGEL J R, HEDGER M P, FERGUSON M B, MARTIN G B. Relationships among body composition, circulating concentrations of leptin and follistatin, and the onset of puberty and fertility in young female sheep[J]. Animal Reproduction Science, 2014,151(3/4):148-156.doi:10.1016/j.anireprosci.2014.10.008.
[4] 邢凤,张朝阳,廖秋萍,孔正权. 多浪羊与和田羊初情期启动过程中生殖激素的变化规律[J]. 四川农业大学学报,2017,35(3):414-419.doi:10.16036/j.issn.1000-2650.2017.03.020.XING F, ZHANG C Y, LIAO Q P, KONG Z Q. Variation of reproductive hormone level on the puberty onset of Duolang sheep and Hetian sheep[J]. Journal of Sichuan Agricultural University, 2017,35(3):414-419.doi:10.16036/j.issn.1000-2650.2017.03.020.
[5] YANG G, REN J, LI S, MAO H, GUO Y, ZOU Z, REN D, MA J,HUANG L. Genome-wide identification of QTL for age at puberty in gilts using a large intercross F2 population between White Duroc ×Erhualian[J]. Genetics Selection Evolution, 2008,40(5):529-539.doi:10.1051/gse:2008019.
[6] HOLL J W, CASSADY J P, POMP D, JOHNSON R K. A genome scan for quantitative trait loci and imprinted regions affecting reproduction in pigs[J]. Journal of Animal Science, 2004,82(12):3421-3429.doi:10.2527/2004.82123421x.
[7] 李平华,李杰,杨竹青,张志燕,杨斌,陈从英. 母猪初情期全基因组关联分析和位置候选基因研究[J]. 中国农业科学,2012,45(19):4075-4083. doi:10.3864/j.issn.0578-1752.2012.19.020.LI P H, LI J, YANG Z Q, ZHANG Z Y, YANG B, CHEN C Y. Genomewide association study and positional candidate gene analysis on age at puberty of gilts[J]. Scientia Agricultura Sinica, 2012,45(19):4075-4083. doi:10.3864/j.issn.0578-1752.2012.19.020.
[8] PATTERSON J L, WILLIS H J, KIRKWOOD R N, FOXCROFT G R.Impact of boar exposure on puberty attainment and breeding outcomes in gilts[J]. Theriogenology, 2002,57(8):2015-2025. doi: 10.1016/s0093-691x(02)00674-x.
[9] BROWNING S R, BROWNING B L. Rapid and accurate haplotype phasing and missing-data inference for whole-genome association studies by use of localized haplotype clustering[J]. American Joural of Human Genetics, 2007,81(5):1084-1097. doi:10.1086/521987.
[10] PURCELL S, NEALE B, TODD-BROWN K, THOMAS L, FERREIRA M. A, BENDER D, MALLER J, SKLAR P, de BAKKER P I, DALY M J, SHAM P C. PLINK: a tool set for whole-genome association and population-based linkage analyses[J]. American Journal of Human Genetics, 2007,81:559-575. doi:10.1086/519795.
[11] ZHOU X, STEPHENS M. Genome-wide efficient mixed-model analysis for association studies[J]. Nature Genetics,2012,44(7):821-824.doi:10.1038/ng.2310.
[12] HUANG D, SHERMAN B T, TAN Q, KIR J, LIU D, BRYANT D, GUO Y,STEPHENS R, BASELER M W, LANE H C, LEMPICKI R A. DAVID Bioinformatics resources: expanded annotation database and novel algorithms to better extract biology from large gene lists[J]. Nucleic Acids Research, 2007,35:W169-W175. doi:10.1093/nar/gkm415.
[13] 郭红洲,朱淋,张龙超,颜华,王立刚,侯欣华,高红梅,赵福平,刘欣,王立贤. 初情日龄对美系大白母猪繁殖性能的影响[J]. 畜 牧 兽 医 学 报,2018,49(11):2402-2408. doi:10.11843/j.issn.0366-6964.2018.11.011.GUO H Z, ZHU L, ZHANG L C, YAN H, WANG L G, HOU X H, GAO H M, ZHAO F P, LIU X, WANG L X. The effect of age at puberty on reproductive performance in Yorkshire sows[J]. Chinese Journal of Animal and Veterinary Sciences, 2018,49(11),2402-2408.doi:10.11843/j.issn.0366-6964.2018.11.011.
[14] REILLY F, SANCHEZ-LECHUGA B, CLINTON S, CROWE G,BURKE M, NG N, COLCLOUGH K, BYRNE M M. Phenotype,genotype and glycaemic variability in people with activating mutations in the ABCC8 gene: response to appropriate therapy[J]. Diabet Med,2020,37:876-884. doi:10.1111/dme.14145. doi:10.1111/dme.14145.
[15] MATSUTANI N, FURUTA H, MATSUNO S, OKU Y, MORITA S,URAKI S, DOI A, FURUTA M, IWAKURA H, ARIYASU H, NISHI M,AKAMIZU T. Identification of a compound heterozygous inactivating ABCC8 gene mutation responsible for young-onset diabetes with exome sequencing[J]. J Diabetes Investig, 2020,11:333-336. doi:10.1111/jdi.13138.
[16] XIAO Y, YANG Y, WANG Y, LI X, WANG W. Five novel genes related to the pathogenesis and progression of pancreatic neuroendocrine tumors by bioinformatics analysis with RT-qPCR verification[J].Front Neurosci, 2019,13:937. doi:10.3389/fnins.2019.00937.
[17] KATOH M, KATOH M. Identification and characterization of human FNBP1L gene in silico[J]. International Journal of Molecular Medicine, 2004,13(1):157-162. doi:10.3892/ijmm.13.1.157.
[18] VERVOORT V S, ROSELLI S, OSHIMA R G, PASQUALE E B. Splice variants and expression patterns of SHEP1, BCAR3 and NSP1, a gene family involved in integrin and receptor tyrosine kinase signaling[J].Gene, 2007,391(1/2):161-170. doi:10.1016/j.gene.2006.12.016.
[19] MENG X, LIU J, WANG H, CHEN P, WANG D. MicroRNA-126-5p downregulates BCAR3 expression to promote cell migration and invasion in endometriosis[J]. Molecular and Cellular Encocrinology,2019,494:110486. doi:10.1016/j.mce.2019.110486.
[20] CHOI E J, KIM D H, KIM J G, KIM D Y, KIM J D, SEOL O J, JEONG C S, PARK J W, CHOI M Y, KANG S G, COSTA M E, OJEDA S R,LEE B J. Estrogen-dependent transcription of the NEL-like 2(NELL2)gene and its role in protection from cell death[J]. The Journal of Biological Chemistry, 2010,285(32):25074-25084. doi:10.1074/jbc.M110.100545.
[21] ZHOU S, LI P. Effects of NELL2 on the regulation of GnRH expression and puberty in female rats[J]. Genetics and Molecular Research,2014,13(3):6672-6682. doi:10.1074/jbc.M110.100545.
[22] VALENTIJN K M, SADLER J E, VALENTIJN J A, VOORBERG J, EIKENBOOM J. Functional architecture of Weibel-Palade bodies[J]. Blood, 2011, 117(19):5033-5043. doi:10.1182/blood-2010-09-267492.
[23] RONDAIJ M G, BIERINGS R, KRAGT A, van Mourik J A,VOORBERG J. Dynamics and plasticity of Weibel-Palade bodies in endothelial cells[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2006, 26(5):1002-1007. doi:10.1161/01.ATV.0000209501.56852.6c.