【研究意义】鸡胚蛋是受精鸡蛋孵化至一定天数后尚未破壳可食用的鸡蛋[1]。早在明朝,《本草纲目》就有记载:“鸡胚蛋有治头痛、偏头痛、头疯病及四肢疯瘴之功能,童叟弱者常食之,有健脾胃作用,遂而起到强身健体之功效”。在孵化过程中,鸡胚蛋提供了雏鸡生长发育所必需的各种营养物质,因此鸡胚蛋被认为是有生命力的蛋,民间有“喜蛋”“活珠子”“毛蛋”等俗称[2]。鸡胚蛋是民间食补佳品,在我国南方以及日本、韩国等东南亚国家一直有食用鸡胚蛋的习俗[3-4]。与鲜鸡蛋相比,鸡胚蛋中对人体有利的物质增加,如蛋白质、氨基酸、维生素、无机盐、不饱和脂肪酸、牛磺酸及免疫球蛋白等,而总糖、总脂肪、胆固醇等不利物质明显下降[4-5]。鸡胚混悬液或冻干粉可促进动物生长发育、增强免疫、抗疲劳、抗应激、抗衰老等[6-10],鸡胚除常规的“喜蛋”“活珠子”产品外,鸡胚保健食品、鸡胚营养粉等新型鸡胚制品也应运而生。鸡胚蛋作为传统的功能性食品,因其具有提高免疫力的功效而被广泛食用,对其发挥免疫调节功能的物质基础及其作用机制进行科学研究与验证具有重要意义。
【前人研究进展】外泌体(Exosomes)是一种由细胞分泌的胞外囊泡,于1983年在绵羊网织红细胞中被发现,1987年Johnstone对其命名[11]。外泌体含有蛋白质、非编码RNA(miRNA、lncRNA等)、mRNA、脂质等功能物质,并在细胞间信息传递、信号传导、免疫调控、代谢物清除及凝血等方面发挥重要作用[12-13]。研究表明,外泌体所含小RNA,可以稳定存在并推测能够通过囊泡运输进入目的细胞,参与机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等[14]。四川农业大学李学伟教授团队发现乳汁外泌体内的miRNA在高温、酸性、冻融和外源RNA酶处理等条件下免受内源性RNA酶的降解作用,以一种非常稳定的状态存在,由此推测外泌体miRNA可能通过乳汁的方式从消化道黏膜表皮细胞直接被子代摄入[15-16]。人食用牛乳4~6 h后血浆中检测到高含量miR-29b和miR-200c(牛乳富含miRNAs),牛奶消耗后血液单核细胞中的矮小相关转录因子2(Runt-related transcription factor 2, RUNX2,miR-29b的已知靶标)的表达增加31%[17];金银花的MIR2911通过饮食方式传递至小鼠外周血和肺脏,并通过靶向聚合酶碱性蛋白2(Polymerase basic protein 2, PB2)和非结构蛋白1(Nonstructural protein 1, NS1)基因抑制甲型流感病毒的复制;生姜外泌体miRNAs可以调节肠道菌群改善肠道健康[19]。上述研究说明食物中外泌体的miRNAs可能是调节人类基因的食源性生物活性物质。近年来,血液、唾液、尿液、乳汁、细胞培养液等液体样本中的外泌体分离及功能得到深入研究,而组织样本中外泌体的分离及功能研究报道鲜见。【本研究切入点】作为传统的食补佳品,鸡胚蛋中生物活性物质的传递及其可能的作用机制尚不清楚,所含的外泌体及其携带的miRNAs对人类健康如何发挥作用值得我们探索,然而目前既无适用于动物组织中外泌体分离纯化的标准方法,也无适用的商业化试剂盒,阻碍了鸡胚外泌体功能的深入研究。【拟解决的关键问题】本研究以鸡胚为素材,综合采用样品前处理、超速离心、液体样本外泌体提取的商业化试剂盒分离鸡胚组织来源的外泌体,比较各方法所获外泌体含量与纯度,为后续深入解析鸡胚中活性物质及其作用机制提供依据。
1 材料与方法
1.1 试验材料
从广东省农业科学院动物科学研究所家禽试验场收集处于产蛋高峰期的惠阳胡须鸡受精蛋30枚。于收集当天置于数字孵化器中孵化,孵化条件为37 ℃、相对湿度65%~75%,每小时自动翻蛋1次,孵化至13 d时,取出鸡胚蛋终止孵化,选择大小及重量相近的胚蛋12枚,分为3组,每组4枚,用于后续处理。
主要试剂:Ⅲ型胶原酶,美国Worthington Biochemical公司;无菌PBS、DMEM培养基、BCA蛋白浓度测定试剂盒均购自Thermo Scientific公司;蛋白酶抑制剂、磷酸酶抑制剂购自Cell Signaling Technology公司;exoEasy Maxi kit试剂盒购自Qiagen公司;ExoQuick ULTRA EV Isolation kit试剂盒购自System Biosciences公司;流式检测CD63-Antibody-FITC和CD81-Antibody-FITC,购自美国BD生物科学公司。
主要仪器:数字孵化器(Digital incubator Rcom PRO 50 PX-50),韩国Autoelex 有限公司;HWS24型电热恒温水浴锅,上海一恒科技有限公司;低温离心机,Thermo Fisher Scientific公司;超速离心机(XPN-100),美国Beckman Coulter有限公司;透射电镜(JEM-1200EX),日本电子株式会社(JEOL);纳米流式检测仪(Flow NanoAnalyzer,nanoFCM),厦门福流生物科技有限公司;流式细胞仪(BD accuri C6 flow cytomenter),美国BD生物科学公司。
1.2 试验方法
1.2.1 鸡胚组织消化 用75%酒精擦拭胚蛋表面后置于超净工作台,用无菌镊子从鸡蛋钝端开孔并取出鸡胚,将分离到的鸡胚经无菌PBS漂洗2~3次,去除喙、翅、脚等。用灭菌的剪刀轻柔剪碎,并经0.5% Ⅲ型胶原酶于37 ℃消化30 min,期间轻柔混匀消化液,收集消化样品,加入DMEM基础培养基、蛋白酶抑制剂、磷酸酶抑制剂,并定容至50 mL,用于后续离心。
1.2.2 鸡胚组织中外泌体分离 鸡胚组织经酶消化、差速离心、过滤等前处理后,分别采用超速离心法(UC)、蔗糖垫超速离心法(SDUC)、exoEasy Maxi kit膜 亲 和 法(exoEasy) 以 及exoQuick ULTRA EV Isolation kit聚乙二醇沉淀法(exoQuick)4种方法进行外泌体的分离、纯化,操作流程如图1所示,所获样品经PBS重悬或洗脱液洗脱,经0.22 μm滤膜过滤后分装,分别标记为A、B、C和D,于-80 ℃保存备用。
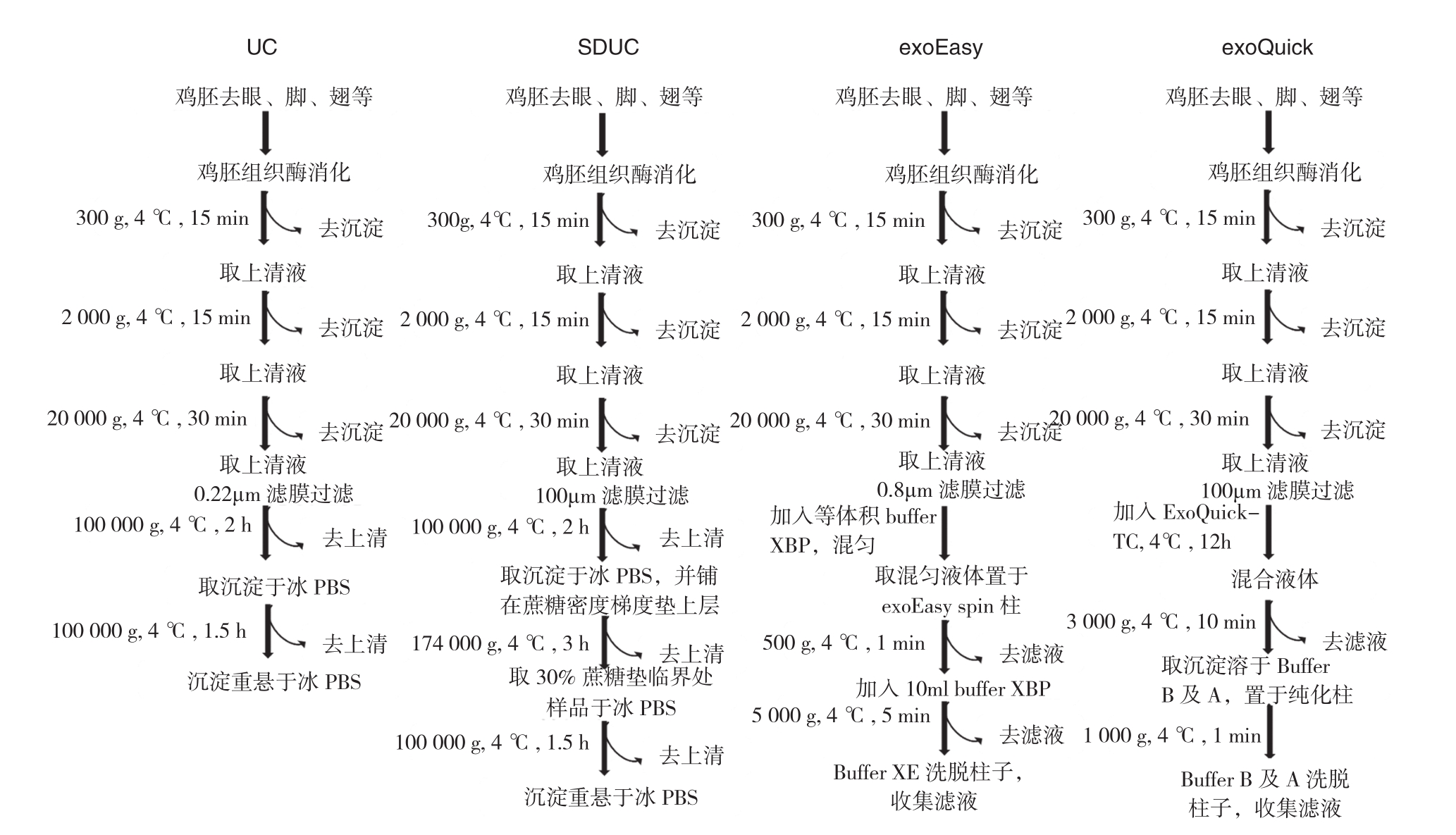
图1 4种鸡胚组织中外泌体分离提取方法流程
Fig. 1 Four methods process for the isolation and extraction of exosomes from chicken embryo tissues
1.2.3 外泌体蛋白浓度测定 按照BCA试剂盒操作说明制作标准曲线,并测定A、B、C和D样品蛋白浓度。取各稀释浓度的蛋白标准品和待测蛋白质样品各25 μL,加入微孔板中,然后加入200 μL工作液,并在振荡器上震荡30 s,充分混匀,将微孔板密封,在37 ℃孵育30 min,将微孔板冷却到室温,使用酶标仪测定样品在562 nm处的吸光值。
1.2.4 外泌体鉴定 采用透射电镜观察囊泡形态、大小,将制备好的外泌体样品10 μL滴于2 mm载样铜网上,沉淀3 min,用滤纸沿铜网边缘吸去浮液;经PBS漂洗后用3%磷钨酸负染;室温干燥5 min,将载样铜网置于电镜样品室,80 kV下观察样品形态并拍照。采用纳米流式nanoFCM检测囊泡大小分布及其囊泡颗粒浓度,该法利用二氧化硅标准球建立散射光强度与颗粒粒径的标准工作曲线,可将相同条件下待测样品的散射强度转化为粒径,获得待测样品的粒径分布;通过检测已标定浓度的荧光微球的个数快读得到特定进样压力的样品流体积流量,在相同的进样压力条件下检测待测样品,获得样品的颗粒浓度,根据仪器操作说明参照粒径标准品和已标定浓度的荧光微球的适宜检测条件对外泌体样品进行测定。外泌体标记蛋白流式细胞仪检测,用100 μL无菌PBS复匀外泌体,密封冰上保存,样品分别与含CD63和CD81抗体磁珠孵育、染色,并留取阴性对照,按照仪器操作进行检测。
2 结果与分析
2.1 鸡胚组织中外泌体蛋白浓度
采用BCA法对鸡胚组织中外泌体进行蛋白定量分析,得到A、B、C和D样品的蛋白浓度分别为 274.56±18.19、94.81±10.74、793.86±28.81、1 301.28±180.26 μg/mL,由高到低依次为D>C>A>B,不同方法获得的外泌体蛋白浓度存在极显著差异。聚乙二醇沉淀法获得外泌体D,同时可与疏水性蛋白和脂质分子结合沉淀,因此所获外泌体中可能参杂其他杂蛋白,蛋白浓度最高。膜亲合法获得外泌体C,该方法运用了囊泡的通用特性,可分离到所有类型的囊泡,因此C样品蛋白浓度也较高。A、B分别为经超速离心和蔗糖垫超速离心获得的外泌体,前者沉淀了所有对应离心力范围的物质,后者相对富集了30%蔗糖密度垫附近的囊泡颗粒,因此A样品蛋白浓度较B样品高。
2.2 鸡胚组织中外泌体形态特征鉴定
2.2.1 形态鉴定 在相同条件下利用透射电子显微镜(Transmission Electron Microscope, TEM)观察4种方法分离获得的样品,均发现获得呈圆形或椭圆形的囊泡颗粒,具有典型的杯状,在囊泡外周可见膜性结构(图2),从微囊结构、形态可判定样品均为外泌体。各外泌体样品囊泡颗粒大小、呈现状态存在差异,A、B、C样品在电镜下均能看到大量具有外泌体样结构的囊泡,D样品虽然也有一些外泌体样结构,但大部分出现聚团,这可能与提取方法的特性有关。
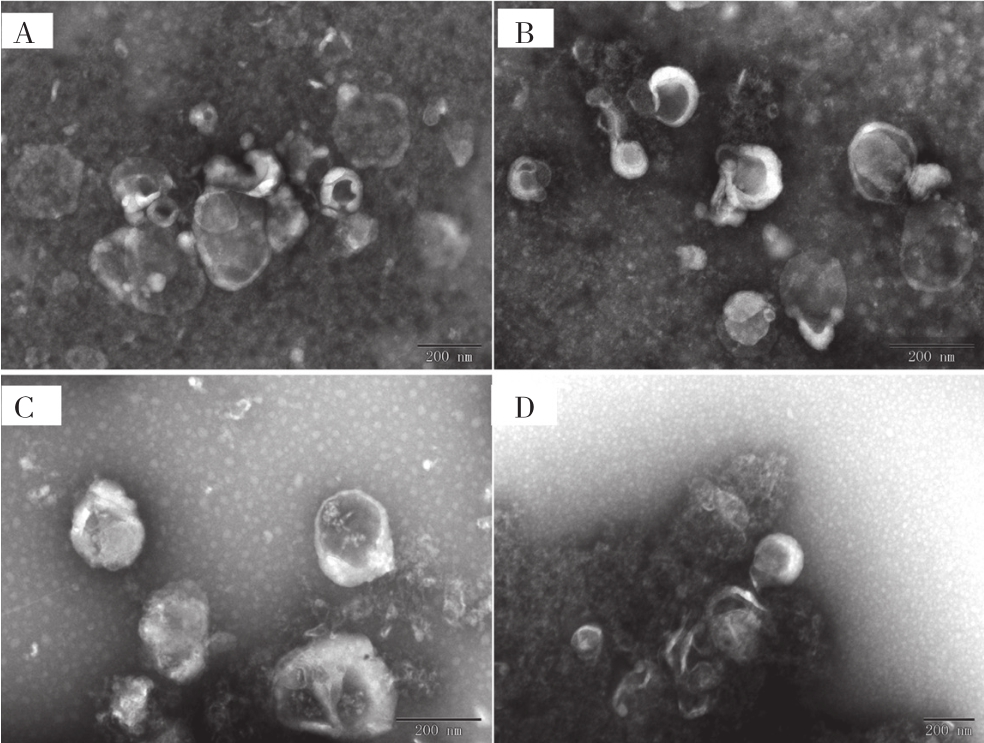
图2 透射电镜检测鸡胚组织来源的外泌体
Fig. 2 Embryo tissue-derived exosomes under TEM
A~D分别为超速离心法(UC)、蔗糖密度垫超速离心法(SDUC)、膜亲合法(exoEasy)、聚乙二醇沉淀法(exoQuick)分离到的外泌体样品;标尺均为200 nm
A-D represent Exosomes isolated by ultracentrifugation (UC), sucrose density ultracentrifugation (SDUC), membrane affinity method (exoEasy),polyethylene glycol precipitation method (exoQuick), respectively; Scale bar is 200 nm
2.2.2 粒径分布及浓度检测 根据nanoFCM测得的囊泡直径分布(表1)可知,4种方法获得的囊泡直径范围主要分布在50~145 nm之间,且直径均值集中在70~80 nm范围,其中C、D样品直径分布范围宽,而B样品直径分布范围最窄。4种方法获得囊泡浓度由高到低依次为D>C>A>B,与外泌体蛋白浓度变化趋势一致。同时,传统方法与商业化试剂盒分离到的囊泡数量存在极显著差异。A、B均采用超速离心法,但B样品为在30%蔗糖密度垫处富集的囊泡,囊泡颗粒浓度和种类均少于A样品。此外,因鸡胚组织由多种细胞组成,故分离到的囊泡异质性特征明显,大小、直径均有差异。
表1 鸡胚组织中胞外囊泡的纳米流式检测结果
Table 1 Detection results of embryo tissue-derived extracellular vesicles under nanoFCM
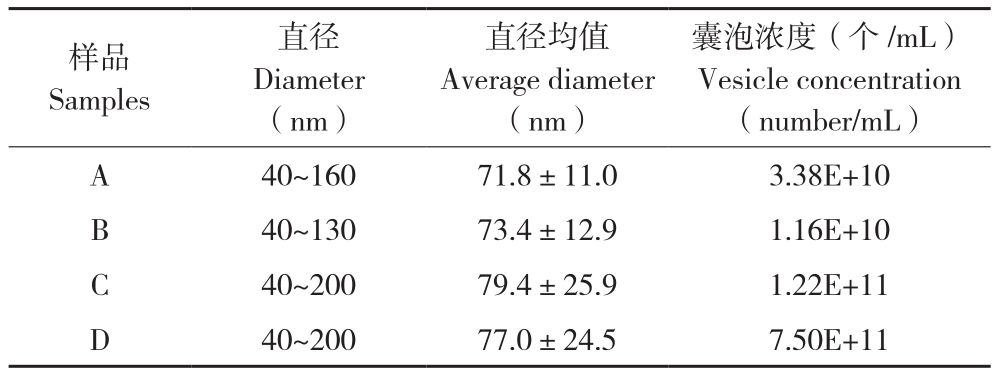
注:A~D分别为超速离心法(UC)、蔗糖密度垫超速离心法(SDUC)、膜亲合法(exoEasy)、聚乙二醇沉淀法(ExoQuick)分离到的外泌体样品
Note: A-D represent Exosomes isolated by ultracentrifugation(UC),sucrose density ultracentrifugation(SDUC), membrane affinity method(exoEasy), polyethylene glycol precipitation method(exoQuick), respectively.
囊泡浓度(个/mL)Vesicle concentration(number/mL)A 40~160 71.8±11.0 3.38E+10 B 40~130 73.4±12.9 1.16E+10 C 40~200 79.4±25.9 1.22E+11 D 40~200 77.0±24.5 7.50E+11样品Samples直径Diameter(nm)直径均值Average diameter(nm)
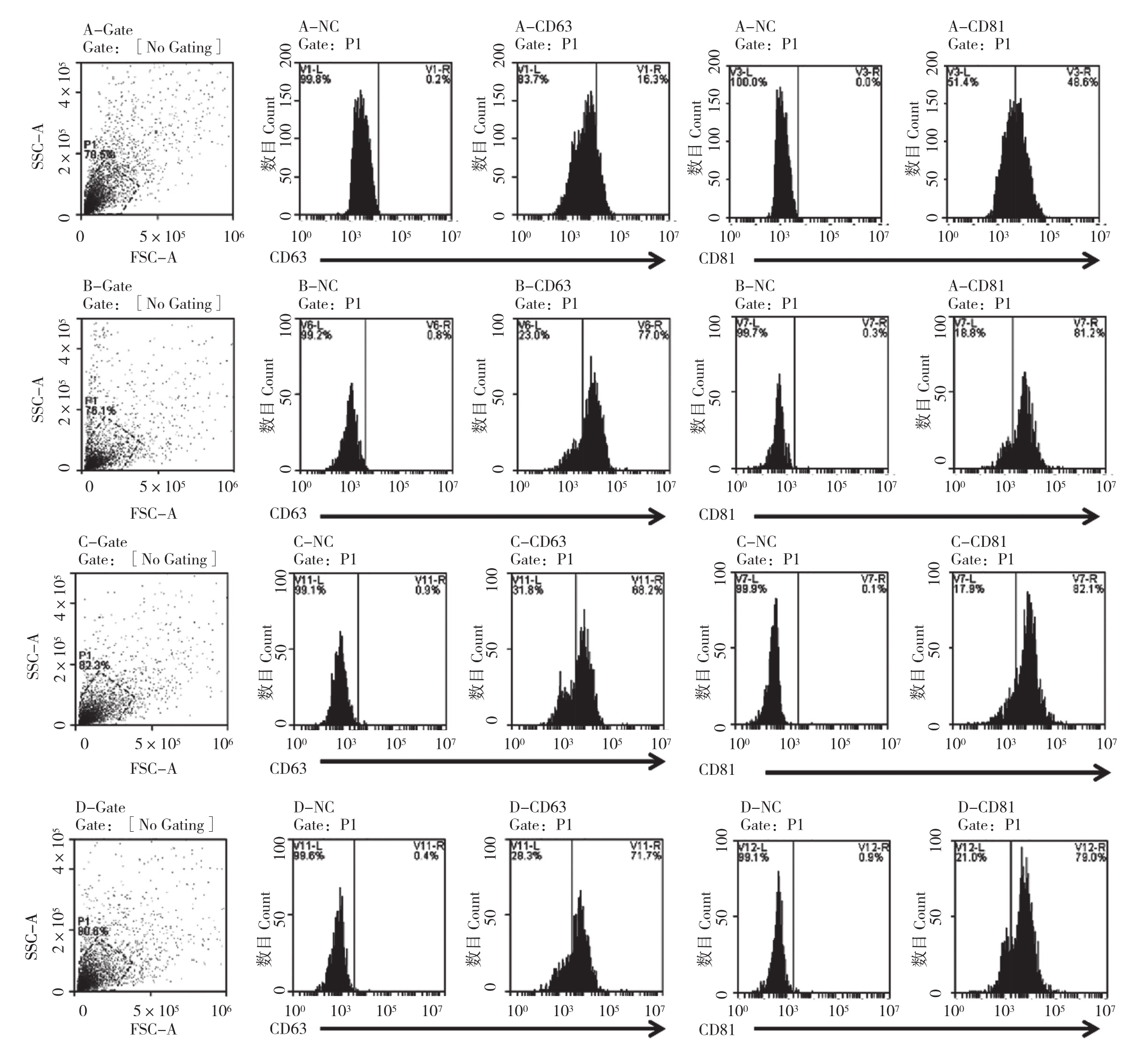
图3 鸡胚组织中外泌体标志蛋白的流式检测结果
Fig. 3 Detection results of embryo tissue-derived exosome marker proteins under flow cytometry
2.2.3 标志蛋白鉴定 为进一步确认和比较分析所获外泌体情况,采用流式细胞仪检测经外泌体标志蛋白(CD63、CD81)荧光抗体孵育的外泌体样品。由图3可知,4个样品中均检测到一定比例的阳性囊泡颗粒,说明分离到的外泌体具有胞外囊泡标志蛋白。本研究中CD63和CD81阳性比例存在差异,其中CD63阳性率为B(77.0%)>D(71.7%)>C(68.2%)>A(16.3%),CD81阳性率为B(81.2%)>D(79.0%)>C(78.9%)>A(48.6%),但两者阳性率变化趋势一致。从标志蛋白阳性率来看,B方法分离获得的外泌体纯度最好。
3 讨论
国内外学者采用不同的商业化试剂盒、超速离心等方法研究了各种液体样本(血清、乳汁、细胞上清等)中的外泌体,仅从所获外泌体的蛋白浓度、颗粒浓度指标判定,商业化试剂盒普遍优于超速离心法,且以聚乙二醇沉淀法开发的试剂盒分离产量最高[20-24],因聚乙二醇沉淀法分离外泌体试剂盒出现早、应用广,有效解决了超速离心耗时长及其对技术与平台要求高的问题,因此相关研究报道最多。该方法具有快速、简单、易操作、样本处理体积范围广的优势[25],部分研究者从经济成本、蛋白产量和囊泡浓度指标考量推荐使用基于聚乙二醇沉淀法开发的试剂盒,如ExoQuik试剂盒(System Bioscience公司)和Total Exosome Isolation Kit试剂盒(Thermo Fisher Scientific公司)[21,25]。但是,随着研究的不断深入,发现聚乙二醇沉淀法对各类囊泡均无选择性,除了获得外泌体外,同时还能获得其他细胞外囊泡、细胞外蛋白质和蛋白质聚集体等[26]。基于膜亲和法分离外泌体的试剂盒具有耗时短、操作简便等优点,且可根据外泌体与杂质有无膜结构进行区分,因此样本是否存在细胞和细胞碎片等有膜结构物质是该方法成败的关键。
组织内细胞间外泌体在机体生长、发育过程中发挥重要作用,但组织中外泌体分离、纯化及其功能研究报道较少。鉴于目前尚无标准的组织样本外泌体分离方法,本研究采用Ⅲ型胶原酶消化、差速离心和过滤等进行前处理,与前人采用的前处理方法不尽相同。对于富含外泌体的脑组织,Gallart-Palau等[27]采用机械均质化和过滤进行脑组织样品前处理;Vella等[28]采用酶消化、离心进行前处理;对于脂肪组织,Zhang等[29]采用离体培养3 d后通过收集培养液分离外泌体,该方法获得了组织分离培养条件下所分泌的外泌体,组织细胞离体培养过程中可能会因环境的改变影响外泌体的释放及其所携带的物质成分。近期两个不同研究团队先后报道了人肾癌组织和转移性黑色素瘤组织中外泌体的分离与纯化,在样品前处理方面,均采用了胶原酶消化、离心、过滤,与本研究采用的前处理方法相似,在分离、纯化方面采用超速超速离心或蔗糖梯度离心,与本试验UC和SDUC法基本一致,均采用 100 000~120 000 g的离心条件[30-31]。
由TEM、nanoFCM和流式细胞检测可知,4种方法均可获得具有典型形态特征的外泌体囊泡,囊泡形态、粒径范围及标志蛋白与乳汁[32]、尿液[33]、血浆[34]、子宫腹水[35]及细胞培养液[36]中分离的外泌体特征基本一致。本研究中商业化试剂盒分离到的囊泡数量是超速离心法的10倍以上。Tang等[37]比较了超速离心法和两种商业化试剂盒(exoQuick和TEI)分离提取细胞培养液和血清中外泌体的效果,Helwa等[34]分析了超速离心与miRCURY、exoQuick和TEI 3种商业化试剂盒提取血清外泌体的效果,均发现商业化试剂盒的外泌体颗粒浓度远高于超速离心,与本研究结果一致。然而聚乙二醇沉淀法分离的外泌体蛋白浓度最高且出现聚团,说明分离到的样品中含有大量其他物质,这与Tang等[37]、Caradec等[21]分离血清、细胞培养液等液体样本外泌体的研究报道结果一致。本研究结果表明,不同分离方法获得的外泌体样品的标志蛋白含量不同,这与Royo等[38]采用WB检测不同方法获得的尿液中外泌体样品标志蛋白(CD9、CD10、CD63、TSG101等)得到的结果相似;SDUC法分离到的外泌体标志蛋白阳性率最佳,而Ding等[20]采用WB检测外泌体标志蛋白CD63和TSG101发现,exoQuick分离的外泌体其标记蛋白阳性率高于超速离心,与本研究采用流式细胞术检测结果不同,这可能与所采取的检测方法及其抗体结合能力有关。
目前,外泌体纯化产品不断涌现,综合比较发现,不同方法获得的外泌体在蛋白浓度、囊泡颗粒浓度、直径大小分布、RNA总量、小RNA表达谱、蛋白质谱等方面均存在差异,尤其小RNA表达谱、蛋白质谱差异较大[20,22,39]。不同研究团队均发现超速离心获得的血浆外泌体样品RNA含量及蛋白纯度优于商业化试剂盒[34,37],且结合密度梯度纯化获得的样品纯度最高[22-23],但产量远低于商业化试剂盒。针对各种商业化试剂盒进行比较发现,基于膜亲和法获得的细胞培养液和血浆外泌体RNA纯度高、质量好[22]。分析外泌体样本蛋白质谱发现,商业化试剂盒中聚乙二醇沉淀法获得较高的外泌体产量[20],但含有大量非外泌体颗粒(如血清蛋白聚集体),因此外泌体纯度很低[34]。
不同方法各有优缺点,超速离心法作为外泌体分离的金标准,仍是最常用的外泌体纯化手段。同时,目前仅有的少量从组织中分离纯化外泌体的报道均采用超速离心法,但超速离心法费时、对设备要求高,在多个循环中施加不同的离心力,有助于去除细胞碎片和其他污染物,使外泌体样本纯度更好,但也存在可能导致样本中的外泌体损失及外泌体产量更低等缺陷。目前尚无针对组织样本外泌体分离纯化的商业化试剂盒,现有的商业化试剂盒均为针对液体样本,其操作简单、高效,但试剂盒之间差异大,每种方法都不能有效分离到高纯度的外泌体,不同方法获得的外泌体中存在白蛋白、高密度脂蛋白和RNA结合蛋白(Argonaute 1和2)聚集体等污染,而这一比例的大小尚无确切数据支撑,需要进一步鉴定[22,24]。因此,需根据试验材料、目的以及后续研究需要综合评估选用适宜的分离纯化方法,在得率与纯度之间取得良好平衡。本研究在前处理的基础上利用超速离心、蔗糖垫超速离心和商业化试剂盒进行了组织中外泌体的分离比较,为后续开展组织中外泌体分离及其功能研究奠定基础。
4 结论
本研究比较了超速离心法、蔗糖垫超速离心法、膜亲和法以及聚乙二醇沉淀法分离鸡胚组织中外泌体的效果,综合考量外泌体的纯度、形态、大小及其标志性蛋白表达情况,根据供试组织样品来源、试验条件和目的可优选蔗糖垫超速离心法或膜亲和法,如需高纯度外泌体可首选蔗糖垫超速离心法(SDUC),样品稀有或不具备超速离心设备则选用膜亲和法(exoEasy)。
[1] 聂露,牛伟贺,张扬,张磊,龙博文,贺彦昭,牟维豪,董正江,杜晓惠.褐壳与绿壳鸡胚蛋特色营养物质的含量变化[J]. 食品科学,2016,37(2): 142-146. doi:10.7506/spkx1002-6630-201602025.NIEL, NIU W H, ZHANG Y, ZHANG L, LONG B W, HE Y Z, MOU W H, DONG Z J, DU X H. Variations in special nutrient contents of greenshelled embryonated chicken eggs and brown-shelled embryonated chicken Eggs[J]. Food Science, 2016, 37(2): 142-146. doi:10.7506/spkx1002-6630-201602025.
[2] 李曦. 鸡胚蛋对免疫力低下小鼠的免疫调节功能研究[D]. 无锡:江南大学,2012.LI X. Study on the immunomodulatroy effect of chick embryo egg on hypoimmunity mice[D]. Wuxi: Jiangnan University, 2012.
[3] 高伟,张培正,宫玮. RP-HPLC法测定鸡胚蛋及鸡蛋中性激素 的 残 留 量[J]. 食 品 科 学,2008(6): 364-367. doi:10.3321/j.issn:1002-6630.2008.06.080.GAO W, ZHANG P Z. Determination of residual free sex hormons in HY-LINE variety brown embryo and egg by RPHPLC[J]. Food Science, 2008(6): 364-367. doi:10.3321/j.issn:1002-6630.2008.06.080.
[4] 段翔.孵化对鸡蛋营养成分及生物活性组分的影响[D]. 无锡:江南大学,2015.DUAN X. Effect of fertilization on nutritional compositions and bioactive components of hen egg[D]. Wuxi: Jiangnan University, 2015.
[5] 李利东,袁建兴,宓晓黎,成恒嵩. 不同孵化期的鸡胚蛋营养和功效成分研究[J]. 食品科学,2004, 25(11): 287-290. doi:10.3321/j.issn:1002-6630.2004.11.076.LI L D, YUAN J X, MI X L, CHENG H S. Study on nutrients improvement and efficacy factors of embrynated eggs duing different incubation periods[J]. Food Science, 2004, 25(11): 287-290.doi:10.3321/j.issn:1002-6630.2004.11.076.
[6] 王倩,王化洲,齐志敏,赵保东. 鸡胚口服液免疫调节作用的实验研究[J]. 中国生化药物杂志,2000(4): 195-197. doi:10.3969/j.issn.1005-1678.2000.04.013.WANG Q, WANG H Z, ZHAO B D. An experimental study on the effect of the per oral solution extracted from chicken embryo on immunologic function[J]. Chinese Journal of Biochemical Pharmaceutics, 2000(4): 195-197. doi:10.3969/j.issn.1005-1678.2000.04.013.
[7] 吕玉琴,郝志明,李引乾,赵银萍. 鸡胚对小鼠生长和免疫力的影响[J]. 西安联合大学学报,2002, 5(2): 26-29. doi:10.3969/j.issn.1008-777X.2002.02.006.LU Y Q, HAO Z M, LI Y Q, ZHAO Y P.Chick embryo impact on mouse growth and immunity[J]. Journal of Xi'an United University, 2002, 5(2): 26-29. doi:10.3969/j.issn.1008-777X.2002.02.006.
[8] 郝志明,谢斐,吕玉琴. 鸡胚复方制剂对小白鼠生长、脾脏指数及血浆SOD和MDA的影响[J]. 西安联合大学学报,2004, 7(2): 8-11.doi:10.3969/j.issn.1008-777X.2004.02.002.HAO Z M, XIE F, LU Y Q. Chicken embryo compound preparation on mouse's growth, spleen index, SOD & MDA plasma[J]. Journal of Xi'an United University, 2004, 7(2): 8-11. doi:10.3969/j.issn.1008-777X.2004.02.002.
[9] 陈正跃,黄丽君,许建文,张光军,邱培勇,张积霞,王永学. 鸡胚胎素的美容抗衰老及免疫调节作用(英文)[J]. 中国临床康复,2006, 10(27): 190-192. doi:10.3321/j.issn:1673-8225.2006.27.045.CHEN Z Y, HUANG L J, XU J W, ZHANG G J, QIU P Y, ZHANG J X,WANG Y X. Effect of eggembryosin on cosmetology, anti-senility and immunoloregulation[J]. Chinese Journal of Clinical Rehabilitation,2006, 10(27): 190-192. doi:10.3321/j.issn:1673-8225.2006.27.045.
[10] 李丹. 鸡胚及其人参配伍免疫调节与抗疲劳作用的研究[D]. 泰安:山东农业大学,2008.LI D. Study on immune regulatory and anti-fatigue effect of chicken embryo and combined with Ginseng[D]. Taian: Shandong Agricultural University, 2008.
[11] VLASSOV A V, MAGDALENO S, SETTERQUIST R, CONRAD R.Exosomes: current knowledge of their composition, biological functions,and diagnostic and therapeutic potentials[J]. Biochimia et Biophysica Acta, 2012, 1820(7): 940-948. doi:10.1016/j.bbagen.2012.03.017.
[12] HESSVIK N P, LLORENTE A. Current knowledge on exosome biogenesis and release[J]. Cellular Molecular Life Sciences, 2018, 75(2): 193-208. doi:10.1007/s00018-017-2595-9.
[13] GAO F, JIAO F, ZHANG Y, QIN W, QIAN X. Advances in separation techniques for exosomes and their clinical applications[J]. Chinese Journal of chromatography, 2019, 37(10): 1071-1083. doi:10.3724/SP.J.1123.2019.02007.
[14] CORRADO C, RAIMONDO S, CHIESI A, CICCIA F, DE LEO G,ALESSANDRO R. Exosomes as intercellular signaling organelles involved in health and disease: basic science and clinical applications[J]. International Journal of Molecular Sciences, 2013, 14(3):5338-5366. doi:10.3390/ijms14035338.
[15] GU Y, LI M, WANG T, LIANG Y, ZHONG Z, WANG X, ZHOU Q,CHEN L, LANG Q, HE Z, CHEN X, GONG J, GAO X, LI X, LV X.Lactation-related microRNA expression profiles of porcine breast milk exosomes[J]. PLoS One, 2012, 7(8): e43691. doi:10.1371/journal.pone.0043691.
[16] 张顺华. 猪不同泌乳期乳汁Exosome中microRNA转录组的鉴定和表达谱分析[D]. 雅安:四川农业大学,2013.ZHANG S H. Lactation-related microRNA expression profiles of porcine breast milk exosomes[D]. Yaan: Sichuan Agricultural University, 2013.
[17] BAIER S R, NGUYEN C, XIE F, WOOD J R, ZEMPLENI J.MicroRNAs are absorbed in biologically meaningful amounts from nutritionally relevant doses of cow milk and affect gene expression in peripheral blood mononuclear cells, HEK-293 kidney cell cultures, and mouse livers[J]. The Journal of Nutrition, 2014, 144(10): 1495-1500. doi:10.3945/jn.114.196436.
[18] ZHOU Z, LI X, LIU J X, DONG L, CHEN Q, LIU J L, KONG H H,ZHANG Q Y, QI X, HOU D X, ZHANG L, ZHANG G Q, LIU Y C, ZHANG Y J, LI J, WANG J, CHEN X, WANG H, ZHANG J F,CHEN H L, ZEN K, ZHANG C Y. Honeysuckle-encoded atypical microRNA2911 directly targets influenza A viruses[J]. Cell Research, 2015, 25(1): 39-49. doi:10.1038/cr.2014.130.
[19] TENG Y, REN Y, SAYED M, HU X, LEI C, KUMAR A, HUTCHINS E,MU J, DENG Z, LUO C, SUNDARAM K, SRIWASTVA M K, ZHANG L,HSIEH M, REIMAN R, HARIBABU B, YAN J, JALA V R, MILLER D M, VAN KEUREN-JENSEN K, MERCHANT M L, MCCLAIN C J, PARK J W, EGILMEZ N K, ZHANG H G. Plant-derived exosomal microRNAs shape the gut microbiota[J]. Cell Host Microbe, 2018, 24(5): 637-652. doi:10.1016/j.chom.2018.10.001.
[20] DING M, WANG C, LU X, ZHANG C, ZHOU Z, CHEN X, ZHANG C Y, ZEN K, ZHANG C. Comparison of commercial exosome isolation kits for circulating exosomal microRNA profiling[J]. Analytical and Bioanalytical Chemistry, 2018, 410(16): 3805-3814. doi:10.1007/s00216-018-1052-4.
[21] CARADEC J, KHARMATE G, HOSSEINI-BEHESHTI E, ADOMAT H, GLEAVE M, GUNS E. Reproducibility and efficiency of serumderived exosome extraction methods[J]. Clinical Biochemistry, 2014,47(13/14): 1286-1292. doi:10.1016/j.clinbiochem.2014.06.011.
[22] ALVAREZ M L, KHOSROHEIDARI M, KANCHI R R, DISTEFANO J K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers[J]. Kidney International, 2012, 82(9): 1024-1032.doi:10.1038/ki.2012.256.
[23] YAMADA T, INOSHIMA Y, MATSUDA T, ISHIGURO N. Comparison of methods for isolating exosomes from bovine milk[J]. The Journal of Veterinary Medical Science, 2012, 74(11): 1523-1525. doi:10.1292/jvms.12-0032.
[24] MACIAS M, REBMANN V, MATEOS B, VARO N, PEREZ-GRACIA J L, ALEGRE E, GONZALEZ A. Comparison of six commercial serum exosome isolation methods suitable for clinical laboratories. Effect in cytokine analysis[J]. Clinical Chemistry and Laboratory Medicine,2019, 57(10): 1539-1545. doi:10.1515/cclm-2018-1297.
[25] DOYLE L M, WANG M Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis[J]. Cells, 2019(7): 1-24. doi:10.3390/cells8070727.
[26] ZAROVNI N, CORRADO A, GUAZZI P, ZOCCO D, LARI E,RADANO G, MUHHINA J, FONDELLI C, GAVRILOVA J, CHIESI A. Integrated isolation and quantitative analysis of exosome shuttled proteins and nucleic acids using immunocapture approaches[J].Methods, 2015, 87: 46-58. doi:10.1016/j.ymeth.2015.05.028.
[27] GALLART-PALAU X, SERRA A, SZE S K. Enrichment of extracellular vesicles from tissues of the central nervous system by PROSPR[J]. Molecular Neurodegeneration, 2016, 11(1): 1-13.doi:10.1186/s13024-016-0108-1.
[28] VELLA L J, SCICLUNA B J, CHENG L, BAWDEN E G, MASTERS C L, ANG C S, WILLAMSON N, MCLEAN C, BARNHAM K J, HILL A F. A rigorous method to enrich for exosomes from brain tissue[J].Journal of Extracellular Vesicles, 2017, 6(1): 1348885. doi:10.1080/20013078.2017.1348885.
[29] ZHANG Y, YU M, DAI M, CHEN C, TANG Q, JING W, WANG H,TIAN W. miR-450a-5p within rat adipose tissue exosome-like vesicles promotes adipogenic differentiation by targeting WISP2[J]. Journal of Cell Science, 2017, 130(6): 1158-1168. doi:10.1242/jcs.197764.
[30] CRESCITELLI R, LÄSSER C, JANG S C, CVJETKOVIC A,MALMHÄLL C, KARIMI N, HÖÖG J L, JOHANSSON I, FUCHS J, THORSELL A, GHO Y S, OLOFSSON BAGGE R, LÖTVALL J. Subpopulations of extracellular vesicles from human metastatic melanoma tissue identified by quantitative proteomics after optimized isolation[J]. Journal of Extracellular Vesicles, 2020, 9(1): 1-21. do i:10.1080/20013078.2020.1722433.
[31] ZIEREN R C, DONG L, PIERORAZIO P M, PIENTA K J, DE REIJKE T M, AMEND S R. Extracellular vesicle isolation from human renal cancer tissue[J]. Medical Oncology, 2020, 37(4): 1-11.doi:10.1007/s12032-020-1346-1.
[32] MARTIN C, PATEL M, WILLIAMS S, ARORA H, BRAWNER K,SIMS B. Human breast milk-derived exosomes attenuate cell death in intestinal epithelial cells[J]. Innate Immunity, 2018, 24(5): 278-284. doi:10.1177/1753425918785715.
[33] ELSHARKAWI F, ELSABAH M, SHABAYEK M, KHALED H. Urine and serum exosomes as novel biomarkers in detection of bladder cancer[J]. Asian Pacific Journal of Cancer Prevention, 2019, 20(7):2219-2224. doi:10.31557/APJCP.2019.20.7.2219.
[34] HELWA I, CAI J, DREWRY M D, ZIMMERMAN A, DINKINS M B, KHALED M L, SEREMWE M, DISMUKE W M, BIEBERICH E, STAMER W D, HAMRICK M W, LIU Y.A Comparative study of serum exosome isolation using differential ultracentrifugation and three commercial reagents[J]. PLoS One, 2017, 12(1): e170628.doi:10.1371/journal.pone.0170628.
[35] ROMAN-CANAL B, MOIOLA C P, GATIUS S, BONNIN S, RUIZMIRÓ M, GONZÁLEZ E, GONZÁLEZ-TALLADA X, LLORDELL I, HERNÁNDEZ I, PORCEL J M, GIL-MORENO A, FALCÓNPÉREZ J M, PONOMARENKO J, MATIAS-GUIU X, COLAS E. EV-associated miRNAs from peritoneal lavage are a source of biomarkers in endometrial cancer[J]. Cancers(Basel), 2019, 11(6): 1-15. doi 10.3390/CANCERS11060839.
[36] LOBB R J, BECKER M, WEN S W, WONG C S, WIEGMANS A P,LEIMGRUBER A, MOLLER A. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J]. Journal of Extracellular Vesicles, 2015, 4(1): 1-11. doi:10.3402/jev.v4.27031.
[37] TANG Y T, HUANG Y Y, ZHENG L, QIN S H, XU X P, AN T X, XU Y, WU Y S, HU X M, PING B H, WANG Q. Comparison of isolation methods of exosomes and exosomal RNA from cell culture medium and serum[J]. International Journal of Molecular Medicine, 2017, 40(3):834-844. doi:10.3892/ijmm.2017.3080.
[38] ROYO F, ZUNIGA-GARCIA P, SANCHEZ-MOSQUERA P, EGIA A, PEREZ A, LOIZAGA A, ARCEO R, LACASA I, RABADE A,ARRIETA E, BILBAO R, UNDA M, CARRACEDO A, FALCONPEREZ J M. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples[J]. Journal of Extracellular Vesicles, 2016, 5:1-11. doi:10.3402/jev.v5.29497.
[39] REKKER K, SAARE M, ROOST A M, KUBO A L, ZAROVNI N,CHIESI A, SALUMETS A, PETERS M. Comparison of serum exosome isolation methods for microRNA profiling[J]. Clinical Biochemistry,2014, 47(1-2): 135-138. doi:10.1016/j.clinbiochem.2013.10.020.