【研究意义】桉树(Eucalyptus)是原产澳大利亚的桃金娘科桉属植物的总称[1-2],20世纪80年代引种至我国后,已选育出巨尾桉、邓恩桉、大花序桉等速生、耐寒、大径材优良品种,是我国目前南方的主要速生用材林造林树种[3-5]。广西桉树种植面积居全国首位,其木材被广泛用于制浆造纸、人造板和纤维板等,特别是在造纸木浆生产中有着极重要地位[6-8]。【前人研究进展】在传统选育优良纸浆材品种的基础上,针对木质素合成途径中的关键基因,利用基因工程手段调控基因表达,进而改良木材品质是研究的热点[9-10]。CAD是木质素合成途径中最早被研究的酶类之一,催化木质素单体合成最后一步反应,被认为是木质素形成的标志,更是木质素合成过程中的关键酶和调控节点[11]。目前,已从多种植物中克隆了CAD基因,并利用正、反义抑制和过表达等多种方法在体外对其功能进行了研究[12-14]。在玉米bml突变株中,CAD活性下降60%~70%,木质素含量降低近80%,G木质素和S木质素含量也均有下降[15]。在亚麻中抑制CAD活性,木质素下降约40%,改变了细胞壁的结构,果胶和半纤维素含量降低,但纤维素水平没有发生变化[16]。【本研究切入点】尾叶桉GLU4无性系(Eucalyptus urophylla clone GLU4)是广西广泛种植的桉树良种,其木材纤维特性适宜制浆,是纸浆材首选树种。2014年起,广西林业科学研究院率先在尾叶桉良种GLU4的基础上开展了木质素合成调控的转基因技术研究,前期研究取得进展,在一系列木质素合成途径基因中,已锁定应用尾叶桉肉桂酰乙醇脱氢酶(Cinnamoyl alcohol dehydrogenase,CAD)转化烟草可抑制木质素合成[17-18]。上述对EuCAD基因研究中是使用基因全长序列构建RNA干扰载体,序列片段较长,载体构建和应用都不够便捷,且容易引发脱靶效应等风险。同时RNAi技术的优势之一,就是利用较短的干扰片段进行转录后调控,选取基因中的关键片段用于RNAi更为适宜。【拟解决的关键问题】本研究采用生物信息学工具对EuCAD基因进行序列分析,根据编码蛋白保守结构域的分布情况,选择EuCAD基因的部分序列构建小片段的RNA干扰抑制表达载体并转化植物,分析干扰片段对烟草CAD基因表达和木质素合成的调控效果,为桉树转基因研究提供技术参考。
1 材料与方法
1.1 试验材料
烟草无菌组培苗、DH5a菌株、农杆菌LBA4404菌株为广西优良用材林资源培育重点实验室保存。
ExTaq聚合酶、RNA LA PCR反转录试剂盒购于大连宝生物工程有限公司;限制性内切酶、T4 DNA 连接酶购于普洛麦格生物技术有限公司;SG Fast qPCR Master Mix(2×)购自上海生工生物公司;RNA prep Pure多糖多酚植物总RNA提取试剂盒、高效植物基因组提取试剂盒、普通DNA产物纯化试剂盒、Universal DNA 纯化回收试剂盒、离心柱型普通质粒小提试剂盒购于天根生化科技有限公司;琼脂糖、抗生素等常规试剂购于当地生化试剂公司。引物、序列合成及测序由上海生工生物公司完成。
1.2 试验方法
1.2.1 RNAi载体构建 利用Blastp、ProtParam、psipred、SWISS-MODEL等生物信息学软件对EuCAD基因序列进行分析,根据保守结构域的分布情况,选择一段同时涵盖NAD(P)结合位点、底物结合位点和Zn结合催化位点的序列用于构建RNAi载体。根据选定的序列,利用Vector NTI软件分析筛选出44 bp的片段,序列为5'-gaatttg ccacagtgacattcaccagatcaagaatgatcttggcgc-3'。利用上述片段以“尾尾相连”的方式设计成反向重复序列,并在两端附加XhoI酶切位点后,由上海生工生物公司合成序列,得到携带目标片段的克隆载体pUC57-RNAi。
利用XhoI酶消化pUC57-RNAi,通过凝胶电泳回收得到目标序列,同时利用XhoI酶消化pCAMBIA3301载体,同样经过凝胶电泳回收后,得到去除掉bar基因序列的载体骨架。将载体骨架与回收的目标序列连接,连接产物转化DH5a,应用载体上的测序引物3301-F(5'-CCCTTATCTGGGAACTACTCAC-3')、3301-R(5'-CGCTGAAATCACCAGTCTCTC-3')对转化子进行PCR鉴定,对可扩增得到目标长度片段的克隆进行测序。将测序结果与目标序列比对,序列一致的为构建成功的RNAi载体。RNAi载体构建成功后,常规方法导入农杆菌LBA4404中用于转化。
1.2.2 烟草转化植株培育 利用携带RNAi载体的农杆菌采用常规方法转化烟草,经过愈伤组织培养、芽再生培养阶段的抗生素筛选获得阳性再生芽。随机挑选阳性再生芽,对其进行编号并转入生根培养,每个芽编号为一个株系,获得的再生植株移栽后置于温室内培养。保留每个株系的组培继代芽,以备后续扩繁培养该株系转基因植株之用。
移栽培养60 d后,取叶片提取基因组总DNA。应用载体上的测序引物3301-F/3301-R,对转基因植株进行PCR鉴定,同时对长度相符的PCR扩增产物测序以验证插入的RNAi序列准确性。
从测序鉴定结果正确的转基因株系中随机挑选3个株系按照编号追溯其继代芽,经扩繁后培育转基因植株用于表型检测。
1.2.3 转基因烟草植株叶片CAD基因表达水平检测 利用Vector NTI软件针对内参基因烟草actin基因设计荧光定量引物actin-F(5'-CTG GAATCCATGAGACTACTTACAA-3')、actin-R(5'-AACCGCCACTGAGCACAATA-3')。 针 对目标基因烟草CAD(X62343.1)基因设计引物CAD-F(5'-GTATGGCACCAGAACAAGCAG-3')、CAD-R(5'-CCAATGCCTCTTGTCTCTTCTTAT-3')。
转基因烟草植株移栽培养240 d后,自茎尖向下第3节处取叶片,按试剂盒说明书提取RNA并反转录合成cDNA,用上述引物对CAD基因表达水平进行检测,每个株系选择3株用于试验。依据基因表达水平检测结果,对调控效果最明显的株系进行下一步的表型检测。
1.2.4 茎部木质部厚度分析 参试株系取3株温室培育270 d的烟草茎部顶端向下第4节和第6节处茎部组织,按常规方法制成石蜡切片并用番红-固绿法染色[19]。制好的切片用Nikon研究用光学显微镜进行观察,NIS-Elements软件拍照并测量茎部直径。测量时每个样品选取1张切片,在茎部截面的各个方向分别采集茎部直径数据和木质部厚度数据60个。
1.2.5 纤维素木质素含量测定 取温室培育270 d的烟草植株选择自顶端向下第3~10节茎部,去除叶片后65℃烘干24 h,粉碎后过0.425 mm筛,用于木质素和纤维素含量检测。木质素含量采用酸性洗涤方法测定,参照GB/T20808-2006执行。纤维素含量采用硝酸法测定[20]。参试株系取3株植株作为3个重复。
试验数据采用SPSS 19.0进行统计分析。
2 结果与分析
2.1 RNAi载体构建
pCAMBIA3301载体上的测序引物3301-F/3301-R分别位于XhoI酶切位点旁侧约50 bp处,XhoI酶切位点之间的bar基因序列在构建过程中被替换为目标序列,PCR产物长度从650 bp左右缩短至约200 bp。对转化菌落PCR鉴定结果(图1)显示,检测得到扩增出目标特异性条带的阳性克隆。对阳性克隆提取质粒测序后,结果显示插入序列与预期序列一致,RNAi载体构建成功,命名为pCAMBIA3301-RNAi。
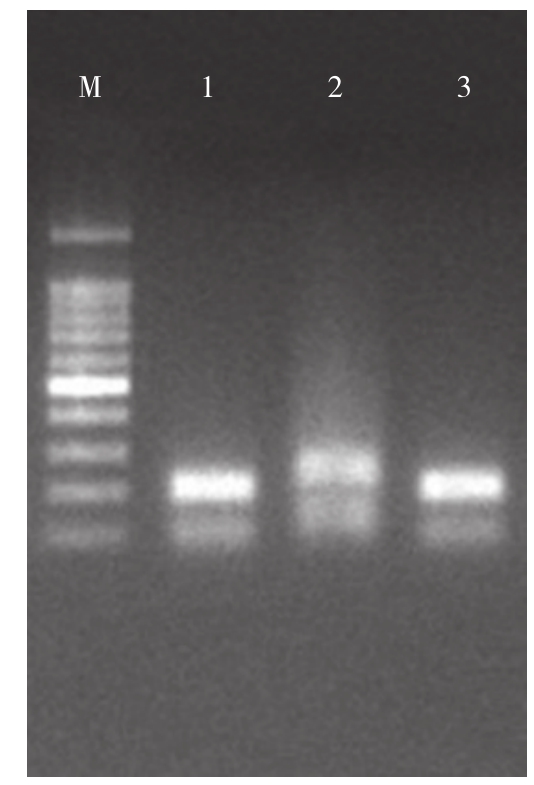
图1 RNAi载体构建的转化菌落PCR验证
Fig. 1 PCR validation of the transformed colony constructed by RNAi vector
M:RealBand DNA Marker(100~1 500 bp);1~3:pCAMBIA3301-RNAi转化菌落PCR扩增产物,其中1、3为阳性克隆
M: RealBand DNA Marker(100-1 500 bp); 1-3: PCR amplification products of colony transformed by the vector pCAMBIA3301-RNAi,1 and 3 were the positive clones
2.2 烟草转化植株培育
将重组载体pCAMBIA3301-RNAi采用农杆菌介导方法转化烟草,获得转基因烟草植株,取叶片提取基因组总DNA用测序引物3301-F/3301-R进行PCR鉴定。基因组上插入RNAi载体的转基因植株中可以检测到长度200 bp的特异性片段,而未整合RNAi载体的植株中则扩增不到目标条带。PCR鉴定结果显示获得了阳性植株(图2)。对阳性植株进一步进行PCR扩增产物测序,测序结果显示序列与目标RNAi序列一致的鉴定为转基因植株。试验共获得28个转基因株系,从中随机挑选3个命名为R1、R2、R3,用于表型检测。
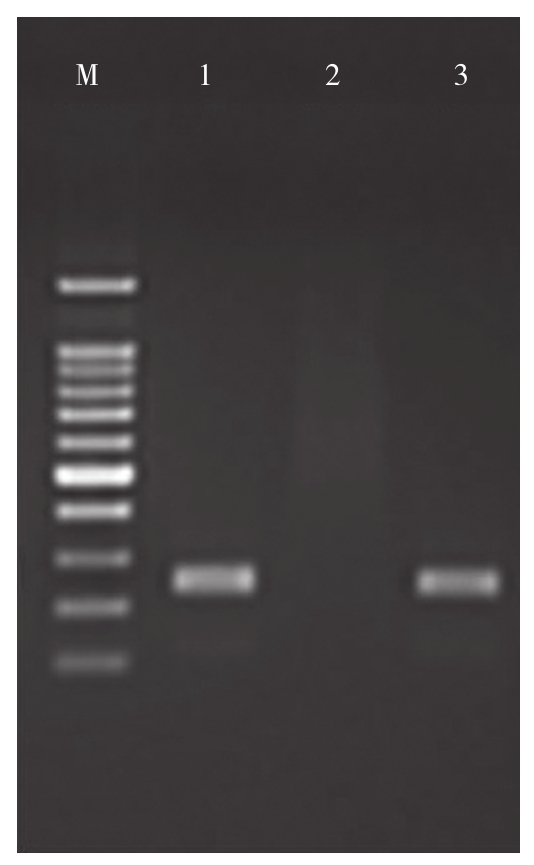
图2 烟草转化苗PCR验证
Fig. 2 PCR validation of transgenic tobacco seedling
M:RealBand DNA Marker(100~1 500 bp);1~3:pCAMBIA3301-RNAi载体转基因植株PCR鉴定结果,其中1、3为阳性植株
M:RealBand DNA Marker(100-1 500 bp); 1-3: PCR identification results of transgenic plants containing pCAMBIA3301-RNAi vector,1 and 3 were positive plants
2.3 转基因植株CAD基因表达水平检测
在GenBank上检索到烟草完整CAD基因(X62343.1),将其与RNAi片段所用的44 bp序列比对,两序列一致性达到66.7%,序列同源较高,推测其RNAi片段很可能对目标基因引发较强的抑制作用。
对获得的转基因烟草植株中CAD基因表达水平进行检测,结果显示3个转基因株系中CAD基因表达水平都较野生型呈现显著下降(图3),说明转入的RNAi片段如预期的引发了RNAi,抑制了CAD基因的表达。其中R2、R3株系中CAD基因表达分别较野生型降低67.93%和76.30%,R1株系中降幅最大、降低至野生型的12.51%,说明该株系中调控效果最为理想,进一步对其茎部结构和木质素含量等表型进行检测。
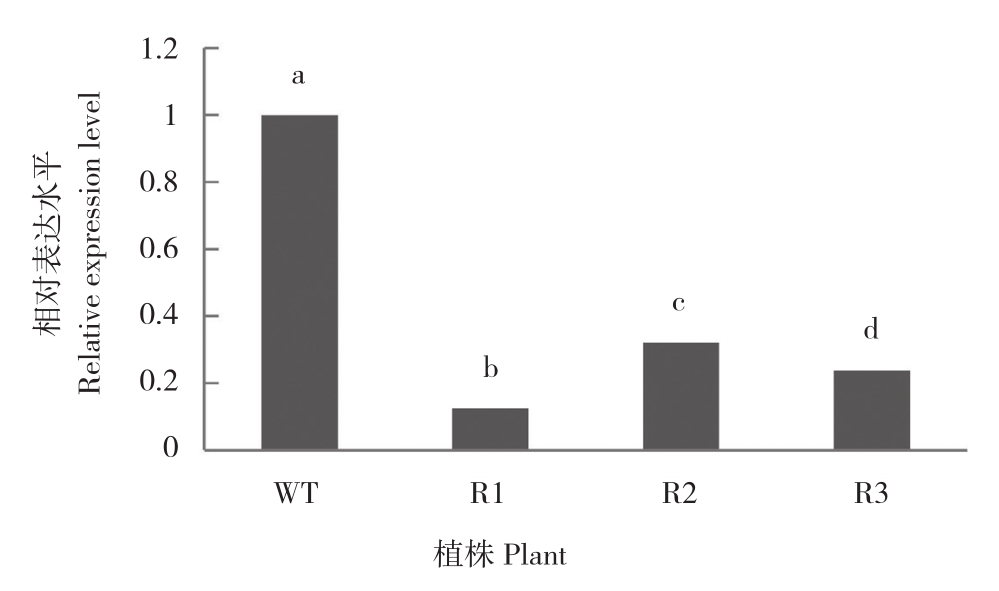
图3 转基因烟草中基因表达水平分析
Fig. 3 Analysis of gene expression level in transgenic tobacco
柱上小写英文字母不同者表示差异显著
Different lowercase letters on the bar represent significant differences
2.4 转基因植株茎部解剖结构分析
转基因植株生长状况与野生型无异,植株叶片伸展,茎干挺直,培养270 d后苗高达到1.6 m左右,能正常开花结实。为研究转入的RNAi片段是否影响烟草茎部结构的形成,选取转基因植株茎部第4节和第6节横切,制成石蜡切片并染色。从表1可知第4节和第6节处茎部直径,转基因株系和野生型之间无显著差异,说明转基因植株茎部的生长发育未受到显著影响。对第4节和第6节处茎部的木质部厚度测量结果显示,在第4节处转基因植株木质部厚度较野生型显著降低11.75%,在第6节处降幅缩小至10.06%。
表1 转化植株茎部直径、木质部厚度变化
Table 1 Changes in stem diameter and xylem thickness of transformed plants

注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
木质部厚度Xylem thickness(µm) 茎部直径Stem diameter(µm)第4节The 4th node植株编号Plant number 第6节The 6th node第4节The 4th node第6节The 6th node WT 320.91±14.10a 427.53±20.03a 6634.29±249.95a 8576.63±422.21a R1 283.21±10.80b 384.53±15.55b 6247.00±718.03a 8357.81±307.51a
2.5 纤维素木质素含量测定
对转基因植株茎部组织中木质素含量和纤维素含量进行检测,结果(表2)显示,转基因植株中木质素含量与木质部厚度变化趋势相一致,较野生型显著降低15.26%,说明转入的RNAi片段起到了定向调控木质素合成的调控效果。但转基因植株中纤维素含量并未如预期中呈现补偿性的增加,反而较野生型显著降低10.61%。
表2 转基因烟草中木质素、纤维素含量
Table 2 Lignin and cellulose contents in transgenic tobacco

注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
纤维素含量Cellulose content(%)WT 13.37±0.04 a 35.16±0.03 a R1 11.33±0.03 b 31.43±0.01 b植株编号Plant number木质素含量Lignin content(%)
3 讨论
在对目标基因序列不甚了解时,进行RNAi通常使用基因全长序列构建RNAi载体,这种常规的研究策略在许多植物中取得了较好的研究结果,但也有研究者提出,干扰片段过长,自身复制过程中碱基错配几率更高,同时较长的序列更容易与其他非目标基因序列匹配,脱靶风险更高[21]。若想选择目标基因的部分小片段用于RNAi,所选择片段的位置至关重要。Holen等[22]针对目标基因的不同位置设计4条RNAi片段用于研究,结果发现了一种可能的位置效应;张斌等[23]对OsPUT1基因的RNA干扰研究也提出类似的位置效应。由此可推断,针对目标基因选择RNA干扰片段时,片段在基因CDS中的位置应当谨慎选择。
鉴于CAD蛋白在木质素合成中的重要功能,在许多植物中都对其进行了基因克隆和功能研究[24-26],到目前为止NCBI已收录2 428条陆生植物CAD蛋白序列。不同植物中的CAD具有高度的同源性,对CAD蛋白序列比对分析发现,几乎所有CAD都具有两类典型的保守的结构域:第一类是辅酶和底物结合结构域,包括NAD(P)结合位点、底物结合位点;第二类是酶活性中心结构域,包括Zn结合催化位点和Zn结合结构位点[27]。本研究所选序列从其编码蛋白的结构域来看,该段序列编码蛋白兼具辅酶、底物结合结构域和酶催化结构域,对CAD酶的催化活性影响较大。从基因序列位置分析,所选片段近于转录翻译的起始端,倘若RNA干扰在此处发生,CAD酶几乎无法转录或翻译,对酶活性的抑制也将更为明显。在将RNAi片段转化烟草后,发现片段对木质素的调控效果较为理想,从基因表达水平到木质素含量和木质部厚度均较野生型显著降低,试验结果与预期相一致,说明所选序列为比较理想的RNAi片段。
研究中还发现,植物茎部结构特点是从上到下木质化程度逐渐提高,而在转基因植株中,随着木质化程度的提高,茎部木质部厚度较野生型的降幅却有所降低,通过抑制CAD基因表达调控木质素合成的效果却逐渐弱化。推测造成这种变化的原因可能在于CAD对木质素合成的调控主要发生在木质化初期,在木质化中后期,这种调控效果被其他代谢通路中的基因应答作用而掩盖。同时,通过数据分析发现,转基因植株中木质部厚度的降幅均在10%左右,降幅较低,较小的降幅可能在木质化过程中被逐渐积累的木质部厚度稀释,造成降幅差异逐渐不显著。对此在后续研究中可尝试使用底物标记等手段,分阶段解读木质化过程,有望深入揭示抑制CAD基因调控木质素合成的生理生化机制。
4 结论
本研究选择了一段同时包含NAD(P)结合位点、底物结合位点和Zn结合催化位点的CAD基因片段用于构建RNAi载体。结果表明,在将RNAi片段转化烟草后,转基因植株茎部直径与生长发育与野生型无异,植株中CAD基因表达水平显著降低,植株茎部木质素含量与木质部厚度均较野生型降低10%以上。本研究结果可为下一步桉树木质素合成调控研究提供技术参考。
[1] 张荣贵,李思广,蒋云东.云南的桉树引种及对其发展状况的剖析[J]. 西部林业科学,2007(3):97-102. doi:10.3969/j.issn.1672-8246.2007.03.020.ZHANG R G, LI S G, JIANG Y D. Introduction of Eucalyptus in Yunnan and analysis on development status[J]. Journal of West China Forestry Science, 2007(3):97-102. doi:10.3969/j.issn.1672-8246.2007.03.020.
[2] 项东云,陈健波,叶露,申文辉.广西桉树人工林发展现状、问题与对 策[J]. 广西林业科学,2006(4):195-201. doi:10.3969/j.issn.1006-1126.2006.04.005.XIANG D Y, CHEN J B, YE L, SHEN W H. Status, problems and strategies of Eucalyptus plantations developing in Guangxi[J].Guangxi Forestry Science, 2006(4):195-201. doi:10.3969/j.issn.1006-1126.2006.04.005.
[3] 汤珧华,李志辉.耐寒性桉树早期选择I.耐寒性桉树早期选择研究综述[J]. 中南林学院学报,2000(3):70-74. doi:10.3969/j.issn.1673-923X.2000.03.013.TANG Y H, LI Z H. Early selection in cold-resistant Eucalyptus I.Researching summaries on early selection in cold-resistant Eucalyptus[J]. Journal of Central South Forestry University, 2000(3):70-74.doi:10.3969/j.issn.1673-923X.2000.03.013.
[4] 莫继有,严理,王建忠,秦武明,韦炳俭.广西29年生大花序桉生长规律及模型探究[J]. 湖北农业科学,2020,59(4):91-97.doi:10.14088/j.cnki.issn0439-8114.2020.04.019.MO J Y, YAN L, WANG J Z, QIN W M, WEI B J. Study on growth rhythm and regression model of 29 years Eucalyptus cloeziana in Guangxi[J]. Hubei Agricultural Sciences, 2020,59(4):91-97.doi:10.14088/j.cnki.issn0439-8114.2020.04.019.
[5] 温远光,张祖峰,周晓果,朱宏光,王磊,蔡道雄,贾宏炎,明安刚,卢立华.珍贵乡土树种与桉树混交对生态系统生物量和碳储量的影响[J]. 广西科学,2020,27(2):111-119. doi:10.13656/j.cnki.gxkx.20200421.005.WEN Y G, ZHANG Z F, ZHOU X G, ZHU H G, WANG L, CAI D X,JIA H Y, MING A G, LU L H. Effects of mixing precious indigenous tree species and Eucalyptus on ecosystem biomass and carbon stocks[J]. Guangxi Sciences, 2020,27(2):111-119. doi:10.13656/j.cnki.gxkx.20200421.005.
[6] 熊涛,潘雅琪,黄全,刘衡,李顺永,符韵林. 5年生大花序桉生材性质研究[J]. 陕西林业科技,2020,48(1):15-18.XIONG T, PAN Y Q, HUANG Q, LIU H, LI Y S, FU Y L. Green wood properties of Eucalyptus cloeziana at age of five[J]. Shaanxi Forest Science and Technology, 2020,48(1):15-18.
[7] 李方平,高岚.桉树人工林经济效益的影响因素分析[J]. 广东农业科学,2014,41(13):205-208. doi:10.16768/j.issn.1004-874X.2014.13.043.LI F P, GAO L. Analysis on factors influencing economic benefits of eucalyptus plantation[J]. Guangdong Agricultural Sciences, 2014,41(13):205-208. doi:10.16768/j.issn.1004-874X.2014.13.043.
[8] 杜雨菲,吴保国,陈玉玲.基于机器学习算法的广西桉树适宜性研究[J]. 浙江农林大学学报,2020,37(1):122-128. doi:10.11833/j.issn.2095-0756.2020.01.016.DU Y F, WU B G, CHEN Y L. Eucalyptus suitability in Guangxi based on machine learning algorithms[J]. Journal of Zhejiang A&F University, 2020,37(1):122-128. doi:10.11833/j.issn.2095-0756.2020.01.016.
[9] 朱玲,贾昌路,张锐.木质素生物合成及其关键酶基因的研究进展[J]. 塔里木大学学报,2016,28(3):128-136. doi:10.3969/j.issn.1009-0568.2016.03.022.ZHU L, JIA C L, ZHANG R. The research progress of lignin biosynthesis and its key enzymes[J]. Journal of Tarim University,2016,28(3):128-136. doi:10.3969/j.issn.1009-0568.2016.03.022.
[10] 陈雪,陈雪梅,盖颖.毛白杨阿魏酸-5-羟基化酶对烟草木质素的影响[J]. 广东农业科学,2015,42(11):42-47. doi:10.16768/j.issn.1004-874X.2015.11.009.CHEN X, CHEN X M, GAI Y. Lignin biosynthesis in tobacco with regulated expression of poplar ferulate 5-hydroxylase[J]. Guangdong Agricultural Sciences, 2015,42(11):42-47. doi:10.16768/j.issn.1004-874X.2015.11.009.
[11] RALF M,DIANE S,LORELLE P,HEATHER F,ARMIN W. Gene silencing of cinnamyl alcohol dehydrogenase in Pinusradiata callus cultures[J]. Plant Physiology Biochemistry, 2005, 43(12): 1061-1066. doi:10.1016/j.plaphy.2005.11.001.
[12] MARTA P, ANNA K, JACEK Z, LUCYNA D, JERZY H,MALGORZATA A, MICHAL S, JAN S. Manipulating cinnamyl alcohol dehydrogenase(CAD)expression in flax affects fibre composition and properties[J]. BMC Plant Biology, 2014, 14:50-67.doi:10.1186/1471-2229-14-50.
[13] 韩伯涛,盖颖,蒋湘宁.正义、反义、干涉调控肉桂酰辅酶A脱氢酶基因对烟草的影响[J]. 广东农业科学,2013,40(11):140-144,156.doi:10.16768/j.issn.1004-874X.2013.11.039.HAN B T, GAI Y, JIANG X N. Regulation of cinnamoyl-CoA reductase by sense,antisense and RNAi method to tobacco[J]. Guangdong Agricultural Sciences, 2013,40(11):140-144,156. doi:10.16768/j.issn.1004-874X.2013.11.039.
[14] RALPH J, MACKAY J J, HATFIELD R D, O'MALLEY D M,WHETTEN R W, SEDEROFF R R. Abnormal lignin in a loblolly pine mutant[J]. Science, 1997,277(5323):235-239. doi:10.1126/science.277.5323.235.
[15] HALPIN C, HOLT K, CHOJECKI J, OLIVER D, CHABBERT B,MONTIES B, EDWARDS K, BARAKATE A, FOXON G A. Brownmidrib maize(bm1)--a mutation affecting the cinnamyl alcohol dehydrogenase gene[J]. The Plant Journal, 1998,14(5):545-553.doi:10.1046/j.1365-313x.1998.00153.x.
[16] WRÓBEL-KWIATKOWSKA M, STARZYCKI M, ZEBROWSKI J, OSZMIAŃSKI J, SZOPA J. Lignin deficiency in transgenic flax resulted in plants with improved mechanical properties[J].Journal of Biotechnology, 2007,128(4):919-934. doi:10.1016/j.jbiotec.2006.12.030.
[17] 陈博雯,蒋华,覃鹏飞,姜伟.尾叶桉GLU4无性系肉桂酰乙醇脱氢酶基因克隆及序列分析[J]. 西部林业科学,2014,43(2):19-24.doi:10.16473/j.cnki.xblykx1972.2014.02.012.CHEN B W, JIANG H, QIN P F, JIANG W. Cloning and prokaryotic expression of cinnamyl alcohol dehydrogenase of Eucalyptus urophylla clone GLU4[J]. Journal of West China Forestry Science, 2014,43(2):19-24. doi:10.16473/j.cnki.xblykx1972.2014.02.012.
[18] CHEN B W, XIAO Y F, LI J J, LIU H L, QIN Z H, GAI Y, JIANG X N. Identification of the CAD gene from Eucalyptus urophylla GLU4 and its functional analysis in transgenic tobacco[J]. Genetics and Molecular Research, 2016,15(4). doi:10.4238/gmr15049062.
[19] 肖玉菲,袁剑英,刘海龙,刘雄盛,晏巢,陈博雯.桉树4个无性系茎部差异分析[J]. 中南林业科技大学学报,2017,37(10):61-66,74.doi:10.14067/j.cnki.1673-923x.2017.10.010.XIAO Y F, YUAN J Y, LIU H L, LIU X S,YAN C, CHEN B W.Difference analysis on stem section of four Eucalyptus clones[J].Journal of Central South Forestry University, 2017, 37(10):61-66,74.doi:10.14067/j.cnki.1673-923x.2017.10.010.
[20] 王林风,程远超. 硝酸乙醇法测定纤维素含量[J]. 化学研究,2011, 22(4):52-55.WANG L F, CHENG C Y. Determination the content of cellulose by nitric acid-ethanol method[J]. Chemical Research, 2011, 22(4):52-55.
[21] WANG L, ZHENG J, LUO Y Z, XU T, ZHANG Q X, ZHANG L, XU M Y, WAN J M, WANG M B, ZHANG C Y, FAN Y L. Construction of a genomewide RNAi mutant library in rice[J]. Plant Biotechnology Journal, 2013,11(8):997-1005. doi:10.1111/pbi.12093.
[22] HOLEN T, AMARZGUIOUI M, WIIGER M T, BABAIE E, PRYDZ H. Positional effects of short interfering RNAs targeting the human coagulation trigger tissue factor[J]. Nucleic Acids Research, 2002,30(8):1757-1766. doi:10.1093/nar/30.8.1757.
[23] 张斌,刘询,耿雅楠,阮颖.OsPUT1基因三个不同位置的RNA干扰效果[J]. 分子植物育种,2017,15(2):559-564. doi:10.13271/j.mpb.015.000559.ZHANG B, LIU X, GENG Y N, RUAN Y. The effect of RNAi on three different positions of OsPUT1 gene[J]. Molecular Plant Breeding,2017,15(2):559-564. doi:10.13271/j.mpb.015.000559.
[24] 张春红,熊振豪,吴文龙,李维林.黑莓果实发育成熟期木质素合成CAD酶及其基因表达[J]. 南京林业大学学报(自然科学版),2019,43(1):141-148. doi:10.3969/j.issn.1000-2006.201805004.ZHANG C H, XIONG Z H, WU W L, LI W L. CAD enzyme activity and gene expression in connection with lignin synthesis during fruit development and ripening process of blackberry[J]. Journal of Nanjing Forestry University(Natural Science Edition),2019,43(1):141-148. doi:10.3969/j.issn.1000-2006.201805004.
[25] 朱金鑫,孙金金,原晓龙,王娟,杨宇明,王毅.巴拉圭瓜多竹CAD 基因的克隆与分析[J]. 西部林业科学,2017,46(1):6-11,16.doi:10.16473/j.cnki.xblykx1972.2017.01.002.ZHU J X, SUN J J, YUAN X L, WANG J, YANG Y M, WANG Y.Cloning and sequence analysis of cinnamoyl alcohol dehydrogenase gene from Guadua paraguayana[J]. Journal of West China Forestry Science, 2017,46(1):6-11,16. doi:10.16473/j.cnki.xblykx1972.2017.01.002.
[26] 张经博,李波,杨洋,胡文冉,陈方圆,谢丽霞,范玲.陆地棉CAD基因家族的进化和表达分析[J]. 新疆农业科学,2016,53(7):1177-1187.doi:10.6048/j.issn.1001-4330.2016.07.001.ZHANG J B, LI B, YANG Y, HU W R, CHEN F Y, XIE L X, FAN L.Genomi-wide investigation and expression analysis of CAD gene family in Gossypium hirsutum[J]. Xinjiang Agricultural Sciences, 2016,53(7):1177-1187. doi:10.6048/j.issn.1001-4330.2016.07.001.
[27] SCHUBERT R , SPERISEN C, MÜLLER-STARCK G, SCALA L S,ERNST D, SANDERMANN H, HÄGER K P. The cinnamyl alcohol dehydrogenase gene structure in Picea abies(L.)Karst.: genomic sequences, Southern hybridization, genetic analysis and phylogenetic relationships[J]. Trees, 1998, 12(8):453-463. doi:10.1007/pl00009728.