【研究意义】当归(Angelica sinensis)为常用中药材,属中医妇科用药,是补血活血、去瘀生新、润肠通便、调经止痛的良好药物[1-2]。当归主产甘肃、陕西、云南和四川,有效成分为阿魏酸[3]、多糖、挥发油等,阿魏酸具有清除自由基的作用,能抑制血小板聚集和血栓形成[4]。甘肃当归产量最大、质量最好,栽培历史最为悠久[5]。甘肃当归正常年产量约1万t左右,占全国年产量95%以上,是当地最具优势的特色药材之一[6]。甘肃当归的主产区在岷县,还有周边的渭源县、康乐县、卓尼县、宕昌县。随着当归需求量日益增加,大量种植造成连作面积不断提高,多年连作导致当归生长发育不良,产品品质及产量下降,抗病能力降低,土壤环境逐年恶化,根病加重[7]。而导致土壤环境恶化的原因是连作使部分土壤养分异常积累,另一部分养分过度消耗,病原微生物迅速繁衍,土壤微生物种群结构失调,引发作物品质及产量下降[8-10]。有些生物有机肥所含的微生物对病菌有抑制作用。【前人研究进展】微生物菌剂和生物有机肥已应用在多种作物上,施用生物有机肥(菌肥)可有效改善土壤性质、提高土壤养分,通过增加根系活力、提高作物对营养元素的吸收利用使作物增产或提高抗病性[11]。微生物菌剂和有机肥在当今农业生产中越来越受重视,生物肥料在设施蔬菜[13]、马铃薯[14]、玉米[15]、水稻[16]、果树[17]等多种作物上都有显著增产效果,促进作物对养分的吸收,增强作物的抗病性。用于生产生物肥料的菌种种类很多,据不完全统计,已发现包括假单胞菌和芽胞杆菌等20多个属的根围细菌具有防病促生潜能[12]。但针对当归的专用抗病促生生物肥料较少。【本研究切入点】抗病型生物肥料DZF-363是由抗病菌株DG-16-2、DG-23复合而成。DG-16-2、DG-23是从当归根际分离的具有抑制镰刀菌等病原微生物生长的拮抗菌株,对当归有显著促生效果。【拟解决的关键问题】为探明生物肥料DZF-363的作用机理,进行了生物肥料在当归上的盆栽试验,以期为肥料的推广和当归安全生产提供理论依据。
1 材料与方法
1.1 试验材料
生物肥料DZF-363由甘肃省农业科学院土壤肥料与节水农业研究所微生物研究室提供,含有机质442 g/kg、全氮10.82 g/kg、全磷5.1 g/kg、全钾12.3 g/kg、全盐17.22 g/kg、pH7.5、两种菌(壁芽孢杆菌Bacillus muralis DG-23和油菜假单胞菌Pseudomonas brassicacearum DG-16-2)的活菌数均≥2.5×108 cfu/g。
1.2 试验方法
试验设施用载体10 g/盆、生物肥料DZF-363 10 g/盆和空白对照3个处理,每个处理8次重复。
试验在甘肃省农业科学院温室大棚进行,采用塑料花盆,每盆装土750 g、蛭石粉150 g。移栽前将土样750 g与150 g蛭石粉、10 g生物肥料(或载体)充分混匀后装盆。移栽前灌水按基质重的35%计,即每盆灌水375 mL。每个处理装盆10盆,当归每盆移栽2株,生长30 d后每处理选择长势良好的8盆作为重复,定植1株,生长90 d后收获,测定当归地上部、地下部鲜重和干重;取新鲜土壤过1 mm筛进行土壤脲酶、磷酸酶活性及微生物群落多样性测定。试验于2019年3月23日移栽,4月25日定苗,7月29日收获。
当归植株的收获及土样取样:将当归与土全部从花盆倒出,把周围土抖落,将根上的土抖到牛皮纸上,植株装入塑料袋中,土样每两盆混合均匀装入1个自封袋中。将根冲洗干净后用纸吸干水,进行称重;植株进行株高、根长、根粗测量,风干后分别称地上部和根干重。
土壤中可培养的微生物(细菌、真菌、放线菌)采用稀释平板法测定;土壤脲酶活性测定采用靛酚比色法,磷酸酶活性测定采用磷酸苯二钠比色法[18]。
土壤微生物群落碳代谢多样性采用Biolog-MicroPlate方法进行[19-20]:称取10 g新鲜土壤加入装有90 mL无菌生理盐水锥形瓶中(0.85%NaCl溶液)。摇床振荡30 min,静置30 min,取上清液5 mL加入到45 mL无菌生理盐水中,稍加振荡后倒入V型接种槽,用八道移液器接种到Biolog Eco微平板,每个孔接种150 μL,25℃培养192 h,每24 h读数1次,将OD值导出,用590 nm的OD值减去750 nmOD值的差值计算平均颜色变化率、丰富度等。
(1)平均颜色变化率(average well color development,AWCD),表示微生物群落的碳源代谢强度,是土壤微生物活性及功能多样性的一个重要指标[21-22]。采用各Eco-MicroPlate吸光值数据计算:
式中,Ci为除对照孔外各孔590 nm的OD值减去750 nm的OD值差,R为对照孔590 nm的OD值减去750 nm的OD值的差,n为31种碳源。
(2)Shannon-Wiener物种丰富度指数(H’),用于评估群落的物种丰富度:
式中,Pi为不同碳源的微孔和对照孔吸光值的差值与整个微板总体差值之和的比值:
式中,Ci为每个微板孔590 nm的OD值减去750 nm的OD值差,R为对照孔590 nm的OD值减去750 nm的OD值的差,n为31种碳源。
(3)McIntosh物种均一度指数(U)。
式中,ni为第i反应孔与对照孔的差值(ni=Ci-R)。
(4)辛普森指数又称优势度指数(D),是对多样性方面的集中性度量。
试验数据采用Microsoft Excel 2003进行处理,采用DPS统计软件进行差异显著性分析。
2 结果与分析
2.1 生物肥料对当归生长的影响
表1结果显示,施用生物肥料和载体处理对当归根生长都有显著促进作用,尤其是对当归根干重、芦头直径有显著促进作用。与对照相比,施用生物肥料后当归的根干重、芦头直径分别增加100.5%、31.39%,施用载体处理当归的根干重、芦头直径分别增加28.1%、10.31%,差异显著。
表1 不同处理对当归生长的影响
Table 1 Effects of different treatments on the growth of A. sinensis
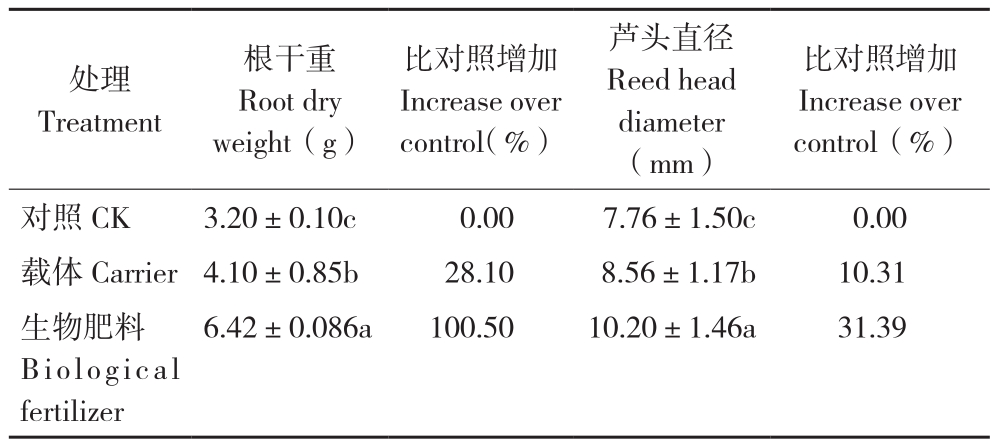
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
比对照增加Increase over control(%)对照CK 3.20±0.10c 0.00 7.76±1.50c 0.00载体Carrier4.10±0.85b 28.10 8.56±1.17b 10.31生物肥料Biological fertilizer处理Treatment根干重Root dry weight(g)比对照增加Increase over control(%)芦头直径Reed head diameter(mm)6.42±0.086a 100.50 10.20±1.46a 31.39
2.2 生物肥料对当归根际土壤微生物数量的影响
试验结果(表2)表明,在当归根际施用生物肥料可以显著增加根际土壤细菌、真菌、防线菌数量。与对照相比,生物肥料处理细菌、真菌、放线菌分别增加154%、21.6%、34.7%,差异显著,载体处理分别增加78%、20.1%、6.5%;生物肥料处理与载体处理相比,细菌、真菌、放线菌分别增加42.6%、1.27%、26.5%。说明生物肥料中的有机物料能显著增加土壤中细菌和真菌数量,而菌剂的加入使土壤细菌和放线菌的数量大幅度提高。
细菌与放线菌之和与真菌数量的比值是土壤微生物区系结构的重要特征指标[23]。通过细菌和放线菌数量之和与真菌数量的比值分析土壤中微生物的群落结构,从表2可以看出,使用生物肥料可以显著改变当归根际土壤微生物的群落结构。与对照和载体处理相比,生物肥料处理的比值分别增加92.6%、39.2%,说明施用生物肥料可以显著改变当归根际土壤微生物的群落结构。
2.3 生物肥料对当归根际土壤脲酶和磷酸酶活性的影响
2.3.1 对土壤脲酶活性的影响 土壤酶是表征土壤中物质、能量代谢旺盛程度和土壤质量水平的一个重要生物指标[24]。表3显示,在当归根际施用生物肥料能够显著增加土壤脲酶活性。与对照相比,生物肥料处理的脲酶活性增加46.9%,与载体处理相比增加9.09%,差异显著。
2.3.2 对土壤磷酸酶活性的影响 磷酸酶可以加速有机磷的脱磷速度,积累的磷酸酶对土壤磷素的有效性具有重要作用[25]。表3结果表明,与对照相比,生物肥料处理土壤酸性磷酸酶、碱性磷酸酶活性分别增加19.9%、43%,差异显著;与载体处理相比,分别增加9.66%、8.51%。
2.4 生物肥料对土壤微生物功能多样性影响
2.4.1 对土壤微生物平均颜色变化率(AWCD)的影响 AWCD反映土壤微生物的整体活性[26],可作为土壤微生物活性的有效指标[19,27],不同施肥处理土壤的AWCD分析结果见图1。由图1可知,不同施肥处理土壤微生物AWCD的总体变化趋势随着时间延长而逐渐提高,在培养24~120 h期间,曲线斜率最大,AWCD增长率最高,表明此阶段土壤微生物碳源代谢活性最高。不同处理间相比,施生物肥料处理AWCD值高于载体处理和对照,可见,施用生物肥料能提高土壤微生物代谢活性。
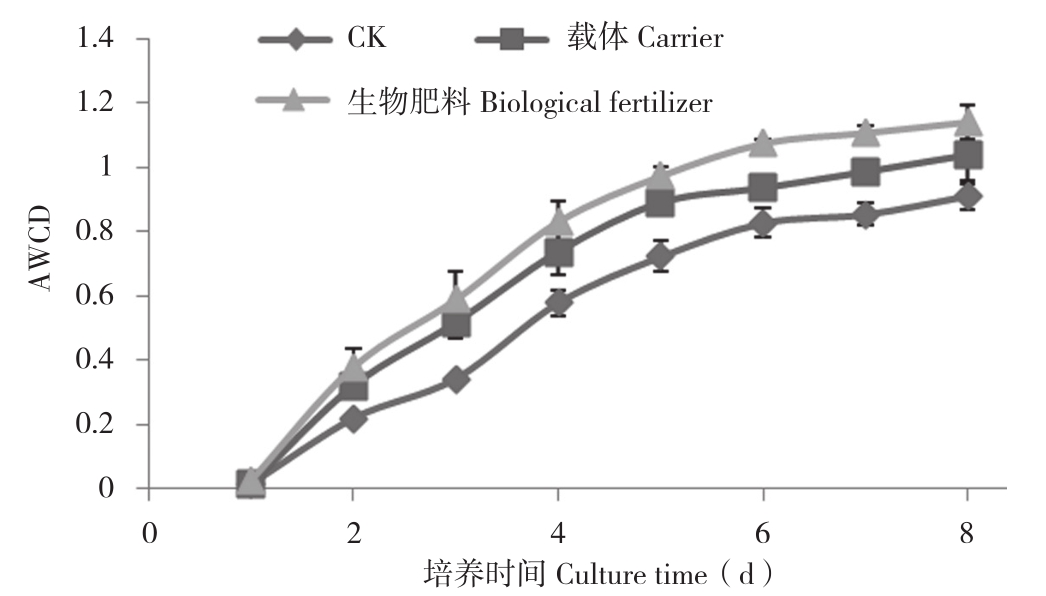
图1 不同处理对土壤微生物AWCD的影响
Fig. 1 Effects of different treatments on soil microganism AWCD
2.4.2 对土壤微生物群落功能多样性指数的影响 通过计算培养120 h时的Shannon-Wiener物种丰富度指数(H')、McIntosh物种均一度指数(U)、物种优势度指数(D)来表征土壤微生物群落代谢功能多样性[28-29]。表4结果表明,在当归根际施用生物肥料后,土壤中微生物群落功能多样性指数的变化趋势与微生物利用单一碳源能力的趋势基本一致,都是生物肥料处理最高,载体处理次之,对照最小。与对照相比,物种丰富度指数、均一度指数分别增加40.2%、6.6%;与载体处理相比,分别增加25.5%、1.6%;物种优势度指数(Sinpson)不同处理间基本无影响。说明施用生物肥料可以提高当归根际土壤微生物丰富度指数和物种均一度指数,对物种优势度指数基本无影响。
表2 不同处理对当归根际土壤微生物数量的影响
Table 2 Effects of different treatments on number of microorganisms in rhizosphere soil of A. sinensis
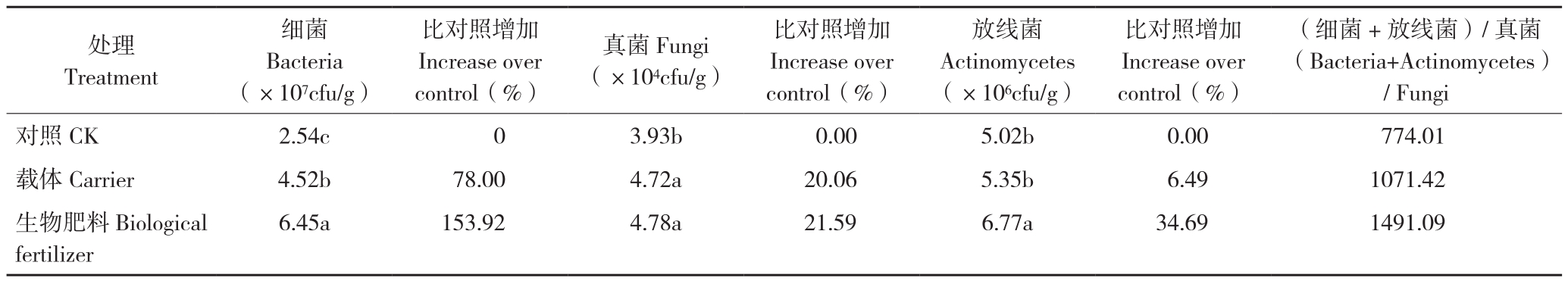
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
(细菌+放线菌)/真菌(Bacteria+Actinomycetes)/ Fungi对照CK 2.54c 0 3.93b 0.00 5.02b 0.00 774.01载体Carrier 4.52b 78.00 4.72a 20.06 5.35b 6.49 1071.42生物肥料Biological fertilizer处理Treatment细菌Bacteria(×107cfu/g)比对照增加Increase over control(%)真菌Fungi(×104cfu/g)比对照增加Increase over control(%)放线菌Actinomycetes(×106cfu/g)比对照增加Increase over control(%)6.45a 153.92 4.78a 21.59 6.77a 34.69 1491.09
表3 不同处理对当归根际土壤酶活性的影响
Table 3 Effects of different treatments on enzyme activity in rhizosphere soil of A. sinensis
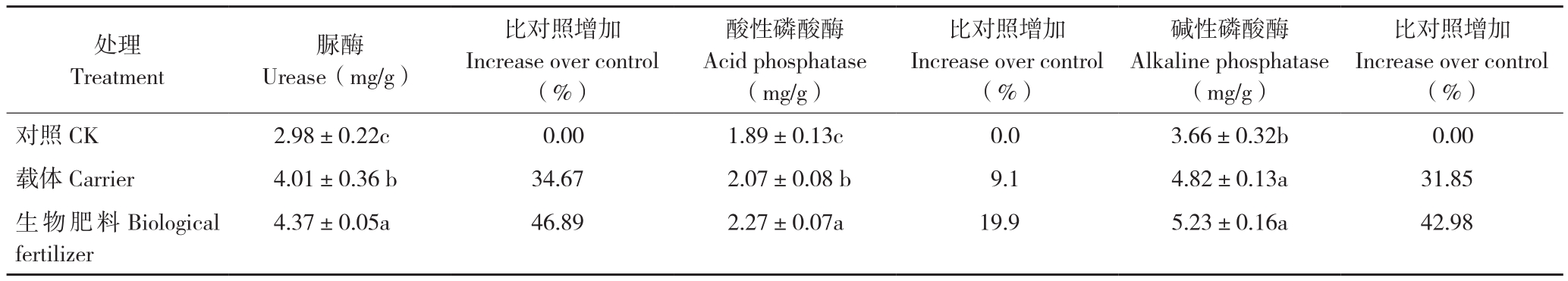
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
比对照增加Increase over control(%)对照CK 2.98±0.22c 0.00 1.89±0.13c 0.0 3.66±0.32b 0.00载体Carrier 4.01±0.36 b 34.67 2.07±0.08 b 9.1 4.82±0.13a 31.85生物肥料Biological fertilizer处理Treatment脲酶Urease(mg/g)比对照增加Increase over control(%)酸性磷酸酶Acid phosphatase(mg/g)比对照增加Increase over control(%)碱性磷酸酶Alkaline phosphatase(mg/g)4.37±0.05a 46.89 2.27±0.07a 19.9 5.23±0.16a 42.98
表4 不同处理对当归根际土壤生物功能多样性指数的影响
Table 4 Effects of different treatments on functional diversity indexes of rhizosphere soil of A. sinensis

注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
处理Treatment U H’ D对照CK 2.39±0.01c 2.860±0.05b 0.93±0.04a载体Carrier 3.00±0.03b 3.00±0.04ab 0.95±0.03a生物肥料Biological fertilizer 3.35±0.06a 3.048±0.05a 0.94±0.03a
2.4.3 生物肥料对单一碳源的影响 不同施肥措施对土壤微生物群落碳源利用能力产生不同影响。AWCD高低可用来表征微生物对碳源的利用率高低[26]。计算出Eco-microPlate上的31种碳源96 h的Ci-R 值平均值,对变化较大的14种碳源进行分析,表5结果显示,施用生物肥料后可显著提高D-木糖、葡萄糖-1-磷酸盐、L-苯基丙氨酸、甘氨酰-L-谷氨酸、D,L-α-甘油、I-赤藻糖醇、N-乙酰基-D-葡萄胺7种碳源的利用率,降低了L-丝氨酸、丙酮酸甲酯、腐胺、4-羟基苯甲酸、D-半乳糖醛酸、衣康酸、D-苹果酸7种碳源的利用率,使单一碳源的代谢发生变化。与对照相比,生物肥料处理的D-木糖、葡萄糖-1-磷酸盐、L-苯基丙氨酸、甘氨酰-L-谷氨酸、D,L-α-甘油、I-赤藻糖醇、N-乙酰基-D-葡萄胺的利用率分别增加89.8%、86.8%、17.3%、14.0%、35.5%、21.7%、91.3%;碳源L-丝氨酸、丙酮酸甲酯、腐胺、4-羟基苯甲酸、D-半乳糖醛酸、衣康酸、D-苹果酸分别降低了18.2%、10.2%、12.2%、16.0%、10.4%、5.9%、15.5%。碳源利用发生了变化,说明微生物种群发生变化,施用生物肥料改变了微生物群落结构。
表5 不同处理对单一碳源的影响
Table 5 Effects of different treatments on single carbon source
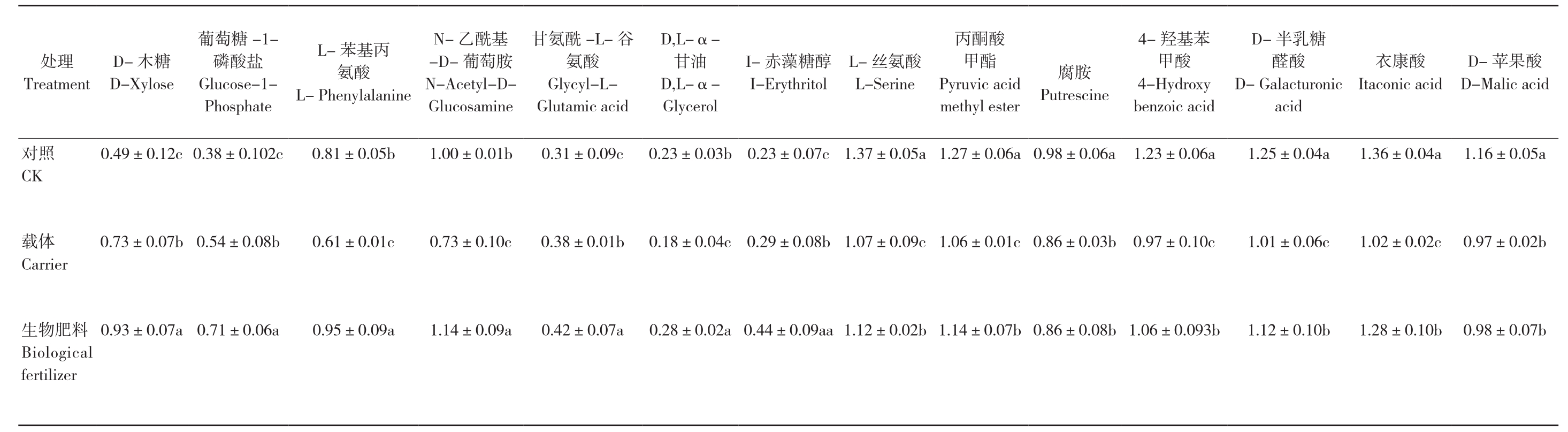
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters in the same column represent significant differences.
酸果苹D-M a l i c a c i d D-酸康衣I t a c o n i c a c i d糖乳酸D-半醛G a l a c t u r o n i c a c i d D-苯基酸4-羟甲H y d r o x y 4-b e n z o i c a c i d胺腐P u t r e s c i n e酸酮甲酯y l e s t e r丙v i c a c i d P y r u m e t h酸氨丝L-L-S e r i n e赤E r y t h r i t o l醇糖藻I-I-α-D,L-油α-甘D,L-G l y c e r o l谷--L-酸i c a c i d酰氨氨甘G l y c y l-L G l u t a m基胺-酰萄N--乙葡-D N-A c e t y l-D i n e G l u c o s a m丙苯氨基酸L-P h e n y l a l a n i n e L--1-1-糖酸盐萄磷葡G l u c o s e-P h o s p h a t e糖D-木X y l o s e D-理e n t处T r e a t m 5 a ±0.0 1.1 6±0.0 4 a 1.3 6±0.0 4 a 1.2 5 6 a ±0.0 1.2 3 0.9 8±0.0 6 a 1.2 7±0.0 6 a 1.3 7±0.0 5 a .0 7 c 0.2 3±0 0.2 3±0.0 3 b .0 9 c 0.3 1±0 1.0 0±0.0 1 b 5 b .0 0.8 1±0 0.3 8±0.1 0 2 c 2 c .1 0.4 9±0照C K对2 b .0 0.9 7±0 2 c ±0.0 1.0 2±0.0 6 c 1.0 1 0 c ±0.1 0.9 7 3 b ±0.0 0.8 6 1.0 6±0.0 1 c 1.0 7±0.0 9 c 0.2 9±0.0 8 b 0.1 8±0.0 4 c 0.3 8±0.0 1 b .1 0 c 0.7 3±0 1 c ±0.0 0.6 1 0.5 4±0.0 8 b .0 7 b 0.7 3±0体C a r r i e r载7 b .0 0.9 8±0 0 b ±0.1 1.2 8 0 b ±0.1 1.1 2 1.0 6±0.0 9 3 b 8 b ±0.0 0.8 6 1.1 4±0.0 7 b 0.4 4±0.0 9 a a 1.1 2±0.0 2 b 0.2 8±0.0 2 a .0 7 a 0.4 2±0.0 9 a 1.1 4±0 9 a ±0.0 0.9 5 0.7 1±0.0 6 a .0 7 a 0.9 3±0生B i o l o g i c a l料肥物f e r t i l i z e r
3 讨论
土壤微生物是土壤生态系统中的重要组成部分,是土壤中物质转化的动力,其群落结构组成及其变化在一定程度上反映土壤质量,同时也是克服连作障碍及其他土壤障碍因子的关键。杨永等[30]研究表明,在哈密瓜上施用微生物肥料能改变土壤真菌的群落结构,降低根际病原真菌数量,使大量有益真菌繁衍。唐艳领[31]研究表明,在严重连作土壤上对辣椒施用微生物肥料能够提高土壤中微生物数量,提高土壤酶活性,降低辣椒疫病的发生。胡丽可[32]在连作大棚中施用5406菌肥,辣椒根际土壤中细菌数量显著增加,真菌数量减少,土壤酶脲酶、蔗糖酶、过氧化物酶活性显著提高,也可以提高辣椒的品质。可见生物肥料可以有效减轻土壤连作障碍的发生,增加土壤微生物数量和提高酶的活性,提高作物的产量和品质。本研究在当归上施用生物肥料后,当归根际土壤中细菌、真菌、放线菌都显著增加,土壤脲酶、磷酸酶活性显著增加,与前人研究结果基本一致。通过Biolog-MicroPlate方法测定微生物对31种的利用情况,表明生物肥料改变了14种碳源的利用率,施用生物肥料可以改变土壤微生物群落结构。土壤微生物群落结构和组成的多样性与均匀性不仅提高土壤生态系统的稳定性与和谐性,同时也提高对土壤微生态环境恶化的缓冲能力[33]。土壤中微生物数量在一定程度上影响土壤酶的活性,土壤中酶活性是土壤肥力的一个重要指标[34]。施用生物肥料可以显著提高土壤脲酶、磷酸酶的活性。耿士均等[35]研究表明微生物菌剂和生物有机肥可显著改善植物根周的微环境,调节菌群种类和数量,促进有益菌群的生长,土壤中微生物含量增加,可以提高各种酶活性。酶活性与上壤中各营养元素的释放与发育土壤中腐殖质的形成以及土壤的结构和物理状况密切相关。张辉等[36]研究表明,生物有机无机复合肥可明显提高土壤蔗糖酶、脲酶、磷酸酶活性,促进土壤有机质的分解转化和速效养分释放。本研究结果表明,施用生物肥料增加了土壤细菌和放线菌的数量,提高了微生物的活性和土壤微生物的群落结构多样性[37];土壤中微生物含量增加,从而提高了土壤的脲酶、磷酸酶等活性,由于酶促反应增强,加速了土壤有机质的分解和矿物质养分的转化,有利于农作物根系对养分的吸收,从而提高当归的产量。
4 结论
本研究结果表明,当归专用生物肥料对当归根的生长有显著促进作用,施用生物肥料后当归的芦头直径和根干重显著增加,与对照相比,分别增加了31.39%、100.5%,提高了当归的商品性。施用生物肥料增加了土壤微生物的数量,与对照相比,细菌、真菌、放线菌分别增加154%、21.6%、34.7%,使土壤微生物功能多样性发生变化;提高了土壤脲酶、酸性磷酸酶、碱性磷酸酶活性,较对照分别增加46.9%、19.9%、43.0%。土壤中微生物数量增加,提高了土壤酶活性,加速了土壤有机质的分解和矿物质养分的转化,有利于农作物根系对养分的吸收,从而提高当归产量。
[1] 国家药典委员会. 中国药典(一部)[S]. 北京:化学工业出版社,2005.National Pharmacopoeia Commission. Chinese Pharmacopoeia I[S].Beijing, Chenical industry press, 2005.
[2] 张新慧,张恩和.当归叶片光合参数日变化及其与环境因子的关系[J]. 西北植物学报,2008,28(11):2314-2319. doi:1000-4025(2008)11-2314-06.ZHANG X H,ZHANG E H.Diurnal dynamics of photosynthetic parameters in leaves of Angelica sinensis and its relation to environmental factors[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(11):2314- 2319. doi:1000-4025(2008) 11-2314-06.
[3] 尹华,董晓烨.当归药材的质量标准研究[J]. 中医药学刊,2005,23(8):1500-1503. doi:10.13193/j.archtcm.2005.08.149.yinh.074.YIN H, DONG X Y.Studies on quality control standard of DangGui[J]. Chinese Archivers of Traditional Chinese Medicine, 2005,23(8):1500-1503. doi:10.13193/j.archtcm.2005.08.149.yinh.074.
[4] 董晴,陈明苍.当归化学成分及其药理作用研究进展[J]. 亚太传统医药,2016,2(12):32-34. doi:10.11954/ytctyy.201602014.DONG Q,CHEN M C.Composition and pharmacological research progress of Angelica[J]. Asia-Pacific Traditional Medicine, 2016,2(12):132-134. doi:10.11954/ytctyy.201602014.
[5] 彭建平,陈永刚,仇成友.探索甘肃当归产业可持续发展之路[J].甘肃农业,2011,295(2):61-63. doi:10.15979/j.cnki.cn62-1104/f.2011.02.045.PENG J P, CHEN Y G, QIU C Y. Exploration on the sustainable development of Angelica industry in Gansu Province[J]. Gansu Agriculture, 2011,295(2):61-63. doi:10.15979/j.cnki.cn62-1104/f.2011.02.045.
[6] 何晋武,祁永安,石利兵.甘肃省中药材产业发展现状及对策研究[J].中国农业资源与区划,2011,32(5):60-64.HE J W,QI Y A, SHI L B.Study on Chinese herbal medicine industry development and countermeasures in Gansu Province[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2011, 32(5):60-64.
[7] 张新慧.当归连作障碍机制及其生物修复措施研究[D].兰州:甘肃农业大学,2009.ZHANG X H.Studies on mechanism of continuous Angelica cropping obstacle and its preparatory bioremediation[D].Lanzhou: Gansu Agricultural University, 2009.
[8] 杨菁,谢应忠,吴旭东,徐坤.不同种植年限人工苜蓿草地植物和土壤化学计量特征[J]. 草业学报,2014,23(2):340-345.doi:10.11686/cyxb20140240.YANG J,XIE Y Z,WU X D,XU K.Stoichiometry characteristics of plant and soil in alfalfa grassland with different growing years[J].Acta Prataculturae Sinica, 2014, 23(2):340-345. doi:10.11686/cyxb20140240.
[9] 王飞,李世贵,徐凤花,顾金刚.连作障碍发生机制研究进展[J].中国土壤与肥料,2013(5):6-13. doi:10.11838 /sfsc. 20130502.WANG F,LI S G,XU F H, GU J G.The research progress on mechanism of continuous cropping obstacle[J]. Soil and Fertilizer Sciences in China, 2013(5):6-13. doi:10.11838 /sfsc.20130502.
[10] 温健.不同茬口当归根际微生物多样性研究[D].兰州:甘肃农业大学,2008.WEN J.Studies on phylogenetic diversity of unculturable bacterias from Angelica sinensis rhizosphere under different residues[D]. Lanzhou:Gansu Agricultural University,2008.
[11] 王立刚,李维炯,邱建军,马永良,王迎春.生物有机肥对作物生长、土壤肥力及产量的效应研究[J]. 土壤肥料,2004(5): 12-16.WANG L G, LI W J, QIU J J,MA Y L, WANG Y C.Effect of biological organic fertilizer on crops growth, soil fertility and yield[J]. Soil and Fertilizer Sciences, 2004,(5): 12-16.
[12] 徐立功.生物有机肥对番茄生长发育及产量品质的影响[D].泰安:山东农业大学,2006.XU L G.Effect of microbial organic fertilizer on the growth, yield and quality of tomato[D].Taian: Shandong Agricultural University, 2006.
[13] 王书娟,齐合玉,孙超,陈文钊,蒲江涛.微生物菌肥对大棚番茄的影响[J]. 蔬菜,2020(1):34-37.WANG S J, QI H Y, SUN C,CHEN W Z, PU J T.Effects of microbial fertilizer on greenhouse tomato[J]. Vegetables, 2020(1):34-37.
[14] 林团荣.不同生物菌肥对马铃薯产量的影响试验研究[J]. 现代农业,2019(12):4-5. doi:10.14070/j.cnki.15-1098.2019.12.002.LIN T R. Effect of differen biological bacteria fertilizer on potato yield[J]. Modern agriculture, 2019(12):4-5. doi:10.14070/j.cnki.15-1098.2019.12.002.
[15] 李依韦,毕佳欣,袁琴,尹萌萌,魏晓奇.不同施肥处理玉米根际微生物种群结构及代谢多样性[J]. 中国微生态学杂志,2020,32(1):21-24. doi:10.13381/j.cnki.cjm.202001005.LI Y W, BI J X,YUAN Q,YIN M M,WEI X Q.The population structure and metabolic diversity of microorganisms in rhizosphere soil of corn treated with different fertilizer[J]. Chin J Microecol, 2020,32(1):21-24. doi:10.13381/j.cnki.cjm.202001005.
[16] 黄琢理,刘栩薇,梁陆欣,郜子峰,付晓萌,廖荣,王树丽,莫钊文.喷施微生物菌肥对广东丝苗香米产量形成及茎鞘物质转运特性的影响[J]. 西北农业学报,2020,29(5):1-6. doi:10.7606/j.issn.1004-1398.2020.05.012.HUANG Z L,LIU X W,LIANG L X,GAO Z F,FU X M,LIAO R,WANG S L,MO Z W.Effectof spraying microbial fertilizer on yield for mation and tranoportation characteristics of stem and sheath in cantonese fragrant long grain rice[J]. Acta Agriculturae Boreali-occidentalis Sinica,2020,29(5):1-6. doi:10.7606/j.issn.1004-1398.2020.05.012.
[17] 王孝娣.高效生物有机肥在果树上的应用效应[D].泰安:山东农业大学,2005.WANG X D.Application effect on fruit tree of bio-organic manure[D].Taian: Shandong Agricultural University, 2005.
[18] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.XU G H, ZHENG H Y. Handbook of analytical methods for soil microorganisms[M].Beijing: Agriculture press, 1986.
[19] GARLAND J L,MILLSA L.Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991,57(8):2351-2359.
[20] ZHENG H L,WEINER L M, BAR-AM O,EPSZTEJN S,CABANTCHIK Z I, WARSHAWSKY A,YOUDIMM B H, FRIDKIN M.Design,synthesis, and evaluation of novel bifunctional iron-chelators as potential agents for neuroprotection in Alzheimer's, Parkinson's,and other neurodegenerative diseases[J]. Bioorganic & Medicinal Chemistry, 2005,13(3):773-783.
[21] 黄红艳.次生盐渍化土壤的微生物多样性及微生物改良效应研究[D].上海:上海交通大学,2012.HUANG H Y.Soil microbial diversity in secondary salinization soils and it’s microbial remidation[D].Shanghai: Shanghai Jiao Tong University, 2012.
[22] 党雯,郜春花,张强,李建华,卢朝东,靳东升,卢晋晶.Biolog法测定土壤微生物群落功能多样性预处理方法的筛选[J]. 中国农学通报,2015,31(2):153-158.DANG W, GAO C H,ZHANG Q, LI J H,LU C D,JIN D S,LU J J.Screening of preprocessing methods of biolog for soil microbial community functional diversity[J]. Chinese Agricultural Science Bulletin, 2015,31(2):153-158.
[23] 柴彦君,黄利民,董越勇,李艳,王志荣,单胜道,平立凤,张无敌.沼液施用量对毛竹林地土壤理化性质及碳储量的影响[J]. 农业工程学报,2019,35(8):214-220.CHAI Y J, HUANG L M, DONG Y Y, LI Y, WANG Z R, SHAN S D,PING L F, ZHANG W D.Effects of biogas slurry application rates on soil physical and chemical properties and carbon storage of bamboo forest[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2019, 35(8):214-220.
[24] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.BAO S D, Analysis of soil agrochemistry[M]. Beijing: China Agricultural Publishing,2000.
[25] 姜莉,陈源泉,隋鹏,栾琛,张敏,汪洪焦,李媛媛,高旺盛.不同间作形式对玉米根际土壤酶活性的影响[J]. 中国农学通报,2010,26(9):326-330.JIANG L,CHEN Y Q,SUI P,LUAN C,ZHANG M,WANG H J,LI Y Y,GAO W S.The rhizosphere soil enzyme activities of diferent corn intercropping system[J]. Chinese Agricultural Science Bulletin,2010,26(9):326-330.
[26] GARLAND J L.Analytical app roaches to the characterization of samples of microbial communities using patterns of potential C source utilization[J]. Soil Biology & Biochem is try, 1996,28:213-221.
[27] HAACK S K,GARCHOW H, ODELSON D A.Analysis of factors affecting the accuracy,reproducibility, and interpretation of microbial community carbon source utilization patterns[J]. Applied Environmental Microbiology, 1994,60:2483-2493.
[28] 杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志,2000,20(2):23-25,47.YANG Y H, YAO J, HUA X M.Effect of pesticide pollution against functional microbial diversity in soil[J]. Journal of Microbiology,2000,20(2):23-25,47.
[29] 孔维栋,刘可星,廖宗文,朱永官,王碧玲.不同腐熟程度有机物料对土壤微生物群落功能多样性的影响[J]. 生态学报,2005,25(9):2291-2296.KONG W D, LIU K X, LIAO Z W, ZHU Y G, WANG B L.Effects of organic matters on metabolic functional diversity of soil microbial community under pot incubation conditions[J]. Acta Ecologica Sinica, 2005, 25(9):2291-2296.
[30] 杨永,张学军,李寐华,王登明,王广智,张永兵,伊鸿平.微生物肥料对设施长期连作哈密瓜根际土壤真菌群落结构的影响[J]. 应用与环境生物学报,2018,24(1):68-74. doi:10.19675/j.cnki.1006-687x.2017.03014.YANG Y,ZHANG X J,LI M H,WANG D M,WANG G Z, ZHANG Y B,YI H P.Effects of microbiological fertilizer on rhizosphere soil fungus communities under long-term continuous cropping of protected Hami melon[J]. Chinese Journal of Applied and Environmental Biology,2018,24(1):68-74. doi:10.19675/j.cnki.1006-687x.2017.03014.
[31] 唐艳领.微生物肥在设施辣椒连作障碍克服中的应用研究[D].郑州:河南农业大学,2014.TANG Y L. The application research on microbial fertilizer to overcome continuous cropping obstacle of pepper in protected production[D].Zhengzhou: Henan Agricultural University,2014.
[32] 胡丽可.连作大棚施用5406抗生菌肥的效果研究[D].武汉:华中农业大学,2015.HU L K.Research on the effect of 5406 antibiotic fertilizer applied in continuous capsicum annuum cropping greenhou[D].Wuhan:Huazhong Agricultural University,2015.
[33] 焦晓丹,吴凤芝.土壤微生物多样性研究方法的进展[J]. 土壤通报,2004,35(6):789-792. doi:10.19336/j.cnki.trtb.2004.06.026.JIAO X D,WU F Z.Progress of the methods for studying soil microbial diversity[J]. Chinese Journal of Soil Science, 2004,35(6):789-792.doi:10.19336/j.cnki.trtb.2004.06.026.
[34] 陈竑峻,李传涵.杉木幼林地土壤酶活性与土壤肥力[J]. 林业科学研究,1993,6(3):321-326. doi:10.13275/j.cnki.lykxyj.1993.03.016.CHEN H J,LI C H.Soil enzyme activity and soil fertility in Cunninghamia lanceolata plantation[J]. Forest research, 1993,6(3):321-326. doi:10.13275/j.cnki.lykxyj.1993.03.016.
[35] 耿士均,王波,刘刊,商海燕,权俊娇,陆小平,沈其荣.专用微生物肥对不同连作障碍土壤根际微生物区系的影响[J]. 江苏农业学报,2012,28(4):758-764.GENG S J, WANG B,LIU K, SHANG H Y, QUAN J J, LU X P,SHEN Q R.Effect of specific microbial fertilizer on the rhizosphere microbial flora of different continuous cropping obstacles soil[J]. Jiangsu Journal of Agricultural Sciences, 2012,28(4):758-764.
[36] 张辉,李维炯,倪永珍.生物有机无机复合肥对土壤性质的影响[J]. 土壤通报,2006,37(2):273-277. doi:10.19336/j.cnki.trtb.2006.02.014.ZHANG H,LI W J,NI Y Z.Effects of biological-organic-inorganic compound fertilizer on soil properties[J]. Chinese Journal of Soil Science, 2006,37(2):273-277. doi:10.19336/j.cnki.trtb.2006.02.014.
[37] 朱丽霞,张家恩,刘文高.根系分泌物与根际微生物相互作用研究综述[J]. 生态环境,2003,12(1):102-105. doi:10.16258/j.cnki.1674-5906.2003.01.025.ZHU L X,ZHANG J E,LIU W G.Review of studies on interactions between root exudates and rhizopheric microorganisms[J].Ecology and Environment, 2003, 12(1):102-105. doi:10.16258/j.cnki.1674-5906.2003.01.025.