【研究意义】茄褐纹拟茎点霉(Phomopsis vexans Harter)是真菌界半知菌类腔孢纲球壳孢目球壳孢科拟茎点霉属真菌,是造成茄子褐纹病的病原菌[1]。此病菌可造成茄子苗期猝倒,生长期叶片病斑、干枝、结果期果腐等症状,最终导致减产20%~70%[2-3]。目前针对茄子褐纹病的研究主要集中在菌株分离培养、形态学及分子鉴定、基于离体接种的致病力鉴定等方面[2, 4-12]。针对褐纹病菌致病分子机理的研究还十分有限。孢子萌发是致病菌侵染植株和完成生活史的关键步骤[13]。通过现代组学技术对孢子萌发过程中分子水平的变化进行研究有助于找到致病菌孢子萌发过程中的关键基因、蛋白,也有助于定位潜在抗菌剂靶点及致病菌效应因子[14]。因此,孢子萌发机理研究是致病分子机理研究的重要组成部分。且已在水稻稻瘟病[15]、大豆菌核病[16]、香蕉枯萎病[17]等病害的研究中得到有效应用。针对孢子萌发机理的组学研究需要大量孢子作为实验材料。因此,探索更高效的产孢方法对茄子褐纹病菌孢子萌发相关的组学研究有重要意义。【前人研究进展】罗立娟等[18-19]通过改变固体培养基配方、增加光照、降低温度,使菌落长出分生孢子器,再通过无菌水冲洗培养皿,从中获取孢子,此方法最快需要5~6 d。钟彩虹等[20]在此基础上,通过对固体培养基上的菌丝进行扫刷、无菌水冲洗、晾干等步骤将固体培养基大量产孢时间缩短到4 d。Rohini等[21]使用PDA培养基在28 ℃培养7 d产孢。Mudasir等[22]分析了30个茄褐纹病菌株的菌丝形态及颜色,并发现不同菌株在PDA培养基上25 ℃培养需要的产孢时间从5 d到30 d不等。【本研究切入点】随着生物技术的发展,利用基因组、蛋白组、代谢组等多组学为致病机制研究提供了新的技术手段,然而以上传统产孢方法所获孢子数量有限且无法满足多组学分析研究的需求。【拟解决的关键问题】本研究以优化培养方法和提高褐纹病菌产孢数量为主要科学问题,建立了茄子褐纹病致病菌的分离鉴定和产孢条件的优化方法,为茄子抗褐纹病种质资源筛选鉴定、抗病机制及褐纹病菌致病机理研究提供技术支撑。
1 材料与方法
1.1 试验材料
试验于2019年3—12月在广东省蔬菜新技术重点实验室进行。褐纹病菌株(PV5)病株取自广东省广州市白云区钟落潭镇茄子种植基地(23°23' 24.5" N,113°26' 19.4" E)。
菌株及质粒载体:TA克隆所用大肠杆菌DH5α感受态细胞、琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司,pM-18T质粒购自购自宝生物工程(大连)有限公司。
酶及有关试剂:Primer STAR 高保真PCR酶、Loading Buffer购自宝生物工程(大连)有限公司,琼脂粉、葡萄糖购自Sigma公司,马铃薯、燕麦、苜蓿杆购自当地市场。
1.2 试验方法
1.2.1 褐纹病菌株的分离纯化 无菌环境下,取1×0.5 cm大小的病健交界处组织,无菌水冲洗2次后,次氯酸钠溶液消毒10 min,无菌水冲洗3次后,放入PDA平板28 ℃培养。
1.2.2 褐纹病菌株的分子鉴定 取培养基中菌丝约100 mg,使用CTAB法提取真菌基因组DNA。以此DNA为模板,使用真菌核糖体rDNA区通用引物ITS1:ITS1:5'-TCCGTAGGTGAACCTGCGG-3',ITS4:5'-TCCTCCGCTTATTGATATGC-3'进行PCR反应,扩增ITS1-5.8S-ITS2 rDNA全序列及部分18S和28S rDNA序列。反应体系为:模板1 μL,上下游引物各 0.5 μL,ddH2O 8 μL,PCR 酶 MIX10 μL。反应条件为:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 2 min,30 个循环;72 ℃ 10 min。对PCR产物进行琼脂糖凝胶电泳后,切胶回收DNA条带,经TA克隆后,送上海生工生物测序,将菌株ITS1-5.8S-ITS2 rDNA序列在NCBI网站上进行比对,下载比对结果中相似度较高序列,并使用MEGA软件构建进化树。
1.2.3 培养基配制 马铃薯葡萄糖固体培养基(Potato Dextrose Agar,PDA)的配制:去皮马铃薯200 g、琼脂粉17~20 g、葡萄糖20 g、蒸馏水1 000 mL,马铃薯洗净后,称取200 g,切成碎块,放入锅中加1 000 mL水煮沸30 min,双层纱布过滤后,趁热加17~20 g琼脂粉和20 g葡萄糖使其充分溶解,补足水量,分装到三角瓶并用封口膜密封,高压湿热灭菌(121 ℃,20 min)后冷却备用。其他培养基方法相同,燕麦固体培养基(Oat Meal Agar,OMA):燕麦30 g,琼脂粉14 g,水1 000 mL。苜蓿煎汁固体培养基:苜蓿杆100 g,燕麦30 g,琼脂粉14 g,水1 000 mL。对应的液体培养基在配方中去除琼脂粉。
1.2.4 液体培养基产孢方法 使用PDB, 50%(10 g)葡萄糖PDB,25%(5 g)葡萄糖PDB,无糖PDB,苜蓿煎汁液体培养基,燕麦液体培养基,接种后,在28 ℃150 r/min光照12 h/d条件下培养1 d后分别放入20、22、24、26 ℃培养箱中培养。
1.2.5 孢子的显微镜观察 取液体培养基100 μL在干净载玻片上,盖上盖玻片,显微镜观察。产孢数量通过血球计数板显微观察测定。
2 结果与分析
2.1 褐纹病菌的鉴定
2.1.1 形态学鉴定 从发病组织上分离得到菌株PV5,该菌株在PDA固体培养基上呈辐射状生长,菌丝为白色絮状。菌落整体呈同心轮纹状,靠近菌落中心部位菌丝较密集,靠近菌落边缘菌丝则相对稀疏(图1 A)。生长后期菌落上产生黑色点状分生孢子器,内含大量孢子。光学显微镜观察显示孢子呈卵圆形,宽约5~6 μm,长约10~12 μm,两端有油胞(图1 B)。

图1 茄子褐纹病菌菌落及孢子形态
Fig. 1 Colonies and spore morphologies of Phomopsis vexans Harter
A:菌落Colony;B:孢子Spores
2.1.2 分子生物学鉴定 使用PV5菌株ITS1-5.8S-ITS2 rDNA区段在NCBI网站上进行序列相似性比对,发现该菌株的ITS序列与已报道的多条茄褐纹拟茎点霉菌序列相似度达80%以上。因此可以确定菌株为拟茎点霉属的茄褐纹病菌。使用Neighbor-Joining法对菌株以及拟茎点霉属其他种病原菌的ITS序列构建系统发育树,结果(图2)显示,PV5与Phomopsis vexans 亲缘关系最近。从草莓上分离的Phomopsis obscuransd单独聚为一分支,从葡萄、樱桃和沙梨上分离的 Phomopsis viticola、Phomopsis perniciosa和Phomopsis fukushii亲缘关系与PV5较近。黄瓜和杨桃上分离的Diaporthe phaseolorum和Phomopsis averrhoae与PV5亲缘关系较远。
2.2 不同培养条件对产孢数量的影响
2.2.1 培养基形态对菌丝生长的影响 经过24 h培养,PDA培养基和苜蓿煎汁+OMA培养基中菌斑直径分别为1.5、1 cm,而OMA固体培养基中则未出现肉眼可见的菌落。液体培养基中部分菌丝由于摇床的摇动而呈小球状,且3种液体培养基中的菌丝量远远大于固体培养基(图3)。
2.2.2 充分营养生长对产孢数量的影响 茄褐纹拟茎点霉菌在液体培养条件下28 ℃培养1 d即可产生大量菌丝。一定的低温条件能促进孢子产生,而低温不利于菌丝生长。为了缓解这一矛盾,本试验探索使用28℃培养1 d后再放入24 ℃培养产孢。为了证明效果,使用28 ℃培养1 d、24 ℃培养3 d的产孢量与24 ℃持续培养4 d的产孢量进行比对,结果(表1)表明,不提供充分营养生长的条件下,褐纹病菌培养3 d后才开始产孢,而提供1 d的营养生长时间,褐纹病菌培养2 d后就开始产孢并且培养4 d后的孢子数量为不提供营养生长的240倍。
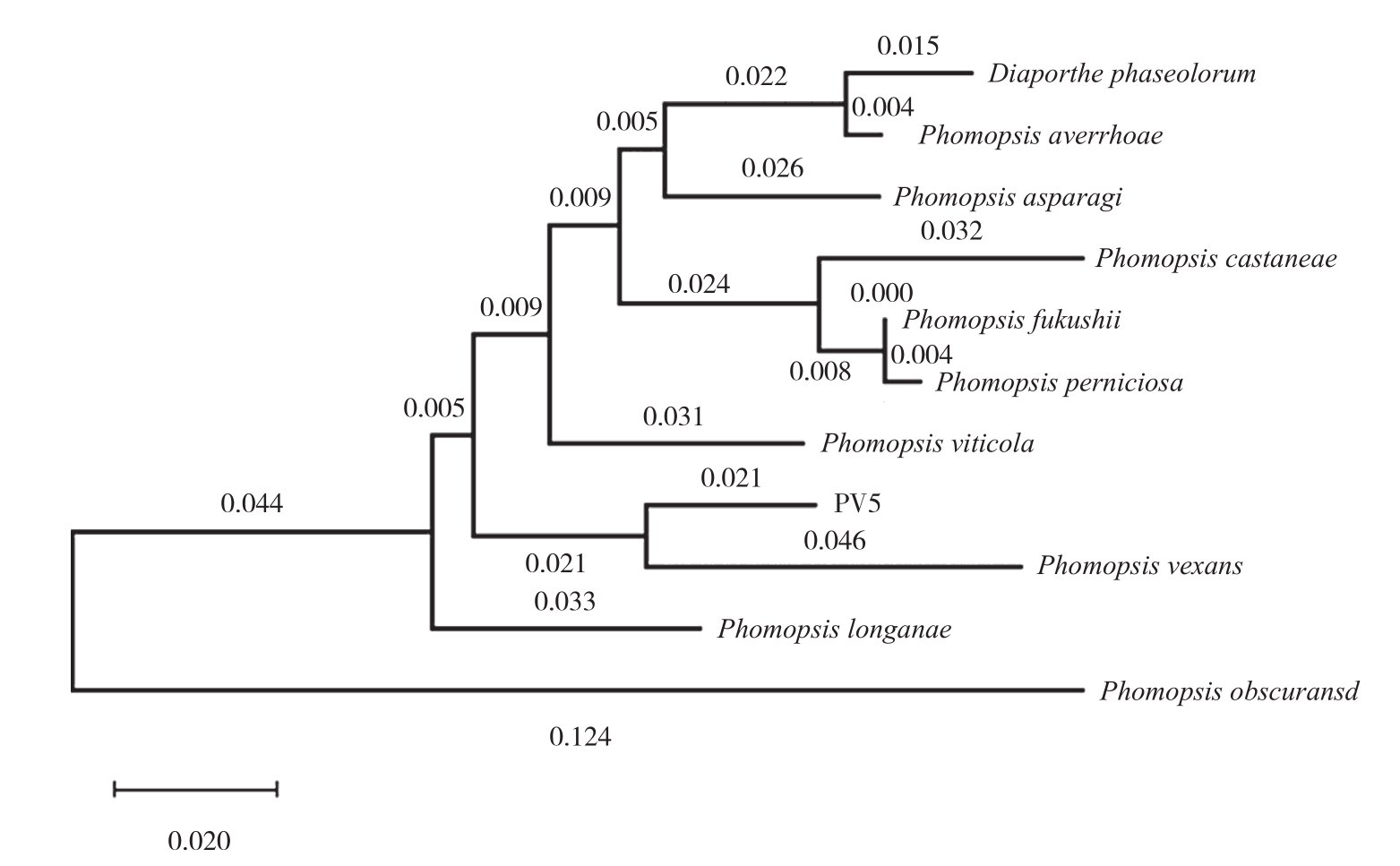
图2 基于ITS-5.8S rDNA 序列构建的遗传进化树
Fig. 2 An evolutionary tree based on ITS-5.8S rDNA sequence of Phomopsis vexans Harter

图3 不同形态培养基中PV5菌株菌丝生长情况
Fig. 3 Growth condition of PV5 in different media
A:OMA培养基, B:PDA培养基,C:苜蓿煎汁+OMA培养基,D:燕麦液体培养基,E:PDB培养基,F:苜蓿煎汁+燕麦培养基
A: OMA medium, B: PDA medium, C: Alfalfa decoction + OMA medium,D: Oat liquid medium, E: PDB medium, F: Alfalfa decoction + oat medium
2.2.3 培养温度对产孢数量的影响 为了探索液体培养基培养的最佳产孢温度,设置20、22、24、26 ℃ 4个温度梯度,经过28 ℃培养1 d后,将菌液放入相应的温度培养3 d并通过血球计数板观察每培养1 d后的孢子数量,结果见表2。22~26 ℃条件下菌株在培养3 d后观察到产孢。培养4 d后观察产孢量发现,24℃培养条件下孢子含量最高。因此可以判断,24℃为最佳产孢培养温度。
表1 不同培养步骤的产孢数量(个/毫升)
Table 1 Spore production quantity under different culture methods(spores/mL)
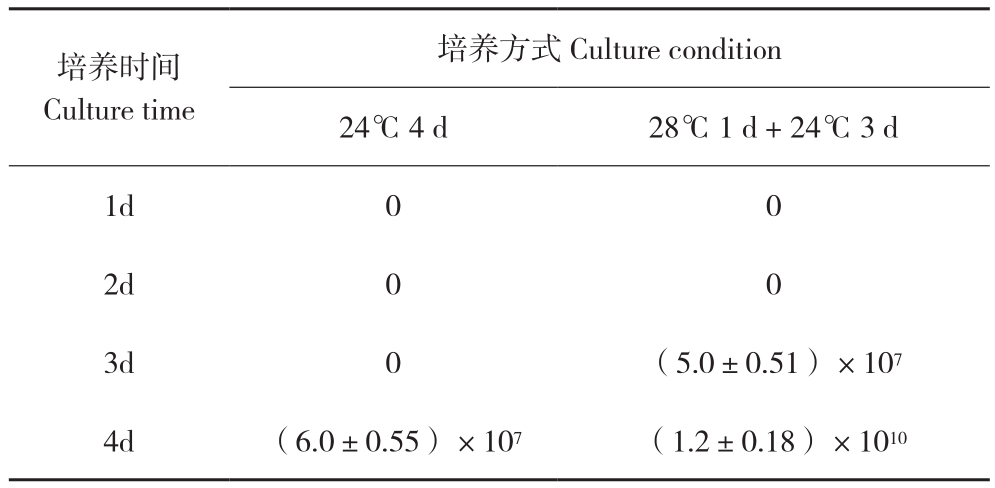
培养时间Culture time培养方式 Culture condition 24℃ 4 d 28℃ 1 d + 24℃ 3 d 1d 0 0 2d 0 0 3d 0 (5.0±0.51)×107 4d (6.0±0.55)×107 (1.2±0.18)×1010
2.2.4 培养基配方对产孢数量的影响 在已有的产孢相关研究中,不同培养基种类对产孢数量也有较大影响。且培养基中碳源含量也会影响产孢。针对这一情况,研究了相同培养条件下,PDB、减糖PDB培养基以及两种较常见产孢培养基的产孢数量,结果见表3。25%葡萄糖PDB培养基和苜蓿培养基产孢效率相对较高。考虑到培养基配制的简便性,25%葡萄糖PDB培养基产孢效率最高。
3 讨论
褐纹病是当前茄子生产上的重大病害,然而由于相关研究基础薄弱,仅局限于病原菌的分离鉴定和抗病资源筛选等研究,且缺乏完备的产孢方法,严重阻碍了茄子褐纹病菌的致病机制研究和分子机理解析。微生物人工培养条件的筛选与优化是开展相关机理研究的技术基础[23-24]。通过培养条件的优化、简化技术流程,进而获得致病菌孢子的富集,对于深入研究孢子发育、致病机理具有重要理论意义。前人研究发现能促进植物病原菌产孢的因素主要有营养控制、寄主组织诱导、光照、物理损伤等[25],目前针对褐纹病菌的研究多用PDA固体培养基对病菌进行培养。Akhtar等[26]曾使用马铃薯葡萄糖液体(PDB)培养基对茄子褐纹病菌进行培养,并称量了不同菌株的重量,但并未提及产孢相关内容。本研究通过比较固体和液体培养基对菌丝生长量的影响,发现3种液体培养基(OMA培养基、PDA培养基、苜蓿煎汁+OMA)28 ℃培养1 d比固体培养基菌丝生长量增加。本研究通过6种液体培养基比较试验发现,25%葡萄糖PDB培养基产孢效率最高;并且使用28 ℃培养1 d 24 ℃培养3 d后的产孢量是24 ℃持续液体培养4 d产孢量的240倍。因此,在促进菌丝生长后,可以根据实验条件综合多个因素如光照、机械损伤等以提高产孢效率。
表2 不同培养温度的产孢数量(个/毫升)
Table 2 Spore production quantity under different culture temperatures(spores/mL)

培养时间Culture time 20℃ 22℃ 24℃ 26℃1d 0 0 0 0 2d 0 0 0 0 3d 0 (2.0±0.50)×107 (5.0±0.51)×107 (1.3±0.33)×107 4d (2.5±0.82)×107 (9.5±1.08)×108 (1.2±0.18)×1010 (8.5±0.41)×108
表3 不同培养基的产孢数量(个/毫升)
Table 3 Spore production quantity under different culture media(spores/mL)
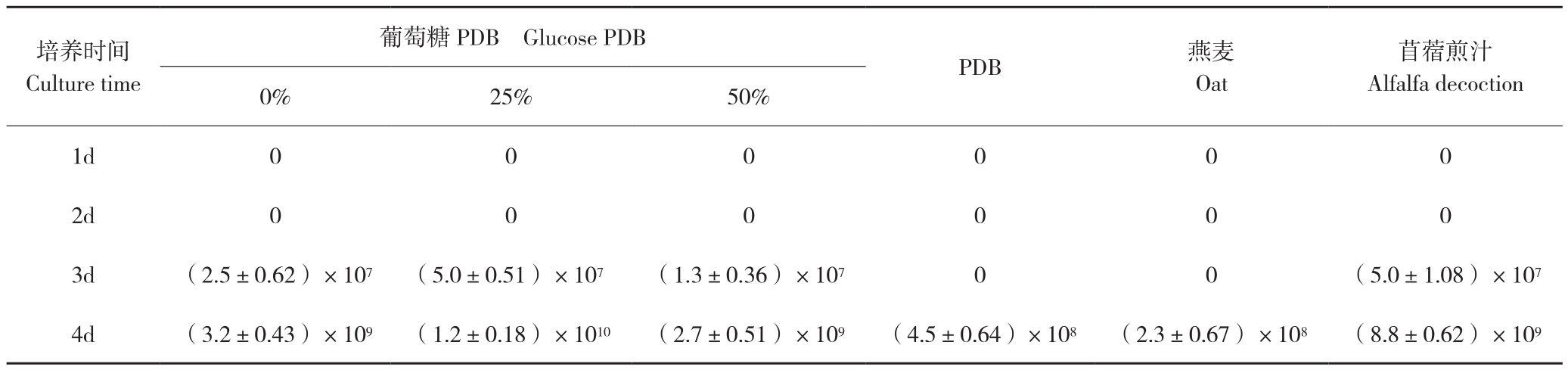
培养时间Culture time苜蓿煎汁Alfalfa decoction 0% 25% 50%葡萄糖PDB Glucose PDB PDB 燕麦Oat 1d 0 0 0 0 0 0 2d 0 0 0 0 0 0 3d (2.5±0.62)×107 (5.0±0.51)×107 (1.3±0.36)×107 0 0 (5.0±1.08)×107 4d (3.2±0.43)×109 (1.2±0.18)×1010 (2.7±0.51)×109 (4.5±0.64)×108 (2.3±0.67)×108 (8.8±0.62)×109
本研究在前人研究的基础上,使用液体培养基培养褐纹病菌,通过低温光照提供的逆境,以及液体培养中摇床造成的机械力打断菌丝,综合了多种促进产孢的因素。同时,所产生分生孢子器中的孢子直接进入培养基,获得的孢子液过滤后可直接使用,简化了产孢过程。为茄子褐纹病菌的基因组及转录组研究[27]、深入挖掘茄褐纹病菌孢子萌发相关分子机制、开展褐纹病与植株的互作研究提供理论基础。
本研究所产生的孢子均为α型孢子,未见β型孢子。在前人的研究中,PDA固体培养基培养的褐纹病菌能产生α、β两种孢子[13-14],本课题组前期研究中也获得了类似结果。但为何液体培养产孢只观察到α型孢子,还需要进一步开展产孢机理研究。
4 结论
本研究首次尝试使用液体培养基促进茄子褐纹病菌产孢。产孢条件的优化结果表明,液体培养基中菌丝生长多余固体培养基且可用于产孢。最佳产孢条件为:在150 r/min摇床中,使用25%葡萄糖PDB培养基,28℃培养1 d后24℃培养3 d。在此条件下培养,产孢量可达到1.2×1010个 /mL。
[1] 李涛,黎振兴,李植良,徐小万. 茄子褐纹病的研究现状与展望[J]. 中国农学通报,2015, 31(5): 108-115. doi:10.11924/j.issn.1000-6850.2014-2366.LI T, LI Z X, LI Z L, XU X W. Research status and prospect of brown streak disease of eggplant[J]. China agricultural science bulletin,2015, 31(5):108-115. doi:10.11924/j.issn.1000-6850.2014-2366.
[2] 陈珊珊,宋述尧,赵靖,赵春波. 茄子褐纹病极其抗病育种的研究进展[J]. 吉林农业科学,2015, 40(3): 76-79.CHEN S S, SONG S Y, ZHAO J, ZHAO C B. Research progress on breeding of brown grain disease and Phomopsis vexans[J].Jilin agricultural science, 2015, 40(3): 76-79. doi:10.16423/j.cnki.1003-8701.2015.03.020.
[3] 陈珊珊. 茄子抗褐纹病机制与转录组测序研究[D]. 长春: 吉林农业大学,2015.CHEN S S. Study on mechanism and transcriptome sequencing of Phomopsis vexans[D]. Changchun: Jilin agricultural university, 2015.
[4] NAZNIN N, ISLAM M R, UDDIN M M, JONG P D, STRUIK P,STOMPH T J. Disease management in eggplant(Solanum melongena L.)nurseries also reduces wilt and fruit rot in subsequent plantings: A participatory testingin Bangladesh[J]. Crop Protection, 2019, 120,113-124. doi:10.1016/j.cropro.2019.02.018.
[5] UDAYASHANKAR A C, CHANDRA N S, ARCHANA B,LAKSHMEESHA T R, NIRANJANA S R, LUND O S, PRAKASH H S.Specific PCR-based detection of Phomopsis vexans the cause of leaf blight and fruit rot pathogen of Solanum melongena L[J]. Letters in Applied Microbiology, 2019, 69(5): 358-65. doi:10.1111/lam.13214.
[6] MOAKALA J, RAJESH T, TOMBISANA D R K, MAJUMDER D,KENNEDY N, HEMOCHANDRA L. Cultural and Morphological Variability in Phomopsis vexans(Sacc. & Syd.)Harter Causing Fruit Rot of Brinjal[J]. International Journal of Current Microbiology and Applied Sciences, 2018, 7(7): 2807-14. doi:10.20546/ijcmas.2018.707.328.
[7] AMRENDRA K, RANDHIR K, MOHAMMAD A, SHIRIN A,ANUPAM A, VINOD K. Screening against phomopsis blight in Brinjal(Solanum melongena L.)[J]. International Journal of Current Microbiology and Applied Sciences. 2020, 9(3): 223-228.doi:10.20546/ijcmas.2020.903.026.
[8] SHWETA S, AKHILESH S, VIVEKA K. Biotechnological interventions in eggplant(Solanum melongena L.)[J]. The Journal of Horticultural Science And Biotechnology, 2020, 95(3): 1-12. doi:10.1080/14620316.2019.1686432.
[9] MASUDULLA K, ZAKI A S. Zinc oxide nanoparticles for the management of Ralstonia solanacearum, Phomopsis vexans and Meloidogyne incognita incited disease complex of eggplant[J].Indian Phytopathology, 2018, 71: 355-364. doi:10.1007/s42360-018-0064-5.
[10] SUSHREE A, BEURA S K, MUTHU M C. Evaluation of efficacy of various fungicides against Phomopsis vexans the incident of fruit rot of Brinjal(Solanum melongena L.)[J]. International Journal of Current Microbiology and Applied Sciences, 2018, 7(8):684–687.doi:10.20546/ijcmas.2018.708.074.
[11] 李可,金辉,邹华芬,高晓敏,闫海霞,王琚钢,茄子对褐纹病的抗性及其生理相应[J]. 中国瓜菜,2018, 31(12):31-36.LI K, JIN H, ZOU H F, GAO X M, YAN H X, WANG J G. Eggplant’s resistance and physiological response to phomopsis blight[J]. China Cucurbit sand Vegetables, 2018, 31(12): 31-36.
[12] 成玉梅,杜爱玲,韦玉霞,康业斌. 褐纹病菌粗毒素对茄子的致病性研究[J]. 河南农业科学,2004, 8(7):1-5. doi:10.3969/j.issn.1004-3268.2004.08.024.CHENG Y M, DU A L, WEI Y X, KANG Y B. Study on the pathogenicity of aubergine by crude toxin of Phomopsis vexans[J]. Henan Agricultural Science, 2004, 8(7): 1-5. doi:10.3969/j.issn.1004-3268.2004.08.024.
[13] POPPY C S, SEPHTON C, VOELZ K. Spore germination of pathogenic filamentous fungi[J]. Advances in Applied Microbiology Academic Press, 2018, 102: 117-157. dio:10.1016/bs.aambs.2017.10.002.
[14] ORTIZ S C, HUANG M, HULL C M. Spore Germination as a target for antifungal therapeutics[J]. Antimicrobial Agents and Chemotherapy,2019, 63(12). dio: 10.1128/AAC.00994-19.
[15] LIU X H, LIANG S, WEI Y Y, ZHU X M, LI L, LIU P P, ZHENG Q X,ZHOU H N, ZHANG Y, MAO L J, CAROLINE M F, MAURIZIO D P,NAWEED I N, LIN F C. Metabolomics analysis identifies sphingolipids as key signaling moieties in appressorium Morphogenesis and Function in Magnaporthe oryzae[J]. mBio, 2019, 10(4): e01467-19. dio:10.1128/mBio.01467-19.
[16] YU M H, ZHANG G Y, JIANG J S, DU L C, ZHAO Y F. Lysobacter enzymogenes employs diverse genes for inhibiting hypha growth and spore germination of soybean fungal pathogens[J]. Phytopathology,2020, 110(3): 593-602. dio: 10.1094/PHYTO-09-19-0356-R.
[17] DENG G M, YANG Q S, HE W D, LI C Y, YANG J, ZUO C W, GAO J, SHENG O, LU S Y, ZHANG S, YI G J. Proteomic analysis of conidia germination in Fusarium oxysporum f. sp. cubense tropical race 4 reveals new targets in ergosterol biosynthesis pathway for controlling Fusarium wilt of banana[J]. Applied microbiology and biotechnology, 2015, 99(17): 7189-7207. dio:10.1007/s00253-015-6768-x
[18] 罗丽娟,习平根,姜子德,戚佩坤. 纯培养拟茎点霉属真菌的产孢条件[J]. 菌物学报,2004, 23(2): 219-55. doi:10.3969/j.issn.1672-6472.2004.02.011.LUO L J, XI P G, JIANG Z D, QI P K. Spore-producing conditions of pure culture of Phomopsis vexans of the genus stylopae[J].Acta bacteriologica sinica, 2004, 23(2): 219-255. doi:10.3969/j.issn.1672-6472.2004.02.011.
[19] 罗丽娟,习平根,姜子德,戚佩坤. 纯培养下拟茎点霉分生孢子的形成及意义[J]. 菌物学报,2004, 23(3): 375-80. doi:10.3969/j.issn.1672-6472.2004.03.011.Luo L J, Xi P G, Jiang Z D, QI P K. Formation and significance of Phomopsis vexans in pure culture[J]. Acta bacteriologica sinica,2004, 23(3): 375-80. doi:10.3969/j.issn.1672-6472.2004.03.011.
[20] 钟彩虹. 一种拟茎点霉菌的快速诱导产孢方法及其应用[P]. 2015.Zhong C H. A rapid spore-producing method and its application for Phomopsis vexans[P]. 2015.
[21] ROHINI, HG. GOWTHAM, HARIPRASAD P AND NIRANJANA S R.Cultural, morphological and physiological characterization of phomopsis vexans isolates from different brinjal(Solanum melongena L.)growing regions of karnataka, india[J]. International Journal of Pharma and Bio Science, 2016, 7(3): 70-77. doi:10.3923/ijpp.2012.56.65.
[22] BHAT M, ANWAR A, MUGHAL M N, MOHIDDIN F, MAKHDOOMI M,BHAT A,FAYAZ U. Morpho-cultural and pathological variability in Phomopsis vexans causing leaf blight and fruit rot of brinjal in Kashmir[J]. Indian Phytopathology, 2019, 72(2): 225-33. doi:10.1007/s42360-019-00128-7.
[23] 郑晓雅,殷伟伟,张松,兰瑛. 不同发酵条件对柱状田头菇菌丝产胞外多糖的影响[J]. 广东农业科学,2019,46(5):25-32.doi:10.16768/j.issn.1004-874X.2019.05.004.ZHEN X Y, YIN W W, ZHANG S, LAN Y. Effects of different fermentation conditions on extracellular polysaccharides produced by mycelia of Agrocybe aegerita[J].Guangdong Agricultural Sciences,2019, 46(5): 25-32. doi:10.16768/j.issn.1004-874X.2019.05.004.
[24] 侯宪文,符瑞益,徐林,文少白. 姬松茸液体发酵培养基筛选和条件优化研究[J]. 广东农业科学,2020,47(2):24-29. doi:10.16768/j.issn.1004-874X.2020.02.004.Hou X W, Fu R Y, Xu L, Wen S B. Study on screening and condition optimization of liquid fermentation medium for Agaricus blazei Murill[J]. Guangdong Agricultural Sciences, 2020, 47(2):24-29. doi:10.16768/j.issn.1004-874X.2020.02.004.
[25] SU Y Y, QI Y L, CAI L. Induction of sporulation in plant pathogenic fungi[J]. Mycology, 2012, 3(3): 195-200. doi:10.1080/21501203.2 012.719042.
[26] AKHTAR J, CHAUBE H S. Variability in phomopsis blight pathogen Phomopsis vexans(Sacc. & Syd.)Harter[J]. Indian Phytopathology,2006, 59(4): 439-444. https://doi.org/10.18174/475569.
[27] 衡周,李涛,李植良,黎振兴,宫超,孙保娟. 茄子褐纹病菌的基因组及转录组测序分析[J]. 园艺学报,2018, 45(S1): 2613.Heng Z, Li T, Li Z L Li Z X, Gong C, Sun B J. Genome and transcriptome sequencing of Phomopsis vexans[J]. Acta Horticulturae Sinica, 2018, 45(S1): 2613.