【研究意义】哈维氏弧菌(Vibrio harveyi)是一种弯曲杆状、有发光特性、耐盐的革兰氏阴性菌,是海水生物中的正常成员[1]。但随着水产养殖业的发展,哈维氏弧菌被认为是海水养殖动物的重要病原菌,主要感染对象是凡纳滨对虾(Litopenaeus vannamei)[2]、太平洋牡蛎(Crassostrea gigas)[3]、斜带石斑鱼(Epinephelus coioides)[4]、金鲳(Trachinotus ovatus)[5]和大菱鲆(Psetta maxima)[6]等。徐芝亮等[7]发现感染的对虾主要症状表现为体表变暗、运动迟缓、发光甚至死亡等;Saulnier等[8]就法国太平洋牡蛎大批死亡事件进行研究,发现与哈维氏弧菌密切相关;吴后波等[9]针对海水网箱养殖的高体鰤弧菌病进行研究,发现患病鱼表现为消瘦,体表溃烂、脱鳞,肝、脾等内脏出现明显病变;Alvarez等[10]发现哈维氏弧菌感染的大西洋棘白鲳(Chaetodi pterus faber)表现为眼球突出、鳍充血;范文辉等[6]研究发现患病大菱鲆主要表现为身体表面溃烂,鳃丝贫血,内脏肿大,肠透明。可见,海水养殖鱼感染哈维氏弧菌的发病症状因鱼的种类及生存环境不同各有差别,但均会给海水养殖户造成巨大损失。目前生产上多数依靠使用抗生素减少病害,但滥用抗生素不仅会导致耐药性菌株不断出现[11],而且药物残留极大影响水产品的质量,还会污染水体破坏生态平衡。近年来随着免疫学和基因工程的快速发展,新型疫苗的研制备受关注。【前人研究进展】编码丝氨酸羟甲基转移酶(serine hydroxylmethyltransferase,SHMT)的glyA基因在细菌中不可或缺,研究表明,该蛋白催化丝氨酸、甘氨酸相互转化为菌体,提供充足的氨基酸[12]。而L-丝氨酸对细菌的作用非常多,如分子结构中的甲基可满足机体对一碳单位(如甲基、甲酰基及亚氨甲基等)的需求;能参与S-腺苷甲硫氨酸、嘧啶、嘌呤等小分子物质的生物合成,进而合成核酸、蛋白质等大分子物质;能转变成乙醇胺、胆碱,用于合成磷酸脂;能转变为乙酰胆碱,对神经系统有关键作用[14]。可见,该基因对细菌的复制、信息传递具有重要影响。国内外已有学者对不同生物的SHMT蛋白展开研究,如拟南芥[15]、嗜水气单胞菌[16]、脊尾白虾[17]、家蚕[18],但针对弧菌的研究很少。【本研究切入点】以克隆哈维氏弧菌glyA基因全长为基础,设计构建哈维氏弧菌原核表达载体BL21-pET-28a-glyA,并对重组菌株诱导表达条件进行优化。【拟解决的关键问题】本研究成功构建了BL21-pET-28a-glyA重组菌株,并获得最佳诱导表达条件,以期为亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 试验材料
供试哈维氏弧菌ZJ0603菌株筛选自患病斜带石斑鱼(Epinephelus coioides),Takara pMD-18T、pET-28a、大肠杆菌感受态(Escherichia coli)DH5α和BL21均由广东省水产经济动物病原生物学及流行病学重点实验室提供。Easy Pure PCR Purification Kit试剂盒和Easy Pure Plasmid Mini Prep Kit试剂盒购自赛默飞世尔科技公司;耐超高温DNA聚合酶、BamHⅠ和XhoⅠ内切酶和T4 DNA连接酶购自Takara公司;氨苄霉素、卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)购自上海生物工程公司。
1.2 试验方法
1.2.1 glyA基因克隆 将超低温下保存的哈维氏弧菌ZJ0603菌株接种于培养基进行扩繁,然后根据说明书提示提取哈维氏弧菌ZJ0603菌株的全基因组。根据GenBank已公布的弧菌glyA(登录号:MT364338)基因序列,分别设计含BamHⅠ和XhoⅠ酶切位点的上下游引物,上游引物F:(含BamHⅠ酶切位点)5'-CGCGGATCCATGAACAA GAGTTACCCTA-3',下游引物(含Xho I酶切位点)R:5'-CCGCTCGAGTTATTGGTAAAGAGGGTA-3',下划线部分为酶切位点及保护碱基以确保不发生碱基错配。以提取的哈维氏弧菌全基因组为模板特异性扩增获得glyA基因,PCR反应体系50 µL,含 TaqDNA 聚合酶 25 µL、无菌水 21 µL、DNA模板2 µL、上下游引物各1 µL。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s、58 ℃ 90 s、72 ℃ 1 min,35 个循环;72℃延伸10~15 min。
经琼脂糖凝胶电泳检测目的片段大小后,参考说明书将PCR产物纯化获得glyA基因片段,与pMD-18T载体在4 ℃条件下连接过夜(16 ℃2 h),然后转化至E.coli DH5α,在LB培养基中培养 1 h(37 ℃ 180 r/min),取 100~150 µL涂布于含100 μg/mL氨苄霉素的平板上继续培养过夜后,挑取单菌落进行菌落PCR,电泳检测片段正确后送由广州生工生物工程公司进行测序。
1.2.2 载体pET28a-glyA的构建 参照试剂盒说明书分别对经测序的重组质粒pMD-18T-glyA和空载pET-28a提取质粒,经BamHⅠ和XhoⅠ酶切后,借助T4连接酶的特性将两者连接起来即可成功构建pET-28a-glyA,然后转入E. coli BL21中,过夜培养后进行菌落PCR鉴定,将片段大小符合的菌液(取>300 µL)送至广州生工生物工程公司进行测序。
1.2.3 重组蛋白的诱导表达 37 ℃、180 r/min条件下,重组菌株BL21-pET-28a-glyA在含100 μg/mL卡那霉素LB培养基上培养,每隔30 min测1次OD600值。当OD600达0.4~0.6时,抽取1 mL未经诱导的BL21-pET-28a-glyA为对照,同时向培养基中添加1 mmol/L IPTG进行诱导表达。对照组与试验组同时在37 ℃下振动培养4 h后离心,PBS洗净后10~15 min水煮提取蛋白,取10 μL上清进行SDS-PAGE电泳分析以确保重组蛋白正常表达。
1.2.4 原核表达条件优化 分别在不同IPTG浓度、时间、温度条件下对重组菌株表达条件进行优化。
(1)IPTG诱导浓度:设诱导剂IPTG梯度为 0、0.2、0.4、0.6、0.8、1.0 mmol/L,在 37 ℃180 r/min下培养4 h,低速离心后经PBS洗净,用水煮法获得蛋白后进行SDS-PAGE电泳分析。SDS-PAGE电泳条件:5%浓缩胶电压设置为80~90 V,10%~12%分离胶电压设置为100~120 V,每孔上样约10~20 µL,电泳2~2.5 h。然后用考马斯亮蓝染色2 h,再用脱色液脱色[19]。
(2)诱导时间:其他处理条件不变情况下,分别在诱导0、1、2、3、4、5 h后收集菌液,用(1)的SDS-PAGE电泳方法进行分析(诱导时间达到后放于4 ℃冰箱,防止诱导剂继续诱导影响试验结果)。
(3)温度:当OD600值达到0.4~0.6时,分别在20 ℃、37 ℃,IPTG浓度为1 mmol/L条件下诱导4 h,离心收集10~20 mL菌液,并用PBS清洗吹匀,然后放置于冰上进行超声破碎细胞壁(功率300 W,超声开时间2 s,超声关时间8 s,超声破碎总时间约10 min)至菌液澄清透明时即停止(若破碎中有黑色沉淀,说明超声时间过长,蛋白变性,应缩短超声时间)。低温离心后将裂解液的上清和沉淀分装,上清保存于4 ℃冰箱,沉淀用8 mol/L尿素在4 ℃条件下溶解过夜[20]。用(1)的SDS-PAGE电泳方法进行分析。
1.2.5 Western Blot分析 在最佳表达条件下诱导处理重组菌株,利用pET-28a序列上的His标签特异吸附SHMT特异性纯化融合蛋白,蛋白在低温、200 mA条件下进行电泳2~2.5 h,然后将蛋白转至聚偏氟乙烯(PVDF)膜上,放在封闭液(5%脱脂奶粉)中4 ℃过夜(常温摇床2 h)处理,用TTBS溶液冲洗,10 min/次,重复4次(或5 min/次,重复5次,),加一抗:鼠抗His-Tag单克隆抗体(体积比1∶5000稀释),常温摇床孵育;如上TTBS冲洗,加二抗:HRP-Tag山羊抗鼠IgG(1∶5000)孵育,TTBS冲洗后使用显色液显色,待条带肉眼可见后滴加ddH2O结束反应。
1.2.6 生物信息学分析 利用NCBI ORF finder获得glyA编码的氨基酸序列,Expasy-Prot分析SHMT蛋白的理化性质,SignalP5.0 Server预测SHMT蛋白的信号肽,Psort.hgc预测蛋白亚细胞定位;MEGA10.0和DNAMAN9.0分析序列同源性,SOPMA对其高级结构进行预测;SOPMA分析序列二级结构。
2 结果与分析
2.1 glyA基因扩增及生物信息学分析
PCR扩增后获得如图1的条带,大小与预测的glyA ORF大小一致。经生物信息学分析发现,哈维氏弧菌glyA基因ORF为1 296 bp,编码431个氨基酸,编码的SHMT蛋白理论分子质量为46.60 ku,理论等电点6.18,不稳定系数28.66(<40,蛋白稳定),脂肪系数88.33,总平均亲水性-0.200(亲水性蛋白)。该蛋白位于细胞质中,N端无信号肽切割位点,序列中含有N-糖基化位点3个,蛋白激酶C磷酸化位点6个,酪氨酸激酶磷酸化位点1个,N-肉豆蔻酰化位点13个,酰胺化位点1个,C端靶向信号11个,丝氨酸羟甲基转移酶吡哆醛-磷酸附着基1个,脂蛋白标签1个。通过BLAST对哈维氏弧菌glyA氨基酸序列进行同源性分析,发现哈维氏弧菌与日本弧菌、欧文斯氏弧菌、溶藻弧菌、副溶血弧菌glyA基因同源性较高,其中与日本弧菌属同源性最高、达99.54%。从二级结构来看,哈维氏弧菌α-螺旋占比45.71%,β-转角占比6.96%,延伸链占比13.23%,随机线圈占比34.11%。
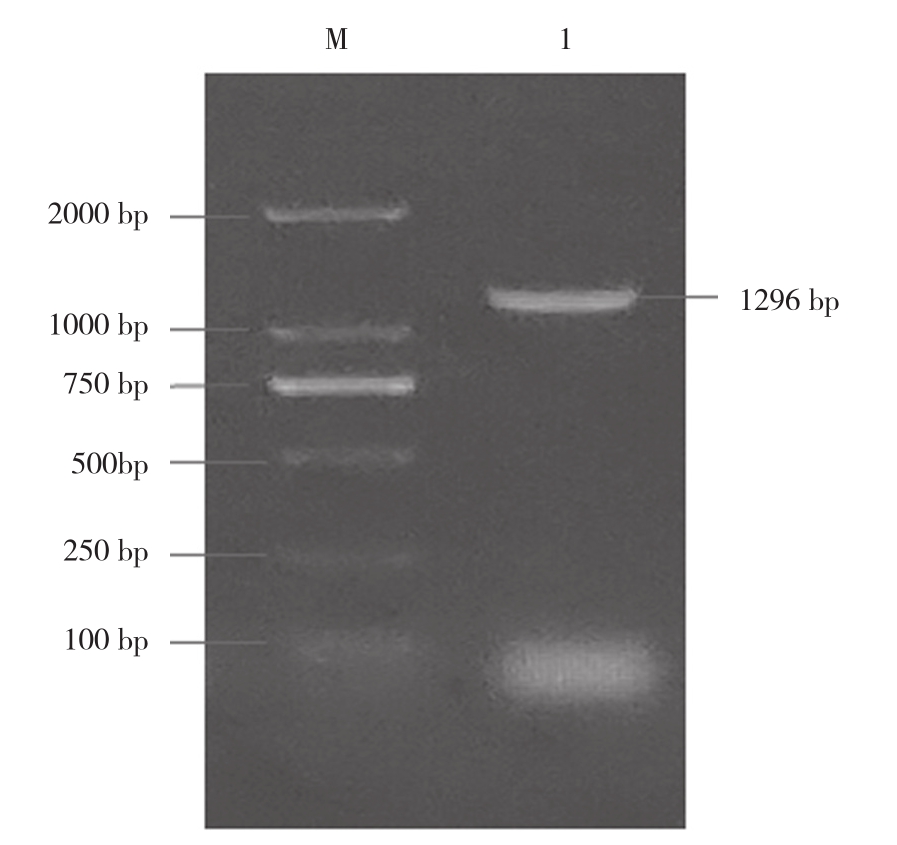
图1 glyA 基因PCR产物电泳结果
Fig. 1 Electrophoresis result of PCR products of glyA
M: DL2000 DNA分子标准;1: glyA基因PCR产物
M: DL2000 DNA marker; 1: The PCR products of glyA
2.2 重组表达载体pET28a-glyA的诱导表达及条件优化
将重组质粒pET-28a-glyA连接后转入表达菌株BL21,测序结果发现构建的pET-28a-glyA没有发生突变及错配,表明表达载体BL21-pET-28a-glyA构建成功。经诱导剂诱导过的重组载体pET-28a-glyA出现约为46.6 ku的明显蛋白条带,以上结果说明glyA基因在表达载体中成功表达。
2.2.1 不同IPTG 浓度对重组蛋白表达的影响分析不同浓度IPTG诱导重组蛋白,结果(图2)表明,诱导前的全菌蛋白没有目的条带,0.2、0.4、0.6、0.8、1.0 mmol/L IPTG诱导后均有目的蛋白出现,以0.4 mmol/LIPTG诱导的蛋白表达量达到最高,因此IPTG最佳诱导浓度为0.4 mmol/L。
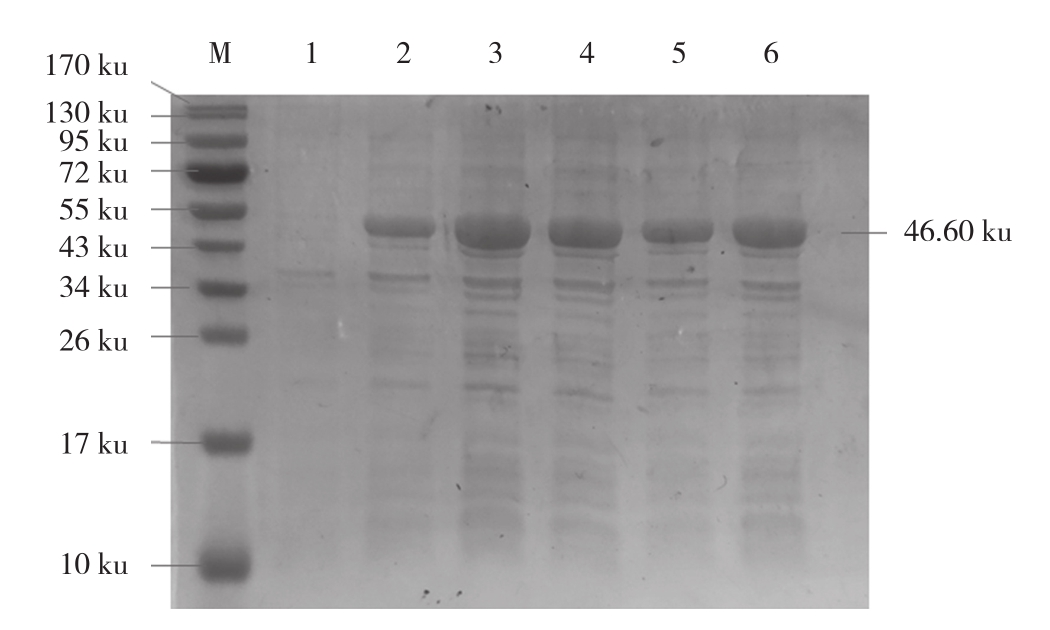
图2 不同IPTG 浓度对重组蛋白表达的影响
Fig. 2 Effects of different IPTG concentrations on recombinant protein expression
M:蛋白marker;1:诱导前的全菌蛋白;2~6:IPTG浓度分别为0.2、0.4、0.6、0.8、1.0 mmol/L
M: Protein marker; 1: Whole bacterial protein before induction;2-6: IPTG concentrations were 0.2, 0.4, 0.6, 0.8 and 1.0 mmol/L
2.2.2 不同诱导时间对重组蛋白表达的影响 不同诱导时间结果(图3)表明,IPTG诱导浓度为0.4 mol/L且其他条件相同时,时间的变化重组蛋白表达量随诱导时间变化呈先增加后稳定趋势,诱导4 h时重组蛋白表达量达到最大,故最佳诱导时间为4 h。
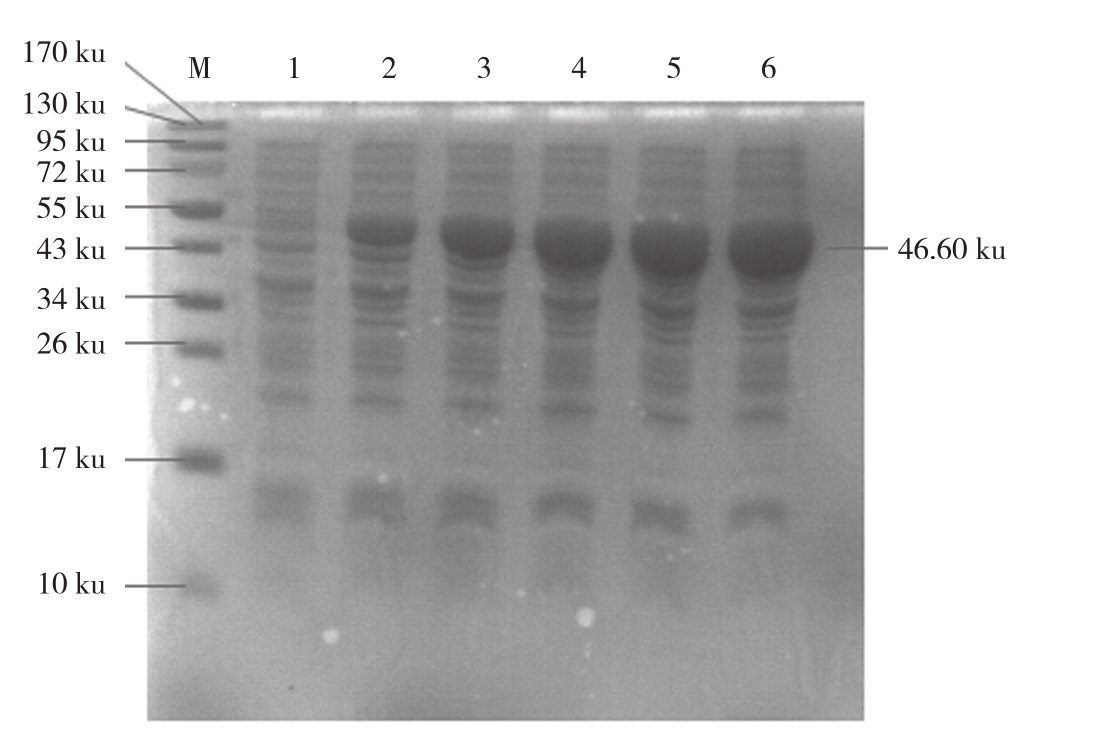
图3 不同诱导时间对重组蛋白表达的影响
Fig. 3 Effect of induction time on recombinant protein expression
M:蛋白marker;1:诱导前的全菌蛋白;2~6:分别诱导1、2、3、4、5 h 的重组蛋白
M: Protein marker; 1: Whole bacterial protein before induction;2-6: Recombinant protein induced at 1, 2, 3, 4 and 5 h
2.2.3 不同温度对重组蛋白表达的影响 由图4可见,重组菌株在20 ℃和37 ℃条件下诱导表达,上清和沉淀中均有目的蛋白出现,且上清的表达量均高于沉淀,以37 ℃时上清的蛋白表达量最高。
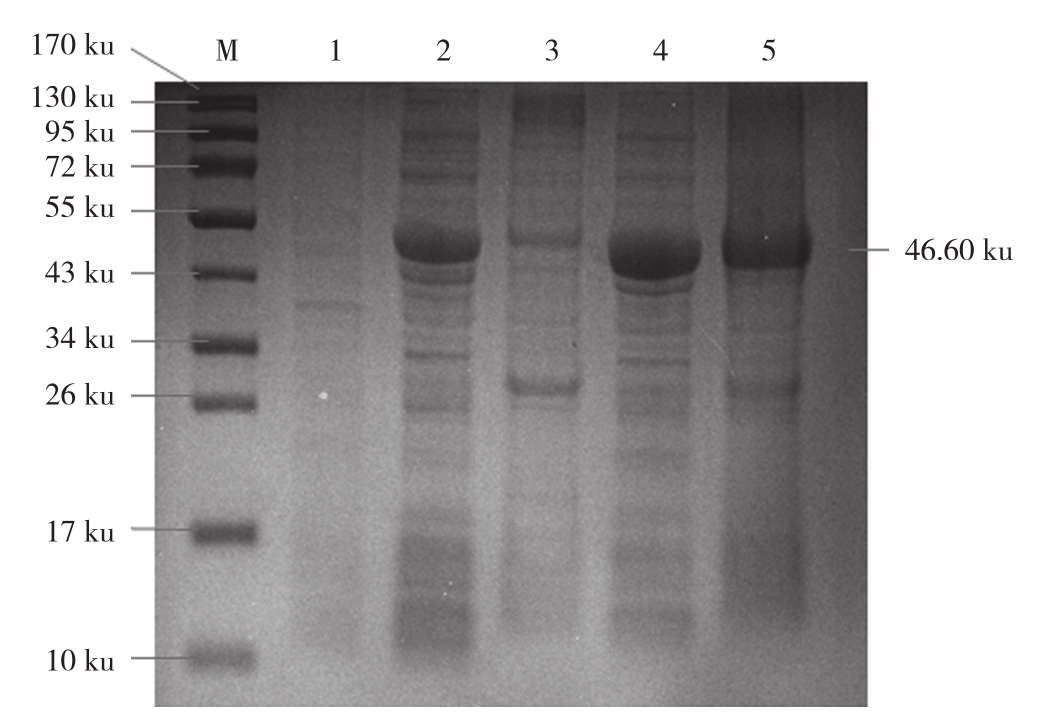
图4 不同温度对重组蛋白表达的影响
Fig. 4 Effect of different temperature on recombinant protein expression
M: 蛋白质marker;1:诱导前的全菌蛋白;2、3:20 ℃下诱导的上清和沉淀;4、5:37 ℃下诱导的上清和沉淀
M: Protein marker; 1: Whole bacterial protein before induction;2, 3: Supernatant and precipitate induced at 20 ℃;4, 5: Supernatant and precipitate induced at 37 ℃
2.3 Western blot分析

图5 Western blot 鉴定结果
Fig. 5 Result of Western blot identification
M:蛋白marker;1:纯化的上清蛋白;2:诱导前的全菌蛋白
M: Protein marker; 1: Purified supernatant protein;2: Whole bacterial protein before induction
在37 ℃、0.4 mmol/L IPTG条件下对重组菌株进行诱导表达4 h,然后对其细胞壁破碎并收集上清进行纯化。Western blot分析结果(图5)表明,经诱导的重组菌株出现符合预测值的目的条带,而未诱导的重组菌株无条带出现,说明SHMT蛋白表达成功。
3 讨论
目前生产上对哈维氏弧菌引起的病害多采用抗生素措施预防暴发,但会造成环境和食品抗生素残留以及耐药细菌的产生,引发各界人士担忧[21]。随着分子免疫学和基因工程等新型技术的快速发展,近年来出现了亚单位疫苗(Subunit vaccine)[22],又称重组亚单位疫苗。利用DNA重组,将致病菌某些抗原基因导入受体,使其在受体中快速表达,再将保护性抗原与其他适宜的试剂配合即可制成基因工程亚单位疫苗[23]。亚单位疫苗具有稳定性好、免疫效果好、免疫时效长等优点。因此,确定病原体主要保护性抗原并合成毒副作用低的亚单位疫苗逐渐受到人们关注。
本研究克隆了glyA基因,将其序列与大肠杆菌的丝氨酸羟甲基转移酶基因进行比对,发现序列同源性为58.59%,氨基酸序列同源性为56.81%,同源性较低;且从二级结构来看,哈维氏弧菌α-螺旋、β-转角、延伸链、随机线圈占比分别为45.71%、6.96%、13.23%、34.11%,而大肠杆菌中α-螺旋、β-转角、延伸链、随机线圈占比分别为46.28%、7.91%、14.63%、31.18%,这些序列上的差异可能有助于哈氏弧菌在海水中存活。
为获得哈维氏弧菌的SHMT蛋白,本研究扩增了哈维氏弧菌glyA基因,得到长为1 296 bp的序列,并将其在大肠杆菌pET28-BL21表达系统里表达,该载体含有噬菌体T7强启动子,可在含有T7噬菌体的BL21菌株中短时间内提高SHMT外源蛋白表达量;且pET28载体带有6×His-Tag标签,使得蛋白纯度更高,更利于提高后续SDSPAGE、Western blot检测的准确度[24-26];BL21是一株常见的大肠杆菌菌株,能够在最低限度的培养基中旺盛生长,不致病,也不大可能在宿主组织中存活并导致疾病[27]。
外源基因在大肠杆菌中表达的影响因素很多,主要包括不可控因素和可控因素,如外源基因、载体和宿主菌的结构为不可控因素,培养环境、营养状况、诱导浓度等为可控因素。因此,必须对其可控因素进行优化才能获得最大程度的表达[28]。
4 结论
本研究克隆出哈维氏弧菌中一段长为1 296 bp的glyA基因,与pET-28a连接并转入BL21中,成功构建BL21-pET-28a-glyA重组质粒。IPTG诱导后Western blot分析结果表明成功获得SHMT重组蛋白,对表达条件优化后发现,IPTG最佳诱导浓度、时间以及温度分别为0.4 mmol/L、4 h、37 ℃,研究结果为下一步研制亚单位疫苗奠定基础。
[1] 张晓华,钟英斌,陈吉祥. 哈维氏弧菌的生物学特性、流行病学及检测技术[J]. 中国海洋大学学报(自然科学版). 2007, 37(5):740-748. doi:10.3969/j.issn.1672-5174.2007.05.030.ZHANG X H, ZHONG Y B, CHEN J X. The biological characteristics,epidemiology and detection technology of Vibrio harveyi[J]. Journal of Ocean University of China(Natural Science Edition). 2007, 37(5):740-748. doi:10.3969/j.issn.1672-5174.2007.05.030.
[2] ZHOU J F, FANG W H, YANG X L, ZHOU S, HU L L, LI X C, QI X Y,SU H, XIE L Y. A nonluminescent and highly virulent Vibrio harveyi strain is associated with‘bacterial white tail disease’of Litopenaeus vannamei shrimp[J]. PLoS One, 2012, 7(2): e29961. doi:10.1371/journal.pone.0029961.
[3] WILLIAM L K, CHERYL J, JEFFREY G, NACHSHON S, JUSTIN R S,MAURIZIO L. Characterisation of the pacific oyster microbiome during a summer mortality Event[J]. Microbial Ecology, 2018, 77: 502–512.doi:10.1007/s00248.018.1226.9.
[4] 陈献稿,吴淑勤,石存斌,李宁求. 斜带石斑鱼病原菌(哈维氏弧菌)的分离与鉴定[J]. 中国水产科学,2004(4): 34-38. doi:10.3321/j.issn:1005-8737.2004.04.007.CHEN X G, WU S Q, SHI C B, LI N Q. Isolation and indentification of pathogenetic vibrio harveyi from estuary cod Epinephelus coioides[J].Journal of Fishery Sciences of China, 2004(4): 34-38. doi:10.3321/j.issn:1005-8737.2004.04.007.
[5] TU Z G, LI H Y, ZHANG X. Complete genome sequence and comparative genomics of the golden pompano(Trachinotus ovatus)pathogen, Vibrio harveyi strain QT520[J]. PeerJ, 2017, 5(12):e4127. doi:10.7717/peeri.4127.
[6] 范文辉,黄倢,王秀华,史成银,刘莉. 养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析[J]. 微生物学报,2005, 45(5): 665-670. doi:10.13343/j.cnki-wsxb.2005.05.002.FAN W H, HUANG J, WANG X H, SHI C Y, LIU L. Identification and phylogenetic study of pathogenic bacteria causing ulcer disease of cultured Turbot(Scophthalmus maximus)[J]. Acta Microbiologica Sinica, 2005, 45(5): 665-670. doi:10.13343/j.cnki-wsxb.2005.05.002.
[7] 徐芝亮. 哈维氏弧菌遗传多样性分析及毒力相关基因的检测[D].湛江: 广东海洋大学,2012. doi:10.7666/d.Y2215226.XV Z L. The analysis of genetic diversity of vibrio harveyi and its virulfence-associated genes[D]. Zhanjiang: Guangdong Ocean University, 2012. doi:10.7666/d.Y2215226.
[8] SAULNIER D, DECKER S D, HAFFNER P, COBRET L, ROBERT M,GARCIA C. A large-scale epidemiological study to identify bacteria pathogenic to pacific oyster Crassostrea gigas and correlation between virulence and metalloprotease-like activity[J]. Microbial Ecology,2010, 59(4): 787-798. doi:10.2307/40802178.
[9] 吴后波,潘金培. 海水网箱养殖高体鰤弧菌病致病菌研究[J]. 水产学报,1997, 21(20): 171-174.WU H B, PAN J P. Studies on the pathogenic bacteria of the vibriosis of seriola dumerili in maeine cage culture[J]. Journal of Fisheries of China, 1997, 21(20): 171-174.
[10] ALVAREZ J D, AUSTIN B, ALVAREZ A M, REYES H. Vibrio harveyi: a pathogen of penaeid shrimps and fish in Venezuela[J]. Fish Disease, 1998, 21: 313-316. doi:10.1046/j.1365-2761.1998.00101.x.
[11] AOKI T, EGUSA S. Drug sentitivity of Aeromonas liquefaciens isolated from freshwater fishes[J]. Nippon Suisan Gakkaishi, 1971, 37(3):176-185. doi:10.2331/suisan.37.176.
[12] 刘万红,刘爱福. GlyA基因及其编码的丝氨酸羟甲基转移酶[J]. 氨基酸和生物资源,2001, 23(2): 13-16.. doi:10.3969/j.issn.1006-8376.2001.02.004.LIU W H, LIU A F. GlyA gene and serine hydroxymethyltransferase encoded by GlyA gene[J]. Amino Acids and Biological Resources,2001,23(2): 13-16. doi:10.3969/j.issn.1006-8376.2001.02.004.
[13] 乔越美. 丝氨酸工程菌的构建及高效表达[D].南宁:广西大学,2004.QIAO Y M. Construction and high-rite expression of glyA recombinant bacteria[D]. Nanning: Guangxi University, 2004.
[14] 陈紫薇. 谷氨酸棒杆菌中L-丝氨酸转运蛋白的研究[D]. 无锡:江南大学,2018.CHEN Z W. Investigation of L-serine exporter in Corynebacterium glutamicum[D]. Wuxi: Jiangnan University, 2018.
[15] 陈丽梅,刘婷,曾智东. 拟南芥丝氨酸羟甲基转移酶基因与甲酸脱氢酶基因的双表达应用[P]. CN104774866A. 2015.CHEN L M, LIU T, ZENG Z D. Application of double expression of Arabidopsis thaliana serine hydroxymethyl transferase gene and formate dehydrogenase gene[P]. CN104774866A. 2015.
[16] 黄飞,吴高兵,黄小罗,洪玉枝. 嗜水气单胞菌丝氨酸羟甲基转移酶基因的克隆及酶学分析[J]. 农业生物技术学报,2010, 18(4):783-787. doi:10.3969/j.issn.1674-7968.2010.04.025.HUANG F, WU G B, HUANG X L, HONG Y Z. Molecular cloning and recombinant expression of serine hydroxymethyltransferase gene from Aeromonas hydrophila and its characterization[J]. Journal of Agricultural Biotechnology, 2010, 18(4): 783-787. doi:10.3969/j.issn.1674-7968.2010.04.025.
[17] 孙金秋,徐莞媛,马杭柯,高威,欧阳乐飞,高焕,阎斌伦. 脊尾白虾丝氨酸羟甲基转移酶基因的克隆及其表达特征分析[J]. 渔业科学进展 . 2020, 41(1): 127-134. doi:10.19663/j.issn2095-9869.20181229001.SUN J Q, XU W Y, MA H K, GAO W, OUYANG L F, GAO H, YAN B L. Cloning and expression analysis of serine hydroxyl methyltransferase(SHMT)genes from from Exopalamon carinicauda[J]. Fisheries Science Development, 2020, 41(1): 127-134. doi:10.19663/j.issn2095-9869.20181229001.
[18] 李俊龙. 家蚕丝氨酸羟甲基转移酶BmSHMT的鉴定及酶活性质研究[D].重庆:西南大学,2014.LI J L. Identification and enzymatic properties of serine hydroxymethtransferase from the silkworm, Bombyx mori[D].Chongqing: Southwest University, 2014.
[19] 马少鸿,黄郁葱,简纪常,蔡双虎. 哈维氏弧菌PspF基因的克隆及原核表达分析[J]. 广东海洋大学学报,2019, 39(5): 1-7.doi:10.3969/j.issn.1673-9159.2019.05.001.MA S H, HUANG Y C, JIAN J C, CAI S H. Cloning and prokaryotic expression analysis of gene PspF of Vibrio harveyi[J]. Journal of Guangdong Ocean University, 2019, 39(5): 1-7. doi:10.3969/j.issn.1673-9159.2019.05.001.
[20] 张崇文,于涟,毛芝娟,褚武英,钱荣华. 哈维氏弧菌外膜蛋白OmpK 基因的克隆及原核表达[J]. 水产学报,2006, 3(1): 9-14.doi:10.3321/j.issn:1000-0615.2006.01.002.ZHANG C W, YU L, MAO Z J,CHU W Y, QIAN R H. Cloning and expression of OmpK gene from Vibrio harveyi in Pseudosciaena crocea[J]. Journal of Fisheries of China, 2006, 3(1): 9-14.doi:10.3321/j.issn:1000-0615.2006.01.002.
[21] SOMMERSET I, KROSSØY B, BIERING E, FROST P. Vaccines for fish in aquaculture[J]. Expert Review of Vaccines, 2005, 4(1): 89-101. doi:10.1586/14760584.4.1.89
[22] 何超军. 哈维氏弧菌外膜蛋白OmpK的原核和真核表达[D].武汉:华中农业大学,2011. doi:10.7666/d.Y2003992.HE C J. Prokaryotic and eukaryotic expression of OmpK of vibrio harveyi[D].Wuhan: Huazhong Agricultural University, 2011.doi:10.7666/d.Y2003992.
[23] 郭文龙,朱瑞良. 基因工程亚单位疫苗的研究现状及发展动态[J]. 国外畜牧学(猪与禽),2008, 28(4): 77-80. doi:10.3969/j.issn.1001-0769.2008.04.035.GUO W L, ZHU R L. Research status and development trend of genetic engineering subunit vaccine[J]. Animal Husbandry Abroad(Pig and Poultry), 2008, 28(4): 77-80. doi:10.3969/j.issn.1001-0769.2008.04.035.
[24] 解庭波. 大肠杆菌表达系统的研究进展[J]. 长江大学学报,2008,5(3): 77-82. doi:10.3969/j.issn.1673-1409-B.2008.03.034.XIE T B. Research progress of E. coli expression system[J]. Journal of Yangtze University, 2008, 5(3): 77-82. doi:10.3969/j.issn.1673-1409-B.2008.03.034.
[25] 王靖瑶,王天女,卢磊,张帅,赵敏. 大肠杆菌Ⅰ型分泌表达系统研究进展及提高蛋白表达量的策略[J]. 中国生物工程杂志,2014, 34(6): 98-104. doi:10.13523/j.cb.20140614.WANG J Y, WANG T N, LU L, ZHANG S, ZHAO M. Research advances in secretary production of recombinant protein using Escherichia coli type I secretion system and strategies for enhancement of secretion of type I pathway[J]. Chinese Journal of Bioengineering,2014, 34(6): 98-104. doi:10.13523/j.cb.20140614.
[26] 周维,汤菊芬,高增鸿,甘桢,简纪常,吴灶和,丁燏. 哈维氏弧菌qnr基因的克隆及原核表达条件优化[J]. 广东海洋大学学报,2016, 36(1): 93-97. doi:10.3969/j.issn.1673-9159.2016.01.016.ZHOU W, TANG J F, GAO Z H, GAN Z, JIAN J C, WU Z H,DING Y. Cloning and optimization of prokaryotic expression of quinolone resistance gene in Vibrio Harveyi[J]. Journal of Guangdong Ocean University. 2016, 36(1): 93-97. doi:10.3969/j.issn.1673-9159.2016.01.016.
[27] SØRENSEN H P, MORTENSEN K K. Advanced genetic strategies for recombinant protein expression in Escherichia coli[J].Journal of biotechnology, 2005, 115(2): 113-128. doi:10.1016/j.jbiotec.2004.08.004.
[28] 蔡双虎,鲁义善,吴灶和,简纪常,汤菊芬,黄郁葱. 溶藻弧菌asp基因在大肠杆菌中表达活性研究及条件优化[J]. 广东海洋大学学报,2008, 28(3): 45-49. doi:10.3969/j.issn.1673-9159.2008.03.010.CAI S H, LU Y S, WU Z H, JIAN J C, TANG J F, HUANG Y C. The optimization of expression condition and activity analysis of asp gene from Vibrio alginolyticus in Escherichia coli[J]. Journal of Guangdong Ocean University, 2008, 28(3): 45-49. doi:10.3969/j.issn.1673-9159.2008.03.010.