【研究意义】近年我国年上岸产卵绿海龟数量急剧下降,《中国海龟保护行动计划(2019—2033年)》鼓励通过海龟全人工繁育,探索野外种群补充新途径,以加快野生海龟资源恢复[1]。但人工条件下亲龟活动空间受限,环境和食物的改变也会对子代的生长发育产生较大影响;水质变坏、体表外伤等容易导致龟苗染病,甚至大量死亡。目前,海龟疾病诊断和治疗困难,给人工繁育尤其龟苗规模化培育带来极大困扰[2]。弧菌是海水中的常见细菌,广泛存在于海洋环境和海洋生物的体表和肠道中,且能造成较为严重的细菌疾病[3],对大多数海水养殖对象包括鱼、虾、蟹和贝壳类等,均有不同程度危害。体表溃疡、出血,鳃丝腐烂等是弧菌病的主要症状[4]。开展海龟弧菌病的流行病调查及弧菌的耐药试验,对海龟的病害防控具有重要意义。【前人研究进展】在人工养殖条件下,饵料和环境变差可导致海龟体质下降,易感染寄生类、消化呼吸类及营养类疾病。海龟常见疾病多由细菌、真菌和病毒感染引起,一般表现为肛门肿大、四肢及腹甲发炎或体表多处皮肤、甲壳糜烂等。海龟腐甲病是环境恶化引起的一种常见的细菌、真菌混合感染疾病,若不加以控制,海龟会出现停食、精神萎靡和大面积糜烂,直至死亡[5]。澳大利亚昆士兰州2006—2009年调查发现,绿海龟常发寄生性疾病(41.8%)、胃肠道疾病(11.8%)、微生物感染疾病(5.2%)和体表创伤(5.2%),其他疾病患病率较低[6]。【本研究切入点】关于绿海龟的保护生物学、生态研究、人工饲养及组织病理学均有较多报道,病害分类和机理研究方面也有相关报道,但都比较笼统。国内已有假单胞菌属细菌(Pseudomonas medocina、Pseudomonas viridilivida)导致海龟腐皮病的报道[7],绿海龟弧菌病传染性强、死亡率高,但有关弧菌感染绿海龟致病的案例鲜有报道。【拟解决的关键问题】溶藻弧菌是一种嗜盐性弧菌,可引发人体中耳炎、伤口感染、肠炎等,也可感染多种水生动物,如斜带石斑鱼、凡纳滨对虾、大黄鱼、半滑舌鳎和紫贻贝等,引起大量死亡[8]。本研究于2019年10月在绿海龟稚龟鳍状肢腐皮病灶上分离纯化得到1株优势菌,对该菌株进行生理生化鉴定,16SrRNA序列和系统发育树初步分析,证实该菌株为溶藻弧菌。此外,对该菌进行药物敏感性测定,为防控绿海龟感染溶藻弧菌提供一定参考。
1 材料与方法
1.1 试验材料
海龟病料于2019年10月采自广东惠东海龟国家级自然保护区,为人工繁育过程中死亡绿海龟稚龟的鳍状肢。该鳍状肢边缘位置出现明显的表皮腐烂,组织坏死变黄并深入到骨骼处。
供试血平板、TCBS培养基及生化鉴定管购自广东环凯微生物科技有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;2×Taq Master Mix购自南京诺唯赞生物科技有限公司;凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司;DH5α感受态细胞及T载体pEASY-T1 Simple Cloning Kit购自北京全式金生物技术有限公司;药敏纸片购自杭州微生物试剂有限公司;16SrRNA的PCR扩增通用引物27F/1492R[9]及热休克蛋白基因(Heat shock protein 60 gene,hsp60)简并引物[10](表 1),由擎科生物科技有限公司合成。
1.2 试验方法
1.2.1 细菌分离纯化与形态观察 绿海龟稚龟的鳍状肢病料有明显腐皮症状(图1),用75%酒精擦拭表面,用无菌解剖剪在腐皮病灶上剪开缺口,将无菌接种环探入腐皮中,划线于血平板上,于30℃下培养24 h,挑取形态一致的优势菌单菌落进行革兰氏染色,同时划线于TCBS培养基上继续培养24 h,观察菌株是否生长。另挑取单菌落用LB液体培养基于30℃下过夜扩培。
表1 PCR扩增引物信息
Table 1 Primers for PCR amplification
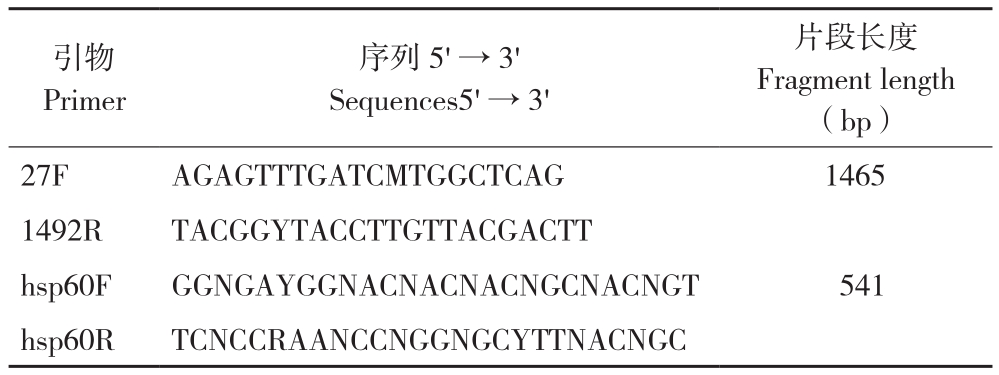
片段长度Fragment length(bp)27F AGAGTTTGATCMTGGCTCAG 1465 1492R TACGGYTACCTTGTTACGACTT hsp60F GGNGAYGGNACNACNACNGCNACNGT 541 hsp60R TCNCCRAANCCNGGNGCYTTNACNGC引物Primer序列5'→3'Sequences5'→3'
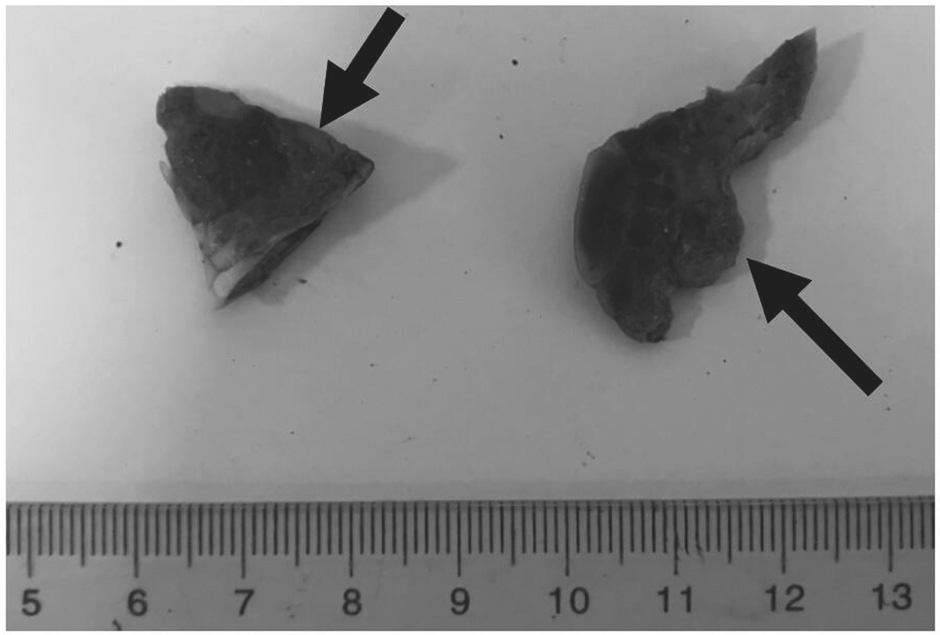
图1 绿海龟鳍状肢腐皮症状
Fig. 1 Symptoms of decayed skin of flippers in green sea turtle
1.2.2 菌株的生理生化特征鉴定 挑取纯化后的单菌落置于0.85%生理盐水中,将菌悬液制备成与0.5麦氏浊度标准管相同的浓度(约1.5×108 CFU/mL),按照使用说明接种到细菌生化鉴定管中,37℃下培养24 h。参照《常见细菌系统鉴定手册》[13]对分离菌株的生理生化结果进行鉴定。
1.2.3 菌株16SrRNA及hsp60基因序列鉴定 取扩培后的菌液,按照天根细菌DNA提取试剂盒提取菌体DNA作为PCR模板。16SrRNA基因PCR扩增体系为 50 µL:2×Taq Master Mix 25 µL,引 物 27F(10 µmol/L) 和 1492R(10 µmol/L)各 2 µL,模板 2 µL,补充 ddH2O 至 50 µL。PCR反应程序为:94℃预变性2 min;94℃变性30 s、55℃退火30 s、72℃延伸45 s,共35个循环;72℃延伸7 min。取PCR产物5 µL进行1.5%琼脂糖凝胶电泳,剩余PCR产物送至广州擎科生物科技有限公司进行测序,测序结果在NCBI进行BLAST比对。使用Mega7.0对序列进行分析并构建系统发育树。
hsp60基因的PCR 扩增体系为20 µL:2×Taq Master Mix 10 µL,引物 hsp60F(10 µmol/L)和 hsp60R(10 µmol/L)各 1 µL,模板 1 µL,补充ddH2O至20 µL。PCR反应程序为:94℃预变性2 min;94℃变性30 s、55℃退火30 s、72℃延伸30 s,共35个循环;72℃延伸7 min。取PCR产物10 µL进行1.5%琼脂糖凝胶电泳并进行切胶回收,使用pEASY-T1 Simple Cloning Kit进行连接,转化感受态细胞DH5α,涂布氨苄抗性LB平板,挑选阳性克隆摇菌后送至广州擎科生物科技有限公司进行测序,测序结果在NCBI进行BLAST比对。
1.2.4 菌株药敏试验 参照曾德乾等[11]方法,用纸片扩散法(Kirby-Bauer法),以大肠杆菌ATCC25922为参考菌株,检测分离菌对 27种药物的敏感性。取200 μL 0.5麦氏浊度(约1.5×108 CFU/mL)的菌悬液涂布于含0.1%NaCl的MH琼脂平板,每个平板均匀贴上6个药敏纸片,于30℃条件下倒置培养24 h,测量并记录抑菌圈直径,依据 WS/T125-1999[12]判断分离菌株的药物敏感性。
2 结果与分析
2.1 细菌分离纯化与形态观察
分离菌株在血平板生长,菌落为乳白色,扁平,有光泽,有粘性且边缘皱褶(图2);分离菌株也能在TCBS培养基上生长,菌落为黄色圆形,稍隆起,有光泽,有粘性且边缘光滑(图3)。经革兰氏染色,菌株为革兰氏阴性短杆菌(图4),命名为CMRT91026。
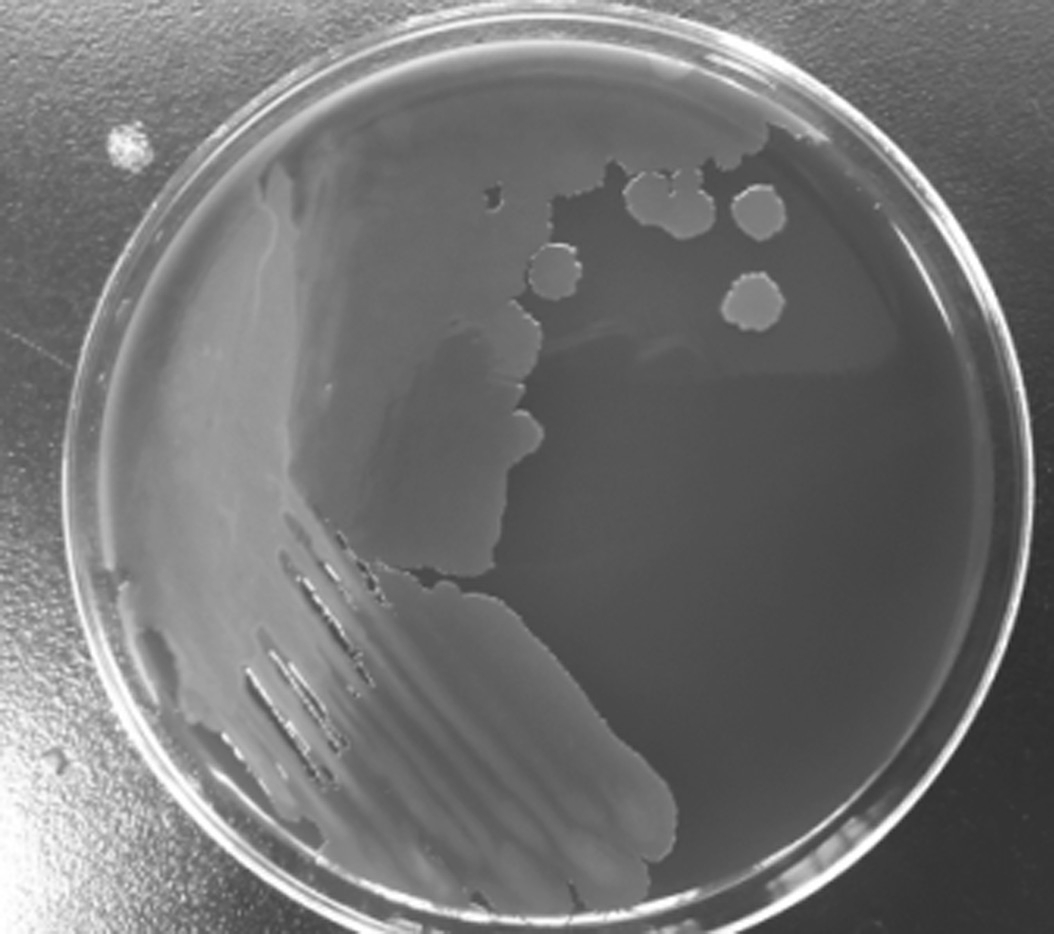
图2 血平板上的菌落形态
Fig. 2 Morphology of strains on blood agar

图3 TCBS培养基上的菌落形态
Fig. 3 Morphology of strains on TCBS medium
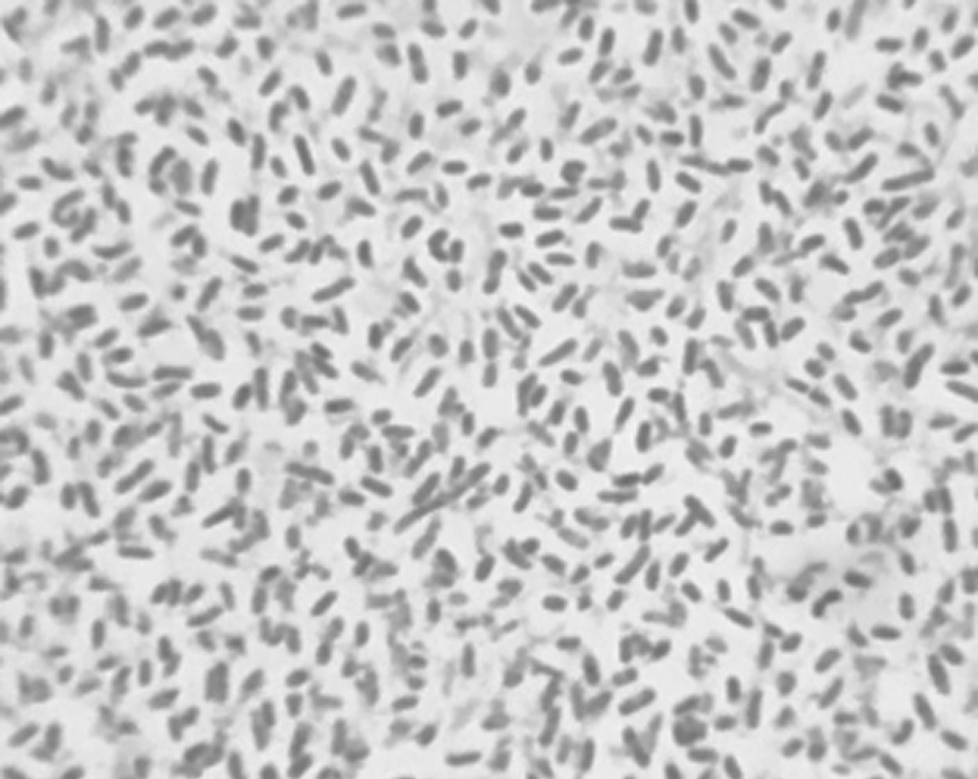
图4 分离菌株革兰氏染色
Fig. 4 Gram stain of isolated strains
2.2 菌株的生理生化特征鉴定
结果(表2)显示,菌株CMRT91026的VP反应,蔗糖、甘露糖、赖氨酸脱羧酶检测呈阳性;该菌不能在无盐胨水中生长,在3%、6%、8%和10%的NaCl胨水中均能生长;葡萄糖产气,蛋白胨水、阿拉伯糖、肌醇和精氨酸双水解酶均呈阴性。参照《常见细菌系统鉴定手册》[13],菌株CMRT91026与标准株ATCC33787的生理生化特征鉴定结果一致,初步鉴定为溶藻弧菌。
2.3 菌株的16SrRNA及hsp60基因序列鉴定
菌株CMRT91026的16SrRNA及hsp60基因PCR扩增结果见图5。将菌株CMRT91026的16SrRNA测序结果在NCBI进行BLAST比对,结果显示该菌与GenBank 登录号为MT549165.1的溶藻弧菌同源性为100%。使用MEGA7.0软件构建菌株的系统发育树(图6),CMRT91026与溶藻弧菌NR_113781、NR_117895.1聚为一支。hsp60基因扩增片段经连接载体测序,NCBI序列比对结果显示该序列与溶藻弧菌(GenBank登录号为AF230931.1)hsp60的基因序列同源性为99.28%,进一步确定分离菌株为溶藻弧菌。
2.4 菌株药敏试验
药敏试验结果(表3)显示,CMRT91026菌株对新霉素、多西环素、阿莫西林、利福平、头孢拉定、头孢呋辛、链霉素、麦迪霉素、阿米卡星、庆大霉素、环丙沙星、苯唑西林、红霉素、阿奇霉素和四环素等15种药物耐药;对氟苯尼考、复方新诺明、妥布霉素、大观霉素、诺氟沙星和氨曲南等6种药物中介;对恩诺沙星、萘啶酸、米诺环素、左氧氟沙星、头孢吡肟和头孢曲松等6种药物敏感。
表2 菌株CMRT91026生理生化特征鉴定结果
Table 2 Physiological and biochemical identification results of strain CMRT91026

注:“+”为反应阳性,“-”为反应阴性。
Note: “+” represents positive, “-” represents negative.
检测项目Test item标准参考株 ATCC33787 Standard reference strain ATCC33787菌株CMRT91026 Strain CMRT91026葡萄糖产气Glucose gas production - -VP + +蛋白胨水Pepton water - -蔗糖Sucrose + +甘露糖Mannose + +阿拉伯糖Arabinose - -肌醇Inositol - -赖氨酸脱羧酶Lysine decarboxylase + +精氨酸双水解酶Arginine digydrolase - -无盐胨水0% NaCl glucose phosphate peptone water medium - -3%NaCl胨水 3% NaCl glucose phosphate peptone water medium + +6%NaCl胨水 6% NaCl glucose phosphate peptone water medium + +8%NaCl胨水 8% NaCl glucose phosphate peptone water medium + +10%NaCl胨水 10% NaCl glucose phosphate peptone water medium + +
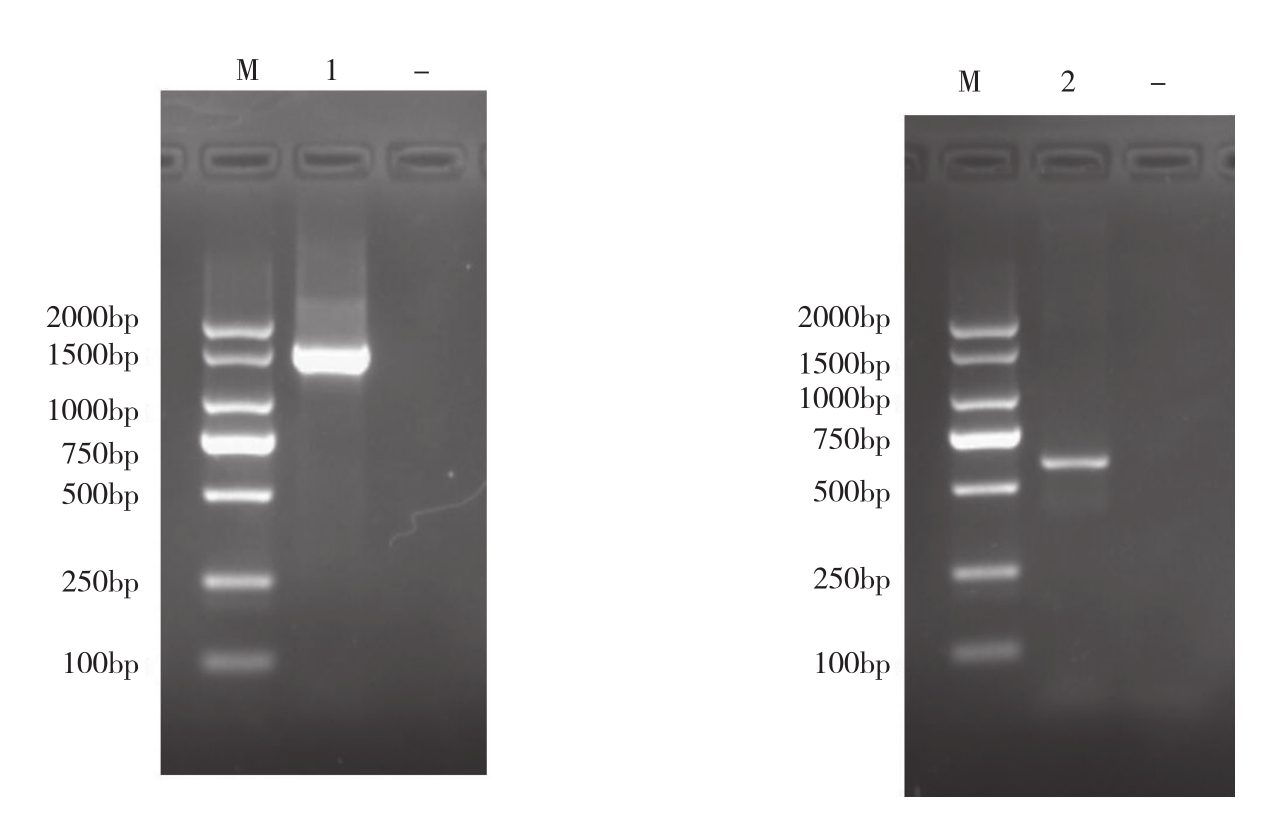
图5 菌株CMRT91026 16SrRNA和hsp60基因的PCR扩增结果
Fig. 5 PCR amplification of 16SrRNA and hsp60 gene from strain CMRT91026
M:2000DNA Marker;-:空白对照; 1:菌株16SrRNA扩增片段; 2:菌株hsp60基因扩增片段
M: 2000 DNA Marker, -: Blank control, 1: Amplification fragment of 16SrRNA, 2: Amplification fragment of hsp60 gene
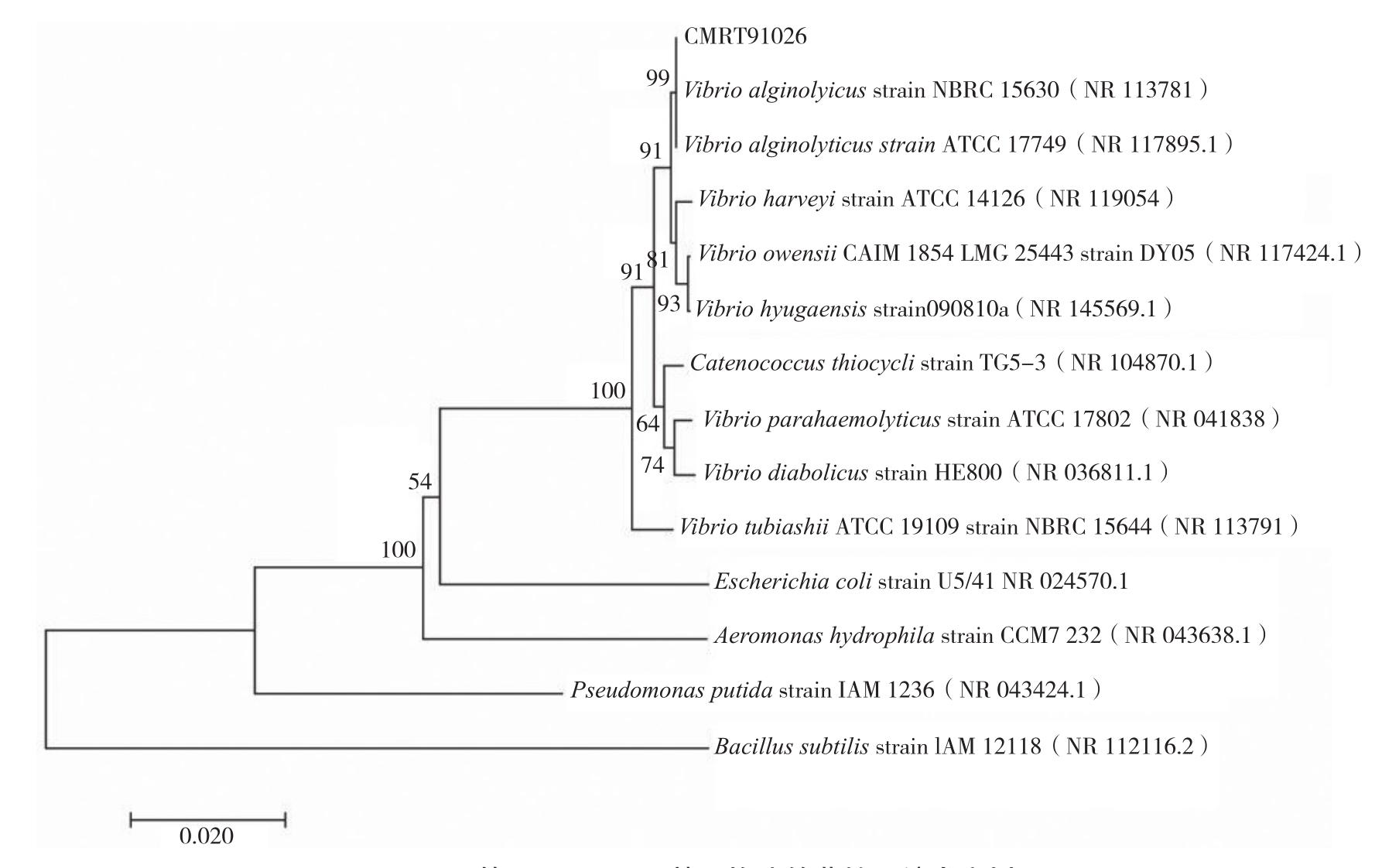
图6 基于16SrRNA基因构建的菌株系统发育树
Fig. 6 Phylogenetic tree based on 16SrRNA gene sequence
3 讨论
溶藻弧菌是海洋中一种常见的弧菌,有关资料显示,海水和海产品中的溶藻弧菌带菌率分别为28%和13.2%;淡水产品中鱼、蟹、贝类和虾等同样存在溶藻弧菌污染,污染率不具有种的特异性[14];广州地区海产品、淡水产品及外环境水体中溶藻弧菌污染严重, 检出率为 20.31%,其中海产品的检出率高达26.30%,淡水产品检出率为 11.67%[15]。目前,国内外有较多关于溶藻弧菌感染水生动物致病的现象,Sangster等[16]对乌贼种群死亡原因进行调查发现,53个病例中有33个病例的溶藻弧菌呈阳性,表明该菌可引起继发溃疡感染,特别是受伤个体;溶藻弧菌作为潜在的细菌性病原体也可感染罗氏沼虾导致死亡[17-18];韩风杰等[19]在山东某魁蚶养殖区发病魁蚶和养殖水体中分离到的溶藻弧菌通过回归可使健康魁蚶发病,死亡率达100%。近年来也有相关报道证实溶藻弧菌可感染人引起食物源疾病,引发呼吸道感染、血液感染、肠胃炎、伤口感染、呕吐、腹痛和腹泻等多种症状[20-22]。溶藻弧菌可感染并致病的范围在逐步扩大,因此对其引起的污染及病害必须予以重视。
表3 菌株CMRT91026药物敏感性试验结果
Table 3 Antibiotic Drug of strain CMRT91026
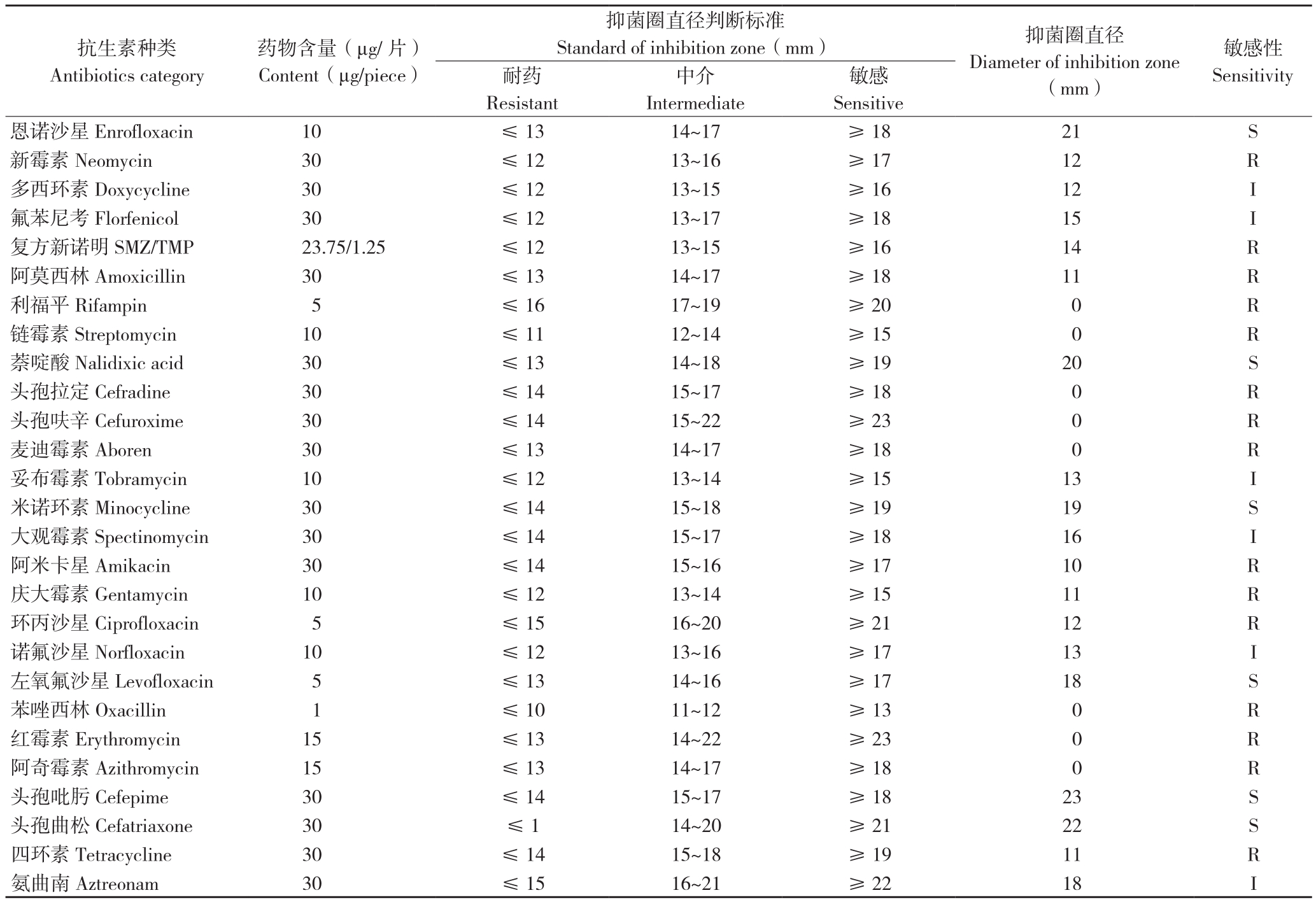
注: R:耐药; I:中介; S:敏感。
Note: R: Resistant; I: Intermediate; S: Sensitive.
敏感Sensitive恩诺沙星Enrofloxacin 10 ≤13 14~17 ≥18 21 S新霉素Neomycin 30 ≤12 13~16 ≥17 12 R多西环素Doxycycline 30 ≤12 13~15 ≥16 12 I氟苯尼考Florfenicol 30 ≤12 13~17 ≥18 15 I复方新诺明SMZ/TMP 23.75/1.25 ≤12 13~15 ≥16 14 R阿莫西林Amoxicillin 30 ≤13 14~17 ≥18 11 R利福平Rifampin 5 ≤16 17~19 ≥20 0 R链霉素Streptomycin 10 ≤11 12~14 ≥15 0 R萘啶酸Nalidixic acid 30 ≤13 14~18 ≥19 20 S头孢拉定Cefradine 30 ≤14 15~17 ≥18 0 R头孢呋辛Cefuroxime 30 ≤14 15~22 ≥23 0 R麦迪霉素Aboren 30 ≤13 14~17 ≥18 0 R妥布霉素Tobramycin 10 ≤12 13~14 ≥15 13 I米诺环素Minocycline 30 ≤14 15~18 ≥19 19 S大观霉素Spectinomycin 30 ≤14 15~17 ≥18 16 I阿米卡星Amikacin 30 ≤14 15~16 ≥17 10 R庆大霉素Gentamycin 10 ≤12 13~14 ≥15 11 R环丙沙星Ciprofloxacin 5 ≤15 16~20 ≥21 12 R诺氟沙星Norfloxacin 10 ≤12 13~16 ≥17 13 I左氧氟沙星Levofloxacin 5 ≤13 14~16 ≥17 18 S苯唑西林Oxacillin 1 ≤10 11~12 ≥13 0 R红霉素Erythromycin 15 ≤13 14~22 ≥23 0 R阿奇霉素Azithromycin 15 ≤13 14~17 ≥18 0 R头孢吡肟Cefepime 30 ≤14 15~17 ≥18 23 S头孢曲松Cefatriaxone 30 ≤1 14~20 ≥21 22 S四环素Tetracycline 30 ≤14 15~18 ≥19 11 R氨曲南Aztreonam 30 ≤15 16~21 ≥22 18 I抗生素种类Antibiotics category药物含量(μg/片)Content(μg/piece)敏感性Sensitivity耐药Resistant抑菌圈直径判断标准Standard of inhibition zone(mm) 抑菌圈直径Diameter of inhibition zone(mm)中介Intermediate
由于产卵场、海藻(草)床、珊瑚礁等重要栖息地丧失,外加人为捕杀、渔业捕捞、非法贸易、海洋污染以及饵料食物资源下降等因素,全球范围内的海龟都面临极大的生存威胁[23-24]。在海龟资源的保护策略上,一方面,需要制定相关法律法规和技术规范,如加强洄游通道和关键栖息地保护,制订人工繁育及救护技术规范等;另一方面,要加强海龟病害防控。目前国内关于海龟感染弧菌致病的报道尚空白,虽然海龟生存及抗病能力都很强,但由于环境恶化,病害问题日益严重。本研究采用最基本的流行病学调查方法,分离纯化海龟腐皮病的疑似病原菌,并对分离菌株进行生化鉴定和分子生物学鉴定,得到了较为准确的结果,同时也开展了相关的药敏试验,得到该菌敏感的药物,可用于指导临床防治。但本研究未对分离菌株进行人工回归感染试验,以进一步确定分离菌是否为真正病原菌及其致病能力强弱。主要是因为考虑到绿海龟是国际濒危和珍稀资源,科研中也应得到充分保护;其次可用中华草龟等龟鳖目物种进行回归感染试验,但个体及生存环境差异较大,可能会导致试验结果误差较大,目前关于将龟鳖目中物种作为攻毒模型进行试验的研究鲜有报道,缺少有力依据。另外,刘晓斐等[25]建立溶藻弧菌动物感染模型中采用小鼠,通过半数致死量研究感染量和感染时间,并对分离株进行药敏试验。在后续探讨中我们将尝试使用中华草龟或小鼠等动物感染模型进行相关试验,这对于探讨溶藻弧菌的致病机制及其防治都具有重要意义。
采用通用引物测序16SrRNA序列,我们发现在进行NCBI的BLAST比对时,几乎所有同源性高的菌株均属于弧菌属(Vibrio),且同源性均达到99%~100%。由于弧菌种间16SrRNA序列相似度极高,我们无法仅靠16SrRNA序列比对就将这些菌株鉴定到种的水平。16SrRNA序列的系统发育树分析也显示,大多数菌株与弧菌模式种无法归为一簇,因此16SrRNA基因在弧菌种的分类鉴定上分辨率并不高。Pascual等[26]研究表明,弧菌属的16SrRNA序列在种内与种间遗传距离上具有非常大的重叠,无法提供种的水平区分能力。龚婷等[27]进一步采用基于4种看家基因(rpoA、pyrH、gapA和topA)的多位点序列分析技术(MLSA)对分离到的弧菌菌株进行分类鉴定,4种看家基因串联后的多态位点比率高达41.1%,远高于16SrRNA基因的13.4%。在本研究中我们只分析了分离菌株的16SrRNA序列和hsp60基因序列,显然还有一定不足,但结合标准菌株和试验菌株的生化鉴定,能较为准确地确定菌株CMRT91026为溶藻弧菌。
当前细菌疾病的治疗仍以抗生素为主,抗生素的滥用导致细菌耐药性不断提高。对临床分离的病原菌进行类别鉴定以及药物敏感性试验,可根据病原菌特点进行有效药物的筛查与确定,促进抗生素的合理使用并提高治疗效果,因此临床药敏试验有重要指导意义。从27种抗生素药敏试验结果来看,本次分离的溶藻弧菌CMRT91026仅对喹诺酮类药物的恩诺沙星、萘啶酸和左氧氟沙星3种药物敏感,对四环素类药物米诺环素敏感,对三代头孢类药物的头孢吡肟和头孢曲松敏感。冼钰茵等[28]对广州市售水产品分离的118株溶藻弧菌进行药敏试验分析,结果显示四环素耐药率为0、环丙沙星及庆大霉素耐药率均为2.54%,与菌株CMRT91026药敏试验结果不一致;此外,郑晨晖[29]分离到的黄姑鱼源溶藻弧菌对氟苯尼考和诺氟沙星敏感,与菌株CMRT91026药敏结果也不一致。由此可以推断,菌株CMRT91026出现多重耐药现象。不同物种、不同环境及不同区域,即使感染的是同一种细菌,但细菌对于同种抗生素也会呈现出不同的敏感和耐药情况。症状相同也可能由不同细菌引起或者交叉感染,如果凭经验用药往往适得其反。本研究采用大肠杆菌标准菌株25922一同进行药敏试验,且质控菌抑菌圈在质控范围内,药敏结果更加可靠。对于敏感药物是否在治疗海龟腐皮病有明显效果,则需要进一步试验观察。
4 结论
本研究在患病绿海龟稚龟鳍状肢腐皮病灶中发现优势菌株CMRT91026,该菌株能在TCBS平板上生长,菌株的VP、赖氨酸脱羧酶和10%NaCl胨水呈阳性,与溶藻弧菌标准株ATCC33787结果一致。经16SrRNA序列分析,分离菌株与GenBank 登录号为 MT549165.1的溶藻弧菌同源性为100%,系统发育树上与溶藻弧菌聚为一簇;该菌株的hsp60基因序列与GenBank登录号为AF230931.1的溶藻弧菌的hsp60基因序列同源性为99.28%,进一步证实分离菌株CMRT91026为溶藻弧菌,这是国内海龟感染溶藻弧菌的首次报道。药敏试验结果显示,本次分离菌株CMRT91026具有多重耐药现象,对多新霉素、多西环素、头孢拉定、麦迪霉素、阿米卡星、环丙沙星和四环素等15种药物耐药;对恩诺沙星、头孢曲松和米诺环素等6种药物敏感。因此,在选择治疗药物时,应该选择更有针对性、更有效且低残留的抗生素。此外,可选择中草药辅助治疗,中草药对水产动物疾病防治起良好作用,复方中草药与中西药联用防治具有较大的应用优势[30]。当前环境下,研究与开发中草药治疗绿海龟等水生动物疾病具有广阔前景。在规模化生产中,可探讨通过循环水系统开展龟苗培育,严格水质净化、投喂优质配合饲料及生境营造等技术规程,科学确定养殖密度、减少龟苗打斗受伤,增强免疫能力,做到预防为主、防控结合,提高育苗成活率。本研究在后续工作中需收集更多绿海龟感染致病性弧菌的案例,充分展开对海龟溶藻弧菌病原学特征和流行病学调查,进一步探讨回归感染试验及感染模型选择,分析溶藻弧菌对海龟的毒力强弱和致病机制。
[1] 农业农村部. 海龟保护行动计划(2019—2033年)[Z]. 2019.The Ministry of Agriculture and Rural Affairs. Turtle conservation action plan(2019—2033)[Z]. 2019.
[2] 刘译浓,章宇思,潘连德,徐培培,郑佳瑞.海龟资源保护及其疾病的研究进展[J]. 水产养殖,2015,36(1):35-40. doi:10.3969/j.issn.1004-2091.2015.01.009.LIU Y N, ZHANG Y S, PAN L D, XU P P, ZHENG J R. Research progress on turtle resources protection and diseases[J]. Aquaculture,2015,36(1):35-40. doi:10.3969/j.issn.1004-2091.2015.01.009.
[3] 丁淑妍,侯丽艳,于成勇,张剑,解洁,黄忠义,曲业敏,李文晓,王明义.海洋性弧菌致病机制研究进展[J]. 职业与健康,2019,35(7):984-989.doi:10.13329/j.cnki.zyyjk.2019.0261.DING S Y, HOU L Y, YU C Y, ZHANG J, XIE J, HUANG Z Y, QU Y M, LI W X, WANG M Y. Research progress on pathogenic echanism of marine vibrio[J]. Occupation and Health, 2019,35(7):984-989.doi:10.13329/j.cnki.zyyjk.2019.0261.
[4] CRAIG B A, OLIVER D, MUMIRUL A, AFSAR A, WALDOR M,QADRI F, MARTINEZ U J. Vibrio spp. infections[J]. Nature Reviews Disease Primers, 2018,4(1):8. doi:10.1038/s41572-018-0005-8.
[5] 王俊,邵庆均.海龟的主要疾病及防治措施[J]. 水产养殖,2005(6):30-33. doi :10.16178/j .issn.0528 -9017.2006.02.039.WANG J, SHAO Q J. The main diseases and control measures of sea turtles[J]. Aquaculture, 2005(6):30-33. doi :10.16178/j .issn.0528-9017.2006.02.039.
[6] MARK F, JANET C, PATTERSONK, COLIN J L, PAUL C, MILL S.Health surveillance of stranded green turtles in Southern Queensland,Australia(2006-2009): An epidemiological analysis of causes of disease and mortality[J]. EcoHealth, 2010(7):135-145. doi:10.1007/s10393-010-0300-7.
[7] 项楠,王荣丹,曹露露,胡振兴,符史杭.绿海龟腐皮病病原体的Biolog鉴定[J]. 北京农业,2015(5):81-83. doi:10.3969/j.issn.1000-6966.2015.05.064.XIANG N, WANG R D, CAO L L, HU Z X, FU S H. The green sea turtle biolog identification of the pathogens of rotten skin disease[J].Beijing Agriculture, 2015(5): 81-83. doi:10.3969 / j.issn.1000-6966.2015.05.064.
[8] 雷美华,喻大鹏,邓国华,时少坤,黄浦江,鲁义善,冯卫权.线纹海马源溶藻弧菌的分离、鉴定及药敏分析[J/OL].基因组学与应用生物学,http://kns.cnki.net/kcms/detail/45.1369.Q.20191220.1442.003.html.LEI M H, YU D P, DENG G H, SHI S K, HUANG P J, LU Y S,FENG W Q. Isolation, identification and drug sensitivity analysis of Vibrio alginolyticus from Hippocampus[J/OL]. Genomics and Applied Biology, http://kns.cnki.net/kcms/detail/45.1369.Q.20191220.1442.003.html.
[9] LANE D J. 16S/23S rRNA sequencing // STACKEBRANDT E,GOODFELLOW M. Nucleic acid techniques in bacterial systematics[M]. Chichester,UK: John Wiley & Son Ltd,1991:115-175.
[10] KWOK, ANITA Y C W, JASON T C, MICHAEL N G, LAI K M, LUCY C, ANTHONY W.Phylogenetic study and identification of human pathogenic Vibrio species based on partial hsp60 gene sequences[J].Canadian Journal of Microbiology, 2002, 48(10):903-910.
[11] 曾德乾,冯娟,徐力文,苏友禄,郭志勋.海水养殖鱼哈维弧菌分离株的耐药谱型分析[J]. 中国水产科学,2015,22(1):129-138.doi:10.3724/SP.J.1118.2015.00098 ZENG D Q, FENG J, XU L W, SU Y L, GUO Z X. Analysis of drug resistance profile of Vibrio harveyi isolates in marine cultured fish[J]. Chinese Journal of Fishery Sciences, 2015,22(1):129-138.doi:10.3724/SP.J.1118.2015.00098
[12] 中华人民共和国卫生部. WS/T125-1999纸片法抗菌药物敏感试验标准[S].北京:中国标准出版社,2000.Ministry of Health of the People's Republic of China. WS / T125-1999 Standard of antibiotics susceptibility test(Kirby-Bauer method)[S].Beijing: China Standard Press, 2000.
[13] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001.DONG X Z ,CAI M Y. Manual for Identification of Common Bacterial Systems[M].Beijing: Science Press, 2001.
[14] 林业杰,林勇,林金财.海产品携带溶藻弧菌调查[J]. 海峡预防医学杂志,2000,6(2):45. doi:10.3969/j.issn.1007-2705.2000.02.026.LIN Y J, LIN Y, LIN J C. Investigation on Vibrio alginolyticus carried by seafood[J]. Journal of Strait Preventive Medicine, 2000,6(2):45.doi:10.3969/j.jssn. 1007-2000.02.026.
[15] 张晶,陈佳璇,伍业健,陶霞,吴新伟. 广州地区水产品及外环境水体溶藻弧菌污染状况与毒力相关基因分析[J]. 中国卫生检验杂志,2016(4):539-541.ZHANG J, CHEN J X, WU Y J, TAO X, WU X W. Analysis of the contamination status and virulence-related genes of Vibrio alginolyticus in aquatic products and external environmental water in Guangzhou[J]. Chinese Journal of Health Laboratory Technology,2016(4): 539-541.
[16] SANGSTER C R, SMOLOWITZ R M. Description of Vibrio alginolyticus infection in cultured Sepia officinalis, Sepia apama, and Sepia pharaonis[J]. Biological Bulletin, 2003, 205(2):233-234.
[17] 苗鹏飞,杨映,谭淑雯,陈言峰,彭钟琴,吴勇亮,于辉.罗氏沼虾致病性溶藻弧菌的鉴定及药敏分析[J]. 水产科学,2018,37(3):384-388. doi:10.16378/j.cnki.1003-1111.2018.03.016.MIAO P F, YANG Y, TAN S W, CHEN Y F, PENG Z Q, WU Y L, YU H. Identification and drug sensitivity analysis of pathogenic Vibrio alginolyticus in Macrobrachium rosenbergii[J]. Aquatic Sciences,2018,37(3):384-388. doi:10.16378/j.cnki.1003-1111.2018.03.016.
[18] ABDUL HANNAN M D, MAHBUBUR RAHMAN M D, NURUNNABI MONDAL M D, SUZAN CHANDRA DEB, CHOWDHURY GAZlLIMA, TOFAZZAL ISLAM M D. Molecular identification of Vibrio alginolyticus causing vibriosis in shrimp and its herbal remedy.[J]. Polish Journal of Microbiology, 2019,68(4). doi:10.33073/pjm-2019-042.
[19] 韩风杰,徐文娜,刘敏,李启萌,王雪鹏.魁蚶溶藻弧菌分离鉴定与药敏试验[J]. 山东畜牧兽医,2016,37(5):13-14. doi:10.3969/j.issn.1007-1733.2016.05.007.HAN F J, XU W N, LIU M, LI Q M, WANG X P. Isolation,identification and drug sensitivity test of Vibrio alginolyticus in Scapharcabroughtonii[J]. Shandong Animal Husbandry and Veterinary Medicine, 2016,37(5):13-14. doi:10.3969/j.issn.1007-1733.2016.05.007.
[20] LEE K K, LIU P C, CHEN Y C, HUANG C Y. The implication of ambient temperature with the outbreak of vibriosis in cultured small abalone Haliotis diversicolor supertexta Lischke[J]. Journal of Thermal Biology, 2001,26(6). doi:org/10.1016/S0306-4565(1)00004-3.
[21] KHOUADJA S, SNOUSSI M, SAIDI N, BAKHROUF A. Phenotypic characterization and RAPD fingerprinting of Vibrio parahaemolyticus and Vibrio alginolyticus isolated during Tunisian fish farm outbreaks[J]. Folia microbiologica, 2013,58(1):17-26. doi:10.1007/s12223-012-0174-x.
[22] CHANG C C, YEH M S, LIN H K. The effect of Vibrio alginolyticus infection on caspase-3 expression and activity in white shrimp Litopenaeus vannamei[J]. Fish Shellfish Immunol, 2008, 25(5):672-678. https://doi.org/10.1016/j.fsi.2008.09.004
[23] LUTCAVAGE M E, PLOTKIN P, WITHERINGTON B. Human impacts on sea turtle survival// LUTZ P L,MUSICK J A,WYNEKEN J. The Biology of Sea Turtles[M]. Boca Raton, FL: CRC Press,1997: 387-410.
[24] 王静,郭睿,杨袁筱月,张宇.中国海龟受威胁现状和保护建议[J]. 野生动物学报,2019,40(4):1070-1082. doi:10.19711/j.cnki.issn2310-1490.2019.04.036 WANG J, GUO R, YANG Y X Y, ZHANG Y. The threatened status of Chinese sea turtles and protection suggestions[J]. Journal of Wildlife, 2019,40(4):1070-1082. doi:10.19711/j.cnki.issn2310-1490.2019.04.036
[25] 刘晓斐,张河林,胡志德,曹源,胡成进.溶藻弧菌动物感染模型的建立及药敏试验分析[J]. 中国实验诊断学,2014,18(3):361-363.LIU X F, ZHANG H L, HU Z D, CAO Y, HU C J. Establishment of animal infection model of Vibrio alginolyticus and analysis of drug sensitivity test[J]. Chinese Journal of Laboratory Diagnosis,2014,18(3):361-363.
[26] PASCUAL J, MACIAN M C, ARAHAL D R, GARAY E, PUJALTE M J. Multilocus sequence analysis of the central clade of the genus vibrio by using the 16s rrna, reca, pyrh, rpod, gyrb, rctb and toxr genes[J].International Journal of Systematic & Evolutionary Microbiology,2010,60(1): 154-165.
[27] 龚婷,骆祝华,于艳萍,GUNTER J.基于16SrDNA和看家基因序列分析技术的鲍鱼养殖水体弧菌种类的鉴定[J]. 应用海洋学学报,2014,(4):531-538. doi:10.3969/J.ISSN.2095-4972.2014.04.011.GONG T LUO Z H, YU Y P, GUNTER J. Identification of vibrio species in aquaculture abalone based on 16SrDNA and housekeeping gene sequence analysis technology[J]. Journal of Applied Oceanography,2014(4):531-538. doi:10.3969/J.ISSN.2095-4972.2014.04.011.
[28] 冼钰茵,余翀,阮荣勇,易敏英,吴希阳,凌莉.广州市售水产品副溶血弧菌和溶藻弧菌的耐药性评估[J]. 安徽农业科学,2017,45(28):74-77. doi:10.3969/j.issn.0517-6611.2017.28.026.XIAN Y Y, YU C, RUAN R Y, YI M Y, WU X Y, LING L.Evaluation of drug resistance of Vibrio parahaemolyticus and Vibrio alginolyticus in aquatic products sold in Guangzhou[J].Anhui Agricultural Sciences, 2017,45(28):74-77. doi:10.3969/j.issn.0517-6611.2017.28.026.
[29] 郑晨晖.黄姑鱼源溶藻弧菌的分离鉴定[J]. 北京农业,2014(27):7-9.doi:10.3969/j.issn.1000-6966.2014.27.005.ZHENG C H. Isolation and identification of Vibrio alginolyticus from Huanggu Fish[J]. Beijing Agriculture, 2014(27):7-9. doi 10.3969/j.issn.1000-6966.2014.27.005.
[30] 徐晓津,李秀华,马一帆,李慧耀,祁欣,郑江,吕海龙,鄢庆枇.复方中草药及其与抗生素联用对斜带石斑鱼溶藻弧菌病的治疗效果[J]. 水产学报,2019,43(5):1338-1346. doi:10.11964/jfc.20181211565.XU X J, LI X H, MA Y F, LI H Y, QI X, ZHENG J, LYU H L, YAN Q P. Compound Chinese herbal medicine and its combination with antibiotics for the treatment of Epinephelus coioides vibriosis of grouper[J]. Journal of Fisheries, 2019,43(5): 1338-1346.doi:10.11964 / jfc.20181211565.