【研究意义】广藿香〔Pogostemon cablin(Blanco)Benth.〕为唇形科刺蕊草属植物,属多年生草本,通常以其干燥的地上部分入药,是为中药广藿香[1]。广藿香是临床上常用的芳香化湿药,其味较辛,性微温,归脾、胃、肺经,具有芳香化浊、和中止呕、发表解暑等功效[2]。广藿香作为一种广东道地药材,是多种著名中成药如藿香正气丸、藿胆丸等以及现代中药制剂如抗病毒口服液的主要原料。由于广藿香具有较高的药用价值和经济价值,其质量和产量对其入药至关重要。研究表明,多种植物对丛枝菌根显出较强的依赖性,丛枝菌根(Arbuscular Mycorrhiza,AM)真菌能与陆地上80%以上的植物形成共生[3],这其中也包括了多种药用植物。AM真菌作为菌肥接种,可以促进生长、提高植物的经济产量、抗逆性、抗病性和次生代谢产物产量等,且AM真菌本身无毒无味,是一种纯正的生物肥料[4]。【前人研究进展】肖家欣等[5]研究发现,AM真菌不仅能显著增加百喜草的株高、植株鲜重,还能显著降低植株Zn、Fe、B、Cu含量。黄京华等[6]研究发现,摩西球囊霉(Glomus mosseae)和地表球囊霉(Glomus versiforme)均能显著增加黄花蒿对N、P、K的吸收,提高其叶片叶绿素含量、蒸腾速率和地上生物量等。AM真菌还能提高药用植物有效成分的含量,如AM真菌能提高丹参植株丹参酮的含量[7];接种AM真菌可以显著提高药用植物黄檗中重要的药用成分小檗碱、药根碱及掌叶防己碱的含量[8];黄花蒿接种AM真菌后青蒿素及其挥发油含量显著提高[6]。冷平生等[9]研究发现,接种AM真菌不仅能减轻干旱对银杏的危害,还能显著提高银杏萜类内酯含量。【本研究切入点】广藿香这一药用植物正面临种质资源衰竭、产品质量下降等问题,威胁到其入药的安全性、稳定性、有效性。目前对AM真菌与广藿香共生的研究较少,本研究通过广藿香接种AM真菌,研究其对广藿香生长和药用有效成分的影响,以期达到提高质量、增加产量,满足用药需要的目的。【拟解决的关键问题】通过比较不同AM真菌接种下广藿香的生长情况、内源激素变化及挥发油出油率等各项指标,揭示AM真菌与广藿香之间的共生效应,为广藿香的高产及高效栽培提供理论依据。
1 材料与方法
1.1 试验材料
供试A M真菌为幼套近明球囊霉(Claroideoglomus etunicatum)和摩西管柄囊霉(Funneliformis mosseae),菌种购自中国丛枝菌根真菌种质资源库(Bank of Glomeromycota in China,BGC,前者编号为BGC HEN02A,后者编号为BGC NM02A),试验所用接种剂由上述菌种按盆栽沙培法扩繁而得[10]。广藿香扦插苗由广西那坡广藿香种植基地提供。供试基质为河沙、土壤(黄棕壤)、珍珠岩按5∶5∶1比例混合的盆栽基质。
1.2 试验方法
试验采用盆栽的方法,于2019年4—11月在广西大学农学院(108°17′9.00″E,22°50′28.41″N)温室中进行,室内保持在25 ℃、空气湿度75%左右。试验设单接种幼套近明球囊霉(CE)、单接种摩西管柄囊霉(FM)和不接种对照3个处理,每个处理28次重复,每个重复1盆,做好标记置于温室中,完全随机排列。将采用高温灭菌法灭菌消毒18 h以上的盆栽基质混合,采用一层基质一层菌沙的处理方法填满29 cm× 27 cm花盆,每盆用250 g菌沙。广藿香苗采用直插法插入花盆中,每盆1个插穗。插后立即浇透水,每日定时淋水保持盆内土壤湿润。由于广藿香为全日照植物,阴雨天需对其进行人工补光。
1.3 测定指标及方法
广藿香苗定植后,在整个生长期内,每隔31 d测定1次株高、茎粗。定植后31、93、155、217 d分别测定广藿香菌根侵染率;广藿香苗进入快速生长期后每隔31 d(即定植后93、124、155、186、217 d)采样测定其地上部分干物质量、内源激素含量等指标,每次采样时每个处理随机取3盆。广藿香进入成熟期后提取其挥发油并计算挥发油得率。
广藿香株高用卷尺直接测量,茎粗用游标卡尺测量,地上部分干物质量用称重法测定,菌根侵染率用染色镜检法[11],内源激素用酶联免疫吸附分析法,挥发油的提取用水蒸气蒸馏法。
试验数据采用Microsoft Excel 2019和SPSS20.0软件进行处理和分析。
2 结果与分析
2.1 不同接种处理广藿香菌根侵染率
试验结果表明,摩西管柄囊霉(FM)与幼套近明球囊霉(CE)均可与广藿香共生形成丛枝菌根。图1为AM真菌侵染广藿香植株后在根段内观察到的孢子及泡囊结构。由图2可知,FM处理与CE处理的菌根侵染率均随着广藿香的生长而逐渐上升,定植初期各处理的菌根侵染率均较低,CE、FM处理的菌根侵染率在定植后217 d达到最高,分别为78.33%、75.00%。在每个时期,FM、CE两种接种处理均高于CK且差异均极显著;CE处理的菌根侵染率均显著高于FM处理,且定植后93 d差异达极显著水平。
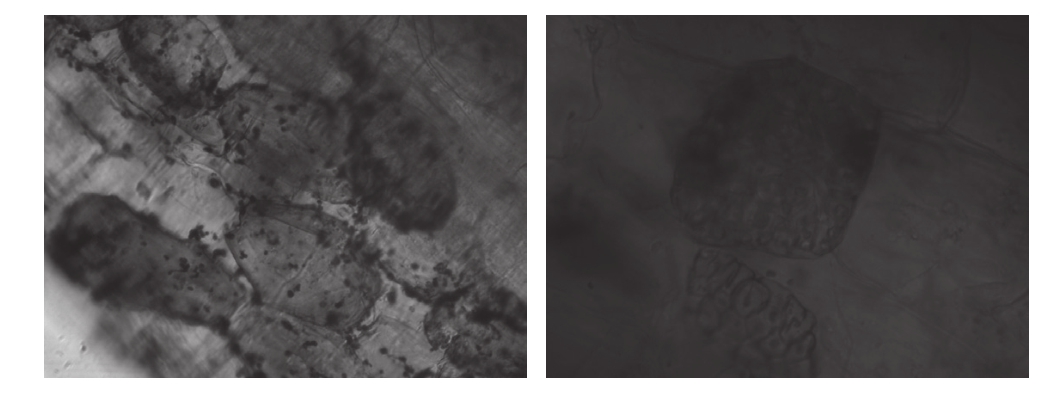
图1 广藿香根段内孢子及泡囊
Fig. 1 Spores and vesicles in the root of P. cablin
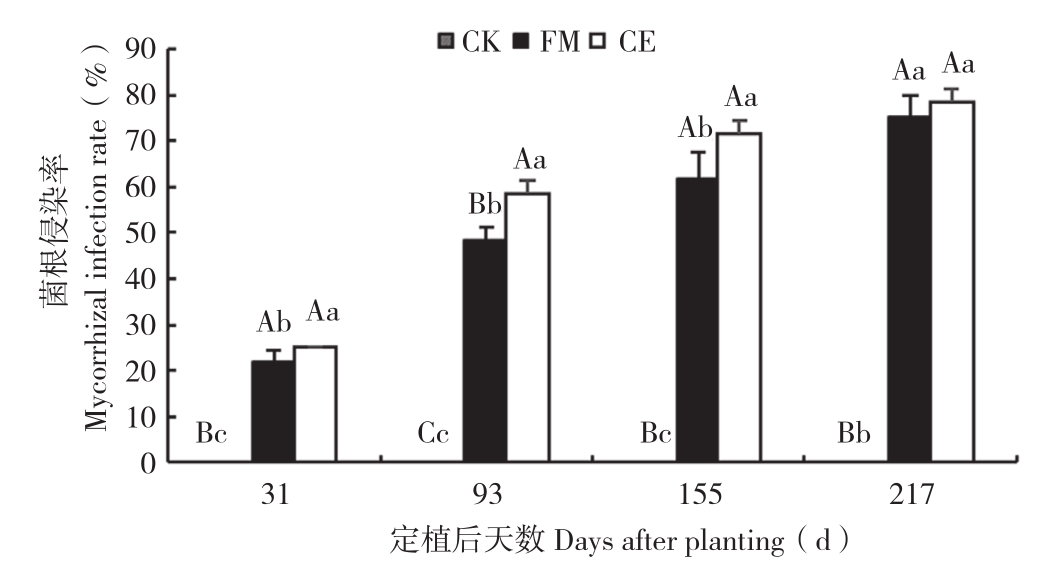
图2 不同处理广藿香菌根侵染率
Fig. 2 Mycorrhizal infection rate of P. cablin under different treatments
2.2 不同接种处理广藿香生长情况
由表1可知,各处理广藿香株高的增长趋势基本一致,均随着时间的推移而逐渐增高,在整个生长期内,各处理株高表现为CE>FM>CK。广藿香在定植后2~4个月进入快速生长期,株高增长速度最快,除定植后186、217 d之外,其他时期FM、CE处理株高与CK差异极显著;定植后186 d,FM处理的株高与CK无显著差异,而CE处理与CK差异显著;定植后217 d,FM处理株高与CK无显著差异,而CE处理与CK差异极显著;FM、CE两个接种处理间在定植后62、155 d均有显著差异,其他时期则均无显著差异。表明FM、CE两种AM真菌都对广藿香的株高增长有促进作用,但差异不大。
广藿香基部茎径的变化趋势为前4个时期增长迅速,而后3个时期增长趋于平缓,CE、FM处理与CK基部茎径均在定植后217 d达到最大值,分别为15.19、14.66、13.05 mm;除定植后62 d各处理基部茎径大小表现为FM>CE>CK,其他时期表现为CE>FM>CK。其中,CE处理基部茎径在所有时期与CK差异极显著;FM处理与CK定植后186 d差异显著外,其他时期均呈极显著差异;CE处理与FM处理间除定植后93 d出现显著差异外,其他时期均无显著差异,表明这两种AM真菌对广藿香的基部茎径增粗有一定的促进效果,但差异较小。
2.3 不同接种处理广藿香干物质量变化
由图3可知,两组AM真菌接种处理广藿香干物质量均显著高于对照。其中,CE处理除接种初期外,其他时期与CK均呈极显著差异;FM处理除定植后186、217 d外其他时期与CK均呈极显著差异;CE处理与FM处理间除定植后93、217 d存在显著差异外,其余时期差异不显著。表明接种AM真菌对广藿香干物质量具有显著促进作用,FM、CE处理的广藿香干物质量分别为CK的 1.21~1.70倍和 1.19~1.78倍。
2.4 不同接种处理广藿香内源激素变化
由表2可知,各处理广藿香植株叶片IAA含量都呈先升后降的变化趋势。FM处理IAA含量除最后收获期外在每个时期均高于CK,在定植后93、155、186 d更是达到极显著差异,最高时FM处理IAA含量比CK高59.2%,而CE处理与CK无显著差异;FM处理与CE处理IAA含量除收获期差异显著外,其他时期差异均达极显著。表明两种不同AM真菌接种处理对广藿香叶片IAA含量的影响不同,FM处理能显著提高广藿香叶片IAA含量,CE处理则无明显影响。
表1 不同处理广藿香生长情况
Table 1 Growth of P. cablin under different treatments
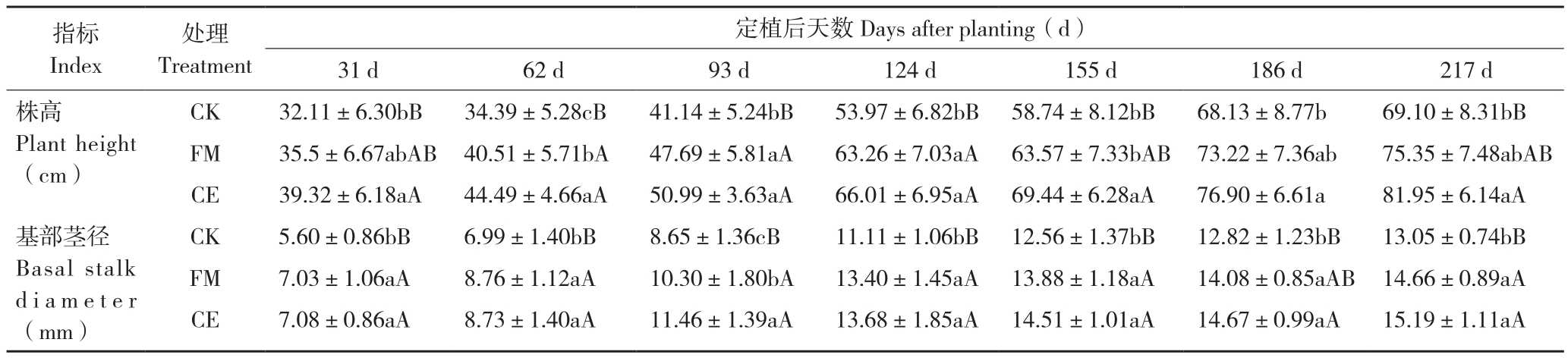
注:同一指标同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after the data in the same column under the same index represent significant differences, different capital letters represent extremely significant differences .
指标Index处理Treatment定植后天数Days after planting(d)31 d 62 d 93 d 124 d 155 d 186 d 217 d株高Plant height(cm)CK 32.11±6.30bB 34.39±5.28cB 41.14±5.24bB 53.97±6.82bB 58.74±8.12bB 68.13±8.77b 69.10±8.31bB FM 35.5±6.67abAB 40.51±5.71bA 47.69±5.81aA 63.26±7.03aA 63.57±7.33bAB 73.22±7.36ab 75.35±7.48abAB CE 39.32±6.18aA 44.49±4.66aA 50.99±3.63aA 66.01±6.95aA 69.44±6.28aA 76.90±6.61a 81.95±6.14aA CK 5.60±0.86bB 6.99±1.40bB 8.65±1.36cB 11.11±1.06bB 12.56±1.37bB 12.82±1.23bB 13.05±0.74bB FM 7.03±1.06aA 8.76±1.12aA 10.30±1.80bA 13.40±1.45aA 13.88±1.18aA 14.08±0.85aAB 14.66±0.89aA CE 7.08±0.86aA 8.73±1.40aA 11.46±1.39aA 13.68±1.85aA 14.51±1.01aA 14.67±0.99aA 15.19±1.11aA基部茎径Basal stalk d i a m e t e r(mm)
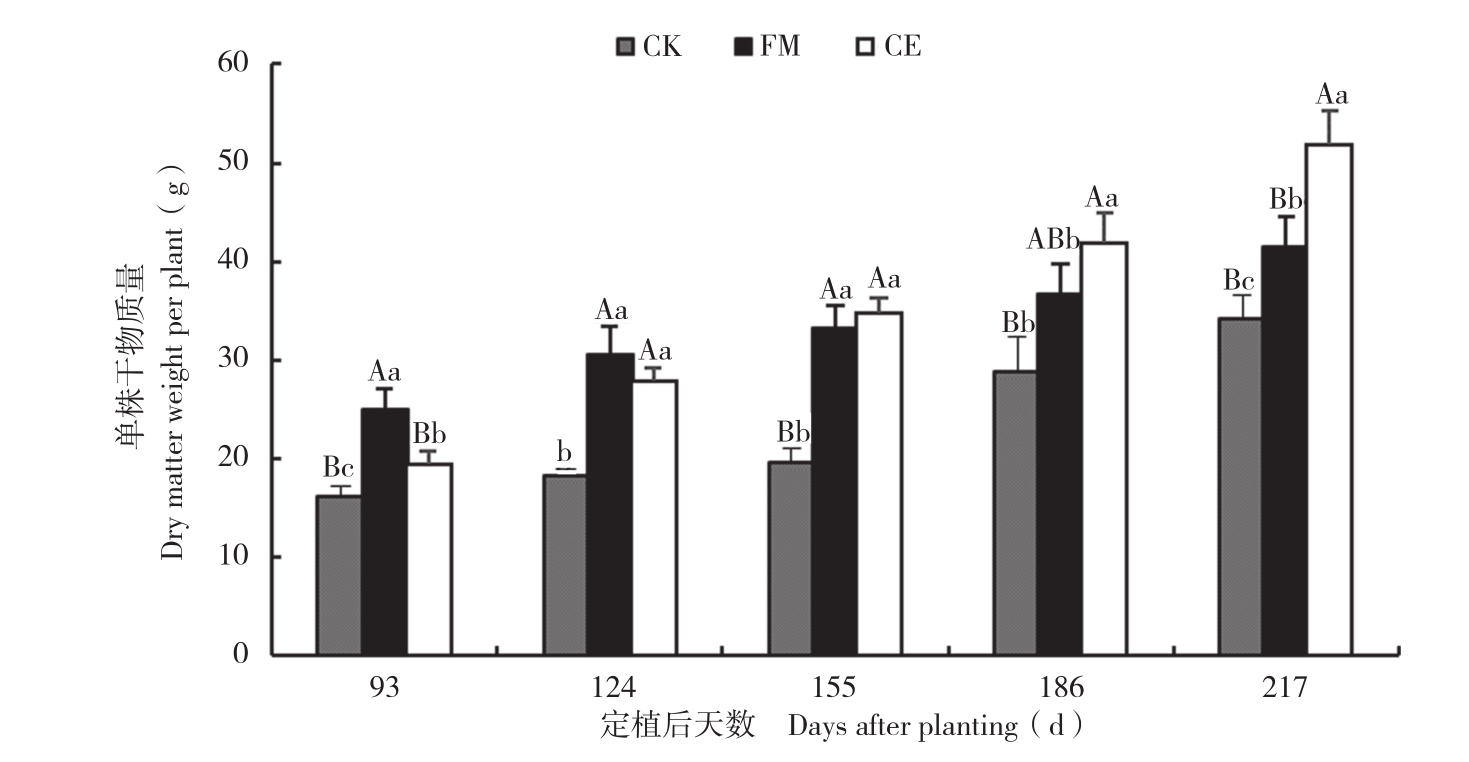
图3 不同处理的广藿香干物质量
Fig. 3 Dry matter weight of P. cablin under different treatments
表2 不同处理的广藿香内源激素变化
Table 2 Changes of endogenous hormones in P. cablin under different treatments
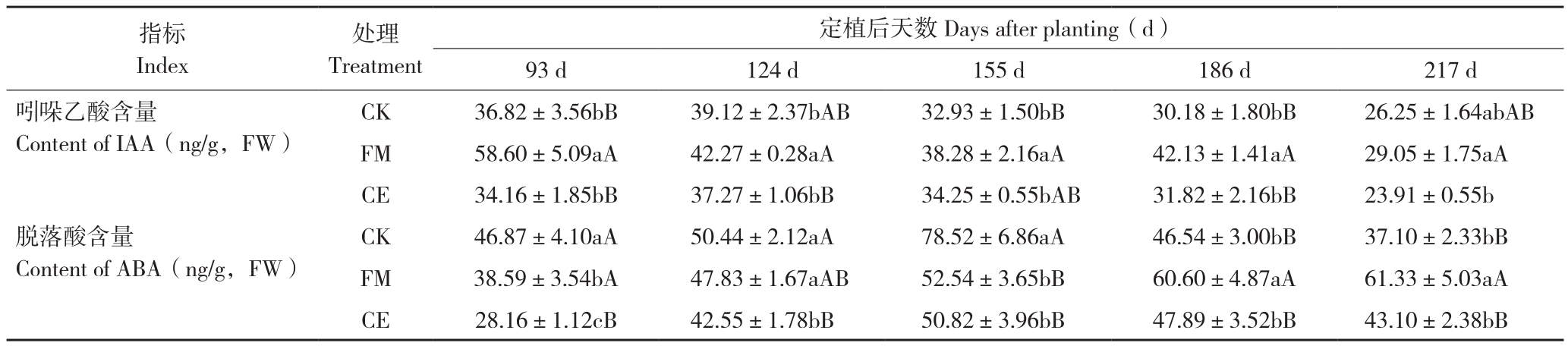
注:同一指标同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after the date in the same column under the same index represent significant differences, different capital letters represent extremely significant differences.
定植后天数Days after planting(d)93 d 124 d 155 d 186 d 217 d吲哚乙酸含量Content of IAA(ng/g,FW)指标Index处理Treatment CK 46.87±4.10aA 50.44±2.12aA 78.52±6.86aA 46.54±3.00bB 37.10±2.33bB FM 38.59±3.54bA 47.83±1.67aAB 52.54±3.65bB 60.60±4.87aA 61.33±5.03aA CE 28.16±1.12cB 42.55±1.78bB 50.82±3.96bB 47.89±3.52bB 43.10±2.38bB CK 36.82±3.56bB 39.12±2.37bAB 32.93±1.50bB 30.18±1.80bB 26.25±1.64abAB FM 58.60±5.09aA 42.27±0.28aA 38.28±2.16aA 42.13±1.41aA 29.05±1.75aA CE 34.16±1.85bB 37.27±1.06bB 34.25±0.55bAB 31.82±2.16bB 23.91±0.55b脱落酸含量Content of ABA(ng/g,FW)
不同处理广藿香植株叶片ABA含量在定植后93~217 d变化趋势不同。其中,CK为先上升后下降,最高含量与最低含量之间相差较大;FM处理为一直缓慢上升;CE处理为先缓慢上升后缓慢下降;FM、CE处理ABA最高含量较最低含量增长不大。广藿香定植后93、124、155 d,3个处理ABA含量依次为CK>FM>CE;定植后186、217 d,3个处理ABA含量依次为FM>CE>CK。定植后155 d,CK与CE处理ABA含量在达到峰值后开始下降,而FM处理仍在继续上升直到定植后217 d,说明FM处理在生长期内延缓了ABA开始快速产生的时间,延缓了对广藿香生长的抑制。
2.5 不同接种处理广藿香挥发油含量变化
由图4可知,接种AM真菌显著提高了广藿香的挥发油得率,且不同AM真菌对广藿香挥发油得率的提高效果不同。至收获时,FM处理挥发油得率为2.06%,是对照(1.47%)的1.40倍,CE处理挥发油得率为2.87%,是对照的1.95倍。方差分析结果表明,定植后155 d,CK与FM、CE处理间挥发油得率无显著差异;定植后155 d,广藿香植株开始进入完全成熟期,积累挥发油的速率加快,定植后186、217 d,CE处理与CK的挥发油得率差异极显著,而FM处理挥发油得率虽高于CK,但差异不显著。
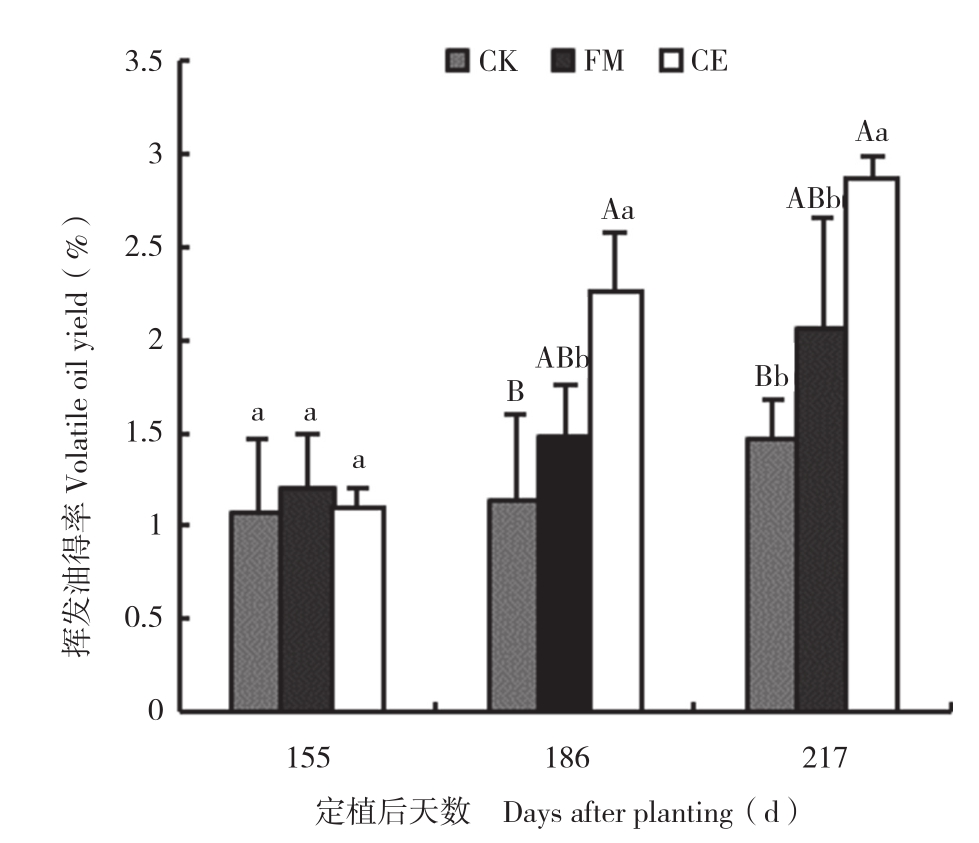
图4 不同处理的广藿香挥发油得率
Fig. 4 Volatile oil yield from P.cablin under different treatments
3 讨论
一直以来,本研究所选用的球囊霉属的AM真菌表现出较强的适应性与抗逆性[12],并且分布广泛。球囊霉属的AM真菌是华南地区常见的优势属[13],侵染对象范围广,但不同AM真菌对同一植物的选择性不同,而且差异较大[14]。本研究发现,两种AM真菌均能与广藿香共生,且两者与对广藿香的侵染能力存在一定差异,以幼套近明球囊霉对广藿香的侵染能力更优。
AM真菌能促进植物生长,提高产量[15-16]。Radheshyam等[17]发现AM真菌与植物促生菌共同作用通过提高植物的抗病性获得了产量的增长。Aroca等[18]发现AM真菌通过改变ABA在植物体内的活动,减轻逆境环境对植物生长的不利影响。本研究中,广藿香植株中的IAA含量也表现出随着侵染率的逐步上升而提高,且含量显著高于对照;ABA含量的增长速率随着侵染率的提高而减缓,且前期ABA含量显著低于对照。研究表明,IAA具有促进植物生长、调运养分的作用,而ABA的主要作用为抑制生长、促进脱落和休眠[19]。AM真菌接种使得广藿香叶片内的IAA含量提高,ABA含量降低,延长了广藿香生长期,促进广藿香生长和干物质量的积累。
挥发油是广藿香的主要药用成分,自20世纪70年代开始人们从广藿香挥发油中分离出了广藿香酮等抗真菌活性成分后[20],挥发油的研究一直被人们所关注。研究发现,AM真菌对药用植物中药效活性成分的积累有着积极作用[21-22]。例如,苍术苗接种AM真菌后挥发油有效成分含量显著提高[23]。本研究结果表明,接种AM真菌的广藿香植株所提取出的挥发油显著高于对照,且由于广藿香对不同种AM真菌的选择性不同,接种FM与CE对广藿香挥发油积累的提升效果也不同,以CE处理的效果更佳。
本研究只是初步地探讨了单接种不同AM真菌对广藿香的影响,并未进行混合菌接种的影响效应研究,至于AM真菌对广藿香挥发油中有效成分合成的影响机理,更需要从AM真菌对药用有效成分在广藿香植株内分布的规律以及合成积累途径中各种酶与次生代谢产物的影响等方面深入地研究。
4 结论
本研究结果表明,两种AM真菌对广藿香生长都有促进作用,且效果显著。至收获时,FM接种处理的广藿香株高比对照高9.0%,基部茎径比对照高9.8%,干物质量比对照高21.4%,挥发油得率比对照高0.59个百分点;CE接种处理的广藿香株高比对照高18.6%,基部茎径比对照高14.4%,干质比对照高51.4%,挥发油得率比对照高1.40个百分点。AM真菌侵染广藿香后,促使广藿香产生了更多内源激素IAA,降低了ABA含量,且接种FM对IAA的促进效果更好,而接种CE对ABA的抑制效果更好。综合而言,CE对广藿香的整体增益效果更好,且对于广藿香产量中最重要的挥发油含量促进效果明显。
[1] 国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社,2015: 45.Chinese Pharmacopoeia Commission. Chinese pharmacopoeia: Volume 1[M]. Beijing: China Medical Science and Technology Press, 2015: 45.
[2] 常怡雪,甘君妍,王玮哲,寇新宇,冯志攀,李普旺,杨子明,陈煜.广藿香功效及应用进展[J]. 热带农业科学,2019, 39(12): 68-74.doi:10.12008/j.issn.1009-2196.2019.12.011.CHANG X Y, GAN J Y, WANG W Z, KOU X Y, FENG Z P, LI P W, YANG Z M, CHEN Y. The Efficacy and application progress of Pogostemon cablin[J]. Chinese Journal of Tropical Agriculture,2019, 39(12): 68-74. doi:10.12008/j.issn.1009-2196.2019.12.011.
[3] DAVISON J, MOORA M, ÖPIK M, ADHOLEYA A, AINSAAR L, BÂ A, BURLA S, DIEDHIOU A G, HIIESALU I, JAIRUS T, JOHNSON N C, KANE A, KOOREM K, KOCHAR M, NDIAYE C, PÄRTEL M, REIERÜ, SAKSÜ, SINGH R, VASAR M, ZOBEL M. Global assessment of arbuscular mycorrhizal fungus diversity reveals very low endemism[J]. Science, 2015, 349(6251): 970-973.
[4] 王丹丹,魏蓉,张薇,林明琛,陈红锋. 土壤水分含量和接种摩西斗管囊霉(Funneliformis mosseae)对伯乐树幼苗生长的影响[J]. 广 西 植 物,2019, 39(7): 976-985. doi:10.11931/guihaia.gxzw201804016.WANG D D, WEI R, ZHANG W, LIN M C, CHEN H F. Effect of soil water content and inoculation with Funneliformis mosseae on growth of Bretschneidera sinensis seedlings[J]. Guihaia, 2019, 39(7): 976-985. doi:10.11931/guihaia.gxzw201804016.
[5] 肖家欣,任群,吴雪俊,陈迎迎,张绍铃. AM真菌对百喜草的生理特性的影响(英文)[J]. 植物分类与资源学报,2011, 33(5): 521-528. doi:10.3724/SP.J.1143.2011.11007.XIAO J X, REN Q, WU X J, CHEN Y Y, ZHAO S L. Effects of Arbuscular Mycorrhizal Fungi on physiological character of bahia grass(Paspalum notatum Poaceae)[J]. Plant Diversity and Resources,2011, 33(5): 521-528. doi:10.3724/SP.J.1143.2011.11007.
[6] 黄京华,谭钜发,揭红科,曾任森. AM真菌对黄花蒿生长及药效成分的影响[J]. 应用生态学报,2011, 22(6): 1443-1449.HUANG J H, TAN J F, JIE H K, ZENG R S. Effects of inoculating arbuscular mycorrhizal fungi on Artemisia annua growth and its officinal components[J]. Chinese Journal of Applied Ecology, 2011,22(06): 1443-1449.
[7] 杨立. AM真菌对丹参根部病害的抗病性及其机理研究[D]. 成都:西南交通大学,2012.YANG L. Effects of Arbuscular Mycorrhiza fungi on resistantce to root disease by Salvia miltiorrhiza and related mechanismas[D]. Chengdu:Southwest Jiaotong University, 2012.
[8] 范继红. 黄檗丛枝菌根生理生态学研究[D]. 哈尔滨: 东北林业大学,2006.FAN J H. Ecological ang physiological research on VA mycorrhizas of Amur Cork-tree[D]. Harbin: Northeast Forestry University, 2006.
[9] 冷平生,苏淑钗,李月华,王沙生,蒋湘宁. 施肥与干旱胁迫对银杏生长及黄酮苷和萜类内酯含量的影响[J]. 北京农学院学报,2001(1):32-37.LENG P S, SU S C, LI Y H, WANG S S, JIANG X N. Effects of fertilier and drought stress on growth as well as flavonol glycosides and terpene lactone content of Ginkgo biloba seedlings[J]. Journal of Beijing University of Agriculture, 2001(1): 32-37.
[10] 刘青,黄京华,李晓辉. 用玉米做宿主扩繁AMF菌剂的技术[J].安 徽 农 学 通 报,2007(11): 46-47. doi:10.16377/j.cnki.issn1007-7731.2007.11.021.LIU Q, HUANG J H, LI X H. The technology of using maize as host to propagate arbuscular mycorrhizal fungi[J]. Anhui Agricultural Science Bulletin, 2007(11): 46-47. doi:10.16377/j.cnki.issn1007-7731.2007.11.021.
[11] 廖楠. 广西甘蔗根际土壤丛枝菌根(AM)真菌多样性研究[D]. 桂林:广西师范大学,2016.LIAO N. Research on diversity of Arbuscular Mycorrhizal(AM)Fungi in sugarcane rhizosphere soil in Guangxi[D]. Guilin: Guangxi Normal University, 2016.
[12] 张伟珍,古丽君,段廷玉. A M真菌提高植物抗逆性的机制[J]. 草业科学,2018, 35(3): 491-507. doi:10.11829/j.issn.1001-0629.2017-0169.ZHANG W Z, GU L J, DUAN T Y. Research progress on the mechanism of AM fungi for improving plant stress resistance[J].Pratacultural Science, 2018, 35(3): 491-507. doi:10.11829/j.issn.1001-0629.2017-0169.
[13] 赖文珍,王思佳,胡文涛,唐明,谢贤安. 华南主要树木AM真菌物种多样性调查研究[J]. 西北林学院学报,2018, 33(6): 171-179.doi:10.3969/j.issn.1001-7461.2018.06.28.LAI W Z, WANG S J, HU W T, TANG M, XIE X A. Investigation on species diversity of Arbuscular Mycorrhizal fungi occurring in the main tree species in Southern China[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2018, 33(6): 171-179. doi:10.3969/j.issn.1001-7461.2018.06.28.
[14] 杨光,郭兰萍,郭晓恒,陈敏,陈美兰,周洁. 药用植物与AM真菌的选择性侵染研究[J]. 中国中医药信息杂志,2012, 19(1): 53-55.doi:1005-5304(2012)01-0053-03.YANG G, GUO L P, GUO X H, CHEN M, CHEN M L, ZHOU J.Selectivity infection of Arbuscular Mycorrhizal fungi in medicinal plants[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2012, 19(1): 53-55. doi:1005-5304(2012)01-0053-03.
[15] 韦莉莉,卢昌熠,丁晶,俞慎. 丛枝菌根真菌参与下植物—土壤系统的养分交流及调控[J]. 生态学报,2016, 36(14): 4233-4243.doi:10.5846 / stxb201412042407.WEI L L, LU C Y, DING J,YU S. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soilmicrobe system[J]. Acta Ecologica Sinica, 2016, 36(14): 4233-4243. doi:10.5846 / stxb201412042407.
[16] 刘欢. 不同丛枝菌根真菌对四种植物生长特性影响[D]. 兰州:甘肃农业大学,2016.LIU H. Effect of various arbuscular mycorrhizal fungi on plant growth characteristics[D]. Lanzhou: Gansu Agricutural University, 2016.
[17] RADHESHYAM Y, PANKAJ R, PARIKSHITA R, WUSIRIKA R . Bacteria from native soil in combination with arbuscular mycorrhizal fungi augment wheat yield and biofortification[J]. Plant Physiology and Biochemistry, 2020, 150:222-233. doi:10.1016/j.plaphy.2020.02.039.
[18] AROCA R, VERNIERI P, RUIZ-LOZANO J M. Mycorrhizal and non-mycorrhizal Lactuca sativa plants exhibit contrasting responses to exogenous ABA during drought stress and recovery[J]. Journal of Experimental Botany, 2008, 59(8): 2029-41. doi:10.1093/jxb/ern057.
[19] 段娜,贾玉奎,徐军,陈海玲,孙鹏. 植物内源激素研究进展[J]. 中国农学通报,2015, 31(2): 159-165.DUAN N, JIA Y K, XU J, CHEN H L, SUN P. Research progress on plant endogenous hormones[J]. Chinese Agricultural Science Bulletin, 2015, 31(2): 159-165.
[20] 杨賛熹,谢培山. 中药广藿香抗真菌成分——广藿香酮(Pogostone)的分离及结构测定[J]. 科学通报,1977(7): 318-320.YANG Z X, XIE P S. Isolation and structure determination of pogostone, an antifungal component of pogostone[J]. Chinese Science Bulletin, 1977(7): 318-320.
[21] 杨敏,张杰,张德全,何静,祁俊生,周浓. 丛枝菌根真菌对掌叶大黄产量及次生代谢产物的影响[J]. 中国实验方剂学杂志,2018, 24(10): 33-37. doi:10.13422/j.cnki.syfjx.20181007.YANG M, ZHANG J, ZHANG D Q, HE J, QI J S, ZHOU N. Effect of Arbuscular Mycorrhizal on yield and secondary metabolites of Rheum palmatum[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(10): 33-37. doi:10.13422/j.cnki.syfjx.20181007.
[22] 韦正鑫. 丛枝菌根真菌对滇重楼的接种效应研究[D]. 重庆:西南大学,2016.WEI Z X. The study of inoculation effect with arbuscular mycorrhizal fungi to Paris polyphylla var. yunnanensis[D]. Chongqing: Southwest University, 2016.
[23] 梁雪飞,唐梦君,吕立新,赵翔宇,戴传超. 三种丛枝菌根真菌对茅苍术的生长、生理及主要挥发油成分的影响[J]. 生态学杂志,2018, 37(6): 1871-1879. doi:10.13292/j.1000-4890.201806.010.LIANG X F, TANG M J, LYU L X, ZHAO X Y, DAI C C. Effects of three arbuscular mycorrhizal fungi(AMF)species on the growth,physiology, and major components of essential oil of Atractylodes lancea[J]. Chinese Journal of Ecology, 2018, 37(6): 1871-1879.doi:10.13292/j.1000-4890.201806.010.