【研究意义】南岭莪术(Curcuma kwangsiensis var. nanlingensis N. Liu et X. Y. Ma)是姜黄属广西莪术(C. kwangsiensis)的变种[1],自然花期为4—6月和7—9月[2]。南岭莪术株形较矮小,在广东地区其地上部通常11月初枯萎,采挖其地下根茎经低温贮藏后可打破休眠,再经高温催芽后,可在水培条件下开花,此时临近春节,可利用此花期调控技术推广南岭莪术作高品质水培年宵花卉[3]。本课题组前期研究发现,南岭莪术根茎耐贮藏,贮藏时间和温度与其水培期开花率相关,而完成休眠最少需要在13~15 ℃环境中贮藏30 d[4]。生产上根茎的长期贮藏对周年供花有积极意义,但随着贮藏时间的延长,干藏根茎容易失水、萎缩干扁,包埋湿藏根茎易发生腐烂,进而影响水培期花芽和叶芽的发育,降低成花品质。因此,选择适宜的长期贮藏方式和水培方法,提高南岭莪术根茎的成花率和成花品质,对实现南岭莪术根茎的“一次采收处理,周年供花”具有商业生产实际应用价值。【前人研究进展】球根类花卉在低温贮藏期间,球根的营养物质发生变化,可能影响到成花品质。Jayakumar等研究了姜黄(C. longa)的根茎从采收到发芽前贮藏期间蛋白质和RNA含量的变化,发现蛋白质和RNA合成量随贮藏时间延长而增加,其稳定休眠期为30 d[5]。Ruamrungsri等发现姜荷花(C.alismatifolia)在贮藏期间根茎和球根的鲜重、氮含量、淀粉含量和可溶性糖含量均下降,根茎中脱落酸含量在贮藏前中期增加,贮藏后期则降低直至萌芽前[6]。刘建新研究则发现,几种植物生长调节剂对红火炬郁金(C. petiolata)种球在短期低温胁迫中具有保护效果,以6-BA和ABA效果最为突出[7]。【本研究切入点】植物生长调节剂是一种与植物激素相类似的、作用于植物生理和生物学效应的物质,可以调节和控制植物的生长发育和各种生理活动,如促使种子和营养繁殖器官发芽、诱导花芽分化、增强植物抗逆力、贮藏保鲜等[8]。植物生长调节剂能否对长期贮藏的南岭莪术根茎起到生理调节作用、提高成花率和成花品质,是本研究的关注点。【拟解决的关键问题】研究植物生长调节剂对南岭莪术根茎长期贮藏和水培开花的生理调节作用,筛选出适宜的植物生长调节剂,为更好地推广应用南岭莪术作为新型水培花卉提供技术参考。
1 材料与方法
1.1 试验材料
南岭莪术根茎采挖自韶关市乐昌县姜黄属植物种植基地,按照盛爱武等的方法进行根茎分级和处理:挑选无腐烂、大小一致的当年生2级(根茎直径3~4 cm)南岭莪术根茎,洗净并剪去须根,置于800~1 000倍百菌清溶液中浸泡10 min,取出晾干[9]。所用植物生长调节剂均为分析纯,购自广州翔博生物科技有限公司。
1.2 试验方法
试验于2016-2019年在仲恺农业工程学院广东省热带亚热带花卉重点实验室进行。随机挑选洗净消毒过的根茎,分别置于TDZ(0.5、2、8 mg/L)、6-BA(10、50、100 mg/L)、GA3(10、15、20 mg/L)、IAA(10、50、100 mg/L) 中 浸泡2 h,然后清洗表皮残留溶液,并以无菌水浸泡2 h为对照(CK),再用洁净河沙覆盖根茎,河沙湿度以手握成团、松手即散为度,置于13℃冷库(SC-316GA型,Haier)中贮藏。共13个处理,每个处理3次重复,每个重复10个根茎。贮藏期间,每个处理取出5个根茎测定生理指标。
另取洗净消毒过的根茎,用洁净河沙覆盖后直接于13 ℃冷藏室内冷藏30 d,再置于人工气候培养箱(RXZ智能型,宁波江南仪器)催芽30 d,催芽条件为30 ℃、全暗、河沙表面覆盖保鲜膜以保湿。待芽体长至1~2 cm时,取出用不同浓度的 6-BA(1、5、10、15、20 mg/L)和 GA3(1、5、10、15、20 mg/L)溶液对根茎进行培养,每隔7 d补加溶液,保持水培液面深度为根茎高度的1/2,并以无菌水培养为对照(CK)。水培期间温度保持为30℃,光强3 000~4 000 lx,全天光照,相对湿度70(±10)%。共11个处理,每个处理3次重复,每个重复10个根茎。
1.3 测定指标及方法
按赵世杰等[10]方法测定根茎贮期含水量(30、90、150 d)、电导率(30、60、90、120、150 d)、蛋白质含量(30、60、120 d),3次重复。含水量、蛋白质含量变化率的计算方法为:(最后一次测量值-首次测量值)/首次测量值×100%。
根茎水培期间测定生长指标,包括现蕾天数(水培期始至现蕾的时间)、始花天数(水培期始至可育苞片内第1朵小花开放)、花枝长度(花葶基部到冠苞片顶部的垂直长度)、花枝粗度(花葶直径最大处的粗度)。
试验数据采用Excel和SPSS Statistics 17.0进行统计分析。
2 结果与分析
2.1 植物生长调节剂对南岭莪术根茎长期贮藏的影响
2.1.1 含水量 南岭莪术根茎含水量在长期贮藏中变化不大,总体呈下降趋势。相比对照,IAA处理南岭莪术根茎含水量在贮藏过程中略微上升,以50 mg/L处理最佳;TDZ处理可以显著降低贮藏过程南岭莪术根茎的含水量变化,以2 mg/L处理为佳;6-BA处理对根茎含水量变化的影响随处理浓度不同而差距较大,50 mg/L处理显著降低了含水量变化,但100 mg/L处理则加剧了含水量变化;GA3处理整体上加剧了根茎在贮藏中的失水,随着处理浓度的增大,含水量变化率开始降低,20 mg/L处理对根茎含水量作用较好(表1)。
2.1.2 蛋白质含量 从表2可以看出,随着低温贮藏时间的延长,南岭莪术根茎的蛋白质含量呈明显下降趋势,从贮后30 d到贮后120 d,各处理蛋白质含量变化率均达60%以上,但不同处理间仍存在差异。相较于对照,IAA处理蛋白质含量变化总体上都更小、以10 mg/L效果最佳,其次是10 mg/L GA3 处理对根茎蛋白质含量保护作用较好,6-BA处理总体上效果较差。
表1 植物生长调剂对贮期南岭莪术根茎含水量的影响
Table 1 Effects of plant growth regulators on moisture content of rhizome of Curcuma kwangsiensis var. nanlingensis during storage period
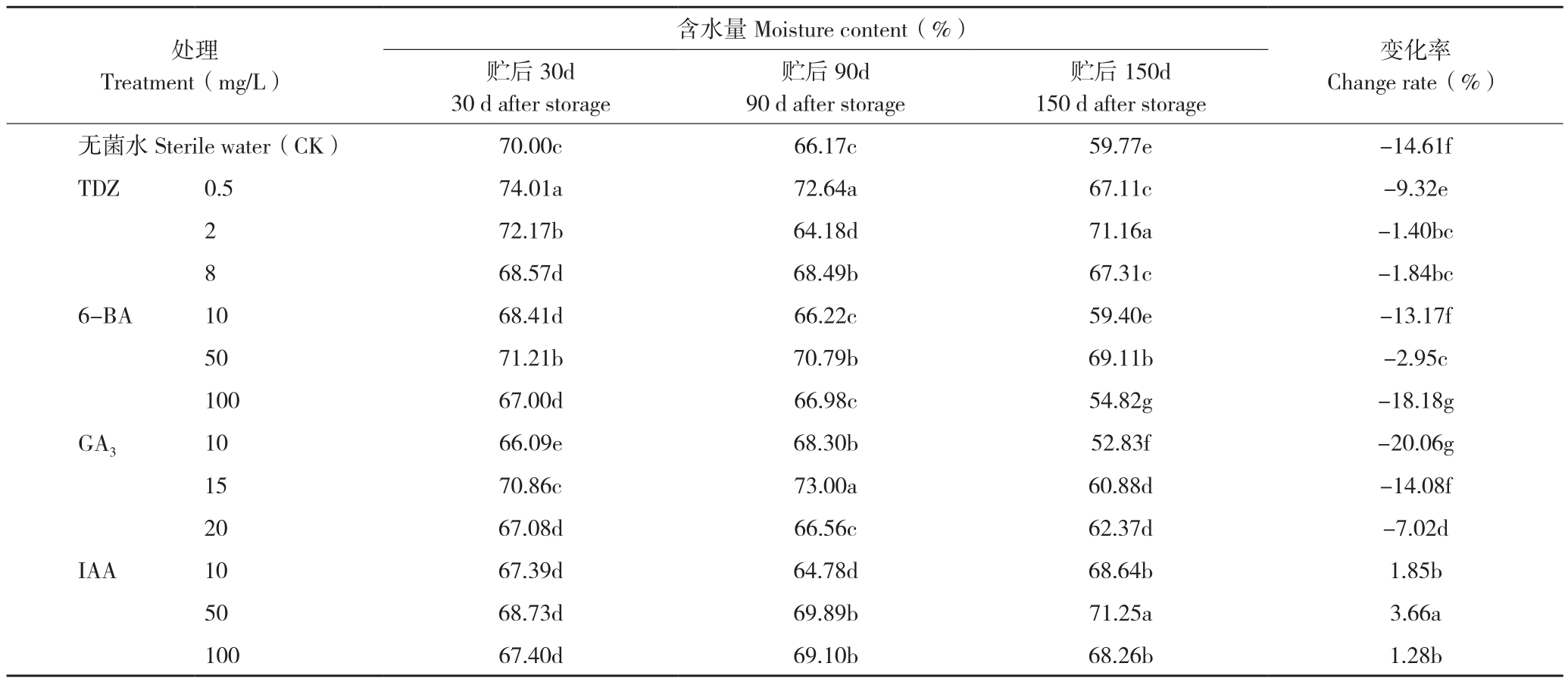
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in the same column represent significant differences.
贮后150d 150 d after storage无菌水Sterile water(CK) 70.00c 66.17c 59.77e -14.61f TDZ 0.5 74.01a 72.64a 67.11c -9.32e 20 72.17b 64.18d 71.16a -1.40bc 80 68.57d 68.49b 67.31c -1.84bc 6-BA 100 68.41d 66.22c 59.40e -13.17f 500 71.21b 70.79b 69.11b -2.95c 1000 67.00d 66.98c 54.82g -18.18g GA3 100 66.09e 68.30b 52.83f -20.06g 150 70.86c 73.00a 60.88d -14.08f 200 67.08d 66.56c 62.37d -7.02d IAA 100 67.39d 64.78d 68.64b 1.85b 500 68.73d 69.89b 71.25a 3.66a 1000 67.40d 69.10b 68.26b 1.28b处理Treatment(mg/L)含水量Moisture content(%) 变化率Change rate(%)贮后30d 30 d after storage贮后90d 90 d after storage
2.1.3 电导率 由图1可知,各处理南岭莪术根茎贮藏过程中电导率的变化趋势总体一致,贮后30~60 d有所上升或下降,到贮后90 d时电导率急剧上升,再到贮后150 d时又有部分上升。各处理对南岭莪术根茎电导率的影响在贮后30~90 d表现不明显,在贮后90~150 d表现出明显降低作用,其中TDZ处理组以2 mg/L效果最好,6-BA组以10 mg/L处理的综合效果更好,GA3组以20 mg/L处理较好,IAA组以10 mg/L处理较好。通过比较根茎电导率发现,以IAA 10 mg/L处理对南岭莪术根茎电导率的降低作用最为明显,其次为GA3 20 mg/L处理,表明该处理对根茎细胞膜的保护性好。
表2 植物生长调剂对贮期南岭莪术根茎蛋白质含量的影响
Table 2 Effects of plant growth regulators on protein content of rhizome of
C.urcuma kwangsiensis var. nanlingensis during storage period
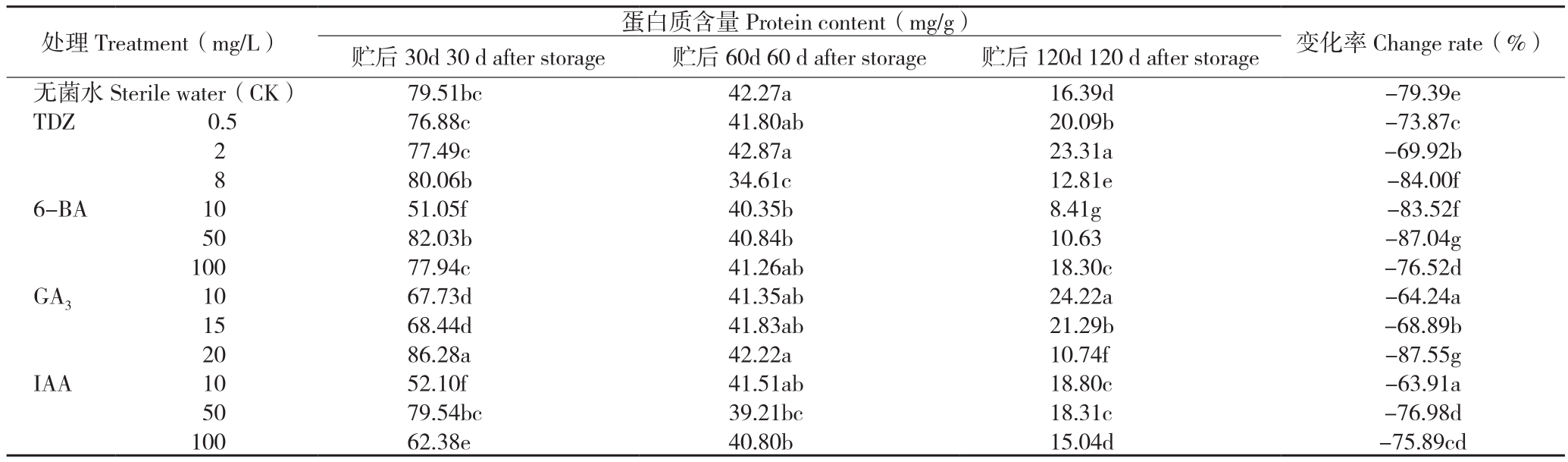
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in the same column represent significant differences.
处理Treatment(mg/L) 蛋白质含量Protein content(mg/g) 变化率 Change rate(%)贮后30d 30 d after storage 贮后60d 60 d after storage 贮后120d 120 d after storage无菌水Sterile water(CK) 79.51bc 42.27a 16.39d -79.39e TDZ 0.5 76.88c 41.80ab 20.09b -73.87c 20 77.49c 42.87a 23.31a -69.92b 80 80.06b 34.61c 12.81e -84.00f 6-BA 100 51.05f 40.35b 8.41g -83.52f 500 82.03b 40.84b 10.63 -87.04g 1000 77.94c 41.26ab 18.30c -76.52d GA3 100 67.73d 41.35ab 24.22a -64.24a 150 68.44d 41.83ab 21.29b -68.89b 200 86.28a 42.22a 10.74f -87.55g IAA 100 52.10f 41.51ab 18.80c -63.91a 500 79.54bc 39.21bc 18.31c -76.98d 1000 62.38e 40.80b 15.04d -75.89cd

图1 植物生长调节剂对贮期南岭莪术根茎电导率的影响
Fig. 1 Effects of plant growth regulators on conductivity of rhizome of C.urcuma kwangsiensis var. nanlingensis during storage period
2.2 植物生长调节剂对南岭莪术根茎水培开花的影响
GA3和6-BA对水培期间南岭莪术根茎的成花品质改善作用各有侧重。表3显示,从现蕾天数和始花天数来看,6-BA处理使根茎水培的现蕾天数较对照提早3~4 d,始花天数提早2~4 d,以1 mg/L、5 mg/L 6-BA对促进花期提前效果最好;6-BA处理使根茎水培的花枝粗度也较对照显著增加,以20 mg/L 6-BA处理的效果最佳,表明6-BA作为南岭莪术根茎水培溶液可以加快花芽分化进程。
低浓度GA3(1、5、10 mg/L)对南岭莪术花枝长度的促进作用显著,现蕾天数和始花天数提早 1~3 d,而高浓度 GA3(15、20 mg/L)会抑制花芽分化进程,使花期延后,花枝长度和粗度也相应降低(表3)。
表3 植物生长调节剂对南岭莪术根茎水培成花品质的影响
Table 3 Effects of plant growth regulators on hydroponic flower quality of rhizome of C.urcuma kwangsiensis var nanlingensis
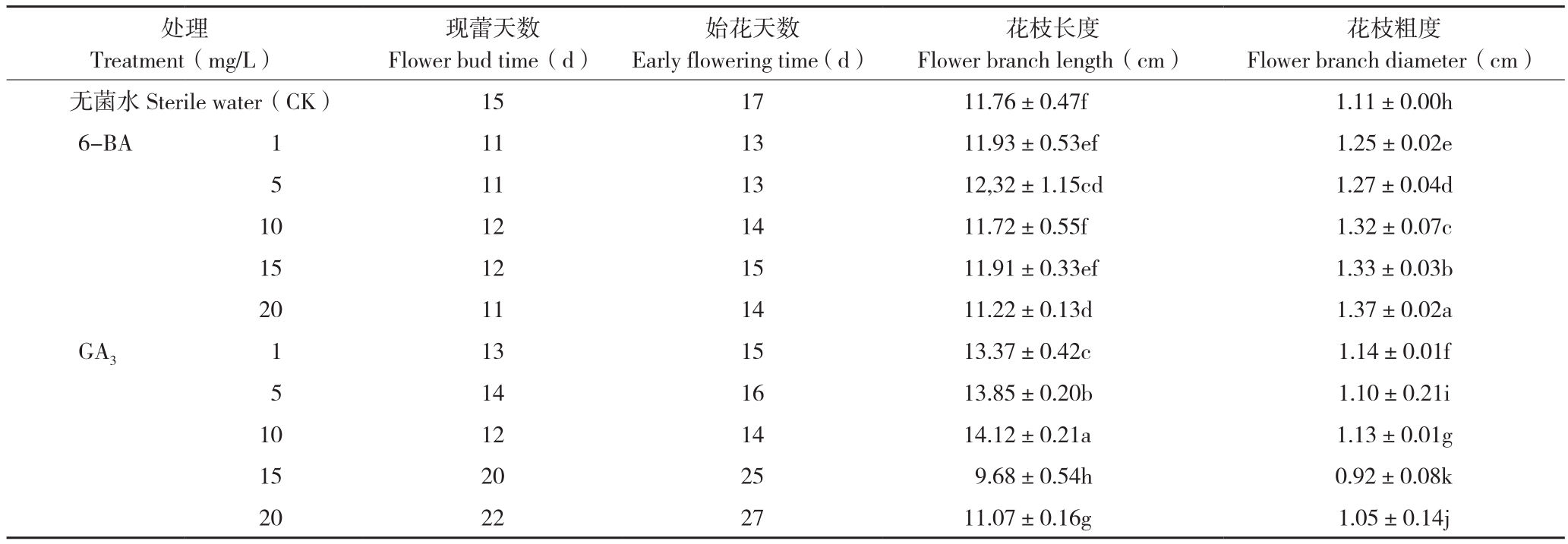
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in the same column represent significant differences.
花枝粗度Flower branch diameter(cm)无菌水 Sterile water(CK) 15 17 11.76±0.47f 1.11±0.00h 6-BA 1 11 13 11.93±0.53ef 1.25±0.02e 5 11 13 12,32±1.15cd 1.27±0.04d 10 12 14 11.72±0.55f 1.32±0.07c 15 12 15 11.91±0.33ef 1.33±0.03b 20 11 14 11.22±0.13d 1.37±0.02a GA3 1 13 15 13.37±0.42c 1.14±0.01f 5 14 16 13.85±0.20b 1.10±0.21i 10 12 14 14.12±0.21a 1.13±0.01g 15 20 25 9.68±0.54h 0.92±0.08k 20 22 27 11.07±0.16g 1.05±0.14j处理Treatment(mg/L)现蕾天数Flower bud time(d)始花天数Early flowering time(d)花枝长度Flower branch length(cm)
3 讨论
在花期调控研究中,球根类花卉常常通过低温贮藏完成休眠而开花,贮藏温度、贮藏时间、光照、贮藏介质等因素都可影响开花特性。本课题组前期研究发现,南岭莪术根茎在15 ℃低温下贮藏完成休眠的最短时间是30 d,当低温贮藏时长不足时,根茎水培开花率极低,表明其尚未完成休眠;当低温贮藏时间长于60 d时,根茎易腐烂,且其开花率开始降低,花期延后[3-4]。本试验通过测定贮藏期间南岭莪术根茎的生理指标,发现根茎含水量和蛋白质含量随贮藏时间延长而不断降低,其中含水量降低程度小、蛋白质含量迅速下降,与Anuwong 等发现“姜荷花根茎和球根在贮藏期间干物质量迅速下降直到开花”[11]的现象一致。表明贮藏期间低温抑制根茎呼吸作用,根茎的休眠程度在不断加深,可解释成花率和花期随贮藏时间增加而降低和延后的现象,类似研究还有蔡军火发现5℃贮藏石蒜鳞茎时花期、成花品质随贮藏时间增加而大幅延后和降低[12],陈梦玲研究发现百合花期随低温贮藏时间增长而延后[13];电导率在贮藏至90 d时有大幅度升高,根茎的细胞膜可能在此贮藏时间点左右遭受较大伤害,导致透性增大,可以认为90 d可能是南岭莪术根茎贮藏过程中生理生化发生突变的一个时间节点,贮藏超过90 d不利于水培开花。
植物生长调节剂对植物的生理影响是多样的,在种球类花卉低温贮藏过程中可能起到打破休眠、保护种球、调节生理代谢、维持细胞膜稳定性的效果。赵莉研究6-BA、GA3和IBA等3种不同浓度的植物生长调节剂对香水百合根茎生长发育的影响,发现6-BA 60 mg/L+GA3 150 mg/L+IBA 40 mg/L的配比效果最佳,不仅可提前花期,还能改善成花品质[14]。本试验研究单一植物生长调节剂对南岭莪术根茎长期贮藏的影响,在含水量保持方面,以IAA处理效果最佳,表明外源IAA的施用使根茎持水能力增强,在贮藏150 d时甚至出现含水量略微增加的现象,这可能与IAA可增强根茎从贮藏介质吸水能力、减弱根茎表皮气孔蒸腾有关,有研究表明外源生长素处理和内源生长素水平的升高都会抑制气孔发育[15];外源IAA 10 mg/L处理使得南岭莪术根茎贮期电导率升高的幅度最小,也说明IAA对细胞膜起到一定的保护效果。
张婧等认为使用0.05 mg/L 6-BA浸泡唐菖蒲种球2 h或4 h均可使其花期提前[16],王辉等认为在香草兰花芽分化前期喷施外源6-BA可提高花芽分化率[17]。本试验中6-BA处理使南岭莪术根茎水培花期提前,与前人研究结果一致,但花枝长度变化并不如低浓度的GA3处理,可能与6-BA和GA3的作用特性有关,即6-BA可促进花芽分化[18]但并不促进细胞伸长,而GA3作为水培溶液最突出的作用是可使花枝伸长(因为植物茎伸长的主要原因是细胞长度的增加,也有细胞数目的增加),赤霉素最明显的作用是促进茎伸长[19-20]。本试验仅比较了单一植物生长调节剂对南岭莪术根茎的影响,复合施用几种植物生长调节剂的效果是否更好,外源施用是否引起内源激素含量变化则还需要进一步深入研究。
4 结论
植物生长调节剂在南岭莪术根茎长期贮藏过程中具有一定保护作用,综合含水量、蛋白质含量和电导率指标的评价,以根茎浸泡10 mg/L IAA溶液2 h后长期贮藏的效果最佳。6-BA和GA3两种植物生长调节剂作为水培溶液均可促进提高南岭莪术根茎的成花品质,二者各有侧重,以5 mg/L 6-BA处理效果最佳最佳,可促进花期提前,且花枝长度和粗度均有所增加。
[1] 马晓燕,周伟斌,刘念.广东姜黄属一新变种——南岭莪术[J]. 仲恺农业工程学院学报,2009,22(3):15-16. doi: 10.3969/j.issn.1674-5663.2009.03.004.MA X Y,ZHOU W B,LIU N. Curcuma kwangsiensis S. G. Lee et C. F. Liang var. nanlingensis N. Liu et X. Y. Ma(Zingiberaceae), a new variety from Guangdong[J]. Journal of Zhongkai University of Agriculture and Technology,2009,22(3):15-16. doi: 10.3969/j.issn.1674-5663.2009.03.004.
[2] 刘念 .姜科花卉资源[J]. 广东园林,1994(3):15-16.LIU N.Zingiberaceae flower resource[J]. Journal of Guangdong Landscape Apchitecture, 1994(3): 15-16.
[3] 盛爱武,刘念,张施君,叶向斌,肖德兴,范艳萍.温度调控对南岭莪术根茎开花与花芽分化的影响[J]. 中国农业科学,2011,44(2):379-386. doi:10.3864/j.issn.0578-1752.2011.02.018.SHENG A W,LIU N,ZHANG S J,YE X B,XIAO D X,FAN Y P. Effects of temperature regulation on flowering and bud differentiation of Curcuma kwangsiensis var. nanlingensis N. Liu et X. Y. Ma Rhizomes[J]. Scientia Agricultura Sinica,2011,44(2):379-386. doi:10.3864/j.issn.0578-1752.2011.02.018.
[4] 盛爱武,刘念,张施君,叶向斌,骆海林.三种姜黄属花卉根茎贮藏对开花的影响[J]. 北方园艺,2011(24):99-101.SHENG A W,LIU N,ZHANG S J,YE X B,LUO H L. Effect of storage on flowering of three species Curcuma[J]. Northern Horticulture, 2011(24):99-101.
[5] JAYAKUMAR M, EYINI M, LINGAKUMAR K, KULANDAIVELU G. Changes in proteins and RNA during storage of Curcuma longa L. Rhizome[J]. Biologia Plantarum, 2001,44(2):297-299.doi:10.1023/A:1010220013700.
[6] RUAMRUNGSRI S, OHTAKE N, KUNI S, SUWANTHADA C, APAVATJRUT P, OHYAMA T. Changes in nitrogenous compounds, carbohydrates and abscisic acid in Curcuma alismatifolia Gagnep. during dormancy[J]. The Journal of Horticultural Science and Biotechnology, 2001,76(1):48-51. doi:10.1080/14620316.2001.11511325.
[7] 刘建新,丁华侨,徐笑寒.红火炬郁金种球的抗寒生理及植物生长调节剂的低温保护效果[J]. 江苏农业科学,2018,46(10):149-153.doi:10.15889/j.issn.1002-1302.2018.10.038.LIU J X,DING H Q,XU X H. Cold-resistant physiology and cryoprotective effect of plant growth regulator of Curcuma hybrid 'Red Torch' bulbs[J]. Jiangsu Agricultural Sciences, 2018,46(10):149-153. doi:10.15889/j.issn.1002-1302.2018.10.038.
[8] 罗倩,董运常,严过房,黄勇,罗伟聪.植物生长调节剂在园林植物生产及抗逆性上的应用研究[J]. 安徽农学通报,2017,23(16):122-124,157. doi:10.3969/j.issn.1007-7731.2017.16.047.LUO Q,DONG Y C,YAN G F,HUANG Y,LUO W C.Research and application of plant growth regulators on the production techniques and resistance of garden plants[J]. Anhui Agricultural Science Bulletin,2017,23(16):122-124,157. doi:10.3969/j.issn.1007-7731.2017.16.047.
[9] 盛爱武,刘念.广西莪术种球分级依据及其特性研究[J].安徽农业科学,2008,36(12):4943-4944. doi:10.3969/j.issn.0517-6611.2008.12.066.SHENG A W,LIU N. Study on the classification basis of Curcuma kwangsiensis bulb and its characteristics[J]. Journal of Anhui Agricultural Sciences, 2008,36(12):4943-4944. doi:10.3969/j.issn.0517-6611.2008.12.066.
[10] 赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科技出版社,2002.ZHAO S J,SHI G A,DONG X C. Experimental guidance of plant physiology[M].Beijing: China Agricultural Science and Technology Press,2002.
[11] ANUWONG C, OHTAKE N, SUEYOSHI K, RUAMRUNGSRI S,OHYAMA T. Characterisation of proteins in the storage organs of Curcuma alismatifolia Gagnep[J]. The Journal of Horticultural Science and Biotechnology, 2014,89(5). doi:10.1080/14620316.2014.11513112.
[12] 蔡军火,魏绪英,张露.鳞茎贮藏对石蒜开花、展叶及内源激素的影响[J]. 南京林业大学学报(自然科学版),2012,36(5):56-60.doi:10.3969/j.issn.1000-2006.2012.05.010.CAI J H, WEI X Y, ZHANG L. Effects of bulb storage on flowering,leaf traits, and endogenous hormones of Lycoris radiata[J]. Journal of Nanjing Forestry University(Natural Science Edition), 2012,36(5):56-60. doi:10.3969/j.issn.1000-2006.2012.05.010.
[13] 陈梦玲.低温贮藏对百合花芽分化的影响[D]. 成都:四川农业大学,2017.CHEN M L.Effects of low temperature storage on flower bud differentiation of Lily[D]. Chengdu:Sichuan Agricultural University,2017.
[14] 赵莉.6-BA、GA3和IBA对香水百合生长发育的影响[D]. 成都:四川农业大学,2012.ZHAO L. Effects of 6-BA, GA3 and IBA on growth and devement of Lilium casa blanca[D]. Chengdu:Sichuan Agricultural University,2012.
[15] 张静懿.生长素调控气孔发育的功能和作用分子机理的研究[D].上海:上海交通大学,2015.ZHANG J Y.The function and molecular mechanism of auxin in regulating stomatal development[D]. Shanghai: Shanghai Jiao Tong University,2015.
[16] 张婧,杨娜,杨建,贺学勤,马春梅.NAA和6-BA在唐菖蒲切花花期提早和新球品质提高上的作用[J]. 北方园艺,2016(6):50-54.doi:10.11937/bfyy.201606014.ZHANG J,YANG N,YANG J,HE X Q,MA C M.Effect of NAA and 6-BA on forcing cut flower and improving quality of Daughter Corms in Gladiolus hybridus Hort[J]. Northern Horticulture, 2016,(6):50-54.doi:10.11937/bfyy.201606014.
[17] 王辉,顾文亮,庄辉发,赵青云,朱自慧,宋应辉.不同外源激素对香草兰花芽分化的影响[J]. 热带农业科学,2016,36(11):72-76.doi:10.12008/j.issn.1009-2196.2016.11.015.WANG H, GU W L, ZHUANG H F, ZHAO Q Y, ZHU Z H, SONG Y H. Effects of plant external hormones on flower bud differentiation of Vanilla[J]. Chinese Journal of Tropical Agriculture, 2016,36(11):72-76. doi:10.12008/j.issn.1009-2196.2016.11.015.
[18] 刘嘉仪,王颖,吴林,小森贞男,渡边学.长日照处理下‘雪球’海棠休眠特性和喷施6-BA对其萌芽及开花的影响[J]. 北方园艺,2017(21):109-114. doi:10.11937/bfyy.20170268.LIU J Y,WANG Y,WU L,KOMORI S,WATANABE M. Dormancy characteristics of 'Snowdrift' and effects of spraying 6-BA on its germination in long-day treatment[J]. Northern Horticulture, 2017(21):109-114. doi:10.11937/bfyy.20170268.
[19] 卫晓轶,张学舜,魏锋,洪德峰,马俊峰.激素对细胞伸长生长的调控综述[J]. 现代农业科技,2012(21):166-167,170. doi:10.3969/j.issn.1007-5739.2012.21.101.WEI X Y,ZHANG X S,WEI F,HONG D F,MA J F.Review of hormone on regulation of cell elongation[J]. Modern Agricultural Sciences and Technology, 2012(21):166-167,170. doi:10.3969/j.issn.1007-5739.2012.21.101.
[20] 李巧峡,张丽,王玉,黄小霞.赤霉素调控植物开花及花器官发育的研究进展[J]. 中国细胞生物学学报,2019,41(4):746-758.doi:10.11844/cjcb.2019.04.0026.LI Q X, ZHANG L, WANG Y, HUANG X X. The research progress of gibberellin on the regulation of flowering and floral organ development in plant[J]. Chinese Journal of Cell Biology, 2019,41(4):746-758.doi:10.11844/cjcb.2019.04.0026.