【研究意义】黄瓜花叶病毒(Cucumber mosaic virus,CMV)是我国蔬菜作物上的主要病毒,在全球范围广泛传播[1-2],严重影响作物生长和产量,造成了巨大的经济损失[3-4]。洛阳地区的蔬菜种植比较广泛,及时明确CMV在洛阳地区蔬菜作物上的发生情况,对于提前做好相关防控、防止CMV在该地区的大暴发十分重要。【前人研究进展】CMV是雀麦花叶病毒科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus)的代表种,为典型的三分子单链正义RNA(+ssRNA)病毒,基因组大小约为8.6 kb,由3个RNA片段(RNA1、RNA2、RNA3)构成[5]。CMV是目前已知寄主范围最多、分布范围最广、危害性最大的植物病毒之一,可以通过蚜虫、种子、寄生植物以及汁液摩擦传播[6],能侵染 1 000多种植物[7-8]。植株被CMV侵染后不能正常生长,表现出斑驳、褪绿、花叶、蕨叶、畸形、皱缩、坏死等症状[5-6,9]。CMV在我国大陆31个省(自治区、市)的茄科、葫芦科、豆科和十字花科作物上均有发生,其中茄科和葫芦科作物上发生最为严重,其次是豆科作物,十字花科作物上相对较少。我国大部分地区的辣椒、番茄、南瓜、菜豆、豇豆、萝卜和大白菜上均有CMV的发生,尤其在河南、天津和广东的番茄以及河南、海南的南瓜上发生率最高[1]。近年来由于各种蔬菜作物新品种的引进、栽培规模不断扩大以及农业生态气候的变化,植物病毒病的发生越来越严重,而CMV的为害更加猖獗。CMV由于基因组的差异,具有丰富的遗传多样性,根据其寄主范围、致病性、血清学分析、编码外壳蛋白(Coat protein, CP)的基因序列分析等将CMV株系分为两个不同亚组,即CMV亚组Ⅰ(CMVⅠ)和CMV亚组Ⅱ(CMVⅡ)[5-6]。目前在我国蔬菜作物上报道的CMV大部分为CMVⅠ,CMVⅡ的发生相对较少[10-16],而CMVⅠ的危害比CMVⅡ大得多,不仅并发症状明显,严重时可导致植株直接坏死,引起蔬菜等经济作物大量减产。
【本研究切入点】及时监测某一地区CMV的发生情况和鉴定并做好对CMV的防控工作极为重要,但目前我国对CMV的发生报道主要集中在范围较大的地区如省(自治区、市),针对特定地区的报道相对较少。本研究通过田间调查和RT-PCR检测方法在洛阳地区的蔬菜作物上开展CMV的调查和鉴定,并对所获得的CMV基因组序列进行分析。【拟解决的关键问题】明确CMV在洛阳地区蔬菜作物上的发生情况及株系鉴定,为该地区更好地进行CMV的田间识别、选育抗病品种和抗病基因、制定有效的防控措施提供重要依据。
1 材料与方法
1.1 试验材料
CMV调查样品为2019年6—7月在洛阳市蔬菜种植区采集的茄科(辣椒、番茄)、豆科(四季豆、花生)和葫芦科(南瓜、西葫芦)等疑似病毒病样品,主要表现症状有斑驳、花叶、线形叶和蕨叶。采集样品于-20 ℃冰箱保存备用。
分子生物学试剂盒:RT-PCR反转录试剂盒为TaKaRa Reverse Transcriptase M-MLV(RNase H-),植物总RNA提取试剂盒为TaKaRa MiniBEST Plant RNA Extraction Kit,均购自宝生物工程(大连)有限公司(TaKaRa);PCR扩增试剂Green Taq Mix和DNA纯化回收试剂盒FastPure Gel DNA Extraction Mini Kit均购自南京诺唯赞生物科技有限公司(Vazyme Biotech Co., Ltd)。
1.2 总RNA的提取及RT-PCR扩增
1.2.1 检测引物序列 应用CMV CP片段的通用 检 测 引 物 CMVCPuF/CMVCPuR[22],可 扩 增到 nt 1112-nt 1993(LC066518) 约 882 bp大 小的RNA3片段,包含完整的CP基因。并根据NCBI Genbank中CMVⅠ和CMVⅡRNA3基因组序列,在两者变异较大的非保守基因组区间片段设计特异性检测引物CMVⅠdF1/CMVⅠdR1和CMVⅡdF2/CMVⅡdR2,对采集的疑似病毒病蔬菜样品进行检测。引物序列见表1。
1.2.2 总RNA提取及RT-PCR扩增 利用植物总RNA提取试剂盒从疑似病毒病样本中提取病株总RNA。反转录以提取的样品总RNA为模板,使用RT-PCR反转录试剂盒合成病毒cDNA。体系为10 μL,具体方法为:将含2 μL模板,1 μL 检测引物的下游引物(表1),3 μL ddH2O的混合样混匀后,70 ℃下反应10 min,迅速拿出放在冰上冷却3 min,之后加入含2 μL 5×M-MLV Buffer,0.5 μL dNTP mix(10 mmol/L),0.5 μL RNase M-MLV,1 μL ddH2O 的混合液,在42 ℃反应1 h,70 ℃下15 min反应结束。反应结束后立刻取出放置冰上待用。
表1 黄瓜花叶病毒检测引物
Table 1 Primers used for the detection of cucumber mosaic virus

退火温度Tm(℃)CMV CMVCPuF TCTCATGGATGCTTCTCCGCG nt 1112~1132(LC066518) 882 55 CMVCPuR CCGTAAGCTGGATGGACAACC nt 1993~1973 (LC066518)CMVⅠ CMVIdF1 CCGAAGTAACCCAYGGTCGT nt 300~319(KC019301) 969 55 CMVIdR1 GATTTGTCCATGACTCGACTC nt 1268~1248(KC019301)CMVⅡ CMVIIdF2 CGCGAGTTAGCGTTTAGTTGT nt 1157~1177(HG917910) 762 55 CMVIIdR2 TTAACGTCTTCGGACGCCG nt 1918~1900(HG917910)病毒Virus引物Primer序列Sequence(5'—3')位置Position长度Length(bp)
PCR反应体系总体积为10 μL,具体方法为:取上述合成的 cDNA 1 μL,加入 3.6 μL ddH2O,5 μL Green Taq Mix,上、下游引物各 0.2 μL(表1)。反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min;4 ℃终止反应。配置1%琼脂糖凝胶,反应产物在凝胶电泳后放置紫外灯下观察结果。
1.3 PCR产物的回收及测序
将PCR扩增获得的目标条带参照FastPure Gel DNA Extraction Mini Kit凝胶回收试剂盒说明书进行纯化回收,测序由擎科生物科技有限公司(北京)完成,测序结果由DNAStar7.0进行编辑之后,提交NCBI核酸数据库进行BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)序列比对验证。
1.4 系统发育分析
用 MEGA7 软件对获得的CMV CP基因组核苷酸序列构建系统进化树,采用邻接法(neighbourjoining,NJ),自展值(bootstrap)设为 1 000,系统进化树中只显示自展值大于70%的结点。用于构建系统进化树的参考序列分别为GenBank上具有代表性的CMV亚组Ⅰ和亚组Ⅱ基因组序列。
2 结果与分析
2.1 洛阳田间蔬菜上CMV检测结果
2019年在洛阳各地区采集蔬菜作物疑似病毒病样品86份(表2),其中茄科蔬菜样品44份(辣椒33、番茄11)、葫芦科样品21份(南瓜15、西葫芦6)、豆科样品21份(菜豆6、豇豆9、花生6)。用CMV通用检测引物CMVCPuF/CMVCPuR对这些样品进行RT-PCR检测,结果显示在1份辣椒、5份番茄、4份菜豆和3份花生样品中扩增到大小约为882 bp的条带(图1 A)。其中检测到CMV的几份番茄、菜豆和花生分别在同一块田中,各挑选1份辣椒、番茄、菜豆和花生样品进行测序,测序后经NCBI Blast比对,这些分离物均与GenBank上CMV的序列同源性达到91.0%左右。为了进一步确定所获得的CMV分离物株系,分别对检测到CMV的样品再次用CMVⅠ和CMVⅡ特异性检测引物进行RT-PCR检测验证,结果显示CMVⅠ特异性引物在13个样品中均扩增出对应的目标条带(图1 B),而CMVⅡ特异性检测引物未扩增到对应条带(图1 C),进一步证明这些分离物为CMVⅠ亚组病毒。
CMV在所有检测样品中的检出率为15.12%,其中在茄科样品中的检出率为13.64%,在豆科上的检出率为33.33%,在番茄、花生和菜豆上的检出率均较高,分别为45.45%、50.00%、66.67%(表2)。
表2 洛阳地区蔬菜作物上CMV检测结果
Table 2 Detection results of CMV on vegetable crops in Luoyang area
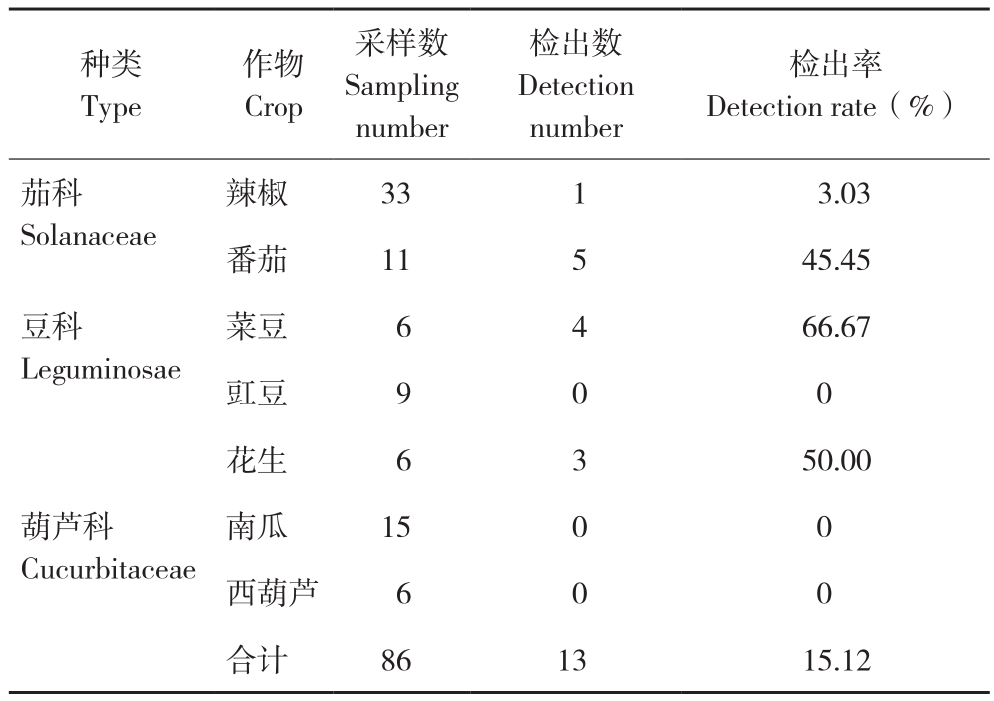
种类Type作物Crop采样数Sampling number检出数Detection number检出率Detection rate(%)茄科Solanaceae辣椒 33 1 3.03番茄 11 5 45.45豆科Leguminosae菜豆 6 4 66.67豇豆 9 0 0花生 6 3 50.00葫芦科Cucurbitaceae南瓜 15 0 0西葫芦 6 0 0合计 86 13 15.12
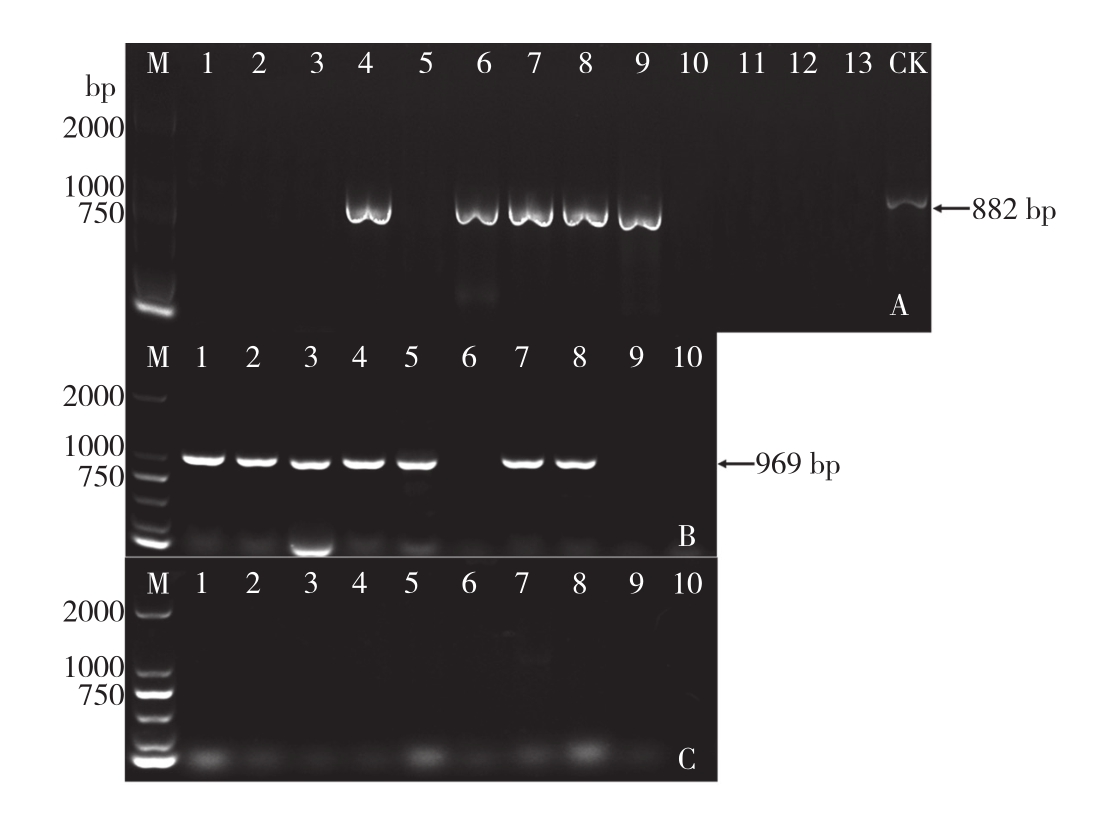
图1 洛阳地区部分蔬菜样品CMV(A)、CMV I(B)和CMV II(C)RT-PCR扩增结果
Fig. 1 CMV(A), CMV I(B)and CMV II(C)amplification results of some vegetable samples in Luoyang area by RT-PCR
M:DL2000 Marker;泳道1~13(10):部分检测样品;CK:阳性对照M: DL 2000 Marker; Lane 1-13(10): Partial tested samples;
CK: Positive control
2.2 CMV在洛阳地区的田间表现症状
感染CMV的辣椒田间表现症状为花叶(图2 A),番茄田间表现症状主要为蕨叶(图2 B),菜豆表现症状为花叶、畸形和坏死(图2 C),花生表现症状为花叶、黄化。
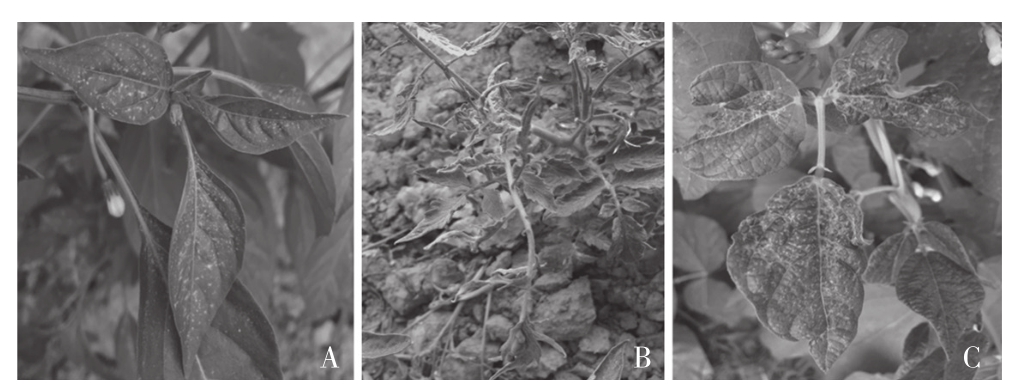
图2 田间部分蔬菜作物上黄瓜花叶病毒的发生症状
Fig. 2 Symptoms of CMV on some vegetables in fields
A:辣椒花叶;B:番茄蕨叶;C:菜豆花叶、畸形、坏死A: Pepper mosaic; B: Tomato fern leaf;C: Kidney bean mosaic, distortion and necrosis
2.3 CMV CP基因核苷酸序列进化分析及亚组鉴定
将获得的大小约为657 bp的4个完整辣椒、番茄、菜豆和花生CMV CP基因核苷酸序列分别在NCBI上用Blast与GenBank中CMV的基因组序列比对分析,其中与100条CMV基因组核苷酸序列的比对结果表明,辣椒分离物CMVLYLJ核苷酸基因组序列与GenBank中CMV的基因组序列同源性在93.5%~95.2%之间,其中与中国草莓分离物(KT165229)和中国分离物K株系(AF127977)的同源性最高,均在95%以上。番茄分离物CMV-LYFQ核苷酸基因组序列与GenBank中CMV的基因组序列同源性在92.0%~97.9%之间,其中与中国烟草QZ分离物(EU414790)和HB24分离物(KC019301)中国的同源性最高,均在97%以上。菜豆分离物CMV-LYCD核苷酸基因组序列与GenBank中CMV的基因组序列同源性在91.0%~95.6%之间,其中与台湾M48分离物(D49496)的同源性最高,为95%以上。花生分离物CMV-LYHS核苷酸基因组序列与GenBank中CMV的基因组序列同源性在93.6%~95.2%之间,和辣椒分离物相同,也是与中国草莓分离物(KT165229)和中国分离物K株系(AF127977)的同源性最高,在95%以上。
这4个CMV分离物中,CMV-LYLJ与CMVLYHS的CP基因组同源关系较近,其核苷酸同源性为96.9%,氨基酸同源性为94.4%。CMVLYFQ与CMV-LYCD的CP基因组同源关系较近,其核苷酸同源性为98.8%,氨基酸同源性为100%,而这两个分离物与CMV-LYLJ和CMVLYHS的CP基因核苷酸序列同源关系相对较低,在90.8%~92.3%之间;氨基酸同源性相差不大,在93.8%~94.4%之间(表3)。
表3 洛阳4个CMV分离物CP基因核苷酸和氨基酸同源性比对
Table 3 Homology comparison of nucleotide and amino acid of CP genes of four CMV isolates in Luoyang(%)
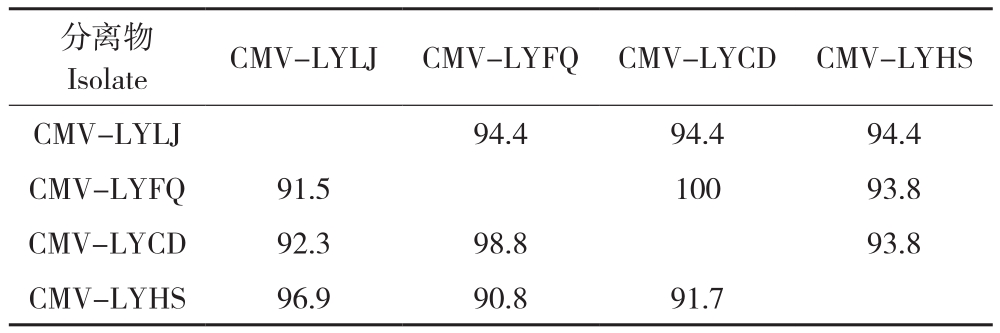
分离物Isolate CMV-LYLJ CMV-LYFQ CMV-LYCD CMV-LYHS CMV-LYLJ 94.4 94.4 94.4 CMV-LYFQ 91.5 100 93.8 CMV-LYCD 92.3 98.8 93.8 CMV-LYHS 96.9 90.8 91.7
分别将辣椒分离物CMV-LYLJ、番茄分离物CMV-LYFQ、菜豆分离物CMV-LYCD和花生分离物CMV-LYHS与GenBank中有代表性的CMVⅠ和CMVⅡ亚组病毒分离物(表4)核苷酸序列构建系统进化树(图3)。进化树分析表明,在CMV分离物的两个大类群中,本研究所获得的4个CMV分离物(CMV-LYLJ、CMV-LYFQ、CMV-LYCD和CMV-LYHS)均分布在CMVⅠ亚组中,但CMV-LYFQ和CMV-LYCD分离物较CMV-LYLJ和CMV-LYHS基因组变异较大。从系统进化树中可以看出,CMV基因组序列的变异进化与地域和寄主均无直接相关性。
表4 用于构建系统进化树的CMV序列
Table 4 Information of CMV sequences used for phylogenetic tree analysis
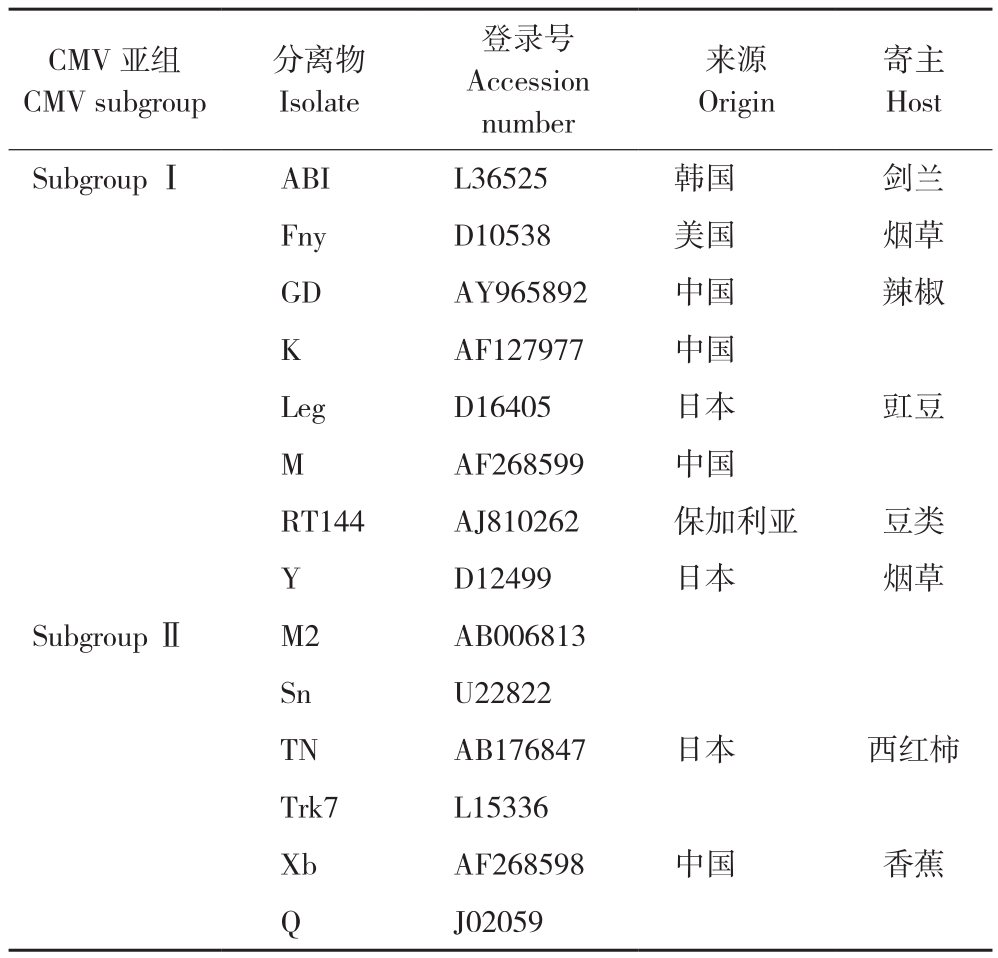
CMV 亚组CMV subgroup寄主Host Subgroup Ⅰ ABI L36525 韩国 剑兰Fny D10538 美国 烟草GD AY965892 中国 辣椒K AF127977 中国Leg D16405 日本 豇豆M AF268599 中国RT144 AJ810262 保加利亚 豆类Y D12499 日本 烟草Subgroup Ⅱ M2 AB006813 Sn U22822 TN AB176847 日本 西红柿Trk7 L15336 Xb AF268598 中国 香蕉Q J02059分离物Isolate登录号Accession number来源Origin
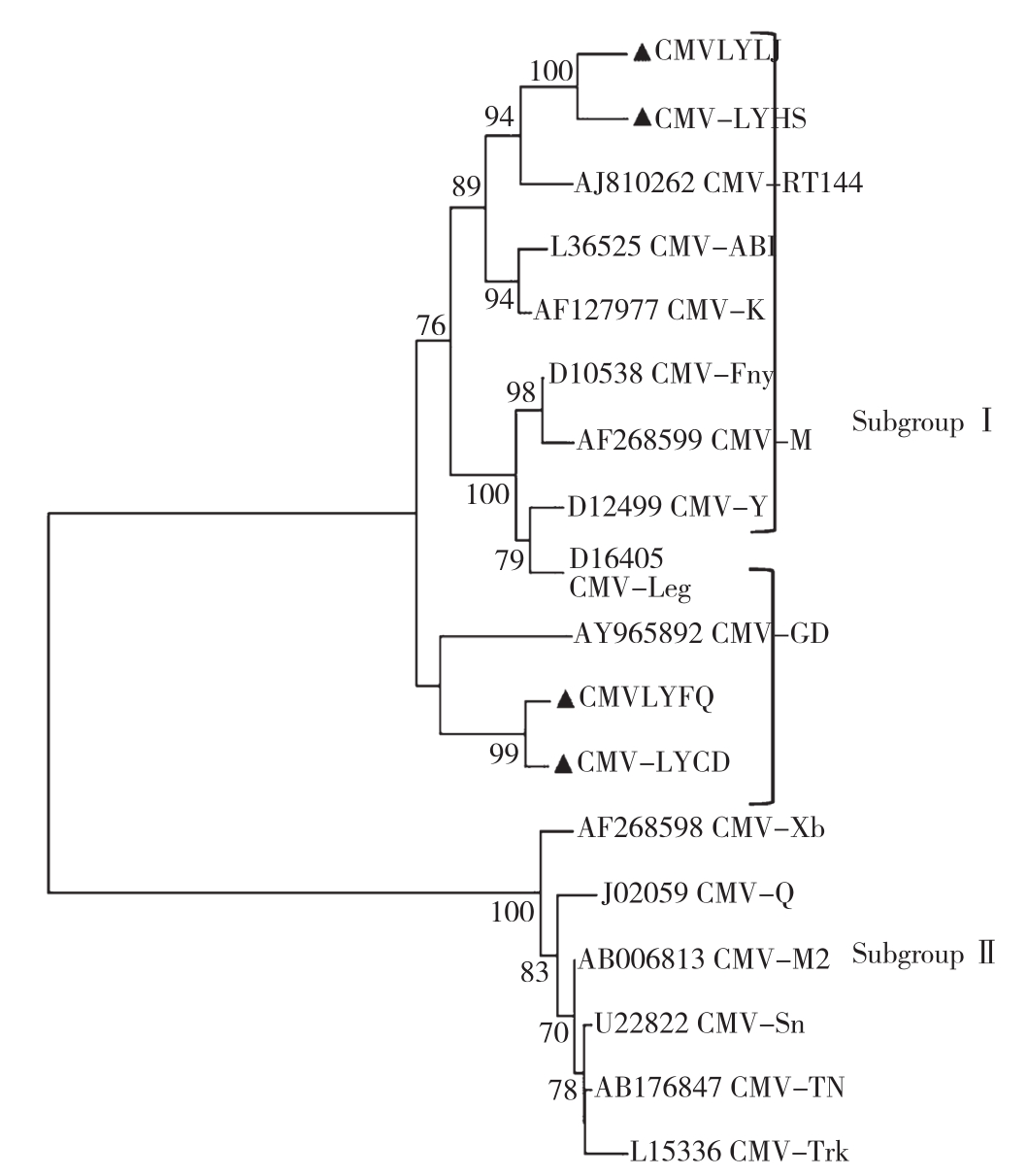
图3 基于CMV CP基因组核苷酸序列系统进化分析
Fig.3 Phylogenetic analysis of CMV based on CP gene nucleotide sequences
3 讨论
随着小RNA测序技术、转录组测序技术等的逐渐推广应用,越来越多的新病毒被发现,目前我国蔬菜作物上报道的病毒至少有63种,在这些病毒中,CMV的检出率最高[1],为我国蔬菜作物上发生最广泛、为害最大的病毒。本研究结果表明,CMV在洛阳地区的蔬菜作物上的发生也较为普遍,在辣椒、番茄、菜豆和花生上均已检测出了CMV病毒,且检出率较高。目前已知,CMV可以通过80多种蚜虫或者摩擦等多种途径进行传播[23],因此,为避免将来因CMV在洛阳地区经济作物上的大暴发而产生巨大的经济损失,应提前在种植早期积极开展蚜虫的防控措施,利用目前对CMV防控的研究成果进行相关防控[24],并积极在蔬菜作物上开展CMVⅠ的抗病育种等工作。
鉴定CMV亚组的方式有很多,但核苷酸基因组序列分析是目前公认最可靠也是最有效的一种方法。CMV株系或分离物被分为CMVⅠ和CMVⅡ两个亚组,在我国植株上这两个亚组均已有报道,其中CMVⅠ的发生概率远远高于CMVⅡ[10-16],而CMVⅠ的危害也远比CMVⅡ大[3,4,9,15]。在洛阳地区蔬菜作物上采集的样品CMV病毒经CMVⅠ和CMVⅡ两个亚组特异性检测引物检测及CP核苷酸基因组序列分析,发现均为CMVⅠ,暂无CMVⅡ,与我国大部分地区发生的CMV相似,以CMVⅠ为主。这说明CMVⅠ很可能是目前洛阳地区蔬菜作物上CMV病毒的优势亚组,但是,由于CMVⅡ感染作物的病发症状不够明显,因而采集过程中易被忽视;而且其本身稳定性较差, 对温度比较敏感,容易降解失活,在检测过程中也易被丢失[15],且本研究采集的样品数量有限,因此,不排除没有CMVⅡ发生的可能,应继续在本地区扩展检测范围和数量,做好CMV的监测工作。本研究中CMV亚组鉴定呈单一性的结果,一方面反映了CMVⅠ的适应能力和变异能力强,同时也为洛阳地区提早做好对CMV的防控,培育CMVⅠ的抗性品种提供了理论依据。
4 结论
本研究分别利用CMV CP基因组的通用检测引物及CMV亚组Ⅰ和亚组Ⅱ特异性检测引物对采自洛阳地区有疑似病毒病症状的辣椒、番茄等主要茄科蔬菜作物,菜豆、豇豆等豆科作物以及南瓜、西葫芦等葫芦科蔬菜作物进行鉴定,并结合对所获得的CP基因核苷酸序列的分析结果,明确了CMV在洛阳地区辣椒、番茄、菜豆及花生几种作物上的发生,并确定了CMV Ⅰ为主要发生株系。该研究结果暗示了应在洛阳地区茄科和豆科蔬菜种植早期做好蚜虫防控和抗病品种、抗病基因筛选鉴定等方面的工作。
[1] 刘勇,李凡,李月月,张松柏,高希武,谢艳,燕飞,张安盛,戴良英,程兆榜,丁铭,牛颜冰,王升吉,车海彦,江彤,史晓斌,何自福,吴云锋,张德咏,青玲,严婉荣,杨学辉,汤亚飞,郑红英,唐前君,章松柏,章东方,蔡丽,陶小荣. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J].中国农业科学,2019, 52(2): 239-261. doi:10.3864/j.issn.0578-1752.2019.02.005.LIU Y, LI F, LI Y Y, ZHANG S B, GAO X W, XIE Y, YAN F, ZHANG A S, DAI L Y, CHENG Z B, DING M, NIU Y B, WANG S J, CHE H Y, JIANG T, SHI X B, HE Z F, WU Y F, ZHANG D Y, QING L, YAN W R, YANG X H, TANG Y F, ZHENG H Y, TANG Q J, ZHANG S B, ZHANG D F, CAI L, TAO X R. Identification, distribution and occurrence of viruses in the main vegetables of China[J].Scientia Agricultura Sinica, 2019, 52(2): 239-261. doi: 10.3864/j.issn.0578-1752.2019.02.005.
[2] KEBEDE Y, MAJUMDER S. Molecular detection and first report of Cucumber mosaic virus infecting 'cavendish' banana plants in Ethiopia[J]. Journal of Plant Diseases and Protection, 2020, 127(3): 417-420. doi: 10.1007/s41348-020-00315-z.
[3] BREUIL S D, GIOLITTI F J, BEJERMAN N, LENARDON S L. Effects of Cucumber mosaic virus on yield and yield components of peanut[J].Journal of Plant Pathology Pathology, 2012, 94(3): 669-673. doi:10.1186/1471-2229-12-198.
[4] RAHMAN M S, JAHAN K, SABUZ A, AKANDA A M. Effects of Cucumber mosaic virus on cellular components, host physiology and yield of chilli[J]. Plant Tissue Culture and Biotechnology, 2019, 29(2): 219-230. doi: 10.3329/ptcb.v29i2.44511.
[5] 陈玉珍,谭新球,朱春晖,孙书娥,刘勇,张德咏. 我国部分地区常见农作物上黄瓜花叶病毒分离物核酸多样性分析[J]. 植物保护学报,2016, 43(3): 427-433. doi: 10.13802 /j.cnki.zwbhxb.2016.03.011.CHEN Y Z, TAN X Q, ZHU C H, SUN S E, LIU Y, ZHANG D Y.Sequence diversity analysis of Cucumber mosaic virus isolates from common crops in China[J]. Journal of Plant Protection, 2016, 43(3):427-433. doi: 10.13802 /j.cnki.zwbhxb.2016.03.011.
[6] 王达新,郭刚,殷晓敏,李嘉,曾会才. 黄瓜花叶病毒研究
进 展[J]. 现 代 农 业 科 技,2013(3): 121-123. doi: 10.3969/j.issn.1007-5739.2013.03.081.WANG D X, GUO G, YIN X M, LI J, ZENG H C. Research progress on Cucumber mosaic virus[J]. Modern Agricultural Science and Technology, 2013(3): 121-123. doi: 10.3969/j.issn.1007-5739.2013.03.081.
[7] 王凯利,张洁,吴阔,杨学宝,魏建丽,王昌命,董家红. 露兜树感染黄瓜花叶病毒的鉴定[J]. 园艺学报,2019, 46(10): 2055-2060.doi:10.16420/j. issn.0513-353x.2018-1003 WANG K L, ZHANG J, WU K, YANG X B, WEI J L, WANG C M, DONG J H. Identification of Cucumber mosaic virus infecting Pandanus tectorius[J]. Acta Horticulturae Sinica, 2019, 46(10):2055-2060. doi:10.16420/j.issn.0513-353x.2018-1003.
[8] KUMAR A, BASAVARAJ Y B, BHATTARAI A, WATPADE S.Occurrence of Cucumber mosaic virus in cucurbita pepo and Rumex hastatus from Himachal Pradesh, India[J]. IPSCONF2020, 7th International Conference on “Phytopathology in Achieving UN Sustainable Development Goals”, 2020, P:(S06)03. doi:10.13140/RG.2.2.21761.61282.
[9] 金大伟. 我国主要烟区烟草黄瓜花叶病毒的鉴定及全基因组序列分析[D]. 武汉: 华中农业大学,2014.JIN D W. Identification and complete sequence analysis of Cucumber mosaic virus from tobacco in the main tobacco growing areas in China[D]. Hua zhong agricultural university, 2014.
[10] 田兆丰,裘季燕,刘伟成,李永丹. 我国部分省市甜椒黄瓜花叶病毒的亚组鉴定[J]. 植物病理学报,2004, 34(2): 190-192.TIAN Z F, QIU J Y, LIU W C, LI Y D. CMV subgroup identifieation of sweet pepper in parts of China[J]. Acta Phytopathologica Sinica,2004, 34(2): 190-192.
[11] 李志勇,夏惠娟,李兴红,董金皋. 北京、宁夏甜椒上分离的黄瓜花叶病毒CP基因序列分析及亚组鉴定[J]. 河北农业大学学报,2005, 28(4): 89-92.LI Z Y, XIA H J, LI X H, DONG J G. Sequence analysis of cp gene and identification of subgroup of Cucumber mosaic virus from Beijing and Ningxia[J]. Journal of Agricultural University of Hebei, 2005, 28(4):89-92.
[12] 席德慧,林宏辉,向本春. 黄瓜花叶病毒2个分离物的亚组鉴定及株系分化研究[J]. 植物病理学报,2006, 36(3): 232-237. doi:10.3321/j.issn:0412-0914.2006.03.006.XI D H, LIN H H, XIANG B C. Subgrouping identification and strain differentiation of two Cucumber mosaic virus isolates[J]. Acta Phytopathologica Sinica, 2006, 36(3): 232-237. doi: 10.3321/j.issn:0412-0914.2006.03.006.
[13] 杨国慧,张仲凯,崔崇士. 滇黑两省黄瓜花叶病毒南瓜分离物外壳蛋白基因序列分析[J]. 园艺学报,2006, 33(6): 1237-1240.YANG G H, ZHANG Z K ,CUI C S. Sequence Analysis of cp genes of CMV from pumpk in in Yunan and Heilongjiang provinces[J]. Acta Horticulturae Sinica. 2006, 33(6): 1237-1240.
[14] 姚明华,王飞,叶志彪. 侵染辣椒的黄瓜花叶病毒分离物的亚组鉴定及株系分析[J]. 华中农业大学学报,2009, 28(4): 472-475.YAO M H, WANG F, YE Z B. Subgroup identification and strain analysis of the Cucumber mosaic virus infecting pepper plant in Hubei province[J]. Journal of Huazhong Agricultural University, 2009, 28(4): 472-475.
[15] 田兆丰,于嘉林,刘伟成,裘季燕,刘德文. 黄瓜花叶病毒(CMV)亚组 I、II 分离物生物学特性比较研究[J]. 华北农学报,2009 , 24(5):201-205.TIAN Z F, YU J L, LIU W C, QIU J Y, LIU D W. Comparative study on bio-characteristics of Cucumber mosaic virus(CMV)subgroup Ⅰ andⅡ[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(5): 201-205.
[16] 刘培培,车海彦,曹学仁,杨毅,罗大全. 侵染胡椒的黄瓜花叶病毒海南分离物全序列分析及亚组鉴定[J]. 热带生物学报,2016, 7(2):265-269. doi: 10.15886/j.cnki.rdswxb.2016.02.021.LIU P P, CHE H Y, CAO X R, YANG Y, LUO D Q. Complete sequence analyses and subgroup identification of Cucumber mosaic virus hainan isolates infecting Piper nigrum L. in Hainan province[J]. Journal of Tropical Biology, 2016, 7(2): 265-269. doi: 10.15886/j.cnki.rdswxb.2016.02.021.
[17] LEPCHA S S, CHAUDHARY K, PRATAP D. First Report of Cucumber mosaic virus Infecting Musa × Paradisiaca cv. Chini Champa in Sikkim, Northeast India[J]. Plant Disease, 2017, 101(5): 844. doi:10.1094/PDIS-07-16-1081-PDN.
[18] HOU H, KAMRAN A, JIA H, ZHANG J, YANG J. First report of Cucumber mosaic virus infecting Pseudostellaria heterophylla in China[J]. Journal of Plant Pathology, 2019, 102:3. doi: 10.1007/s42161-019-00397-1.
[19] PAVITHRA B S, GOVIN K, RENUKA H M, KRISHNAREDDY M,HIMABINDU K. Characterization of Cucumber mosaic virus infecting coleus(Plectranthus barbatus)in Karnataka[J]. Virus Disease,2019, 30(4): 1-10. doi: 10.1007/s13337-019-00536-3.
[20] MIN D J , PARK J S , HONG J S. First report of Cucumber mosaic virus isolated from Zinnia elegans in Korea[J]. Journal of Plant Pathology, 2020, 2. doi: 10.1007/s42161-020-00532-3.
[21] SOUZA L C S, HANADA R E, LUIZ ASSIS L A G, CAMELO V,REZENDE J A M, YUKI V A, ELLIOT K. Ocurrence of Pepper yellow mosaic virus and Cucumber mosaic virus on Capsicum chinense in the state of Amazonas, Brazil[J]. Acta Amazonica, 2020, 50(1): 5-7.doi: 10.1590/1809-4392201903510.
[22] LI Y Y, MA Y, MENG Y, HUANG M Z, REN G M, ZHAO J F AND LI F.First report of Chilli veinal mottle virus infecting Solanum aethiopicum in China[J]. Plant Disease, 2018, 102: 1181. doi: 10.1094/PDIS-09-17-1351-PDN.
[23] GALLITELLI D. The ecology of Cucumber mosaic virus and sustainable agriculture[J]. Virus Research, 2000, 71(1-2): 9-21.doi: 10.1016/S0168-1702(00)00184-2.
[24] Kavyashri V V, Nagaraju N. Management of Cucumber mosaic virus(CMV)disease in chilli through biotic defense inducers[J].International Journal of Current Microbiology & Applied Sciences,2019, 8(1): 297-313. doi: 10.20546/ijcmas.2019.801.032.