【研究意义】羽脉山黄麻(Trema levigata Hand.-Mazz.),又名麻椰树,乔木或灌木,速生常绿植物,耐干旱,是干旱河谷造林和绿化裸岩山地的优良先锋树种,具有生态防护等经济开发价值[1-2]。植原体(Phytoplasma)是一类无细胞壁、寄生在植株韧皮部筛管细胞内或昆虫体内的原核生物,是引起植物病害的一类重要病原[3]。羽脉山黄麻丛枝病由植原体引起,感病植株表现为丛枝、小叶、节间缩短和叶片卷曲黄化等症状,影响植物的生长发育,严重的可导致植株死亡。研究植原体对羽脉山黄麻内源激素的影响及该病害的发病机制有利于为该病害的防治提供理论指导,为植原体的深入研究奠定基础。
【前人研究进展】植原体侵染会引起植株体内各类化学物质的显著变化,内源激素水平的失衡,最终导致病害症状的产生,不同植原体侵染不同植物所引起的激素水平变化并不相同[4-5]。植原体致病性涉及到许多效应蛋白,它们对植物的生长等方面有着深刻而多样的影响,这些效应蛋白可以触发植物的生理反应,导致症状发展。受感染的植物可以表现出不同的症状,如芽的增殖(即丛枝病)。这种生理变化是植原体单一或同时对寄主激素、营养、发育、应激信号途径及它们之间相互作用影响的结果[6-7]。不同激素之间通过复杂的、相互交叉的网络协同或拮抗发挥作用,水杨酸和茉莉酸在植物中的功能已被广泛研究,其他激素如赤霉素、生长素、细胞分裂素和脱落酸等,单独或通过调控水杨酸、茉莉酸和乙烯信号分子转导网络参与植物与病原物互作,然而目前对各种植物激素信号传导的分子机制仍然知之甚少[8-9]。了解寄主植物体内激素水平的变化有助于发现激素间的相互作用,进而探索可能的致病机理。
【本研究切入点】目前对植原体引起寄主激素水平变化的研究主要集中在某一类或某几类激素上,对生长素的研究相对较多,为了更好地了解植原体对寄主的影响,可同时结合多种激素进行研究[10]。【拟解决的关键问题】本研究基于液相色谱串联质谱(LC-MS/MS)法定性定量检测植原体侵染羽脉山黄麻后植株体内六大类植物激素(生长素、细胞分裂素、脱落酸、茉莉酸、水杨酸、赤霉素)中25种激素含量水平的变化,从而结合多类激素探讨植原体对寄主激素水平的影响及其内在规律和可能的致病机制。
1 材料与方法
1.1 试验材料
于2018年在野外采集云南省新平县羽脉山黄麻同一植株上未表现症状的正常健康茎叶及表现为典型丛枝症状的感病茎叶,立即冷冻在液氮中,之后于-80 ℃保存,并将样品分为健康组和感病组。其中赤霉素检测为1个生物学重复,其余激素检测为3个生物学重复。
标准品与试剂:包括色谱纯乙腈(ACN)和甲醇(MeOH)和MilliQ水等。所有标准品均购自BioBioPha和Sigma-Aldrich。标准品以10 mg/mL浓度用乙腈或甲醇作为溶剂溶解后,-20 ℃保存。质谱分析前用乙腈稀释成不同梯度浓度。
1.2 样品制备和提取
赤霉素检测:称取磨碎的样品粉末300 mg,4 ℃ 冰上溶解于600 μL70%乙睛提取液溶液中。溶解后涡旋15 s, 4 ℃ 12 000 r/min离心5 min,常温超声仪中超声30 min。涡旋15 s,4 ℃ 14 000 r/min离心10 min,吸取上清液200 μL,加入800 μL纯水。使用1 mL甲醇和1 mL水冲洗活化SPE小柱。用3 mL80%甲醇洗脱样品,洗脱液于30 ℃加热模式下氮气吹干。用200 μL 30%甲醇-水复溶样品,涡旋15 s,过0.22 μm滤膜后保存于进样瓶。
其他激素检测:称取120 mg溶解于1.2 mL80%甲醇-水提取液中。溶解后隔0.5 h涡旋1次,共涡旋6次,4 ℃冰箱过夜。4 ℃12 000 r/min离心15 min,吸取上清,35 ℃加热模式下液氮吹干。用100 μL 30%甲醇-水复溶样品,12 000 r/min离心15 min,吸取上清,并保存于进样瓶中。最后用于LC-MS/MS分析。
1.3 色谱质谱采集条件
数据采集仪器系统主要包括超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)和串联质谱(Tandem mass spectrometry,MS/MS)。液相条件主要包括:色谱柱,Waters ACQUITY UPLC HSS T3 C18(1.8 μm,2.1 mm×100 mm);流动相,超纯水(0.04%甲酸);洗脱梯度,0 min水/乙腈(95∶5,V/V),11.0 min为5∶95(V/V),12.0 min为5∶95(V/V),12.1 min为95∶5(V/V),15.0 min为95∶5(V/V);流速0.35 mL/min;柱温40 ℃;进样量5 μL。赤霉素检测流动相,水相为超纯水(加入0.04%甲酸),有机相为乙腈(加入0.04%乙酸);洗脱梯度,0 min水/乙腈(80∶5,V/V),10 min为50∶95(V/V),11 min为35∶95(V/V),11.1 min为25∶5(V/V),14 min为10∶5(V/V);流速0.35 mL/min;柱温45 ℃;进样量5 μL。质谱条件主要包括:电喷雾离子源(electrospray ionization,ESI)温度500 ℃(赤霉素为550 ℃),质谱电压5 500 V(赤霉素为4 500 V),帘气(curtain gas,CUR)35 psi。
2 结果与分析
2.1 激素的定性与定量分析
根据基于植物激素标准品构建的MWDB(metware database)植物激素数据库,对质谱检测数据进行定性分析。利用三重四级杆质谱的多反应监测模式进行定量分析。获得不同样本的激素质谱分析数据后,对色谱峰进行峰面积积分和积分校正,将积分峰面积代入不同激素标准曲线线性方程进一步计算得到实际样本中激素的绝对含量,激素的回收率和仪器检出限见表1。
表1 激素的回收率和仪器检出限
Table 1 Recovery rates of hormones and detection limits of instruments
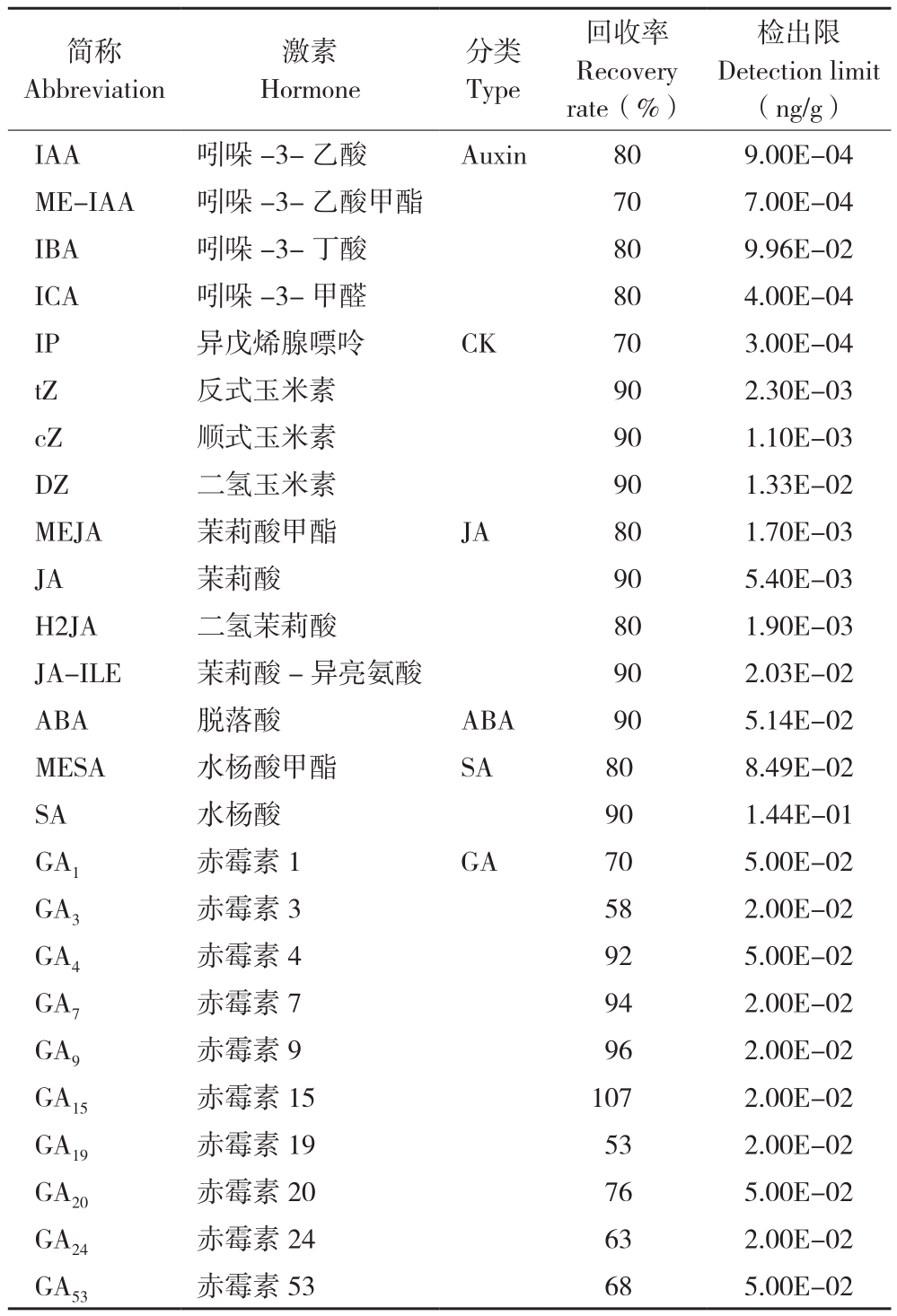
简称Abbreviation分类Type激素Hormone回收率Recovery rate(%)检出限Detection limit(ng/g)IAA 吲哚-3-乙酸 Auxin 80 9.00E-04 ME-IAA 吲哚-3-乙酸甲酯 70 7.00E-04 IBA 吲哚-3-丁酸 80 9.96E-02 ICA 吲哚-3-甲醛 80 4.00E-04 IP 异戊烯腺嘌呤 CK 70 3.00E-04 tZ 反式玉米素 90 2.30E-03 cZ 顺式玉米素 90 1.10E-03 DZ 二氢玉米素 90 1.33E-02 MEJA 茉莉酸甲酯 JA 80 1.70E-03 JA 茉莉酸 90 5.40E-03 H2JA 二氢茉莉酸 80 1.90E-03 JA-ILE 茉莉酸-异亮氨酸 90 2.03E-02 ABA 脱落酸 ABA 90 5.14E-02 MESA 水杨酸甲酯 SA 80 8.49E-02 SA 水杨酸 90 1.44E-01 GA1 赤霉素 1 GA 70 5.00E-02 GA3 赤霉素 3 58 2.00E-02 GA4 赤霉素 4 92 5.00E-02 GA7 赤霉素 7 94 2.00E-02 GA9 赤霉素9 96 2.00E-02 GA15 赤霉素15 107 2.00E-02 GA19 赤霉素19 53 2.00E-02 GA20 赤霉素20 76 5.00E-02 GA24 赤霉素24 63 2.00E-02 GA53 赤霉素53 68 5.00E-02
2.2 感病山黄麻植株五大类植物内源激素含量水平的变化
通过LC-MS/MS检测得到植株中5类内源激素(生长素、细胞分裂素、脱落酸、茉莉酸、水杨酸)14种激素的含量(表2)。其中H2JA在健康样品和感病样品中含量均低于检出限。cZ在感病样品也未检测到。14种激素在山黄麻中含量相对较高的有ABA、SA、MESA、JA-ILE和JA,其中MESA最高,在健康样品中均值达9.3 μg/g以上,在感病样品中均值达3.1 μg/g以上。健康样品中的ME-IAA、IBA和MEJA及感病样品中的ME-IAA含量在2 ng/g以上,其余种类激素基本低于1 ng/g。通过SPSS 20.0软件分析表明IAA、IBA、ICA、MEJA、JA、JAILE、MESA、SA和ABA等9种激素含量在健康样品和感病样品之间存在极显著差异,IP和tZ存在显著差异,ME-IAA和DZ差异不显著。对于这14种激素,感病样品较健康样品激素含量水平下降幅度多达70%以上,其中JA-ILE下降约93%,SA、JA、ICA和MEJA下降80%以上。总体来说感病植物激素水平除ME-IAA(约14%)、tZ(约18%)、DZ(约3%)小幅上升,IP小幅下降(约21%)外,其余都大幅下调。从激素类型来看,Auxin类除ME-IAA小幅上调,其余大幅下降,CK类除cZ减少明显外,其余变化相对较小,最终感病样品Auxin类降幅较CK类大,C(细胞分类素类)/A(生长素类)比值升高。JA类、SA类和ABA都显著下降。
表2 山黄麻健康样品和感病样品中14种植物内源激素含量
Table 2 Contents of 14 plant endogenous hormones in healthy samples and infected samples of Trema levigata(ng/g)
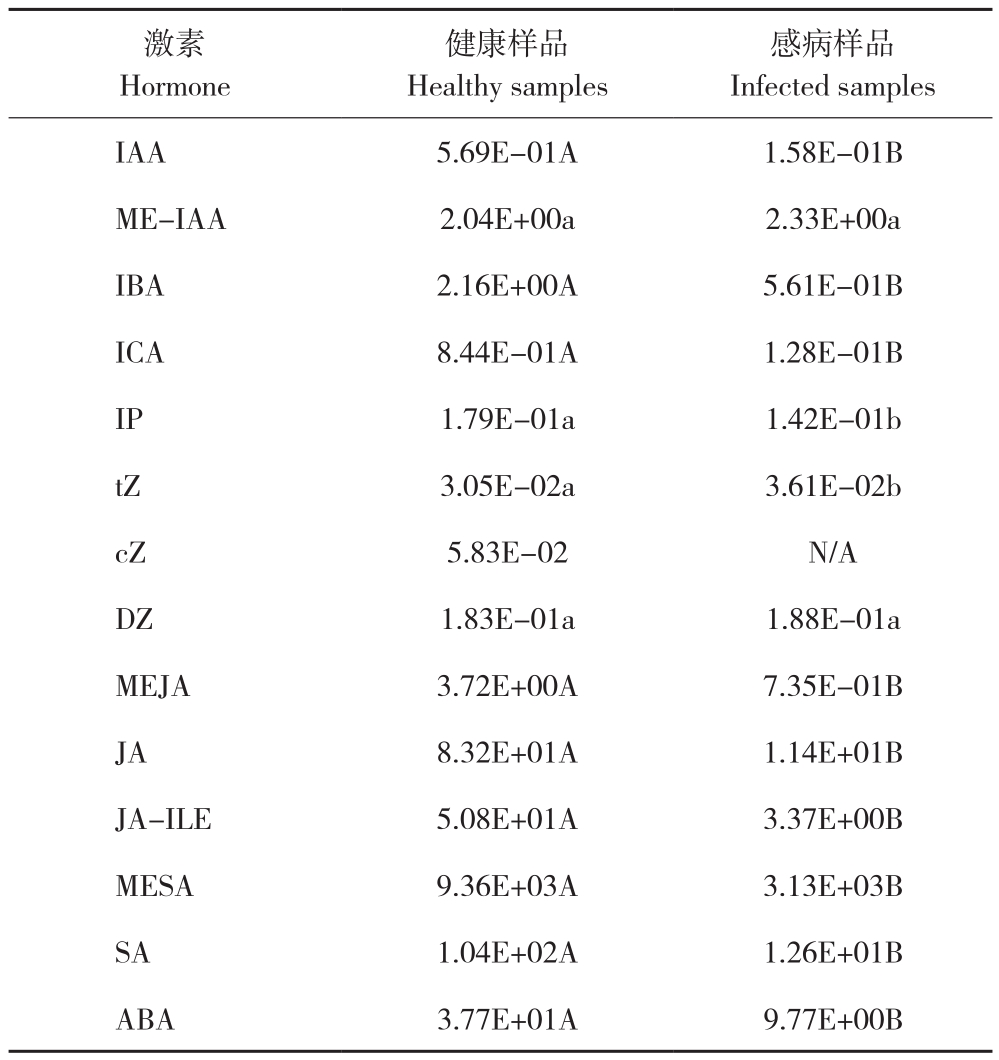
注:同行数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。N/A表示含量低于仪器检出限。
Note: Different lowercase letters after the date in the same line represent significant difference, and different capital letters represent extremely significant different. N/A indicated that the content was below the instrument detection limit.
感病样品Infected samples IAA 5.69E-01A 1.58E-01B ME-IAA 2.04E+00a 2.33E+00a IBA 2.16E+00A 5.61E-01B ICA 8.44E-01A 1.28E-01B IP 1.79E-01a 1.42E-01b tZ 3.05E-02a 3.61E-02b cZ 5.83E-02 N/A DZ 1.83E-01a 1.88E-01a MEJA 3.72E+00A 7.35E-01B JA 8.32E+01A 1.14E+01B JA-ILE 5.08E+01A 3.37E+00B MESA 9.36E+03A 3.13E+03B SA 1.04E+02A 1.26E+01B ABA 3.77E+01A 9.77E+00B激素Hormone健康样品Healthy samples
2.3 感病山黄麻植株赤霉素类植物内源激素含量变化
赤霉素类共检测了10种,其中GA1、GA3、GA4、GA7、GA9和GA15在健康样品和感病样品中都有检测到,GA19只在感病样品中检测到,GA20、GA24、GA53只在健康样品中检测到。检测到的激素中GA1、GA3和GA19含量水平为上调,其他为下调。除GA1(上升约10%)、GA4(下降约0.3%)、GA24和GA53(都下降约0.08 ng/g)相对变化较小,其他赤霉素含量水平变化较大,其中GA3感病样品较健康样品增加10倍以上,GA19和GA20感病样品较健康样品分别增加约1 ng/g和减少约 4.5 ng/g,GA7、GA9和 GA15下降60%以上(表3)。
表3 山黄麻健康样品和感病样品中10种赤霉素含量
Table 3 Contents of 10 gibberellins in healthy and infected Trema levigata(ng/g)
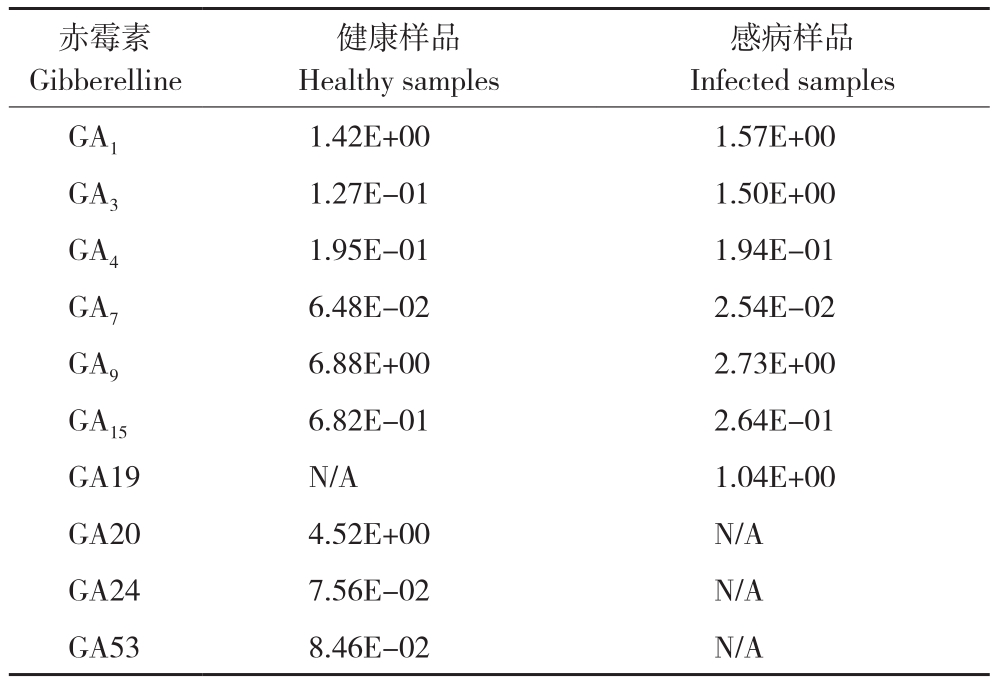
注:N/A表示含量低于仪器检出限。
Note: N/A indicated that the content was below the instrument detection limit.
感病样品Infected samples GA1 1.42E+00 1.57E+00 GA3 1.27E-01 1.50E+00 GA4 1.95E-01 1.94E-01 GA7 6.48E-02 2.54E-02 GA9 6.88E+00 2.73E+00 GA15 6.82E-01 2.64E-01 GA19 N/A 1.04E+00 GA20 4.52E+00 N/A GA24 7.56E-02 N/A GA53 8.46E-02 N/A赤霉素Gibberelline健康样品Healthy samples
3 讨论
3.1 山黄麻植原体对植株C/A比值的影响
本研究结果表明,感病羽脉山黄麻丛枝体内内源激素含量水平较健康植株发生了明显变化,针对所检测到的24种植物激素,六大类激素含量水平总体下降明显,C/A比值升高。植物激素与植原体病害症状的发生可能是由于C/A失调而造成[11]。C/A的变化会导致植株顶端优势消失,产生侧芽,最后呈现丛枝症状。据报道,被植原体感染后植株C/A的变化主要有以下几种情况:(1)细胞分裂素含量增加,同时生长素含量降低,如泡桐丛枝病[12]和枣疯病[13];(2)细胞分裂素含量增加,生长素含量不变,如甘薯丛枝病[14];(3)细胞分裂素和生长素含量同时增加,C/A比值无明显变化,如桑树萎缩病[15]。前两者导致C/A比值升高,诱导丛枝症状的产生。本研究与以上情况不同,感病样品生长素和细胞分裂素含量同时降低,只是Auxin类降幅较CK类大,所以C/A比值升高,这可能是山黄麻丛枝症状产生的原因之一。
3.2 山黄麻植原体对植株生长素和细胞分裂素的影响
前期研究表明,山黄麻植原体侵染后会引起植株生长素含量的降低、升高或基本不变[11-15],本研究检测了IAA、IBA、ICA和ME-IAA 4种生长素,前三者的含量水平显著下降,可能是因为病株内过氧化物酶和IAA氧化酶活性增强导致其直接氧化分解所致,也可能是激素与氨基酸、糖等交联使激素活性降低,或者是过氧化氢酶的活性受到抑制降低了植物生长素的生物合成[16-17]。生长素具有抗植原体活性,病原与寄主相互作用引起IAA水平增高可能是寄主抗病的一种表现,而IAA水平的降低则是一种致病表现[5,18],生长素水平降低导致植物节间缩短,顶端优势消失,侧芽萌生,有利于丛枝症状的产生。对于细胞分裂素,本次共检测IP、tZ、cZ和DZ 4种细胞分裂素,前三者变化较为显著,IP和cZ含量下降,tZ含量上升。研究表明枣树植原体导致内源玉米素(ZT)含量提高,桑树植原体同样使寄主细胞分裂素的含量增加[13,15]。细胞分裂素(CK)水平的升高可能会引起丛枝病或增殖症状[17,19],但在本研究中4种细胞分裂素的变化趋势并不相同,tZ的增加可能有利于侧芽和丛枝的产生。
3.3 山黄麻植原体对植株赤霉素的影响
植原体对植物内源赤霉素的影响研究较多的是GA3。马铃薯紫顶植原体导致马铃薯GA3水平显著降低[20],翠菊黄化植原体引起翠菊GA水平的降低[21],植原体侵染枣树后GA含量提高,且与发病程度呈正相关[12],另一研究则表明枣树被侵染后GA3无明显变化[22]。桑树植原体使病株中的GA3和GA4含量都明显增加[15]。研究表明从赤霉菌及其他病菌中分离的GA以GA3或GA4为主,而高等植物体内GA1是主要活性物质,GA3含量则很低[5]。本试验检测的10种赤霉素中GA3上调幅度大,GA7下降明显,GA3含量的上调可能是由植原体分泌引起的,同时GA3和GA7具有生物活性[23],GA3的上调或者GA7的下降可能和症状的关系最为密切。游离态赤霉素和结合态赤霉素之间能够根据不同发育时期的需求相互转化,因此其他赤霉素的变化可能导致GA3和GA7的变化。赤霉素具有提高生长素水平、形成顶端优势的作用,GA3的上调没有使生长素含量增加,这可能与其他激素或者是两者生物合成交叉途径中的关键酶或基因受到了植原体的影响有关。
3.4 山黄麻植原体对植株ABA、SA和JA的影响
前期研究表明,植原体侵染枣树后,ABA含量有所提高[13,24],有的则无明显变化[22]。本研究中ABA含量下降可能是由于采样时山黄麻处于发病前期,丛枝生长旺盛,ABA含量减少有利于减轻它对芽的抑制作用。当植物受到病原菌侵染时,SA和JA的含量会发生变化[25],从而起到防御或抑制病害的作用,SA被认为是植物对病原菌产生抗性反应的信号分子,JA则是植物对昆虫取食和机械损伤产生抗性反应的信号分子,SA可直接杀伤病原,积累后可激活SAR(系统获得抗性),如果SA不能正常积累,植株对病原菌的入侵会变得更加敏感[26-27]。植原体效应子可以植物细胞核为靶点,破坏植物转录因子的稳态导致植株形态变化,使JA合成减少,抑制JA介导的防御,并改变植物和昆虫载体的互作[28]。因此降低SA和JA的含量水平可能是植原体入侵寄主植物的一种手段,这样更有利于植原体本身的寄生和传播,具体的作用机制还需进一步研究。
4 结论
植原体对植物内源激素的影响与植物抗感程度[29]、植原体种类和寄主植物[10]有关,植原体侵染可影响寄主激素合成相关基因而导致相应激素含量水平的变化[30-31]。病害症状的产生是各种致病因子综合影响的结果,这其中有主要致病因子,也会产生主要症状,同时主要因子会受到其他因子的调控,并使植株产生伴随症状。山黄麻丛枝病的典型症状为丛枝小叶,本研究检测山黄麻感病植株中六大类植物内源激素,发现每一类激素含量水平都发生了明显变化,但具体是哪些激素在其中发挥主要作用,还需进一步研究。同时要考虑激素间的相互作用,可以从植物病理学、生理学、生物化学和分子生物学等方面来研究其致病机制。对于植原体的防治,补充外源激素可以起到一定效果,而且激素类型不同效果不同[18,32]。本研究得出山黄麻感染植原体后激素水平的变化情况,可以为山黄麻丛枝病的激素防治提供指导,同时为山黄麻丛枝病致病机理的研究奠定基础。
[1] 刘刚,姚崇怀,陈红艺.羽脉山黄麻的生物学特性及其开发潜力的研究[J]. 湖北林业科技,2006(4):29-34.LIU G, YAO C H, CHEN H Y. Study on biology characteristic and exploitation potential of Trema levigata Hand[J]. Hubei Forestry Science and Technology, 2006(4):29-34.
[2] 杨超本.耐旱的“先锋树种”——山黄麻[J]. 云南林业,2013,34(2):64.YANG C B.Drought-tolerant "pioneer tree species"—Trema levigata Hand.-Mazz[J]. Yunnan Forestry, 2013,34(2):64.
[3] 卢恒宇,魏辉,杨广.植原体病害研究进展[J]. 福建农业学报,2016,31(3):326-332. doi:10.19303/j.issn.1008-0384.2016.03.022.LU H Y, WEI H,YANG G.Research progress on phytoplasma disease[J]. Fujian Journal of Agricultural Sciences, 2016,31(3):326-332.doi:10.19303/j.issn.1008-0384.2016.03.022.
[4] NEGRO C, SABELLA E, NICOL F, PIERRO R, MATERAZZI A,PANATTONI A, APRILE A, NUTRICATI E, VERGINE M, MICELI A,DE B L, LUVISI A. Biochemical changes in leaves of vitis vinifera cv.sangiovese infected by bois noir phytoplasma[J]. Pathogens, 2020, 9:269. doi:10.3390/pathogens9040269.
[5] 田国忠,李怀方,裘维蕃.植物激素与植物病害的相互作用[J].植物生理学通讯,1999,35(3):177-184. doi:10.13592/j.cnki.ppj.1999.03.001.TIAN G Z, LI H F, QIU W F. Interactions between plant hormones and diseases[J]. Plant Physiology Journal, 1999,35(3):177-184.doi:10.13592/j.cnki.ppj.1999.03.001.
[6] DERMASTIA M. Plant hormones in phytoplasma infected plants[J]. Frontiers in Plant Science, 2019,10:477. doi: 10.3389/fpls.2019.00477.
[7] VELÁSQUEZ-VALLE R, VILLA-RUANO N, HIDALGOMARTÍNEZ D, GERARDO ZEPEDA-VALLEJO L, PÉREZHERNÁNDEZ N, REYES-LÓPEZ C A, REYES-CERVANTES E,MEDINA-MELCHOR D L, BECERRA-MARTÍNEZ E. Revealing the 1H-NMR metabolome of mirasol chili peppers(Capsicum annuum)infected by candidatus phytoplasma trifolii[J]. Food Research International, 2019. doi: https://doi.org/10.1016/j.foodres.2019.108863.
[8] 旷永洁,柳浪,严芳,任斌,闫大琦,张大伟,林宏辉,周焕斌.水稻与病原物互作中植物激素功能的研究进展[J]. 生物技术通报,2018,34(2):74-86. doi:10.13560/j.cnki.biotech.bull.1985.2017-1104.KUANG Y J,LIU,YAN F,REN B,YAN D Q,ZHANG D W,LIN H H,ZHOU H B.Functions of phytohormones during the interactions between rice and pathogens[J]. Biotechnology Bulletin, 2018,34(2):74-86. doi:10.13560/j.cnki.biotech.bull.1985.2017-1104.
[9] 陈星彤,杜春梅.植物激素调控植物与尖孢镰刀菌互作的研究进展[J]. 应 用与环境 生物学报,2020(1):1-9. doi:10.19675/j.cnki.1006-687x.2018.09034.CHEN X T, DU C M.Advances in research on phytohormones regulating plants and Fusarium Oxysporum[J]. Chinese Journal of Applied and Environmental Biology, 2020(1):1-9. doi:10.19675/j.cnki.1006-687x.2018.09034.
[10] 刘俊男,王柱华,赵宇,蔡红,郭乔优.植原体病害及其相关植物激素研究进展[J]. 西昌学院学报(自然科学版),2018,32(2):1-5,16.doi:10.16104/j.issn.1673-1891.2018.02.001.LIU J N, WANG Z H, ZHAO Y, CAI H, GUO Q Y.Research on phytoplasma diseases and related plant hormones[J]. Journal of Xichang University(Natural Science Edition), 2018,32(2):1-5,16.doi:10.16104/j.issn.1673-1891.2018.02.001.
[11] 郭建民,杨俊强,薛新平,马光跃,申仲妹.枣疯病研究进展[J]. 山 西 农 业 科 学,2017,45(8):1389-1392. doi:10.3969/j.issn.1002-2481.2017.08.42.GUO J M,YANG J Q,XUE X P,MA G Y,SHEN Z M.Research progress on jujube witches’broom disease[J]. Journal of Shanxi Agricultural Sciences, 2017,45(8):1389-1392. doi:10.3969/j.issn.1002-2481.2017.08.42.
[12] 范国强,冯志敏,翟晓巧,曹艳春,董占强,蒋建平.植物生长调节物质对泡桐丛枝病株幼苗形态和叶片蛋白质含量变化的影响[J].河南农业大学学报,2006,40(2):137-141.FAN G Q,FENG Z M,ZHAI X Q,CAO Y C,DONG Z Q,JIANG J P.Effects of plant growth regulators on morphological and content changes of proteins of witches’broom of paulownia seedlings[J]. Journal of Henan Agricultural University, 2006,40(2):137-141.
[13] 杜绍华,卜志国,刘洋.植原体浸染对枣树内源激素含量的影响[J].北方园艺,2013(13):12-15.DU S H,BU Z G,LIU Y. Study on the change of endogenous hormones of jujube caused by phytoplasma infection[J]. Northern Horticulture,2013(13):12-15.
[14] 何放亭,武红巾,陈子文,戴群.C/A值与甘薯丛枝病症状发生的关系[J].植物病理学报,1997,27(1):43-46.HE F T,WU H J,CHEN Z W,DAI Q.The ratio of cytokinin to auxin in relation to the occurence of sweet potato witches’broom symptom[J].Acta Phytopathologica Sinica, 1997,27(1):43-46.
[15] 刘秉胜,戴群.桑树植原体含量的周年变化及其对寄主激素水平的影响[J]. 山东大学学报(自然科学版),1999,34(1):100-104.LIU B S, DAI Q. Anniversary variaton of the phytoplasma amounts in mulberry[J]. Journal of Shandong University(Natural Science),1999,34(1):100-104.
[16] 原牡丹,侯智霞,翟明普,苏艳.IAA分解代谢相关酶(IAAO、POD)的研究进展[J]. 中国农学通报,2008,24(8):88-92.YUAN M D,HOU Z X,ZHAI M P,SU Y. The research advances on indole-3-acetic acid(IAA)catabolism related enzymes:IAA oxidase(IAAO),peroxidase(POD)[J]. Chinese Agricultural Science Bulletin, 2008,24(8):88-92.
[17] YUAN H M, LIU W C, LU Y T. CATALASE2 coordinates SA-mediated repression of both auxin accumulation and JA biosynthesis in plant defenses[J]. Cell Host & Microbe, 2017,21(2): 143-155.doi:10.1016/j.chom.2017.01.007.
[18] PERICA M.Auxin-treatment induces recovery of phytoplasma infected periwinkle[J]. J Appl Microbiol, 2008,105(6): 1826-1834.doi:10.1111/j.1365-2672.2008.03946.x.
[19] 田迎秋. 石斛新种鉴定及铁皮石斛(Dendrobium catenatum)组培苗丛枝病的分子机理研究[D]. 成都: 四川农业大学,2017.TIAN Y Q. Identification of Dendrobium new species and molecular mechanism of witches’broom disease for Dendrobium Catenatum[D].Chengdu: Sichuan Agricultural University,2017.
[20] DING Y, WU W, WEI W,. DAVIS R E, LEE I M,HAMMOND R W, SHENG J P, SHEN L, JIANG Y,ZHAO Y. Potato purple top phytoplasma-induced disruption of gibberellin homeostasis in tomato plants[J]. Annals of Applied Biology, 2013,162(1):131-139.doi:10.1111/aab.12008.
[21] CHANG C J. Pathogenicity of aster yellows phytoplasma and spiroplasma citri on periwinkle[J]. Phytopathology,1998, 88(12):1347-1350. doi:10.1094/PHYTO.1998.88.12.1347.
[22] 赵锦,刘孟军,代丽,周俊义.枣疯病病树中内源激素的变化研究[J].中国农业科学,2006,39(11):2255-2260.ZHAO J, LIU M J, DAI L, ZHOU J Y.The variations of endogenous hormones in Chinese jujube infected with witches' broom disease[J].Scientia Agricultura Sinica, 2006,39(11):2255-2260.
[23] 高秀华,傅向东.赤霉素信号转导及其调控植物生长发育的研究进展[J]. 生物技术通报,2018,34(7):1-13. doi:10.13560/j.cnki.biotech.bull.1985.2018-0447.GAO X H,FU X D.Research progress for the gibberellin signaling and action on plant growth and development[J]. Biotechnology Bulletin,2018,34(7):1-13. doi:10.13560/j.cnki.biotech.bull.1985.2018-0447.
[24] 谭钺,朱东姿,魏海蓉,王甲威,宗晓娟,陈新,徐丽,刘庆忠.植原体侵染对甜樱桃叶片结构功能的影响[J]. 植物生理学报,2017,53(7):1306-1312. doi: 10.13592/j.cnki.ppj.2017.0067.TAN Y, ZHU D Z, WEI H R, WANG J W, ZONG X J, CHEN X, XU L, LIU Q Z.Effects of phytoplasma infection on structure and function of sweet cherry leaves[J]. Plant Physiology Journal, 2017,53(7):1306-1312. doi: 10.13592/j.cnki.ppj.2017.0067.
[25] 王晓静,李成奇,张金宝,王清连. 黄萎病菌胁迫下棉花根系茉莉酸、水杨酸含量的动态变化[J]. 江苏农业科学,2016,44(2):141-143.doi:10.15889/j. issn.1002-1302. 2016. 02. 040.WANG X J, LI C Q, ZHANG J B, WANG Q L.Dynamic changes of jasmonic acid and salicylic acid content in cotton roots under Verticillium dahliae stress[J]. Jiangsu Agricultural Sciences,2016,44(2):141-143. doi:10.15889/j. issn.1002-1302. 2016. 02. 040.
[26] 付冰,叶霞,王会鱼,陈鹏,李继东,郑先波,谭彬,冯建灿.枣WRKY转录因子的鉴定及其对枣疯病植原体和激素处理的应答[J].林业科学,2018,54(8):65-78. doi:10.11707 j.1001-7488.20180808.FU B, YE X, WANG H Y, CHEN P, LI J D, ZHENG X B, TAN B,FENG J C.Identification of WRKY transcription factors in jujube and their responses to ‘Candidatus Phytoplasma ziziphi’and salicylic acid or methyl jasmonate treatments[J]. Scientia Silvae Sinicae,2018,54(8):65-78. doi:10.11707 j.1001-7488.20180808.
[27] LYON G D,REGLINSKI T,NEWTON A C.Novel disease control compounds:the potential to‘immunize’plants against infection[J].Plant Pathology, 1995,44(3):407-427. doi:10.1111/j.1365-3059.1995.tb01664.x.
[28] SUGIO A, MACLEAN A M, KINGDOM H N, GRIEVE V M,MANIMEKALAI R, HOGENHOUT S A. Diverse targets of phytoplasma effectors: from plant development to defense against insects[J]. Annual Review of Phytopathology, 2011,49:175-195. doi:10.1146/annurev-phyto-072910-095323.
[29] 杜绍华,卜志国.植原体的侵染对不同抗性枣叶片内源IAA、ZT的影响[J]. 吉林农业科学,2013,38(3):61-63.DU S H, BU Z G.Effect of phytoplasma inoculation on endogenous IAA and ZT of leaves of jujube with different resistance[J]. Journal of Jilin Agricultural Sciences, 2013,38(3):61-63.
[30] 张舒怡,张钟,张春梅,李欢,李新岗.基于转录组水平的枣疯病发病机理研究[J]. 园艺学报,2017,44(7):1287-1298. doi:10.16420/j.issn.0513-353x.2017-0024.ZHANG S Y,ZHANG Z,ZHANG C M,LI H, LI X G.Transcriptomic analysis on pathogenesis of witches’ broom disease in Ziziphus jujuba[J]. Acta Horticulturae Sinica, 2017,44(7):1287-1298.doi:10.16420/j.issn.0513-353x.2017-0024.
[31] WANG H Y,YE X,LI J D,TAN B,CHEN P,CHENG J,WANG W,ZHENG X B ,FENG J C. Transcriptome profiling analysis revealed co-regulation of multiple pathways in jujube during infection by ‘Candidatus Phytoplasma ziziphi’[J]. Gene, 2017. doi:10.1016/j.gene.2018.04.070.[32] CURKOVIC P M, LEPEDUS H, MUSIC M S. Effect of indole-3-butyric acid on phytoplasmas in infected Catharanthus roseus shoots grown in vitro[J]. FEMS Microbiol Lett, 2007,268(2): 171-177. doi:10.1111/j.1574-6968.2006.00577.x.